Contents
- 要旨
- 1. 序論
- 2. コロナウイルス
- 3. SARS-CoV2の疫学
- 4. SARS-CoV-2 の侵入、複製、媒介感染
- 5. SARS-CoV-2は免疫細胞の浸潤、サイトカインストーム、炎症を媒介する。
- 6. SARS-CoV-2は神経炎症を媒介し、中枢神経系の線維化を誘導する。
- 7. 神経系のSARS-CoV-2感染症
- 7.1. COVID-19と脳卒中
- 7.2. 頭痛とCOVID-19
- 7.3. 発作とCOVID-19
- 7.4. アノスミア(嗅覚脱失)(嗅覚脱失)およびエイジウジアとCOVID-19
- 7.5. COVID-19と認知障害/認知症
- 7.6. パーキンソン病(PD)におけるCOVID-19
- 7.7. 脳症
- 7.8. 筋萎縮性側索硬化症
- 7.9. 失調症
- 7.10. ギラン・バレー症候群、急性炎症性脱髄性多発神経障害(AIDP
- 7.11. ベル麻痺
- 7.12. 脳腫瘍
- 7.13. 低酸素症のCOVID-19患者
- 7.14. 不安、抑うつ、および精神病を含む神経精神症状
- 7.15. Long-COVID、慢性COVID、長期不調組
- 8. COVID-19の潜在的な治療法
- 9. 結論
SARS-CoV-2 mediated neuroinflammation and the impact of COVID-19 in neurological disorders
pubmed.ncbi.nlm.nih.gov/33674185/
ハイライト
- SARS-CoV-2 呼吸器系に深刻な影響を与える 新型コロナウイルスが COVID-19パンデミックの原因である。
- 免疫細胞の浸潤、サイトカインストーム、炎症を説明している。
- SARS-CoV-2は神経炎症を媒介し、神経疾患におけるCOVID-19の影響について論じている。
- ATN-161はSARS-CoV-2スパイクタンパク質の インテグリンα5β1とα5β1/hACE2への結合を阻害する
- COVID-19患者を治療するために利用可能な治療法とワクチンを要約する。
要旨
SARS-CoV-2 は呼吸器系に重篤な影響を与える新型コロナウイルスであり、COVID-19 パンデミックの原因となっており、全世界で 200 万人の死者を出すと予測されている。最近の報告では、SARS-CoV-2が他の臓器とともに中枢神経系にも影響を及ぼすことが示唆されている。
COVID-19に関連した合併症は、脳卒中、アルツハイマー病、パーキンソン病などの神経疾患を持つ高齢者に見られる。したがって、我々は、SARS-CoV-2ウイルスの複製とその炎症を媒介とする感染について議論する。このレビューはまた、これらの合併症を有する個人および他のグループの人々におけるCOVID-19関連の神経学的合併症にも焦点を当てている。
最後に、患者を治療するために利用可能な現在の治療法、現在進行中の治療法および効果的な治療のためのワクチンについても簡単に述べ、特に、インテグリンα5β1 およびα5β1/hACE2 の両方への SARS-CoV-2 スパイクタンパクの結合を阻害する小型 5 アミノ酸ペプチド(PHSCN)ATN-161 の治療可能性に焦点を当てている。
グラフィカル・アブストラクト
1. 序論
コロナウイルス感染症2019(COVID-19)の原因菌である重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は 2019年後半に出現した呼吸器系病原体である[1]。2021年1月下旬現在、全世界で9700万人に感染し、米国だけでも2500万人に感染し、421,000人の死亡が報告されている(https://www.cdc.gov/)。COVID-19の症状には、ほとんどの患者で発熱に続いて咳を伴うものがある[2]。その他の症状としては、発症時の筋肉痛、下痢、便秘などがある。高血圧、糖尿病、肺疾患、心疾患などの基礎疾患を持つ高齢者では死亡率が20%を超えることがあるが [3]、大多数の症例では集中的な介入を必要とせず、ほとんどの感染者は急性肺感染症の影響から完全に回復すると予想される。ほとんどの場合、ウイルスの複製は上気道上皮で起こり、サイトカインストームによって免疫応答を増加させるアンジオテンシン変換酵素2(ACE2)を媒介して効果的に伝達される[4]。
興味深いことに、コロナウイルスは播種性脳脊髄炎、多発性硬化症、熱性発作、脳炎てんかんなどの中枢神経系(CNS)疾患と関連している[3,[5], [6], [7]。ヒトコロナウイルスOC43(HCoV-OC43)は、軸索輸送および脳内ニューロンを介したウイルスの移動を介して中枢神経系にアクセスできることが研究により示されており[8]、また、SARS-CoVは血液循環(血液脳関門、BBB)および嗅球の両方を介して中枢神経系に侵入する可能性があることが報告されている[9], [10], [11]。SARS-CoV-2に対する炎症性および免疫応答は、免疫系の変化をもたらし、肺損傷および中枢神経系の合併症を促進する。重要なことに、COVID-19と併発する神経学的問題(主に脳卒中と錯乱)を抱えて入院した患者は、他の患者よりも死亡リスクが高い。したがって、感染を予防し、SARS-CoV-2による死亡率を制限する介入策の開発に加えて、COVID-19の合併症のこれらの中枢神経系症状を特徴づけ、最終的に治療するためのさらなる研究が必要とされている。
科学界と医学界は、この壊滅的なパンデミックに対処し、新規の予防対策とCOVID-19治療法を開発するために動員されている。2020年12月11日、米国FDAはファイザー・バイオンテックCOVID-19ワクチンの初の緊急使用承認を発行し、続いて2020年12月18日にはモデルナCOVID-19ワクチンの承認を発行し、COVID-19の予防のために米国内で配布されることになった。SARS-CoV-2が作用するメカニズムについての我々の集団的理解が進むにつれ、新たな治療法の道筋が明らかになってきている。実際、私たちのグループの最近の研究では、SARS-CoV-2がアルギニン-グリシン-アスパラギン酸(RGD)モチーフを持ち、ウイルスの宿主細胞への侵入を促進するインテグリンの関与を示していることが明らかになった[12]。インテグリンが脳機能、損傷、および疾患の文脈で神経血管ユニットの調節に関与していることを示唆する一連のデータを考えると[[12], [13], [14]]、インテグリンを標的とした治療法は、ウイルス感染機構に直接作用して感染を予防するか、中枢神経系基質に間接的に作用してウイルスによる損傷を減衰させるか、あるいはその両方に作用する新しい治療法となる可能性がある。
本総説では、中枢神経系におけるSARS-CoV-2について現在知られていること、および肺における炎症や線維化がSARS-CoV-2の病態の根底にどのように存在しているのかをまとめることを目的としている。また、COVID-19のウイルス感染性と中枢神経系の症状を媒介するインテグリンの役割にも注目する。COVID-19の免疫学をよりよく理解することは、将来の研究や介入戦略の指針となるであろう。
2. コロナウイルス
コロナウイルスは、ニドウイルス目(Nidovirales)とコロナウイルス科(Coronaviridae)に分類されている。この家族内のコロナウイルスの4つの異なる属がある。Alphacoronavirus、Betacoronavirus、Gammacoronavirus、およびDeltacoronavirus [15]。コロナウイルス科亜科内のBetacoronavirusクラッドには、中東呼吸器症候群(MERS-CoV)SARS CoV、SARS様コウモリCoV、および現在はSARS-CoV-2が含まれる[7,16,17]。
2.1. MERS-CoV
MERS-CoV は 2012 年にサウジアラビアで初めて同定され、その後遡ってヨルダンで発生したことが明らかになった [18]。人と人との間での感染はよくわかっていないが、MERS-CoV の主要なリザーバー宿主はドロメダリーラクダであることが知られている [19]。それにもかかわらず、この人獣共通感染症は院内感染で人と人との間で感染する[20]。MERSは、発熱、咳、呼吸困難などの症状を伴う下気道疾患としてヒトに発症する。MERS-CoVに感染した患者は無症状の場合もある [19]。MERSに感染した患者の約5人に1人が虚血性脳卒中、意識障害、麻痺などの神経学的症状を呈する [7]。MERS-CoV感染による神経症状の存在は、自己反応性T細胞がウイルス成分をウイルス感染の一部ではなく、宿主粒子として識別していることに起因する可能性がある[21]。MERSは、SARS-CoVおよびSARS-CoV-2と同様に、ベータコロナウイルスに分類される。このタイプのウイルスのスパイクタンパク質は、受容体によるウイルスの認識を調節し、ウイルスの発病を引き起こすため、種を越えた感染に不可欠である[18]。
2.2. SARS-CoV
人獣共通感染性呼吸器ウイルスSARS-CoVはアジアで初めて出現し 2003年には世界26カ国で8,000人以上の感染者を出してパンデミックした[7](WHO)。本疾患の主な症状は、発熱、悪寒、乾いた咳や呼吸困難などの呼吸困難である。また、最も重篤な症例では、死亡に至る呼吸不全が起こることもある[7]。この病気のヒトからヒトへの感染は、その強い感染力と相まって、人の健康への重大な脅威となる。2003年のSARSの発生では、症例の致死率は10%であった [22]。SARS-CoVは、骨格筋や脳を含む全身に発現しているACE2受容体に結合する[16]。
2.3. SARS-CoV-2
新型コロナウイルスSARS-CoV-2のアウトブレイクは 2019年12月に中国の武漢で始まった。この病気は後にCOVID-19と命名された。SARS-CoV-2は、SARSやMERS[4]と同様にコウモリに人獣共通感染源があったと考えられており、最初は華南海鮮市場で発生し、瞬く間に中国の武漢地域全体に広がった。このウイルスは現在、世界210以上の地域や国に広がっている[4]。感染率の推定値は様々で、R0が3に近いという報告もあれば、R0が5.7にもなるという報告もある [4], [23]。SARS-CoV-2感染の潜伏期間は最大14日であるが、平均潜伏期間は3日である[[24], [25], [26]]。2020年11月初旬の時点で、米国では3度目の急増を経験し、1日に10万人以上の症例が出現している(https://covid.cdc.gov/)。
SARS-CoV-2の症状は多岐にわたり、無症状の症例から発熱や乾いた咳、多臓器不全に至るまで、いくつかの臓器系に影響を与え、死亡率は約1~2%と推定されている[7,27,28]。神経学的症状も報告されている。頭痛、てんかん、意識障害はすべて頭蓋内感染の可能性を示している[7]。COVID-19は、発作、脳卒中、無感覚、脳症、さらには全身麻痺などの様々な神経学的合併症に寄与している[29]。COVID-19で集中治療室(ICU)に入院した患者の約20%が神経学的問題を報告しており、神経学的問題を抱えた患者は他の患者よりも高い死亡率を示している[29]。
SARS-CoV-2は、SARS-CoVと同じ受容体タンパク質を認識する;両ウイルスは、スパイクタンパク質を宿主細胞の膜上のACE2受容体に結合させることで宿主細胞に付着する[16]。SARS-CoVおよびMERS-CoVに関連しているが、SARS-CoV-2はその前身のいずれよりもはるかに致死性が高い[16]。
2.3.1. ゲノム構造
SARS-CoV-2はSARS-CoVに79.5%の遺伝子的類似度で関連しており、コウモリコロナウイルスとの遺伝子的類似度は96%に達しており[7,30]、このウイルスがコウモリ宿主に由来するという説をさらに支持している[30]。最大のRNAウイルスゲノムを持つSARS-CoV-2ウイルスのポジティブセンスRNA鎖は、長さ約30キロバイトのゲノムサイズを持っている[31]。mRNAのキャップされた5’末端では、ゲノムはリーダー配列を表す約70塩基から始まり、ゲノムの3’末端にはポリAテールがある[32]。両末端の間に、SARS-CoV-2のゲノムは、非翻訳領域、スパイクタンパク質、膜タンパク質、ヌクレオカプシドタンパク質、エンベロープタンパク質、および13-15のオープンリーディングフレームORFを含む[30]。ORF1aおよびORF1abは最大のものであり、ウイルスタンパク質の産生において重要な役割を果たしている[32]。ORF1aはその翻訳にリボソームフレームシフトを必要とするのに対し、ORF1abはゲノムRNA自体を介して発現することができる。
2.3.2. タンパク質の構造
ウイルスは多くの構造タンパク質と非構造タンパク質をコードしており、これらはウイルスの産生と感染に不可欠である。非構造タンパク質は、それぞれORF1aとORF1abのポリタンパク質1aと1abによってコードされている[33]。さらに、SARS-CoV-2ゲノムの4つの主要構造タンパク質は、スパイク(S)タンパク質、エンベロープ(E)タンパク質、膜(M)タンパク質、ヌクレオカプシド(N)タンパク質である[33]。Sタンパク質は、ウイルスが細胞内に侵入する部位である。Sタンパク質は、宿主に感染するためのRBDと融合ドメインの両方を持ち[34]、ACE2受容体[35]などの宿主細胞受容体と相互作用することで最も注目されている。これは、このウイルスの感染に不可欠かつユニークな側面である[35]。Sタンパク質は、エクトドメイン膜貫通部と細胞内Cドメインを含む[36]。その2つのサブユニットのうち、スパイクタンパク質のS1フラグメントは受容体相互作用に機能し、S2部分は膜の融合を助ける[36]。SARS-CoV-2の構造に不可欠なもう一つのタンパク質はEタンパク質であり、ウイルスの増殖と産生に機能している[30]。さらに、膜タンパク質はウイルスエンベロープの形状を制御している[35]。最後に、ヌクレオカプシドタンパク質は、小胞体-ゴルジ体コンパートメント内でのウイルス粒子の局在化を可能にする。
3. SARS-CoV2の疫学
いくつかの国のデータによると、SARS-CoV-2 と診断された患者の 14~19%が入院し、3~5%の患者が ICU に入院する必要があることがわかっている(https://www.cdc.gov/)。2021年1月現在、SARS-CoV-2の確定症例数は99,825,219人、死亡者数は2,143,198人となっているが、この数は過小評価されている可能性が高いです(https://coronavirus.jhu.edu/map.html)。症例の大部分は北米および南米で発生している。2020年12月20日現在の世界のCOVID-19確定症例数の累積は、https://www.who.int/publications/m/item/weekly-epidemiological-update—22-december-2020(図1)から修正したヒートマップに示されている。
図1 2020年12月20日現在の全世界の累積COVID-19確定症例数
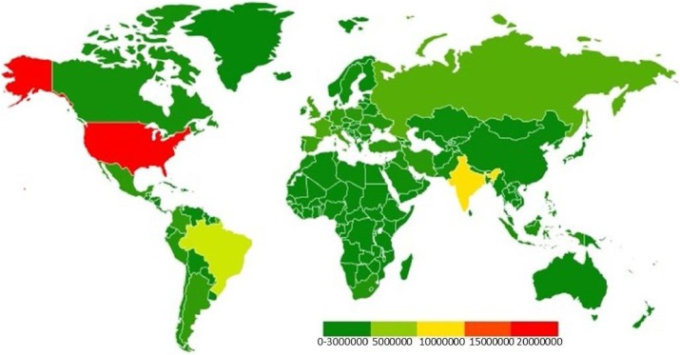
www.who.int/publications/m/item/weekly-epidemiological-update—22-december-2020。
4. SARS-CoV-2 の侵入、複製、媒介感染
SARS-CoV-2感染は、くしゃみや咳などの飛沫や密接な接触を介して人と人との間で感染する[37]。感染者には、感染後14日以内に症状が現れることがある[37]。以下のセクションでは、ウイルスの侵入から始まり、臓器機能障害に至る感染のメカニズムを説明する。
4.1. ウイルスの侵入と複製のメカニズム
これまでのSARS-CoVの研究では、ヒトコロナウイルスは逆行性の神経細胞播種およびシナプス結合、BBB上皮細胞、または全身循環を介して脳に侵入できることが明らかにされている[38,39]。SARS-CoV-2のヒト脳への侵入の決定的なメカニズムはまだ完全には解明されていないが、ウイルスは血液循環を介して脳に供給する静脈および動脈内皮細胞を介して脳に侵入する可能性があると考えられている[40]。[40].
SARS-CoV-2は、ウイルスのスパイクタンパク質が細胞膜受容体、特にACE2受容体によって認識されることにより宿主細胞に侵入する[41]。ACE2受容体は、肺、腎臓、心臓、および消化管細胞に存在する[33]。宿主細胞への結合におけるSARS-CoV-2の親和性は、SARS-CoVの結合親和性の約10~20倍である。この結合およびスパイクタンパク質の構造変化に続いて、ウイルスエンベロープは宿主の細胞膜と融合し、ウイルスRNAを宿主細胞内に放出する [42]。
SARS-CoV-2はまた、その3量体スパイクタンパク質の保存されたRGD(403-405:Arg-Gly-Asp)モチーフを介して、宿主細胞の侵入においてインテグリンを使用する可能性がある[43]。細胞表面受容体のファミリーであるインテグリンは、細胞外マトリックス(ECM)タンパク質を認識して結合し、細胞の生存、増殖、分化、および遊走を媒介する非共有結合性のαおよびβサブユニットで構成されている[[44], [45], [46]]。規制緩和された細胞-細胞および細胞-マトリックス相互作用は、腫瘍の増殖、転移、および腫瘍の血管新生を促進する。インテグリンは、呼吸器上皮細胞[47]や血管内皮細胞など、SARS-CoV-2感染に感受性のある細胞を含むほとんどの細胞で発現している[48]。重要なことに、インテグリンのβ1ファミリーはACE2と密接に関連しており[49]、特に内皮細胞上のα5β1フィブロネクチン受容体[50,51]は、癌などの異常な血管新生(すなわち血管の成長)を伴う多くの疾患、さらに最近では虚血性脳卒中後の血液脳関門を安定化させるために標的とされている[13,51]。
以前の研究では、多くのヒトウイルスがインテグリン受容体との相互作用およびその後の細胞感染にRGDモチーフが必要であることが報告されている[52]。インテグリンの関与は、ヒトアデノウイルス2/5型[53]、ロタウイルス[54]、エプスタインバーウイルス(HHV-4)[55]においても示されており、SWISS-MODELの3Dモデルを用いて解析された最近の研究では、モチーフがインテグリンに結合することの重要性、およびスパイクタンパク質での重要な局在化について説明されている[43,56]。多くの研究で、SARS-CoV-2スパイク糖タンパク質の中で、RGDモチーフはACE2受容体に結合することが示されている[57], [58], [59]]。しかし、インテグリンの結合はRBDに異なる構造変化を誘導し、RGDモチーフを更なるインテグリン結合にさらす可能性がある。これは、マイトジェン活性化プロテインキナーゼ(MAPK)が関与する導入経路を活性化することで感染を促進し、ウイルスの侵入と宿主細胞への感染を促進する[43]。
ウイルススパイクタンパク質が宿主細胞上のACE2受容体に結合し、それによってSARS-CoV-2感染を引き起こすためには、膜貫通型セリンプロテアーゼ2(TMPRSS2)がスパイクタンパク質のプライミングに必要である[60]。具体的には、このプロテアーゼは、ウイルスのスパイクタンパク質を2つのサブユニット、S1およびS2に切断し、それぞれACE2受容体と相互作用し、膜と融合することで結合を促進する [61]。このプロセスはウイルスを活性化し、その結果、ウイルスの宿主細胞への侵入を促進する [62]。
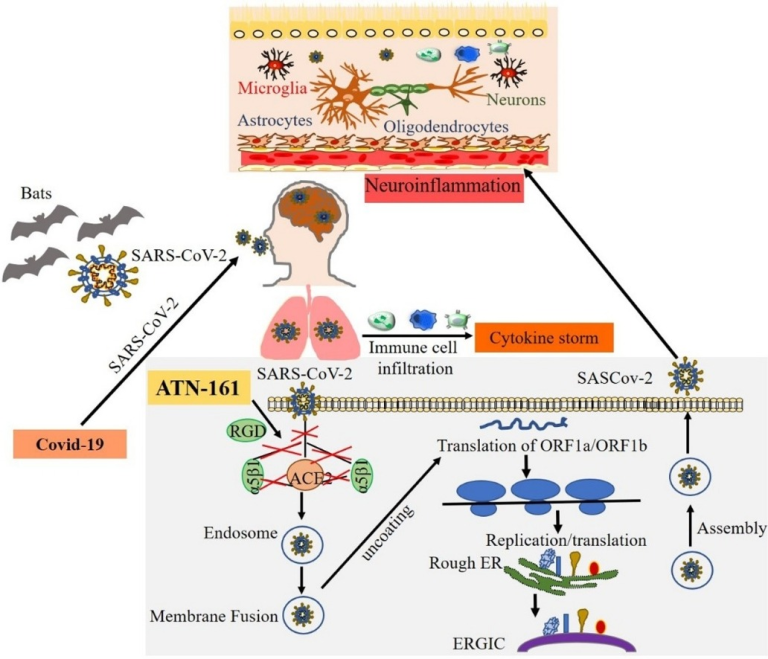
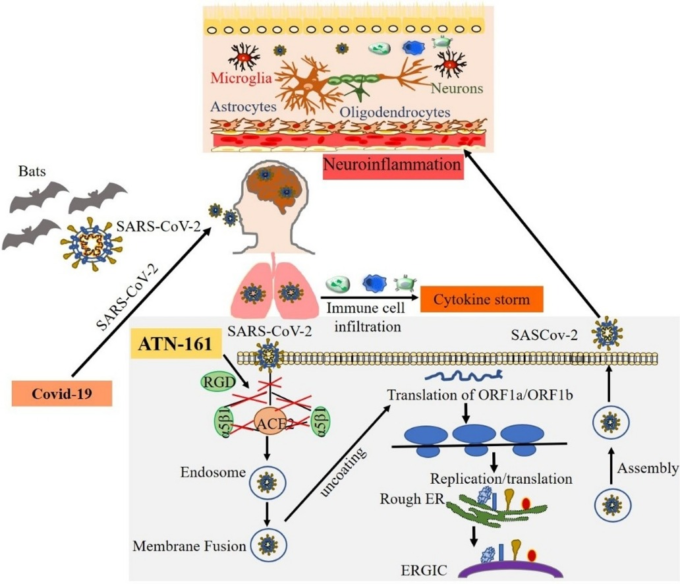
宿主細胞内に入ると、ウイルスRNAはその後、新しいタンパク質を合成し、その遺伝物質の複製を開始する [63]。2つの大きなオープンリーディングフレームであるORF1aとORF1bは翻訳され、酵素PLプロテイナーゼと3CLプロテアーゼを介してポリプロテイン1aと1abを産生する。これにより、リボソームフレームシフトが誘導され、この単一のmRNAから複数のタンパク質が生成される [33]。生成される非構造タンパク質(NSP)の1つは、RNA依存性RNAポリメラーゼの触媒サブユニットであり、その後のRNA合成に不可欠なnsp12である[64]。その後、多くのNSPが一緒になって複製転写酵素複合体(RTC)を形成し、RNA合成、複製、および転写を可能にする [41]。これにより、最終的に構造タンパク質に翻訳するためのサブゲノムRNAの産生が可能になる [33]。小胞体に挿入された後、これらの新しく合成された構造タンパク質は、小胞体-ゴルジ中間コンパートメントに輸送され、そこでN-カプセル化されたウイルスRNAは最終的に膜に出芽て細胞外に出る [41]。SARS-CoV-2感染の既知のメカニズムを図2に示す。
図2 SARS-CoV-2の感染、複製、神経系侵入のメカニズム
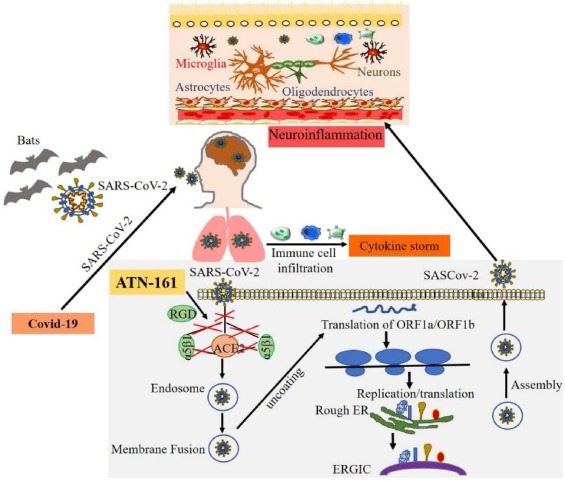
COVID-19を引き起こすSARS-CoV-2は、一次宿主であるコウモリに由来し、種の壁を越えてヒトに侵入する可能性がある。SARS-CoV-2のスパイクタンパク質は、細胞表面受容体ACE2と酵素TMPRSS2に結合し、ウイルスの侵入を助け、ウイルスはそのRNAを放出し、その一部はタンパク質に翻訳され、RNAはゴルジ体内で新しいウイルスに組み立てられて放出される。SARS-CoV-2への曝露は、炎症性サイトカインストームを促進する免疫細胞の浸潤を伴う肺の炎症を誘導する。コロナウイルスは血液循環を介して神経系に影響を与え、神経炎症を引き起こす可能性がある。我々は、ATN-161の添加がSARS-CoV-2感染を阻害することを試験管内試験で同定し、ATN-161の添加が宿主α5β1インテグリン、ACE2へのSARS-CoV-2スパイク蛋白質の結合、およびα5β1-ACE2の結合を阻害することが提案されている。我々は、ACE2とα5β1インテグリンを介してウイルスが脳内皮細胞に侵入する可能性があり、これはATN-161によっても阻害される可能性があると仮説を立てた。さらに、ATN-161はSARS-CoV-2が媒介するBBB破壊と神経炎症を間接的にブロックする可能性があるという仮説を立てた。
5. SARS-CoV-2は免疫細胞の浸潤、サイトカインストーム、炎症を媒介する。
SARS-CoV-2は、マクロファージ、内皮細胞、好中球、樹状細胞を含む様々な細胞に感染する[65]。ウイルスが宿主系に侵入すると、インターフェロン(IFN)の産生を介して免疫応答が開始される [65]。これらのシグナル伝達タンパク質は、ウイルスの存在を伝達する [66]。SARS-CoV-2感染に対するIFN免疫応答によって誘発される免疫細胞の1つのタイプは、T細胞、具体的にはCD8+細胞傷害性T細胞およびCD4+ヘルパーT細胞である[67]。これらの細胞はまた、B細胞などの他の細胞にシグナルを送ることで免疫応答をさらに刺激し、ウイルス感染に対する抗体を産生する [65]。SARS-CoV-2感染に関与する主要な抗体は、IgMおよびIgG抗体である[65]。さらに、このウイルス感染は、「サイトカインストーム」とも呼ばれるプロ炎症性ケモカインおよびサイトカインの流入を誘導する[65]。SARS-CoV-2感染反応における他の注目すべき免疫細胞は、ナチュラルキラー(NK)細胞であり、これはウイルスに対する初期反応において重要である[68,69]。
5.1. 好中球
マクロファージに加えて、好中球もまた、SARS-CoV-2に対する最初の防御ラインで役割を果たしている。好中球の数の増加は、COVID-19の重症例の患者で検出される[70]。これは、測定されたより高い好中球-リンパ球比を説明するものである[71]。SARS-CoV-2に対する好中球応答は、げっ歯類モデルにおいてさらに探索されている。ヒトACE2受容体を発現し、COVID-19に感染したトランスジェニックマウスでは、リンパ球およびマクロファージに加えて、好中球が肺胞間質に蓄積し、肺胞壁の肥厚を引き起こして肺障害を引き起こすことが判明した[72]。
5.2. 樹状細胞
樹状細胞(DC)は自然免疫と適応免疫の両方で重要な役割を果たしている。SARSに対する応答における樹状細胞の細胞サブタイプ特異的な相互作用は、急性期には樹状細胞の数が減少し、COVID-19患者の気管支肺胞ラバージでは成熟した樹状細胞が増加していることから、これらの細胞が感染に対する応答に関与していることを示唆しているようである[73,74]。SARS-CoV-2が樹状細胞に感染するメカニズムは不明である。ある論文では、樹状細胞への侵入はACE2受容体、マイクロピノサイトーシス、またはジペプチジルペプチダーゼ4(DPP4)受容体の相互作用を介したものである可能性が示唆されている。それでも、SARS-CoV-2と樹状細胞の相互作用については多くのことが不明である[74]。
5.3. マクロファージ
マクロファージは、SARS-CoV-2に対する自然免疫応答の最初の防御ラインとして機能する [70]。肺の細胞のSARS-CoV-2感染後、肺胞マクロファージは、隣接する上皮細胞および内皮細胞とともにATP、核酸、およびASCオリゴマーの放出における損傷に関連した分子パターンを認識し、炎症性サイトカインおよびケモカインの放出を誘発することによって応答する [75]。これらのタンパク質の放出の結果として、より多くのマクロファージ、単球、およびT細胞が感染部位に引き寄せられ、炎症をさらに助長する[75]。感染部位では、肺胞マクロファージはファゴサイトーシスを介して中和されたウイルスおよびアポトーシス細胞を除去するのに役立つ[75]。
問題は、肺に見られるようなアンジオテンシン変換酵素2(ACE2)を発現するマクロファージは、SARS-CoV-2の浸潤および感染に感受性があることである[75]。肺細胞に加えて、ACE2を有するCD68+およびCD169+マクロファージは、SARS-CoV-2核タンパク質抗原とともに脾臓およびリンパ節に存在する[76]。感染したCD169+マクロファージの大部分は脾臓の赤髄部に集まる [76]。リンパ節では、マクロファージは周縁部に多く集まり、これらの周縁部は非周縁部よりもウイルス核カプシドタンパク抗原に対して陽性を示す可能性が高い[76]。SARS-CoV-2はACE2を介してマクロファージに感染することができ、マクロファージの非定型活性化を引き起こし、インターロイキン(IL)-6,腫瘍壊死因子(TNF)IL-10,およびPD-1の産生をもたらし、肺胞マクロファージで見られるIL-6の発現、および脾臓およびリンパ節マクロファージで見られるIL-6の発現をもたらす [76]。これは、SARS-CoV-2に対する免疫応答をさらに複雑にする。
SARS-CoV-2によるマクロファージ感染は、げっ歯類モデルでさらに検討されている。SARS-CoV-2感染したACE2受容体発現トランスジェニックマウスの免疫組織化学染色では、マクロファージ内のウイルス抗原が示され、病理組織学的には、マウスの肺胞間質および肺胞腔内にマクロファージの浸潤および蓄積が示された[72]。また、肺に隣接する領域でもマクロファージによる血管周囲浸潤が認められている[72]。
5.4. T細胞
サイトカインストームの放出の引き金となった後、T細胞が感染部位に勧誘され、炎症がさらに促進される。COVID-19の症状発症から約1週間後に、ウイルスに対するT細胞およびB細胞の反応が血液中で検出される [75]。感染細胞の直接的な攻撃と殺傷の大部分はCD8 + T細胞によって行われ、CD4 + T細胞は他のT細胞とB細胞を刺激する。さらに、CD4 + T細胞は、サイトカイン産生および免疫細胞リクルートの活性化において重要である[75]。Tリンパ球はACE2発現を欠いているが、それでもSARS-CoV-2の影響を受ける可能性がある[77]。このことは、COVID-19が異なるメカニズムを介してこれらの細胞に感染することを示唆している。
SARS-CoV-2は、MHCクラスIおよびII分子をダウンレギュレートすることにより、T細胞が介在する免疫応答を阻害する[70]。細胞障害性T細胞およびNK細胞の枯渇はウイルスの持続を可能にする。感染初期のNKG2Aのアップレギュレーションによって示されるこの枯渇は、重篤な疾患の進行と関連している[70]。ある研究では、COVID-19の間にCD8 + T細胞の数が減少し、重症例ではメモリーCD4 + T細胞およびT調節細胞の数も減少していることが明らかになった[70]。T細胞の減少はリンパ節および脾臓で認められた [71]。症状が軽度で軽症の患者では、重症患者と比較して、T細胞(CD3+細胞)とCD8+T細胞(CD3+/CD9+細胞)の両方のレベルが有意に高いことが示された。軽症と重症の両方において、CD8 + T細胞数は健康なドナーと比較して減少していた[70]。COVID-19患者のこれらのCD8 + T細胞は、健康なドナーに比べてサイトカインIL-2,IFN-γ、およびグランザイムBの産生レベルが低く、脱顆粒も少ないことが判明した[70]。ICUの重症患者の末梢血T細胞では、PD-1(プログラムされた細胞死1)受容体の発現が、健康なドナーおよび軽症患者のT細胞と比較して高かった[70]。これらの知見は、T細胞の適応免疫応答におけるSARS-CoV-2の強力な免疫抑制能力を説明するのに役立つ。
5.5. B細胞
COVID-19の感染に続いて、B細胞はウイルスが宿主細胞に侵入するのをブロックする抗体を産生することができる[70]。B細胞およびT細胞は、長期記憶および防御免疫を保持する上で重要である[78]。COVID-19に重症感染した患者では、軽症感染患者に比べてB細胞数が減少する[76]。スパイク特異的中和抗体、記憶B細胞、および循環T濾胞ヘルパー細胞は、COVID-19から回復した患者で発見されている[79]。また、いくつかの研究では、感染後および回復後の中和抗体産生(および記憶)が、重症の症例に比べて軽症の症例では低いことが示されている。このことは、初期の免疫応答がより強力であれば、後になってからの再感染に対してより多くの保護が得られる可能性を示唆している[76]。個人差はあるが、回復したCOVID-19患者の中には感染後5ヶ月までの高力価の中和抗体を発見した研究がある[80]。このように、抗体は少なくとも5ヶ月間持続することが示されているが、これも試験期間の評価の末期であったため、もっと長く持続する可能性がある。
5.6. SARS-CoV-2媒介性サイトカインストーム
SARS-CoV-2は、細菌または他の微生物からの感染と同様に、免疫応答を迅速に誘発し、身体資源を流用し、代謝物資を動員することができる[81]。SARS-CoV-2に感染すると、T細胞、B細胞、単球、マクロファージ、NK細胞などのいくつかの細胞プレーヤーが感染に対抗するために活性化する。ウイルスに感染した細胞間で受容体-リガンド相互作用が起こり、白血球を活性化させる正のフィードバックループが発生し、その結果、炎症性サイトカインを放出するカスケードが始まり、それが全身に広がる。SARS-CoV-2患者の中には、この現象を経験することができ、呼吸器系の問題や全身的な疲労感を含む軽度から重度の風邪のような症状を呈する者もいる [82,83]。腫瘍壊死因子(TNF)ケモカイン、IL、IFN、コロニー刺激因子(脳脊髄液)成長因子、およびその他の分子など、いくつかのサイトカインがこの反応を媒介すると考えられている。サイトカインストームは、抗原提示細胞がウイルス抗原を処理し、この抗原をCD8陽性T細胞やナチュラルキラー細胞に提示した結果、適応免疫系と自然免疫系の両方が刺激され、免疫系が過剰に活性化されて病原性を示すようになるときに起こる。この事象は、臓器不全や死に至る可能性がある[84]。サイトカインストームは、SARS-CoV-1の過去の症例でも報告されている[82]。
5.6.1. GM-脳脊髄液
顆粒球-マクロファージ(GM)-脳脊髄液はプロ炎症性サイトカインに分類され、顆粒球、樹状細胞、マクロファージ、単球の産生など、多数の免疫系プロセスに関与している。重要なことに、SARS-CoV-2患者では上昇している[85]。GM-脳脊髄液はこの病理学的状態の主要な推進因子であるため、患者における抗GM-脳脊髄液のプロ炎症状態の影響を軽減する能力を検証する臨床試験が現在進行中である[85,86]。ある症例コホート研究では、GM-脳脊髄液の阻害剤であるリンジルマブが、重症肺炎を有する高リスクのCOVID-19患者において、IL-6やTNF-αなどの炎症マーカーを減少させ、臨床転帰の改善と関連していることが示された[87]。
5.6.2. IL-6
SARS-CoV-2に感染した患者では、プロ炎症性サイトカインIL-6の高レベルも示されている。このサイトカインは、感染開始時に刺激を受けた単球やマクロファージから作られる。研究では、IL-6のレベルの増加は、ウイルスに罹患している患者の肺の損傷と相関していることが示されている。GM-脳脊髄液と同様に、このサイトカインの受容体をブロックして不活性化することで、このサイトカインに関連する問題を緩和する可能性がある[88]。有望な薬剤の一つは、他の障害におけるサイトカイン放出を減少させるために使用されるモノクローナル抗体であるトシリズマブである。現在、SARS-CoV-2を患う患者での有効性を決定するための試験が実施されている[89]。IL-6受容体をブロックすることの限界は、体の自然防御力が低下し、病原体を撃退する効果が低下することである [86]。
5.6.3. IL-10
IL-10 のレベルは、SARS-CoV-2 を有する患者においても増加することが示されている。文献分析によると、IL-10は重症患者で有意に増加し、そのレベルは疾患の重症度と関連していることが明らかになった[90]。活性化される調節性T細胞は、病原体に曝露されるとIL-10の産生を開始する。通常、肺のウイルス感染は、自然炎症反応を減少させ、組織を破壊するIL-17産生細胞を防ぎ、特定のウイルスの死亡に関与するIL-6のような他のサイトカインを減少させるために、IL-10を引き起こす。正常なサイトカインレベルよりも高いサイトカインレベルは適応免疫を無効にし、肺の炎症に対する SARS-CoV-2 の影響を悪化させる可能性があり、感染後の患者の転帰を予測するための有用なマーカーとなる可能性がある [91]。
5.6.4. その他のサイトカインおよびケモカイン
IL-1は、活性化されたマクロファージおよび単球から生じる炎症性サイトカインであり、肺機能の低下、ウイルス負荷の増加、および死亡率の増加と相関している [81,92]。IL-2はエフェクターおよびメモリーT細胞を増殖させる働きをしており、IL-2の高レベルは重症で重症のCOVID-19症例で観察される [93,81]。IL-4は、Bリンパ球の活性化から分化に至るまで、適応免疫のもう一つの重要なプレーヤーである。この抗炎症性サイトカインは、サイトカインストーム時にも上昇する[22]。
ケモカインは、免疫細胞の移動および適応免疫系および自然免疫系の発達に関与している。これらは感染症や病原体に反応して活性化し、白血球を懸念される部位に連れてくることができる。ケモカインCXCL8,CXCL10などはプロ炎症性であり、SARS-CoV-2患者でも上昇している[94,95]。
6. SARS-CoV-2は神経炎症を媒介し、中枢神経系の線維化を誘導する。
BBBは、脈絡叢の上皮細胞、大脳上皮、クモ膜上皮の間の緊密な接合体で構成されている [96]。提案されているメカニズムの1つは、ウイルスがBBB内皮細胞間のACE2受容体と結合し、神経炎症を介して中枢神経系に侵入するというものである[39]。ウイルスはまた、中枢神経系に侵入するマクロファージや単球に感染することで、BBBの保護を回避することもある [39]。ウイルスがBBBを破壊するもう一つの方法は、肺でのウイルス感染に反応して行われる全身性の炎症に由来する。アストロサイトはBBBの構成要素であり、循環中のプロ炎症性サイトカインからのシグナルを受け取ることになる[97]。これはSARS-CoV-2が中枢神経系に侵入し、神経炎症を引き起こす可能性がある。
ミクログリアは中枢神経系に本来存在する免疫細胞であり、脳への傷害や感染が起こると活性化する [97]。ミクログリアは、神経細胞の可塑性、破片の除去、シナプスの剪定、脳実質の調整、末梢免疫系からの入力の受信などの機能を含むがこれらに限定されない幅広い機能を有する。SARS-CoV-2の感染後、患者は、上述したように、全身性の炎症性サイトカインの大幅な増加を呈することがある。ミクログリア細胞は中枢神経系においてそのような広い範囲の機能を持っているので、SARS-CoV-2の感染は、神経変性疾患として患者に現れる可能性のある親炎症性ミクログリア表現型を誘発する可能性がある。また、反応性抗炎症性ミクログリアの存在は、神経炎症を引き起こす遺伝子の発現を増加させる可能性がある[95,97,98](図2)。
SARS-CoV-2感染は、神経細胞傷害および神経学的変化を促進しうる。感染に伴い、脳炎や致死的な微小血栓の発生が起こる可能性がある[99]。重症患者からの多系統炎症性症候群は、線維化および血栓症を引き起こし、脳に影響を及ぼす可能性がある[100]。神経細胞上のACE2受容体とウイルスとの相互作用は、軸索損傷を引き起こし、神経学的損傷を誘発する可能性がある。恐ろしいことに、脳内のACE2のレベルは様々であるため、これが様々な神経変性疾患を加速させる可能性があることは十分に考えられる[101]。
7. 神経系のSARS-CoV-2感染症
COVID-19患者にみられる神経学的症状は、基礎となる神経学的状態の有無にかかわらず、この疾患の重要な側面として認識されるようになってきている。中国の武漢で行われた系統的研究では、COVID-19で入院した214人の患者のうち78人に神経学的症状が認められたことが報告されている[102]。この研究では、患者の14.8%が意識障害を経験し、5.7%が急性脳事故を経験し、19.3%が骨格筋損傷を経験した。COVID-19でICUに入院した患者の約20%が神経学的合併症を報告し、神経学的問題を抱えた患者では死亡率が高かった。これらの症状には、脳卒中、脳症、急性炎症性脱髄性多発神経炎脳炎などが含まれている[29]。フランスの研究では、COVID-19患者58人中49人の神経症状が報告されている[103]。COVID 19の最も一般的な神経学的症状のメタアナリシスでは、疲労が32%、筋痛が16%、頭痛が9.2%の患者で報告されている[104]。これらを総合すると、COVID-19の神経学的症状は一般的であり、潜在的に深いものであるという明確な証拠がある。MERSやSARSを含む以前のコロナウイルス感染症では、中枢神経系を標的とした重大な合併症が報告されていなかったことを考えると、これは特に問題である[105]。
7.1. COVID-19と脳卒中
脳卒中は、SARS-CoV-2感染後の一般的で壊滅的な合併症として浮上している。実際、COVID 19を有する入院患者の2~6%が急性脳血管イベントを経験している [106]。一般集団で脳卒中を経験する患者と同様に、COVID-19に関連した脳卒中は一般的に虚血性であるが、出血性の症例も数例報告されている [107]。さらに、COVID-19患者は高齢で高血圧で、DダイマーおよびC反応性蛋白質レベルが高く、COVID-19感染の臨床経過がより重篤な患者では、脳卒中の可能性が高かった [107]。SARS-CoV-2が脳卒中を引き起こすメカニズムは様々であり、凝固障害、脳塞栓症を伴う心筋損傷、または既存のアテロームプラークの不安定化を含む [108]。ウイルスは、内皮、血小板、および凝固に関与する免疫系反応を誘発することにより、血栓症を引き起こす。さらに、SARS-CoV-2に反応して生じる「サイトカインストーム」は、Dダイマーを増加させ、凝固に影響を与え、脳卒中を誘発する。また、ウイルスは心臓を損傷し、ウイルス性心筋炎を引き起こし、心筋塞栓性脳卒中を引き起こす可能性がある。炎症はさらに、アテロームプラーク周辺の線維性カプセルを不安定化させ、血栓性凝固物質を露出させて動脈の閉塞を促す可能性があり、これも脳卒中の原因となる [108]。
ある研究では、脳卒中の既往歴のあるCOVID-19患者は予後が悪く、脳卒中の既往歴のない患者に比べて3倍以上死亡する可能性が高いことが明らかになった[108]。感染していない患者であっても、COVID-19パンデミックの間接的な結果として、脳卒中の罹患率と死亡率が増加している可能性がある。病院に行くことへの恐怖は、COVID-19の患者に集中している病院のリソースとともに、間接的に脳卒中の罹患率の増加につながる可能性がある [108]。COVID-19を併発している場合の脳卒中の管理は、非COVID脳卒中の標準ケアに従うべきである。出血性脳卒中は、サイトカインストーム、またはSARS-COV-2が脳の内皮および動脈平滑筋細胞のACE2受容体に結合することによって引き起こされ、頭蓋内動脈を破断点まで損傷させることがある [107]。
7.2. 頭痛とCOVID-19
頭痛はCOVID-19の症状としてよく見られるだけでなく、髄膜炎、脳炎、血管炎、頭蓋内高血圧症などの他の神経学的疾患の合併症である可能性があり、これらはすべてCOVID-19で報告されている。しかし、低酸素、代謝異常および全身性炎症はすべて頭痛の一因となる可能性がある。COVID-19患者の最大40%で頭痛が報告されていることを考えると、新たに発症した頭痛、および既知の原発性頭痛障害を持つ患者における頭痛の特徴やパターンの変化は、急性COVID-19などの二次的な原因の探索を必要とする[109]。
7.3. 発作とCOVID-19
基礎となる発作障害を有する患者は、COVID-19を含む感染症による画期的な発作のリスクが高くなる可能性がある[110]。COVID-19を有する患者がてんかんの既往歴がなくても発作を起こした症例報告があるが、これがSARS-CoV-2感染による直接的なものなのか、それとも他の要因による発作障害のアンマスク化なのかは明らかではない[111]。
7.4. アノスミア(嗅覚脱失)(嗅覚脱失)およびエイジウジアとCOVID-19
嗅覚障害と加齢障害の有病率は文献でも幅広く報告されており、武漢での研究では低嗅覚の有病率が5.6%、低嗅覚の有病率が5.1%であったと報告されている。ドイツの研究では、COVID-19患者の88.5%が嗅覚機能障害を経験し、88%が味覚障害を経験したと報告している[112]。さらに、イタリアの研究では、患者の34%が嗅覚障害を報告したことが明らかになった[113]。
7.5. COVID-19と認知障害/認知症
COVID-19のパンデミックは、認知症患者に独特の課題を提示している。認知症の患者は、手指衛生、マスクの着用、他人との社会的距離の維持などの公衆衛生ガイドラインに従うことがより困難である[114]。社会的な接触の欠如は、これらの患者にとって特に困難である。なぜ愛する人と接触できないのかを十分に理解しておらず、精神衛生に悪影響を与え、うつ病の原因となることさえあるからである[114]。最後に、COVID-19による医療制度への負担は、認知症のような慢性疾患の患者から資源を奪い、疾患のコントロールの進展を妨げる可能性がある[114]。
認知症患者はCOVID19に感染するリスクが高まる可能性がある。APOE e4はアルツハイマー型認知症の発症リスクを高め、APOE e2はこのリスクを低下させることが知られている。最近のイギリスの研究では、APOE e4のキャリアではCOVID-19に感染するリスクが高いことが報告されている[115]。これは、APOE e4およびSARS-CoV-2感染者を認知機能障害のリスクが高い状態に置く可能性がある。さらに、認知症患者は認知症のない人よりも心血管疾患、糖尿病、肺炎などの併存疾患を持っている可能性が高く、COVID-19に感染した場合、重篤な病的障害や死亡のリスクが高くなる[114]。
(Canvelli et al 2020)は、パンデミック中に認知症患者の臨床状態や認知障害が変化したかどうかを調べる研究を行った[114]。彼らは、研究対象となったサンプルの3分の1近くで症状の全体的な悪化がみられたことを発見した。特に、患者は記憶力と志向性の低下を呈していた。19人の患者(サンプルの13.6%)では、自立度の低下と機能低下が指摘された。半数以上の患者では、攻撃性、無関心、抑うつなどの行動障害が新たに発生したり、悪化したりしていた。サンプル数は限られていたが、COVID-19は認知症やその他の認知障害を持つ患者の臨床状態に間接的に影響を与えていると研究者らは判断した。
7.6. パーキンソン病(PD)におけるCOVID-19
COVID-19のパーキンソン病患者への影響は、ウイルスが直接健康に影響を与えるだけでなく、病気の進行や生活の質にも影響を与えるため、複雑なものである。パーキンソン病患者の95.6%が手洗い、マスク着用、厳格な閉じこもり、社会的距離、手袋の使用などの予防措置をとっているにもかかわらず、ウイルスを心配しているのは68.8%にすぎなかった[116]。しかし、パーキンソン病患者の11.7%がウイルスに感染した後に集中治療室に入院したり、重症肺炎を発症したりしているため、この集団は重症化のリスクが高い可能性がある [117]。さらに、これらの患者は非パーキンソン病患者と比較してCOVID-19で死亡するリスクが高い [118]。研究では、死亡率は19.7%~50%であることが示されている[[118], [119], [120]]。なぜパーキンソン病患者が死亡リスクが高いのかという仮説の1つは、誤嚥性肺炎を引き起こす可能性のある口咽頭嚥下障害の発症によるものである。
さらに、COVID-19はパーキンソン病患者の神経学的症状を悪化させる可能性もある [117]。症例報告では、COVID-19の診断前にPDおよび運動症状(すなわち、転倒、言語障害、ジストニック痙攣)が悪化したことが報告されている[[121], [122], [123]。運動症状に対するこれらの変化は、COVID-19の症状である下痢による経口療法の吸収の低下によって部分的に説明されることがある [124]。症状の悪化は、ストレスや通常の活動への変化など、パンデミックの二次的影響に起因する場合もある。パンデミックが始まる前の1ヵ月間と1ヵ月後の神経学的症状の変化を評価すると、患者は硬直、疲労、振戦、痛み、集中力などのPD症状の悪化を経験した[125]。
COVID-19は、パーキンソン病患者の日常生活がパンデミックの影響を受けるため、パーキンソン病患者の生活にさらに影響を与える。COVID-19を持たないパーキンソン病患者は、パンデミックの間接的な結果として、生活の質と身体活動の低下、および精神症状(すなわち、うつ病、不眠症、過敏性)の増加を示している[125], [126], [127], [128]。
COVID-19と神経学的症状との長期的な関係が表面化するには数年かかるだろうが、健康な個人ではパーキンソニズム発症の証拠があるかもしれない。45歳の男性が感染後2ヶ月でパーキンソニズムを発症したという症例報告が発表されているが、運動機能の変化、発話、両プータメンにおける18F-FDOPAの取り込み量の減少などが証明されており、ウイルスによる神経学的変化を示唆している[129]。さらなる研究と観察により、COVID-19の長期的な神経学的効果についての洞察が得られるであろう。
7.7. 脳症
脳症は注意力と覚醒力の障害によって特徴づけられる。脳症の原因は多因子性であることが多く、毒性代謝性の原因、低酸素症、敗血症、臓器不全、薬剤の副作用などの探索が必要である。患者を発症させる危険因子には、アルツハイマー病のような基礎的な神経変性疾患、感染症、代謝異常および内分泌異常、入院中の全身疾患、特に集中治療室での入院、および認知機能障害の他の原因が含まれる[130]。
COVID-19関連脳症の初期症例報告は2019年3月に始まった[131,132]。しかし、最近の研究では神経学的患者における9.4%~37.7%の割合が報告されており、発生率はその後増加している[133,134]。興味深いことに、脳症、発作、または髄膜徴候などの明確な神経学的合併症を報告した小児は1%未満であった[135]ことから、脳症は小児のCOVID-19患者よりも成人のCOVID-19患者の方が一般的であることが示されている。
COVID-19患者では、混乱、激越、意識不明、精神状態の変化および発作の一般的な状態を呈しており、診断検査が必要とされている [136,137]。脳症の一般的な診断ツールである脳波計を受けたとき、21%が脳症を示した [136]。この診断は重症患者では74%に増加した [138]。背景異常で最も多かったのはびまん性徐行、部位は前頭部であった[137]。診断は機能的転帰の悪化や死亡率の増加と関連しているため、脳症の症状に対する認識と診断検査が重要である[134]。
7.8. 筋萎縮性側索硬化症
筋萎縮性側索硬化症(ALS)とCOVID-19との関係はほとんど研究されていない。COVID-19に対する感受性の増加やALSとの関連での転帰重症度の増加は報告されていない。現在のところ、遠隔医療または感情的苦痛に対するCOVID-19の効果に焦点を当てた研究が行われている[[139], [140], [141], [142], [143], [144]。ALSに対するパンデミックの主な間接的影響は、患者の精神衛生への影響であり、パンデミックによりうつ病、不安、自己認識が増加したことが研究で明らかになっている[139,144]。さらに、患者は治療セッションの中断や医師の診察のキャンセルを経験した。これらの要因は、より高い臨床進行率と運動障害の自己認識による悪化に寄与しているかもしれない[144]。
7.9. 失調症
現在のところ、小脳失調症と診断された患者の転帰に対するCOVID-19の効果を検討した研究はない。失調症の既往歴のない患者では、COVID-19による二次的なこの状態の発症はまれであり,0.4%の患者が失調症を経験しているにすぎない [134]。症例研究では、30~73歳の男性におけるCOVID-19の前、中、および後に発症した運動失調が報告されている[[145], [146], [147], [148]]。しかし、治療法は患者によって様々であり、症状を解消するためにレベチラセタムの併用または単独での使用が含まれていた [146,147]。
7.10. ギラン・バレー症候群、急性炎症性脱髄性多発神経障害(AIDP
ギラン・バレー症候群(GBS)は、SARS-CoV-1感染症を含む以前の消化器および呼吸器疾患の設定で記載されている[149]。COVID-19後にイタリアでGBSの5例が報告された。患者の大多数は下肢の脱力感と麻痺を呈し、神経症状の発症はウイルス性症状の発症から5~10日後であった[150]。COVID-19の感染症では、Miller Fisher症候群、多神経性頭蓋炎、咽頭および顔面脱力症を含むGBSが報告されている[151]。
7.11. ベル麻痺
COVID-19に関連したベル麻痺は、耳鼻咽喉科症状を呈する89人の患者のうち1人しかベル麻痺を報告していないため、珍しいものである[152]。症例研究では主にベル麻痺とCOVID-19の関係が報告されている。1人の患者は両側性の脱力感を経験したが、他の3人の報告は左顔面麻痺に限定されていた。年齢は男女ともに35~65歳で、妊娠39週の妊婦1名を含む。すべての患者が感染時にBell’s Palsyを発症していた。治療は、抗ウイルス薬および/またはステロイド、または免疫グロブリンの静脈内投与 [[153], [154], [155], [156]] であった。
7.12. 脳腫瘍
腫瘍治療を受ける能力は、パンデミックの二次的な犠牲者となっている。1,459人の脳腫瘍患者を対象とした研究では、地域(アメリカ大陸、ヨーロッパ、またはアフリカ/アジア/オセアニア)間でCOVID-19の陽性率に差はなかった。しかし、ヨーロッパ人が最も治療の遅れを経験した。臨床試験への登録にも影響があり、18.6%の患者がCOVID-19のために参加できなくなっている[157]。英国では、10.7%の患者が管理計画の変更を余儀なくされ、86%の患者が手術を受けられなくなった[158]。COVID-19患者の治療には病院のリソースが必要であり、これらの患者は高リスクと考えられているため、これらの遅延は両面的なものである。病院は、外科的介入の必要性を判断するためのアルゴリズムとフローチャートを開発したり、入院期間を最小限に抑えるために侵襲性の低い外科的技術を利用したりしている[[159], [160], [161]]。追加のプロトコルは、COVID-19感染のリスクを最小化するために効果的に実施されている[162,163]。
7.13. 低酸素症のCOVID-19患者
COVID-19に罹患している患者の多くはまた、異常に低い血中酸素飽和度レベルを呈するようである[164]。組織への酸素供給が不十分な低酸素症は、損傷を引き起こす [165]。これらの患者は血液を通して適切な酸素供給を受けていないが、低酸素症のCOVID-19患者はしばしば呼吸困難に陥っているようには見えない;むしろ、警戒感があり、容易に話をすることができる [164]。したがって、COVID-19患者における低酸素状態は、追加的な影響を最小限に抑えることができるため、しばしば「幸せな」または「静かな」低酸素状態として知られている[164]。
7.14. 不安、抑うつ、および精神病を含む神経精神症状
COVID-19に関連する神経精神医学的合併症、特にうつ病、不安、外傷性ストレス障害などは極めて一般的であるようであり、生活の質に悪影響を与える機能障害の表現型を幅広く網羅している [166,167]。例えば、正式に入院したCOVID-19患者のサンプルでは、退院後30日目の時点で、心的外傷後ストレス障害、うつ病、不安、強迫性障害、および不眠症の症状がそれぞれ28%、31%、42%、20%および40%の割合で報告されている[168]。さらに、他の呼吸器疾患に感染した患者と比較して、大規模な電子カルテ研究では、COVID-19と診断されたが精神医学的障害の既往歴がない患者では、感染後90日以内に新たな不安障害を発症する確率が約4.6%であったことが報告されている[169]。
二次的な結果として、SARS-CoV-2のパンデミックは世界の人々の間に精神衛生上の危機を引き起こした。実際、多くの報告では、不安および抑うつ症状の高い有病率(症状に依存する範囲は12%~67.5%)に加えて、臨床ケア提供者および必要不可欠な労働者における不眠症および心的外傷の存在が記述されている[[170], [171], [172]])。一般人口の間では、世界的なロックダウンによって引き起こされた社会的孤立、不確実性、およびコントロールの所在の低さが、精神保健治療を求める患者や気分変調を呈する患者の増加の観察された理由である可能性が非常に高い。悲しいことに、パンデミックは、薬物の使用や自殺行為などのネガティブな対処法の増加を同時にもたらした [173]。
免疫系と中枢神経系の機能が精神衛生やストレスへの反応に関与することは、過去数年の間に集中的な研究の対象となっており、免疫活性化(すなわち、ウイルス感染による)が神経精神医学的合併症を媒介しうる多くのメカニズムを明らかにしてきた。これらのメカニズムの中で最も重要なものは、これらの合併症がCOVID-19に関連するような過剰な炎症によって引き起こされるという考え方である[174,175]。実際、IL-1β IL-6およびTNF-αを含む、COVID-19患者で誘導されることが知られているサイトカインの多くは、大うつ病および不安障害と関連しており、他の場所で広範囲にレビューされている[[176], [177], [178]]。重要なことに、抗うつ薬とともに非ステロイド性抗炎症薬を併用することは、気分障害の症状を有意に減少させ [179]、COVID-19の炎症性カスケード誘発性神経精神症状と闘うための実行可能な治療法の選択肢となりうる。
これらの新たなデータを総合すると、SARS-CoV-2パンデミックの結果として直接的または間接的に生じた精神衛生上の合併症は重大な医学的課題であり、その負担は今後何年にもわたって続く可能性が高いことが示唆される。SARS-CoV-2およびMERS-CoVの大パンデミックにおいて、患者、一般市民、および医療従事者の間で同様の神経精神症状が報告されていることに留意することが重要である[[180], [181], [182], [183]]。
7.15. Long-COVID、慢性COVID、長期不調組
COVID-19の急性期の後に神経学的およびその他の症状が長引く患者のサブセットの症例報告が増えている。これらの患者は、口語では「長引く患者」と呼ばれている [184]。最も一般的な長期的愁訴の1つは、以前のコロナウイルス感染症で報告されている筋痛性脳脊髄炎としても知られる慢性疲労症候群に似た重度の疲労である。この状態は現在のところ同定されたバイオマーカーがないため、診断は除外の一つであり、症状に基づいている[185]。実際、急性感染後13~36ヶ月間働けなかった22人の患者において、筋痛、抑うつ、疲労、睡眠障害を含む同様の訴えがSARS感染後に報告されている[186]。別の研究では、SARS感染後4年後の患者を追跡調査したところ、40%の患者が慢性疲労に悩まされていることが判明した[182]。
8. COVID-19の潜在的な治療法
COVID-19に対する多くの潜在的な治療法が研究され、試験されているが、幸いなことに、FDAによって承認されたいくつかの薬剤が、影響を受けた個人に対して利用可能である[187]。いくつかの医薬品は、成功の程度の差こそあれ、潜在的な治療法として検討されている [188]。ヒドロキシクロロキンは、もともとマラリアおよび他の炎症性疾患の治療に使用されていたが、当初はCOVID-19に対する可能性があると考えられていたが[187]、その後、効果がないことが示されている[189]。リバビリンは、ウイルスの宿主細胞への侵入と同様に、ウイルスの融合を防ぐ[187]。COVID-19に対するもう一つの薬物療法はレムデシビルであり、これはSARS-CoV-2のウイルス複製を阻害する[187]。
さらに、拮抗薬トシリズマブもまた、宿主細胞へのウイルスの侵入を阻害する[187]。潜在的な治療法の最後の手段は、回復したCOVID-19患者から血漿を患者に投与する回復期血漿である。これは、回復した患者の血漿中の抗体が感染した患者のウイルスとの戦いに役立つことを期待して行われる[188]。ヒトにおけるCOVID-19を制限するためのワクチン、抗ウイルス剤、および中和抗体に関するいくつかの進行中の臨床試験を表1に列挙する。ACE2/TMPRSS2機構の阻害もまた、COVID-19の治療的アプローチとして検討されている[61]。ある研究では、SARS-CoV-2の侵入は細胞の侵入に受容体ACE2を使用し、Sタンパク質のプライミングにTMPRSS2を使用し、TMPRSS2活性はセリンプロテアーゼ阻害剤によってブロックされることが示されている[190]。
表1 COVID-19のための治験薬および利用されている治療法。リソース。FDA、WHO、Clinical trials.gov
| 治療の種類 | アプローチ/薬物 | 作用機序 |
|---|---|---|
| 医薬品 | ファビピラビル | RdRpおよびウイルスRNAポリメラーゼ活性を阻害します |
| クロロキン | 細胞受容体の糖タンパク質に影響を与え、SARS-CoV-2認識を阻害します | |
| ヒドロキシクロロキン | ウイルス複製、タンパク質のグリコシル化、ウイルスの集合、およびその他の抗ウイルス活性を阻害します | |
| レムデシビル | RdRpおよびウイルスのRNA転写の早期終了を妨害する | |
| リバビリン | RdRpを模倣してその機能を阻害し、ウイルス合成を防ぎます | |
| トシリズマブ | IL-6受容体を阻害するため、サイトカインストームの影響を最小限に抑える可能性があります | |
| ビタミンD | 感染のリスクを減らし、免疫力を高め、ACE2をアップレギュレートし、全体的に病気の重症度を軽減します | |
| 亜鉛 | ウイルス複製を抑制し、抗ウイルス免疫を強化し、体内のCOVID-19関連の損傷を軽減します | |
| ワクチン | ファイザーBioNTech「Comirnaty」 | 上腕の筋肉に注入されたmRNAワクチン。21日間隔で2ショットで配布。このワクチンの有効率は95%です |
| モデルナ「mRNA-1273」 | 上腕の筋肉に注入されたmRNAワクチン。28日間隔で2ショットで配布。このワクチンの有効率は94.1%です | |
| オックスフォード-アストラゼネカ「AZD1222」 | 上腕の筋肉に注射されるアデノウイルスベースのワクチン。4週間間隔で2ショットで配布。このワクチンの有効率は、投与量にもよりますが62〜90%です。 | |
| ジョンソン&ジョンソン「Ad26.COV2.S」 | アデノウイルスベースのワクチンは、腕の筋肉への注射を介して1回投与で配布されます。このワクチンの有効性の結果はまだ決定されていません。 | |
| 家庭薬 | 塩水うがい、熱いお茶、トローチ | 喉の痛みの症状を緩和する |
| 気化器、加湿器、蒸気吸入器 | 混雑を緩和する | |
| 漢方薬 | さまざまな症状を緩和する | |
| その他 | 回復期の血漿 | 回復した患者の血漿中の抗体は、現在感染している患者と戦うのに役立つ可能性があります |
インテグリン結合を阻害する多くの既知の化合物は、SARS-CoV-2に対する有望な治療アプローチを提供する可能性がある[191]。また、α4β1/β7 インテグリン拮抗薬であるナタリズマブは、もともと多発性硬化症の治療に使用されていた。 同様に、αIIbβ3 阻害薬であるティロフィバンは、急性冠症候群の治療に伝統的に使用されているが、SARS-CoV-2 の治療法としての可能性が模索されている[192]。我々や他のグループの研究では、非RGDペプチドであるATN-161(PHSCN)が、実験的な癌や虚血性脳卒中の生体内試験でα5β1受容体の活性を阻害する可能性があることが示されている[13,193]。また、ATN-161は第I相がん臨床試験でも成功を収めており、用量制限毒性を伴わない安全性と忍容性の高さが証明されている[194]。実験的虚血性脳卒中では、脳卒中後の脳内皮細胞α5β1インテグリン発現の増加とBBBの破壊、その後の浮腫および神経炎症の増加が関連しており、これらの両方(および脳損傷全体の大きさと機能的欠損)がATN-161によってブロックされる可能性があることが示されている[13]。
抗ウイルス療法の可能性として、以前の研究では、ATN-161がα5β1-FAKシグナル伝達機構を介してマウスのbetacoronavirus porcine hemagglutinating encephalomyelitis virus(イングランド公衆衛生サービスV)のウイルス複製をブロックできることが報告されている[195]。このメカニズムは、ATN-161がRGD結合ポケットに結合することから始まり、インテグリンα5β1の非競合的な阻害剤として作用する [196]。同様に、ACE2はタンパク質-タンパク質相互作用にアクセス可能な領域にRGDモチーフを持っているにもかかわらず、RGDに依存しない方法でα5β1に結合する[197]。本研究では、SARS-CoV-2スパイクタンパク質がα5β1とα5β1/hACE2に結合し、VeroE6細胞ではATN-161で結合が阻害されることを明らかにした。ACE2-α5β1-ATN-161のメカニズムをまとめたものを図2に示す。これらの研究は、新規なCOVID-19抗ウイルス治療薬としてのATN-161のさらなる試験を支持し、COVID-19に関連する神経炎症、脳卒中、およびウイルスの他の中枢神経系症状の治療にも有効である可能性を示唆している。
9. 結論
COVID-19のパンデミックは世界的な公衆衛生上の懸念であり、その多くの影響が人間の健康と幸福に及ぼすことを注意深くモニタリングし、認識する必要がある。現在、いくつかの臨床試験がCOVID-19の治療法を求めて進行中である。このウイルスの治療法を研究する上で、その感染方法だけでなく、中枢神経系を含む体内のさまざまなシステムへの無数の影響に注意することが重要である。SARS-CoV-2は、COVID-19の神経炎症を媒介し、サイトカインストームを誘導することができる。
中枢神経系合併症の既往を有するCOVID-19患者は、予後が悪化するだけでなく、罹患率および死亡率のリスクが増加する。
しかし、感染者におけるSARS-CoV-2の複雑な病態生理学的メカニズムや、利用可能なバイオインフォマティクスの遺伝子発現プロファイリングデータを考慮すると、SARS-CoV-2はACE2とともに、インテグリンを利用した宿主細胞侵入のための代替RGDを利用している可能性がある。インテグリンを標的とすることは、ウイルスの複製を阻害し、ウイルスの負荷を軽減し、BBB破壊と神経炎症を軽減することで、COVID-19治療のための実行可能な戦略となる可能性がある。
パンデミックは世界のコミュニティの生活に大きな影響を与えており、最近の記憶の中で最も重要な研究努力の一つから得られた進歩が、この集団的課題の負担を和らげる新たな洞察を生み出すことを期待している。