Contents
pubmed.ncbi.nlm.nih.gov/33730676/
2021年3月10日
概要
COVID-19の発症率と症例死亡率(CFR)は民族によって異なるため、これらの現象を説明できる遺伝的要因を突き止める努力が必要である。最近、英国のバイオバンクでアポリポ蛋白E(APOE)遺伝子の多重度が調査され、ε4/ε4が重症のCOVID-19と関連していることが明らかになった。我々は、APOE4による代謝異常(コレステロールや酸化リポ蛋白の上昇)が、肺細胞の感染感受性を高め、ε4/ε4遺伝子型に関連する肺の炎症を悪化させる中心的な要因になっているのではないかと考えている。また、APOEε4/ε4の人のCOVID-19の予防と管理のために考えられる食事療法や薬理学的アプローチについても述べる。
1. はじめに
コロナウイルス感染症2019(COVID-19)は,重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とする呼吸器感染症である。感染は,細胞膜貫通型セリンプロテアーゼ2(TMPRSS2)によるウイルススパイク(S)エンベロープ糖タンパク質のタンパク質分解プライミングと,肺細胞,腸管上皮細胞,マクロファージ,内皮細胞などの複数の細胞型の細胞膜に発現するアンジオテンシン変換酵素2(ACE2)受容体への結合によって媒介される[1]。
COVID-19が重症化すると、肺胞毛細血管の損傷によりガス交換機能が阻害され、急性呼吸窮迫症候群(ARDS)の発症につながる。ARDSは、両側の肺浸潤、重度の低酸素血症、異常な免疫反応を特徴とし、敗血症性ショック、多臓器不全、死亡に至る可能性がある。重篤なCOVID-19に関与する免疫学的メカニズムは完全には解明されていないが、SARS-CoV-2の感染は、従来の抗ウイルス免疫のルートを引き起こさない可能性があることが示されている。つまり、まず抗ウイルス反応が活性化され、続いて第二の防御ラインとして炎症プロセスが起こるのではなく、インターフェロンを介した抗ウイルス防御が誘導されるよりもずっと前に、炎症反応が引き起こされるのである[2]。炎症は、ウイルスのタンパク質やRNAによってNLRP3依存性のインフラマソームが活性化され、細胞内のToll様受容体のシグナルが伝達される結果、感染した肺細胞によって開始されると考えられる。これにより、肺細胞のパイロプトーシスが誘導され、サイトカインやHMGB1やATPなどの損傷関連分子パターン(DAMPs)が放出され、溶血細胞が死滅する[4]。DAMPsは、隣接する上皮細胞、内皮細胞、肺胞マクロファージによって認識され、NLRP3依存性のインフラマソームの活性化やその他のシグナル伝達経路の引き金となって、いくつかの炎症性サイトカインやケモカインの産生と分泌を引き起こす[4]。これらの分子は、好中球、単球、マクロファージ、T細胞を感染部位に引き寄せ、炎症と肺組織の損傷を増幅させる。その結果として生じる「サイトカイン・ストーム」は全身に影響を及ぼし、病気の症状を悪化させ、時には多臓器不全を引き起こすこともある。
SARS-CoV-2感染症の臨床転帰は、宿主とウイルスの両方に関連するいくつかの要因に影響される。高齢、肥満、糖尿病、高血圧、慢性閉塞性肺疾患(COPD)およびウイルス量の動態は、重症化や死亡率を高めるリスク要因となる[1]。しかし、これらの危険因子は、症状が軽度または全くない人がいる一方で、重度の反応を示す人がいる理由を完全には説明していない。さらに、COVID-19の症例致死率(CFR)は民族によって異なる(図1)。このような違いから、SARS-CoV-2感染症の臨床的転帰に影響を与える遺伝的要因を明らかにすることに大きな関心が寄せられている。ここでは、COVID-19の重症度と死亡率にアポリポ蛋白E(APOE)遺伝子の多重発現が関与していることを示す、最近発表された証拠を紹介する[5,6]。
図1. 2020年11月15日までの欧州各国におけるCOVID-19の症例致死率(CFR)(死亡が確認された数を確認された症例数で割った値として定義)
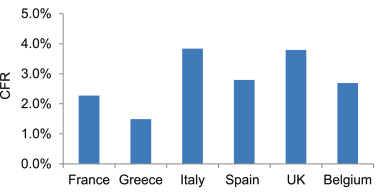
データはEuropean Centre for Disease Prevention and Control(ECDC)のウェブサイト(https://www.ecdc.europa.eu/en)から抽出した。
2. アポリポ蛋白質Eの生理機能と疾患について
APOEは、生体の脂質およびコレステロールのホメオスタシスを制御するアポリポタンパク質ファミリーの一員である[7]。APOEは、肝および非肝組織からの細胞性コレステロールの流出、コレステロールの輸送、および血漿中のリポタンパク質残骸の除去に関与している[8]。このタンパク質は,主にトリグリセリドを多く含む超低密度リポタンパク質(VLDL)粒子と結合して肝外脂質の供給を仲介し,次に高密度リポタンパク質(HDL)粒子と結合して逆コレステロール輸送(RCT)を仲介する。VLDLによる脂質の細胞への供給は、APOEが膜の低密度リポタンパク質受容体(LDLR)に結合し、その後、受容体を介したリポタンパク質のエンドサイトーシスを介して行われる。コレステロールの排出は、ATP結合カセット輸送体ABCA1を介したリポ蛋白へのコレステロールの移動を伴う。
血漿中のAPOEの大部分は肝細胞に由来するが、APOE全体の20〜40%はマクロファージ、脂肪細胞、グリア細胞、神経細胞、いくつかの上皮細胞などの非肝組織で産生される。発現パターンは、APOEの異常による潜在的な生理学的機能および/または組織特異的な病理学的症状を示す可能性があるため、興味深いものである。例えば、APOEは肺胞マクロファージ、I型およびII型肺胞上皮細胞、肺動脈平滑筋細胞など、肺のいくつかの種類の細胞で検出される[9]。マウスを用いた研究では、ApoEを欠損させると、肺胞形成不全、気道抵抗の増加、加齢に伴う肺の反発力低下の促進など、肺の発達に障害が生じることが示されている[10]。同様に、肝臓でもApoEを欠損させると、肝臓の老化が促進され[11]、マウスに高コレステロール食を与えると脂肪性肝炎を発症する[12]。APOEはまた、脂質を含んだマクロファージ(泡沫細胞)からのコレステロールの排出にも寄与し、動脈壁の病変の形成を抑制する[13,14]。脂質代謝に直接関係するこれらの重要な生物学的機能の他に、APOEは他のアポリポタンパク質と同様に、抗炎症作用や免疫調節作用を媒介する[15,16]。
マウスを用いたこれらのノックアウト研究は有益であるが、ヒトAPOEの影響の複雑さを完全には反映していない。というのも、げっ歯類とは異なり、ヒトではAPOE遺伝子には多型性があるからである。最も顕著な変異体は、染色体19q13.2に位置する遺伝子のエクソン4に存在する一塩基多型(SNP)rs429358[C/T]およびrs7412[C/T]である(図2)。ε2,ε3,ε4の3つのハプロタイプが存在し,E2,E3,E4の3つのタンパク質アイソフォームに変換され,ε2/ε2,ε2/ε3,ε2/ε4,ε3/ε3,ε3/ε4,ε4/ε4の6つの組み合わせの変異体が見られる[18,19]。その中でも、ε4/ε4は、いくつかのヒトの病態に関連する議論の余地のない疫学的・実験的証拠があるため、最も注目されている[7]。
図2 ヒトAPOE遺伝子の模式図と、APOEのエクソン4に存在するSNP rs7412およびrs429358の位置
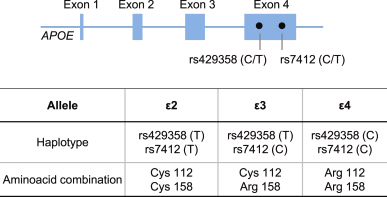
SNPの組み合わせにより,各対立遺伝子にはε2,ε3,ε4と呼ばれる3つのハプロタイプが生じ,その結果,112残基と158残基のアミノ酸の組み合わせが異なる。
実際、APOEε4変異体は、心血管疾患(心血管疾患)の遺伝的危険因子であり、E4の発現は、頸動脈内膜中膜厚の増加、総血中コレステロールおよびLDL結合コレステロールの増加と関連している[20]。実際、APOE遺伝子座の変異は、総血中およびLDL-コレステロール濃度の集団変異の約7%を占めている[21]。また、ε4/ε4遺伝子型は、散発性および家族性の遅発性アルツハイマー病(AD)に関連しており、ε3/ε3と比較して疾患リスクが最大で10倍増加すると報告されているが、ε2/ε2はリスクの減少と関連している[22]。UKバイオバンクに登録されている950の疾患アウトカムとAPOE遺伝子型の最近のフェノメワイド関連研究では、ε3/ε3遺伝子型と比較して、ε4(ε3/ε4またはε4/ε4)に関連する心血管疾患、ADおよび高コレステロール血症のリスクが高いことが確認された[23]。
APOEは、ウイルスや病原性微生物の感染に対する細胞や生体の反応にも関連している。特に、APOEε4/ε4遺伝子型は、他のAPOE変異体と比較して、HIV-1感染に対する感受性の増加およびAIDSの疾患経過の悪化と関連しており[24]、HSV-1関連の口唇ヘルペスおよびHSV-1の神経細胞への侵入性の感受性と関連している[25]。
3. APOEとCOVID-19の臨床結果との新たな関連性
最近の2つの研究では、APOEε4/ε4遺伝子型に関連する病態群にCOVID-19が加わった[5,6]。Kuoらは、UK Biobankに登録されている遺伝子および臨床データ(450,000人以上のヨーロッパ系祖先の参加者)を解析し、遺伝子型がε4/ε4の人はε3/ε3の人に比べて重症のCOVID-19のリスクが2倍高く[6]、COVID-19陽性の場合には死亡率が4倍高くなることを明らかにした[5]。これらの関連性は、既存の認知症、心血管疾患、2型糖尿病とは無関係であった。
ε4/ε4キャリアーの頻度が集団によって異なることを示唆するこれまでの証拠[26]を考慮すると、Kuoらの発見は、異なる民族におけるSARS-CoV-2感染症の転帰の違いの一部を説明できる可能性がある。COVID-19による死亡率が最も高いヨーロッパ諸国の一つである英国と比較して、ギリシャではCFRが低いことから(図1)ギリシャ人と英国人のAPOEε4/ε4遺伝子型の頻度を比較することにした。我々は、SNP rs7412とrs429358に由来するハプロタイプに基づいて、1638人のギリシャ人のAPOE遺伝子型を評価し、その結果を、別の報告にあるように、英国のバイオバンクから抽出したAPOE遺伝子型データと比較した[23]。APOE遺伝子型の分布は、2つの集団の間で有意に異なることがわかった(表1)。注目すべきは、ε4/ε4がヨーロッパ系英国人の2.42%に認められるが、ギリシャ人集団コホートの1%にしか認められず、ε4対立遺伝子の頻度はそれぞれ0.1563と0.0919であった(表2)。今回のデータは、240人の健康な中年ギリシャ人コホートにおけるPCR-RFLP法によるε4頻度0.1020と一致しており、これを大きく拡張したものである[27]。これらの観察結果は、UK Biobankの調査結果 [5,6] を他の集団で確認するためのさらなる研究を必要としている。また、APOE遺伝子型とCOVID-19の重症度を結びつける生物学的メカニズムを解明するには、さらなる研究が必要である。
表1
APOE遺伝子型は、SNP rs7412およびrs429358に由来するハプロタイプに基づき、StepOnePlusTMリアルタイムPCRエンジン(いずれもApplied Biosystems社、米国)上でTaqmanベースのアッセイを用いて、ギリシャ全土の1638人で決定された。APOE遺伝子型ごとのパーセンテージ(%)分布と個体数(カウント)を示す。欧州系英国人に関するデータは文献[23]から抜粋した。[23].
| APOE遺伝子型 | カウント | %分布 | ||
|---|---|---|---|---|
| 英国人 | ギリシャ語 | 英国人 | ギリシャ語 | |
| ε4ε4 | 8179 | 20 | 2,42% | 1,00% |
| ε3ε4 | 80499 | 242 | 23,85% | 15,00% |
| ε2ε4 | 8616 | 19 | 2,55% | 1,00% |
| ε3ε3 | 196306 | 1203 | 58,17% | 73,00% |
| ε2ε3 | 41695 | 142 | 12,36% | 9,00% |
| ε2ε2 | 2172 | 12 | 0,64% | 1,00% |
| 合計 | 337467 | 1638年 | 100% | 100% |
表2.
対立遺伝子頻度は、表1の分析結果と、文献[23]から抽出したヨーロッパ系イギリス人に関するデータを基に算出した。[23].
表2。対立遺伝子頻度は、表1に記載されている分析と、参考文献から抽出されたヨーロッパ系イギリス人に関するデータに基づいて計算されました。[ 23 ]。
| 対立遺伝子、% | |||
|---|---|---|---|
| ε2 | ε3 | ε4 | |
| ギリシャ語 | 5,65 | 85,16 | 9,19 |
| 英国人 | 8,10 | 76,28 | 15,63 |
4. COVID-19の臨床結果とAPOEとの関連を支えると思われるメカニズム
異なるAPOEアイソフォームの既知の分子的役割のいくつかを精査すると、APOEε4/ε4とCOVID-19の重症度との関連について、推定されるメカニズムの手がかりが得られる。コレステロールがその中心となるかもしれない(図3)。
図3 APOE E4/E4がCOVID-19の重症度と死亡率に影響を及ぼすと考えられる主な機序を図示したもの
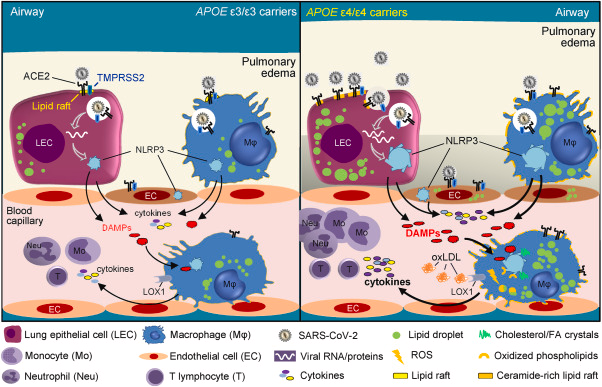
APOEε4/ε4遺伝子型は、循環および組織中のコレステロールと酸化LDL(oxLDL)の増加と関連している。肺細胞、肺マクロファージ、内皮細胞におけるこれらの細胞内蓄積は、セラミドやコレステロールに富む膜マイクロドメイン(脂質ラフト)におけるACE2/TMPRSS2の密度を高め、その結果、ε3/ε3細胞(左図)と比較して、SARS-CoV-2感染に対する感受性が高くなる(右図)。その結果、ε3/ε3細胞に比べてSARS-CoV-2の感染感受性が高まり(右図)NLRP3インフラマソームの活性化、パイロプトーシス、DAMPsの放出が促進される。また、ε4/ε4細胞のoxLDL濃度が上昇すると、肺胞やリクルートされた単球由来のマクロファージにおいて、LOX-1を介したoxLDLの内在化、活性酸素の産生、内因性DAMPsとして機能する酸化脂質やコレステロール結晶の生成により、基礎的なインフラマソームの活性化が起こると考えられる。これらのマクロファージは、SARS-CoV-2の肺感染に反応して、インフラマソームの活性化とピロプトーシスの増幅を受け、免疫細胞の動員、肺水腫、重篤な全身症状を引き起こす「サイトカインストーム」が発生する。
4.1. APOE4は、細胞内のコレステロールレベルを調節することにより、SARS-COV-2の感染性に影響を与える可能性がある
APOEアイソフォームは、細胞内および循環中のコレステロールレベルに影響を及ぼす。17の異なる民族の14,799人を対象としたメタアナリシスでは、ε4対立遺伝子の保有者はε3/ε3遺伝子型の保有者よりも血漿コレステロール値が高いことが確認されており[28]、この現象は欧米型の食事を与えたAPOE4標的置換マウスでも反映されている[29]。
高脂肪食を慢性的に投与すると、マウスの肺組織のコレステロール値が40%上昇するが[30]、これはApoEがない場合に顕著であり[31]、コレステロールの循環レベルの変化を反映している可能性が高い。実際、げっ歯類を用いた脂質追跡実験では、肺のコレステロールの約83%が血漿由来であり、残りは肺の常在細胞による合成によるものであることが示されている[32]。したがって、血漿中のコレステロールレベルの上昇に加えて、ε4対立遺伝子が肺細胞中のコレステロール過剰と関連している可能性が高い。
細胞内のコレステロール値の上昇がCOVID-19に与える影響は何であろうか。いくつかの観察研究では、COVID-19の重症度が血清HDLの低下と関連していることが示されている。これは、末梢組織における脂質のホメオスタシスを担う逆コレステロール輸送(RCT)経路の欠陥を示している[33,34]。また、COVID-19では、脂質を含むマクロファージが肺に異常に蓄積していることが指摘されている[35]。また、細胞内のコレステロールは、肺細胞[38]を含むいくつかの組織で加齢とともに蓄積され、これは高齢者におけるCOVID-19の重症度の増加と相関している。
これらの相関関係に加えて,最近のプレプリント報告では,細胞内のコレステロールの高さとSARS-CoV-2の感染力の増加とを直接結びつけている[30].細胞にコレステロールを負荷すると、エンドサイト侵入部位へのACE2のトラフィッキングが増加し、ウイルスのエンドサイト侵入ポイントが2倍になる[30]。コレステロールはまた、ACE2受容体への結合が改善されることで、より感染力の高いウイルスの産生に影響を与えている可能性がある[30]。SARS-CoV-2のスパイク(S)糖タンパク質にはPRRARという配列が含まれており、これは呼吸器に多く存在するフーリンプロテアーゼによって切断される。コレステロールは、上皮細胞からの脱出時に、S糖タンパク質のフーリン切断部位をタンパク質分解のために最適な位置に置き、その結果、ウイルスは他の細胞に効率よく感染することができる[30]。また、ε3/ε3の人と比較して、APOEε3/ε4の人の単球では、SARS-CoV-2の最初の結合、内在化、細胞間感染の部位となる、コレステロールに富む膜マイクロドメイン(脂質ラフト)が増加していることが報告されている[39]。したがって、APOE4は、細胞内のコレステロールレベルに影響を与えることで、SARS-CoV-2の感染力に影響を与える可能性がある。
4.2. APOE4は、NLRP3インフラマソームを活性化することにより、SARS-CoV-2による炎症を促進する可能性がある
ヒトでは、APOE4は、菌血症に対する自然免疫反応の亢進と関連しており[41]、これには、活性化マクロファージによる炎症性サイトカインIL-6やTNFの産生亢進[42]、内皮細胞の血栓促進作用[43]、さらには、脳におけるCCL3の発現亢進を特徴とする神経炎症が含まれる[44]。APOE4の影響を受けるサイトカインおよびケモカインの、異なる病態や組織における詳細な特徴付けはまだなされていないが、IL-6,TNFおよびCCL3は、重度のCOVID-19のサイトカインストームマーカーの一部を示している[4,39]。さらに、このようなAPOE4の影響のメカニズムは完全には解明されていないが、我々は、脂質代謝プロセスの異常が、APOE4とSARS-CoV-2に対する炎症反応の亢進とを結びつけるのではないかと考えている。
重症のCOVID-19で観察される誇張された炎症は、主にNLRP3インフラマソームが過剰に活性化され、COVID-19の臨床的標的であるIL-1βの過剰生産につながることが原因とされている。現在、コレステロールと脂肪酸は、様々な経路を介してNLRP3シグナルを制御する重要な因子として浮上している[45,46]。飽和脂肪酸のパルミチン酸とステアリン酸は、脂質を含むマクロファージにおいて細胞内結晶化を起こし、内因性DAMPsとして機能することにより、試験管内試験および生体内試験でNLRP3インフラマソームを活性化することが示されている[47]。重度の喫煙者[48]、特発性肺線維症[49]、リポイド肺炎[50]の肺で検出されるコレステロール結晶もまた、NLRP3の強力な誘導因子である[51]。したがって、APOE4は、肺へのコレステロール蓄積を促進することで [30]、SARS-CoV-2感染に反応して、上皮細胞、マクロファージ、内皮細胞のインフラマソーム活性化を亢進させる可能性があると考えられる(図3)。この概念は、マウスモデルや肥満患者 [52,53]ではNLRP3の基礎活性が高く、COVID-19重症化の危険因子となっていることと一致する。同様に、インフラマソームの活性化は、重症のCOVID-19の危険因子でもある加齢に伴う低級な炎症と平行している[54]。コレステロール結晶は、細胞内DAMPsとして機能するだけでなく、好中球を刺激して好中球細胞外トラップ(NET)を放出させる。NETは、ApoEート/マウスのコレステロール豊富なアテローム性動脈硬化プラークに見られ、マクロファージにサイトカインを放出させる働きがある[55]。注目すべきは、COVID-19の重症例では、NETosisの血清マーカーの上昇が観察されることである[56]。
コレステロールはまた、膜ラフトの形成を通じてT細胞受容体(TcR)シグナルに影響を与え、TcRシグナルの開始、TcRリガンドに対する高い感受性、T細胞の増殖を可能にする[57]。また、細胞内のステロールは、T細胞のTh17への分化を促進する[58]。この分化により、高コレステロール食を与えたアテローム性動脈硬化症のApoE-/-マウスでTh17細胞の数が増加することが説明できるかもしれない[59]。興味深いことに、APOE4アイソフォーム(ε3/4,ε4/4)を発現するヒトでは、活性化T細胞の循環数が増加しており[60]、COVID-19肺炎に罹患した患者では、著しいT細胞の活性化とTh17表現型への偏りが見られる[61]。これらの観察結果から、APOE4による代謝異常は、肺細胞、マクロファージ、内皮細胞のインフラマソーム活性化とサイトカイン産生を亢進させ、SARS-CoV-2のT細胞数と分化に対する組織的・全身的影響を増幅させるのではないかと推測される(図3)。
4.3. APOE4はLDL脂質酸化を介してSARS-CoV-2の病原作用を増強する可能性がある
LDLの酸化は、LDL脂質およびアポリポタンパク質の酵素的または非酵素的な酸化的修飾によって引き起こされる[62]。脂質の酸化は、高コレステロール血症、糖尿病、高血圧、喫煙などの病態における血管酸化ストレスの結果として発生する活性酸素種(ROS)の過剰な産生によって引き起こされる[63]。脂質酸化の最終産物は、数百種類の生理活性リン脂質、トリグリセリド、コレステロールを含む酸化LDL (oxLDL) の形成です [62]。
酸化LDLは、マクロファージに発現しているスカベンジャー受容体に認識されて取り込まれ、動脈硬化病巣に見られる泡沫細胞の形成につながるため、動脈硬化発症の主要な病原因子となる [63]。OxLDLはまた、レクチン様酸化低密度リポタンパク質受容体-1 (LOX-1)や、単球/マクロファージや内皮細胞に発現するCD36/TLR4/TLR6のヘテロ三量体と結合することで、炎症性の特性を発揮する。LOX-1にoxLDLが結合すると、LOX-1が細胞内に取り込まれ、細胞内に脂質が蓄積され、いくつかの炎症性および酸化性経路が活性化される[62]。例えば、酸化LDLは、フリーラジカルによるアラキドン酸の過酸化によって生成されるイソプロスタンなどの活性酸素や炎症性脂質の産生を促進することが示されている[64]。酸化リン脂質(oxPL)はoxLDLの主要成分であり、NLRP3を活性化するDAMPsとしての役割を果たし、IL-1β/IL-18の分泌を引き起こす[65]。LDLの酸化と肺疾患との関連性は、ヒトのoxLDLをマウスに鼻腔内投与すると、タバコの煙で誘発される肺炎の特徴を反映した炎症反応が始まるという観察結果からも明らかである[60]。
いくつかの証拠から、oxLDLとCOVID-19の関連性が示唆されている。第一に、動脈硬化だけでなく、肥満、メタボリックシンドローム、COPDにおいても、循環血液中のoxLDL濃度の上昇が検出されており[[66], [67], [68], [69]]、これらはすべて、重度のCOVID-19の危険因子となっている[1]。第二に、oxLDLによって引き起こされる炎症経路は、SARS-CoV-2によって活性化される経路と共通しており、DAMP-orchestrated inflammationが関与している。第3に、oxLDLは、ACE2とTMPRSS2の発現レベルを増加させ[70]、コレステロールとセラミドが濃縮された脂質ラフトの密度を増加させ[71]、ウイルスの感染性を高めることに貢献する[40,72]。最後に,SARS-CoVに感染した患者の傷ついた空隙にある肺細胞やマクロファージに重なる炎症性滲出液にoxPLが検出されている[73]。これらの観察結果から、我々は、oxLDLがSARS-CoV-2の病原性に対する宿主細胞の感受性を高めているのではないかと推測している。
APOEは肺の酸化ストレスに対する保護作用がある。マウスでApoEを切除すると、急性肺損傷が悪化し、oxLDLとIL-6レベルが上昇してARDSのような状態になる[74]。APOE4は、他のAPOEアイソフォームと比較して、最も有効な抗酸化特性を持たず[75]、試験管内試験でのLDL酸化を抑制する効果も低い[76,77]。APOE4はまた、酸化ストレスのマーカーとも正の相関がある。APOEε4/ε3の人は過酸化脂質レベルが高く[78]、ε4対立遺伝子を持つ喫煙者は、他のAPOE遺伝子型と比較して、血清中のoxLDLレベルが26.7%増加している[79]。これらの知見を総合すると、APOE4は、特に慢性または急性の炎症条件下でoxLDLレベルの上昇と関連しており、肺におけるSARS-CoV-2感染の感受性を増幅させる可能性が示唆される。
5. APOEε4/ε4のCOVID-19の予防・管理のための薬理学的・食事学的アプローチの可能性
ここでは、APOEε4/ε4遺伝子型がCOVID-19の重症度および死亡率に及ぼす有害な影響について、コレステロールおよび酸化リポ蛋白の上昇が重要な媒介因子となっている可能性を考えてみた。したがって、APOEε4/ε4遺伝子型を持つ人のコレステロール負荷を軽減する薬理学的および食餌学的戦略によって、COVID-19感染の結果を軽減することができるかもしれない。
スタチン系薬剤は、コレステロール生合成経路の律速段階を司る酵素であるHMG CoA還元酵素を標的としたコレステロール低下剤である。スタチンの投与は、LDL-コレステロールの減少に加えて、循環しているoxLDLも減少させる[80,81]。スタチンは、中用量のスタチン使用者におけるインフルエンザ死亡リスクの有意な低下[82]、HIV陽性患者における抗レトロウイルス療法の成績向上[83]、エボラウイルス病患者の死亡率低下[84]など、いくつかのウイルス誘発性病態に対して有益な効果を示している。全身の免疫調節作用を含むスタチンの多面的な機能にもかかわらず、感染性エボラウイルスの産生を減少させるロバスタチンの直接的な試験管内試験効果が報告されている[85]。
COVID-19の管理におけるスタチンの臨床的有用性については議論されてきた[86]。しかし、最近発表されたCOVID-19患者8990人を対象とした4つの臨床研究のメタアナリシスでは、スタチンは重症または致死的なCOVID-19症例の危険性を減少させると結論づけている[87]。スタチンによる治療は、特に肥満の患者において2型糖尿病のリスクを増加させるのではないかという懸念がある[88]。注目すべきは、APOEε4リスクアリルを持たないスタチン使用者はインスリン抵抗性が高いが、APOEε4キャリアはインスリン機能が改善されていることである[89]。したがって、スタチンの有益な効果が、他のAPOE遺伝子型と比較してε4/ε4 COVID-19患者でより顕著であるかどうかを調べることは興味深いことである。APOE模倣ペプチドやoxLDLに含まれるoxPLを中和する抗体などの生物学的薬剤は、アテローム性動脈硬化症の観点から評価されており[90]、ε4/ε4 COVID-19患者の管理に新たな機会を提供するかもしれない。
APOE4アイソフォームは、一般的に食事による介入には影響を受けないと考えられている。例えば、植物ステロールは、APOEε3/ε3遺伝子型を持つ高コレステロール血症患者の血中コレステロール値を低下させるが、ε4キャリアは低下させない[91]。しかし、APOE4アイソフォーム保有者に対する特定の食事計画は、実行可能かつ効果的である[92]。したがって、飽和脂肪を一価不飽和脂肪に置き換えたり、低血糖指数の炭水化物に置き換える24週間の食事療法は、他のAPOEアイソフォームに比べて、APOE4キャリアに血漿コレステロールの低下をもたらすことがわかっている[93]。APOE4保有者を対象とした同様の低トリアシルグリセロール血症効果は、毎日2個のキウイフルーツを摂取した4週間の健康的な食生活で報告されており、おそらく脂質低下作用のある抗酸化ビタミンとポリフェノールの摂取量を増やすことによるものと思われる[94]。
魚由来のオメガ3多価不飽和脂肪酸やリゾホスファチジルコリンの形をしたドコサヘキサエン酸を慢性的に摂取すると、APOEε4保有者の血中トリグリセリド濃度が低下し[92]、レゾルビンやプロテリンなどの分解促進性脂質メディエーターの産生を通じて、炎症の解消が促進される可能性があることも報告されている[95]。肺の炎症を調節するためのこの食事法の潜在的な利点は、オメガ3脂肪酸を減らした食事を与えたAPOE欠損マウスの肺における炎症誘発性のエイコサノイドの蓄積が、オメガ3脂肪酸の補充によって回復するという実験データによって示されている[96]。興味深いことに、酸素吸入や人工呼吸を必要とする重症COVID-19患者の治療に現在標準的な治療法となっているデキサメタゾンは、プロテリンD1などのSPMを誘導することも示されている[98,99]。APOEε4キャリアはまた、ビタミンEの需要が若干増加している可能性があり[91,100]、ビタミンEは、ウイルス性気道感染症に有益な抗酸化作用と免疫調整作用を付与する[101]。
6. 考察
APOEは、いくつかの病態に関与している多面的なタンパク質であり、アイソフォーム依存的な作用を示す。E4アイソフォームのホモ接合保因者は,心血管疾患,高コレステロール血症,脳卒中,アルツハイマー病,ウイルス誘発性病態に特に罹患しやすい。COVID-19は、APOEε4関連疾患のネットワークに最近加わり、APOEε4/ε4遺伝子型とCOVID-19の重症度および死亡率との間に有意な関連が認められている[5,6]。最近の実験的証拠は、SARS-CoV-2感染に対するε4/ε4ニューロンおよびアストロサイトの感受性の高さを裏付けている[102]。
ε4対立遺伝子の頻度、つまりAPOE ε4/ε4遺伝子型の分布は、民族によって異なる可能性がある[103]。ここで紹介するデータは、ギリシャのコホートにおけるε4/ε4遺伝子型の頻度が、欧州系英国バイオバンクの英国コホートよりも有意に低いことを示しており、このことは、英国に比べてギリシャのCOVID-19 CFRが低いことと類似している。SARS-CoV-2に対する反応は、宿主、ウイルス、環境など多くの要因に影響される複雑なものであるが、この観察結果は、最近発表されたGWAS [104]のように、民族の遺伝的構成とSARS-CoV-2感染症の発生率、重症度、死亡率との間の推定される関連性を調査すべきであることを示唆している。
また、APOE遺伝子型とCOVID-19の重症度を結びつける生物学的メカニズムを解明するためには、さらなる調査が必要である。細胞内および全身のコレステロール値の上昇は、APOE E4/E4の代謝機能の典型であり[28]、この関連性の中心となっている可能性がある(図3)。我々は、ε4ホモ接合体によって肺細胞内にコレステロールとoxLDLが蓄積されると、SARS-CoV-2感染に対する感受性と重症度が高くなるのではないかと考えている。これは、脂質ラフトの量的・質的変化と、肺気道を覆う細胞の高い酸化状態が原因であると考えられる。このような条件下では、細胞膜におけるACE2とTMPRSS2の発現が増加し、ウイルスの結合、内在化、細胞間の伝達が増加する(図3)。SARS-CoV-2以外にも、脂質ラフトはいくつかのウイルスの侵入口として重要な役割を果たしており[105]、その中にはHIV-1も含まれている。
他のアイソフォームと比較して、APOE4は基礎的なNLRP3インフラマソームの活性化を促進し、肺の炎症反応を増大させ、重症のCOVID-19の「サイトカイン・ストーム」に関係していると考えられる(図3)。COVID-19に対するAPOE4の有害な臨床効果[5,6]は、以前心血管疾患リスクについて記録されたように、喫煙、肥満、喘息、COPDなどの追加因子の共存に依存するか、それによって増幅される可能性がある[79,106]。
脂質代謝がAPOE4とCOVID-19の関連の核心であるとする前述のモデルを支持し、スタチンはCOVID-19患者に臨床的利益をもたらす。我々は、重症のCOVID-19のリスクが高いAPOEε4/ε4の患者は、予防的な食生活の改善および/または中等量のスタチンの治療的使用から特に恩恵を受けると考える。しかし、APOE4が脂質代謝に大きな影響を与えることは、肺における他のAPOE4機能がSARS-CoV-2感染の臨床結果に影響を与える可能性を排除するものではない。この点に関して、APOEε4対立遺伝子は、脂質レベルとは無関係に高齢者の肺呼吸能力の低下と関連しており[107]、マウスでのApoE切除は、COVID-19患者の死亡リスクを高める重症肺高血圧症の発症と関連している[108]。
1973年にHavelとKaneによって発見されて以来[109]、APOEはいくつかの疾患との新たな関連性で我々を驚かせ続けており、今後の研究の肥沃な土壌となっている。
