Contents
The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with non-severe COVID-19: A pilot, double-blind, placebo-controlled, randomized clinical trial
www.thelancet.com/journals/eclinm/article/PIIS2589-5370(20)30464-8/fulltext
カルロス・チャクール
アイナ・カゼラス
アンドレス・ブランコ-ディ・マッテオ
イニゴ・ピネダ
アレハンドロ・フェルナンデス=モンテロ
ポーラ・ルイズ=カスティーヨ
他
要旨
背景
イベルメクチンは、現在承認されている用量では容易に達成できない濃度で、試験管内試験でSARS-CoV-2の複製を阻害する。COVID-19 患者におけるイベルメクチンの臨床使用を支持する証拠は限られている.我々は,イベルメクチンの単回投与による SARS-CoV-2 の感染抑制効果を評価するために,無作為化二重盲検プラセボ対照試験を試験的に実施した。
試験方法
2020年7月31日から 2020年9月11日までの間にClínica Universidad de Navarraの救急室に通院した非重症COVID-19で合併症の危険因子のない患者を連続して登録した。すべての登録は、発熱または咳の発症から72時間以内に行われた。患者は、イベルメクチン400mcg/kg、単回投与(n=12)またはプラセボ(n=12)に1対1で無作為に割り付けられた。主要評価項目は、治療後7日目に鼻咽頭スワブからPCR法でSARS-CoV-2 RNAが検出された患者の割合であった。主要転帰は,各サンプルのウイルス負荷および感染性の判定によって裏付けられた。イベルメクチンとプラセボの差は、フィッシャーの厳密検定を用いて計算し、相対リスク比として示した。この研究は ClinicalTrials.gov に登録されている。NCT04390022。
調査結果
募集した全患者が試験を終了した(年齢中央値、26歳[イベルメクチン群ではIQR 19~36,対照群では21~44歳]、女性12人[50%]、募集時に症状があったのは100%、70%が頭痛、62%が発熱、50%が全身倦怠感、25%が咳を報告した)。7日目の時点では、PCR陽性患者の割合に差はなかった(RR 0.92,95%CI:0.77-1-09,p=1.0)。イベルメクチン群では、治療後4日目(遺伝子Eはp=0.24,遺伝子Nはp=0.18)および7日目(遺伝子Eはp=0.16,遺伝子Nはp=0.18)のウイルス負荷が統計学的に有意でないが低く、治療後21日目のIgG値も低かった(p=0.24)。イベルメクチン群の患者では、低吸汗症/低吸汗症からの回復が早かった(76対158患者日目;p<0.001)。
解釈
COVID-19が非重症で重症化の危険因子を持たない患者に、発熱や咳の発症から72時間以内に400mcg/kgのイベルメクチンを単回投与したところ、PCR陽性の割合に差は見られなかった。しかし、自己申告による無汗症・多汗症の顕著な減少、咳嗽の減少、ウイルス負荷の低下とIgG値の低下傾向が認められ、より大規模な試験での評価が必要であると考えられた。
資金提供
ISGlobal、バルセロナグローバルヘルス研究所、Clínica Universidad de Navarra。
文脈の中での研究
この研究の前の証拠
イベルメクチンは、抗ウイルス特性が知られている幅広いスペクトルの抗寄生虫薬である。2020年4月3日、Calyらは、イベルメクチンがマイクロモル濃度でSARS-CoV-2の複製を阻害できることを示す試験管内試験実験のエビデンスを発表した。これにより、科学界は、臨床試験に失敗する可能性の高い薬剤への投資と労力を避けることを求めるグループと、COVID-19の潜在的な適応症である安全性と有効性が証明されていなくても、迅速なスケールアップを求めるグループの2つの反対意見に引き裂かれた。2020年4月以降、COVID-19に対するイベルメクチンの潜在的な有効性を示唆する観察試験、症例シリーズ、生態学的分析が豊富に行われてきた。しかし、厳密に実施された無作為化比較臨床試験の報告は非常に少ない。バングラデシュとアルゼンチンで実施された研究からの新たなエビデンスは、潜在的な臨床使用の可能性を示唆している。
本研究の付加価値
このパイロット試験は、無作為化プラセボ対照二重盲検試験であり、イベルメクチン投与7日後のPCR陽性患者の割合の減少を示すことはできなかった;しかしながら、自己報告された嫌悪感/不快感の減少、(統計学的に有意ではない)ウイルス負荷とIgG値の低下傾向が示されており、これはおそらく軽度の疾患を反映している。
利用可能なすべてのエビデンスの意味
動物モデルや他の臨床試験からの新たなエビデンスとともに、このパイロット試験で発見されたポジティブなシグナルは、COVID-19の早期治療のためにイベルメクチンを使用した大規模な試験の実施を保証するものである。
1. 序論
2020年12月21日現在、世界では7,000万人以上の症例数と100万~600万人のCOVID-19死亡者数が確認されている[1]。閾値を正確に予測することは困難であるが[2]、SARS-CoV-2の感染拡大は、ワクチン接種または自然感染からの回復のいずれかによって、人口の少なくとも50%が免疫を獲得するまでに止まる可能性は低い[3]。現在、緊急の規制当局による承認に向けて進んでいる有望なワクチン候補があるが[4]、パンデミックの軌道上では、人口に影響を与えるために必要なレベルまで世界的なアクセスが遅れると予測されている。治療法の選択肢を開発するための努力は続いているが、薬剤を用いた感染阻止戦略や感染低減戦略の評価には、あまり注目されていない。これらの戦略は、感染者による感染を抑制する目的で薬剤を投与することで構成され、医療システムへの負担を軽減し、ワクチンが完全に試験され、スケールアップされるまでの時間を稼ぐことができる。
イベルメクチンは広く使用されている抗寄生虫薬であり、いくつかの単一系統のRNAウイルスに対して部分的な有効性が知られている[5, 6, 7]。Caly らは、マイクロモル濃度のイベルメクチンを用いて SARS-CoV-2 複製を 試験管内試験 で阻害したことを報告している [8]。これらの知見は、初期の観察的証拠および生態学的証拠とともに、いくつかのラテンアメリカ諸国がCOVID-19治療の国策の一部としてイベルメクチンを含めることを促した[9]。
2020年12月21日現在、clinicaltrials.govに登録されているCOVID-19の治療または予防に対するイベルメクチンの有効性を評価する研究は45件、WHOのInternational Clinical Trials Registry Platform(https://apps.who.int/trialsearch/)に登録されている研究は74件あり、そのうち少なくとも14件はすでに完了している。いくつかの観察研究や症例対照研究、また新たに開発された小規模無作為化臨床試験は、潜在的な有用性を示唆しているが [10, 11, 12, 13]。しかし、政策決定に適切な情報を提供するための堅牢なランダム化比較試験はまだ十分ではない。
本試験は、欧州で承認されているイベルメクチンの最大投与量が、発症後早期に投与された場合に SARS-CoV-2 の感染に影響を与えるかどうかを評価するためのパイロット試験として計画された。
2. 方法
これは、重症ではない COVID-19 で危険因子のない患者を対象に、イベルメクチンの単回投与量とプラセボを比較したパイロット二重盲検、プラセボ対照、単施設、並行群、優越性、無作為化臨床試験であった。臨床試験のプロトコルは公表されており[14]、プロトコルの最終版と統計解析計画書は補足ファイルとして入手可能である。プロトコルは、スペイン国家医薬品研究倫理委員会(Hospital Puerta de Hierro Majadahonda)およびスペイン医薬品・医療機器庁によって承認された。すべての手順は、ヘルシンキ宣言の最新改訂版および臨床試験実施基準に準拠して実施された。すべての患者は、登録時に口頭でのインフォームドコンセントを行い、EMAの勧告に従って隔離が解除された後に書面での同意を得ました。”COVID-19(コロナウイルス)パンデミック時の臨床試験管理に関するガイダンス 第 2 版(27/03/2020)」[15]。この研究はClinicalTrials.govに登録されている。NCT04390022。この研究はISGlobalおよびClínica Universidad de Navarraによって資金提供された。これらの資金提供者は、本試験の設計、分析、および結果の公表の決定には何ら関与していない。
2.1 患者
Clínica Universidad de Navarra(スペイン、パンプローナ)の救急外来に連続して通院し、COVID-19に適合する症状を有し、72時間以上の発熱または咳嗽がなく、SARS-CoV-2のPCRが陽性であった患者が登録された。ベースライン時にSARS-CoV-2に対するIgG陽性、重症化の危険因子と考えられる併存疾患、またはCOVID-19肺炎を有する患者は除外された(詳細な適格基準はプロトコルに記載されている-補足ファイル-)。
2.2 試験デザインと管理
試験はパンプローナ都市圏(スペイン・ナバラ州)で実施された。患者は2020年7月31日から 2020年9月11日の間に登録され、イベルメクチン(400mcg/kg)単回経口投与またはプラセボに1:1の割合で無作為に割り付けられた。無作為化シーケンスは、バランスを確保するために4つのブロックを使用して試験統計学者がコンピュータで作成した。割り付けは、不透明な封筒を用いて治験責任医師が行った。プラセボ錠はイベルメクチンと外観が一致しなかったため、臨床試験チームの盲検化を維持するために、参加していない看護師が薬局から不透明な瓶を直接受け取り、閉鎖されたドアの向こう側で内容物を投与するという直接の監督の下で治療が行われた。治験チームは治験薬との接触はなかった。2020年3~4月の閉鎖後10週間は局所伝播が激減したため、募集に遅れが生じたが、9月2日にプロトコルが修正されており、対象基準が48時間から最大72時間の咳または発熱に延長された。
主な目的は、低リスクで重症ではないCOVID-19患者にイベルメクチンを単回投与し、発熱または咳の発症後最初の72時間に投与することで、その後の感染を減少させる有効性を判断することであった。
2.3 臨床、実験室およびウイルス学的モニタリング
登録時および治療後4日目、7日目、14日目、21日目、28日目の評価には、一般的な症状の報告、身体検査(呼吸数、血中酸素飽和度、胸部聴診を含む)有害事象が含まれている。すべての患者さんには、治療後1日目から 28日目までの症状を毎日オンラインで日記に記入していただいた。登録時、および7日目と14日目に採血を行い、全血球数、C反応性蛋白、プロカルシトニン、フェリチン、クレアチニンホスホキナーゼ、乳酸脱水素酵素、トロポニンT、Dダイマー、IL-6,および腎機能を評価した。
SARS-CoV-2 PCR用の鼻咽頭スワブを登録時および治療後4日目、7日目、14日目、21日目に採取した。一貫性を持たせるために、これらのサンプルは 3 人の臨床医が同じ技術を用いて採取した。すべてのサンプルは、SARS-CoV-2の遺伝子NおよびEのPCRによって処理された(Real Time PCR SARS-CoV-2,Vircell SLU、Granada、スペイン)。すべてのサンプルについて、標準参照曲線(EDX SARS-CoV-2, Exact Diagnostics LLC, Fort Worth Texas)を用いてウイルス負荷を計算した。さらに、処理後4日目からのすべてのサンプルを、ベロ細胞で7日間培養し、その後、細胞毒性効果を評価し、収穫された無細胞上清にPCRを行った。4日目に上清からのPCRが陽性であれば、7日目の患者のサンプルについても同様の手順を繰り返した。SARS-CoV-2に対するIgG(COVID-19 VIRCLIA IgG monotest、Vircell SLU、Granada、スペイン)の半定量的な血清検査を、治療後21日目に全患者の検体について行った。
2.4 アウトカム測定
主要評価項目は、治療後7日目に鼻咽頭スワブからPCRでSARS-CoV-2 RNAが検出された患者さんの割合でした。
関連する副次的転帰として、治療後4日目、7日目、14日目、21日目のウイルス負荷、治療後4日目、7日目、14日目、21日目に症状(特に発熱と咳)を認めた患者の割合、試験期間中に重症化または死亡した患者の割合、治療後21日目に血清転換を認めた患者の割合、および薬剤関連の有害事象の割合が指定された。
2.5 サンプルサイズの正当化
COVID-19では、ウイルス負荷は症状の発症直前または発症時にピークを迎え [16,17]、二次症例のほとんどは症状後5日目より前に発生する [18]。この試験は、感染を減少させるためのイベルメクチンの使用を評価するために設計された。後発感染を減らす目的で、公衆衛生に影響を与えるためには、治療後 7 日目の PCR 陽性者の割合における確実な効果の大きさが必要である。陽性者の割合が少なくとも50%減少することが、潜在的な価値があると考えられた。
サンプルサイズは2つの割合の比較に基づいており、治療後7日目にPCR陽性の参加者の割合が50%減少(100対50%)したことを検出する力が5%の有意水準で80%であると計算された。7日目のPCR陽性率100%の数値は 2020年3月~5月の第1波の間にClínica Universidad de Navarraで行われたCOVID-19外来患者の経験に基づいている。感染性の結果は、細胞培養物におけるウイルス負荷と感染性の変化を評価することで裏付けられた。
2.6 統計解析
記述的分析では、質的変数には頻度とパーセンテージ(非欠損サンプルサイズに基づく)を、量的変数には中央値、四分位間距離、および n(非欠損サンプルサイズ)を用いた。
主要目的については、治療後7日目にPCRが陽性であった参加者の割合を算出した。比率は、フィッシャーの厳密検定を用いて試験群間で比較され、対応する95%信頼区間(CI)と相対リスク比(RR)として示された。患者から報告された症状(症状日記)の解析では、欠落データは最後に入手可能なデータから繰り越された。有意性は0.05とした。解析はStata(StataCorp.2019. Stata Statistical Software. リリース16。College Station, TX. StataCorp LLC)を用いた。)
量的変数および質的変数の記述のために、それぞれBoxplotsおよび棒グラフを作成した。図を読みやすくするために、ウイルス負荷値は対数変換した。グラフはRバージョン4.0.2(R Core Team, R: A Language and Environment for Statistical Computing, Vienna, Austria. R Foundation for Statistical Computing, 2020)を使用し、ggplot2パッケージ(H. Wickham, ggplot2. Elegant Graphics for Data Analysis, Springer-Verlag New York, 2016.)
ウイルス負荷データは、任意の症状の発症からの日数を考慮して分析前に同期化し、感染日が不明であったため、平均潜伏時間を5日間と仮定した[19]。ピークウイルス負荷(Cmax)およびピークウイルス負荷までの時間(Tmax)はプロファイルから直接決定した。ウイルス負荷曲線下面積は、仮定した感染時間から最後のサンプルまでの時間(AUCobs)から台形則を用いて計算した。最後に記録されたCt値が閾値を下回っていない場合には,プロファイルから直接,または線形外挿したプロファイルから,サイクル閾値(Ct)35を超えた期間を求めた。
2.7 ポストホック分析
ウィルコクソン順位和検定を用いて、すべてのサンプリング時間におけるウイルス負荷の中央値および試験群間の IgG 値の中央値を比較した。
症状の存在に対する試験群の効果は、被験者をランダム切片とする混合効果ロジスティック回帰モデルを用いて推定した。これらのモデルは、フォローアップの日(症状は時間の経過とともに消失すると予想されるため)および登録前の症状の持続期間(疾患発症の代理として)によって調整されている。症状の進行に対する試験群の潜在的な効果を評価するために、試験群とフォローアップの日との間の交互作用もモデルに含まれている。治療法間の差が観察されたアウトカムとして、任意の症状、無呼吸または低呼吸、咳嗽の3つのモデルを調査した。さらに、イベルメクチンの無汗症/多汗症に対する観察された効果を性別のサブ解析で評価した。
イベルメクチン群の参加者の脂肪体重は、Gomez-Ambrosiら[20]に記載されている方法で計算した。この情報は、受け取った脂肪体重あたりのイベルメクチン投与量を推定するために使用され、報告された無汗症/多汗症の最終日に対してプロットされた。
3. 結果
3.1 患者の特徴
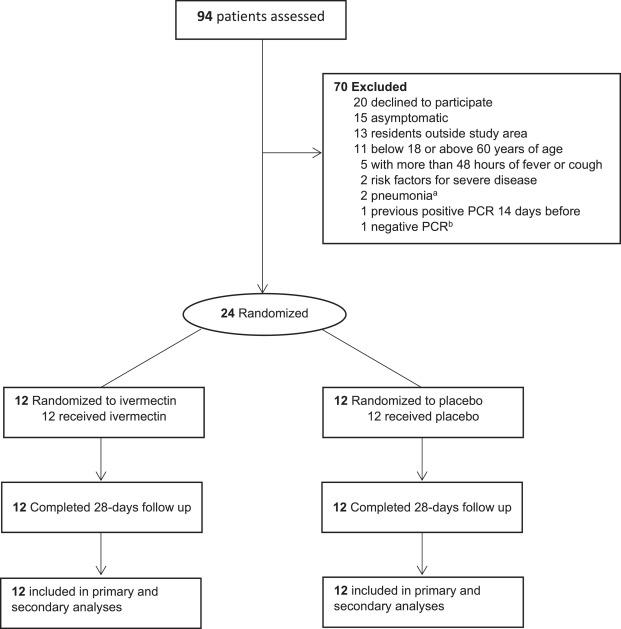
評価された94人の患者のうち、50人が適格基準を満たさず、20人が参加を辞退し、24人が無作為化された。無作為化された患者はすべて、対応する試験製品を投与され、28日間の追跡調査を完了した(図1)。両群の患者のベースライン特性を表1に示す。
図1登録と患者の流れ

a 1名はERで肺炎を呈し、1名はスクリーニング時に適合性のあるX線検査を受けた。
表1群別の患者のベースライン特性
| イベルメクチン(n = 12) | プラセボ(n = 12) | |
|---|---|---|
| 年齢、中央値(IQR)[範囲]() | 26(19–36)[18–54] | 26(21–44)[18–54] |
| 性別、番号(%) | ||
| 女性 | 5(42%) | 7(58%) |
| 男性 | 7(58%) | 5(42%) |
| ボディマス指数、中央値(IQR)[範囲] kg / m2 | 23・5(19・6–27・8)[18・6–29・9] | 22・9(21・0–24・8)[19・3–29・9] |
| 症状 | ||
| ない。(%) | 12(100%) | 12(100%) |
| 発熱、いいえ。(%) | 7(58%) | 9(75%) |
| 咳、いいえ。(%) | 4(33%) | 2(17%) |
| 頭痛、いいえ。(%) | 7(58%) | 10(83%) |
| 筋肉痛/全身倦怠感、番号(%) | 8(67%) | 6(50%) |
| 症状の最も早い開始
、中央値、(IQR)[範囲] |
24(24–48)[18–120] | 48(36–48)[24–72] |
| 発熱の最も早い開始
*、いいえ、中央値。(IQR)[範囲] |
24(12–24)[12–24]、n = 7 | 24(24–48)[4–48]、n = 9 |
| 咳の最も早い開始
、いいえ、中央値。(IQR)[範囲] |
24(16–36)[8–48]、n = 4 | 10(8–12)[8–12]、n = 2 |
| バイタルサイン | ||
| 収縮期血圧、中央値。(IQR)mmHg | 114(113–117) | 129(116–134) |
| 拡張期血圧、中央値。(IQR)mmHg | 76(72–80) | 79(77–85) |
| 心拍数、中央値(IQR)bpm | 83(77–99) | 90(81–100) |
| 呼吸数、中央値(IQR)bpm | 14(12–17) | 14(12–15) |
| 温度、中央値(IQR)°C | 36・8(36・4–37・0) | 36・9(36・5–37・0) |
| 酸素飽和度、中央値(IQR)% | 97(96–98) | 98(97–100) |
| ウイルス量 | ||
| 遺伝子E、番号(IQR)コピー/ ml | 1・7・107 (5・9・106-3・9・108) | 2・7・107 (8・3・105-4・2・108) |
| 遺伝子N、番号(IQR)コピー/ ml | 3・7・108 (1・8・107-9・3・109) | 3・3・108 (5・8・107-6・7・109) |
| 炎症マーカー | ||
| CRP、中央値(IQR)mg / dL [正常値] | 0・3(0・2–0・8)[<0・5] | 0・3(0・2–0・6)[<0・5] |
| フェリチン、中央値(IQR)mg / dL [正常値] | 165・0(95・8-241・3)[30–400] | 156・1(103・1–223・0)[30–400] |
| IL-6,中央値(IQR)pg / mL [正常値] | 6・5(5・1-9・6)[<7] | 4・5(3・0–6・5)[<7] |
| D-ダイマー、中央値(IQR)ng / mL [正常値] | 295(270–420)[150–500] | 280(270–315)[150–500] |
| 完全な血球数 | ||
| 赤血球、中央値(IQR)1012/ L | 5・05(4・62–5・55) | 5・07(4・67–5・45) |
| ヘモグロビン、中央値(IQR)g / dL | 15・3(13・8–16・0) | 15・2(13・7–15・8) |
| 血小板、中央値(IQR)109/ L | 194(167–216) | 205(179–247) |
| 白血球、中央値(IQR)109/ L | 4・7(4・3–6・3) | 4・4(3・7–5・9) |
| 好中球、中央値(IQR)% | 52・4(45・6–65・1) | 53・4(43・9–62・2) |
| リンパ球、中央値(IQR)% | 29・5(18・5-7・9) | 28・7(20・8–39・9) |
投薬の1時間前
bベースライン時のプラセボ群の収縮期血圧中央値がわずかに高かったため、その後の研究訪問では見られず、非臨床的に有意であると判断された。研究全体のすべてのバイタルサインの進展については表S3 *報告または測定された発熱。IQR:四分位範囲
プラセボ群では女性の割合が高かった(58対42%)。両群の参加者の人口統計とベースラインの疾患特性を表1に示した。全体では、66%の患者が自覚的または客観的な発熱、25%の咳、70%の頭痛、58%の患者が筋肉痛または全身倦怠感を呈したが、両群間に顕著な差はなかった。治療前の症状の開始時刻の中央値は、イベルメクチン群では24時間(中間値幅、24~48時間)プラセボ群では48時間(中間値幅、36~48時間)であった。ベースラインでは、バイタルサイン、炎症マーカー、全血球数に群間の差は認められなかった(表1)。
3.2 主要評価項目
治療後7日目のPCR陽性者の割合に差はなく、両群とも遺伝子Nについては12/12(100%)の患者がPCR陽性であった。遺伝子Eについては、イベルメクチン投与群で11/12例(91%)プラセボ投与群で12/12例(100%)がPCR陽性であった(RR 0-92,95% CI: 0-77-1 0-09,p = 1-0)。
3.3 ウイルス負荷
遺伝子EとNはすべての時点で同等の結果を示した。両試験群の患者では、治療前のウイルス負荷は、遺伝子EとNの中央値と四分位の範囲が同じオーダであり、同様の結果であった(図2および表S1)。いずれの時点においても,分岐点間範囲と完全範囲に一貫した重なりが見られたが,両遺伝子のウイルス負荷中央値はイベルメクチン群の方が治療後4日目と7日目に低く,その差は4日目の3倍(遺伝子Eはp=0-24,遺伝子Nはp=0-18)から7日目には約18倍(遺伝子Eはp=0-16,遺伝子Nはp=0-18)にまで拡大した(図2,表S1)。14日目と21日目のウイルス負荷についても同様の傾向がみられ、イベルメクチン群の患者の値は少なくとも1つの遺伝子について一貫して低くなっていたが、その差はどの時点でも統計的に有意ではなかった(図2,表S1)。周期閾値の値は、非常に類似した挙動を示した(図S1)。ウイルスのキネティクスに関するサマリー統計を表S2に示す。
図2試験腕別のウイルス負荷の進化
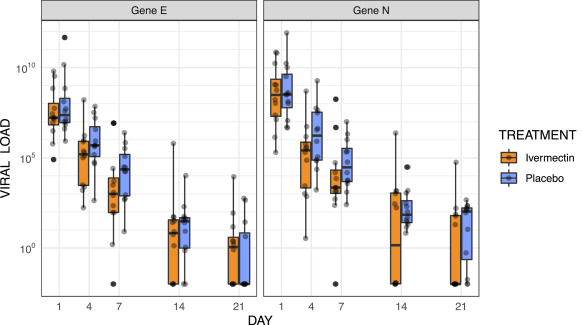
ウイルス負荷値は対数変換した。ボックスは、四分位の範囲を示す。ドットは個々の値を示す。
3.4 ウイルス培養
処置後 4 日目には、イベルメクチン群では 7/12 サンプル、プラセボ群では 5/12 サンプルが Vero 細胞培養を効果的に複製していた。投与 7 日目までにイベルメクチン群では 1/6(以前に陽性であったサンプルが 1 つ消失),プラセボ群では 1/5 のみが細胞培養中に複製した。
3.5 症状
毎日のオンライン質問紙への回答は、イベルメクチン群で282日分(84%)プラセボ群で295日分(88%)と良好であった(図S2)。
イベルメクチン群では、プラセボ群に比べて、何らかの症状の患者日数が少なかった(171日対255日)。この差は、主に無呼吸・多呼吸と咳嗽の2つの症状に起因していると考えられた。イベルメクチン群の患者は、プラセボ群と比較して50%の無呼吸/多呼吸を報告していた(無呼吸/多呼吸の患者日数は76日 vs 158日)。また、イベルメクチン群では咳嗽が30%減少した(咳嗽の患者日数は68対97日)(図3)。
図3 自己申告した症状、自己申告した咳、自己申告した無気力感/多汗症の1日の割合
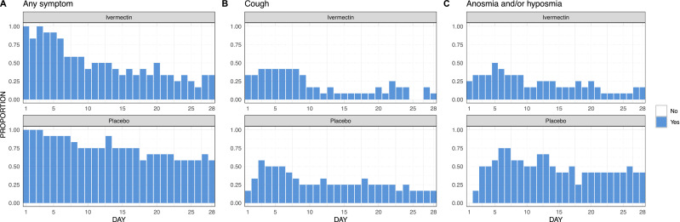
各グラフは、28日間の追跡調査において、対応する試験群で各症状を呈した人の1日の割合(n/N)を表している。欠落している回答は、直前の日の値に置き換えられている。
イベルメクチン群とプラセボ群では、発熱(12対12)全身倦怠感(51対61)頭痛(34対38)鼻づまり(91対97)の報告患者日数に大きな差はなかった。一方、イベルメクチン群では、消化器症状の患者日数が3.5倍(21対6)息切れが5倍(3対15)減少した(図S3)。
いずれの群でも重症化した患者はいなかった。
3.6 血清検査
両群とも治療後 21 日目までにすべての患者が血清転換した。イベルメクチン投与群ではプラセボ投与群に比べてIgG値の中央値が低かった(指標4-7,間値範囲[3-5-8-9])(指標7-5,間値範囲[4-2-9-3])(Wilcoxon rank-sum検定によるp=0-24)(図4)。
図4 試験群別IgG価。箱は四分位間の範囲を示す。ドットは個々の値を表している(p = 0-24,Wilcoxonランクサム検定)

3.7 安全性
全患者が 28 日間のフォローアップ期間を終了した。10名の患者が経験した有害事象は15件(イベルメクチン投与群7件、プラセボ投与群8件)であった(イベルメクチン投与群5件、プラセボ投与群5件)。重篤な有害事象はなかった。
症状のオンライン日記には、イベルメクチン特有の有害事象に関する質問が含まれていた。錯乱(1対0)眠気(0対0)そう痒症(0対3)については、イベルメクチン群とプラセボ群で報告された患者日数に差はなかった。イベルメクチン群の患者では、めまい(7対1)と目のかすみ(24対1)の患者日数が多かったが、イベルメクチン群では2~28日目に目のかすみを報告した患者が1人いたことから、さらに評価を進めたところ、以前に診断されていなかった老眼の可能性が示唆された(図S4)。
バイタルサイン(表S3)炎症性マーカー(C反応性蛋白、プロカルシトニン、フェリチン、IL-6)その他の臨床検査値には、各群で大きな差は認められなかった(表S4)。
3.8 ポストホック分析
この試験の主な目的は、ウイルスの対向感染の減少を探ることであり、7日目からのサンプルのウイルス培養では、Ct値が30以下のサンプルでのみ複製ウイルスを示したことから、カプランマイヤー曲線を描き、Ct≧30の生存閾値を用いた対数順位検定を用いて生存解析を行った。この解析の結果、遺伝子Eについては統計的に有意な差があり(p = 0-035,Log-rank test)遺伝子Nについては境界線上で有意な差があった(p = 0-055,Log-rank test)。その曲線を図5に示す。
図5ウイルス負荷のカプラン-マイヤー曲線

Ct≧30の生存閾値を使用した。Log-Rank検定により、遺伝子Eの違いについては有意(p = 0-0358)遺伝子Nの違いについては境界線上の有意(p = 0-0550)が得られた。
図を見る をする をする(PPT)
ロジスティック回帰モデルでは、イベルメクチン群で症状を呈する確率が低いことが観察された(OR:0-04 [95%CI:0-00, 0-75] p = 0-032)。両群ともに、何らかの症状の存在は時間の経過とともに減少する傾向にあった(OR(95%CI):プラセボ群では0-80(0-74,0-86)イベルメクチン群では0-81(0-77,0-85))。この減少傾向は両試験群で同様であった(p = 0-687)。咳の有無に関しては、試験群間での差は認められなかった(p = 0-575)し、経時的に減少する傾向も認められなかった(p = 0-373)。しかし、無気力症/多汗症の有無については差が認められた:プラセボ群の患者では、無気力症の有無に時間的な傾向は認められなかった(OR(95%CI):0-99(0-95, 1-02)p = 0-459)。逆に、イベルメクチン群の患者では有意な減少が認められた(OR(95%CI):0-90(0-85,0-94)p<0-001)(図S5)。
また、イベルメクチン投与による無気力感・多動感に対する全体的な効果は、主に男性患者(イベルメクチン群20名、プラセボ群76名、それぞれ無気力感・多動感の患者日数)に牽引されており、女性患者(イベルメクチン群56名、プラセボ群81名、それぞれ無気力感・多動感の患者日数)とは対照的であった(図S6)。性がロジスティック回帰モデルに影響を与えるかどうかを評価するために感度分析を行った。この変数をモデルに追加しても、上記で示された係数は変化しなかった。
参加者は、体重の14%から39%の範囲の脂肪体重を有していた。これにより、全身体重あたりの実際の投与量が399〜427 mcg/kgという相対的に狭い範囲で達成されたとしても、脂肪キロあたりのイベルメクチン投与量は1028 mcg/adipose-kgから 2963 mcg/adipose-kgまでの範囲になった(表2)。脂肪-kgあたりのイベルメクチン投与量は、明らかなパターンを持たずに、無気力症/多汗症の持続時間と報告された無気力症/多汗症の最終日に対してプロットされたが、データの希少性を考慮して回帰は試みられなかった(図S7)。
表2イベルメクチン投与群の体組成と投与量
| 参加者ID | 年齢 | セックス | 重量 | 高さ | BMI | 脂肪の重さ | 脂肪重量* | 受け取った3mgの錠剤 | 総投与量 | 用量/ kg | 用量脂肪/ kg |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 年 | M / F | kg | m | kg / m2 | % | kg | タブレット | mg | mcg / kg | mcg / kg | |
| SAINT-5 | 24 | 男性 | 65・1 | 1・77 | 20・8 | 0・14 | 9・11 | 9 | 27 | 415 | 2963 |
| SAINT-17 | 22 | 男性 | 72・7 | 1・79 | 22・7 | 0・17 | 12・43 | 10 | 30 | 413 | 2413 |
| SAINT-18 | 18 | 女性 | 57・0 | 1・75 | 18・6 | 0・21 | 11・97 | 8 | 24 | 421 | 2005年 |
| SAINT-19 | 18 | 女性 | 45・1 | 1・55 | 18・8 | 0・21 | 9・61 | 6 | 18 | 399 | 1874年 |
| SAINT-3 | 33 | 男性 | 71・0 | 1・70 | 24・6 | 0・21 | 15・48 | 10 | 30 | 423 | 1938年 |
| SAINT-21 | 18 | 女性 | 50・1 | 1・60 | 19・6 | 0・22 | 11・47 | 7 | 21 | 419 | 1830年 |
| SAINT-16 | 20 | 女性 | 49・2 | 1・59 | 19・5 | 0・23 | 11・37 | 7 | 21 | 427 | 1848年 |
| SAINT-9 | 28 | 男性 | 89・9 | 1・79 | 28・1 | 0・26 | 23・82 | 12 | 36 | 400 | 1511 |
| SAINT-11 | 47 | 男性 | 85・8 | 1・77 | 27・4 | 0・27 | 23・77 | 12 | 36 | 420 | 1515 |
| SAINT-20 | 29 | 男性 | 92・2 | 1・79 | 28・8 | 0・27 | 25・54 | 13 | 39 | 423 | 1527 |
| SAINT-8 | 39 | 男性 | 93・6 | 1・77 | 29・9 | 0・30 | 28・27 | 13 | 39 | 417 | 1380 |
| SAINT-13 | 57 | 女性 | 66・0 | 1・57 | 26・6 | 0・39 | 26・27 | 9 | 27 | 409 | 1028 |
4. 議論
部分的な抗ウイルス特性にもかかわらず、イベルメクチンはCOVID-19に対する再利用の可能性のある薬剤として、欧米では初期の段階では限られた注目を集めていた。これは、現在承認されている経口投与量では、Calyら[21]によって記載された抗ウイルス濃度で肺組織レベルに達することができないことを強調したある薬物動態モデルに主に基づいていた。試験管内試験実験や薬物動態モデルの結果からの直接的な推論を避ける理由としては、イベルメクチン代謝物の潜在的な役割、本剤の潜在的な免疫調節的役割、培養に使用したVero細胞株のウイルス/細胞比や適切性に関する疑問などが挙げられる[23]。
このパイロット研究は、イベルメクチンの再利用の可能性へのさらなる投資が必要かどうかという疑問を評価することを目的とした。このように、我々は重症化リスクの低い患者のコホートにおいて、ウイルスの動態、抗体反応、および臨床的有効性に関するエビデンスを得ることを目的とした。作用機序が明確に定義されていなければ、これらのパラメータのいずれかにシグナルが出ただけでは、さらなる努力を正当化するには不十分である。今回の試験では、イベルメクチン投与群でウイルス負荷が低下する傾向があり、IgG値が低下する傾向があり、これは軽症化した疾患を反映している可能性があり、組織障害に関連するCOVID-19の主要な症状である無汗症/多汗症および咳嗽において臨床的有用性があることが示された。これらの結果は、バングラデシュ [10,11] およびアルゼンチン [12] で実施された試験で、治療を受けた参加者のウイルスクリアランスが早かったことを示す新たなエビデンス、およびパスツール研究所の SARS-CoV-2 ハムスターモデルの最近のデータと一致している。
これらの結果が確認されるまでは、この試験は COVID-19 に対するイベルメクチンの潜在的な作用機序に光を当てるものである。この試験では、ウイルス負荷の中程度の違いを検出するための統計的パワーは与えられなかったが、ウイルス負荷がPCRによって直接測定され、疾患の重症度のマーカーとしてIgG価を使用して間接的に測定された場合には、わずかな効果が示唆されている[25,26]。また、この試験では、イベルメクチンは発熱や倦怠感などの全身性炎症に関連する症状の期間を短縮しておらず、全身性炎症マーカーにも測定可能な影響を与えていなかった。
これらの所見を考えると、直接的な抗ウイルス効果とは異なる別の作用機序が考えられるかもしれない。代替的な説明としては、イベルメクチンによるニコチン性アセチルコリン受容体の積極的なアロステリック調節があり、ACE-2受容体のダウンレギュレーションと呼吸器上皮および嗅球の細胞へのウイルスの侵入につながる可能性がある[27]。
イベルメクチンが無嗅覚症の逆転に影響を与えるもう一つのメカニズムは、嗅上皮におけるプロ炎症性経路の活性化を阻害することである。嗅粘膜の炎症は、SARS-CoV-2感染における嗅覚異常の発生に重要な役割を果たしていると考えられている[28]。
イベルメクチンは、IL-8,TNF-α、およびカテリシジンLL-37を含むいくつかの炎症性遺伝子の発現をダウンレギュレートすることが知られている [29]。この効果は、酒さ(赤ら顔、ほてり)の治療におけるイベルメクチンの有効性を部分的に説明していると考えられている [29,30]。この分子は、IL-18およびIL-1β産生の刺激を含む、いくつかのプロおよび抗炎症経路に直接影響を与え、好中球および好酸球に対して化学走化作用を有するため、LL-37への影響は特に重要であると考えられる[31]。この効果は、ビタミンD受容体(VDR)の核への進入を阻害することによって媒介されていると考えられる[32]。イベルメクチンは、リガンドに依存しないVDRの輸送において重要な役割を果たすα/βファミリーのインポーチンを阻害する。このように、インポーチンの阻害がイベルメクチンの免疫調節効果や他のビタミンD経路への影響に寄与している可能性があり、この分野でのさらなる研究を支持するものである。
確認が必要ではあるが、これらの結果はいくつかの重要な疑問を投げかけている。COVID-19に対するイベルメクチンの作用機序がニコチン作用に関連しているとすれば、この受容体の阻害濃度(ナノモル範囲)は、経口投与では短期間、ネブライザー投与ではかなり長い期間、肺組織内で達成可能である[36]。メカニズムが免疫調節性である場合、適切な用量とレジメンはそれに応じて調整されるべきである。高用量または多量投与を検討する前に、観察された効果におけるイベルメクチンの代謝物の潜在的な役割をよりよく理解する必要がある。最後に、イベルメクチン投与群では IgG 値が低下する傾向があることから、イベルメクチン治療、重症度、炎症、ウイルス動態、抗体価との間の潜在的な関係を評価する必要がある; [37,38] 特に、イベルメクチン治療を受けた患者における SARS-CoV-2 に対する長期的な体液性および細胞性免疫反応に注意を払う必要がある。
このパイロット試験は、COVID-19におけるイベルメクチンの使用の可能性を示唆しており、リスク因子やより重篤な疾患を有する患者の臨床的転帰を考慮して、より大規模な試験でのさらなる検討を必要としている。これは、イベルメクチンの低価格、広範な入手可能性、製造プロセスの拡張性を考えると、資源が限られている環境では特に重要である。
この試験にはいくつかの重要な制限があり、結果を慎重に解釈する必要がある。第一に、これはCOVID-19におけるイベルメクチンの使用のための潜在的なシグナルを探ることを目的としたものであり、このテーマに関する決定的な証拠を提供するものではなく、そのためサンプルサイズが小さい。第二に、このパイロット試験では、重症ではなく、リスク因子がなく、発熱や咳の最初の48時間に治療が行われた被験者に限定されている。さらに、提示されたウイルス負荷の定量化は、サンプルの不均一性によって本質的に制限されており、すべてのサンプルが同じ臨床医によって得られたとしても、ウイルス負荷が真に比較可能であることを確実にするためには、ヒト上皮細胞遺伝子に対する標準化が必要であろう[39]。
このパイロット試験で発見された陽性シグナルは、COVID-19の早期治療のためにイベルメクチンを用いたより大規模な試験を実施することを保証するものである。そのような試験には、肺炎患者だけでなく、重症化の危険因子を持つ患者も含めるべきである。また、直接的な抗ウイルス効果とは異なる作用機序の可能性があることから、高リスク群における曝露前予防の道も開かれている。