The Bidirectional Relationship between Sleep and Immunity against Infections
www.ncbi.nlm.nih.gov/pmc/articles/PMC4568388/
オンライン公開2015年8月31日
エリザベス・G・イバラ=コロナド(Elizabeth G. Ibarra-Coronado)1 アナ・マー(Ana Ma. Pantaleón-Martínez, 1 Javier Velazquéz-Moctezuma, 2 Oscar Prospéro-García, 3 Mónica Méndez-Díaz, 3 Mayra Pérez-Tapia, 4 , 5 Lenin Pavón, 6 and Jorge Morales-Montor 1 , *。
概要
睡眠は、免疫反応の重要な調節因子であると考えられている。したがって、睡眠不足は免疫力を低下させ、生物の感染症に対する感受性を高める。例えば、睡眠時間が短いと風邪を引きやすくなると言われている。
睡眠不足がどのようにしてウイルス、細菌、寄生虫などの感染症にかかりやすくなるのかを理解するためには、免疫反応を変化させる睡眠の機能を明らかにする必要がある。睡眠時間が短くなると感染症にかかりやすくなることについては、いくつかの説明がある。例えば、部分的な睡眠不足では、リンパ球の分裂増殖の障害、HLA-DRの発現低下、CD14+のアップレギュレーション、CD4+とCD8+のTリンパ球の変化などが観察されている。
また、ステロイドホルモンは、性行動の制御に加えて、睡眠にも影響を与える。このように、睡眠と免疫・内分泌系は、感染症に対する免疫力をはじめとするさまざまな生理的プロセスを支配する双方向の関係にあると考えられる。
この総説では、ウイルス、細菌、寄生虫などの感染症に対する免疫反応が睡眠パターンに及ぼす双方向性の影響と、睡眠不足がそのような感染症に対する免疫反応にどのように影響するかについての証拠を論じている。睡眠はホメオスタシスの維持に不可欠であるため、生物が継続的にさらされる感染症に対する免疫反応において、睡眠パターンやその他の生理学的パラメータの変化を引き出すためには、これらの状況を適応させる必要がある。
1. はじめに
睡眠は、回復作用と調節作用を持つ生理的プロセスであると提唱されている [1, 2]。睡眠の正確な機能はいまだに解明されていないが、免疫系に影響を及ぼす可能性があることから、近年、睡眠は特に注目されている。多くの研究で、完全な睡眠不足や急速眼球運動(REM)睡眠不足が、CD4+、CD8+、NKなどの細胞亜集団の割合や、IFN-g、TNF-a、IL-1などのサイトカインレベルなど、免疫系のさまざまな構成要素を変化させることが明らかになっている[3-5]。また、逆に、免疫反応時には睡眠パターンが変化することから、睡眠と免疫反応は双方向のコミュニケーションでつながっていることが示唆される。
睡眠は、外部からの刺激に反応する能力が低下した結果、体が動かなくなった状態と定義することができ、速やかに元に戻せることから、昏睡や鎮痛とは区別される。さらに、睡眠を奪われても、その程度や時間に応じて、生体は回復する傾向がある。このような睡眠遮断後の「リバウンド」の存在は、睡眠が単に活動性や覚醒度が低下する期間ではなく [6, 7]、様々な生理機能を調整する重要なプロセスであることを示唆している。
哺乳類や鳥類では,睡眠には脳波のパターンがあり,それによって睡眠過程がいくつかの段階に分けられている。さらに、筋電図(EMG)や眼電図(EOG)を用いて、睡眠の段階を区別している。これらのパラメータに基づいて,覚醒期,軽度の睡眠(2段階),徐波睡眠,急速眼球運動(REM)睡眠といういくつかの睡眠段階が提案されており,それぞれが特定の電気的パターンを持っている[8]。睡眠段階の分類に基づいてヒプノグラムを作成すると,夜間睡眠のエピソード数,持続時間,リズム,および潜伏時間を記述することができる。睡眠パターンは、生物種間および個体発生の過程で異なり、睡眠障害(不眠症)や、医学的、精神医学的、神経学的疾患の発症時には変化する [9]。
睡眠中には,プロラクチンや成長ホルモンなどのホルモンレベルの上昇など,哺乳類の内分泌機能に関わる重要なプロセスが生じる [10]。逆に、コルチゾールのレベルは低下し、起床前にピークを迎える[10, 11]。このことは、睡眠と他の生理学的事象との間に関連性があることを示している。
全面的な睡眠遮断やレム睡眠遮断に関する研究から,睡眠は記憶の定着,学習,神経細胞の可塑性に重要な機能を持つことが示唆されているが [12-14] ,エネルギーの保存と回復のメカニズムであることも提案されている [1, 15] 。また,睡眠は,機能や細胞成分[2, 16]が回復するプロセスであると主張する説もあるが,これらの研究の中には議論の余地があるものもあり,したがって,睡眠の正確な機能は不明のままである。
免疫系の主な機能は、初期の自然免疫とそれに続く適応反応によって、病原体や自己改変された細胞による感染から体を守ることである。
自然免疫は第一の防御ラインである。自然免疫は、侵入してきた病原体を炎症過程で隔離・破壊することと、抗原を認識・処理して獲得免疫に影響を与えることの2つが主な機能である。どちらの免疫にも、感染症に迅速に対応し、固有物質と異物を正確に区別するように設計された細胞および生化学的なメカニズムが含まれている。
例えば、自然免疫では、外来の病原体はパターン認識受容体(PRR)によって認識される。PRRは、生殖細胞にコードされており、そのような生物に特有の分子構造を検出する幅広い特異性を持ち、進化的に保存されている。このような病原体に特有の分子パターンは,病原体関連分子パターン(PAMPs)として知られている[17]。PMAPは一般的に、リポ多糖(LPS)やペプチドグリカンなど、細菌の細胞壁を構成する成分である。その他の重要なPAMPsとしては、β-グルカン(真菌の細胞壁成分)やウイルスの核酸(DNAおよびRNA)などがあり、これらはすべて特定の構造的特徴を持っている[18]。
PAMPsを認識する受容体にはさまざまなものがあるが,その中でも最もよく研究されているのがToll様受容体(TLR)で,13種類の受容体があり,幅広いPAMPsを認識する。TLRは、細菌やマイコプラズマに含まれる大きなリポペプチドなどの分子に結合する[19]。NLRは、ウイルスのDNAやRNAを検出する細胞内センサーとして機能するTLRの別のグループを形成している[20]。
細菌のリガンドによるTLRの活性化は、マクロファージを刺激する炎症反応を引き起こし、マクロファージは、腫瘍壊死因子アルファ(TNF-α)インターロイキン-1β(IL-1β)インターフェロン-ガンマ(IFN-γ)インターロイキン-6(IL-6)などの炎症性サイトカインを産生し、局所的および全身的な炎症性免疫反応を調整する。TNF-αとIL-1βは、局所の内皮を刺激して血管拡張を誘導し、血管の伝染性を高めることで、血清タンパク質や白血球の感染部位への流入を促進する。IL-1βとIL-6は一緒になって肝細胞に作用し、肝細胞を活性化して急性期タンパク質を産生し、補体を活性化して病原体をオプソニン化し、好中球やマクロファージに貪食させる。
TLRは、好中球、単球、NK細胞、γδT細胞など、自然免疫系の他のエフェクター細胞にも発現しており[18]、これらの細胞は1種類以上のTLRを共発現することができる。好酸球、好塩基球、マスト細胞などの貪食性白血球は、自然免疫の主要なエフェクターであり、その主な機能は病原体を摂取して死滅させることである。他の種類の食細胞もこれらのプロセスに参加し,抗原提示細胞(APC)として働き,特異的な免疫反応を活性化する抗原ペプチドを生成している。
適応免疫系による抗原の認識は,特定の受容体を介して行われる。これらの受容体は生殖細胞にもコードされており、体細胞の組み換えによって、これらの遺伝子のセグメントがランダムに組み合わされると、高い特異性を持つ膨大で多様な受容体のレパートリーが生成される[22]。得られた産物は、1抗原に特異的な受容体を発現する抗原特異的Tリンパ球およびBリンパ球にクローン的に分布し、病原体に対応して特定の集団が選択されて拡大していく[23]。
T細胞は、T細胞受容体(TCR)を介してペプチドを認識するが、このTCRは、Tリンパ球の反応の種類に応じて、異なるメカニズムで作用する。従来のT細胞には2つの主なグループがある。CD4コアセプターを発現するTヘルパー(Th)細胞と、CD8を発現する細胞傷害性Tリンパ球である。どちらの細胞も、主要組織適合性複合体クラスII(MHC II)分子に結合しなければならない抗原ペプチドを認識するのに対し、B細胞は3次元の分子決定基(エピトープ)に結合して抗原を認識する。
一方、B細胞は3次元的な分子決定基(エピトープ)に結合して抗原を認識する。さらに、特定のTh細胞がB細胞と相互作用し、B細胞が大量の免疫グロブリンまたは抗体を産生する。すべてのB細胞は、抗原を中和して破壊する固有の特異性を持つ抗体を産生する[23]。
自然免疫反応と獲得免疫反応には,それらを信号化し,組織化する分子のネットワークが必要である.これらの分子(サイトカイン)は、すべてのクラスの免疫細胞および他の多くの細胞タイプによって合成される。一般に、サイトカインは、炎症促進、調節、または抗炎症分子として作用し、サイトカインを産生したリンパ球のサブタイプに応じて、Th0,Th1,Th2,Th3,またはTh17に分類されるが、実際の分類はより幅広く、より複雑である。
サイトカインは、自然免疫反応と適応免疫反応に関与している[24]。Th1細胞と活性化マクロファージは、主にIFN-γなどのサイトカインを分泌し、細胞内病原体に対する反応を媒介するとともに、B細胞にIgG2抗体の合成を誘導する。Th2細胞は、多細胞の寄生虫に優先的に反応し、好酸球、好塩基球、粘膜上皮リンパ球の機能を調節するIL-4,IL-5,IL-13を産生する[25]。IL-5は、リンパ球にIgE抗体の産生を特異的に指示する。Th17細胞は、上皮細胞などの細胞タイプを誘導して、IL-17やケモカインを産生させ、感染部位に好中球をリクルートし、細胞外の細菌や真菌細胞に対する反応に関与する[25]。
Th細胞のさまざまな系統への分化は、マスター転写因子によって制御されており、その発現は、PAMPsによる活性化に応じてAPCが産生・支配するサイトカインによって制御されている。このように、適応免疫応答は、自然免疫応答によって編成された抗原特異的な活性化をもたらすのである。
2. 睡眠に対する感染症の影響
脳は免疫系と連動しており、睡眠時にも同様の相互作用が起こり、脳の活動が変化することで、いわゆる「起きている脳」と「眠っている脳」が生じる。睡眠中には、神経伝達物質、ホルモン、サイトカインなどの分子の発現が調節されることが知られており、ヒトを対象とした研究では、これらの成分の一部が睡眠中に血清レベルで変化することが報告されている。具体的には、単球や樹状細胞からのIL-1β、IL-10,IL-12,TNF-αの分泌量は、概日リズムとは無関係に睡眠中にピークに達する。
動物がこれらのサイトカインのリズムを奪うと、発現の変化が弱まることから、この行動は睡眠と直接関係していると考えられる[26, 27]。また、単球、T細胞、NK細胞の血中濃度は、睡眠・覚醒サイクルに関する明確な概日リズムに従っている[3]。注目すべきは、プロラクチン、コルチゾール、ノルエピネフリンなどの他の神経内分泌メディエーターも概日リズムを示しているが、その分泌パターンは睡眠-覚醒サイクルにより関連しており、これらの化合物はすべて免疫反応を調節しているという点である[28]。
逆に,ある種のサイトカインは睡眠に影響を与える。例えば,IL-1βは,ウサギやラットに脳室内投与すると,ノンレム睡眠の持続時間を増加させる。この効果は、IL-1βアンタゴニストを投与すると消失する[29-31]。サイトカインであるTNF-αやIFN-αを投与しても、IL-1βと同様の効果が得られる[32-34]。
視床下部,海馬,脳幹には,IL-1β,TNF-αおよびそれらの受容体に対する免疫反応性ニューロンが存在する。これらのニューロンは,脈絡叢,海馬,視床下部,大脳皮質など,脳のさまざまな領域に異なる形で分布している。特に、これらの領域は、睡眠の調節に関与している可能性がある。さらに,IL-1βはセロトニン神経系に作用し,いくつかのレベルで睡眠を支配している[35-37]。
これらの証拠から、免疫系の構成要素と睡眠を生み出すメカニズムとの相互作用が示唆される。したがって、病原体に対する免疫反応が行われているときに睡眠中に起こる変化について説明する必要がある。
いくつかの感染症は、睡眠障害と関連している。特に、ウイルス、バクテリア、寄生虫などの感染体は、中枢神経系に感染し、感染に対抗して生成される免疫反応や、病原体による直接的な影響によって、睡眠障害を引き起こすことがある。さらに、睡眠障害を引き起こす他の侵襲性因子は、呼吸器系や内分泌系など、睡眠を制御する器官ではない他の器官に影響を与える。
しかし、ほとんどの感染プロセス、特に免疫反応の急性期には、睡眠パターンが変化し、通常、徐波の持続時間が長くなり、その結果、覚醒度とレム睡眠が減少する。このような睡眠パターンの変化は、感染時によく見られる現象であり、生物がこのような状況に適応し、より多くのエネルギーを免疫系に注いで感染を解消しようとするメカニズムであると考えられる。
3. ウイルス感染と睡眠
ウイルスは、細胞に感染して複製を行い、ウイルス粒子と呼ばれる粒子を排出する存在である。通常、ウイルスはDNAまたはRNAで構成され、カプシドと呼ばれるタンパク質の層で覆われている。ウイルスは、細胞内の他の生命体とは異なり、複製時にはカプシドに覆われず、宿主細胞の機械を利用して複製を行う[38]。
ウイルスは,インフルエンザや免疫不全ウイルス(HIV)など,パンデミックを含む多くの病気の原因となる。これらの疾患は、感染した臓器や器官によって様々な症状を呈するが、その多くは睡眠障害、疲労感、発熱を伴う。例えば,マウスにインフルエンザウイルスを経鼻接種すると,体温が低下するにもかかわらず,非急速眼球運動睡眠(NREM)が亢進し,急速眼球運動睡眠(REM)が低下する[39-42].
遺伝もまた、感染症に対する感受性や抵抗性に影響を与える[43-47]。例えば,インフルエンザ感染時のNREM睡眠の増加は,BALB/cマウスでは見られないが,C57BL/6(B6)マウスでは感染時にNREM睡眠が増加するなど,系統に依存しているようである[41]。インフルエンザウイルスが睡眠パターンに及ぼす影響や、睡眠における特定の変化については、広範囲にわたって研究されている。インフルエンザウイルスが脳内を移動する際の経路や時間軸がよくわかっていることから、ウイルス感染と睡眠との関係を調べるのに適したモデルであると考えられる。1995年、Tothは、インフルエンザ感染による系統間の睡眠パターンの変化の違いに加えて、C57BL/6マイクでは徐波睡眠が増加することを報告した。これは、げっ歯類の睡眠の概日リズムが系統によって典型的に変化することを示している[41]。
無気力脳炎(LE)は1世紀以上前から報告されているが、うつ病との関係についてはほとんど知られていない。むしろ、LEは中枢神経系に対する免疫反応に起因するとされている。ヒポクラテスや19世紀のSydenhamによって特徴づけられたにもかかわらず、その病因は特定されていない。LEは中枢神経系(CNS)の疾患であり、初期に咽頭炎、続いて原発性過眠症などの睡眠障害、および様々な形態の眼球運動が発症する[48]。
LEは、1916年にコンスタンティン・フォン・エコノモによって命名された。エコノモは、顕著な睡眠障害、嗜眠、錐体外路性運動に加えて、生存している患者が緊張病、強迫性障害、ミュータンスなどの神経精神疾患を発症していることを観察した[49]。LEの特徴は、脳炎の大脳基底核と中脳構造の萎縮である。1916年から 1927年のパンデミック以降、LEの症例はほとんど報告されていない。LEのパンデミックは1918年のインフルエンザ大パンデミック時に発生し、2つのパンデミックを結びつけていた[50]。また、同じ臨床症状を持つ患者を対象とした他の研究では、LEは自己免疫疾患との相関性が高いことが示されており、被験者の95%が大脳基底核の抗原に対する抗体を持っていた。
ポリオウイルスは、中枢神経系に影響を与え、睡眠障害を引き起こすもう一つのウイルス感染症である。このウイルスに感染し、急性感染を経験した患者は、数年後に神経筋や呼吸器系の症状を含む症候群を発症し、睡眠中の酸素欠乏に影響を及ぼす閉塞性無呼吸・低呼吸を主な特徴とする睡眠障害を併発する[52, 53]。他の研究では、嚥下や呼吸の困難に加えて、睡眠中に周期性四肢運動が起こることが示されている。これは、おそらく脳幹の運動ニューロンの機能障害に起因するもので、睡眠に伴う呼吸障害に関与するドーパミンの異常な産生が原因と考えられている[54]。
同様に,ヒト免疫不全ウイルス(HIV)の感染も,中枢神経系に影響を与える。現代の最も重要なパンデミックと考えられているこのレンチウイルスに感染した患者は,無症状の段階で疲労や睡眠障害を経験する [55].また,HIVに感染すると,推論や記憶が損なわれる[56].HIVの感染が進行すると、患者は精神的・認知的機能障害を呈することがあるが、これはよく知られている神経病理学の一部である可能性がある。
HIV感染者を対象とした初期の睡眠ポリグラフ研究では、成人や小児では、睡眠開始後の覚醒時間が長くなるため、感染初期や感染期間中に起こる睡眠構成の変化が報告されている[57]。これらの患者では、レム睡眠が減少し、徐波睡眠が存在し、睡眠紡錘体密度およびK複合体密度が低下する。これらの症状は、疾患に応じて進行し、最終的には、総睡眠時間と徐波睡眠が減少し、覚醒時間が増加する[58]。
HIV陽性であるが無症状の患者を対象とした他の研究では、矛盾したデータが報告されている。Normanらは、徐波睡眠の割合、第1段階睡眠とレム睡眠の期間数、および覚醒回数の増加を報告しているが[59]、徐波睡眠とレム睡眠の期間が正常であることは他の研究でも観察されている[60]。それにもかかわらず、両研究とも、睡眠潜時がより長く、第2段階睡眠の割合が低いことを指摘している[59, 60]。Normanらは、これらの変化が投薬、不安障害、うつ病によるものである可能性を排除し、代わりに中枢神経系に対する免疫反応の動員によるものであることを示唆した[59]。その後、無症状の患者では、覚醒、徐波睡眠、レム睡眠の期間が一晩中均一に分散していることが報告された[59]。さらに、精神疾患や神経疾患とは無関係に、周期的な交替パターンが有意に高い割合で発生している無症候性患者の睡眠の微細構造には別の変化が生じていた[61]。
睡眠障害は、感染の初期段階、つまり病気が大きく進展する前に現れるため、これらの変化は、中枢神経系への直接感染によって引き起こされ、カプシドの構成要素など、特定のウイルスペプチドが関与していると提案されている[62]。ラットでは,gp120糖タンパク質(カプシドタンパク質の一部)を脳室内に投与してから4時間後に,ヒトのHIV感染時に起こるものと同様の睡眠パターンの変化が見られる[63].さらに,gp120を注射すると,視交叉上核と外側手綱核でのグルコース利用が減少する[64].さらに,同じくエンベロープの構成要素であるgp160やgp41などの他の糖タンパク質をラットに長期投与すると,レム睡眠が増加し,睡眠の断片化や脳波の低周波成分が変化する.しかし、これらを継続的に投与すると、軽度の発熱反応が誘発される[65]。
他の研究では、猫免疫不全ウイルス(FIV)に感染した猫では、中枢神経系のさまざまな領域(海馬回転時のグリア結節、皮質および皮質下領域など)に損傷と単核細胞の浸潤が見られることが報告されている。ウイルスが検出された他の構造は、大脳皮質、中脳、小脳である。ウイルスの位置は、脳波(EEG)における優位な周波数のスローダウンや、徐波睡眠の断片化や変位などの睡眠構造の変化を伴う[66]。感染した猫では、覚醒している時間が50%以上長くなり、覚醒と睡眠の間の移行期間が多くなり、徐波睡眠中のレム睡眠が30%減少し、睡眠紡錘の頻度が低下することが観察されている。
感染した猫におけるこれらの変化の多くは、HIVに感染した人やAIDSを発症した人における変化と近似している[67]。したがって,このモデルは,HIV感染が睡眠パターンの変化を引き起こすメカニズムを調べるのに適した実験手法である。おそらく,中枢神経系におけるウイルス成分の直接的な作用や,感染時のウイルスやそのタンパク質に対する免疫反応によるものであろう。また、狂犬病のように中枢神経系に直接作用するウイルスもある。狂犬病によって誘発される変化は、感染の初期段階で始まり、臨床症状が弱まるのと同時に消失する。狂犬病は、マウスの顕著な脳波異常には影響しないが、睡眠障害を引き起こす。この障害の特徴は、レム睡眠の回数が減り、覚醒時間が長くなることである。固定狂犬病ウイルスと比較して、通り狂犬病は脳波記録を変化させ、睡眠段階と覚醒段階が病的な睡眠段階に置き換えられる。
これらの障害における免疫反応の機能を明らかにするために、感染した免疫抑制マウスを用いて、免疫力のあるマウスと比較して、睡眠パターンの変化に注目した。脳波によって、両グループは同じ変化を経験した。したがって、これらは、ウイルスに対する免疫反応ではなく、ウイルスの病原性メカニズムによって直接引き起こされる可能性が高いと考えられる[68]。
神経刺激性ウイルスである水痘帯状疱疹も睡眠障害を引き起こし、患者は疲労、低血圧、睡眠障害を発症する[69]。C型肝炎ウイルスは、精神疾患や睡眠障害に影響を与えるが、CNDに疾患を引き起こすかどうかは不明である。C型慢性肝炎患者の約60%が睡眠障害などの精神疾患を発症し、インターフェロンα(IFN-α)による治療中にも症状が現れる[70]。C型肝炎患者は、IFN-αによる治療中および無治療時に、睡眠障害、うつ病、不安症の発生率が高く、したがって、睡眠への影響は感染症に依存していると思われる[71]。
一方、Raisonは、IFN-α療法がこれらの障害を悪化させることを示した。このような患者は、ステージ3および4の睡眠時間と睡眠効率(総睡眠時間/ベッドで過ごした時間×100)が有意に減少し、一方で疲労感が増し、日中の昼寝回数が減り、血漿コルチゾール濃度が高くなった[72]。これらのデータは、このような患者のストレスの指標であり、睡眠障害、うつ病、不安は、情緒的な状態とウイルスに対する免疫反応の悪化から生じることを示唆している。
同様に、別の研究では、B型肝炎感染者で睡眠障害もあり、IFN-αではなく代替薬(ナツメの種子、Anemarrhenaの根茎、Poria sclerotium、Ligusticim wallichiiの根茎の抽出物)で治療したところ、睡眠の質が改善したことが報告されている。睡眠Iと睡眠IIは改善したが,睡眠III,睡眠IV,レム睡眠は有意に増加した[73].この証拠は、IFN-αを投与されていない患者に睡眠障害が生じるという知見を支持し、このサイトカインのレベルの変化によって引き起こされることを示唆している。つまり、IFN-αなどのサイトカインや自然免疫分子に継続的にさらされることで、睡眠の継続性が低下し、不眠や覚醒と一致するパターンが誘発されることを示している。
C型肝炎患者におけるさまざまな変化は、インフルエンザウイルス感染時にも起こり、マウスの徐波睡眠睡眠時のデルタ波の振幅を減少させ、臨床的には低体温を誘導し、運動量を減少させる。他にも、マウスでは系統に依存した変化が観察されており、例えば、感染したB57BL/6マウスは暗期に徐波睡眠で過ごす時間が長くなり、その結果、感染から4日後には睡眠の概日リズムが失われている。さらに、免疫マウスではウイルスチャレンジ後に総睡眠時間が増加する。一方、BALB/cマウスでは、これらの障害が全く起こらなかった[41]。このことから、感染が睡眠パターンに及ぼす影響については、遺伝的な違いや免疫反応の種類が系統間で異なることが示唆される。この行動は、プロスタグランジン代謝に関連する6番染色体のMC10-12領域に起因すると考えられている。
C57BL/6マウスと同様、Swiss-Websterマウスでも、致死性株(H1N1)と非致死性株(H3N2)の感染時の反応が異なっていた。H1N1に感染した幼・成体マウスは、体温や運動量が低下し、徐波睡眠が増加したが、レム睡眠は抑制された。しかし、H3N1ウイルスと比較して、H3N2ウイルスによる睡眠障害は、10倍の高用量で投与されたにもかかわらず、その範囲は狭かった[40]。このように、ウイルスによって引き起こされる変化は、マウスの系統に依存しており、おそらく各ウイルス系統に対する免疫反応の違いに起因していると考えられる。
睡眠障害は、感染症に発展する臨床プロファイルの一部であるかもしれない。23型ライノウイルスに感染した男女を対象とした研究では、ウイルスの活動期には、潜伏期と比較して、患者の睡眠時間が減少し、一方で睡眠効率は5%低下した。これらの変化は、無症状の人の方が大きかったため、少なくとも今回の感染では、このウイルスに対する免疫反応の鋭さと関係があるかもしれない[74]。
これらの研究にもかかわらず、ウイルス感染によって引き起こされる変化は、明確に定義されていない-あるものは睡眠の様々な段階を促進し、他のものはそのリズムを消したり乱したりする。これらの影響は、中枢神経系に対するウイルスの直接的なメカニズムや、これらの感染症に対抗するために生じる免疫反応の種類によって媒介される可能性があるが、これらは依然として不明である。図1は、ウイルス感染と睡眠の関連性を示したものである。
図1 ウイルス感染と睡眠の関連性
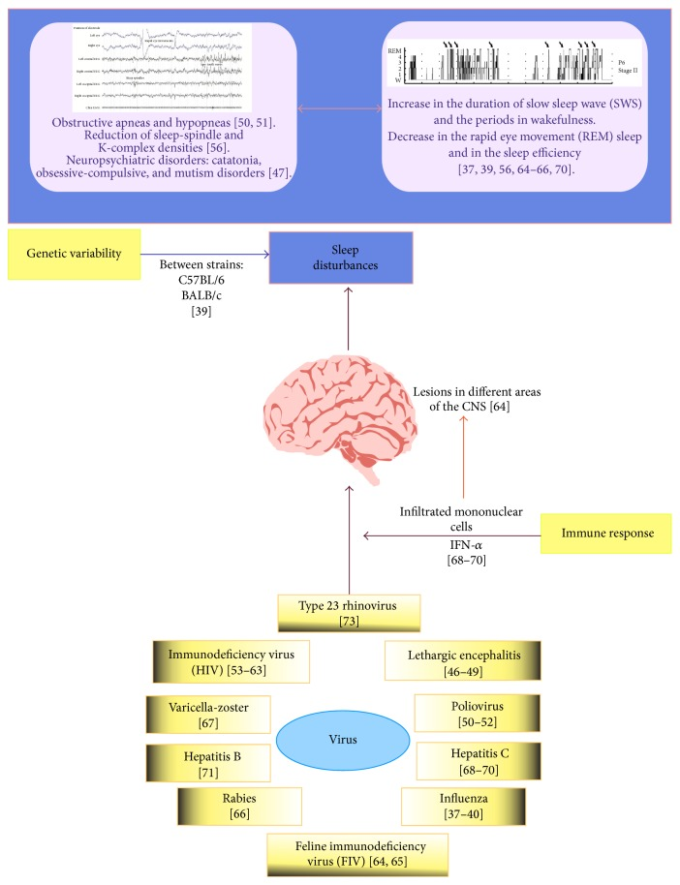
寄生虫によって引き起こされる睡眠障害には、緩慢な睡眠波(徐波睡眠)の持続時間の増加、覚醒期間の増加、急速眼球運動睡眠(REM)の減少、そして一般的には睡眠効率の低下などがある。その他の障害としては、睡眠紡錘体密度やK複合体密度の低下など、脳波特性の変化が挙げられる。これらの変化は、免疫系の活性化や、中枢神経系の構造に様々な影響を与えるサイトカインの産生によって引き起こされる可能性があり、睡眠の形態や量を変化させる。このような病原体は、間接的に睡眠を乱し、呼吸機能障害、強迫性障害、ミュータンスなどを引き起こし、精神疾患に伴う睡眠時無呼吸症候群などの睡眠障害を引き起こす。
4. 細菌感染症と睡眠
細菌もまた、感染して病気を引き起こし、体の機能全体を大きく変化させる大きな病原体の一つである。具体的には、細胞壁を構成する成分のように、細菌の特定の分子が睡眠を誘発する。例えば,ムラミルペプチドは,ウサギ,ラット,イヌの徐波睡眠を長くする[75]。しかし,ウサギでは,LPSの脳室内および静脈内投与により,徐波睡眠とその振幅が増加し,レム睡眠が抑制された[76].
ヒトにSalmonella abortus endotoxinを接種した研究では、覚醒睡眠とREM睡眠が有意に減少し、それに伴ってノンレム睡眠が増加したことが報告されている[77]。実験動物での変化とは対照的に、このエンドトキシンはデルタ波の振幅を増加させなかった[77]。その後の研究では、Salmonella abortusのエンドトキシンはNREM睡眠の総時間を減少させたが、覚醒・睡眠潜時と日中の眠気は増加した[78]。
TothとKreuger(1988)[79]は、抗原の接種だけではなく、感染症の経過中に睡眠が変化することを報告した。彼らの研究では、ウサギに電極を埋め込んだ後、黄色ブドウ球菌を静脈内に接種した。睡眠パターンの変化については、徐波睡眠の総量、エピソードの振幅と持続時間が増加した。睡眠に対する感染の影響は、抗生物質(セファロチン)によって弱められた。セファロチンと同様の変化は、動物への接種に死菌を用いた場合にも見られた[79]。
その後の研究では,ウサギにEscherichia coli,Candida albicans,Pasteurella multocidaを感染させると,S. aureus感染と同様の影響を及ぼすことが示された[80, 81].一方,別の研究では,ラットへの細菌のコロニー形成は,感染後1週間は睡眠パターンに影響を与えなかったが,2週間目にはエピソード数,頻度,レム睡眠の割合が減少した。これらの結果は、非侵襲的に細菌をコロニー化させると、発熱を伴わずにレム睡眠が減少することを示しており、細菌のコロニー化の程度を示す感度の高い指標となっている[82]。
臨床データは、細菌感染が睡眠障害にも影響を与えることを示している。実験動物における変化とは対照的に、Borrelia burgdorferiという細菌によって引き起こされるヒトのライム病は、慢性疲労や不眠症などの睡眠障害と関連している。Greenbergらの報告によると、主な睡眠障害として、入眠困難、頻繁な夜間覚醒、日中の過度の眠気、レストレスレッグ症候群が挙げられている。また、これらの患者では、睡眠潜時の増加、睡眠効率の低下、覚醒指数の上昇、睡眠の断片化などがあまり見られない[83]。注目すべきは、ノンレム睡眠の段階でα波(通常、眠い人やリラックスしている人に見られる規則的なフシギなパターン)も観察されたことである。これらの変化は、ライム病の臨床症状を構成するものであるが [83] 、その根本的なメカニズムはまだ不明である。百日咳菌(Bordetella pertussis)は、てんかん発作、窒息音、睡眠時歩行などの睡眠中の変化を引き起こす。このような副睡眠は感染に関連しており、病原体が除去されると消失する[84]。
これらの感染症とは対照的に、睡眠障害は呼吸器系の細菌感染中または感染後に発症する。しかし、このような睡眠障害は、呼吸器系への感染の影響に起因すると主張されている。リステリア菌による細菌性髄膜炎や菱脳炎、サルコイドーシス、肺炎球菌による髄膜炎では、睡眠障害が生じる。サルコイドーシスの際には、一般的な無呼吸が発生し、リステリア感染症における変化は、網状層の病変によって誘発され、呼吸数を乱し、レム睡眠やノンレム睡眠において酸素欠乏を引き起こすと考えられる[85-87]。このような状況下では、多くの覚醒が起こり、睡眠の質が低下する。リステリア菌に感染した患者は、昼間の睡眠時間が長く、夜間の睡眠時間が短く、夜間の覚醒時間が長いという特徴があり、その結果、睡眠覚醒サイクルに変化が生じ、これらの患者の特徴的な症状となっている。しかし、これらの変化のメカニズムはまだ解明されていない。
ナルコレプシーのような他の睡眠障害も、細菌感染と関係があるかもしれない。ナルコレプシー患者の多くは、自己免疫疾患に関連する細菌感染症であるレンサ球菌に対する抗体(抗ストレプトリジンまたはASO)やヘリコバクター・ピロリに対する抗体(抗Hp Ig)-2を持っており[88]、自己免疫機構を介してナルコレプシーを引き起こす可能性がある。
ウイルスと同様に、細菌感染は、影響を受ける脳の部位に応じて様々な睡眠障害を引き起こす。しかし、中枢神経系への直接的な感染は、覚醒度や徐波睡眠を変化させません。これは、細菌感染によって合成・放出が促進されるプロスタグランジンD2などの免疫・炎症反応の特定の成分が影響していると考えられる。図2は、細菌が睡眠パターンに及ぼす複雑な影響を示した図である。
図2 バクテリア感染による睡眠プロセスへの影響
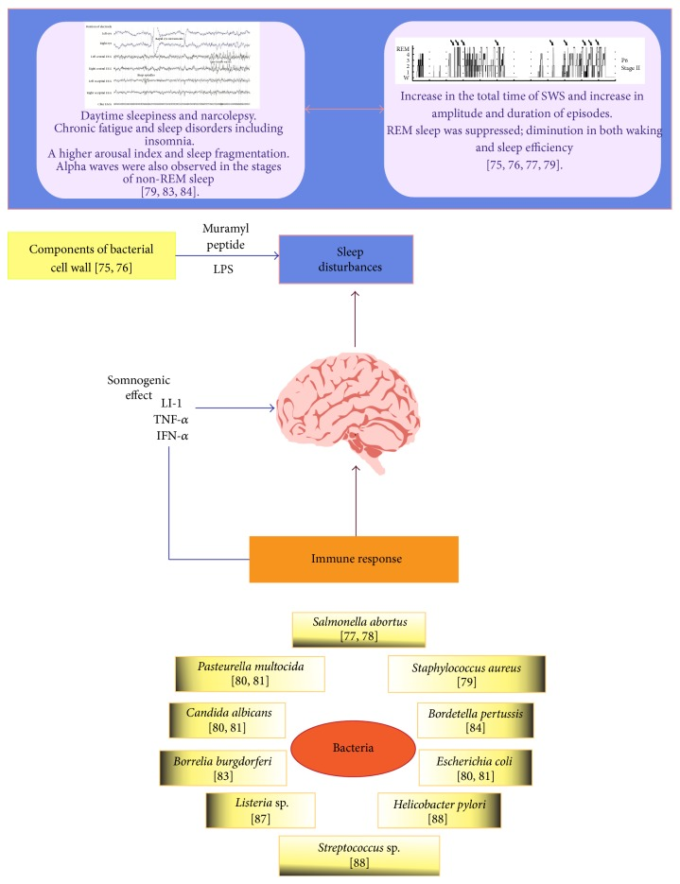
細菌が原因となる睡眠障害には、日中の眠気やナルコレプシー、慢性疲労、不眠などがあり、覚醒指数の上昇や睡眠の断片化などを伴うことが知られている。細菌感染は他にも、徐波化した睡眠波(徐波睡眠)の持続時間の増加や覚醒期間の増加などの変化を引き起こす。また、細菌感染症では、急速眼球運動(REM)睡眠と睡眠効率が低下する。細菌の壁成分(主にLPS)は炎症性サイトカインを強く誘導するため、感染症が睡眠障害を引き起こすメカニズムの一つとして考えられている。
5. 寄生虫感染症と睡眠
寄生虫の感染は、その結果生じる免疫反応や直接的な影響によって、睡眠パターンを変化させることもある。寄生虫は多細胞生物であるため、感染を促進し、ライフサイクルを完了するために、特定の行動を変更することができる[89]。外部からの刺激に対する反応性が低下して感染しやすくなることから,睡眠状態が感染した宿主を利用できる状態である可能性がある。しかし、この関係を示す証拠はほとんどない。
これまで述べてきたように、睡眠はホメオスタシスの維持につながる生理的な状態である。この目標を達成するために、睡眠を制御する大脳機構は、内分泌系や免疫系と相互に関係している。急性および慢性的な睡眠不足は、免疫反応を変化させ、逆に免疫学的な課題は、正常な睡眠パターンを変化させる。したがって、睡眠障害は寄生虫感染を促進すると予想される。
しかし、この問題はあまり広く研究されていない。ヒトアフリカトリパノソーマ症(HAT)は、睡眠パターンに影響を与える寄生虫感染症として最もよく知られている。HATは、内分泌系や神経精神系の症状、感覚の変化、睡眠パターンの劇的な変化など、神経系の機能に深刻な障害を伴う。このような変化は、概日リズムの完全な喪失、総睡眠時間の増加、覚醒状態からレム睡眠への直接的な移行と定義されるナルコレプシー様エピソードとして現れる。睡眠パターンの変化に基づいて、HATは睡眠病とも呼ばれている[90]。
HATの原因は、サハラ以南のアフリカに生息するツェツェバエの集団によって媒介される血球貪食症Trypanosoma bruceiの2つの変異である。トリパノソーマ・ブルセイ・ガンビエンセは、西アフリカ(ガンビア)型の病気を引き起こし、その主な宿主は人間である。この病気は数ヶ月から数年かけてゆっくりと進行するため、媒介者であるツェツェバエへの寄生感染の可能性が高くなる。Trypanosoma brucei rhodesienseは、東アフリカ型(ローデシア型)の睡眠病を引き起こし、その主な宿主は牛である。人間が感染すると、病気の経過は加速し、数週間から数ヶ月で発症する[91]。
HAT患者の特徴的な変化は以下の通りである。(i)多相性の睡眠-覚醒パターンで、24時間にわたる睡眠時間と覚醒時間の交代が大きく乱れる。(ii)睡眠の内部構造の変化で、睡眠-覚醒の変化よりも早く現れることがある緩徐徐式急速眼球運動(SOREM)のエピソードが特徴的である[90]。HAT患者の脳波記録では、特徴のない形態学的変化も観察される。概日リズムの喪失は、他の内分泌リズムにも影響を及ぼす。例えば、プロラクチンや成長ホルモンの分泌パターンが乱れる。短い睡眠エピソードを伴う睡眠覚醒サイクルの調節障害の重症度は、昼と夜でほぼ等しく、病気のそれと比例している。これらの知見は、HATにおける睡眠覚醒の変化は、脳内の寄生虫の存在とは直接関係がなく、ゆっくりとした可逆的な機能変化と代償機構が関与していることを示している[92]。免疫系の変化をもたらす病原体のメカニズムを理解するために、HATの動物モデルが開発された。ラットをTrypanosoma brucei bruceiに感染させた研究では、自発的な睡眠・覚醒構造の分析により、死の2日前に徐波睡眠(徐波睡眠)の割合が増加し、覚醒が減少していることが示された。感染ラットでは、睡眠覚醒段階の変化が多く、覚醒と徐波睡眠のエピソードが多かったため、かなりの睡眠の断片化が観察された。感染ラットでは、徐波睡眠のパターンが断片的になり、パラドキシカルスリープ(PS)の平均潜時が減少し、PS-WSの順序が乱れた。異常な遷移、特に睡眠時レム睡眠(SOREM)エピソードの出現は、内部の睡眠構造の調節障害を示していた[93]。
その他の寄生虫感染症でも、マラリア原虫のように睡眠障害を引き起こすことがある。マラリアの急性感染時の症状は、震えを伴う周期的な発熱、頭痛、体の痛み、眠気、食欲不振であり、これらは赤血球期のマラリア原虫細胞が増殖することによって引き起こされる。最近の証拠から、これらの作用は、P. falciparumがPGD2,PGE2,PGF2aを、哺乳類のシクロオキシゲナーゼによるPG生合成とは異質に合成することが判明したことと直接関係していると考えられる。PGD2は体液性物質であり、マラリア原虫が宿主の防御を回避して感染を確立するための特定の戦略を持っていることを示唆している[94]。
フィラリア症における神経学的症状は、この疾患が髄膜血管病変を伴う他の疾患と重なる頻度が高く、致命的な合併症が原因とされているため、あまり注目されていない。1950年、KenneyとHewittは精神神経症状を、黄疸、不眠症、頭痛、神経衰弱、異常な過敏性と特定した[95]。最初の事例は28歳の男性に関するもので、この男性は疲れを伴った人格の変化を起こした。これらの症状は十分に重く、彼はヨーロッパに戻ることになった。休暇中、彼は急性の精神症状と50%から56%の好酸球増加を伴う頭痛に再び苦しんだ。目から虫(M. boa)を取り除くと、すべての症状が改善され、好酸球増多も3%に減少した[96]。
他の寄生虫感染症が宿主に睡眠障害を引き起こすという報告があり、主にこれらの寄生虫症の臨床的特徴が原因となっている。Hookworm-related cutaneous larva migrans(CLM)は、Ancylostoma braziliense、Ancylostoma caninum、またはUncinaria stenocephalaなどの幼虫の線虫がヒトの皮膚に寄生することによって起こる寄生性皮膚疾患である。これらの線虫は通常、犬や猫に寄生する [97]。ヒトは偶発的な宿主であり、正常な幼虫の発育が損なわれているため、CLMは自己限定的である。しかし、匍匐前進による発疹は数ヶ月間持続することがある[98]。CLMでは睡眠障害が頻繁に起こる。患者は、頻繁な覚醒エピソードによる入眠の遅れと睡眠の断片化を報告するが、全員がこの訴えを痒みのせいだとしている-84%の患者が睡眠障害を訴えている。睡眠障害には多くの原因があるが、上述の研究の患者では、病変に起因する重度のそう痒から睡眠の変化が生じているのではないかと推測している[99]。40年以上前に、いくつかのグループがオンコセルカ症に関する研究を行い、感染した患者ではてんかんの有病率が高いことを指摘し、これらの症状の間に因果関係があると考えた[100]。すべてのタイプの発作は、睡眠不足によって活性化される可能性があり、この現象はすべての年齢層の患者で報告されているが、若年層ではより頻繁に発生している[101]。
このセクションで取り上げた寄生虫感染症の場合、睡眠に影響を与えるメカニズムはまだ不明である。マラリア、フィラリア症、トリパノソーマ症などの感染症は、免疫反応を調節することで睡眠パターンを変化させるようである。この目的のために、我々のグループは、Trichinella spiralisをラットに実験的に感染させると、15日後にNREM睡眠が有意に増加することを観察した。この感染は、感染後5日まで続く腸管上皮の局所的な段階と、全身的な段階からなる。感染後15日目には、寄生虫が全身に存在していると考えられる。この間、局所的な免疫反応が起こり、腸間膜リンパ節ではT細胞が減少し、B細胞やγδ細胞が増加し、腸管上皮では炎症性浸潤や好酸球増多が見られることが特徴である(未発表)。
免疫系の機能における睡眠の重要性については、多くのグループで検討されている。2009,Prestonらは、寄生虫の感染から生体を守るために睡眠が種を超えて進化した可能性を研究した。哺乳類12種を対象に、睡眠時間と寄生虫感染レベルの相関関係を分析したところ、負の相関関係が見られた。
睡眠時間が長いほど、寄生虫の感染レベルが低いことと有意に相関していた。したがって,著者らは,睡眠は動物を寄生虫の感染から守るために進化したと結論づけている[102]。睡眠と寄生虫感染の関係の可能性を図3に示した。
図3 睡眠と寄生虫感染症の関係
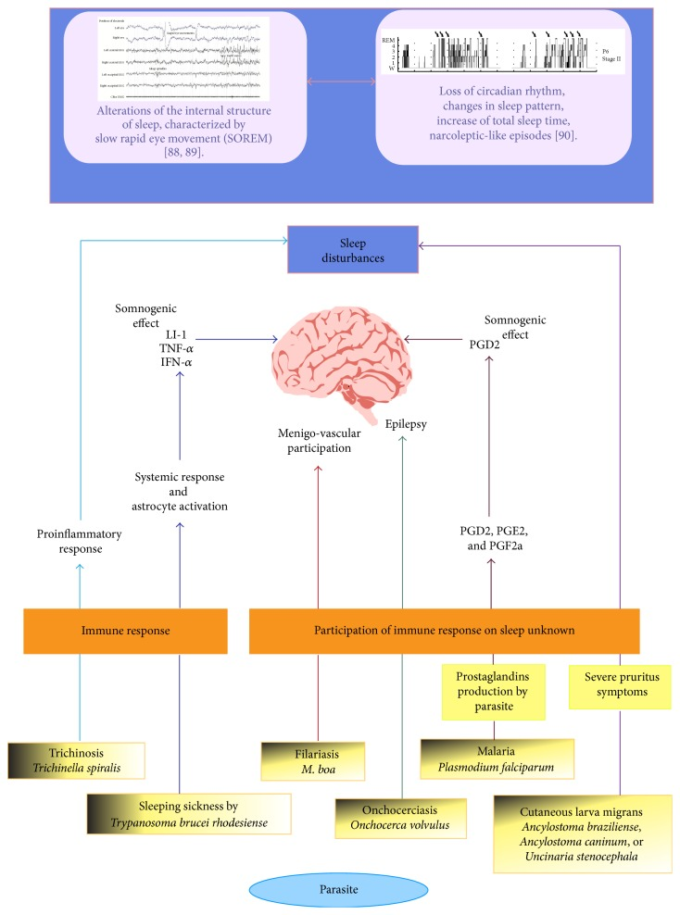
寄生虫によって引き起こされる睡眠障害には、総睡眠時間や各段階(覚醒期、睡眠段階1・2,徐波睡眠、レム睡眠)の持続時間などの睡眠パターンの変化がある。その他の障害としては、入眠時や睡眠段階間の睡眠覚醒遷移の変化、脳波障害などが挙げられる。トリパノソーマ症やトリキノーシスなどの寄生虫感染症の障害には、免疫系の要素が含まれている。プロスタグランジンPGD2,PGE2,PGF2aはこれらの感染症によって誘導され、PGDは体液性物質であることから、これらの寄生虫による睡眠への影響が説明できる。寄生虫による睡眠障害は、寄生虫の感染とライフサイクルの完了を促進するために、特定の行動を修正することができる。
6. おわりに
ここ数十年の間に、神経内分泌系と免疫系の存在と相互作用について多くの実験的・臨床的証拠が得られた。このコミュニケーションネットワークは、特に感染症などの刺激に反応する必要がある場合に、生体の恒常性を維持することを可能にする。感染症にかかると、体は病原体を排除するために代謝機能の多くを変化させなければならない。例えば、エネルギーのほとんどを免疫系に費やし、体の残りの部分への入力を少なくしなければならない。
しかし、このような変化のメカニズムは完全には解明されておらず、特に睡眠と免疫反応の脳内メカニズムは明らかになっていない。一般的には、免疫調節物質(サイトカイン)の影響と睡眠メカニズム、その結果としての睡眠覚醒サイクルの変化、免疫反応中の睡眠調節における神経伝達物質の影響などから、これらのプロセスは関連していると考えられている。ある種のサイトカインは睡眠メカニズムに影響を与える。例えば、IL-1βをウサギに静脈内または脳室内に投与すると、NREM睡眠時間が60%から70%増加する。TNF-αやIFN-αを投与しても同様の効果があり、IL-1が介在しているのではないかと考えられている。IL-1受容体は脳のさまざまな構造に発現しており、IL-1に対して免疫反応性の視床下部ニューロンが存在する。IL-1のセロトニン作動系に対する作用と合わせて考えると、サイトカインが睡眠を促進する仕組みを説明できるかもしれない。
さらに、睡眠が免疫系の細胞や調節因子を調節するという仮説を裏付ける証拠がある。戦場のような状況下で77時間睡眠を奪われた女性は、IFNの産生や食細胞の活性に変化が見られたという。その後の研究では、睡眠不足がリンパ球の出芽やNK細胞の活性を低下させ、IL-1やIL-2をアップレギュレートすることが報告されている。さらに、64時間の睡眠不足に陥った若者は、NK細胞、顆粒球、単球が大幅に増加している。他にも、レム睡眠を選択的に剥奪する戦略をとったラットを使った研究では、96時間の睡眠剥奪で全身の白血球とIgMのレベルが上昇したことが報告されている。また、剥奪72時間後には、IL-1α、IL1β、IL-6,IL-10,TNF、IL-17Aの血漿レベルの上昇などの変化が認められた。これらの結果から、全睡眠とレム睡眠の剥奪は、炎症プロセスを増加させたり、特定の細胞反応を促進したりするなど、免疫系の変調を伴うことが示唆された。
逆に、免疫反応は睡眠パターンの変化に影響を与える。睡眠パターンの変化のメカニズムには、調節因子や免疫系の自然成分が関与している可能性がある。これらの相互作用から、これらのプロセス(睡眠と免疫反応)の関係は、ホメオスタシスを維持し、寄生虫を撃退するために重要であると考えられる。
この仮説に関して、Preston氏らは最近、睡眠が寄生虫の感染から体を守るのに役立っている可能性を調べた。12種の哺乳類において、睡眠時間と寄生虫感染レベルに負の相関関係があることを示し、著者らは、睡眠が動物を寄生虫感染から守るために進化したと結論づけた。
感染によって睡眠パターンがどのように変化するかは、まだ解明されたばかりであり、なぜ病気のときに睡眠が変化するのかは不明である。ある仮説によると、感染時に睡眠が変化するのは、急性期反応の一部であり、サイトカインとその受容体、自然免疫系の受容体が関与するメカニズムによって、病気の回復を促していると考えられる(図4)。
図4 感染症に対する免疫と睡眠の双方向の相互作用
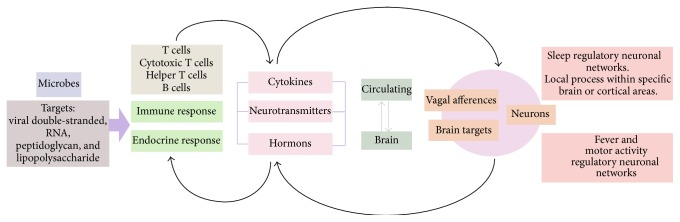
病原体の侵入に対する免疫反応と、それに伴うインターロイキンやサイトカインなどの免疫メディエーターの分泌には、コルチゾールやエピネフリンの分泌など、内分泌系や神経系の反応が伴う。これらの物質は、血液脳関門を通過して様々な神経構造の受容体に到達したり、迷走神経の入力を受けたりして、恒常性を維持する反応を変調させることができる。この調節は、病原体が感染の確立とライフサイクルの完了を確実にするために利用することもできる。しかし、この一連の出来事には複雑な関係がある。感染症は睡眠などの行動パターンを調節し、そのような一次機能が免疫系や内分泌系の機能を変化させる。例えば、睡眠不足が免疫反応や内分泌反応に及ぼす影響を見ると、睡眠はホメオスタシスの維持に不可欠であり、睡眠がないと生理的な障害が生じ、死に至る可能性もあることがわかる。このように、複雑なシステムを研究して、さまざまな状況における2つ以上の変数の相互作用を明らかにし、このバランスの維持に関与するメカニズムを明らかにする必要がある。
