Contents
- 基礎研究
- COVID-19 ワクチン接種後の血栓性血小板減少症 メカニズムの解明に向けて
- SARS-CoV-2スパイクタンパク質とアミロイド形成タンパク質との相互作用:神経変性の潜在的な手がかり
- SARS-CoV-2のスパイクタンパクに注意 目に見えないものが多い
- SARS-CoV-2のS1タンパク質は、マウスの血液脳関門を通過する
- SARS-CoV-2が脳の脈絡叢に感染し、ヒト脳オルガノイドにおける血液-CSFバリアを破壊することについて
- SARS-CoV-2スパイクタンパク質は、ヒト血液脳関門の2次元静的および3次元マイクロ流体インビトロモデルにおける関門機能を変化させる
- SARS-CoV-2スパイク蛋白質を介した肺血管細胞の細胞シグナル伝達について
- SARS-CoV-2由来の受容体結合ドメインを含むスパイク糖タンパク質S1サブユニットによる細胞内Perforin発現の用量依存的な異常抑制作用
- SARS-CoV-2と血液脳関門との相互作用
- SARS-CoV-2スパイクタンパク質は、ACE 2のダウンレギュレーションを介して内皮機能を低下させる
- “Vaccine-Induced Covid-19 Mimicry” Syndrome:
- SARS-CoV-2ワクチン:光と影
- SARS-CoV-2 Spikeタンパク質は、CD147-受容体を介したシグナル伝達によりヒト心筋周皮細胞の機能を破壊する:COVID-19微小血管疾患の潜在的な非感染性メカニズム
- SARS-nCoV-2のS2サブユニットは、腫瘍抑制タンパク質p53およびBRCAと相互作用する:インシリコ研究
- 臨床研究・他
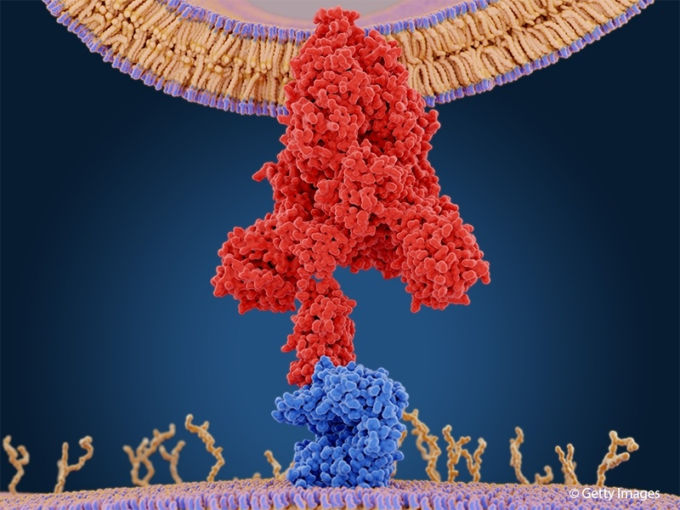
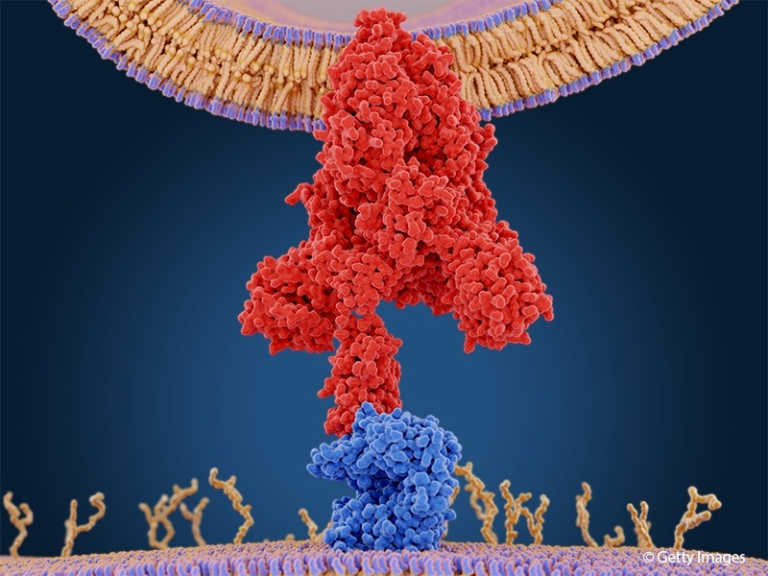
基礎研究
www.cas.org/ja/resource/blog/covid-19-spike-protein
COVID-19 ワクチン接種後の血栓性血小板減少症 メカニズムの解明に向けて
www.ncbi.nlm.nih.gov/pmc/articles/PMC8227748/
抗SARS-Cov-2スパイク蛋白質抗体の血小板因子4との交差反応性
交差反応は,ある特定の抗原に対する抗体が,他の抗原のエピトープをうまく認識する場合に生じる[67].例えば,SARS-CoV-1感染後に産生された抗ヌクレオカプシド抗体は,骨髄間質細胞由来の抗炎症性サイトカインであるインターロイキン11と交差反応する可能性がある[68].また、抗SARS-CoV-2スパイク抗体とさまざまな組織タンパク質との交差反応の可能性も指摘されており、トランスグルタミナーゼ3,トランスグルタミナーゼ2,ミエリン塩基性タンパク質、ミトコンドリア、核抗原、α-ミオシン、甲状腺ペルオキシダーゼ、コラーゲン、クローディン5+6,S100Bなどが網羅されている[69]。このことから,スパイクタンパク質に対する抗体がPF4と交差反応するのではないかという疑問が生じる。しかし、そのようなメカニズムは疑問である。そうでなければ、ワクチンのロールアウトに先立って、回復期の患者における血栓性血小板減少症の増加が報告されるべきである。COVID-19から出現した血栓塞栓症イベントが突然の悪化や死亡の背景にあることは事実であるが、それらはSARS-CoV-2やスパイクタンパクの結合するアンジオテンシン変換酵素2(ACE2)受容体による直接的な血小板刺激や、サイトカインストームによる内皮障害から生じることが提唱されている[70,71]。
最近、抗SARS-CoV-2スパイクタンパク質抗体とPF4との潜在的な交差反応性が調査された[72]。予測ツールと3Dモデリングを用いて示されたように,スパイクタンパク質配列の3つのモチーフがPF4と免疫原性エピトープの可能性を共有していたが,血栓性血小板減少症を発症したAZD1222を接種した人の血清サンプルから採取した精製組換えスパイクタンパク質,精製PF4,およびアフィニティ精製した抗PF4抗体を用いた実験では,交差反応性の証拠は見つかりなかった[72].この報告は、SARS-CoV-2のスパイクタンパク質が、ワクチンの最適な免疫学的標的であり続けることを確信させるものである。
しかし、両mRNAワクチン(BNT162b2とmRNA-1273)Ad26.COV2ベクターワクチン、AZD1222にコードされているスパイクタンパクの特徴的な違いに注意する必要がある。いずれの場合もスパイクタンパク質のプレフュージョン構造をコードする配列が送達されるが、前者3つのワクチンは、受容体結合ドメインの安定化した「アップ」状態を利用している[73,74,75]。これとは逆に,AZD1222は安定化していないプリフュージョンコンフォメーションをコードするChAdOx1アデノウイルスベクターを使用しており,U2OS細胞で実験的に示されたように,その表面上のスパイクタンパク質の大部分はプリフュージョンコンフォメーションで提示されていた。また,U2OS細胞で実験したところ,細胞表面のスパイクタンパク質の大部分はプレフュージョン構造をとっていた。このことが、体液性反応や潜在的な交差反応に何らかの役割を果たしているかどうかは、まだ検証されていない。
スパイクタンパク質と血小板の相互作用
重度のCOVID-19は、しばしば凝固性亢進状態や血栓症を伴う。患者は、血小板の一次産生が低下し、循環血小板の破壊が亢進して血小板減少症に陥るとともに、内皮症が補体系を活性化し、炎症性サイトカインの放出に寄与する。これらすべてが、肺、肝臓、心臓、脳、腎臓などの様々な臓器で血液凝固を引き起こす可能性がある[83,84]。注目すべきは、他の多くのウイルス(例:インフルエンザウイルス)と同様に、SARS-CoV-2も血小板を直接活性化し、その後、制御不能な凝固カスケードと組織傷害を引き起こすことが明らかになっている点である。これは,宿主の受容体であるACE2と,スパイクタンパク質をS2′部位でタンパク質分解的に切断する膜貫通型プロテアーゼセリン2(TMPRSS2)を強固に発現しているためである[70,85].SARS-CoV-2は,ADP,コラーゲン,トロンビンに反応して血小板凝集を増強することが示されているが,さらに重要なことに,精製したスパイクタンパクの存在下でも同様の効果が認められた。さらに、スパイクタンパク質は、アゴニストの非存在下で、インテグリンαIIbβ3の活性化とP-セレクチンの発現を誘導することがわかった[70]。このことは、スパイクタンパクと血小板表面のACE2との相互作用が、血栓防止機能を増強するのに十分であることを明確に示している。したがって,この発見は,ベクターワクチンやmRNAワクチンの接種後に産生されたスパイクタンパクが,自由な形で分泌され,血液中に存在し,おそらく同様の方法で血小板と相互作用することができるのか(どの程度の頻度で存在するのか)という疑問を引き起こす。ベクターワクチンやmRNAワクチンの接種後、スパイクタンパクが産生されると、さらに抗原ペプチドに分解され、主要組織適合性複合体(MHC)I経路を介して細胞傷害性Tリンパ球に提示されるが、放出されて樹状細胞に取り込まれ、さらにMHC II経路を介してヘルパーT細胞やB細胞に提示される可能性もある[86]。したがって、スパイクタンパクの散発的な脱落やその輸送が起こりうることは否定できない。これが本当にそうなのか、また、これが血小板との相互作用につながるのかどうかを理解するためには、血液サンプル中のスパイク・プロテインの含有量を測定する調査が必要である。
スパイクタンパク質の血小板への発現
また、アデノウイルスベクターの血小板への散発的な感染も、現時点では否定できない。血小板はCARや唾液を発現しており,アデノウイルスの細胞侵入に利用される可能性があることから,これは妥当なことである。すでに述べたように,ChAdOx1アデノウイルスベクターが投与部位外の心臓,肝臓,リンパ節,卵巣,精巣にまで移動することは,ほとんど認められていない(study 0841MV38.001)[66]。しかし,アデノウイルスベクターを感染させた血小板は,無核状態で存在し,DNAの転写ができないため,スパイクタンパクを発現しない[87].その代わり、骨髄に存在する血小板前駆体である巨核球では、RNAの転写生産が可能であるため、スパイクタンパクの発現が可能であると考えられる[88]。このような可能性は,ヒト末梢血単核細胞から成熟した巨核球を分離,増殖,分化させることができるので,試験管内試験で調べることができる[89].これらの細胞にアデノウイルスベクターを感染させ、スパイクタンパクを発現させることで、免疫反応や血小板減少症が起こるかどうかは、生体内試験でのさらなる研究が必要である。mRNA ワクチンは、エンドサイトーシスを介して血小板に輸送される可能性もある。BNT162b2の生体内分布研究では、スパイクタンパクが肝臓で低レベルかつ一過性に発現しうることが明らかになっている(研究R-20-0072)[90]。したがって、血小板(および巨核球)がCOVID-19ベクターおよび/またはmRNAワクチンの標的細胞として機能し、スパイクタンパク質の合成やMHC Iの文脈での提示[91]、CD8+細胞による細胞傷害性反応の誘発につながるかどうかは、今後の研究課題である。
SARS-CoV-2スパイクタンパク質とアミロイド形成タンパク質との相互作用:神経変性の潜在的な手がかり
pubmed.ncbi.nlm.nih.gov/33789211/
今回の結果は、SARS-CoV-2のスパイクタンパク質が、ヘパリン結合性のアミロイド形成タンパク質と相互作用するという仮説を支持するものである。この結果は、S1タンパク質がこれらの凝集しやすいタンパク質と安定して結合していることを示しており、これが脳タンパク質の凝集を開始し、神経変性を促進する可能性がある。これらの結果は、COVID-19に関連する神経学的障害の可能性を説明するものである。したがって、SARS-CoV-2スパイクタンパク質と脳内タンパク質との相互作用を標的とすることは、COVID-19患者の凝集プロセス、ひいては神経変性を抑制する適切な方法であると考えられる。
SARS-CoV-2のスパイクタンパクに注意 目に見えないものが多い
pubmed.ncbi.nlm.nih.gov/34100279/
ある論文では、感染者の血液中の特定の抗体がスパイクタンパクの形状を変化させ、細胞に結合しやすくしているようだと報告しており、また別の論文では、コロナウイルスに含まれないスパイクタンパク単体が内皮細胞を傷つけ、血液脳関門を破壊することを示している。これらの知見は、SARS-CoV-2に感染した人の50%もが罹患する可能性のあるlong-COVID症候群の病態にさらに関連していると考えられる。
SARS-CoV-2のS1タンパク質は、マウスの血液脳関門を通過する
pubmed.ncbi.nlm.nih.gov/33328624/
我々は、静脈内に注射した放射性ヨウ素化S1(I-S1)が雄マウスの血液脳関門を容易に通過し、脳領域に取り込まれ、実質的な脳空間に入ることを示した。また、I-S1は肺、脾臓、腎臓、肝臓にも取り込まれた。経鼻投与されたI-S1も、静脈内投与に比べて約10倍低いレベルではあるが、脳内に入った。APOE遺伝子型と性別は、全脳のI-S1取り込みには影響しなかったが、嗅球、肝臓、脾臓、腎臓での取り込みには様々な影響が見られた。海馬と嗅球におけるI-S1の取り込みは、リポポリサッカライドによる炎症によって減少した。メカニズムの研究から、I-S1は吸着性のトランスサイトーシスによって血液脳関門を通過すること、マウスのアンジオテンシン変換酵素2が脳と肺の取り込みに関与するが、腎臓、肝臓、脾臓の取り込みには関与しないことが示された。
SARS-CoV-2が脳の脈絡叢に感染し、ヒト脳オルガノイドにおける血液-CSFバリアを破壊することについて
pubmed.ncbi.nlm.nih.gov/33113348/
SARS-CoV-2スパイクタンパク質は、ヒト血液脳関門の2次元静的および3次元マイクロ流体インビトロモデルにおける関門機能を変化させる
pubmed.ncbi.nlm.nih.gov/33053430/
我々の研究では、SARS-CoV-2スパイクタンパク質だけでも内皮機能障害を強力に誘導することを示し、COVID-19ショック症候群の小児における症状は、少なくとも部分的にはその作用に起因することを示した。したがって、臨床的に観察される浮腫は、透過性の高い内皮バリアに起因するものであり、全身性のびまん性炎症亢進は、内皮における炎症性サイトカインの分泌上昇に起因すると考えられる。これらの知見は、治療的介入のための2つの重要な概念を提供する。1)血管床の脆弱性を高める既存の疾患を持つCOVID-19患者の内皮を安定させること、2)内皮細胞へのウイルスの生産的な感染は、内皮機能障害の絶対的な要件ではなく、ウイルスタンパク質の排出の結果としても起こりうること、である。
多くの全身性ウイルス感染の過程で、排出されたウイルスタンパク質はBBB機能障害の強力な誘導因子であるため、我々は必須のSARS-CoV-2スパイクタンパク質の脳内皮細胞への影響を評価した。SARS-CoV-2スパイクタンパク質の内皮細胞に対する細胞毒性を調べたところ、SARS-CoV-2スパイクタンパク質の慢性的な暴露(72時間以上)によってのみ、細胞死の割合がわずかに増加することがわかった。これらの知見は、COVID-19の重症例における内皮細胞死を報告した最近の臨床データを拡張するものである(Vargaら、2020年)。しかし、血管床を形成・維持している他の細胞(周皮細胞、血管周囲の免疫細胞、実質細胞など)がSARS-CoV-2スパイクタンパクの細胞毒性に影響を受けている可能性も否定できない。
本研究では、スパイクタンパク質がMMP3とMMP12、そしてより少ない範囲でMMP2とMMP9の遺伝子発現を増加させることを報告している。MMP3は、タイトジャンクションタンパク質を消化してBBBを開くことで、外傷性脳損傷に関与していることが知られている(Yang and Rosenberg, 2011)。これらの報告は、私たちが発見したバリアー抵抗性の低下(図3)と走化性ケモカインの分泌増加(図5)を裏付けるものである。一方、MMP12は、BBBの損傷には関与していないが、免疫細胞の脳内への浸潤や移動に関与している(Ulrich et al. MMP3、CCL5、CXCL10、CAMの上昇というデータを総合すると、SARS-CoV-2は、感染した免疫細胞が「トロイの木馬」として脳実質に移動するのを促進する装置を起動する、神経侵襲性の可能性のあるウイルスであると推測することができる。
SARS-CoV-2のスパイクタンパク質がBBBに及ぼす影響を調べた報告は、我々の知る限り初めてである。今回の結果は、この新型コロナウイルスが内皮での反応を引き起こすという継続的なテーマについての洞察を与えるものである。具体的には、脳内皮に関して、SARS-CoV-2スパイクタンパク質はBBBの不安定化を誘導し、炎症状態を促進したが、急性期の細胞生存率には影響を与えなかったようである。COVID-19で観察された神経学的合併症は、このバリアーの機能不全が原因であると考えられている。最後に、BBBの開放は、SARS-CoV-2の病原体が神経侵入するための可能性を示唆している。
今回の報告では、SARS-CoV-2ウイルスのスパイクタンパク質が、初代ヒト脳微小血管内皮細胞(hBMVEC)に及ぼす悪影響が観察されるかどうかを調べた。スパイクタンパク質は,受容体認識に重要な役割を果たしており,受容体結合ドメイン(RBD)を含むS1サブユニットとS2サブユニットで形成されている。まず、死後の脳組織を用いて、アンジオテンシン変換酵素2(ACE2)(SARS-CoV-2スパイクタンパク質の既知の結合標的)が、前頭葉皮質のさまざまな血管径に遍在的に発現していることを示した。さらに、高血圧症や認知症の症例では、ACE2の発現が上昇していた。また、ACE2は、細胞培養条件下で維持された初代hBMVECにおいても検出された。細胞の生存率を解析したところ、S1、S2、RBDのみを含むS1のトランケート型のいずれも、48時間の曝露時間内ではhBMVECの生存率に最小限の影響しか及ぼさないことがわかった。また、血液脳関門(BBB)のinvitroモデルにスパイクタンパクを導入すると、関門の特性に大きな変化が見られた。今回の発見の鍵は、ヒトのBBBの高度な3Dマイクロ流体モデルにおいて、S1がバリアーの完全性の喪失を促進することを示したことである。このプラットフォームは、CNSのインターフェースにおける生理学的条件により近い。また、SARS-CoV-2のスパイクタンパク質は、脳内皮細胞に炎症反応を引き起こし、BBBの機能低下に関与している可能性が示唆された。これらの結果は、SARS-CoV-2スパイクタンパク質が脳内皮細胞に直接影響を与える可能性を示した初めての例であり、COVID-19患者に見られる神経学的な影響をもっともらしく説明するものである。
SARS-CoV-2スパイク蛋白質を介した肺血管細胞の細胞シグナル伝達について
pubmed.ncbi.nlm.nih.gov/33232769/
このように、SARS-CoV-2スパイクタンパク質を介した細胞シグナル伝達は、単に膜表面タンパク質に何かが結合すると細胞が反応するのではなく、成長因子/ホルモン様の特異的な細胞シグナル伝達イベントであり、RBDや細胞シグナル伝達を促進する他のタンパク質領域によってうまく調整されていることを提案する。図3で説明した我々のACE2抗体実験は、ACE2の関与を裏付けるものである。しかし、ACE2抗体とACE2の結合は、MEKの活性化を引き起こすのに十分であると思われる。ACE2抗体がRBDとACE2の結合をブロックして妨害したと解釈しているが、ACE2抗体を介した細胞シグナルが、その後のスパイクタンパクを介したMEKを活性化する作用を鈍らせた可能性もある。このように、SARS-CoV-2のスパイクタンパクを介する細胞シグナルは、ACE2以外の受容体を介して起こる可能性がある。
おわりに
ヒト肺動脈平滑筋および内皮細胞における我々の結果から、SARS-CoV-2スパイクタンパク質S1サブユニットは、SARS-CoV-2ウイルス粒子の残りの部分が参加していなくても、ヒト宿主細胞において生物学的反応を引き起こすのに十分であることが明らかになった。また、COVID-19患者では肺血管壁が肥厚していることもわかった。我々は、COVID-19で見られる心血管や肺の有害な結果には、SARS-CoV-2スパイクタンパク質を介した細胞増殖シグナルが関与していると提案する。このメカニズムは、SARS-CoV-2感染症やCOVID-19に対抗する新たな治療標的を提供する可能性がある。
SARS-CoV-2由来の受容体結合ドメインを含むスパイク糖タンパク質S1サブユニットによる細胞内Perforin発現の用量依存的な異常抑制作用
pubmed.ncbi.nlm.nih.gov/34203929/
S1サブユニット(特にRBD)が細胞内のパーフォリン発現を低下させるメカニズムはまだ不明である。エプスタインバーウイルス(EBV)や鳥インフルエンザ(H5N1)ウイルスなど、いくつかのウイルス感染症では、パーフォリン構造の異常やパーフォリンの活性化の阻害により、CD8+T細胞のパーフォリン発現が低下したり、パーフォリンの機能が低下したりすることが示されている[12,35]。今後の研究では、グランザイムの量を測定したり、パーフォリンのmRNAレベルを評価したり、miRNAの役割を調べたりすることで、可能性のあるメカニズムを解明することができるかもしれない。
以上、今回の試験管内試験 DC-Tモデルのデータから、SARS-CoV-2由来のスパイク糖タンパク質の受容体結合ドメイン(RBD)含有S1サブユニットが、CD8+ T細胞の細胞内パーフォリンの発現を抑制し、スパイク提示細胞を殺す細胞傷害能を用量依存的に低下させるのではないかという仮説を立ててみた。また、抗原提示の持続は、CD8+T細胞の過剰な活動を引き起こし、その後の炎症性サイトカインの過剰生産を開始する可能性がある。したがって、CSSは実際には、SARS-CoV-2の大量のウイルスまたは高度に複製された株を前にしたCD8+ CTLの不足を反映している可能性がある。この結果は、組換えスパイクタンパク質を応用したワクチンの開発において、投与量の選択に影響を与える可能性がある[36]
pubmed.ncbi.nlm.nih.gov/33784827/
SARS-CoV-2と血液脳関門との相互作用
www.ncbi.nlm.nih.gov/pmc/articles/PMC7961671/
3. SARS-CoV-2感染症におけるBBB機能低下のメカニズム
3.1. SARS-CoV-2と脳内皮細胞およびNVUの他の構成要素との直接的な相互作用
前節で述べたように、SARS-CoV-2が脳内皮細胞に感染する可能性を示唆する証拠があり、SARS-CoV-2やその成分がBBBに感染したり、その他の直接的な相互作用を受けて、BBBの機能障害が起こる可能性がある。SARS-CoV-2が媒介する脳内皮機能障害のいくつかの側面を図1に示した。現在、SARS-CoV-2の感染が確認されている唯一のNVU構成要素は神経細胞であり、神経細胞の感染は神経変性や神経血管のリモデリングと関連している[61]。SARS-CoV-2が、内皮以外のNVU構成要素に感染したり、結合したり、機能を直接変化させたりするかどうかは、まだ明らかになっていない。ヒトの初代in vitro BBBモデルを用いた最近の研究では、S1、S2、受容体結合ドメインを含むSARS-CoV-2スパイクタンパク質の構成要素は、毒性がなくてもすべてBBB漏出を引き起こすことが示されている[71]。BBBリークの誘発は、S1およびS2のグリコシル化および非グリコシル化されたフォームに反応して起こった[71]。ACE2を過剰発現させた初代ヒト内皮細胞にSARS-CoV-2を感染させると,凝固因子,接着分子,炎症性サイトカインの過剰発現,多核合胞体の形成,内皮細胞の溶解などが誘導された[57].これらのデータを総合すると、SARS-CoV-2の感染とウイルスタンパク質との接触が、脳内皮の機能障害や損傷の原因になっている可能性が示唆される。
4.8. SARS-CoV-2の脳への侵入メカニズム
現在のところ、SARS-CoV-2が中枢神経系に侵入するメカニズムに関する研究は行われていない。しかし、S1 VAPがマウスのBBBを通過する能力についての研究[162]や、生産的な感染を誘導した後にマウスの脳内に生きたウイルスが出現することについての少なくとも3つの研究[61,66,70]、また、前のセクションで述べたように、脳への侵入や感染が起こりうることを示唆するヒトの脳組織やCSFの分析結果がある。これらの研究は、SARS-CoV-2に適用される可能性の高い、一般的なウイルスの脳への侵入の原則を適用する際の指針となる。
SARS-CoV-2を鼻腔内に投与すると、脳内に出現する[61,66]。この研究は、ウイルスが中枢神経系に侵入できることを明確に証明しているが、ウイルスが嗅球や三叉神経に取り込まれるのか、鼻翼を経由して血流に吸収されるのか、あるいは肺に吸引されて生産性の高い感染が血行性の拡散によって脳に広がるのかは、証明されていない。別の研究では、SARS-CoV-2を感染させたシリアのハムスターでは、嗅球の上皮が免疫細胞の浸潤により大量に損傷していたが、嗅球自体には感染が見られなかった[163]。S1を用いた研究[162]では、鼻腔内投与後に脳に入るS1の量は、篩板(しばん)のレベルで非常に少なく、血液中への侵入はさらに少ないことがわかった。対照的に、血液から脳への移行ははるかに確実であった。これらの結果は、鼻から脳への直接的な拡散は、血液から脳への輸送よりもマイナーなルートである可能性が高いと考えられる。
ACE2は、SARS-CoV-2の脳関門や中枢神経系組織を含むすべての組織への取り込みに支配的な役割を果たしていると考えられている。しかし、いくつかの研究では、S1がbasigin、cyclophilins、dipeptidyl peptidase-4,GRP78などの他の糖タンパク質を受容体または共受容体として利用していることを示す様々なタイプの結果が発表されている[164,165,166]。S1の研究[162]では、S1の脳内への取り込みが役割を果たしていることが示唆されたが、他の結合部位も役割を果たしている可能性が示唆された。一方、ACE2は、肺への取り込みに大きな役割を果たしていたが、他の組織への取り込みにはほとんど、あるいは全く役割を果たしていなかったことから、他の結合部位が取り込みに重要である可能性が示唆された。現時点では、脳への取り込みにはACE2が重要であるが、唯一の結合部位ではないのではないかと解釈している。S1の結果から、ACE2は肺への取り込みに大きく関与していると考えられるが、他の組織でのウイルスの取り込みには他の結合部位が重要である可能性がある。
S1研究[162]で使用された実験デザインを考えると、血管BBBが脳への侵入部位である可能性が高い。ACE2は脈絡叢を構成する上皮細胞に発現しており、SARS-CoV-2は試験管内試験でこれらの細胞に感染することができる[167]。このことから、ウイルスは血管BBBと脈絡叢の両方で脳に侵入すると考えられる。
Songらの感染研究では、脳内の細胞浸潤はほとんど見られなかった[61]。S1の実験デザインを考えると、S1の侵入には免疫細胞を介した輸送は関与していないと考えられる。これらの知見に基づく最良の結論は、SARS-CoV-2は遊離ウイルスとして侵入することができるが、感染した免疫細胞を介して侵入することについては、さらなる研究が必要であるということである。
炎症はCOVID-19の重要な特徴であり、BBBのパラセルラーおよびトランスセルラーの両方の破壊をもたらす大きさであると考えられる。S1の研究[162]では、自然免疫系の活性化は、吸着性のトランスサイトーシスによるS1の侵入を促進しなかったが、BBBの破壊によるS1の侵入は、おそらく超細胞的な経路を介して促進された。これらの侵入経路の可能性と、病態下での変化をまとめたものが図2に示されている。SARS-CoV-2の脳内感染のメカニズムに炎症がどのように関与しているかについては、現在のところあまり詳しい情報はないが、向神経性状態にあるSARS-CoV-2感染の動物モデルでは、全身および神経の両方に炎症が見られるため[61,66,168]、今後の研究では、抗炎症性の介入がSARS-CoV-2の神経侵入を抑制するかどうかを評価することができるだろう。また、SARS-CoV-2の構造タンパク質成分を持つ非複製性の疑似ウイルスは、炎症をブロックすることによっても影響を受ける可能性のある全身のウイルス負荷の違いなどの交絡がない場合に、炎症によって制御されるウイルス侵入をより効果的に研究するためのツールとして使用することができる。以上のことから、S1タンパク質は明らかにBBBを通過することができ、SARS-CoV-2も吸着性トランシトーシスに似た小胞メカニズムを利用して通過する可能性があることが、これまでの最も優れた証拠によって示唆されている。
5.2. アポリポ蛋白質E
特にSARS-CoV-2に関連して、SARS-CoV-2の取り込みに主に関与していることが示唆されている受容体であるアンジオテンシン変換酵素2(ACE2)がApoEと相互作用することが計算機上で示唆されている[192]。さらに、S1タンパク質のC末端は、ニューロピリン-1(NRP1)およびNRP1受容体と直接結合することが示されている[46]。APOE対立遺伝子の違いがこれらの相互作用に影響するかどうかは現在のところ不明である。
我々は最近、マウスのS1 BBB輸送に対するApoE遺伝子型と性別の影響を調べた[162]。APOE遺伝子型は、S1の肝臓、脾臓、腎臓への輸送に影響し、ApoE4では輸送速度が遅くなる。雄のApoE3マウスでは、S1の輸送は嗅球で最も多い。脳全体への輸送速度には差がなかった。これらの結果から、一部の組織でS1の取り込みが亢進していることがCOVID-19のリスク上昇に寄与していると考えられる。ウイルス感染に対するApoEの影響についてはこれまでにもエビデンスがあるが、APOEの遺伝子型とCOVID-19の重症度を結びつける生物学的メカニズムを理解するためには、さらなる調査が必要である。
SARS-CoV-2スパイクタンパク質は、ACE 2のダウンレギュレーションを介して内皮機能を低下させる
pubmed.ncbi.nlm.nih.gov/33784827/
SARS-CoV-2(重症急性呼吸器症候群コロナウイルス2)の感染は、Sタンパク質(スパイク糖タンパク質)が宿主細胞内のACE(アンジオテンシン変換酵素)2と結合することに依存している。血管内皮がSARS-CoV-2に感染すると1、ミトコンドリアの活性酸素産生と解糖系シフトが誘発される2。逆説的だが、ACE2は循環器系で保護的な働きをしており、SARS-CoV-1のSタンパク質は、感染した肺のACE2レベルを低下させることで肺傷害を促進する3。今回の研究では、Sタンパク質が単独でACE2を低下させ、その結果、ミトコンドリア機能を阻害することで、血管内皮細胞(EC)にダメージを与えることを明らかにした。
我々は、Sタンパク質を発現するシュードウイルス(Pseu-Spike)をシリアン・ハムスターに気管内投与した。Pseu-Spikeを投与した動物では、肺胞隔壁の肥厚や単核細胞の浸潤の増加など、肺の損傷が明らかになった
このような内皮におけるpACE2、ACE2、MDM2の発現およびAMPK活性の変化は、Pseu-Spikeを感染させた肺動脈ECを用いたin vitro実験でも再現され、活性酸素種抑制剤であるN-アセチル-L-システインで処理することで回復した
今回の研究では、非感染性のシュードウイルスを使用したことが制限となったが、今回のデータは、Sタンパク質が単独で内皮に損傷を与え、ミトコンドリア機能とeNOS活性が低下し、解糖が増加することを示している。これらの知見は、今後、SARS-CoV-2ウイルスを用いて確認する必要があるが、Sタンパク質によってACE2が減少すると、ウイルスの感染力が低下し、それによって内皮が保護されるというのは逆説的に思える。しかし、ACE2の低下によるレニン・アンジオテンシン系の調節不全は、内皮の機能障害を悪化させ、内皮炎を引き起こす可能性がある。これらの結果を総合すると、Sタンパク質によるEC損傷は、ウイルスの感染力低下に勝ることが示唆される。この結果は、Sタンパク質に対するワクチン生成抗体や外因性抗体は、SARS-CoV-2の感染力から宿主を保護するだけでなく、Sタンパク質が引き起こす内皮傷害を抑制することを示唆している。
“Vaccine-Induced Covid-19 Mimicry” Syndrome:
SARS-CoV-2 Spikeオープンリーディングフレーム内のスプライス反応により、ベクターベースのワクチンで免疫された患者に血栓塞栓症を引き起こす可能性のあるSpikeタンパク質バリアントが生じる
我々の結果によると、野生型およびコドンを最適化したSpikeオープンリーディングフレームの転写は、C末端が切断された可溶性Spikeタンパク質変種につながる代替スプライシングイベントを可能にする。これらの可溶性Spikeタンパク質は、ACE2を発現している血管内皮細胞に結合すると、重篤な副作用を引き起こす可能性がある。SARS-CoV-2ウイルスがコードするSpikeタンパク質が引き起こす血栓塞栓症に類似していることから、我々はこの疾患メカニズムを「Vaccine-Induced COVID-19 Mimicry」症候群(VIC19M症候群)と名付けた。
www.researchsquare.com/article/rs-558954/v1
SARS-CoV-2ワクチン:光と影
pubmed.ncbi.nlm.nih.gov/33966930/
フリーフローティングSpikeタンパク質とACE2の相互作用
ワクチンを接種した細胞が死滅したり、免疫系によって破壊されたりすると、その残骸から大量のSpikeタンパク質やタンパク質断片(Free-floating Spikeタンパク質)が放出されることがある。
SARS-CoV-2は、ACE2をトロイの木馬に見立てて標的細胞に侵入することがよく知られている。したがって、自由に浮遊するスパイクタンパク質と他の細胞のACE2との相互作用は、極めて妥当なメカニズムである。最近、アデノウイルス・ベクター・ワクチンで実証されたように、ワクチン接種によって生成されるSpikeタンパク質は、SARS-CoV-2 Spikeタンパク質の受容体結合機能とプレフュージョン構造をネイティブに模倣している[41]。
ワクチンによって産生されたSpikeタンパク質のネイティブに近い構造は、ACE2と相互作用し、ACE2の内在化と分解を促進する可能性があります[42]。なお、このような現象は、血小板でも観察されています[43]。Zhangと共同研究者は、SARS-CoV-2が血小板中のACE2レベルを時間依存的に減少させることを発見し、ACE2活性化時にACE2が分解されることを示しました[43]。Spikeタンパク質は,用量依存的に血小板凝集とアデノシン三リン酸(ATP)放出の増強を誘導する[43]。Spikeタンパク質のサブユニット1は血小板のACE2に結合し,それによって血小板凝集が引き起こされる
ACE2と浮遊するSpikeタンパク質との相互作用による血小板への影響
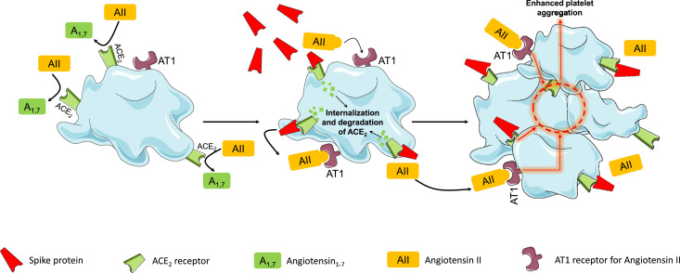
ACE2とSARS-CoV-2 Spikeタンパク質との相互作用を媒介として、細胞膜の外部部位からACE2受容体活性が失われると、アンジオテンシンIIの不活性化が少なくなり、アンチテンシン1-7の生成が少なくなる[44, 45]。アンジオテンシンIIの過剰活性とアンチテンシン1-7の不足のバランスが崩れると、炎症、血栓症、その他の副作用が引き起こされる可能性がある(図1)[44, 45]。このような背景から、浮遊するスパイクタンパク質とACE2の相互作用がこのようなバランスの崩れを助長し、ワクチン接種後の潜在的な有害事象に影響を与えるかどうかは明らかではない(図1)。
結論
SARS-CoV-2ワクチン接種は、現在のパンデミックの局面を脱する機会を提供している。十分な中和反応を誘発するワクチンは、COVID-19に対する保護を提供できるはずである[46]。しかし、SARS-CoV-2ワクチンにとっては、有効性に加えて安全性も重要な問題である。現在、さまざまなプラットフォームが利用されているが、ほとんどのワクチンには以下のような共通点がある。
- (a) SARS-CoV-2のスパイクタンパク質をコードしていること、
- (b) 感染細胞によって組み立てられたスパイクタンパク質が細胞表面に移動すること、
- (c) 突出したスパイクタンパク質がネイティブに近いコンフォメーションを持ち、免疫系に認識されて免疫反応を起こすこと [41]。
このような背景から、ウイルスベクターワクチンは、サイトカイン、ケモカイン、免疫細胞を介したより強力な自然免疫反応を引き起こすことで、スパイクタンパク質に対する免疫反応をさらに強化する可能性がある[21]。このような免疫反応は、COVID-19の活動性疾患を模倣しているように見える。
MERS-CoVやSARS-CoV-1の感染にさかのぼる以前の研究では、SARS-CoVの全長スパイクタンパクを用いたワクチンが、肺や肝臓などさまざまなレベルで強い免疫炎症反応を引き起こす可能性が示されている[29, [32], [33], [34]。
また、SARS-CoV-2への曝露歴があるために、血清反応陽性の人がSARS-CoV-2 mRNAワクチンを単回接種すると、免疫反応が増強されるという証拠もあり、事態は複雑化している[47]。このような状況の中、Kramerと共同研究者は最近 2020年にスパイクmRNAワクチン(PfizerワクチンまたはModernaワクチン)の初回投与を受けた、SARS-CoV-2の免疫が存在するかしない被験者(血清陰性者67名、血清陽性者43名)の抗体反応を評価した[47]。初回投与後に繰り返しサンプリングを行ったところ,血清陰性の参加者の大半は,ワクチン接種後9~12日以内にSARS-CoV-2免疫グロブリンG(IgG)反応が変動し,比較的低い値を示した。対照的に、初回ワクチン接種前のベースラインでSARS-CoV-2抗体を持っていた参加者は、既存の免疫を持たないワクチン接種者の10~45倍の抗体価を急速に獲得した[47]。さらに、既存の免疫を持たないワクチン接種者の抗体価は、2回目のワクチン接種後に3倍に増加し、2回目のワクチン接種を受けたCOVID-19の生存者には抗体価の増加は認められなかった[47]。注目すべきは、これらの著者は、分析を拡張して、血清陰性の148人と血清陽性の82人の参加者を対象に、1回目のワクチン接種後の疲労、頭痛、悪寒、筋肉痛、発熱、関節痛などの全身反応の頻度を計算したことである。既往の免疫を持つワクチン接種者は、免疫を持たない人に比べて、全身反応の頻度と重症度が高かったのである[47]。
これらの結果は、臨床試験結果の実生活への適用性についての議論を開いている[48]。SARS-CoV-2ワクチンの有効性と安全性を検証した臨床試験[9, 11, 18, 19]では、通常、参加時にSARS-CoV-2感染が陰性であった被験者を対象としている。実際、これらの臨床試験では、SARS-CoV-2感染が新たに陽性となることがエンドポイントとなっていた。臨床試験の結果を現実の世界に適用する場合、SARS-CoV-2に対する既存の免疫を持った様々な国の多数の被験者にワクチンを接種することで、既に免疫を持っていて素因を持っている人に、非常に稀ではあるが、予期せぬ激しい炎症反応や血栓反応が引き起こされる可能性を排除することはできない。
このような反応に関わる基本的なメカニズムについては、さらなる研究が必要である。例えば、これまでワクチンの標的となっていた破壊された細胞から放出された自由に浮遊するスパイクタンパク質は、他の細胞のACE2と相互作用し、ACE2の内在化と分解を促進する可能性がある[42]。このメカニズムは、血小板の凝集を促進する[43]。また、ACE2と浮遊するスパイクタンパク質との相互作用は、ACE2受容体活性の低下を介して、アンジオテンシンII過剰活性と抗オテンシン1-7不足のバランスを崩し、炎症や血栓症などの副反応を引き起こす原因となる可能性がある(図1)。
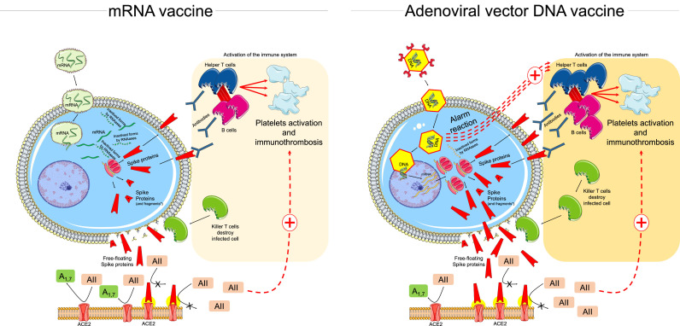
このような背景から、タンパク質工学的手法を用いてウイルス侵入タンパク質の結合分子を同定することは、ACE2とスパイクタンパク質との相互作用による潜在的な有害作用を改善するための代替的な治療戦略となりうる(図3)。
SARS-CoV-2 Spikeタンパク質は、CD147-受容体を介したシグナル伝達によりヒト心筋周皮細胞の機能を破壊する:COVID-19微小血管疾患の潜在的な非感染性メカニズム
www.biorxiv.org/content/10.1101/2020.12.21.423721v2
試験管内試験では、心臓の心臓血管周皮細胞はSARS-CoV-2の感染に対して寛容ではなく、組換えSタンパク質単独では心臓血管周皮細胞の機能変化を引き起こすことが初めて明らかになった。これは、以下のように記録されている。(すなわち、(1)移動の増加、(2)マトリゲル上での内皮細胞(EC)のネットワーク形成能力の低下、(3)サイトカイン・ストームに典型的に関与する炎症性分子の分泌、(4)ECの死因となるプロアポトーシス因子の産生、などである。次に、Sタンパク質の受容体であるアンジオテンシン変換酵素2(ACE2)とCD147に対するブロッキング戦略を採用し、Sタンパク質が心臓血管周皮細胞において、ACE2ではなくCD147の受容体を介して細胞外シグナル調節キナーゼ1/2(ERK1/2)のリン酸化・活性化を促すことを発見した。CD147を中和することにより、Sタンパク質の存在下でERK1/2の活性化が抑えられ、心臓血管周皮細胞の機能が回復した。結論として、今回の発見は、循環するSタンパク質が血管内の心臓血管周皮細胞の機能不全を促し、感染部位から離れた臓器の微小血管障害の確立に寄与する可能性を示唆している。このメカニズムは、臨床的にも治療的にも重要であると考えられる。
臨床的視点
- 重症のCOVID-19は微小血管症候群として現れるが、SARS-CoV-2が心臓の血管周皮細胞(PC)に感染して損傷するかどうかはまだ不明である。
- 我々は、心臓の心臓血管周皮細胞はSARS-CoV-2に感染しないという証拠を示した。その結果、SARS-CoV-2は心臓の血管周皮細胞(心臓血管周皮細胞)には感染しないことが明らかになった。また、SARS-CoV-2のリコンビナントタンパク質が、CD147受容体を介した細胞内シグナルを誘発し、細胞の機能障害や微小血管の破壊を引き起こすことも明らかになった。
- 本研究は、可溶性Sタンパク質が、感染部位から離れた臓器にダメージを伝播し、微小血管障害を促進する可能性を示唆している。患者のCD147受容体をブロックすることで、血管系を感染からだけでなく、Sタンパク質による付随的な損傷からも守ることができるかもしれない。
今回の研究では、ウイルスが血管障害を引き起こすメカニズムについて、新たな知見が得られた。古典的な感染経路では、多機能なSタンパク質が細胞の受容体に結合することで、ウイルスの侵入経路が開かれ、その後、宿主の細胞内機構を操作して細胞の機能障害を引き起こす。しかし、ここでは、少なくともin vitroでは、心臓血管の心臓血管周皮細胞はSARS-CoV-2に感染しないことを示している。これは、英国でのパンデミックの初期に分離されたSARS-CoV-2と、2021年初頭に英国で流行した、より感染力の強いSARS-CoV-2α変異体(B.1.1.7系統)を用いて出現したものである。我々はここに、心臓の心臓血管周皮細胞においてSタンパク質のみによって引き起こされる別の非感染性メカニズムを説明する。この仮説を裏付けるように、我々はCOVID-19患者の血清中に可溶性Sタンパク質を発見した。特に、高齢者や急性期の患者の約33%で、血清中のSタンパク質濃度が上昇していた。細胞性プロテアーゼによってウイルス粒子から切断されたこれらの分子が、呼吸器系から循環系に広がった可能性がある。Sタンパク質が末梢血中に存在するのは、5日から10日の間だけであることから、その後、免疫細胞が産生するブロック抗体によって中和されたと考えられる。この抗体が、ウイルス全体に埋め込まれたSタンパク質も検出した可能性は否定できないが、以前の研究では、急性感染時に採取された血液サンプルのごく一部(~12%)で、ウイルスの感染性を示す閾値以下の低いウイルスRNAコピー数しか検出されなかったことが示されている(41)。 したがって、患者の血清中では、SARS-CoV-2粒子全体よりも、排出されたSタンパク質の方がはるかに多く存在することが示唆される。また,別のグループは,患者の血液中にSタンパク質を同定している(42).我々の測定法では,パンデミック前の対照血清中に検出されたSタンパク質に対する非特異的な陽性反応は,Sタンパク質のいくつかの領域が他のヒトタンパク質と配列相同性があることで説明できるが,これは以前にSARS-CoV-1について説明されたものと同様である(43).この限界を克服するために,我々は対照群の80パーセンタイルよりも高いSタンパク質の濃度のみを生物学的に意味のあるものとみなした.
Sタンパク質を単独で可溶性分子として、あるいは担体と一緒にげっ歯類に投与すると、微小血管の損傷や炎症の誘発を引き起こすことがいくつか報告されている(15, 44-46)。 さらに、可溶性Sタンパク質断片が血液凝固の引き金になる可能性も示唆されている(47, 48)。これらの知見は、Sタンパク質がウイルス粒子全体の存在を超えて、生物学的に重要な役割を果たしていることを裏付けている。さらに,可溶性Sタンパク質は,コロナウイルス全体よりも長く細胞内受容体と結合している可能性があり,その結果,細胞内シグナルが長時間にわたって刺激されることになる。今回のin vitro研究では、Sタンパク質が心臓血管周皮細胞の生物学的特性を変化させることを示すいくつかの知見が得られた。実験に用いたSタンパク質の濃度は、心臓血管周皮細胞のERK1/2を活性化することが知られている他のリガンドの濃度(EGF-0.83nM、bFGF-0.6nM、我々のグループの元データ)と同程度である(31)。 Sタンパク質によって誘導された心臓血管周皮細胞の移動の活性化と、血管新生アッセイにおける心臓血管周皮細胞とCAECの相互協力の阻害は、いずれも心臓血管周皮細胞の表現型の機能不全を示唆している。実際、心臓血管周皮細胞が血管周囲のコンパートメントから切り離されると、毛細血管が不安定になり、病的な血管新生が起こりやすくなり、最終的には希薄化してしまう。一方、Sタンパク質は心臓血管周皮細胞の生存率に影響を与えなかった。SARS-CoV-2は、宿主細胞のメカニズムがなければ複製できない。そのため、Sタンパク質が宿主の受容体と結合した初期段階でウイルスが細胞を死滅させるのは逆効果であると考えられる。興味深いことに、我々の実験では、Sタンパク質が冠状動脈内皮細胞の生存率や血管新生能力を変化させないことから、Sタンパク質の心臓血管周皮細胞に対する特異的な作用が示唆された。また、Sタンパク質は、心臓の心臓血管周皮細胞による炎症性サイトカインの産生を活性化または促進した。MCP1、IL-6、IL-1β、TNFαは、COVID-19患者の呼吸不全と高い死亡率に関連するサイトカイン・ストームの典型的な構成要素である(38, 49)。この炎症性の分泌物は、冠状動脈内皮細胞のアポトーシスに関する実験が示唆するように、周囲の血管細胞に有害なパラクライン効果をもたらす可能性がある。このメカニズムは、ウイルスに直接感染していない細胞集団にも機能的変化を伝播させ、最終的には血管の破壊につながる可能性がある。
結論
今回の研究は、Sタンパク質の断片が、感染とは無関係にCD147を介して血管細胞の機能障害を引き起こす可能性を示唆している。このメカニズムは、細胞や臓器の損傷を感染部位以外にも広げる可能性があり、臨床的にも重要な意味を持つと考えられる。例えば、高血圧、糖尿病、高度肥満などの基礎疾患により内皮バリアーが破壊され、血管透過性が亢進している患者では、Sタンパク質分子は容易に心臓血管周皮細胞コンパートメントに広がり、微小血管障害を引き起こしたり、悪化させたりする可能性がある。CD147受容体をブロックすることで、最も脆弱な患者の血管系を、感染やSタンパク質による副次的な損傷から守ることができるかもしれない。
SARS-nCoV-2のS2サブユニットは、腫瘍抑制タンパク質p53およびBRCAと相互作用する:インシリコ研究
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7324311/
規コロナウイルスのSARS-nCoV-2のS2サブユニットタンパク質と、腫瘍抑制タンパク質であるp53およびBRCA-1/2との相互作用を調べるためにバイオインフォマティクス解析を行った。その結果、S2サブユニット蛋白質と癌抑制蛋白質との相互作用が初めて明らかになった。
p53およびBRCAはよく知られた腫瘍抑制タンパク質であり、多くの細胞ストレスに反応して下流の遺伝子を制御し、ヒトのがんでは頻繁に変異している[5,6]。興味深いことに,p53,BRCA-1,BRCA-2は,S2サブユニットのヘプティック・リピート2領域とC末端ドメインを介して相互作用することがわかった。これらのタンパク質のPDB IDはRCSBのProtein Data Base (PDB)から抽出され、結晶構造IDと相互作用するアミノ酸残基の詳細は図の凡例に記載されている。COVID-19は、肺疾患、糖尿病、癌などの基礎疾患を持つ人に致命的なダメージを与えるため、今回の短いバイオインフォマティクス解析は初めての報告であり、意義深いものである
臨床研究・他
新型コロナウイルスのスパイクタンパク質が病気の発症に重要な役割を果たしていることが判明
www.salk.edu/news-release/the-novel-coronavirus-spike-protein-plays-additional-key-role-in-illness/
新型コロナウイルス感染症と脳卒中 臨床症状と病態生理の洞察
pubmed.ncbi.nlm.nih.gov/32689643/
SARS-CoV-2感染症では、S糖タンパク質がACE2に結合することで、ACE2の発現量が低下し93、その結果、ACEによるAng IIの生成量が増加し、Ang-(1-7)に変換されるACE2の量が減少する。 94 感染によりACEがより多く利用できるようになると、古典的なRAS軸が活性化され、脳動脈に対する血管収縮作用を介して虚血の促進に重要な役割を果たし、さらに脳実質に対する線維化促進、炎症促進、酸化ストレスの増加などの影響を及ぼす可能性がある。古典的なRAS経路の過剰活性化は、代替的なRASシグナルを過小評価し、血管拡張、血管新生、抗炎症、抗酸化、抗アポトーシス反応が低下するとともに、抗血栓、抗動脈硬化、神経保護効果も低下することになる。
COVID-19ワクチン接種後に発見された新たな神経学的症状および関連する神経腫瘍学的病変。脳神経外科の2つの症例とワクチン接種後の炎症反応の検討
pubmed.ncbi.nlm.nih.gov/34277256/
我々は、COVID-19ワクチン接種後に新たな神経学的障害を呈し、その後、2つの異なる神経腫瘍学的診断を受けた2人の患者について説明する。我々は、ワクチン接種後の炎症反応により、これらの病変が超急性に発現したという仮説を立てている。これらの症例は、COVID-19ワクチン接種後の新たな神経学的症状を慎重に検討・評価する必要性をさらに強調するものである。
我々は,COVID-19ワクチン接種後に新たな神経症状を発症した2例を報告する.いずれの症例も,さらなる診断検査により,神経外科的介入を必要とする神経腫瘍学的過程が明らかになった。これらのワクチンの投与は、腫瘍学的診断そのものとは無関係であった。しかし、この2つの独立したプロセスは、いずれもワクチン接種後に臨床的に前面に出ていた。我々は、COVIDワクチンに対する炎症反応が、これらの患者の臨床症状の増加に役割を果たしたのではないかと考えており、COVID-19スパイクタンパクに関連している可能性がある。
特にmRNAベースのワクチンは、COVID-19スパイクタンパクをコード化するように設計されており、ある特殊な報告では、最近のCOVID-19ワクチン接種を受けた状況で、ヒアルロン真皮フィラー移植後に4例の遅発性炎症反応を報告している[9]。著者らは、スパイクタンパクとその典型的なアンジオテンシン2変換酵素受容体(ACE-2)の遮断結合部位が関与する炎症のメカニズムの可能性を仮定した。特にmRNAベースのワクチンはスパイクタンパク自体をコード化するように設計されており、皮膚には相当数のACE-2受容体が存在することから、皮膚に残留したヒアルロン酸粒子の周囲に形成された肉芽腫に反応して、炎症カスケードが開始されたのではないかと仮定した。
ワクチン接種後の炎症の正確なメカニズムは不明だが、COVID-19感染症ではスパイクタンパクが炎症カスケードを起こし、血液脳関門(BBB)を通過することが知られている[10,11]。ワクチン接種後にコード化されたスパイクタンパク質がBBBを通過することで、ワクチン投与後の脳内の初期病理に対する炎症反応が増強される可能性がある。ワクチン接種後の炎症反応の増強は、腫瘍周囲の浮腫を増悪させ、臨床症状を悪化させることで、これらの神経腫瘍学的疾患に注目を集めたと考えられる。
COVID-19ワクチンの自己申告による実世界での安全性と反応原性 国際的なワクチン受領者調査
www.medrxiv.org/content/10.1101/2021.02.26.21252096v1
背景 COVID-19ワクチンの安全性は、最近の研究で特定の集団において実証されているが、ワクチンの選択や医療政策に役立てるためには、特定の集団におけるデータがさらに必要である。
目的 利用可能なCOVID-19ワクチンの安全性、忍容性、反応原性を異なる被接種者グループで比較するために、国際的なオンライン調査を実施した。
方法 本調査は、2021年2月に11日間にわたって実施した。調査完了の7日以上前にCOVID-19ワクチンの初回接種を受けたレシピエントが対象となった。ワクチン接種時の副作用の発生率と重症度を評価した。
結果 2,002人の回答者のうち26.6%がCOVID-19の既往感染者であった(68.8%が実験室で確認済み)。COVID-19の感染歴は,あらゆる副作用(リスク比1.08,95%信頼区間[1.05-1.11]),発熱(2.24 [1.86-2.70]),息苦しさ(2.05 [1.28-3.29]),インフルエンザ様症状(1.78 [1.51-2.10]),疲労(1.34 [1.20-1.49]),局所反応(1.10 [1.06-1.15])のリスク増加と関連していた。また、病院での治療に至る重篤な副作用のリスクの増加と関連していた(1.56 [1.14-2.12])。
mRNAワクチンは、ウイルスベクターベースのワクチンと比較して、あらゆる副作用の発生率が高かったが(1.06 [1.01-1.11])、これらは概して軽度であり(p<0.001)、ほとんどが局所的な反応であった。重要なのは、mRNAワクチン接種者は、アナフィラキシー、腫れ、インフルエンザ様症状、息苦しさ、疲労感などの全身性反応(RR<0.6)と、病院での治療を必要とする副作用(0.42 [0.31-0.58])の発生率がかなり低かったことである。
結論 今回の研究では、COVID-19の既往症とワクチン接種による副作用の発生率の増加が初めて関連しており、mRNAワクチンは、全身性の副作用は軽度で頻度も低いが、局所的な反応が多いことが示された。
キーメッセージ
- COVID-19の既往症がある人は、COVID-19ワクチンの接種後に副作用の発生率と重症度が有意に増加するようである。
- 異なる種類のワクチンの安全性と反応原性を比較した初のヘッド・ツー・ヘッドのこの研究では、mRNAワクチンは、ウイルスベクターワクチンと比較して、全身性の副作用は軽度で頻度も低いが、局所的な反応が多いことが示された。
- Tweetable Summary 2000人以上のCOVID-19ワクチン接種者を対象とした調査では、COVID-19の既往症とワクチン接種による副作用の発生率の上昇が関連している。mRNAワクチンは、全身性の副作用は軽度で頻度も低いが、局所的な反応が多い。
BNT162b2およびChAdOx1nCoV-19ワクチン後の血栓と出血イベント:ヨーロッパのデータの分析
www.ncbi.nlm.nih.gov/pmc/articles/PMC8220408/
なぜCHA(アストラゼネカ)はBNT(ファイザー)よりも血栓出血性イベントが多いのか?
ChA(アストラゼネカ)はBNT(ファイザー)に比べて血栓出血性イベントの発生頻度が高いことが示された。この違いを説明するメカニズムとして、次の4つが考えられる。 i) ワクチン接種後、ChAはBNTよりも大量のSpikeタンパク質の産生を促進する。 ii) ChA接種者のウイルスタンパク質の数はBNT接種者よりも多い。 iii) ChAワクチンに含まれるSpikeをコードするDNA配列がmRNAの代替スプライシングを決定し、異常なSpikeタンパク質をもたらす。
最初の仮説は、これまで検討されたことがない。スパイクタンパク質がヒトのタンパク質と非常に高いレベルで分子模倣していることを考慮すると[11]、スパイクタンパク質の産生レベルが高ければ、自己抗体のレベルが高い免疫/自己免疫反応のレベルが高くなる可能性がある。しかし、ある雑誌の査読を終えていない原稿では、スパイク抗原に対する抗体によって血栓出血イベントが引き起こされることはないと示唆されている[39]。
2つ目の仮説は、ChAワクチンには2.5×108個以上のアデノウイルス粒子が含まれているという考察から始まる[40]。さらに,ウイルスベースのワクチンを注射すると,SARS-CoV-2のS糖タンパク質遺伝子と一緒に,28kbpのアデノウイルス遺伝子が細胞核に送り込まれる[41].野生型アデノウイルスのゲノムには,約35種類のタンパク質がコードされている[42].ChAアデノウイルスのゲノムでは,E1/E3領域が欠失し,E4が改変されているため[43],コードされているタンパク質の数は少なく,また,ChAは複製欠損を起こしている[41].しかし、ChAに感染した細胞株では、アデノウイルス遺伝子の発現は非常に低いレベルで検出されている。したがって、SARS-CoV-2 Spike糖タンパク質だけでなく、模倣活性を持つアデノウイルスタンパク質もワクチン投与後に発現しているという仮説が立てられる。一方、BNTワクチンでは、SARS-CoV-2 Spike糖タンパク質のみが発現した。
3つ目の仮説は、Kowarzらがジャーナルでの査読が完了していない原稿で提案している[17]。著者らは、SARS-CoV-2 Spikeタンパク質をコードするDNA由来のmRNAのうち、わずかな量がスプライシングを受けることを示した以前の知見[41]を確認している。Spikeタンパク質のmRNAスプライシングは、スプライシング接合部の後に異なるオープンリーディングフレームを示すことがあり(aberrant Spikeタンパク質)感染細胞の膜に結合できず、分泌される。この異常なSpikeタンパク質は、血管内皮細胞に発現するヒトACE-2受容体と結合し、ワクチンに反応して産生された抗Spike抗体がACE-2結合型Spikeタンパク質と結合すると、抗体依存性細胞媒介性細胞傷害(ADCC)または補体依存性細胞傷害(CDC)による局所的な炎症反応が活性化される。その結果、炎症が血栓症を引き起こす可能性がある。
Greinacherらは、ChAワクチン接種後に抗PF4抗体が観察されることを示した[16]。抗PF4抗体の促進は、アデノウイルスタンパク質やスパイクタンパク質によるものと考えるのが妥当であろう。さらに、Greinacherらは、ジャーナルでの査読が完了していないごく最近の論文で、ワクチンに含まれるEDTAが微小血管の伝染性を高め、局所的な炎症反応の発生を促し、その結果、抗PF4抗体の産生が促進されることを示した(仮説iv)[19]。
結論として、ChAが血栓出血イベントを促進するメカニズムは異なる可能性があるが、それらは互いに相乗効果をもたらす可能性が高く、また、まだ発見されていない他のメカニズムがワクチンによって誘発されるという仮説を立てることが可能である。
血栓出血性イベントの高頻度は、ウイルスベースのワクチンでも同じか
AdCは、EMAとFDAによって認可されたもう一つのウイルスベースの抗CoViD-19ワクチンである。ChAとAdCは、複製不能なアデノウイルスを使用していること(4.5項のポイントii参照)スパイクタンパクの合成情報を伝えるためにDNAを使用していること(ポイントiii参照)(ポイントi参照)など、いくつかの特性を共有している。しかし、両者はまた異なる。AdCのウイルス量は、ChAの3.3倍であり[40,44]、スパイクタンパクやアデノウイルスタンパクの負担が大きいことを示唆していると考えられる。さらに,アデノウイルスの種類も異なる(AdCではヒトのAd26,ChAではチンパンジーのアデノウイルスを使用している)。エボラワクチンを含むいくつかの他のワクチンは、Ad26ベースのワクチンである[45]。しかし,何百万人もの人々へのワクチン接種には使用されなかった。ヒト、特にサハラ以南のアフリカや東南アジアでは、抗Ad26抗体が存在することが知られており、これらの人々にはAd26ベースのワクチンがうまく機能しない可能性があることを意味している[46]。ヒトに感染しないチンパンジーのアデノウイルスをCHAに使用することで、既存の抗体の問題を回避できるかもしれない[43]。抗アデノウイルス抗体の存在がSAEの頻度を変えるかどうかは不明である。最後に EDTA は ChA ワクチンには含まれているが、AdC ワクチンには含まれていない(ポイント iv を参照)[40,44]。
CVSTの頻度はChAよりもAdCの方が低いと思われるが[18,47]、最新の情報はない。そこで、上記の違いがAdCとChAのSAEの頻度の違いにつながるかどうかを評価するために、AdCの血栓出血性イベントの頻度を分析している。
結論
人間の違い(遺伝、エピジェネティクス、性別、年齢)により、自己免疫反応が起こりやすく、稀なAEに敏感な人がいる[48]。我々はここで、BNT受診者よりもChA受診者の方が血栓出血性イベントの発生率が高いことを示した。具体的には、CVT、SVT、および血小板減少症は、若年者(18-24歳)および成人女性(25-60歳)でより頻繁に見られた。また、BNT接種者では、CVT、SVT、血小板減少症などの血栓出血性イベントの頻度は、一般の人と比べて増加していなかった。このように、ワクチンに依存したスパイク蛋白質の産生は、重篤な血栓出血性有害事象を助長する要因となる可能性があるが、それだけではない。
今回のデータは、ワクチン接種者の年齢や性別、COVID-19リスク、特定の国でのパンデミックの深さなどを考慮して、ChAワクチンのリスク・ベネフィット比を評価する際に役立つと思われる。感染率が低く、集団免疫がほぼ成立している国では、ワクチンのリスク・ベネフィット比をより慎重に評価する必要がある。