Contents
SARS-CoV-2 vaccines: Lights and shadows
pubmed.ncbi.nlm.nih.gov/33966930/
2021年4月30日
ハイライト
- これまでのところ、SARS-CoV-2感染を予防するワクチンは、パンデミックを抑制するための有望なアプローチであると考えられる。
- SARS-CoV-2に対するワクチンは、いくつかの異なるプラットフォームを用いて開発されている。
- SARS-CoV-2ワクチンの安全性については、特に血栓塞栓症などの稀な副反応を根拠に、いくつかの懸念が示されている。
- 第3相臨床試験で得られた有効性と安全性の結果を実生活に適用するには、様々な集団を対象とした広範な追跡調査が必要である。
- 既存の免疫を持っている人にワクチンを接種すると、より強い全身性の炎症を引き起こし、その結果、非常に稀ではあるが、予想外に強い炎症反応や血栓症反応を引き起こす可能性がある。
概要
急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の感染を予防するワクチンは,免疫中和反応を引き起こす。SARS-CoV-2ワクチンの安全性については,ワクチン接種後に重篤な血栓塞栓症を発症した症例報告を中心に,いくつかの懸念が示されている。
SARS-CoV-2ワクチンによる心血管系の有害反応を説明するいくつかのメカニズムが示唆されている。
現在、弱毒性生ワクチン、不活化ワクチン、組み換えタンパク質ワクチン、ベクターワクチン、DNAワクチン、RNAワクチンなど、さまざまなワクチンプラットフォームが利用可能である。
ワクチンは、様々な細胞からSARS-CoV-2スパイクタンパクの内因性合成を増加させる。一旦合成されると、細胞質内で組み立てられたスパイクタンパク質は、細胞表面に移動し、ネイティブに近いコンフォメーションで突出する。これらのタンパク質は免疫系に認識され、免疫反応が急速に進行する。このような反応は、ウイルスベクターをコードするDNAワクチンが存在する場合や、過去にSARS-CoV-2にさらされたことがあって免疫を受けた被験者では、非常に活発になるようである。その結果として生じる病理学的特徴は、活発なコロナウイルス疾患のものと似ているかもしれない。
ワクチンの標的となった細胞で合成され、免疫反応によって破壊されたフリーフローティングスパイクタンパク質は、血液中を循環し、血小板を含む様々な細胞に発現しているアンジオテンシン変換酵素2(ACE2)受容体と系統的に相互作用し、ACE2の内在化と分解を促進する。これらの反応は最終的に、血小板のACE2受容体を含むいくつかのメカニズムを介して、血小板凝集、血栓症、炎症を引き起こす可能性がある。
第3相ワクチン試験では、一般的に過去に免疫を付与されたことのある参加者は除外されるが、現実に膨大な数の集団にワクチンを接種すると、必然的に既存の免疫を持つ人が含まれることになる。そのため、場合によっては、炎症や血栓の反応が過度に高まる可能性がある。この分野では、さらなる研究が必要である。
1. はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は急速に世界に広がり、世界で290万人以上が死亡し、1億3700万人の症例が実験室での検査で確認された(2021年4月16日、https://covid19.who.int/)。そのため、感染からコロナウイルス感染症2019(COVID-19)の重症化への移行を阻止するために最終的に完成した治療薬の探索が継続して行われている。
SARS-CoV-2のヒト細胞受容体への結合の遮断、ウイルスのリボ核酸(RNA)合成・複製の防止、宿主の自然免疫の回復、宿主の特定の受容体や酵素の調節など、さまざまな治療戦略が検討されている[[1]]。それにもかかわらず、SARS-CoV-2の感染を予防するワクチンは、パンデミックを抑制するための最も有望なアプローチと考えられている。
現在までに、3つの異なるプラットフォームで合計7種類のSARS-CoV-2ワクチンが提供されており[2, 3, 4]、2021年4月16日時点で、合計734.121.870回のワクチン投与が行われている(https://covid19.who.int/)。
しかし、最近、SARS-CoV-2ワクチンの安全性に関するいくつかの懸念が提起されており、そのほとんどが血栓塞栓症イベントの散発的な報告に基づいている[5, 6, 7, 8]。
そこで我々は、SARS-CoV-2ワクチンの主なメカニズムと、心血管系との相互作用の可能性についてまとめることを目的とした。
2. 欧州で承認されているワクチンの概要
SARS-CoV-2のワクチンは、いくつかの異なるプラットフォームを用いて開発されている(表1)。その中には、弱毒生ワクチン、不活化ワクチン、組換えタンパク質ワクチン、ベクターワクチン(複製不能ベクターワクチン、複製完了ベクターワクチン、不活化ウイルスベクターワクチン)デオキシリボ核酸(DNA)ワクチン、RNAワクチンが含まれる(表1)。
表1SARS-CoV-2のワクチン開発に使用されたプラットフォームの違い
それぞれのプラットフォームについて、利点と限界も報告されている。
| プラットホーム | 開発 | 利点 | 制限事項 |
|---|---|---|---|
| 不活化ワクチン | 化学的に不活化されたウイルス | 安定している; スパイクタンパク質およびウイルスの他の成分を標的とする免疫応答 | 免疫原性粒子の完全性を維持する必要があります |
| 弱毒生ワクチン | 野生型ウイルスの遺伝的に弱体化したバージョン | 弱毒化ウイルス全体の複数の成分に対する体液性および細胞性免疫を刺激する | 野生型ウイルスへの復帰または組換え(ウイルス複製中のヌクレオチド置換) |
| 組換えタンパク質ワクチン | さまざまなシステムの1つで発現されたウイルスタンパク質で構成されています | 安全; ウイルスの生きているコンポーネントはありません | メモリはテストされます |
| ウイルスベクターワクチン | 標的ウイルスタンパク質を発現する複製能のないまたは複製能のあるウイルスベクター | 強力な免疫応答 | ウイルスゲノムの宿主ゲノムへの潜在的な統合 |
| DNAワクチン | 哺乳類の発現促進因子と標的遺伝子を含むプラスミドDNA | 高安定 | 免疫原性が低い |
| RNAワクチン | 標的ウイルスタンパク質をコードするmRNA | 受信者のDNAとの相互作用はありません | 非常に低い温度に維持する |
凡例 DNA=デオキシリボ核酸、RNA=リボ核酸、mRNA=メッセンジャーリボ核酸。
欧州医療機関(EMA)で承認されているものを含め、SARS-CoV-2ワクチンの主な特徴を表2に示する。
表2COVID-19ワクチンの主な特徴
参考文献より [2], 9, 10, 11, [18], [19]] およびwww.clinicaltrials.gov。
| ワクチン | 開発者 | プラットホーム | 用量 | 有効性** |
|---|---|---|---|---|
| BNT162b2 * | ファイザー/ BioNTech | mRNA | 2(3週間間隔) | 95% |
| mRNA-1273 * | モダナ | mRNA | 2(4週間間隔) | 94% |
| Ad26.COV2.S * | ヤンセン/ジョンソン&ジョンソン | DNAアデノウイルスベクター | 1 | 67% |
| CVnCoV | キュアバック | mRNA | 2(4週間間隔) | NA |
| ChAdOx1nCoV-19 * | アストラゼネカ/オックスフォード大学/セラムインスティテュートオブインディア | DNAアデノウイルスベクター | 2(4 / 8〜12週間間隔) | 70% |
| NVX-CoV2373 | Novavax | 組換えタンパク質 | 2(3週間間隔) | 89% |
| Gam-COVID-Vac(スプートニクV) | ガマレヤ研究所 | DNAアデノウイルスベクター | 2(3週間間隔) | 92% |
凡例 *=欧州連合で使用が認可されているワクチン
(www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-COVID-19/treatments-vaccines/COVID-19-vaccines); **=症候性/中等症/重症のCOVID-19に対する有効性(詳細は参考文献を参照); mRNA=メッセンジャーリボ核酸。
以下に詳述するように、コロナウイルス感染症(COVID-19)ワクチンは、主に2種類(脂質ナノ粒子送達システムを用いたメッセンジャーリボ核酸[mRNA]技術と、非複製組換えアデノウイルスベクターシステムを用いたDNA技術)が緊急用として承認されている。
2.1 ChAdOx1nCoV-19
COVID-19 Vaxzeria(旧COVID-19 vaccine AstraZeneca)は、SARS-CoV-2のS糖タンパク質をコードする単一の組換え複製不能チンパンジーアデノウイルス(ChAdOx1)DNAベクター(ChAdOx1-S, AZD1222)から構成される1価ワクチンである[[2], [3]]。ワクチンに含まれるSARS-CoV-2のS免疫原は、三量体のプレフュージョンコンフォメーションで発現しており、発現したSタンパク質をプレフュージョンコンフォメーションで安定化させるために、コーディング配列は変更されていない[[2], [3]]。
Vaxzevriaの予防接種経過は,0.5mlずつの2回の別々の投与で構成されている。2回目の接種は、1回目の接種から4週間から 12週間の間 COVID-19 Vaxzevriaワクチンの1回目の接種を受けた人は、ワクチン接種経過を完了するために同じワクチンの2回目の接種を受ける必要がある。このワクチンの各投与量(注射用懸濁液として)には、2.5×108感染単位以上のChAdOx1-Sが含まれている。本ワクチンは筋肉内注射専用で、できれば上腕の三角筋に注射する。
EMAの表示によると、COVID-19からの保護は、Vaxzevriaワクチンの初回投与の約3週間後から始まり、個人が完全に保護されるのは2回目の投与の15日後とされている。
ヴァクセブリア・ワクチンの臨床効果は、英国、ブラジル、南アフリカで実施中の4つの盲検無作為化対照試験のデータの中間解析によって評価されている[[9]]。18歳以上の参加者は、ChAdOx1 nCoV-19ワクチンまたは対照(髄膜炎菌A群、C群、W群、Y群結合型ワクチンまたは生理食塩水)に1:1の割合で無作為に割り付けられた。
本試験では,重度および/またはコントロール不能な心血管疾患,胃腸疾患,肝臓疾患,腎臓疾患,内分泌・代謝疾患,神経疾患を有する参加者,重度の免疫抑制状態にある参加者,妊娠中の女性,SARS-CoV-2感染の既往歴のある参加者は除外された[[9]].
有効性の主要解析対象は,2 回目のワクチン接種から 14 日以上経過した時点で核酸増幅試験陽性の綿棒を使用した既往の血清陰性参加者の症候性 COVID-19 であった。
全体の有効性は,症候性COVID-19の予防において70.4%(95%信頼区間[CI]:54.8-80.6)であった(11,000人以上の参加者のうちCOVID-19が確認されたのは131例,ワクチン群が30例,対照群が101例)[[9]].
初回接種から 21日目以降、COVID-19で入院した患者は10名で、すべて対照群であった。このうち2名の患者でCOVID-19が重症化し、1名の患者が死亡した[[9]]。
COVID-19の予防に対するAZD1222の安全性、有効性、免疫原性をプラセボと比較して評価した無作為化二重盲検プラセボ対照多施設共同第III相試験でも同様の結果が得られた。米国、ペルー、チリの88施設で実施された32,449名の参加者から得られたデータによると、症状のあるCOVID-19に対するワクチンの有効性は76%であり、重症または重篤な疾患と入院、および65歳以上の参加者の症状のあるCOVID-19に対するワクチンの有効性は、それぞれ100%と85%であった[[10]]。
2.2 BNT162b2
Pfizer/BioNTech社のワクチン1回分(0.3mL)には、SARS-CoV-2のウイルススパイクタンパクをコードするCOVID-19の一本鎖、5′キャップのメッセンジャーRNA(mRNA)が、対応するDNAテンプレートから無細胞の試験管内試験転写を用いて30マイクログラム含まれている[[2]]。具体的には、このmRNAは脂質ナノ粒子に埋め込まれている。このmRNAは、膜に固定された完全長のSpikeタンパク質をコードしているが、その中心らせん内には2つの点変異がある。この2つのアミノ酸をプロリンに変異させることで、スパイクタンパクは抗原的に好ましいプレフュージョンコンフォメーションに固定される[[2]]。このワクチンは、希釈後に筋肉内に投与する必要があり、好ましい部位は上腕の三角筋である[[2]]。
現在進行中の多国籍、プラセボ対照、観察者盲検、ピボタル有効性試験では、16歳以上の被験者が、プラセボまたはBNT162b2ワクチン候補のいずれかを21日間隔で2回接種するよう、1:1の割合で無作為に割り付けられている[[11]]。
簡単に説明すると、合計43,548人の参加者が無作為化を受け、そのうち43,448人が注射を受けた(BNT162b2が21,720人、プラセボが21,728人)。全体として、2回目の投与から7日以上経過して発症したCOVID-19の症例は、BNT162b2投与に割り当てられた参加者では8例、プラセボ投与に割り当てられた参加者では162例でした(有効率95%、95%信頼区間:90.3~97.6)[[11]]。また、年齢、性別、人種、民族、ベースラインの肥満度、合併症の有無によって定義されたサブグループにおいても、同様のワクチン効果が認められた。重篤な有害事象の発生率は低く、ワクチン群とプラセボ群で同程度であった[[11]]。
注目すべきは、様々な国で行われたいくつかの観察調査でも同様の結果が得られていることである[12, 13, 14, 15, 16]。
2.3 mRNA-1273
Moderna社製のmRNA-1273は、膜貫通型アンカーを持つSARS-CoV-2糖タンパク質と無傷のS1-S2切断部位からなるSARS-CoV-2 S-2P抗原をコードするヌクレオシド修飾mRNAベースの脂質ナノ粒子カプセルワクチンである[[17]]。4種類の脂質からなる脂質ナノ粒子カプセルは,mRNAと脂質の比率を固定して配合した。mRNA-1273ワクチンは,1mlあたり0.5mgの濃度で,注射用の無菌液体として提供された。投与量を調製するための希釈剤として、生理食塩水が使用された[[17]]。
第3相無作為化観察者盲検プラセボ対照試験が米国内の99施設で実施された[[18]]。全体で30,420人の被験者が、mRNA-1273(100μg)またはプラセボの筋肉内注射を28日間隔で2回受けるよう、1:1の割合で無作為に割り当てられた。主要評価項目は,過去にSARS-CoV-2に感染したことのない被験者における,2回目の注射から少なくとも14日後に発症するCOVID-19疾病の予防であった[[18]].
プラセボ群では185名、mRNA-1273群では11名に症候性COVID-19疾患が確認された(ワクチン効果:94.1%、95%CI:89.3 – 96.8%)[[18]]。
重度のCOVID-19は30名の参加者に発生し、1名が死亡した。30名の症例はすべてプラセボ群であった。ワクチン接種後の中等度の一過性反応原性は,mRNA-1273群でより多く発生した。重篤な有害事象はまれであり、発生率は両群で同程度であった[[18]]。
2.4 Ad26.COV2.S
ヤンセン COVID-19 ワクチンは,完全長で安定化した SARS-CoV-2 スパイク(S)タンパク質をコードする組換え複製不能アデノウイルス血清型 26(Ad26)ベクター(DNA)である.このワクチンは,武漢株の最初の臨床分離株(Wuhan 2019;全ゲノム配列,NC_045512)に由来するものであった[[19]].
フェーズ1-2a試験[[19]]では,18~55歳(コホート1)および65歳以上(コホート3)の健康な成人(N=805)を対象に,Ad26.COV2.Sワクチンを1mlあたり5×1010個のウイルス粒子(低用量)または1×1011個のウイルス粒子(高用量)またはプラセボの用量で,単回投与または2回投与のスケジュールで無作為に割り付けた[[19]].野生型ウイルスに対する中和抗体価は,初回接種後29日目に,全被験者の90%以上で検出された。2回目の接種により、力価は2.6~2.9倍に増加した[[19]]。
米国食品医薬品局(FDA)の報告によると[[20]]、18歳以上の被験者4万人を対象とした第3相有効性試験において、本ワクチンは単回接種で投与された。中等症、重症、重篤なCOVID-19(464例、うちワクチン群116例、プラセボ群348例)の予防に66.9%(95%CI:59.0-73.4)の有効性を示した。ワクチンの有効性は、接種後28日目から始まり、14日目以降の有効性と同様であった[[20]]。
3. プラットフォームの違いによる視点の違い
現在、ヒトへの使用が承認または検討されているワクチンは、異なる先端技術を用いて開発されている(表1)[[3], [4]]。前述のように、現在EMAで承認されているワクチンは、2つの異なるプラットフォーム(すなわち、非複製DNAウイルスベクターとmRNA)を使用している。
図1mRNAおよびアデノウイルスベクターDNAワクチンの作用機序の概略と、免疫系の活性化および自由に浮遊するスパイクタンパク質とACE2との相互作用を通じた心血管相互作用の可能性(詳細は本文参照)
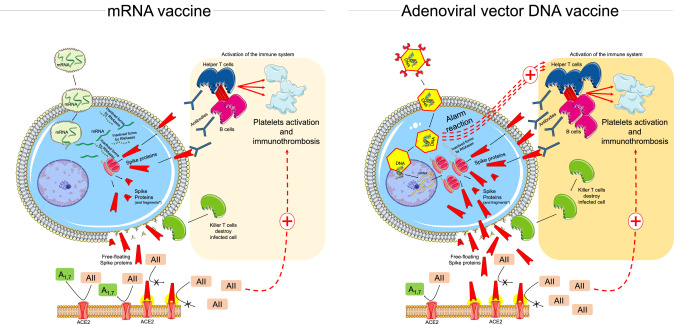
非複製ウイルスベクター(ChAdOx1nCoV-19はチンパンジーアデノウイルス)は、ウイルスのSpikeタンパク質をコードする二本鎖遺伝子のキャリアである(図1,右パネル)。DNAはRNAほど壊れやすくなく、アデノウイルスの強靭なタンパク質コートが内部の遺伝物質の保護に役立っている。感染細胞内に入ったウイルスベクターは、核内に入り、自分のコピーを作らずに、複数のmRNA分子を通じて抗原を作り出す。mRNAは細胞の核を離れ、スパイクタンパク質を組み立て始める。細胞質で生成されたスパイクタンパク質の一部と、断片化された可変量のスパイクタンパク質が細胞表面に移動する[[3], [4]]。
飛び出したスパイクタンパク質は、免疫系に認識され、免疫反応が引き起こされる。アデノウイルスベクターは、宿主の特異的な免疫反応を誘発する。それにもかかわらず、動物のアデノウイルスを使用すると、ヒトのウイルスベクターを使用して観察される既存のベクター免疫が低下する可能性がある[[4]]。アデノウイルスベクターに対する初期の自然応答は、サイトカイン/ケモカインや免疫細胞を介して、ワクチン接種後1-3時間から 1日後に始まり、最終的にスパイクタンパクに対する免疫反応が増強される[[21]]。
さらに、ウイルスベクターワクチンには、固有のアジュバント特性もある。アデノウイルスは、注射後、自然免疫細胞(すなわち樹状細胞)やマクロファージを標的とし、複数のパターン認識受容体に関与してI型インターフェロンの分泌を誘導することで自然免疫反応を刺激し、その結果、注射部位を排出するリンパ節のT細胞に抗原性と炎症性の両方のシグナルを伝達する(T細胞を活性化し、適応免疫を動員する)[[22]]。
DNAを含むウイルスベクターの場合には、ウイルスゲノムの宿主ゲノムへの統合が排除されていない[[3]]。
RNAワクチン(従来型のmRNAまたは自己複製型のmRNA)は、コード化されたタンパク質の発現をもたらした[[3], [4]]。これらのワクチンは,宿主細胞の転写装置を利用して,それぞれのmRNAテンプレートから複数のタンパク質のコピーを作成して標的タンパク質を産生し,B細胞やT細胞の免疫反応を誘発する適応免疫を誘導するという戦略に基づいている(図1,左パネル)。mRNAは、ウイルスタンパク質をコードする免疫原として、また、RNAに内在する免疫賦活作用により、アジュバントとして機能する。具体的には、mRNAは細胞内に入ると、エンドソームや細胞質の自然免疫センサーによって認識され、ウイルスに対する自然免疫反応の重要な部分を形成し、その結果、細胞が活性化され、I型インターフェロンや複数の炎症性メディエーターが産生される[[23]、[24]]。特筆すべきは、脂質ナノ粒子キャリアがmRNAをさらに保護し、リンパ管への送達をターゲットとし、リンパ節でのタンパク質翻訳を促進することである。リンパ節に入った脂質ナノ粒子担体は、樹状細胞に取り込まれ、樹状細胞はその後、抗原を産生してT細胞に提示し、適応免疫反応を活性化する[[23][24]。
しかし、mRNAの安定性を高めるためには、mRNAを修飾する必要があり[3]、脂質ナノ粒子にカプセル化することで、細胞内へのデリバリーが改善される。また、翻訳の細胞質内への局在化と宿主ゲノムへの非統合化は、mRNAワクチンの他の利点である[3], [4]。また、細胞の核に侵入しなければならないウイルスベクターと比較して、mRNAは細胞質にしか存在しないため、RNA分解システム(「RNAase酵素」)の活性にさらされ、翻訳手順の全体的な度合いを下げることで、RNAウイルスに対する最初の防御となる。
ウイルスベクターワクチンと同様に、感染細胞が産生したスパイクタンパク質とその断片は、その表面に収容され、宿主の免疫系によって速やかに認識され、その後抗体が産生される。どちらのタイプのワクチンも、中和抗体やウイルス特異的T細胞の反応を顕著に示する[[25], [26]]。特に、自然免疫反応とともにスパイクタンパクの細胞内産生を促進するmRNAワクチンとウイルスベクターワクチンは、CD8+とCD4+の両方のT細胞に、I型インターフェロンの産生によるエフェクターサブセットとメモリーサブセットへの分化を促すはずである[[24], [27]]。
さらに、これらのワクチンの2回目の投与は、「訓練された免疫」と呼ばれる現象によるマクロファージなどの自然細胞の短期的な変化や、初回の注射で生成されたメモリーT細胞やB細胞の活性化に起因する炎症反応の増強と関連している[[24], [27]]。これらのワクチンがどのようにして免疫反応を動員するのか、また、保護の持続性については完全には明らかになっていない[[24]]。
4. MERSとSARS-CoV-1からの教訓
ここ数年、DNAやmRNAをプラットフォーム技術として使用したワクチンが、健康ソリューションとしての役割を果たす可能性に大きな関心を寄せている。この種のワクチンは、体液性(中和抗体)および細胞性の免疫反応を誘発し、不活化または弱毒化された病原体を使用することによる潜在的な健康リスクを回避できる可能性がある。これらの開発プロセスは、一般的に「従来の」技術よりも迅速に行われる[[28]]。
プラットフォームの違い(前項参照)や宿主との相互作用に関するデータは、主にSARS-CoV-1や中東呼吸器症候群コロナウイルス(MERS-CoV)を用いた前臨床試験から得られている。SARS-CoV-2と同様、SARS-CoV-1とMERSのワクチンの抗原ターゲットは、表面の大きなスパイクタンパクであった。スパイクタンパク質を発現するウイルスベクターを用いたワクチンなど、いくつかのMERSおよびSARS-CoV-1のワクチン候補が開発され、その有効性が検証されている[29, 30, 31]。一般的に,これらのワクチン候補は,免疫応答や中和抗体を誘導する能力を示している[29, 30, 31]。Spikeタンパク質の受容体結合ドメイン(RBD)に結合する抗体は,アンジオテンシン変換酵素2(ACE2)との相互作用を阻止し,ウイルスを中和する可能性を示していた[29, 30, 31].
しかし、SARS-CoV-1やMERS-CoVに対するワクチンの動物実験では、ワクチン接種によって非中和抗体が誘導され、(野生型ウイルスにチャレンジした後の)ウイルス感染の増強を媒介したり、炎症、肝炎の増強、好酸球性肺炎などの有害な免疫反応を引き起こす可能性があることも示されている[32, 33, 34, 35]。
SARS-CoV-1やMERS-CoVに関するこれらの実験的研究は、ワクチン接種による病気の増強や、ウイルス増強抗体や有害な免疫反応の誘発に関して、いくつかの懸念を示していた[[36]]。
5. ワクチン接種と免疫血栓症
最近、COVID-19ワクチンの安全性に関するいくつかの疑問が提起されており、バクスゼブリアやジョンソン・エンド・ジョンソンのワクチン接種後に血栓塞栓症が発生したという報告が散見され、中には致命的なものもあった[5, 6, 7, 8]。
EMAは、アドホック専門家グループからの助言を含む、現在入手可能なすべてのエビデンスを考慮して、最近、異常な血栓事象をヴァクセブリア(旧COVID-19ワクチン・アストラゼネカ)の副作用として記載すべきであると結論付けた。
具体的には、EMAのファーマコビジランス・リスク評価委員会(PRAC)は、2021年3月22日時点で欧州連合の医薬品安全性データベース(EudraVigilance)に報告されている脳静脈洞血栓症(CVST)62例(死亡例18例)および脾静脈血栓症24例について詳細な検討を行った[[17]]。しかし、EMAは、「報告された血栓と血小板低下の組み合わせは非常に稀であり、COVID-19を予防するワクチンの総合的なメリットは、副作用のリスクを上回る」と結論づけている。
これに関連して、Danish National Patient Registryの最近の報告では 2010年1月1日から 2018年11月30日までに記録された一般成人集団における静脈血栓塞栓症の初発症例の発生率が評価されている[[37]]。すべての発生率は、追跡調査中の静脈血栓塞栓症の初発件数を追跡調査中の人年の合計で割って算出し、1000人年あたりで報告された[[37]]。その後、この静脈血栓塞栓症の発生率を用いて、著者らは、2021年3月10日までに欧州でオックスフォード・アストラゼネカ社のCOVID-19ワクチンを接種したのと同じ規模の集団において、1週間と1カ月の間にそれぞれ予想される症例数を推定した[[37]]。これは、罹患率を個人ごとに週単位(7日)および月単位(30.5日)にリスケールし、500万人(すなわち、2021年3月10日までに欧州でオックスフォード・アストラゼネカCOVID-19ワクチンを接種した人のおおよその数と一致するサイズ)を乗じて行った。
罹患率は、全人口およびデンマーク人の18~64歳のサブグループについて算出した。この18~64歳の年齢層は、オックスフォード-アストラゼネカCOVID-19ワクチンがほとんどの欧州諸国で主に使用されている年齢層を表している[[37]]。1000人年あたりの静脈血栓塞栓症の発生率は、18~99歳のデンマーク人では1.76(95%CI:1.75~1.78)18~64歳のデンマーク人では0.95(95%CI:0.94~0.96)であった[[37]]。深部静脈血栓症または肺塞栓症に限定すると、1,000人年当たりの発生率は、18~99歳のデンマーク人で1.70(95%CI:1.68~1.71)18~64歳のデンマーク人で0.91(0.89~0.92)であった[[37]]。
著者ら[[37]]が詳述しているように、500万人の人口では、この発生率は、18~99歳のデンマーク人の発生率に基づくと、週に約169件、月に736件の静脈血栓塞栓症の予想症例に相当する。同様に、18~64歳のデンマーク人の罹患率に基づいて推定すると、1週間に91例、1ヶ月に398例の静脈血栓塞栓症が発生すると予想される。
つまり、これらの結果は、オックスフォード・アストラゼネカ社のCOVID-19ワクチンを接種したヨーロッパ人の間で報告された血栓塞栓症の数は、ワクチン接種プログラム導入前のデンマーク人全体の罹患率から推定された期待数と比較して増加していないという概念を裏付けるものである[[37]]。
しかし、著者が述べているように、デンマークのデータは、ワクチンの使用に関連して報告されたいくつかの静脈血栓塞栓症イベントが実際にワクチンによって引き起こされている可能性を排除することはできない[[37]]。
同様に、慢性疾患センター(CDC)とFDAの共同声明では、ジョンソン・エンド・ジョンソンのワクチンを接種した後に、稀で重篤なタイプの血栓が6例報告されたことに対して、十分な注意を払ってこのワクチンの使用を一時停止するよう勧告している[[6]]。
重篤な有害事象として認められた血栓事象と血小板数の低下(150,000/μL未満)の組み合わせのもっともらしい説明は、ワクチン接種後の免疫反応(「免疫血栓症」)[[38]]であり、これはヘパリン誘発性血小板減少症(HIT)[[39], [40]]に類似した状態に似ているとされている。これらの事象は,ワクチン接種後4~20日後に生じる反応であるPF4血小板抗原に対するワクチン誘発性自己抗体(vaccin-induced prothrombotic immune thrombocytopenia)と関連している可能性がある.HIT抗体が陽性であれば、このような診断が可能である[[39], [40]]。ヨーロッパで発生した症例のほとんどは55歳以下の女性で発生している。
これらの事象は非常に稀であるが、その発生率と異なる個人間での類似したパターンは、ワクチンとの因果関係を懸念させるものであった。また、ワクチン接種後の血液凝固性亢進の病態はまだよくわかっていない。活性型COVID-19を模倣した免疫反応の亢進が想定される。実際、免疫血栓症はCOVID-19の特異的な発症メカニズムである。Bonaventuraらが示唆しているように、SARS-CoV-2感染は好中球や単球の活性化を誘発し、血小板や凝固カスケードと相互作用して、小血管や太い血管に血管内血栓を形成する可能性がある[[38]]。
6. 浮遊するスパイクタンパク質とACE2の相互作用
ワクチンを接種した細胞が死滅したり、免疫系によって破壊されたりすると、その破片から大量のスパイクタンパク質やタンパク質の断片(フリーフローティング・スパイクタンパク質)が放出されることがある。
SARS-CoV-2は、ACE2をトロイの木馬に見立てて標的細胞に侵入することがよく知られている。したがって、自由に浮遊するスパイクタンパク質と他の細胞のACE2との相互作用は、極めて妥当なメカニズムである。最近、アデノウイルス・ベクター・ワクチンで実証されたように、ワクチン接種によって産生されるSpikeタンパク質は、SARS-CoV-2 Spikeタンパク質の受容体結合機能とプレフュージョン構造をネイティブに模倣している[[41]]。
ワクチンによって産生されたSpikeタンパク質のネイティブに近いコンフォメーションは、ACE2と相互作用し、ACE2の内在化と分解を促進する可能性がある[[42]]。注目すべきは、このような現象が血小板でも観察されていることである[[43]]。Zhangらは、SARS-CoV-2が血小板中のACE2レベルを時間依存的に減少させることを発見し、ACE2の活性化に伴うACE2の分解を示した[[43]]。スパイクタンパク質は、用量依存的に血小板凝集とアデノシン三リン酸(ATP)放出の増強を誘導する[[43]]。スパイク蛋白質のサブユニット1は、血小板のACE2に結合し、血小板の凝集を誘発する(図2)[[43]]。
図2ACE2と浮遊するSpikeタンパク質との相互作用による血小板への影響(詳細は本文参照)
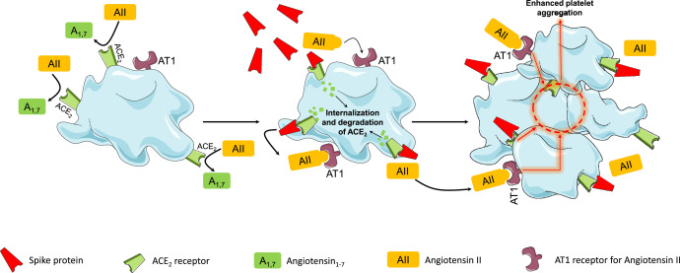
ACE2とSARS-CoV-2 Spikeタンパク質の相互作用を介して、細胞膜の外部部位からACE2受容体の活性が失われると、アンジオテンシンIIの不活性化とアンチオテンシン1-7の生成が少なくなる [[44], [45]]。アンジオテンシンIIの過剰作用とアンチテンシン1-7の不足のバランスが崩れると、炎症や血栓症などの副作用を引き起こす可能性がある(図1)[[44], [45]]。この文脈では、自由に浮遊するスパイクタンパク質とACE2の相互作用がこのようなバランスの崩れを助長し、ワクチン接種後の潜在的な有害事象に影響を与えるかどうかは明らかではない(図1)。
結論
SARS-CoV-2ワクチンの接種は、現在のパンデミックの局面を脱する機会を提供している。十分な中和反応を誘発するワクチンは、COVID-19に対する保護を提供できるはずである[[46]]。しかし、SARS-CoV-2ワクチンにとっては、有効性に加えて安全性も重要な問題である。現在、さまざまなプラットフォームが利用されているが、ほとんどのワクチンには以下のような共通点がある。
- (a) SARS-CoV-2のスパイクタンパク質をコードしていること、
- (b) 感染細胞によって組み立てられたスパイクタンパク質が細胞表面に移動すること、
- (c) 突出したスパイクタンパク質がネイティブに近いコンフォメーションを持ち[[41]]、免疫系に認識されて免疫反応を起こすこと、である。
このような背景から、ウイルスベクターワクチンは、サイトカイン、ケモカイン、免疫細胞によって媒介されるより強力な自然免疫反応を引き起こすことで、スパイクタンパク質に対する免疫反応をさらに強化する可能性がある[[21]]。このような免疫反応は、COVID-19の活動性疾患を模倣しているように見える。
MERS-CoVやSARS-CoV-1の感染にさかのぼる以前の研究では、SARS-CoVの完全長スパイクタンパクを用いたワクチンが、肺や肝臓を含む様々なレベルで強い免疫炎症反応を誘発する可能性が示されていた[[29], 32, 33, 34]。
また、SARS-CoV-2への曝露歴があるために、血清反応陽性の人にSARS-CoV-2 mRNAワクチンを単回投与すると、免疫反応が増強されるという証拠もあり、事態は複雑化している[[47]]。このような状況の中、Kramerと共同研究者は最近 2020年にスパイクmRNAワクチン(PfizerワクチンまたはModernaワクチン)の初回投与を受けた、SARS-CoV-2の免疫が存在するかしない被験者(血清陰性者67名、血清陽性者43名)の抗体反応を評価した[[47]]。初回投与後に繰り返しサンプリングを行ったところ、血清陰性の参加者の大半は、ワクチン接種後9~12日以内にSARS-CoV-2免疫グロブリンG(IgG)反応が変動し、比較的低い値を示した。対照的に、初回ワクチン接種前のベースラインでSARS-CoV-2抗体を持っていた参加者は、既存の免疫を持たないワクチン接種者の10~45倍の抗体価を急速に獲得した[[47]]。さらに、既存の免疫を持たないワクチン接種者の抗体価は、2回目のワクチン接種後に3倍に増加し、2回目のワクチン接種を受けたCOVID-19の生存者には抗体価の増加は認められなかった[[47]]。注目すべきは、これらの著者は、分析を拡張して、血清陰性の148人と血清陽性の82人の参加者で、1回目のワクチン接種後の疲労、頭痛、寒気、筋肉痛、発熱、関節痛などの全身反応の頻度を計算したことである。既往の免疫を持つワクチン接種者は、免疫を持たない人に比べて、全身反応の頻度と重症度が高かったという結果が出ている[[47]]。
これらの結果は、臨床試験結果の実生活への適用性についての議論を開いている[[48]]。SARS-CoV-2ワクチンの有効性と安全性を検証した臨床試験[[9], [11], [18], [19]]では、一般的に、参加時にSARS-CoV-2感染が陰性であった被験者を対象としている。実際、これらの臨床試験では、SARS-CoV-2感染が新たに陽性となることがエンドポイントとなってた。臨床試験の結果を現実の世界に適用する場合、SARS-CoV-2に対する既存の免疫を持った様々な国の多数の被験者にワクチンを接種することで、既に免疫を持っていて素因を持っている人に、非常に稀ではあるが、予期せぬ激しい炎症反応や血栓反応が引き起こされる可能性を排除することはできない。
このような反応に関わる基本的なメカニズムについては、さらなる研究が必要である。例えば、これまでワクチンの標的となっていた破壊された細胞から放出された自由に浮遊するスパイクタンパク質は、他の細胞のACE2と相互作用し、それによってACE2の内在化と分解が促進される可能性がある[[42]]。このメカニズムは、血小板の凝集を促進する[[43]]。また、ACE2と浮遊しているスパイクタンパク質との相互作用は、ACE2受容体の活性低下を介して、アンジオテンシンIIの過剰活性とアンチテンシン1-7の欠乏のバランスを崩し、炎症や血栓症などの副反応を引き起こす一因となる可能性がある(図1)。
このような背景から、タンパク質工学的手法を用いてウイルス侵入タンパク質の結合剤を同定することは、ACE2とスパイクタンパク質との相互作用による潜在的な有害作用を改善するための別の治療戦略を提供する可能性がある(図3)。
図3ACE2とSpikeタンパク質の相互作用による潜在的な有害作用を改善するための代替治療戦略として、コンフォメーション変化を起こした変異型Spikeタンパク質をコードするDNAテンプレートまたはmRNAを用いたワクチンの使用(詳細は本文を参照)。
変異した Spike タンパク質をコードする DNA テンプレートまたは mRNA を用いたワクチンを使用すると、コンフォメーション変化 (ACE2 との相互作用後の融合前コンフォメーションから融合後コンフォメーションへの変化、または RBD の変化) によって、ACE2 受容体への接着性が一部失われる可能性が示唆されている [[49], [50]]。
結論として、理想的なSARS-CoV-2ワクチン候補は、高い免疫原性、中和抗体による効果的な免疫反応を誘導する確立された能力、重症型COVID-19に対するほぼ完全な防御力、そして重要な有害反応のない良好な安全性を有している必要がある。この分野では活発な研究が行われているので、近い将来、このような特徴を持つ新しいワクチンが開発される可能性があると思う。
競業利益の宣言
本研究の著者はいずれも、経済的理由またはその他の理由で利益相反につながる可能性がない。
