Contents
SARS‐CoV‐2 biology and variants: anticipation of viral evolution and what needs to be done
www.ncbi.nlm.nih.gov/pmc/articles/PMC8251359/
オンラインで2021年4月5日に公開
Ruibang Luo, 1 Agnès Delaunay-Moisan, 2 Kenneth Timmis, 3 and Antoine Danchincorresponding author 4 , 5
概要
SARS-CoV-2が世界的に伝播し、多数の変異株が検出され、そのうちのいくつかはオリジナルのクレードに代わって優勢になっていることから、このウイルスがその進化の空間を積極的に探索していることが明らかになった。ウイルスは、高レベルの増殖が続くほど(高レベルの感染が認められるほど)人間の宿主に適応し、成功する方法を見つけることができる。COVID-19パンデミックの第3波は、世界各地で始まっており、これまでの感染封じ込め策が十分ではないことを強調している。封じ込め対策を決定する際に考慮されるのは、ワクチンを接種すればすぐに感染が止まり、正常な状態に戻ることができるという理論的根拠である。しかし、ワクチンは、それ自体がワクチン耐性を持つ変異株の進化のための選択圧となるため、ワクチン展開中に高レベルの感染/ウイルス増殖を容認する政策と、ワクチンがパンデミックに対処するという期待を結びつけることは非現実的である。有効な抗ウイルス剤がない場合、SARS-CoV-2感染症の予防には、インフルエンザの予防と同様に、「優勢な」ウイルスの変異株に対する毎年のワクチン接種キャンペーンが必要になる可能性は低くない。COVID-19との共存は、SARS-CoV-2の変異株と進化の問題となるだろう。したがって、今後出現するであろう変異株を予測するためには、SARS-CoV-2がどのように進化し、何がその進化を制約しているのかを理解することが重要である。これまでは、受容体結合スパイクタンパク質に焦点が当てられてきたが、ウイルスは複雑で、26のタンパク質をコードし、多数の宿主因子と相互作用しているため、進化の可能性は多岐にわたり、先験的に予測することはできない。しかし、COVID-19に対する最善の防御策を講じるためには、変異株に対する防御策を講じる必要があり、そのためには、ウイルスの進化の可能性に関する知識が必要である。ウイルスの一般的な細胞間相互作用に加えて、ヒトには広範な多型(Lewis、HLAなど)があり、ほとんどまたはすべての集団に分布しているものもあれば、特定の民族集団に限定されているものもあり、これらの変異はウイルスの進化に新たな機会や制約を与えている。現在、我々は、ウイルスの変異株を機能的に特徴づけるために、ウイルスゲノムの配列決定、タンパク質の構造決定/モデル化、タンパク質の相互作用解析などの手段を持っているが、包括的なゲノムデータへのアクセスは非常に不均一である。しかし、このような進化が感染や病気に与える影響を理解するためには、感染(ウイルスの疫学)や病気のデータ(患者の臨床データ)さらにはこれらのデータの母集団の粒度と関連付ける必要がある。この論説では、ウイルス生物学の重要な側面と、人間の多型、人間の行動、地理、気候などの関連する側面の影響を探り、これに基づいて、ウイルスの進化をモニタリングし、発生する可能性のある変異株の種類を予測するための一連の推奨事項を導き出している。
はじめに
現在進行中のCOVID-19パンデミックは、まさに分子進化のリアルタイム実験である。これは、ウイルスがナイーブな集団に侵入したときからのウイルスの挙動を明らかにするものである。この「実験」は、巨大な環境的・遺伝的多形性を示す78億個体のホモ・サピエンスを宿主とする地球上のほぼ全域に及んでいる。SARS-CoV-2ベータコロナウイルスの起源は、それほど遠くないコウモリの種に由来するにもかかわらず(Ji er al 2020; Makarenkov er al 2021)多少の謎に包まれているが、異なる集団や国で広がるにつれて、その進化をある程度正確に追跡することができるようになった。2021年3月2日現在、Global Initiative on Sharing All Influenza Data(GISAID、https://www.gisaid.org)で公開されている193,687個のSARS-CoV-2フルゲノムの中で、少なくとも1つのSNPを持つ変異の数は、最初に配列が決定された分離株「Wuhan-Hu-1」[INSDC AccNum MN908947.3 (H. Wang et al 2020b; Wu et al 2020; Zhu et al 2020)]と比較して、19,794個に達している。
パンデミックの進化の重要な特徴を浮き彫りにする貴重なツールを提供してくれる一方で、これらのSNPsの中には、真のウイルスの多様性を表現しているのではなく、品質が不均一なデータに由来するものもあるため、警戒が必要である。また、収集した配列の地理的分布に偏りがあると、特定のSNPsを過剰に、あるいは過小に表現してしまう可能性がある。病原性、病原性、感染性などの挙動が変化したウイルスの変異株を特定することは、ウイルスゲノムサーベイランスの重要な目的である。伝播量の増加は時間の経過とともに選択されることが予想されるが、変異の中には病原性を変化させるものもある(Oulas er al 2021)。しかし、ウイルスの変異株のスペクトルが広く、地理的条件の変化やヒトの広範な多型があるため、ウイルスのより強い毒性または減衰した株のいずれかを特定することが重要であるにもかかわらず、このことは確かに慎重に受け止めなければならない(図S1および表S1のコメントを参照)。この難しさは、SARS-CoV-2とCOVID-19について論じた膨大な数の論文(2021年3月3日のPubMedに掲載された109,000の論文)と、配列データベースにおける体系的なメタデータの共有が行われていないことからも明らかである。この論説では、パンデミックや文献の偏りの轍を踏まないように、できるだけ「既成概念にとらわれない」アプローチで、ウイルスとパンデミックの進化の特徴を予測しようとしている。そのために、パンデミックの発展に影響を与える可能性のある病原体の多様な機能と、それに対応する宿主との相互作用を分析することで、基本的なウイルス生物学(時間をかけて増殖/存続するという原初的な機能を目指している)に照らして、進化の制約を再検討している。これにより、我々が目にしているあまり目立たない特徴を明らかにし、パンデミックの進行に伴って起こりうることを予測することができる。
進化の重要な側面
進化とは、定義上、事後的に見られるものである。時間が関係するということは、生物の短期的な進化を予測する場合と、長期的な進化を予測する場合では、大きな違いがあるということである。さらに、進化は近視眼的であるため、予測を行うことは危険である。進化は近視眼的なものであり、壮大なデザインを持っているわけではない。しかし、長期的に見れば、生物が現存していること自体が、その期間中に繁殖を続けられた機能を浮き彫りにする。短期的には事情が異なり、子孫を残すための機能は限られており、例えば遠い未来に繁殖するための機能が欠けている可能性がある。長く付き合ってきた宿主から新しい宿主に移ると、ウイルスはいきなり不慣れな環境にさらされることになる。しかし、ウイルスはいつもの宿主で繁栄できた機能のプログラムに従っている。並行して、新しい宿主も長期的な進化の結果である。新しい宿主は、特定の侵入者に対しては無防備であるが、そのような侵入者に対応するためのさまざまな一般的な反応を保持する自然淘汰によって形成されてきた。ウイルスの場合、自然の自然免疫は、ウイルスの特徴の存在を認識するだけでなく、ウイルスの発生を防ぐ、あるいは少なくとも制御する機能が選択されてきた(Nan et al 2014,Chen et al 2017,Hur 2019)。これらの機能の多くは、動物や植物のファミリーでさえも共有されている。このことは、例えば、ショウジョウバエにおけるToll受容体の役割の発見(当時は予期していなかった)によって証明されている(Belvin and Anderson, 1996)。
短期的には、成功したウイルスは、ウイルスが繁殖する前に宿主が殺されない限り、宿主の生存から直接的なフィードバックを受けることなく、自分の降下速度を最大にすることができるということになる。宿主がいなければ、最大の殺傷効率を持つ極端な毒性は、長期的には維持できない。この本質的な必要性から、我々は、パンデミックの進展に伴って出現すると予想される機能に注目することになる。残念なことに、進化の様々な経路を理解することは、経済的または道徳的な風味を持つ人間中心の見解によって形成された多くの単純化された仮説につながっている:生物の行動は「利他的」または「利己的」とみなされ、突然変異は「有利」、「有害」または「中立」と認識される。ウイルス性の病原体の場合、ウイルスの子孫を活性化させる多くのプロセスには、矛盾を回避するための既存の理由がないにもかかわらず、このようなことが起こる。例えば、遺伝子産物に機能的な影響が確認されていなくても、ゲノム配列のヌクレオチドの変化は、宿主の代謝組織、ウイルスレプリカーゼの微調整、自然免疫の妨害、温度、機能的なtRNAの利用可能性の調節、他の病原体との共感染などに影響を与える。これらは、ウイルスの増殖に影響を及ぼし、先に挙げたものと同様に、あらゆるレベルで制約を受ける。これらはどれも実際には「中立」ではない。中立性や同様のソフト面を仮定することは、理解できないプロセスを説明し、自分の無知を隠すための手段に過ぎない。生物学的実体の進化において「ブラック・スワン(黒い白鳥)」の役割は避けられないとしても、パンデミックの将来を少なくともある程度予測できることを望むのであれば、これは誤解を招く恐れがある(Taleb, 2008)。
ウイルスゲノムの変更が効果を発揮するかどうかは、時間の経過とともに明らかになり、ウイルスの拡散を短期、中期、長期のいずれで調査するかによって、起こりうる結果は異なる。我々にとって重要なのは、どのような進化モデルを適用するかではなく、パンデミックが拡大し、ピークを迎え、落ち着いていく中で、どのような特徴のパネルが出てくるのかを見極めることである。この点では、今回のパンデミックは非常に予測可能であり、実際、多くの研究で予測されていた(Moya et al 2004,TuriniciとDanchin 2007,Horby et al 2013)。ここでは、モデルを使って予測するのではなく、ウイルス感染時に働く機能を特定し、それによってパンデミックの将来を少なくともある程度は予測できるかどうかを検討したいと思う。
機能解析:機能から配列へ、逆ではない
機能という概念は、把握するのが難しいことで知られている(Allen et al 1998)。ここでは、産業界での設計を例えにしてみよう。産業用機器やプロセスの設計は,対象となる実体を作り出すことを目的とし,それに付随する機能を理解すること,すなわち機能分析から始まる[Fantoni er al)。 一般的な進め方はボトムアップ型で、部品をリストアップし、それらを組み合わせて徐々に複雑な実体にしていき、最終的な仕掛けを手に入れる。これに対して、より良い方法は、エンドユーザーの視点から始まるトップダウン方式である。まず、機器の主機能を特定し(例:紙のプリンターの場合、印刷)次に主機能が動作するために必要な補助機能(例:紙の供給、インクの供給、エネルギーの供給、印刷時間のプログラミングなど)を特定していき、最終的に機器を構成する基本的な部品を特定する。しかし、ウイルスの機能、特にマスター機能を理解することは簡単なことではない。ここでは、生殖(子孫を作ること)と探索(宿主に到達すること)という、大きく異なるが絡み合った2つのマスター機能が必要であることを提案する。これらの機能を実現する方法は、基本的に無限である。これらの機能を実現する方法は基本的に無限であるが、制約がないわけではない。これらの機能は、生命に関連する物質、すなわち特定の構成要素や高分子で具現化されなければならない。幸いなことに、我々の探求の範囲は限られている。動物が出現する前からウイルスは存在していたので、動物はウイルスの侵入に対抗するための一般的な機能を備えている。
探索
まず、「探索」という基本機能に関連するウイルスの機能と宿主の反応を自由に挙げてみよう。生命体にとってこの機能は、様々なスケールで繰り返し使用される特定のヘルパー機能、「アドレス」を必要とする。我々の視点から見ると、病原性ウイルスの標的は人間である。ウイルスが最初に接触するのは、人間の体表面である。これにより、特定の侵入経路が浮き彫りになる。ここでは一般的な例を紹介する。
- 顔/腸のトロピズムは、我々が意識的に手を使うだけでなく、無意識のうちに手を使うという事実によって好まれる(周りを見渡して、顔を触っている人の数を見てみてほしい)。このトロピズムはその後、目→鼻→呼吸器系、口→腸と分かれ、COVID-19のパンデミック開始時に実際に確認された、ユビキタスなオロ・フェカ ル汚染ルートにフィードバックされる可能性がある(Jin er al 2020)。腸内経路がその重要性を維持しているという考えは、排水中にウイルスが存在することからもうかがえる(Sharma et al 2021)。現時点では、この経路を経由したSARS-CoV-2による感染は限定的であると思われる(Goldman, 2020)。しかし、我々の予想では、以下に論じるように、この経路が突然、支配的な役割を獲得する可能性があることを認識しておくことが重要である。
- ウイルスがエアロゾルを媒介する場合の直接的な呼吸器系への感染。鼻に感染した場合と肺の奥深くに感染した場合では結果が異なるため、このルートの詳細を注意深く観察する必要がある。また、宿主細胞の侵入口が変化している可能性もある。
- 病原体自身が寄生虫の宿主であるなど、より複雑な状況が考えられるが、不思議なことに、新しい感染方法のリスクがあるにもかかわらず、まだ調査されていない(Ng et al 2007))。
COVID-19のパンデミックは、最初の2つのルートに関連しているが、人間の行動(例えば、手や顔の衛生ルールの緩和)によっては、ウイルスの新たな進化の窓が開く可能性があることに注意する必要がある。
ヒトの宿主への対応
COVID-19は、人間社会の病気としての特徴を多く持っている(Danchin, 2003)。このことは、人々が自分の行動の一時的な変化さえも受け入れたがらないことに反映されている(Cherif er al 2016)。例えば、エアロゾルの役割については、様々な社会的・政治的な理由から、これまでも、そして今も議論されている。特に、マスクを着用することは、主に他人を守るために役立ち、着用者を守るためにはあまり役に立たないこと(Wei et al 2021)共通の利益の重要性に対する認識が社会によって大きく異なることなどが挙げられる(https://interactives.lowyinstitute.org/features/covid-performance/)。しかし、エアロゾルは、屋外であっても非常に長い時間、ウイルスを空気中に浮遊させておくことができ(Zhang et al 2020)SARS-CoV-2の場合には、主要な感染経路となる可能性が高い(Dumont-Leblond et al 2020,Lieber et al 2021)。この領域での論争は、マスクの着用に関する多数の不適切な推奨をもたらしたため、非常にダメージが大きい(Czypionka et al 2020)。このルートの重要性を理解していないことは、ウイルスが自己増殖し、長期的に危険な変異株を生み出す大きなリスクとなる。人間の行動の多くの特徴、すなわち混雑した環境で社交的になることを求める人間の魅力も、病気の拡散と永続に寄与している。ここでは、汚染源のいくつかの例を紹介する。これらの例は、感染やその伝播、持続のためのさまざまな可能性のある入口を強調している。
環境の変化
呼吸器疾患には強い季節的要素がある(Audi er al)。 しかし、多くの交絡因子が、よく知られた因子と感染症との間の真の因果関係を隠してしまうことがある。季節性、汚染、都市化、生物多様性または緯度はすべて、感染症に因果関係があると示唆されている(Wood er al)。 不思議なことに、気温や雨によって人間集団の屋内外のパターンが変化することはほとんど考慮されていない(Bulfone er al 2020)。感染確率は空気中のウイルス濃度に関係するため、感染者から排出された後のウイルスの希釈が感染の鍵となるため、屋外を含む混雑した空間に人間集団が密集していると、感染力が高くなる運命にある(Derjany er al)。 さらに、都市部の風に守られた場所での空気の滞りは、開放的な農村部よりもウイルスの希釈に不利である。また、粒子による汚染は、病気の重症度と関連している(Brauer er al 2021)。屋外環境では、紫外線の分布は、例えば、緯度や高度によって非常に異なる(Karapiperis et al 2020)。したがって、環境が異なれば、感染や侵入経路の選択圧も異なるため、ウイルスの進化も異なると考えられる。この点で、カプシドやスパイクだけでなく、ウイルスエンベロープの役割を理解することは非常に重要である。
肺と腸のトロピズム
現在のパンデミックの行方を予想する場合、腸管ルートと呼吸器ルートの両方が重要な意味を持つ。他のコロナウイルスの場合、両者の間で行き来が行われていた。例えば、伝達性胃腸炎アルファコロナウイルス(TGEV)は、生まれたばかりの子豚の小腸の絨毛上皮細胞と肺細胞の両方で複製され、ほぼ100%の死亡率を引き起こし、早くも1946年には米国の養豚場に壊滅的な打撃を与えた(Doyle and Hutchings, 1946)。1984年には、同じくアルファコロナウイルスを病原体とする第2の病気、豚呼吸器コロナウイルス(PRCV)が確認された(Wesley et al 1990)。その後、PRCVはTGEVの変異株であり、ウイルスのトロピズムを腸管上皮から呼吸器上皮へと変化させるいくつかの欠失があることが判明した(Rasschaert et al 1990)。驚くべきことに、PRCVに感染すると豚はTGEVから保護され、自然発生的な天然ワクチンとなった(Bernard et al 1989)。このように、トロピズムの変化は、ウイルスの毒性の減衰と関連していた。この観察結果は、腸の健康状態の変化を伴うモニタリングイベントを真剣に実施すべきであることを示唆している。しかし、トロピズムとは無関係に、このような希望に満ちた進化の傾向は、幸運な事故の連続にかかっているため、むしろあり得ないことである。減衰し、続いて、減衰した変異株が効率的に広まり、その後、一次病原体に対する免疫的相互防御が行われる。ウイルスの拡散と並行して弱毒化した変異株が出現する可能性はあるが、短期的にはこれら3つの事象が自然に起こる可能性は低いであろう。しかし、驚くべきことに、ブタTGEVスパイクタンパクのN末端の2つのアミノ酸の変化だけで、腸管トロピズムが失われたことを忘れてはならない(Ballesteros et al 1997)。したがって、弱毒化された型を積極的に探すべきである。しかし残念なことに、コロナウイルスに共通するプロセスである他のRNAウイルスとの組み換え(Zhang et al 2005;Chen et al 2019)により、弱毒化感染症の有望な普及が妨げられる可能性がある(以下のさらなる議論を参照)。
ヒトの多型性
ヒト集団の遺伝子構造の特徴も考慮すべきである。これは理解され始めているが(Williams et al 2020)この日(3月21日)にPubMedで「human polymorphism」AND(「COVID-19」OR「SARS-CoV-2」)を検索しても結果は出なかった。引用文を削除すると281の文献がリストアップされるが、関連性のあるものはほんの一握りである[例:(Ovsyannikova et al 2020)]。興味深いことに、コロナウイルス依存性の多型を調査した遺伝学的研究では、東アジアの集団の祖先は、数千年にわたって人々を感染させてきたコロナウイルス感染にすでに適応していたため、彼らの子孫はナイーブではなく、したがって現在のパンデミックに対して脆弱である可能性が高いことが示唆されている(Souilmi er al 2020)。
SARS-CoV-2は、細胞の標的に到達する前に、ムチンやその他の分泌物の層に付着し、それを通過しなければならない。いわゆるルイスシステムで分泌物を修正する方法によって、人間の集団がいくつかのグループに分かれることが起きている(Lemieux et al 1979年、Nordgren and Svensson 2019)。このことは、感染のプロファイルに対するさまざまな血液型の寄与に、さらに別の層を加えることになるはずである(Bloch et al 2021年、Le Pendu et al 2021年、Shetelig et al 2021)。ウイルスはまた、体液性および細胞レベルでの適応免疫反応の障壁を通過しなければならず、この領域におけるヒトの多型は膨大である。しかし、隔離された集団で病気が蔓延し、ウイルスのゲノム配列が収集できれば、パンデミックの将来をある程度予測できる重要な観察結果が得られるかもしれない。適応免疫に影響を与える環境的な手掛かりという点では、過去の感染はすでに新型SARS-CoV-2ウイルスが示すエピトープを特徴としている可能性がある(Ng er al 2020)。ヒトの多型性の主要なマーカーとなるヒト白血球抗原(HLA)は、このレベルで重要な役割を果たしていると考えられる。HLAによってタグ付けされた特定のウイルスのエピトープが宿主の因子と重なり、深刻な自己免疫反応を引き起こすことが起こるかもしれないので、これについては深く検討する必要がある[特定のHLAグループのインフルエンザH1N1ウイルスと関連したナルコレプシーのケースについての議論を参照してほしい(Schinkelshoek et al 2019)]。] しかし一般的には、適応免疫反応の寄与により、かなりのヒト多型に結びついた、非常に大規模な表現型のパネルが得られると考えられる。炎症のプロセスに関連するありふれた特徴の他に、この貢献を理解することができるのは、多数のウイルスのゲノム配列を収集することによってのみであり、適応免疫の代謝的な結果をヒトの多型の特定の特徴と関連付ける適切な予測を可能にする。
この段階では、ウイルスは細胞に侵入しなければならない(Tortorici and Veesler, 2019)。この目的のために、で説明するACE2(アンジオテンシン変換酵素2)を受容体として使用する。ACE2遺伝子はX染色体にコードされており、大きな多型性を示す。これは、性的二型が感染に影響を与えていることを示唆している。女性の場合、全身の細胞でX染色体がランダムに不活性化されているため、モザイク状の多形性が見られ、その結果、感染傾向や疾患の重症度が連続的に変化する可能性がある。ウイルスの拡散、重症度、進化を調査する際には、この遺伝的特徴を考慮する必要がある(Khayat et al 2020,Hamet et al 2021)。
細胞表面の受容体への対応
ウイルスは、標的に結合するために、さまざまな受容体や宿主因子をリクルートする(Baranowski er al 2001)。コロナウイルスでは、スパイクタンパク質が、コグネイト受容体に関連するトロピズム型の主要な決定因子である(Hulswit er al)。 先行するSARS-CoV-1と同様であり、別の受容体を使用するMERS-CoVとは異なり、SARS-CoV-2のスパイクタンパク質Sは、レニン・アンジオテンシンホルモン系の必須カルボキシペプチダーゼである一次標的受容体ACE2に結合することで、ウイルスの宿主細胞への付着と侵入を媒介する(Gross et al 2020)。ACE2は、心臓、腎臓、精巣、消化器系に発現している。肺では、一部の肺胞2型細胞に低レベルで発現しており、その発現は人によって異なるようである(Hikmet et al 2020,Zou et al 2020)。また、ACE2の発現はインターフェロンによって誘導されることから(Ziegler et al 2020)感染過程におけるフィードフォワードループが示唆され、コロナウイルスの進化の過程でACE2が受容体として採用されたことを説明できるかもしれない。
さらに興味深い特徴として、ACE2は、鼻杯分泌細胞、角膜、肺肺胞2型細胞、回腸吸収腸細胞、腸上皮細胞、胆嚢内で膜貫通型セリンプロテアーゼ2(TMPRSS2)と共発現している(Lukassen et al 2020;Trypsteen et al 2020)。タンパク質分解機能の関与は、ウイルス感染に重要であることが確認されており(Laporte and Naesens, 2017)コロナウイルスのスパイク(S)糖タンパク質のタンパク質分解切断は、宿主細胞への侵入のために糖タンパク質を活性化させる[下記参照(Hoffmann et al, 2020b)]。予測の練習では、高度に関連したウイルスや病気の間の違いを見つけることが明らかになることがある。SARS-CoV-1の感染では、ACE2受容体自体をアルギニン残基とリジン残基で切断すると、ウイルスの感染力が高まる。これらの残基は、TMPRSS2やヒト気道トリプシン様プロテアーゼ[HAT, (Bertram et al 2011)]による切断に不可欠である。一方、ACE2の切断は、SARS-CoV-1のウイルスSタンパク質の活性化には必要なかった(Heurich et al 2014)。さらに別のプロテアーゼが受容体として関与している可能性もある。ジペプチジルペプチダーゼ4(DPP-4)がSARS-CoV-2の共同受容体であることが示唆されているが、これについてはさらに実証されていない(Badawi and Ali, 2021)。いずれにしても、感染の最初のステップにおけるタンパク質分解の役割は、パンデミックの進展に合わせて注意深く調査しなければならない。タンパク質分解は、ウイルスが宿主の細胞に最初に結合する際に関与するだけでなく、後述するように、膜融合を媒介する。
細胞を介した膜融合によるウイルスの侵入
SARS-CoV-2による感染は、2つのステップで進行する。Sタンパク質がACE2受容体に結合した直後、ウイルスエンベロープは宿主細胞膜と融合する。その際、細胞内のプロテアーゼがスパイク状の糖タンパク質Sの細胞侵入を促す。翻訳後修飾、プロテインキナーゼ活性、あるいは様々なタイプの炎症細胞に対する役割は、ヒトコロナウイルスの拡散を理解する上で非常に重要である(Tharappel et al 2020)。Sタンパク質はホモ三量体であり、各モノマーは異なる役割を持つ2つの機能的サブユニットS1とS2から構成されている。コロナウイルスでは、プライミングと呼ばれるタンパク質分解によって、受容体結合ドメインを含み、細胞受容体への結合を促進するS1サブユニットと、膜融合の開始を誘発するS2サブユニットが分離される(Krueger et al 2001,Bosch et al 2003)。効果的な融合のためには、S2がさらに切断されてS2’フラグメントになることで、S2が活性化される必要がある(Chambers et al 2020)。
驚くべきことに、SARS-CoV-2は、S1とS2の境界に多塩基性モチーフであるArg-Arg-Ala-Arg(RRAR)をコードする挿入断片をS遺伝子内に導入していることである。これにより、ゴルジ装置のサブチリシン様プロテアーゼであるフーリンの典型的な標的となっている(Coutard er al)。 SARS-CoV-1には存在しないこの部位は、代わりに1つのArg残基を持つため、複数のプロテアーゼの関与を裏付け、病原性や宿主選択性に直接影響を与える可能性がある。また、ウイルスの侵入に影響を与えることなく、細胞間の融合を促進する可能性もある(Andersen et al 2020)。この見解を裏付けるように、機能的な分析では、宿主の膜貫通型セリンプロテアーゼ2(TMPRSS2)とフーリンが優勢な役割を果たし、共同で細胞表面でのウイルス膜融合を促進することが支持されている(Hoffmann et al 2020a;Papa et al 2021)。S2サブユニットが切断されると、Sタンパク質がS2’部位でTMPRSS2の処理を受けるようになり、近隣の細胞との膜融合が引き起こされ、合胞体が形成される(Buchrieser et al 2020,Papa et al 2021)。このように、SARS-CoVウイルスの細胞内への侵入を仲介する相互作用のネットワークは大きく、進化の余地が多く残されている。したがって、この領域での変異の出現を追跡し、臨床データと関連付けることが特に重要である。この領域の変異は、ヒトの細胞への侵入能力を高めたり、逆に弱めたりするウイルスを生み出す可能性があると予想される。また、別のシナリオとして、エンドサイトーシスによるウイルスの侵入は、カテプシンやフーリンファミリーのメンバーを含む他のプロテアーゼによってサポートされている可能性がある。スパイクタンパク質のS2ドメインによって引き起こされる膜融合のプロセスは、細胞のリソソームを介したウイルスのエンドサイトーシスを誘発する(Ballout et al 2020)。ここでは触れていないが、この過程でエンドソームが生成され、リソソームと合流した後、細胞の細胞質内にコーティングされたウイルスゲノムが放出され(Zhao er al 2021年)そこで複製サイクルが始まる(「生殖」の項で後述)。
興味深いことに、多数の細胞が融合してシンシチウムを形成することは、例えば感染性気管支炎ウイルスの場合に観察されるように、広く行われている感染プロセスである(Yamada and Liu, 2009)。また、細胞内に膜のないコンパートメントが形成される理由として、興味深い生化学的活動が提案されている(Ditlev, 2021)。このプロセスは、タンパク質のいわゆる「無秩序」な領域によって媒介され、膜なしコンパートメントの起源となりそうな相分離を引き起こすことが実証されている(Shea er al 2021)。コロナウイルスでは、このプロセスにNタンパク質が関与している可能性があり、特にアンコートの段階で、ウイルスが増殖するにつれて徐々に大きくなるウイルス特有のチャンバーを生成し、細胞の機械とその代謝物をさらにリクルートする(Dang et al 2021年、Lu et al 2021)。ウイルスゲノムの翻訳に関与するリボソーム以外にも、ウイルスタンパク質と相互作用する宿主の複数のタンパク質がコンパートメント化プロセスに関与しているが、その詳細はまだ十分に解明されていない。
ウイルス特有の防御
自然淘汰の結果、ウイルスは、物理化学的あるいは生物学的プロセスによって容易に認識され、不活性化されることを回避する手段を獲得した。コロナウイルスはエンベロープ型をしているため、ウイルスの防御機能はさらに強化されているが、宿主の脂質代謝との特異的な相互作用が必要である。SARS-CoV-2ウイルスのゲノムには、成熟したウイルス体に存在する4つの構造タンパク質、すなわちスパイク(S)エンベロープ(E)膜(M)タンパク質、およびゲノムを圧縮する核タンパク質(N)がコードされている。Sタンパク質とNタンパク質の役割を説明したが、他の2つのタンパク質は、保護的役割、制御的役割、構造的役割を持ち、ビリオンを形成する。さらに、内側と外側、つまりエンベロープを作るには、浸透圧や電位に対処する新しい機能を実装する必要がある。このことは、宿主の免疫反応を阻害することが明らかであることに加えて、Eタンパク質のイオンチャネル活性や、おそらく膜結合型の付属タンパク質の説明にもなっている(DeDiego er al)。
タンパク質はタンパク質分解の攻撃に敏感であり、自然に老化する(Truscott er al)。 翻訳後修飾はこれらの脆弱性を克服するために貢献する。細胞への侵入に使用されるウイルスタンパク質は、いくつかの理由で広範囲にグリコシル化されている:タンパク質の折り畳みを助け、安定性を提供し、最も重要なのは、宿主による免疫認識からウイルスをシールドすることである[これはしばしば「グリカンシールド」と表現される(Walls et al 2016)]。グリコシル化のレベルは幾分変化しており、インフルエンザ感染に重要なシアリル化の役割(Östbye et al 2020)は、SARS-CoV-2の場合はまだ注意深く検討されていない。Sタンパク質のモノマー1つにつき、22の潜在的なグリコシル化部位がある(D. Wang et al 2020a)。これらの部位のほとんどはN-グリコシル化が記録されているが、O-グリコシル化と思われる部位の占有率は低い。そのため、タンパク質中の対応するアミノ酸残基が重要なシールドの役割を果たしている。非同義的な変異は、変異株の子孫に影響を与える可能性が高く、アスパラギン残基が関与する変化を優先的にモニターする必要がある。
ウイルスの成熟と環境への放出
第2の探索段階では、ウイルスは感染した細胞、感染した臓器、生物から解放される。この感染段階の特徴はまだ十分に解明されていない。一部のウイルス変異株の伝達性に重要な役割を果たしている可能性がある(Lemey et al 2021)。宿主細胞の死は、ウイルスを解放するが、同時にウイルスを捕捉する可能性もある。したがって、活発な放出は、ウイルスの降下を伝播するためのより効率的な方法である。これは古くから出芽によるウイルスの成熟として目撃されてきた(Garoff er al)。 コロナウイルスの出芽に関与する宿主因子にはまだ不明な点が多いが、小胞体とゴルジ装置の両方が関与する細胞質内の全体的な一連のステップについては概説されている(Boson et al 2020)。他のウイルスと同様に(Ortego et al 2007年)SARS-CoV-2のEタンパク質は、成熟と放出の経路を駆動するのに重要である。複製されたゲノムは、核タンパク質NとMタンパク質を介して小胞体の脂質と結合し、ウイルスのパッケージングに必要な相分離のプロセスを推進する(Lu er al 2021)。その後、ウイルスは細胞表面に輸送され、リソソームの外分泌機能を利用して環境に放出される(Ghosh et al 2020)。このように、プロテアーゼはウイルスサイクルの重要な要素であり、将来のウイルスの進化を予測するためには、注意深くモニターする必要があることを改めて強調したい。
最後に、ウイルスのタンパク質は宿主のタンパク質と相互作用し、様々な安定性を持つ複合体を形成する。成熟期には、ウイルスエンベロープが、ウイルスおよび宿主のタンパク質をビリオン内に捕捉することが予想される。これらのタンパク質の中には、非特異的に捕捉されるものもあれば、ウイルスタンパク質との特異的な相互作用により、より安定して捕捉されるものもあるだろう。このステップは、次の感染に備えてウイルスを準備する役割を担っているにもかかわらず、一般的には見過ごされている。なぜなら、これらのタンパク質、特にウイルスのタンパク質は、感染後すぐに受容体である宿主細胞に注入されるからである。この必然的な「汚染」は、ウイルスが宿主を操作したり、ウイルスの増殖開始を早めたりするための方法として、進化の過程で形成されてきたことは間違いない。タンパク質構造のCoV3Dデータベース(Gowthaman et al 2021)は、これらのウイルスタンパク質が媒介する可能性のある相互作用のネットワークを予測する上で重要なリソースである。
細胞に侵入するとすぐに、ウイルスゲノムは2つの大きなポリペプチドに翻訳され、ウイルスのプロテアーゼによって迅速に活性のある非構造タンパク質に分割される。これらのタンパク質がビリオン内に含まれていると、明らかに選択的に有利になる(Haas et al 2021)。例えば、SARS-CoV-2のパパイン様システインプロテアーゼは、非構造タンパク質Nsp3のドメインであり、ウイルスの成熟、宿主の炎症への干渉、抗ウイルス免疫応答に不可欠である。SARS-CoV-1については、質量分析とプロテインキナーゼプロファイリングを用いて、ウイルス粒子に存在するタンパク質の補体について研究されている(Neuman et al 2008)。この実験により、宿主のプロテインキナーゼ調節能を操作する可能性のあるタンパク質相補体(Siddell et al 1981)のほかに、2つのウイルスプロテアーゼ、Nsp3とNsp5が実際に精製されたビリオンに存在することが明らかになった。大きくて複数の膜を持つNsp3タンパク質を見つけることは特に予想外で、自然選択に提出された重要な特徴を特定する一方で、どのようにしてビリオンに組み込まれるのかを理解することが求められた。さらに、Orf3a、Orf9b、Nsp2など、現時点では機能的な知見が限られているタンパク質も、成熟したビリオン内で発見されている。感染の初期段階のダイナミクスを理解するためには、ビリオンの構成要素を完全に解明することが不可欠である。
生殖
ウイルスが宿主細胞に結合すると、Sタンパク質が関与して内在化するが、先に述べたように、他のウイルスタンパク質も関与しており、そのシナリオはまだ完全には解明されていない。細胞内に入ったウイルスは、自分自身のコピーを複数作るための装置に到達しなければならない。SARS-CoV-2はエンベロープに包まれているので、ゲノムの複製と新しいエンベロープの形成に必要な酵素に翻訳される前に、いくつかのタンパク質、特にヌクレオカプシドNに結合しているゲノムの被覆をまず剥がさなければならない。
翻訳
RNAゲノムは、特定の細胞タイプに入る過程で、小胞体の適切な場所に到達した。RNAゲノムは直ちに翻訳機構に関与しなければならない。そのためには、長い5′UTRを介して、関与するリボソームによる活性開始複合体の形成が求められる(Tidu er al)。 この目的のために、ウイルスゲノムは標準的な細胞のmRNAを模倣している。特に、その5′末端はキャップされている。これにより、侵入してすぐに翻訳されるようになっている(Yan et al 2021)。その後の一連の流れ(Hartenian et al 2020)と、SARS-CoV-2ウイルスによって生成される機能性タンパク質の数は知られている(Kim et al 2020)。しかし、翻訳はまだ知られていない機能に対応する多くのステップで構成されており、そのうちのいくつかは今後のウイルスの進化にとって重要である可能性が高い(Neches er al 2021)。このプロセスには、リボソーム以外にも、ウイルスのタンパク質と相互作用する宿主の複数のタンパク質が関与しているが、その詳細はまだ明らかになっていない。
SARS-CoV-2のコード化能力は相当なもので、26種類のタンパク質の合成を指示している(Finkel et al 2021)。驚くべきことに、ウイルスRNAの翻訳は非対称のプログラムに編成されている。アンコートの直後、ゲノムの最初の3分の2は、大きなコーディング領域から、同じRNA配列から不均等な量で産生される2つのポリペプチド、Orf1aとOrf1abに翻訳される。Orf1abは、そのカルボキシ末端領域が、疑似ノットと-1フレームシフトを含むプロセスで翻訳される。Nspタンパク質の非対称な翻訳を引き起こすという、コロナウイルスの翻訳におけるこの普遍的な特徴は、Orf1aタンパク質とOrf1abタンパク質の正確な比率を制御するか、Orf1aの生成物(Nsp 1-11)がRNA複製に適した環境を作り出すまで、Orf1abの生成物(RNA依存性RNAレプリカーゼ、RdRp、Nsp12からなる)の産生を遅らせるための特定の環境を作り出す(Fehr and Perlman, 2015)。これらのポリペプチドはその後、16の非構造タンパク質、Nsp1-16(Orf1aの末端;Nsp11は真の機能を持たない可能性がある)に分割され、そのうちのいくつかは、これまで見てきたように、宿主から抜け出した後の自由なビリオンに存在する。ゲノムの遠位部分は、後述するように転写され、ビリオンの主要タンパク質であるE、M、N、Sなどの個々のタンパク質に翻訳される。
かなりの数のウイルスのゲノム配列を精査することで、ウイルスがコードするすべてのタンパク質に生じている変異を特定することができる。図11は、ウイルスの各タンパク質に生じた変異のうち、最も高い残基の変異率と最も低い変異率の比として計算された、最も高い対立遺伝子の頻度を示したものである。また、表S1には、各タンパク質の変異数が示されている。非常に変異が多いと予想されるSタンパク質の他に、RdRP(Nsp12)も非常に変異が多いという事実は、複製を標的とした抗ウイルス剤の発見が困難であることをすでに物語っている。同じことがプロテアーゼNsp3にも言えるが、Nsp3はマルチドメインであり、複数の標的を提供するため、問題は少ないかもしれない。Nsp2の機能はまだ十分に解明されていないが、その変異の多さから特に注目されている。Orf3の変異は、浸透圧に対する正しい反応を維持することでウイルスエンベロープの安定性を制御していると考えられるため、特に興味深い研究対象である。
図1 193,687株から得られた各タンパク質の、呼び出されたすべての変異(SNPと欠失)の最高対立遺伝子頻度(AF)の分布
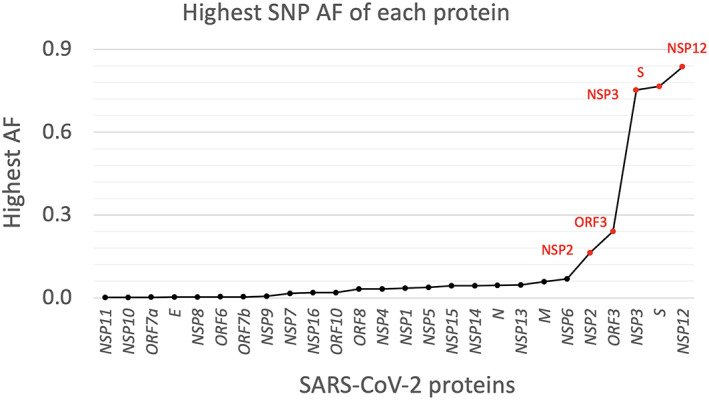
割合が10%より大きいタンパク質のラベルを示し、赤でマークしている。AF = allele frequency。y軸は、193,687株すべてから観測されたすべての変異のうち、最も高い変異率(=最も高い対立遺伝子頻度)を示す。[カラー図はwileyonlinelibrary.comで見ることができる]。
翻訳の制御は、ウイルスの発生に不可欠である。このプロセスは、正確なtRNAの補完物が利用できるかどうかに直接関係する。驚くべきことに、ヒトのゲノムは完全なtRNA分子をコードしていない。前駆体tRNAは、まず核内で成熟させ、その3’末端にCCA補体を付加しなければならない(Augustin er al)。 これは、tRNAを対象遺伝子のコドン使用量の偏りに適応させるために必要な、多くのtRNAヌクレオチド修飾の制御と合わせて、ウイルスの進化におけるボトルネックとなり、それがウイルスにコードされたタンパク質に反映されると考えられる。現時点では、期待される機能については何もわかっていないが、ウイルスのタンパク質遺伝子のコドン使用量の偏りに大きな変化をもたらす突然変異をモニタリングすることは、パンデミックの発展における重要な逸脱を予測するのに役立つだろう」と述べている。
タンパク質の分解
先ほど強調したように、ウイルスにコードされたポリタンパク質のタンパク質分解は、多くのウイルスの重要な機能である(Yost and Marcotrigiano, 2013)。Nsp3のパパイン様プロテアーゼドメインは、合成直後にLXGGアミノ酸配列を認識し、Orf1aとOrf1abを切断する(Barretto et al 2005,Gao et al 2021)。このタンパク質の3次元構造は知られている(Gao et al 2021)。驚くべきことに、このコンセンサス切断配列は、細胞内の脱ユビキチン化酵素によって認識される配列でもあり、Nsp3が宿主細胞の制御機能に干渉することを可能にしている。また、このプロテアーゼは、IRF3(インターフェロン制御因子3)を特異的かつ選択的に切断する。この切断により、SARS-CoV-2感染時に見られるI型IFN反応の弱さが説明できるかもしれない(Moustaqil et al 2021)。このプロテアーゼは、共通の認識部位で複数の重要な機能を担っているため、このプロテアーゼの進化のシナリオは極めて限られている。Nsp5は、[AVPT][VTKRM][LF]Q[ASN]配列を認識して、Nsp3の末端でNsp4を切断し、Nsp4の末端で切断された後、自由になる。その後、Nsp5は、Nsp6からNsp16までのすべてのNspを切断する。Nsp3の場合と同様に、Nsp5は宿主タンパク質、特に炎症の強力な緩和剤であるNLRP12(Normand et al 2018)や、炎症反応の構成要素であるTAB1(TGFbeta activated kinase 1 binding protein 1)の切断を媒介し(Xu and Lei 2020)サイトカインの産生や炎症反応の亢進の分子メカニズムを指摘している(Moustaqil et al 2021)。ここでもまた、病気の重症度に影響を与える進化的事象、この場合は特に「長いコビト」の発生の可能性は限られたままである。しかし対照的に、このことはこれらのプロテアーゼが優れた創薬標的であることを強調している。
転写
Orf1aおよびOrf1ab領域から翻訳され生成されたNspタンパク質、特にNsp12およびNsp13を用いて(Arya et al 2021年)ウイルスの遠位3分の1は、続いて、ウイルスの増殖を促進しながら宿主の防御の不活性化に寄与する個々のタンパク質をコードする転写物として発現される。ウイルスの3′末端は、複数の転写産物に転写され、個々のタンパク質、特に既に説明した構造タンパク質E、M、N、Sに翻訳される。タンパク質Nの多量体化は、複製にも転写にも必要である(Ahamad er al 2020)。転写産物は、完全なウイルスゲノムと同様に、キャップされている。mRNAキャッピング複合体は、タンパク質Nsp14,Nsp16,Nsp10からなる。Nsp16はNsp10と会合してキャップ0を2′の位置でメチル化し、ウイルスの正しい5′末端に機能的なキャップ1構造を完成させて、本物の宿主の機能的RNAとして認識され、その結果、抗ウイルス反応に攻撃されないようにする(Perveen et al 2021)。これらのタンパク質は、ウイルスタンパク質で繰り返し観察されているように、他の機能を持っているようであり、その進化の余地はさらに制限されている。Nsp9はRNA結合タンパク質でもあるが、その機能はまだよくわかっていない(下記の「品質管理」の項を参照)。キャッピング以外にも、転写開始には、ウイルス特有の3D RNA構造に折り畳まれた配列が必要であり(Madhugiri et al 2016)変異しても生産性の高いウイルスゲノムを形成することはできない(以下で検討する変異C241Uは明らかな例外である)。重要なのは、ウイルスの形態形成がいくつかの必須の転写ステップを含むという事実そのものが、転写制御領域の配列進化がかなり制約されていることを明らかにしていることである。ウイルスの複製/転写開始配列の変異に対する耐性がないのとは対照的に、タンパク質コード配列は、生産的なウイルスゲノムの合成を可能にする変異を蓄積する。しかし、これはタンパク質に依存しており、変異を受け入れやすいものとそうでないものがある(Nagy et al 2021)。
複製
ウイルスの増殖には、ウイルスゲノムの複製が中心となる。ポジティブセンスの一本鎖RNAゲノムウイルスであるコロナウイルスの場合、このプロセスは高度に非対称でなければならず、ウイルスゲノムの相補的なコピーの合成量はゲノムそのものよりもかなり少ない。この非対称性がどのように実現されているのかはよくわかっていない。おそらく、小胞体に関連するRNA依存性RNA複製装置に関連する多くの因子の存在が関係しているものと思われる。前述の翻訳の項で述べたように、Orf1aとOrf1abに由来するタンパク質の発現は高度に非対称であり、RNA複製に適した環境を作り出している(Fehr and Perlman, 2015)。SARS-CoV-2の複製を開始するには、ウイルスの構造化された3′末端にプライミングのためのタンパク質Nsp7とNsp8が必要である。その後、RdRpの主要サブユニットであるNsp12は、再びNsp7とNsp8の助けを借りてゲノムの複製を進め(Gao et al 2020)Nsp13はRNAの巻き戻しに関与する。RNA依存性RNAポリメラーゼは、複製プロセスの効率と正確さを決定するため、特に重要である。そのため、多くの抗ウイルス分子の標的として選ばれている。しかし、図1,1に示すように 図1,1に示すように、Nsp12には多くの変異が残されており、ウイルスの進化が薬剤による阻害を回避するための多くの解決策を提供していることを示唆している。このことは、Nsp12が抗ウイルス剤の良いターゲットではない可能性を示している。もう一つのサブユニットであるNsp15は、コロナウイルスに高度に保存されているU特異的エンドヌクレアーゼである(Pillon er al 2021)。その機能は十分に確立されていないが、宿主の抗ウイルス反応の回避に関与しているようである(Zhao er al)。 したがって、その進化は、今後のウイルスの病原性の進化の傾向を予想する上で興味深いものである。
品質管理
SARS-CoV-2の30,000ヌクレオチド長のゲノムのように巨大なゲノムでは、エラーを抑えるための複製と転写の精度が十分ではない(Bradwell er al 2013)。この選択圧の結果として、複製サイクルごとに過剰なエラーの蓄積を防ぐ校正複合体が出現した。エラー率が大きいと、急速に絶滅する欠陥ウイルスの形成につながるため、これは重要である(Pauly and Lauring, 2015)。RNAウイルスの複製の精度を下げることは、ファビピラビルのようないくつかのヌクレオチドアナログのドラッグデザインを推進する基本的なアイデアである。Nsp14は、キャップ0構造を作り出すグアニン-N 7-メチル基転移酵素であると同時に、ゲノム複製中に生じるミスマッチを除去する校正用3′-5′エキソヌクレアーゼでもある(Ogando er al 2020)。このタンパク質の多くの変異は、ウイルスの変異負荷を上昇させる(Eskier er al 2020)。この2つの機能を持つ酵素の変異を精査すると、新しいウイルス系統の「ブルーム」の形成がすでに明らかになっており、そのうちのいくつかは減衰する可能性が高い(Cluzel er al)。
また、ウイルスのタンパク質分解活性の品質管理も、その長期的な生存に重要な役割を果たすと考えられる。したがって、二量体のNsp9が、Nsp5プロテアーゼの切断部位と類似性のあるペプチドLEVELに試験管内試験で結合することに注目してもよい(Littler er al)。 しかし、このタンパク質の主な機能は、分子シャペロンの活性の調節に関わっていると考えられる。これらの因子は、特にウイルス感染時などのストレス条件下では、重要な品質管理要素である。したがって、SARS-CoV-2は、おそらく翻訳後修飾を介してシャペロンの役割を果たし、制御する機能をコードしていると予想される。Nsp9は、Nsp12(前述のRNA依存性RNAポリメラーゼ)のNiRANドメインに関連するマンガン依存性の活性によって、グルタミン酸残基のヌクレオチジル化(試験管内試験ではUTPをわずかに好む)によって修飾されている。この残基は、保存されたN末端のNNEトリペプチドに属している。これは、CoronaviridaeのNsp9ホモログにおいて唯一の不変の残基である(Slanina er al 2021)。興味深いことに、Salmonella enterica TyphimuriumにおけるNsp9のSelO(YdiU)対応物は、生命の3つのドメインすべてで保存されているタンパク質である。これはミトコンドリアのセレノプロテインであり、酸化還元ストレスを管理する役割を果たしている。また、ATPが制限されている状況では、ウリジル化によって分子シャペロンを修飾する(Y. Yang et al 2020c)。このヌクレオチド化の役割は優先的に検討されるべきであり、次項で述べるC > Uのトレンドの観点からも位置づけられるべきである。
未来を予測する
人間の行動は非常に不規則で、場所によって異なるため、未来を予測することは難しいと指摘するのは陳腐なことである(Sullivan er al)。 しかし、多くの状況では、経験に基づいた推測をしなければならない。例えば、アンドリュー・ライトの小説「The End of October」では 2020年初頭にCOVID-19パンデミックのもっともらしい展開を発表するなど、素人でも興味深いシナリオを提案することができ、本物の予測力を示している。伝染病をできるだけ短く、無害なものにするために管理することで、何百万人もの命を救い、莫大な経済的負担を軽減することができる。ここでは、誤った情報を排除した上で、速いペースで蓄積される膨大な量の知識を用いて、SARS-CoV-2の進化の過程で自然淘汰される可能性のある、制約の多い進化空間と少ない進化空間の一部を紹介する。
パンデミック1年目の進化の一般的パターン
SARS-CoV-2に対する人類の対応は、論文やオンライン出版物で膨大な数の議論がなされてきたが、極めて偏った限定的なものであり、緊急に検討すべき多くの点が置き去りにされていた。公的な議論では、エンベロープから突き出たタンパク質、悪名高いスパイクタンパク質(その役割のいくつかについては後述する)など、ウイルスの最も明白な特徴に焦点が当てられ、また、情報のない細胞モデルを使った生体外実験に基づく疑似治療も行われている。このことは、Google検索で「SARS-CoV-2」「spike」を検索すると、3月3日には600万ページが登録されたが(2月15日には900万ページだったので、減少傾向にあることがわかる)例えば「SARS-CoV-2」「Orf8」では50,400ページしか集まらなかったことからもわかる。しかし、すべてとは言わないまでも、ウイルスのタンパク質のほとんどは進化し続けている(Jaroszewski er al 2020)。図22と表S1に示されているように 図22と表S1に表示されているように、ウイルスの遺伝子の変異は、そのスパイクタンパク質よりもはるかに多くのものを包含しており、タンパク質間にはかなりのバリエーションがある。本稿の前半で述べたように、これらの変化を安定化させる選択圧は非常に多くの原因によるものであり、その中には人間が介入可能なものもある。多数の単離株に影響を与えた変異(ヒストグラム上段の最後の列)は、ウイルスの増殖にとって最も重要であると考えられる。
図2 193,687個のSARS-CoV-2株からまとめた各遺伝子の変異率
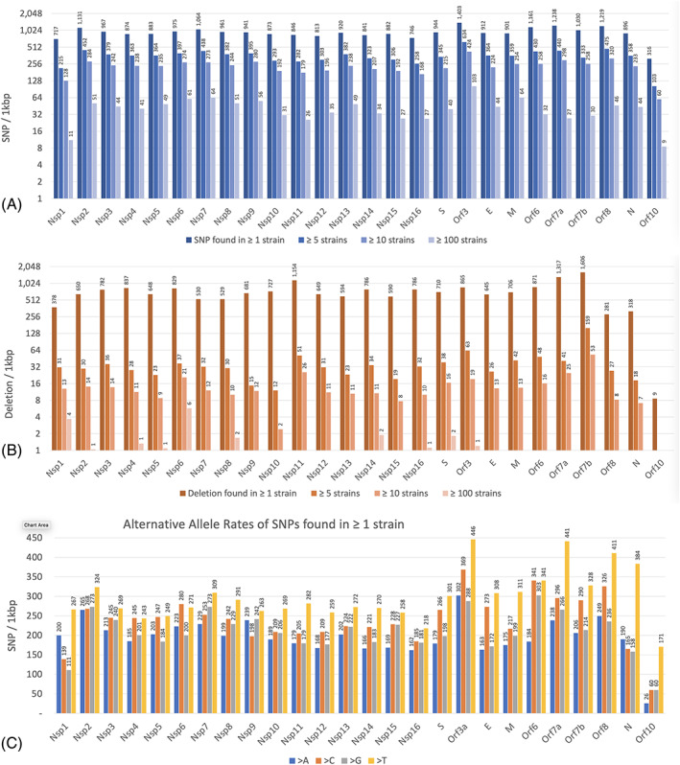
A. SNP率。
B. 欠失率。
C. 1株以上で見つかったSNPの代替対立遺伝子率。> A」は、SNPが非「A」から「A」に移行することを意味する。各遺伝子の長さを用いて、Y軸を1kbpあたりの変異数で正規化した。(A)と(B)では、y軸はベース2の対数スケールを使用し、≧1株、≧5株、≧10株、≧100株で見つかったものの変異率を示している。各遺伝子のこれらの変異率がどのように生成されたかについての情報は、補足説明に示されている。[カラー図はwileyonlinelibrary.comで見ることができる】。]
ここでは、今後のウイルスの進化の変化を予測する上で参考となる具体例を紹介する。タンパク質Nsp1は、ポリタンパク質Orf1aとOrf1abから分割された最初のウイルスタンパク質である。驚くべきことに、このタンパク質の大部分のウイルス変異株は、ほぼ同じサイズの他のNspに比べて少ない変異数を保持しており、長期的な進化に対する強い選択圧を示唆している。Nsp1は、ウイルスゲノムの翻訳開始に重要な役割を果たしている。Nsp1は、ウイルスゲノムの翻訳開始に重要な役割を果たしており、ウイルスのmRNA様ゲノムと細胞のmRNAの大部分との識別に関与し、その翻訳機能はウイルスの他のタンパク質とは異なる(Ou er al)。 このウイルスは変異を避けるためにかなりの圧力を受けているため、その配列に残っているわずかな変異を優先的に分析し、毒性の観点からその直接的な影響を報告すべきである。
最後に、先に述べたように、これらの変化を安定させる選択圧は非常に多くの原因によるものであり、そのうちのいくつかは人間が介入できる可能性がある。このため、ゲノム情報を最大限に構築するために、関連するメタデータを収集することが急務となっている。
環境要因
以前、呼吸器疾患の理解に影響を与える多くの交絡因子がもたらす疑問について強調した。しかし、混雑した環境、特に屋内に限らず、人から人への汚染に最も大きな貢献をしていることはよく知られているようである。エアレーションシステムの構造が大きな影響を与えると考えられ、屋外環境でも社会的な距離を置くことを強制する一方で、空気ろ過の使用を含めた建物のエアレーション方法の研究を促す必要がある(Turgeon et al 2014)。将来の呼吸器疾患のパンデミックを予測するために、居住施設、レストラン、オフィスビル、公共交通機関の建設には、外科手術室のような空気の流れの制御に関する特定のルールを課す強制的な規制が必要である(Timmis, 2020; Newsom er al)。
気候がウイルスの進化に寄与している可能性もある。(B. Chen et al 2020a)のような研究は、単純に、パンデミックの進展を説明するための交絡因子がかなり多いため、多くの知見には貢献しない。天候は人間の行動に影響を与える。我々は、寒いときには屋内にいる傾向がある。ここでも、屋内と屋外での感染伝播の寄与は、最もよく記録されているパラメータであるが、ほとんどの場合は推論に過ぎない。実際、この感染パラメータは外気温と関連している(気温/湿度が高い場合、エアコンが負の役割を果たす可能性もある)。その結果、閉鎖空間での換気(Pease et al 2021)は、ウイルスの進化に決定的な影響を与える可能性がある。このことは、特にモニタリングすべきいくつかの特徴を示唆している。予測に役立てるためには、閉鎖空間での感染を特定するメタデータを徹底的に調査し、エンベロープと関連タンパク質の構造、脂質との結合、小さな疎水性タンパク質の進化、イオンの回収と輸送との関連性を(ゲノム配列解析によって)調査する必要がある。環境のもう一つのパラメータである紫外線の照射についても、おそらく調査すべきである(Karapiperis er al)。 紫外線は病原体を殺す一方で、非常に特殊な方法で変異原性を持つ(Wurtmann and Wolin, 2009)。より標準的な変異原性ヌクレオチド修飾の中では、ウラシル・シクロブタン二量体を生成する。もしこれが重要であれば、ウイルスの進化に非常に偏った形で影響を与えることになり、おそらくUVスコアの高い地域から分離されたウイルスの変異パターンの偏りを分析するなどして、調査を行う必要がある。しかし、ここでは、将来の進化に最も貢献する可能性が高く、実験的アプローチが可能な、よく特徴づけられたウイルスの特徴に限定して議論する。
一般的に、このパンデミックを扱った膨大な文献で指摘されているように、主に宿主の抗ウイルス反応の制御に重点が置かれていた。この視点は、人間の習慣と感染を結びつけるのに役立つ。例えば、喫煙者は呼吸器系疾患が多いため、以前の感染症の病原体との交差反応によるある程度の防御効果があるかもしれない(Saurabh er al)。 多重感染はまた、ウイルス間の組み換えの原因となる可能性があり、この特徴は後述するが、重要な影響を及ぼす可能性がある。ウイルスの進化を予測する際には、この特殊な挙動を考慮する必要がある。この進化は、やはり全ゲノムの配列によってモニタリングされなければならないが、呼吸器や腸の過去の感染歴と関連して、一部のヒト集団におけるウイルスの進化を予測する必要がある。一般的には、ゲノム配列にリンクしたメタデータに、ウイルスのトロピズムが進化する傾向を示す可能性のある患者の臨床データ、特に呼吸器系と消化器系の両方の機能に関連するデータを入力することが重要であることは間違いない。
ウイルスの宿主依存型開発の限界
ウイルスの短期的な進化と長期的な進化の両方を説明するには、ウイルスとその宿主の代謝を関連付けることが不可欠である。ウイルスが増殖すると、宿主の代謝を自分の繁殖のために利用しなければならない。つまり、ウイルスは宿主の代謝を操作することになる。この点で、SARS-CoV-2は非常に興味深い生物体である。SARS-CoV-2の増殖は、細胞の成長という本質的に見落とされていた特性に基づいて、細胞代謝の魅力的な普遍的特性を浮き彫りにした。細胞が成長するとき、代謝の大部分は細胞質で行われ、そこでは細胞の成長に必要なすべての基本要素が生成される。このことは、経済学者にはよく知られているが、無視されている問題、すなわち「非omothetic」な成長を提起する。細胞は3次元的に成長するが、細胞膜は2次元的に成長する表面である。さらに重要なことは、ゲノムは1次元で成長する線状のポリマーであるということである。このことは、細胞膜を「作りすぎる」という代謝上の圧力と、ゲノムを「作りすぎる」というさらに大きな圧力があることを意味している。これらの特徴は、原理的には、非エンベロープ型ウイルスだけでなく、特にエンベロープ型ウイルスにとっても、ウイルスの増殖に大きなメリットをもたらす。このような物理的な不調和が、細胞内でどのように調和するように進化してきたのかを解明する必要がある。
実際、このハードルは、シチジン三リン酸[ゲノム配列の「C」を表す(Danchin and Marlière, 2020; Ou et al 2020)]という単一の分子の合成によって代謝の全セクションを通過させることで、自然淘汰によって解決されてきた。ピリミジン代謝の意外な特徴は、予想される酵素活性がどこにでも存在しないことを強調することで、この観察を立証している。ホスホリボシルトランスフェラーゼはプリン、ピリミジン、その他の複素環塩基をスカベンジしてモノヌクレオチドに変換するために遍在しているが、シトシンホスホリボシルトランスフェラーゼは現在までに発見されたどの生物からも同定されていない(Ou er al)。 近縁の酵素はどこにでも存在するので、このことは特に重要である。存在しない酵素は、既存の酵素のランダムな突然変異の結果として一貫して出現するはずなので、その不在は、シトシンヌクレオチドを完全に救済することに対する強い自然の逆選択を反映しているに違いない。SARS-CoV-2ゲノムにおけるシトシンの減少傾向に関連して、グアニン残基の減少も平行して進行している。なぜなら、複製中にGがCを補い、ウイルスのG含量がやや平行して減少するからである。後述するように、グアニンは活性酸素種(ROS)を含む特定の防御反応の標的となるため、これは興味深い結果となる。
当然のことながら、進化は、CTP合成を操作することでウイルスの発生を妨げる代謝機能を宿主に残している。CTPの抗ウイルス性アナログの合成は、人間の化学者が抗ウイルス性ヌクレオチドを作る方法と、魅力的な自然の類似性を持っている-3′-デオキシ-3′, 4′-didehydro-CTP (ddhCTP)は、viperin (Virus inhibitory protein, endoplasmic reticulum-associated, interferon-inducible)系のタンパク質によって合成され、哺乳類の生得的な抗ウイルス兵器に遍在している(Kang er al)。 , 2020)だけでなく、カキ(Green et al 2015)さらにはバクテリアやアーキア(Bernheim et al 2020)にも存在している。この阻害剤は、CTPの4つの重要な機能、すなわち、RNA合成、tRNAの3′末端へのCCA付加、シトシンヌクレオチドに依存した膜脂質の合成、そして最後に、タンパク質グリコシル化基質の普遍的なキャリアであるドリコールリン酸の合成を同時に阻害する(Ou et al 2020)。この代謝ボトルネックの結果として、SARS-CoV-2は、宿主の高度に特異的な代謝セットがこの制約を緩和しない限り、シトシンの一部を脱落させながら進化していくことになる(以下参照)。したがって、変化しないシトシン残基は、(RNAまたはコード化されたアミノ酸のレベルにかかわらず)ウイルス感染の永続性における重要性の証拠となる。これは、COVID-19抗ウイルス剤の重要なターゲットを示している。したがって、短期的な進化の過程で、ウイルスの異なる系統がこの制限にどのように対処したかをモニタリングすることが重要になる。これには、シトシンを排出する傾向が元に戻る可能性を指摘することも含まれる。なぜなら、元に戻るということは、CTP合成酵素の制御やビペリンによる阻害に変化が生じることを意味し、ウイルスの進化の状況を大幅に変えることになるからである。ここでも、ウイルスゲノムの完全な配列をできるだけ多く収集することが提唱されている。
免疫と代謝の関係をより深く理解することが急務であるが、現在、様々な種におけるウイルスの比較系統学的研究が大幅に増加しているので、その助けとなるだろう。特にコウモリの代謝をはじめとするさまざまな代謝環境との比較は、この点で非常に有益であり、ウイルスの進化の過程における制約条件を予測するのに役立つはずである。コウモリが飛行を進化させる過程で高速代謝が選択された一方で、これらの動物がウイルスを排出し続け、一般的には非病原性の常在生物として維持されていることは興味深い(Shen er al)。 飛行はエネルギー消費量が多く、大量の活性酸素を発生させる活動である。しかし興味深いことに、活性酸素は、マクロファージや好中球による呼吸/酸化バーストを介して、病原体に対する防御にかなり積極的な役割を果たしている(Piacenza er al 2019)。あまり検討されていないが、代謝回転が速いというこのポジティブな結果は、コウモリのウイルス感染が見かけ上無害であることに貢献しているかもしれない。それにもかかわらず、感染によって引き起こされた抗ウイルス反応に続いて、酸化還元のホメオスタシスを回復できないと、活性酸素、プロオキシダントサイトカインの無秩序な放出や、過剰な炎症による病理学につながる可能性がある。このプロセスの制御は、重度のCOVID-19(そしてもちろん「Long-COVID」)の共通の特徴である、肺感染における複数の進行性イベントに特に関連している。並行して、過剰な活性酸素はウイルスゲノムに大きな影響を与え、8-オキソグアニンが形成され、これが複製中にG > U変換変異現象を引き起こす。そのため、コロナウイルスは、このような化学物質による攻撃の負担を軽減する防御機能を進化させていると考えられる。したがって、ウイルスの特定の系統におけるトランスバージョンの数の一貫した変化をモニタリングすることは、非常に重要である(Cluzel er al 2020)。
ウイルスの短期的進化:伝染性の増加
短期的には、異なる種から新たに獲得したウイルスは、新しい宿主に感染する能力だけでなく、その増殖力の割合にも適応しなければならない。これは、これらのプロセスに影響を与えるすべての実体に変異が蓄積されることを意味する。伝染病の初期段階で最も可能性が高いのは、ウイルスがその増殖速度を上げることである。この展開は、2つの一般的な機能に起因している。最も可能性が高いのは感染の増加で、混雑した環境、一部の患者による感染性エアロゾルの安定的かつ長期的な生成、潜伏期の増加など、多くの社会的パラメータが関連している。2つ目の重要な特徴は、ウイルスの複製成功率の増加である。これは、増殖速度が速いと、通常、突然変異の負担が増加するという心強い結果をもたらす。
SARS-CoV-2がヒト集団に侵入した最初の時期には、ゲノムあたり年間平均約22個の突然変異が観測された。上述のシナリオと一致するように、ほとんどのコウモリウイルスゲノムではまだ説明がつかないほどCの含有量が高かったことから、Cヌクレオチドの全般的な減少が観察されている(Matyášek and Kovařík, 2020; Ou et al 2020; Simmonds, 2020)。ウェブサイト(http://www.bio8.cs.hku.hk/sarscov2)では、新しい株に含まれるCの割合を記録している(Luo et al 2020)。変異の継続的な出現は、タンパク質配列に期待される機能的汎用性と回復力によっても許される。パンデミックの最初の6ヶ月間、プロテオームの進化がモニターされた(Lubin er al 2020)。非常に多くの突然変異がウイルスタンパク質のアミノ酸の変化につながっており、正の選択がかなりのレベルで働いていることが示唆されている(Cluzel er al 2020)。ウイルスが新しい宿主に適応したからといって、それが重篤な病気を引き起こすとは限らないが、変化の中にはCOVID-19の重症度に影響を与えるものもあるはずだ。特に、C残基の脱落はddhCTPの干渉の効率を悪くするので、これが病原性の増加を促進するかもしれないことに注意すべきである。図33は、ウイルスの全タンパク質の変化のパターンを時間の関数として表示したものである。1株あたりの平均変異数は、パンデミックの最初の8か月間(2019年12月から 2020年7月まで)は1か月あたり約1変異の割合で増加したが、その後は1か月あたり約0.5変異と比較的低い割合で増加している(2020年8月から 2021年1月まで)。
図3 A. 2019年12月から 2021年1月までの各月における1系統あたりの平均変異数
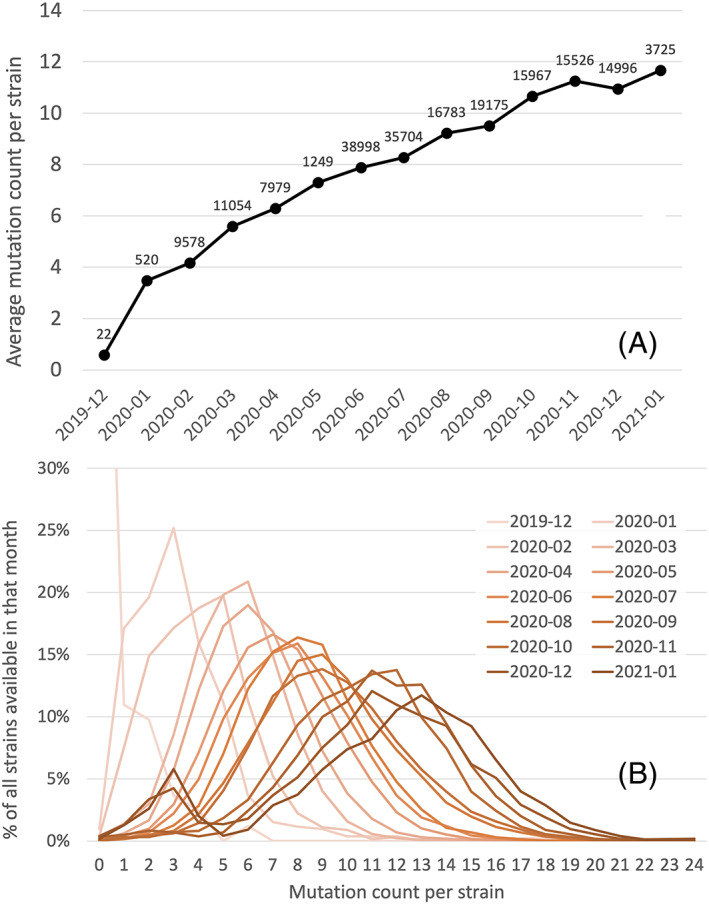
B. 2019年12月から 2021年1月までの各月における、菌株ごとの変異数の分布。(A)では、データラベルはその月の解析で利用可能な株の数を示している。[カラー図はwileyonlinelibrary.comで見ることができる】。]
ゲノム配列に沿って自然変異率が大きく異なるとは考えにくいが、急速に進化する遺伝子座がある一方で、極端に制約されている領域もあるようだ。急速に進化している領域では、ウイルス全体の増殖に対する選択圧が緩和されているため、宿主の抗ウイルス反応に迅速に適応できる可能性がある。この観察結果から、特定の機能の進化が、感染率の高い環境や低い環境と相関しているかどうか、また、病気の重症度の変化と並行しているかどうかをモニタリングする必要がある。一方、スパイク糖タンパク質、RNA依存性RNAポリメラーゼ、さらにはOrf3a、Nsp3,Orf6,Nsp4,Nなどに存在する特異的な変異は、重篤な病態を引き起こすことがあった。最後に、重篤な転帰に関連する変異は、Orf3a、再び、Nsp7に見られる。残念ながら、これらのタンパク質の役割は、病気の広がりという観点からはほとんど議論されていない。また、免疫反応の引き金となるSの役割が広く知られていることに加え、病気の臨床的転帰(緩和または重症化のいずれかの方向)の有意な変化と関連した22の突然変異のうち、4つ(3つは重症化と相関し、1つは軽症化と相関する)がヌクレオカプシドNの10アミノ酸長のリン酸化された部分にマッピングされた。
突然変異がウイルスにとって有害であるかどうかを調べようとしたin silicoやex vivoの分析もあったが、機能重視ではなく構造重視の傾向があり、結論となる推論に偏りがあった。変異が実際に削除されるかどうかは、関連する系統が長く存続しないと理解できない。いくつかの変異株の急速な広がりが、超拡散現象に結びついた創始者効果によるものかどうか不明だった時期を経て、現在では、いくつかの変異が実際に病気の広がりに影響を与えていることが確立されているようである(Borges er al 2020)。この見解は、基本的には事後的な記述的なものである。また、ウイルスが高度に統合された機能を持つ存在であるという事実もほとんど考慮されていない。ウイルスの進化を予測するためには、ウイルスを構成するさまざまな実体間の機能的エピスタシスを評価しなければならない。つまり、異なる変異の結合がウイルスの適応度にどのように寄与するかを評価しなければならない。今回のケースでは、この種の解析により、SARS-CoV-2遺伝子のOrf3aとNsp2,Nsp12とNsp6,Orf8とNsp4の間の遺伝子座、およびNsp2,Nsp13,Nsp14の遺伝子座の間の相互作用が確認された(Zeng et al 2020)。これらの相互作用の中には、まだ病気の重症度と関連していないものもあるので(上記参照)これは明らかになった。したがって、重症度にまだ相関していなかったタンパク質の配列がどのように進化しているかをさらにモニタリングすることは、非常に興味深いことである。このような調査の重要な結果として、病気の軽度または重度の症例に関連する系統を特定することで、病気の感染に関連する行動の政治的管理(社会的距離を置く、マスクを着用する、旅行するなどの規制)を、これまでに特定された主要なウイルスの機能の進化に合わせて、より正確に行うことができるようになるはずである。
ウイルスが集団の中に長期間留まると、ウイルスサイクルの様々なステップの負担が変化する。コロナウイルスは人間の集団と共進化し、人間の遺伝子のネットワークが東アジアの人々を部分的に保護している可能性が指摘されている(Souilmi er al 2020)。興味深いことに、ウイルスの最も重要なタンパク質の一部は変化しなかった。例えば、プロテアーゼNsp5のアミノ酸配列は、SARS-CoV-2の変異株をはるかに超えて、既知のすべてのコロナウイルスでも同じように高度に保存されている。ウイルスファミリー間で保存されている非/弱変化性タンパク質は、広域抗ウイルス剤のターゲットとなりうる。SARS-CoV-2のNsp5は、SARS-CoV-1のNsp5とアミノ酸配列が95%一致している。その立体構造は、HIVの場合に成功したアプローチである、阻害剤の設計に利用することができる(Lubin et al 2020)。関連するメタデータとリンクさせなければならないもう1つの重要な特徴は、致死率の変動と特定の変異との相関関係である。692のSARS-CoV-2ゲノム配列の中で、地理的な起源とCOVID-19の症例重症度との統計的に有意な関連が観察された。特にインド由来の株では、地理的変異自体が症例の重症度と対立遺伝子の変異の両方に関連していた(Goyal er al)。 この観察は基本的なものであり、SARS-CoV-2の全ゲノム配列を系統的に配列決定し、地理的進化を追跡する必要がある。また、病原性の傾向を注意深くモニタリングし、地域的な差異は封じ込めのための差別化された方針を引き起こすべきである。
予想を裏付ける注意点:急速に拡散する変異株
簡単に説明すると、パンデミックの初期段階で最も可能性が高いのは、ウイルスの伝播速度が速くなったときである。これは、2つの一般的な機能、すなわち、感染の増加(ここでは、混雑した環境、一部の患者による感染性エアロゾルの安定的かつ長期的な生成など、多くのパラメータが関係している)と、ウイルスの複製成功率の増加から生じる可能性がある。これらのプロセスの役割は、急速に広まり、既存のウイルス株に取って代わるいくつかの変異株ファミリーで明らかになっている(https://nextstrain.org/ncov/global)。最初に記録された例は、スパイクタンパク質のD614G変異で、これによりS1/S2接合部での切断が促進された(Gobeil er al 2021)。それ以来、Global Initiative on Sharing All Influenza Data(GISAID)で定義されているように、少なくとも8つの主要なクレードが存在している。S、O、L、V、G、GH、GR、GVの少なくとも8つの主要なクレードが地球上に広がっていることが判明している(https://www.gisaid.org/phylodynamics/global/nextstrain/)。アジアではG、GH、GR、L、S、Oの変異株が含まれる特定のパターンが見られ(Sengupta er al)。
残念なことに、変異株の命名法はやや不安定で混乱を招いている。病原体ゲノムデータの科学的および公衆衛生的な可能性を利用するためのオープンソースプロジェクトであるNexstrain(https://nextstrain.org)は、5つの変異株クレード19A、19B、20A、20B、20Cを提案した。Qingtian Guanと同僚も、5つのクレードに分布する系統を提案したが、名前は異なっている。G614,S84,V251,I378,D392(Guan et al 2020)。これらは、Andrew Rambautらが英国でのパンデミックをもとに提案したA、B、B.1,B.1.1,B.1.177のクラードと多少の関連性がある(https://virological.org/t/preliminary-genomic-characterisation-of-an-emergent-sars-cov-2-lineage-in-the-uk-defined-by-a-novel-set-of-spike-mutations/563)。
これらの分類に重なるように、さらに別の6つのクレードとその基礎となるシグネチャーSNPのシリーズがあり、これは変異株配列の早期入手によって検証された。例えば、VI型のクレードは、4つのシグネチャーSNPであるC241U(5′UTR)C3037U(Nsp3 F924F)C14408U(nsp12 P4715L)A23403G(Spike D614G)によって特徴づけられ、強い対立遺伝子の関連が見られた。この変異株は非常に早い時期に優勢型となり(H.-C. Yang et al 2020a)CからUへの進化が支配的である。クレードの優勢の変化を示す例として、インドのテランガナ州では、元々(武漢)のクレード19Aが、ウイルスの5′UTRに遍在するC241U変異とD614Gスパイク変異を持つクレード20Aに急速に置き換わり、続いて20Bが優勢になっている(Gupta er al)。 その後、スパイクタンパク質の他の多くの変化が急速に伝播することがわかり(Vilar and Isom, 2021)このタンパク質に対する選択圧の大部分が宿主への適応に由来することがわかった。したがって、このタンパク質と、より少ない程度のヌクレオカプシドタンパク質は、ワクチン接種という選択圧の下で最も急速に進化することが予想される。このことは、図44と図S1に反映されている。図44と図S1は、突然変異が世界でどのように伝播したかを示している。しかし、データ収集が極めて不均一であるため、これは状況の大まかな概要に過ぎず、ウイルスのゲノム配列を包括的に解析するプログラムが必要であることは強調されているが、このプログラムでは、各国でのウイルスの発展に伴う突然変異の密度が表示される。世界的にはスパイクタンパク質の変異密度は徐々に増加しているが、メキシコやブラジルなどの国では2020年9月以降、それらが急激に増加していることがわかった。
図4 193,687人のSARS-CoV-2フルゲノムにおけるスパイクタンパク質の変異のSNPアリル頻度(AF)
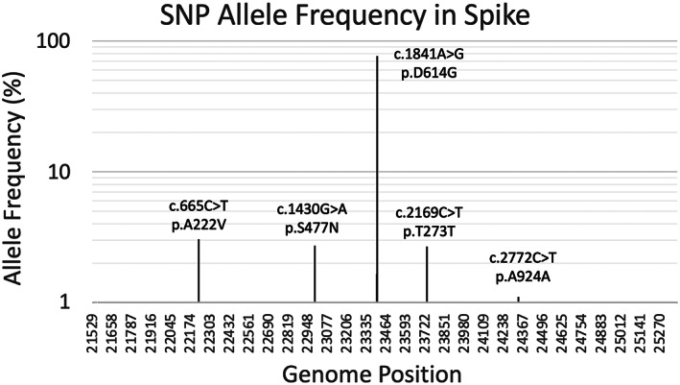
y軸は基数10の対数スケールである。AF≧1%の変異のみを示している
これらの研究が発表された後、他にも重要な変異株の出現が報告された。本稿執筆時点では、多数の変異を持ついくつかの変異株が広く流通しており(https://www.cdc.gov/coronavirus/2019-ncov/more/science-and-research/scientific-brief-emerging-variants.html)イギリスの変異株であるB.1.1.7,南アフリカの変異株であるB.1.351,ブラジルの変異株であるB.1.248(Firestone et al 2021)が世界的に広まっている。多くの変異が同時に変化している(https://covariants.org)。これは収斂進化の結果と考えられ、特定の変異の間にエピスタティックな相互作用があることを示唆している。このような変異を特定することは、ウイルスの機能的特徴を指摘することになり、それによってウイルスのさらなる進化を予測することができ、また、ウイルスの毒性を弱める傾向があるかもしれない。これらの変異株の特徴として、変異の多さに加えて、UK変異株には小さな欠失が存在することが挙げられる。一般的に、進化の過程では、挿入/欠失がよく見られることに注意する必要がある(図2参照)2)。実際、ヒトに感染したSARS-CoV-2は、コウモリウイルスのゲノムへの挿入が発端となっている。B.1.525系統は、スパイクタンパクの変異E484K、Q677H、F888LとB.1.1.7と同じ一連の欠失を持つ、13カ国で確認された興味深い新種であり、共分散が図られている(https://cov-lineages.org/global_report_B.1.525.html)。しかし、今後のパンデミックを予測するためには、スパイクタンパクに影響を与える変異以外の変異の潜在的な重要性を認識しておく必要がある。
現時点では、D614Gの変異が病気の重症度に影響するかどうかは不明である。しかし、最近確認された3つの主要な変異株(Zhou et al 2021)のうち、B.1.1.7の変異株では重症度の上昇が明確に示されている(Davies et al 2021)。他の多くの変異株は、ウイルスの初期の株に徐々に取って代わりつつあり、その中でもB.1.525(デンマーク、英国、ナイジェリア)は重症度は不明だが感染の可能性が高まっている。
スパイクタンパク質以外の重要な変異株のいくつかの例
ほとんどの観察結果は単なる説明的なものであるが、ウイルスの進化に影響を与えるような、特にスパイクタンパク質の予想される変異以外のウイルス機能の変化を特定することは非常に重要だ。例えば、複製プロセスの変更は、2つの大きく対照的な結果をもたらすことが予想される。一方では、長期的には変異株の伝播が阻害され、ウイルスの滅亡につながるが、他方では、短期的には進化の可能性を広げることになるかもしれない。このような観点から、ウイルスが爆発的に系統を増やして進化的な「ブルーム」を形成する傾向を観察することは、例えば、ウイルスがシトシンを排出する自然な傾向を逆転させる可能性と関連させるべきである(Cluzel er al 2020)。実際、ウイルスの進化の結果を予測する上で貴重なこのプロセスは、パンデミックの最初の6ヶ月間にいくつかのクローンを生み出した(Koyama er al 2020)。
注目すべき変異の中でも、ウイルスゲノムの5′UTRに普遍的に存在するC241U変異は、どのような特定の表現型にも関連していない。一般的には中立と解釈されているが、この変異によってウイルスは宿主の代謝にわずかに適応し、ビペリンの作用に対する抵抗力が向上することになる。さらに、その翻訳制御と宿主特異性に特に重要なウイルスゲノムの5′UTRリーダーに位置している(Tidu et al 2020)。その変化に続いて、ブルームの例が多く見られる。例えば、興味深い変異の連続は、今では世界中に広く分布している初期の変異G11083U(タンパク質Nsp6,L37F)から始まり、例えばインドでは大きく異なるクラッドに関連している(Banerjee er al 2020)。さらに別の変異であるG1440A(G392D、タンパク質Nsp2)続いてG2891A(A876T、タンパク質Nsp3のユビキチン様ドメイン)が複数の国で発見され(Liu er al)。 これにより、これらのタンパク質のどちらか一方を発現させることには、コストと利益のジレンマがあることが示された。この遺伝子座でのウイルスの降下は、興味深い弱毒化形態をもたらす可能性があるため、追跡調査する価値がある(Cluzel er al 2020)。同じように、SARS関連コロナウイルスのOrf8領域は多変量である。これはパンデミックの過程で変化し続け、継続的な選択圧を受けていることを示しており、時には2つのペプチドOrf8aとOrf8bが生成されることもある(S. Chen et al 2020b)。パンデミックの最初の部分では、Orf8の突然変異は、最初の突然変異から最後の突然変異まで6週間の間に、4つの異なる国と7つのサンプルに現れた分岐を示した(Cluzel et al 2020)。Orf8タンパク質は、感染サイクルの最後に発現する。ウイルスの病原性の進化にどのように貢献しているかをモニタリングすることが重要になるであろう(Neches er al 2021)。
最後に、ウイルスのレプリカーゼであるNsp12の進化をモニタリングすることは明らかに興味深いことである。パンデミックの初期に、5′末端に広く存在するC241U変異に始まり、Nsp12のジンクフィンガーの末端にあるC14408U(P314L)という変異が、またしても相次いで発生した。この突然変異は、ウイルスの進化系の多くの枝に現れた。この変異はレプリカーゼの活性を変化させるもので、この変異の後にウイルスの新しい系統の「ブルーム」が発生したことから、複製プロセスの変化が変異原性を持つことが示唆されている(Cluzel er al 2020)。注意深く観察すべき一例として、非常に興味深い連続性がある:スパイクタンパク質の変異A23403G(D614G)C3037U(同義)カリウムチャネルを形成するOrf3aの変異G25563U(Q57H)タンパク質の機能を否定的に妨害すると思われる(Issa et al, 2020)プロテインNsp2のC1059U(T265I)プロテアーゼNsp3のSUD-NドメインのトリプレットG4181A(A1305T)さらに突然変異G4285U(E1340D)G28209Uにより、プロテインOrf8のE106で翻訳が終了し、ウイルス進化の重要なマーカーとして再び登場した(Neches er al)。 パンデミックの発生から1年が経過した今、特にワクチン接種が加速している状況下では、新たな解釈を用いて、引き続き出現する変異を探る必要がある。
ワクチン接種とその予想される結果
ワクチン接種は、感染症を制御し、さらには根絶するために選択された方法である。しかし、多くの場合、ワクチン接種は非常に簡単であるが、HIVのようないくつかのウイルスに対して有効なワクチンを作ることは困難であった(Oyston and Robinson, 2012)。弱毒化したウイルスを注射することで初期の成功を収めた後、長年にわたって多くの種類のワクチンが設計されていた(Smith, 2012)。コロナウイルスの場合、ワクチンは動物の病気で成功している(Cruz et al 2010,Singh et al 2019)。そのため、少なくとも発病初期には、ワクチン接種が成功することが期待される。しかし、これまで見てきたように、ウイルスの進化は非常に速いため、初期のCOVID-19ワクチンの効果を低下させるような方法でウイルスが変異するリスクが継続的に存在している。複数の株は一般的な進化の特徴であり、ワクチン接種に影響を与える可能性がある(Zeng er al)。 これは、南アフリカで最初に確認されたB.1.351の変異がそうであるように思われ、初期のワクチンの効果が低下するか、あるいは効果がない可能性がある(Diamond et al 2021)。さらに、ワクチン接種キャンペーンが遅すぎると、ワクチンによる免疫を完全に逃れることができるような変異株を進化させる時間がウイルスに与えられてしまうことになる。この点、ウイルスの単一のタンパク質や、さらに悪いことに、ウイルスタンパク質のドメインに基づくワクチン(J. Yang et al 2020b)は、これらのタンパク質やタンパク質ドメインに変異を持つ変異株が急速に蓄積されるような形でウイルスの進化の軌道を進めることになる。
また、他の原因による感染も、ウイルスの進化に影響を与える可能性がある。SARS-CoV-1感染では、特定の集団が感染を免れたことから、過去の感染が相互防御をもたらした可能性が指摘されている(Ng er al)。 喫煙習慣と感染症の軽症化には、一見逆説的な相関関係があることを前述した。このことは、インフルエンザやインフルエンザワクチンの接種とCOVID-19の病気の進行との間に関連性があることを示唆している。インフルエンザウイルスに感染すると、SARS-CoV-2の感染力が高まるようである(Bai et al 2021)。しかし、レトロスペクティブ・スタディでは、インフルエンザワクチン接種とCOVID-19の間に負の相互作用は見られず、むしろ逆の結果となっている(Green er al 2020)。これらの観察結果を総合すると、部分的にワクチンを接種した集団の中でウイルスが増殖し続け、ウイルスゲノムの進化に変化が生じる可能性をモニタリングしながら、迅速なワクチン接種プログラムを実施することが必要である。これらの観察結果から、この病気の将来を予測するには、ワクチン接種を受けた集団と受けていない集団を別々に考える必要がある。
長期的な進化
1918年から 1919年にかけてのインフルエンザのパンデミックは、COVID-19のパンデミックに何が起こるかを予測するのに役立つかもしれない。当時、何が起こったのか明確なシナリオを再構築することはいまだに困難であるが、パンデミックが3つの段階に分けて進行したことが確認されている。最初の段階は深刻なインフルエンザのパンデミックに似ており、その後、非常に重篤な病気に発展し、最後に人間の宿主に適応して、最終的に現在の形に進化した。また、この病気は人間から豚に伝わり、現在も続いている(Shope, 1936)。インフルエンザウイルスは独立したセグメントで構成されており、類似したウイルスに感染すると再構成されることがある。興味深いことに、これらの強毒性変異株には、ウイルスが宿主細胞に感染し、そこから放出されるために必要なヘマグルチニンやノイラミニダーゼといったタンパク質は含まれていなかった(Reid et al 2004)。このことは、適応免疫系で容易に認識されるタンパク質以外のウイルスの特徴を考慮することが極めて重要であることを改めて強調している。
SARS-CoV-2は、単一のRNA要素で構成されているため再結合しないが、利用可能なRNAと再結合する傾向がある。その結果、短期的に最も心配なウイルスの進化の特徴は、コロナウイルスが大規模な組み換えを行う可能性があることである。RNAゲノムは通常、組換えを行うが、ゲノムが長いほど校正因子をコードしているため、ゲノム長と組換え率には逆相関がある(Zhang et al 2005,Goldstein et al 2021)。SARS-CoV-2では、このプロセスの制御はタンパク質Nsp14の活性に依存している(Gribble er al 2021)。組換えは、同じウイルスの異なる株への共感染から自然に生じることがある。この点では、有性生殖やより一般的な水平遺伝子移動と同様に、ミュラーのラチェットをリセットすることができるが、渡航制限が緩和されると、このプロセスが増幅される可能性がある。しかし、他のウイルスからのRNAや、人工的な構築物を使用することもできる。この点では、最近のmRNAに類似したワクチンでウリジンがシュードウリジンに置き換えられたことは、ウイルスの進化の可能性を広げる偶発的な組み換えイベントの圧力を緩和するポジティブなイノベーションだったかもしれない。しかし、この有益な特徴は、Nsp14校正エキソヌクレアーゼの一時的な変異株を考慮していない。このような変異株の出現は、ウイルスの進化の可能性を広げ、スパイク、ヌクレオカプシド、Orf8タンパク質にホットスポットを発生させる可能性があるため、注意深くモニタリングする必要がある。コロナウイルスは、グローバルな組換えパターンを示し、特に正の一本鎖RNAウイルスで広く見られる(Zhang et al 2005,Patiño-Galindo et al 2021)。組換えイベントは、逆行するだけでなく、広く異なる文脈で出現した変異をまとめることもある。ウイルスの組み換えは、異なる変異株との共同感染時に起こるため、密集した環境、特に閉鎖的な(屋内)環境、多くの人が呼吸する空気が再循環する環境、声の活動、つまりウイルスの排出量が多い環境を作り出す条件が有利に働く。このため、少なくともワクチン接種がほぼ完了するか、有効な抗ウイルス剤が利用できるようになるまでは、このような環境での曝露を最小限に抑えることが重要である。
パンデミックの将来を予測するには、ウイルスのトロピズムがどのように進化するかを注意深く分析する必要がある。現時点では、呼吸器系のトロピズムが主流となっているが、他のコロナウイルスでは、このトロピズムが極めて急速に進化することがわかっている。例えば、鳥類コロナウイルスのスパイクタンパク質の3つのアミノ酸の変化により、ウイルスが腎臓細胞に結合できるようになった(Bouwman er al 2020b)。マウスでは、コロナウイルスは向神経性作用を示すことがある(Pasick et al 1994)。細胞への侵入と融合に関する自然選択は、スパイクタンパク質の動的構造と強く関係している。コウモリ・コロナウイルスにフーリン切断部位を挿入すると、宿主を変えてヒトの受容体ACE2に適応できるようになったことを見てきた(Coutard et al 2020)。そして今、ウイルスは侵入のための別の受容体をすでに見つけている。すなわち、少なくとも試験管内試験のモデルでは、上皮細胞や神経細胞を含むさまざまな細胞に発現しているプロテインS、CD147との相互作用を介してである(K. Wang et al 2020c)。このことは、複数の受容体を用いることで、ある細胞種から別の細胞種へ、つまりある入口の器官から別の器官へと移行することができるという点で重要である。一方、MERS-CoVの受容体であるジペプチジルペプチダーゼDPP4には、ウイルスの侵入に悪影響を及ぼす多型が存在する(Kleine-Weber et al 2020)。他のコロナウイルスはさらに別の受容体を利用する:ブタデルタコロナウイルスはアミノペプチダーゼNを侵入受容体として利用し、スパイクタンパク質のドメインS2を介してAPNと相互作用する(Li et al 2018)。マウス肝炎コロナウイルス(MHV)は、そのスパイクのN末端ドメインを利用して、さらに別のタンパク質受容体であるCEACAM1aを認識する唯一の既知のコロナウイルスである(Shang er al 2020)。
もう1つの注目すべきウイルスの特徴は、ウイルスを分解から守るためのタンパク質のグリコシル化であり、これはウイルスが標的細胞に侵入するための手段として利用されている可能性がある。その例として、ニワトリコロナウイルスの感染性気管支炎ウイルス(IBV)は、ウイルスの重度にN-グリコシル化された付着タンパク質スパイクが、α-2,3結合シアル酸受容体Neu5Acに結合することで宿主細胞に侵入する(Bouwman et al 2020a)。ヒトコロナウイルスOC43は、ウシコロナウイルス(BCoV)のスピルオーバーから出現したようである。OC43は、ヘマグルチニン-エステラーゼが受容体破壊酵素として働くタンパク質Sを介して、9-O-アセチル化糖鎖ベースの受容体利用シアロ糖鎖に結合する(Lang er al)。 受容体相互作用部位は、9-O-アセチルシアロ糖鎖と相互作用するすべてのコロナウイルスS糖タンパク質に保存されており、その構造はコロナウイルスヘマグルチニンエステラーゼやインフルエンザウイルスC/Dヘマグルチニンエステラーゼ融合糖タンパク質のリガンド結合ポケットの構造と類似している(Tortorici and Veesler, 2019)。したがって、突然変異の結果としての糖鎖アミノ酸残基の変化と並行して、ウイルスの糖タンパク質に対する抗体反応をモニタリングすることが開発されるべきである。
展望
COVID-19パンデミックの発生から1年以上が経過した現在、ウイルスが様々な選択圧にさらされ、長期的な生存が可能になったという転換期にある。現在、ウイルスの進化を危険な結果へと導く3つの主要な要因が存在している。それは、株間の組み換え、かなり遅いワクチン接種キャンペーン、抗ウイルス剤を求める極めて限られた研究である。それと並行して、感染者の数も非常に多くなっており、混雑した環境で異なるウイルスの変異株に同時感染することは、もはや珍しいことではない。そうすれば、ウイルスのタンパク質の中で、ウイルスを弱体化させたり、逆に重症化させたりする可能性のある標的部位をピンポイントで特定することができるからである。
我々は、ウイルスの完全なゲノム配列の大規模な収集を提唱している。しかし、これは、それらを関連するメタデータと関連付けることで初めて意味を持つ。また、過去の病気についての質問も重要なメタデータである。メタデータは多ければ多いほどいい。ただし、メタデータの収集は適切に標準化されていなければならない。
緊急に行うべき行動は以下の通りであり、「汝の敵を知れ」という重要な原則に対応するものである。
- ウイルスの全ゲノム(スパイク状のタンパク質遺伝子だけでなく)を、可能な限りあらゆる場所で配列すること。これは、配列決定技術が向上し続けている時期には可能なはずである。例えば、752の臨床サンプルのNanopore®シーケンスを用いた実験では、ウイルスの3つのクレードが容易に特定された(Bhoyar et al 2021)。
- これらの配列に重要なメタデータ(感染者や臨床データについてわかることすべて)を関連付け、スパイクタンパクの調査に限定することなく、メタデータを特定の変異に結びつける。
- 系統とその伝播を確立し、年齢、性別、民族(許可されている場合)体重、ヒト遺伝子多型の特徴(HLA、ルイス分泌型)栄養習慣、喫煙習慣などの一般的な行動などの標準的なデータを含む多様なパラメータと結びつける。また、感染には人との接触が必要であるため、正確な感染場所(国、都市、建物)を特定し、気象学的パラメータと関連付ける必要がある。
- 進化のパターンの変化に注目する:系統のブルームの形成、ヌクレオチドパターンの進化の変更(CまたはGの消失傾向の反転、転位など)そしてこの進化をウイルスの特定のタンパク質の変異と関連付けることを試みる。
- これらの知識に基づいて、減弱している株を特定し、それらを増殖させて、肺から腸へ、あるいはその逆へのトロピズムの変化をモニタリングする。
- 重篤な株を特定し、その地域で厳重な封じ込めを行う
- 感染を下流だけでなく上流まで追跡し、感染者とその接触者の移動を厳重に管理する。
- 特に感染率が高く、複数の変異株が流通している集団では、ワクチン接種を可能な限り加速する。第一世代のワクチンによる免疫の影響を受けにくい変異株の出現に基づいて、第二世代、第三世代のワクチンを緊急に開発する。
- 新しい抗ウイルス剤の開発に大規模な投資を行う。これには、変化の少ないウイルスタンパク質の配列の蓄積に基づくターゲット主導型と、経験的な非ターゲットベースのスクリーニングの両方が含まれる。
最後に、我々はSARS-CoV-2の子孫と共存していかなければならないと思われる。つまり、SARS-CoV-2の悪影響を抑制するためには、その抗原決定基の進化を注意深く見守る必要があるということだ。最終的には、季節性インフルエンザと似たような状況になり、毎年異なるワクチンが必要になるかもしれない。他の呼吸器系疾患、特にインフルエンザとの共進化には細心の注意を払う必要があり、後者に対する安定した集団免疫を維持することを怠ると、悲惨な結果を招く可能性がある。
