Contents
- 要旨
- 序論と背景
- レビュー
- リンパ球減少は重度のCOVID-19とCOVID-19ワクチン接種の両方の特徴である
- SARS-CoV-2スパイクプロテインとそのS1サブユニットは試験管内試験で細胞シグナル伝達を引き起こし、生体内試験での腫瘍形成に寄与する可能性がある
- mRNAワクチンは、Toll様受容体(TLR)を介して宿主の自然免疫を不活性化し、I型IFN応答を損なうように設計されている
- COVID-19ワクチンのコドン最適化は、RNA-G四重鎖(G4)-タンパク質結合系の調節不全を引き起こし、細胞内マイクロRNAの翻訳調節を変化させる可能性がある
- mRNAワクチンに使用されるLNPはマウスで強い炎症を起こす
- 外来RNAの逆転写とゲノム統合がゲノム不安定性の原因となる可能性
- SARS-CoV-2スパイクプロテインのS2サブユニットと癌抑制タンパク質p53および乳癌1/2(BRCA1/2)との相互作用がin silicoで明らかになった
- SARS-CoV-2の宿主細胞への新規感染経路であるCluster of differentiation 147(CD147)膜貫通蛋白質は様々な癌と相関する
- がんまたはその既往歴のある人に対するCOVID-19ワクチン接種の検討
- 結論
www.cureus.com/articles/209584-sars-cov-2-vaccination-and-the-multi-hit-hypothesis-of-oncogenesis
SARS-CoV-2 Vaccination and the Multi-Hit Hypothesis of Oncogenesis
公開日:2023年12月17日
DOI:10.7759/cureus.5070
この論文の引用者:Valdes Angues R, Perea Bustos Y(2023年12月17日)SARS-CoV-2ワクチン接種と発癌のマルチヒット仮説。doi:10.7759/cureus.50703.
要旨
がんは複雑でダイナミックな疾患である。HanahanとWeinberg(2000)は、ヒト細胞が正常な状態から腫瘍化へと進行する過程で獲得する生物学的能力のグループとして、「がんの特徴」を提唱した。これらの能力には、増殖シグナル伝達における自己充足性、増殖抑制シグナルや免疫監視に対する鈍感さ、細胞死を回避する能力、複製的不死性を可能にする能力、エネルギー代謝の再プログラミング、血管新生の誘導、組織浸潤や転移の活性化などが含まれる。これらの能力の根底には、その獲得を促進するゲノムの不安定性と、その機能を助長する炎症がある。さらに、がんはもう一つの複雑な側面を示す。それは、腫瘍微小環境として知られる、浸潤および常在の宿主細胞、分泌因子、細胞外マトリックスからなる異種のレパートリーであり、がん細胞との動的かつ相互的な関係を通じて、不死性、局所浸潤、転移性播種を支えている。この驚異的な複雑さにより、がん患者(またはがんの既往歴のある患者)全員にCOVID-19ワクチンの一次接種と追加接種を勧める際には注意が必要である。さらに、これらの患者は重要な臨床試験に含まれていないため、ワクチンの有効性、安全性、抗がん剤治療との相互作用のリスクに関してかなりの不確実性が残っており、いずれの治療法の価値も無害性も低下させる可能性がある。
入手可能な文献を検討した結果、特定のCOVID-19ワクチンが、一部の(安定した)がん患者や生存者にがんの進行、再発、および/または転移を起こしやすくする、腫瘍形成促進環境(すなわち、腫瘍形質転換を引き起こしうる特定の環境)を生成する可能性を特に懸念している。この仮説は、生物学的に妥当であり、発癌のマルチヒット仮説(すなわち、リンパ球減少と炎症の誘発、アンジオテンシン変換酵素2(ACE2)発現のダウンレギュレーション、発がんカスケードの活性化、がん抑制タンパク質の隔離、RNA-G四重鎖-タンパク質結合系の調節異常、I型インターフェロン応答の変化、レトロトランスポーザブルエレメントのサイレンシング解除など)。ワクチン副作用報告システム(VAERS)に提出された証拠や安全性報告の増加とともに、COVID-19ワクチン接種後に疾患の悪化や再発を経験したがん患者がいることが示唆された。上記を考慮し、また、これらの懸念事項の一部(すなわち、発癌経路の変化、炎症カスケードの促進、レニン-アンジオテンシン系の調節異常)はSARS-CoV-2に感染した癌患者にも当てはまるため、我々は科学界および医学界に対し、COVID-19およびCOVID-19ワクチン接種が癌生物学および腫瘍登録に及ぼす影響を早急に評価し、それに応じて公衆衛生上の勧告を調整することを奨励する。
序論と背景
COVID-19ワクチンが世界全体で何百万人もの命を救った可能性があることを、多くの推定やモデル研究が強調している[1-6]。しかし、COVID-19の危機は、多くの人々、特にがんと共に生きる人々の健康と幸福に悪影響を与えた(すなわち、COVID-19の大流行は、医療へのアクセスを妨げ、がん検診や診断・治療サービスを延期し、がん患者を家族や愛する人から引き離し、ストレスや苦悩の新たな原因となった)。パンデミックから3年が経過した現在も、医療当局は活動性のがん患者やがん罹患歴のある患者に対してCOVID-19のワクチン接種を推奨し続けている[7]。ワクチンの有効性は時間とともに低下し[9]、がんやがん治療の中には免疫系に影響を及ぼし、ワクチンの効果を低下させるものがあるため[10]、ブースター接種が推奨されている[7,8]。COVID-19ワクチンの臨床試験では、がん患者は除外されているが[11-15]、免疫系が低下している患者は重症化するリスクが高いため、ワクチンによる防御が少しでもあれば、防御がないよりはましであるという前提がある。しかし、COVID-19ワクチン接種後に、活動性がん患者やがん罹患歴のある患者が疾患の増悪を経験したことを示唆するエビデンス[16-21]が増えている。米国疾病予防管理センター(CDC)と米国食品医薬品局(FDA)が共同で管理する全国的な自己報告型ワクチン安全性サーベイランスシステムであるVaccine Adverse Effects Report System(VAERS)[22]に登録された報告でも、COVID-19ワクチン接種(すなわちmRNAベースのワクチン)とがんとの間に、他のワクチンと比較して非因果的な関連があることが明らかにされている[23]。具体的には、Seneffら[23]は2つの異なるアプローチに焦点を当てた。1つは、がんに関連するキーワード、すなわち、「がん」、「リンパ腫」、「白血病」、「転移」、「がん腫」、「新生物」を含むあらゆる用語の件数を収集することであった。全体として、研究者らは、これらの用語をCOVID-19ワクチンに関連付ける1,474のエントリーを発見し、これはその年のいずれかのワクチンに関するこれらの用語のエントリーの96%に相当した。補完的なアプローチとして、特定の臓器、すなわち乳房、前立腺、膀胱、結腸、脳、肺、膵臓、卵巣の癌に関連する用語を検索した。数はすべて少なかったが、著者らはCOVID-19ワクチンに関連した特定臓器のがん症例534件を集計し、2021年のあらゆるワクチン症例の97.3%に相当した[23]。
悪性腫瘍は一般的に、進行に数ヵ月から、より一般的には数年かかると理解されており、現時点では長期的な健康脅威の可能性の存在を完全に把握することはできないが、一部の急速に進行するがんや、がんの再発や転移に関連する休眠がん細胞(DCC)の再活性化は、しばしば迅速に検出できる攻撃的なプロセスである[24,25]。このような中長期的な健康脅威の可能性を特定し、理解し、最終的には予防することが最も重要である。 私たちの知る限り、ワクチン接種を受けた被接種者とマッチさせたワクチン接種を受けていない対照群とのプロスペクティブなファーマコビジランスおよび/またはモニタリングは、十分にデザインされた臨床試験では追求されていない。さらに、再発はまれではないが、がんの再発に関する全国的な推定値は、がん登録によって日常的に収集されていない[26]。 前立腺など一部のがんについては、病期やその他の臨床情報に基づいて再発リスクを推定するのに役立つ公式がある[26]。しかし、再発率は腫瘍の特徴、病期、治療法によって異なるため、がんが完全に根絶したかどうかを予測することは(集団を代表するデータがない限り)後から考える以外には不可能である。したがって、すべてのがんサバイバーにとって、がんが再発した場合に速やかに発見できるよう、何らかのサーベイランス・プログラムを受けることが極めて重要である。 病気の理解や、医薬品、ワクチン、食品添加物、その他多くの物質の安全性評価における動物モデルの使用も、同様に重要である。私たちの情報によると、COVID-19ワクチン接種ががん患者の臨床転帰に及ぼす影響を理解するのに役立つ動物モデルは存在しない。 これらのテーマに関する研究を進めることは、保健当局がCOVID-19の重篤な転帰のリスクが高い集団におけるCOVID-19ワクチン接種のリスク/ベネフィット比を適切に評価するのに役立つだけでなく[27]、がんと診断された人やがんの既往歴のある人へのワクチン接種(または適切な代替療法)に関して、より確固とした結論を導き出すのにも役立つ。
まとめると、この論文の目的は、COVID-19ワクチン接種後のがん合併症の発生率と、SARS-CoV-2感染後(ワクチン未接種集団)の同様の事象の発生率を調査し、比較することが急務であることを強調することである。SARS-CoV-2スパイク(S)糖タンパク質の内因性産生を促進するワクチン、すなわちmRNAワクチン(ファイザー/バイオエヌテックおよびモデルナ)およびアデノウイルスベクター化ワクチン(ジョンソン&ジョンソンおよびオックスフォード/アストラゼネカ)に焦点が当てられている[28]。これらの製品は、より従来型の代替ワクチン(組換え蛋白質や生ウイルス、弱毒ウイルスに基づくワクチン)が開発された時でさえも、間違いなく世界中で最も広く使用されてきた。パンデミックの結果として、SARS-CoV-2感染に関連した悪影響[29,30]、がん検診、診断、治療の急減[31]、不健康な行動(アルコール摂取の増加、身体活動の低下など)の採用など、その他の臨床的・社会的要因が生じたことは認める、COVID-19危機によって誘発されたストレス[33] ;数百万人の成人が引き続き失業し、健康保険に加入していないという想定は、今後数ヵ月および数年間、がん死亡率に独立に寄与するであろう。
この記事の以前のバージョンは、2023年10月17日にAuthoreaプレプリントサーバーに投稿された。
レビュー
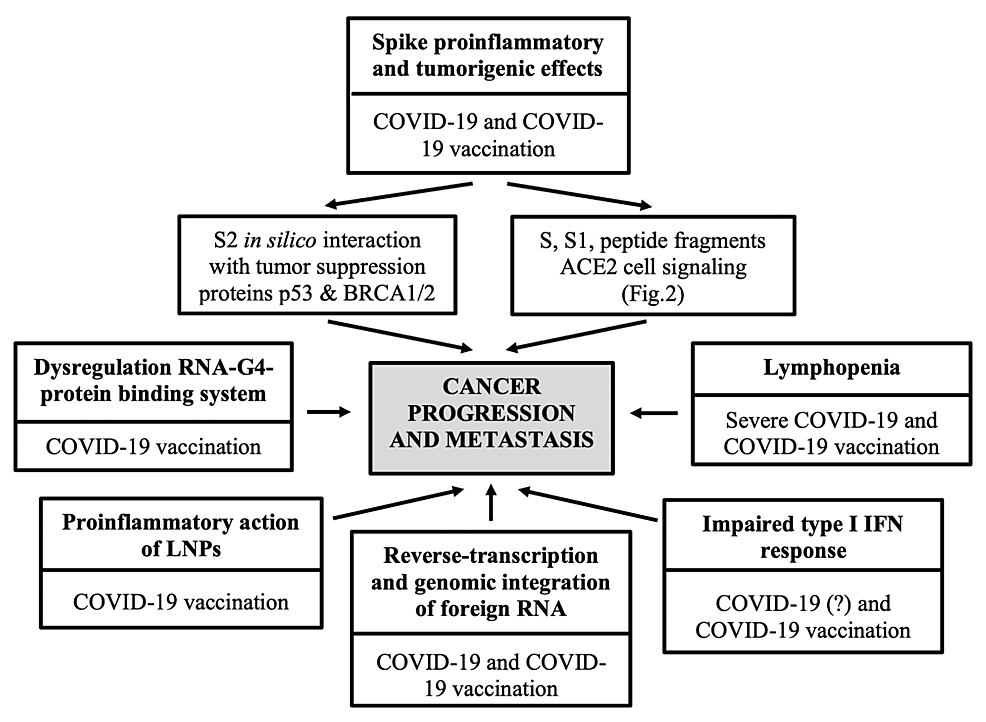
SARS-CoV-2スパイクプロテインベースのワクチン、特にmRNAワクチンは、がんの進行および/またはDCCの再活性化に有利な(一過性の)腫瘍形成促進環境を集合的に生成する可能性のある一連の生物学的メカニズムを開始する可能性がある。このような悪影響は、脂質ナノ粒子(LNP)の炎症促進作用、I型インターフェロン(IFN)応答の障害、構造的に修飾されたマイクロRNAによって引き起こされる細胞内マイクロRNAの翻訳調節障害に起因すると考えられる。構造的に修飾されたmRNA(mRNAワクチン)によって引き起こされる細胞内マイクロRNAの翻訳調節異常、および/または、産生された抗原、すなわちSARS-CoV-2スパイクプロテインおよび/またはそのサブユニットS1およびS2(mRNAワクチンおよびアデノウイルスベクター化ワクチン)のユニークな性質、発現パターン、結合プロファイル、炎症および腫瘍形成作用(図1)。
図1:SARS-CoV-2および/またはある種のCOVID-19ワクチンが介在する可能性のある、がんを促進する分子機構と経路
SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス、COVID-19:新型コロナウイルス019、BRCA1/2:乳がん1/2、ACE2:アンジオテンシン変換酵素2、LNP:脂質ナノ粒子、RNA:リボ核酸、IFN:インターフェロン
さらに、高レベルの可溶性スパイクおよび/またはそのサブユニットとペプチド断片がワクチン接種者の循環中に見出され、それらは数週間から数ヶ月間持続する。したがって、スパイクがヒトの体内で持続的かつ全身的に分布すること(ウイルススパイクは、ほとんどの場合、呼吸器以外の組織や臓器には影響を与えない)により、可溶性の循環型であれ、さまざまな組織や臓器の細胞で発現しているものであれ、SARS-CoV-2の侵入受容体であるアンジオテンシン変換酵素2(ACE2)とのさまざまな予期せぬ相互作用が促進される可能性がある。
以上の理由から、がん細胞とその微小環境に対するCOVID-19とCOVID-19ワクチン接種の効果を理解することが不可欠である。
リンパ球減少は重度のCOVID-19とCOVID-19ワクチン接種の両方の特徴である
リンパ球減少症は、リンパ球数の異常な減少によって定義される病態であり、非重症と比較して重症のCOVID-19の特徴である[34-36]。観察されるリンパ球減少、特にT細胞数の減少の根本的な原因としては、感染臓器へのT細胞の再分布、活性化による消耗、アポトーシス、パイロポトーシスなどが考えられる[37]。T細胞の消耗は、他のウイルス感染でも観察されるが[38]、COVID-19では、より急速で、深刻で、長期間持続するようである。 最近の研究では、重症のCOVID-19患者におけるリンパ球減少は、スパイク-ACE2非依存的にT細胞がSARS-CoV-2に感染した結果である可能性が高いことが示唆されている[39]。さらに、スパイクの発現だけで、E-カドヘリンなどの細胞間接合分子が陰性で、複数の核を持つ大きな細胞の一種である合胞体を産生するために、急速な膜融合を誘導するのに十分であることが報告されている。合胞体はリンパ球を内在化する傾向があり、COVID-19患者のリンパ球減少の一因になっていると考えられる[40]。
リンパ球減少症もCOVID-19ワクチン接種と関連している。BNT162b1(Pfizer/BioNTech)ワクチン[41]およびChAdOx1(Oxford/AstraZeneca)ワクチン[42]を用いた第I/II相臨床試験では、参加者の45%~46%において、ワクチン接種後6~8日目に血漿リンパ球が用量依存的に減少したことが報告されている。イスラエル(BNT162b1ワクチン)[43]とイギリス(BNT162b1ワクチンとChAdOx1ワクチン)[44]の予防接種プログラムに基づく2つのプレプリントは、一貫して、ワクチン接種後9日までの感染リスクの初期急増を報告している。それにもかかわらず、SARS-CoV-2ウイルス抗原に特異的なTリンパ球は、遺伝子ワクチン(すなわち、スパイク特異的T細胞)と、多抗原修飾ワクシニアウイルスアンカラ(MVA)ベースのCOVID-19ワクチンCOH04S1(すなわち、膜特異的T細胞、核タンパク質特異的T細胞、スパイク特異的T細胞)のような従来のプラットフォームの両方で、免疫後に最終的に増加することが示されている[45,46]。
COVID-19感染でもワクチン接種でも、リンパ球減少の根底にある分子メカニズムは完全には解明されていないにもかかわらず、リンパ球減少は長い間、がん罹患率の増加や悪性腫瘍のリスクと関連してきた[47]。リンパ球の変化はがん患者において頻繁にみられ、予後と生存に強く影響する[47,48]。重度のCD4+ T細胞リンパ球減少は、ヒト免疫不全ウイルス(HIV)感染の特徴の一つである。HIV/AIDSに罹患している人は、罹患していない人に比べて、ある種の腫瘍(すなわち、カポジ肉腫)を発症するリスクが高い[49-51]。 CD8+ T細胞は、免疫介在性休眠において重要な機能を有しており、その枯渇はDCCのブレーキを解除し、転移性進展につながる[52,53]。麻酔薬による免疫抑制は、使用量、期間、タイミングによっては、がんの再発を促進する可能性がある[54]。臓器移植を受けた患者において、臓器拒絶反応を予防する免疫抑制剤にさらされると、がんの監視機能が損なわれ、発がん性ウイルスの作用が促進されるため、移植後の腫瘍性合併症のリスクが高まる[55]。同様に、がんサバイバーのドナーから臓器を受け入れた臓器移植レシピエントは、免疫抑制剤に曝されることにより、(臓器と一緒に移植された)隠れていた潜在性転移巣が息を吹き返すため、悪性腫瘍を発症する可能性がある[56]。 注目すべきことに、臓器移植を受けた患者で発症したがんの25%は、免疫抑制剤の投与量を大幅に減らすと臨床的に寛解する[57]。驚くべきことに、化学療法、放射線療法、化学療法と免疫療法の併用など、ある種のがん治療もまた、重篤なリンパ球減少症を引き起こすことがあり、これは生存率の低下と相関している[47,58,59]。
リンパ球減少が炎症関連因子(後述)とともに、がんの進行および/またはDCCの再活性化に好都合な微小環境の形成に寄与することを考えると、がん患者、特に抗がん剤治療を受けている患者にCOVID-19ワクチン接種(最大5回接種)[8]を勧める際には細心の注意が必要である。COVID-19患者とワクチン接種者の両方において、リンパ球全体の減少をもたらす分子メカニズムに関する包括的な研究は、この重大な免疫学的異常とその結果を予防する、ワクチン接種戦略の改善および/または代替的介入の同定に役立つはずである。
SARS-CoV-2スパイクプロテインとそのS1サブユニットは試験管内試験で細胞シグナル伝達を引き起こし、生体内試験での腫瘍形成に寄与する可能性がある
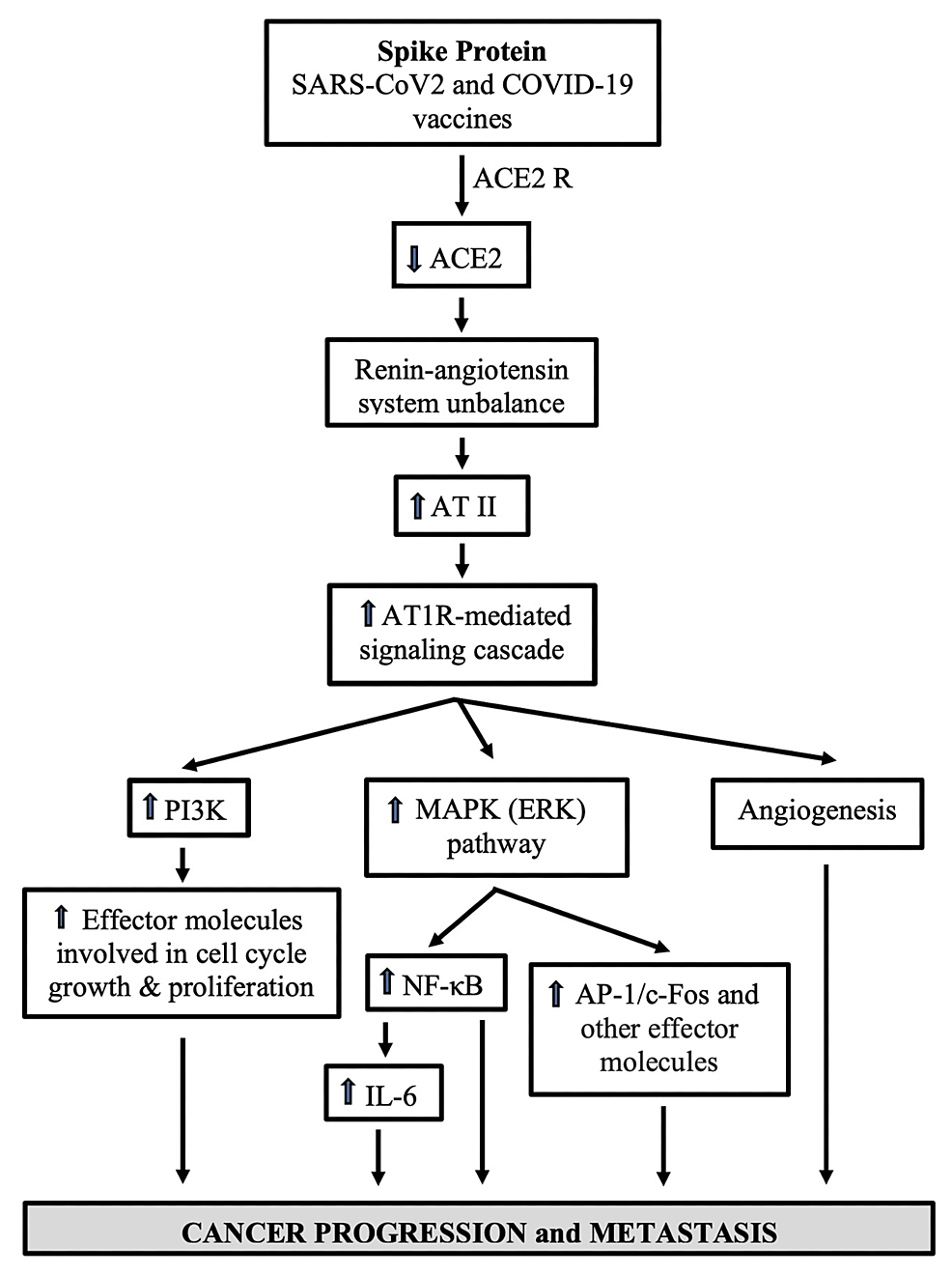
SARS-CoV-2は2つのサブユニットからなるスパイクプロテインを含んでいる:S1とS2である。S1は、多くの細胞表面に発現している多機能タンパク質であるACE2と結合することにより、ウイルスがヒト細胞に感染するのを助ける[60,61]。S2は膜融合プロセスを仲介する[62]。 SARS-CoV-2の宿主細胞への侵入を促進することに加え、スパイクとAEC2の相互作用は、ACE2を発現している細胞において細胞シグナル伝達を引き起こす[63]。肺血管細胞や肺動脈性肺高血圧症の発症に関与する細胞では、スパイクのS1サブユニット単独で、細胞増殖のシグナル伝達機構である細胞外シグナル制御キナーゼ(ERK)のモジュレーターであるMEKが活性化されることがデータで示されている [63]。 さらに、Patra et al.[65]は、全長スパイクがACE2発現のダウンレギュレーションを介して、アンジオテンシンII I型受容体(AT1R)媒介シグナル伝達カスケードを促進し、転写制御分子核因子κB(NF-κB)およびアクチベーター・プロテイン1(AP-1およびアクチベーター・プロテイン1(AP-1)/c-Fosを誘導し、マイトジェン活性化プロテインキナーゼ(MAPK)活性化を介して、上皮細胞におけるインターロイキン6(IL-6)レベルを上昇させた(図2)[65]。
図2:スパイクを介したACE2のダウンレギュレーションと細胞シグナル伝達が、COVID-19患者およびワクチン接種者における癌の進行を促進する可能性
ACE2のダウンレギュレーションとそれに続くAT1Rを介した反応は、その増殖促進作用と血管新生促進作用を通じて、癌の進行と転移を促す可能性がある。
SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス、COVID-19:新型コロナウイルス019、ACE2 R:SARS-CoV-2の侵入受容体として作用するアンジオテンシン変換酵素2、ACE2:アンジオテンシン変換酵素2、AT II:アンジオテンシンII、AT1R. アンジオテンシンIIタイプ1受容体、PI3K:ホスファチジルイノシトール3キナーゼ、MAPK:マイトジェン活性化プロテインキナーゼ、ERK:細胞外シグナル調節キナーゼ、NF-κB:核因子κB、IL-6:インターロイキン6、AP-1:活性化プロテイン1
癌細胞におけるNF-κBの活性化は、増殖、化学療法抵抗性、浸潤を促進し、一方、腫瘍微小環境においては、血管新生と免疫抑制を刺激し、集合的に転移プロセスを支持する[66]。Ras/Raf/MEK/ERK(MAPK)シグナルカスケードは悪性腫瘍に頻繁に関与している[67]。実際、ヒトの癌の30%以上がRas遺伝子によって引き起こされている[68-75]。IL-6レベルの上昇は、乳癌や頭頸部癌における腫瘍再発率の上昇と相関している[76,77]。対照的に、乳癌、頭頸部癌、肝細胞癌の前臨床モデルにおいて、IL-6/シグナルトランスデューサーおよび転写活性化因子3(STAT3)シグナル伝達の阻害は癌の再発を減少させた[78-80]。AT1Rが介在するシグナル伝達カスケードは、最も重要な細胞内経路(PI3K/AKT/mTOR)の構成要素であり、がんのマスターレギュレーターでもあるホスファチジルイノシトール3キナーゼ(PI3K)も活性化する[67,81]。この経路の過剰活性化は多くのヒト悪性腫瘍に見られ、癌の進行に関与している。一貫して、PIK3阻害剤の使用は腫瘍の治療における一般的なアプローチである[82]。
ヒト細胞がスパイクおよび/またはそのS1サブユニットに敏感に反応してACE2細胞シグナルを引き出し、ACE2が癌の血管新生および転移の阻害を含む複数の抗腫瘍効果および抗浸潤効果を発揮することを考慮すると、スパイクを介したACE2のダウンレギュレーション(または一過性であっても消失)が長期化すると、それ自体が腫瘍の進行を促進する可能性がある[83-86]。驚くべきことに、遊離浮遊するスパイク、Sサブユニット、およびSペプチド断片は、COVID-19ワクチン接種後、循環に入り[87,88]、数週間[89]、さらには数ヶ月[89]、重篤なCOVID-19患者に見られるのと同程度の濃度で体内に持続することが分かっている(表1)[89,90]。
| 抗原 | ワクチン接種 | 濃度(pg/mL) | 体内滞在時間(日) |
| S* | BNT162b mRNA-1273 | 初回投与後1~2日目-S値中央値:47pg/mL(血漿中) | 2回目の投与から少なくとも1~2日後(血漿)、60日後(胚中心およびリンパ節)に発現 |
| 初回投与後7日目-S値中央値:1.7pg/mL(血漿中) | |||
| 2回目の投与後1~2日目-S値中央値:1.2pg/mL(血漿中) | |||
| S, S1** | mRNA-1273 | 平均Sピーク値:62±13pg/mL(血漿中) | Sは初回投与後15日まで存在し、2回目以降は検出されない(血漿)。 |
| 平均S1ピークレベル:68±21pg/mL(血漿中) | S1は初回投与後14日まで存在、2回目投与後は検出されず、ピーク値は5日後(血漿中) | ||
| 断片*** | BNT162b mRNA-1273 | – | ワクチン接種後69~187日(血漿) |
表1:mRNAを介したワクチン接種後のスパイク抗原の体内濃度と持続性
*:[87], **:[88], ***:[89]
BNT162b:ファイザー/バイオエヌテックワクチン、mRNA-1273:モデルナワクチン
したがって、スパイクを人体に導入するCOVID-19ワクチンの中長期的な影響をモニターすることが不可欠である。最も重要なことは、癌の進行、再発、および/または癌治療に対する感受性に関連するこれらのシグナル伝達カスケードの寄与と機能的意味を理解するために、適切な実験動物モデルを開発することである。
mRNAワクチンは、Toll様受容体(TLR)を介して宿主の自然免疫を不活性化し、I型IFN応答を損なうように設計されている
DNAとRNAは、主にセンチネル細胞(すなわち樹状細胞やマクロファージ)に発現するタンパク質の一種であるTLRの活性化を通じて、哺乳類の自然免疫系を刺激し、侵入してくる病原体や、死にかけたり傷ついたりした細胞から放出される内因性分子に対する防御の第一線を構成する[91]。TLRはNF-κB、IFN制御因子(IRF)、MAPKを含む複数のシグナル伝達経路を引き起こし、がんを含む多くの疾患で重要な役割を果たす様々なサイトカインを産生する。RNAは特に、ヒトエンドソームのTLR3、TLR7、TLR8を介してシグナルを伝達する。しかし、RNA分子に修飾ヌクレオシドを組み込むと、TLR活性が消失する[92,93]。COVID-19 mRNAワクチンは、SARS-CoV-2スパイクmRNA配列のウリジンをすべてN1-メチル-シュードウリジン(m1Ψ)に合成置換している[94,95]。このような置換は、生物学的安定性を高め、mRNAの翻訳を促進し、自然免疫の感知を劇的に阻害する。なぜなら、制御不能な免疫活性化は、望ましくないアレルギー反応やアナフィラキシーショックにつながる可能性があるからである[94,96]。
mRNAワクチンにおけるシュードウリジンの重要な貢献にもかかわらず、高度に安定化されたm1Ψ修飾mRNAをヒト細胞の細胞質内に送達することの生物学的結果についてはほとんど知られていない。例えば、BNT162b2(FDA緊急使用認可を受けたPfizer/BioNTechの最初の候補)を用いたワクチン接種は、TLR7/8アゴニストR848およびTL3アゴニストpoly I:Cによる刺激後のIFN-α(I型IFN)およびIFN-γ(II型IFN)産生を有意に減少させたという研究がある[97]。Föhseら[97]によると、トランスフェクトされた修飾mRNAと相互作用するエンドソームTLRの感受性が低下することで、その後TLR3/7/8活性が減少し、サイトカイン産生が減少する可能性がある。重要なことは、効果的な免疫応答は、自然免疫系の一部として、TLRを介した強固なI型IFNシグナル伝達カスケードの誘導を伴うということである。この応答が阻害されると、溶解性および潜伏性ウイルス感染時の免疫病理が生じる可能性がある[98,99]。ヘルペスウイルス感染症患者では、TLRの発現不全が報告されている[100,101]。TLR3およびその下流のシグナル伝達分子の変異は、単純ヘルペスウイルス脳炎[102,103]、水痘帯状疱疹ウイルス髄膜脳炎[102]、および再発性帯状疱疹性眼炎[103]の症例と関連している。注目すべきは、アデノウイルスベクター化または不活化COVID-19ワクチン接種後ではなく、mRNA(BNT162b2およびmRNA-1273)接種後に、帯状疱疹の症例数がますます多くなることが報告されていることである[104-109]。このような観察は、m1Ψ修飾mRNAによって引き起こされるTLRを介したI型IFN応答が損なわれていることと一致している。
BNT162b2注射前後の急性COVID-19患者と健常ボランティアの末梢血のマルチモーダルシングルセルプロファイリングでも、両免疫チャレンジに対する反応に劇的な違いがあることが明らかになった。 COVID-19患者では、免疫応答はI型IFN応答が高度に増強されることで特徴付けられたが、これはワクチン受容者にはほとんど見られなかった。IFNシグナル伝達の増加は、COVID-19患者で観察された末梢T細胞や自然免疫様リンパ球における細胞傷害性遺伝子の大幅なアップレギュレーションに寄与している可能性が高い。B細胞およびT細胞のレパートリーを解析すると、COVID-19患者ではクローン性リンパ球の大部分がエフェクター細胞であったのに対し、ワクチン接種者では、クローン性の拡大は主に循環記憶細胞に限られていた[110]。にもかかわらず、SARS-CoV-2感染時にI型IFN活性が強固であるか[23,110,111]、あるいは低下しているか[112,113]については、十分なコンセンサスが得られていない。例えば、SARS-CoV-2 S1サブユニットが、マカク肺気管支肺胞洗浄からの初代細胞において、ACE2およびI型IFNの発現を直接抑制し[113]、SARS-CoV-2に関連した肺疾患の一因となったという逆の証拠がある。さらに、50歳以上でCOVID-19と診断された場合、帯状疱疹を発症するリスクが増加することが報告されている[114,115]。 この明らかな論争は、IFNを大量に分泌することで感染除去を速やかに達成する急性の抗ウイルス免疫応答と、IFN応答の機能的枯渇を伴う、より長く強固な炎症パターン(すなわち、COVID-19の重症型)を引き起こすものとの間の微調整によって部分的に説明できるかもしれない[116]。それにもかかわらず、末梢リンパ球減少症(重症のCOVID-19患者とCOVID-19ワクチン接種者の両方で報告されている)は、COVID-19患者とCOVID-19 mRNAワクチンを接種した人の両方において、潜伏性帯状疱疹感染の再活性化を代替的に(または追加的に)正当化する可能性がある。
驚くべきことに、TLRは免疫細胞だけでなく腫瘍細胞にも発現しており、悪性化を抑制することも促進することもできる[117]。 ヒトとマウスを用いた多くの研究により、免疫細胞と腫瘍細胞の両方から産生される内因性のI型IFNが、腫瘍増殖の制御や抗腫瘍療法に対する反応において重要であることが強調されている[118-120]。Seneffら[23]は、癌の監視と癌の抑制におけるIFN、特にIFN-αの複雑さと役割について広範に論じている。著者らは、直接的(すなわち、細胞周期の停止、アポトーシス、ナチュラルキラーおよびCD8+ T細胞の活性化)および間接的(すなわち、ヤヌスキナーゼ/シグナルトランスデューサーおよび転写活性化因子(JAK/STAT)経路の遺伝子転写活性化)メカニズムの両方を通して、IFN-αによって開始される抗がん作用のめくるめく範囲を指摘している[23]。JAK/STAT経路は、いくつかの血液学的悪性腫瘍において制御不全であり、このことは、黒色腫、結腸直腸癌、リンパ腫の動物モデルにおいて転移能を増大させることが示されている[121]。リンパ球のIFNシグナル伝達の欠損は、乳がん、黒色腫、消化管がん患者において生じており、これらの欠損は、免疫機能不全のがんに関連した共通のメカニズムである可能性がある[120]。一貫して、I型IFNの外因性投与および/またはI型IFN誘導剤の使用は、固形がんに対する自然免疫応答と適応免疫応答を高める[122,123]。
I型IFN応答の障害は、慢性感染症(HIV/AIDS)や自己免疫疾患(多発性硬化症(MS)など)を含む他の疾患でも観察される。 I型IFN応答を阻害することにより、HIV-1は宿主の抗ウイルスシグナルを回避し、持続的なウイルス貯蔵庫を確立することができる。HIV-1が介在するIFN経路の欠陥には、病原体の検出に関与するタンパク質受容体の障害、I型IFNのアップレギュレーションに必要な下流のシグナル伝達カスケードの障害、主要なI型IFN誘導性抗ウイルスタンパク質の発現または機能の障害が含まれる[124,125]。驚くべきことに、HIV感染者は一般集団と比較して、カポジ肉腫、非ホジキンリンパ腫、子宮頸がん[50]などのいくつかの種類のがんのリスクがかなり高く、また、程度は低いが、肛門、肝臓、口腔/咽頭、肺のがんやホジキンリンパ腫[51]もある。同様に、I型IFNシグナル伝達が抑制され、IFN療法によく反応するMS患者[126,127]も、一般集団に比べてがん発症リスクが高い[128]。このリスクの増加は、気管、気管支、肺のがんと同様に、前立腺がん、乳がん、大腸がん、肛門がんで特に明らかである。
全体として、腫瘍生物学におけるTLRおよびI型IFN応答は、非常に複雑かつ多面的な役割を担っているため、生体内試験での治療応用のために合成(すなわち、m1Ψs)mRNAを導入する際には注意が必要である。最も重要なことは、SARS-CoV-2感染とmRNAワクチン接種後のTLRを介したI型IFN応答の破綻は、以下の理由により比較できない可能性があるということである。第一に、合成m1Ψ修飾mRNAは、ウイルスRNAとは異なり、TLR活性を消失させる能力がある。第二に、最近の研究によると、合成スパイクの内因性産生はヒトの体内で長期間(6カ月以上)持続することが示唆されている[87-89]。第三に、ウイルスのスパイクプロテインの大部分は気道にとどまる可能性が高いのに対し、ワクチンによるスパイク産生は内臓や組織で行われるため、より全身的な影響を及ぼす可能性が高い[129]。実際、動物モデルにおけるBNT162b2ワクチンの生体内分布研究から、ワクチンは注射部位にとどまるのではなく、むしろ接種後48時間でさまざまな臓器(肝臓、脾臓、肺、卵巣など)に集積することが明らかになった[130-133]。この文脈において、Bansalら[134]は、mRNAベースのワクチン接種後の効果的な免疫化において、表面にスパイクプロテインを発現する循環エクソソームの重要な役割を実証した。これらのエクソソームは、初回注射後14日目に検出可能であり、ブースター投与後に増加し、4カ月後にはかなり減少した。したがって、エクソソームがスパイク(およびそのmRNA配列)をリンパ系、血管系、さらには神経線維を経由して全身に拡散させるのに貢献していることはもっともである。最後に、比較的短い間隔で複数回接種するワクチンスケジュール[8]を遵守することは、ワクチン接種者の副作用のリスクを増大させる可能性がある。 mRNAワクチン接種および/またはSARS-CoV-2感染の結果として調節不全になる可能性のある、関連するTLR依存性のプロおよび抗腫瘍原性経路を明らかにするために、さらなる研究が必要である。
COVID-19ワクチンのコドン最適化は、RNA-G四重鎖(G4)-タンパク質結合系の調節不全を引き起こし、細胞内マイクロRNAの翻訳調節を変化させる可能性がある
COVID-19ワクチンの設計には、コドン最適化を含む様々なタイプの最適化が含まれる[135]。コドン最適化は遺伝子工学的アプローチであり、同義コドンの変更を用いて、遺伝子を自然には発現しない宿主におけるタンパク質生産を増加させる。このプロセスは、一般的にGC含量を増加させ、転写レベルの増加と相関し、転写休止が減少した結果である可能性がある[136]。 コドンの最適化は、バイオテクノロジー治療薬の安全性と有効性を損なうと忠告する著者もいる[137]。McKernanら[138]、Seneffら[23]などは、COVID-19 mRNAワクチンに含まれるGC含量が(ネイティブのSARS-CoV-2スパイクmRNAと比較して)著しく豊富であるため、翻訳中にG4モチーフなどの二次構造が増加する可能性があると述べている。具体的には、McKernanら[138]は、RNAfoldやQGRSMapperなどの一連のin silicoアプローチにより、ワクチン由来RNAの二次構造がネイティブウイルスと比較して変化していることを示している。特筆すべきは、コドンが最適化されたmRNAワクチンではG4形成の数が増加していることである(すなわち、ワクチンmRNA中のG4構造の多さは、ヒトの遺伝子発現を正常に制御するために、通常ヒトが発現するG4を標的とするRNA結合タンパク質やマイクロRNAの結合を増幅している可能性が高い。さらに、m1Ψの乱雑な塩基対形成は翻訳エラーを促進し[135,139-141]、G4を安定化させる[142,143]ため、コドンの最適化によるG4形成の影響を悪化させる[138]。
RNA G4-タンパク質結合系の調節異常は、細胞のマイクロRNA発現を劇的にダウンレギュレートする可能性があり、これは心血管疾患、神経変性の発症、癌の進行など多くの病態に関与している[23]。細胞の正常なハウスキーピングに不可欠な一例は、p53の物理的な陰性制御タンパク質であるマウスダブルミニッツ2(MDM2)ホモログである(p53は後述するよく知られた癌抑制タンパク質である)。MDM2とp53の間の複雑な相互作用を制御するmicroRNASの調節異常は、様々な癌のリスクを増大させることが予測される[23,138,144-146]。もう一つの例は、筋萎縮性側索硬化症/前頭側頭型認知症(ALS/FTD)(C90RF72遺伝子)や脆弱X症候群(FMR1遺伝子)におけるRNA G4反復配列の増幅である[147]。これらの疾患では、RNA G4結合タンパク質の発現レベルの変化や変異も報告されており、これらのタンパク質は、変異した場合やRNA G4が拡張した細胞では、正常な神経細胞の生理にとって重要な機能を発揮できないことが示唆されている[147]。
これらの観察結果は、コドンの用法が進化的に複雑になったことを浮き彫りにし、ヒトの治療におけるコドン最適化の科学的根拠を問うものである。
mRNAワクチンに使用されるLNPはマウスで強い炎症を起こす
LNPは、mRNAベースのCOVID-19ワクチンの重要な構成要素であり、mRNAの生体内試験安定性を向上させ、抗原提示細胞の細胞質への送達を強化する上で重要な役割を果たしている[148]。 LNPは、中性リン脂質、コレステロール、ポリエチレングリコール脂質、およびイオン化可能なカチオン性脂質の4つの主成分から構成されている[149]。
カチオン性LNPの高い炎症特性は、2010年以来知られている[150]。最近の報告[150]では、ヌクレオシド修飾mRNA COVID-19ワクチンの前臨床試験で使用されたLNPが、マウスにおいて高い炎症性を示すことが特に示されている。 これらのLNPの皮内注射は、好中球の大量浸潤、多様な炎症経路の迅速かつ強固な活性化、様々な炎症性サイトカインとケモカインの産生を引き起こした。経鼻投与でも、肺で同様の炎症反応が起こった[151]。LNPの本質的なアジュバント活性は、防御免疫の誘発に寄与するかもしれないが、様々な異なる炎症経路や収束的な炎症経路の無制御な活性化、炎症性サイトカインやケモカインの分泌は、重篤な炎症や細胞毒性につながるかもしれない。従って、カチオン性LNPと細胞内パターン認識レセプターとの相互作用をマッピングし、これらの脂質がどのようにしてインフラマソーム活性化を誘導するのか、統合的かつ多面的なメカニズムを解明するための広範な研究が必要である[152]。さらに、COVID-19ワクチンLNP-mRNA複合体の筋肉内注射が、ヒトで同様の反応を引き起こす可能性は高いが[151]、そのような反応の正確な性質や、マウスで記録された炎症シグネチャーとどの程度重複しているかは不明である。アデノウイルスをベクター化した注射は、mRNAワクチンとは異なり、重篤な自然免疫応答(すなわちサイトカインストーム)、炎症亢進、標的細胞の大きな損傷を引き起こさない[153]。逆に、重症のCOVID-19(SARS-CoV-2感染集団の約5%が罹患している)[154] は、肺組織にサイトカインストームを引き起こし、免疫病理学、ウイルス血症、全身の多臓器崩壊を伴う可能性がある[155-157]。
がんの場合、炎症は疾患の発症を容易にし、腫瘍形成のすべての段階を促進する[158]。 腫瘍外性の炎症は、細菌やウイルス感染、自己免疫疾患、肥満、タバコの喫煙、アスベストへの暴露、過度のアルコール摂取など、多くの因子によって引き起こされる[158]。 全がん症例の約15%~20%は、同じ組織や臓器部位での感染、慢性炎症、自己免疫に先行している[158-164]。このような場合、がんを促進する炎症が誘導され、腫瘍形成のずっと前から存在する。対照的に、がん内在性またはがん惹起性の炎症は、がんを誘発する突然変異によって誘発され、炎症細胞のリクルートと活性化を通じて悪性腫瘍の進行に寄与することがある[158]。外因性炎症も内因性炎症も免疫抑制をもたらし、腫瘍の発生に好ましい背景を提供する。 注目すべきは、好中球が腫瘍の発生、進行、血管新生、転移の全ての段階を促進する炎症反応のネットワークに積極的に関与していることである[165-170]。好中球は好中球細胞外トラップ(NETs)を形成し、このNETsが調節不全になると、動物モデルでもがん患者でも、炎症の悪化[171,172]、無制約ながんの進行、DCCの再覚醒、転移性播種を引き起こす[173]。さらに、腫瘍微小環境は主に炎症細胞によって組織化され、腫瘍細胞の増殖、生存、遊走を促進する。 mRNA-LNP投与後のマウスモデルで最近証明されたように、炎症反応は既存の炎症状態を背景に悪化する[174]。この効果は、mRNAとは無関係に作用し、LNPに特異的であることが証明された。 LNPは、伝染性と保持効果(EPR)の増強により、しばしば腫瘍に蓄積することから[175-178]、炎症やNETの腫瘍形成促進作用を含む、形質転換に関連したストレス刺激からがん細胞を保護することは、最も重要である。したがって、LNPと好中球[179]の相互作用を理解することは、安全で効果的なナノ材料の開発にとって極めて重要である。
外来RNAの逆転写とゲノム統合がゲノム不安定性の原因となる可能性
Acevedo-WhitehouseとBrunoによる新しい研究[180]は、SARS-CoV-2ゲノムの一部が逆転写を受け、感染細胞内でゲノム統合され、統合された配列の持続的転写につながる可能性について論じている。この仮説は、トランスフェクトされたヒト細胞内でSARS-CoV-2配列の逆転写コピーの存在を検出し、統合されたサブゲノムセグメントの活発な転写を発見した試験管内試験の研究に基づいている[181]。Acevedo-WhitehouseとBrunoは、COVID-19 mRNAワクチンを接種したヒト細胞でも同じ現象が起こりうると推測している。実際、Aldénらによる最近の研究[182]では、内在性のレトロトランスポゾン、すなわちlong interspersed nuclear element-1(LINE-1)が、BNT162b2 mRNAの細胞への侵入後、サイレンシングされなくなることが報告されている。これにより、完全長のワクチンmRNA配列が逆転写され、その後核内に侵入した。
これらの結果が生体内試験で確認されれば、体細胞では通常抑制されているサイレンス化されていないLINE-1の持続的な活性が、逆転写分子の挿入突然変異誘発のリスクを増大させ、その結果、コード領域を破壊し、腫瘍抑制遺伝子の突然変異のリスクを高め、ワクチンの標的となる細胞や組織で持続的なDNA損傷を引き起こす可能性がある[180]。LINE-1遺伝子逆位は実際に癌の主要な特徴であり[183]、p53突然変異、コピー数変化、細胞周期S期チェックポイントと相関している[184]。重要なことは、LINE-1の活性化は上皮間葉転換や上皮癌の転移のリスクを高めることであり、上皮間葉転換は既知のヒト癌の80%から90%を占めている[185]。したがって、COVID-19およびCOVID-19ワクチンによって誘発されるLINE-1の活性化の可能性と、LINE-1が内在的に高発現しているがん細胞や前がん細胞におけるその影響について明らかにすることが急務である。
さらに、SARS-CoV-2スパイクmRNAワクチン配列が逆転写され、標的細胞のゲノムに組み込まれ、ウイルス配列と細胞配列が結合したキメラ転写産物として発現した場合、RNA G4-タンパク質結合系の調節異常が悪性化をさらに促進する可能性がある。実際、実験的研究とバイオインフォマティクスの予測は、G4がDNAプロセス(すなわち、テロメア伸長、組換え、転写)とRNA転写後機構(すなわち、プレmRNAプロセシング、mRNAターンオーバー、ターゲッティング、翻訳)の両方に関連する様々な細胞機能に関与しているという見解を支持している[186]。先に述べたように、RNA G4の不適切な制御と関連する様々な疾患(すなわち、腫瘍性形質転換や神経変性)が増加しており、ヒトの健康におけるこれらの構造の潜在的な重要性を例証している。注目すべきは、G4構造の形成が効率的に制御されないと、ゲノムの不安定性を刺激し、突然変異や欠失、複雑な染色体再配列を引き起こす可能性があることである[187]。G4形成の可能性のある部位と癌に関連するブレイクポイントの位置を比較した計算機による研究では、特にTP53(p53をコードする遺伝子)に変異を持つ癌において、有意な重複があることが明らかになった。このことは、G4領域と突然変異のホットスポットを関連づけたメラノーマ細胞を用いた計算機による研究でも強調されている[188]。さらに、Hänsel-Hertschら[189]は、異なる乳がんの実体において、G4と突然変異の変化との直接的な相関を同定した。このことは、G4の形成が様々な癌において突然変異率を刺激し、影響を与えるという考え方を支持するものである。
SARS-CoV-2スパイクプロテインのS2サブユニットと癌抑制タンパク質p53および乳癌1/2(BRCA1/2)との相互作用がin silicoで明らかになった
バイオインフォマティクス(in silico)解析を用いて、SinghとBharara[190]は、SARS-CoV-2のS2サブユニットが、よく知られた癌抑制タンパク質であるp53とBRCA1/2と強く相互作用することを証明した。p53とBRCA1/2は主に細胞核で働き、細胞周期の進行、DNA損傷の修復と組換え、遺伝子の転写を制御している[191-193]。しかしながら、これらのタンパク質は細胞質においても重要な役割を果たし、アポトーシスを誘発し、オートファジーを阻害することで、腫瘍抑制因子としての使命に貢献している[194,195]。野生型p53は、ヒト原発性腫瘍の一部の細胞質に異常に隔離されていることが報告されている[196]。BRCA1の核内標的化を阻害する無数の癌関連変異は、BRCA1タンパク質を細胞質に限定し、DNA切断の相同組換え修復における核内機能を低下させる[197]。 特に、BRCA1の細胞質蓄積は乳癌の転移を促進し[198]、低悪性度の基底様散発性乳癌における生存、腫瘍悪性度、再発を独立に予測する[199]。
もしin silicoのように、スパイクのS2サブユニットが生体内試験で癌抑制タンパク質と相互作用するならば、このような実証は、COVID-19の影響を受けた人々の長期的な健康だけでなく、COVID-19のワクチン接種を受け、繰り返しブースター投与を受けた人々の健康にも影響を与えるだろう。実際、mRNAワクチンもアデノウイルスベクター化ワクチンも、スパイクの発現を宿主細胞に指示する遺伝物質を運ぶ。上述したように、BNT162b2ワクチンの生体内分布研究から、接種後48時間でさまざまな臓器に蓄積することが明らかになった[130-134]。最も重要なことは、mRNAワクチンの重要な構成要素であるLNPは、EPR効果により、健常組織よりも腫瘍組織に優先的に集積することである[175-178]。 これらの知見に基づき、S2と腫瘍抑制タンパク質(すなわち、特に、これらの相互作用ががん細胞および/または前がん細胞に選択的優位性(すなわち、がん細胞の生存、浸潤、転移、および化学療法抵抗性の促進)を与えるかどうかである。
TP53変異に関連するがんには、乳がん、骨軟部肉腫、脳腫瘍、副腎皮質がんがある。その他の頻度の低いがんには、白血病、胃がん、大腸がんなどがある[200]。 BRCA1活性の障害に関連するがんには、女性では乳がん、子宮がん、卵巣がん、男性では前立腺がん、乳がんがあり、男女ともに膵臓がんがわずかに増加している[201,202]。 BRCA2変異が最も多く報告されているがんには、膵臓がん、男性の前立腺がん、黒色腫などがある[203]。
BRCA1の細胞質隔離[206]と同様に、p53レベル/活性の調節不全や異常な変化[204,205]もまた、神経細胞機能障害に関連している。従って、S2と癌抑制タンパク質の生体内試験での相互作用の可能性は、急速に循環する癌細胞だけでなく、循環しない細胞(特に神経細胞)にも影響を及ぼす可能性があり、その結果、長期の神経変性疾患にも影響を及ぼす可能性がある[207,208]。
SARS-CoV-2の宿主細胞への新規感染経路であるCluster of differentiation 147(CD147)膜貫通蛋白質は様々な癌と相関する
最近、新しいSARS-CoV-2の侵入経路、すなわちCD147膜貫通糖タンパク質の利用が提案された[209]。SARS-CoV-2のスパイクプロテインに対する親和性はACE2よりも低いにもかかわらず、CD147はウイルス感染を媒介する上で補完的なレセプターであるかもしれない[210]。スパイクとCD147の直接的な相互作用を支持する明確な証拠は今のところないが[211]、新規のSARS-CoV-2ウイルスの標的としてCD147が確認されたことは、腫瘍患者にとって重大な意味を持つかもしれない。CD147は様々な癌と相関しており[212,213]、いくつかのメカニズム、すなわち解糖の制御や、マトリックスの分解、腫瘍細胞の浸潤、転移、血管新生につながるプロテイナーゼを誘導するよく知られた能力によって、腫瘍微小環境のアップレギュレーションや癌の進行に関与することが示されている[214]。ACE2について先に述べたように、SARS-CoV-2スパイクプロテインとCD147レセプターとの相互作用の可能性は、腫瘍形成経路の活性化を通じて、癌の進行や再発への道を開く可能性がある。
がんまたはその既往歴のある人に対するCOVID-19ワクチン接種の検討
COVID-19のワクチン接種は、人類史上最大の緊急予防接種キャンペーンである。パンデミックは公の場からほとんど姿を消したが、約2,000~3,000人の米国人が毎週COVID-19で死亡しており[216]、英国でも同じ傾向が見られる[217]。おそらくは、社会のほぼすべての部分が正常に戻った現在でも、一部の集団(すなわち、高齢者、合併症を持つ人々、免疫不全の人々)が依然として重症化の高いリスクに直面しているためであろう。したがって、何百万人もの人々を守ることは、とてつもない挑戦であり責任であり続けている。ワクチンは死亡を回避する上で大きな影響を与えたかもしれないが、ワクチンによる重篤な健康被害は、臨床試験やVAERSのような受動的サーベイランスシステムでは認識されないかもしれない。このような状況において、SARS-CoV-2スパイクプロテインベースのワクチンには、腫瘍抑制タンパクと相互作用し、炎症を促進し、発がん経路を活性化し、免疫応答の微調整を混乱させる可能性があることを示した。 このような調節不全のメカニズムやシグナル伝達経路は、ほとんどの種類のがんの根底にある。さらに、スパイクの遺伝毒性については最近、淡水中に散布されたSARS-CoV-2スパイク断片に暴露されたグッピー(Poecilia reticulata、別名ミリオンフィッシュまたはレインボーフィッシュ)の成魚で研究された[218]。 これらのペプチドに暴露されると、P. reticulataの循環赤血球においてゲノムの不安定性とDNA損傷が誘発された。これは、肝臓と脳におけるマロンジアルデヒド(MDA)レベルの上昇、および肝スーパーオキシドジスムターゼ(SOD)とカタラーゼ(CAT)の抗酸化活性の抑制によって示される酸化還元不均衡と相関していた。
がんとCOVID-19ワクチン接種に関する議論の多くは、このコホートを重篤な疾患や死亡から守るために、強いプレッシャーのもとで行われたことは理解しているが、よりバランスのとれたリスク/便益の評価が早急に必要である。このことは、血液悪性腫瘍の患者[219,220]のように免疫応答が乏しく、ワクチン接種の有益性が疑問視され、連続ブースター接種の累積リスクも不明である(接種を受けるたびに増加する可能性はあるが)人々には特に関連する。 特に懸念されるのは、一部の抗がん剤がCOVID-19ワクチンを無効にしてしまうという観察である[221,222]。さらに、複雑な抗がん剤レジームとCOVID-19ワクチン[222-224]の同時投与は、相互作用または相乗毒性作用の道を開く可能性がある。実際、チェックポイント阻害薬(CPI)投与中の腫瘍患者におけるBNT162b2ワクチンの効果に関する最近の論文[224]では、CPI免疫療法により、すべてのCOVID-19ワクチン接種の副作用が一定かつ変動的に増加したと記述されており、これは憂慮すべきことである。このように、免疫療法とCOVID-19ワクチンの同時使用は、身体の免疫反応を高め、その結果、免疫関連の有害事象が増強されるという懸念がある。さらに、COVID-19ワクチンに続発する反応性腋窩リンパ節腫脹は、癌の転移を模倣する可能性があり、乳癌、頭頸部癌、リンパ腫、背部および上肢の黒色腫の患者に診断のジレンマをもたらし、不安を増大させる。また、BNT162bワクチンの2回目の投与から7~10週間後に陽電子放射断層撮影(PET-CT)検査を受けた169人のイスラエル人患者を対象とした研究では、患者の29%に持続性の片側リンパ節腫脹がみられたと報告されている[225]。対照的に、COVID-19[230]やmRNAベースのCOVID-19ワクチン接種[231] 後に、一時的または長期的にがんが寛解したまれな症例がいくつか報告されているが、これはおそらく、これらの患者において抗がん免疫を促したと思われる激しい免疫炎症反応の結果であろう。全体として、がんは最も複雑で、異質で、動的なヒト疾患の一つであり[232,233]、そのため、普遍的な「万能」アプローチには欠陥がある。
残念ながら、世界(日本、オーストラリア、カナダ、ヨーロッパなど)の現在のがん統計のほとんどは、推定値や予測値でない限り、2020年以降には拡張されていない[234-239]。このため、各時点で入手可能な最善のエビデンスに基づく意思決定に役立つグローバルなファーマコビジランス・データベースの構築が不可欠である。 米国では、2018年1月7日から2022年7月2日まで、CDCのMortality and Morbidity Weekly Reports(MMWR)は、1週間当たり約13,000人のがん死亡者数(範囲:12,221~14,845人)を記載し、ピークは2021年1月(14,284人)と2022年1月(14,845人)に発生している[240]。公衆衛生機関は、2018年から2022年にかけて(がんを基礎的原因とする)がん死亡者数がわずかに増加したことを明記しているが、そのほとんどはCOVID-19などのがん以外の基礎的原因によるものであるとしている。 紛れもなく、2021年と2022年に観察されたがん死亡のピークは、COVID-19の冬の急増とよく相関している。しかし、この2つのピークはCOVID-19のワクチン接種とブースター・キャンペーンの後でもある。先に述べたように、SARS-CoV-2およびSARS-CoV-2スパイクプロテインに基づくワクチンは、いずれもヒト細胞内でのスパイクの産生を促進する。パンデミックの波における混沌とした死亡記録もまた、事実の歪みを生み出し、がん(およびその他の)死亡の主要な原因を予防する努力を誤った方向に導いているのかもしれない。注目すべきことに、米国では、平常時でも死亡診断書の重大な誤りはかなり多く、その頻度は、病院ベースの調査で18%から85%以上であることが研究により判明している[241]。
要するに、多くの研究機関[242,243]や著者[244,245]が、COVID-19ワクチンはがん患者において安全であり、(部分的に)有効であると主張しているにもかかわらず、これらの主張は裏付けがなく、一般集団におけるワクチンの安全性と有効性、がん患者における他のワクチンの成績、および現在のがん治療に内在する免疫変化[246]から、推奨事項の大部分が推測されている。時間的関連性と生物学的妥当性の収束した証拠を考慮すると、遺伝的COVID-19ワクチンのがんの進行と再発への寄与は、現時点では除外できない。 しかし、スパイクの発がん潜在性は、SARS-CoV-2感染時にも発揮されるはずだと主張する人もいるかもしれない。これは部分的には正しいが、COVID-19遺伝子ワクチン、特にmRNAワクチンはSARS-CoV-2ウイルス感染とは根本的に異なることはすでに述べた。したがって、悪性腫瘍を潜在的に促進する経路におけるCOVID-19ワクチン接種とSARS-CoV-2感染の役割は同等ではないかもしれず、さらなる調査が必要である。さらに、LNPビヒクル自体および/または合成改変mRNA(スパイクの毒性またはその欠如に関係なく)に有害性が決定的に起因する場合、これは同じコア技術に基づく新しいmRNA製品の開発に影響を及ぼす可能性がある[247]。
現在の技術状況を鑑みると、がんまたはがんの既往歴のある人は、有益性がリスクを明らかに上回る場合にのみ、ケースバイケースで慎重に評価した上で、遺伝子COVID-19ワクチンを接種すべきであるというのが我々の提案である。最も重要なことは、発がんリスクは用量依存的である可能性があるということである。SutherlandとBailerによって提唱された「発癌のマルチヒットモデル」[248]によれば、正常細胞が癌化するには、細胞やその遺伝的機構に対する複数の異なるヒットや損傷が必要である。COVID-19ワクチンは、予防のための一次シリーズではなく、停止点のない定期的(6カ月ごと)な注射であるため、複数回の予防接種を受けた人(および/またはがんやがん再発のリスクが高い人)だけが、悪性腫瘍のリスクが高くなる可能性がある。COVID-19およびCOVID-19ワクチンが誘発する発がん効果の細胞および分子基盤を比較する学際的な臨床および基礎研究が、これらの製品のリスク/ベネフィットプロファイルのバランスを調整するのに役立つ可能性がある。動物モデルの使用などの直接的なアプローチは、ヒトACE2受容体を発現するマウスの最近の開発[249,250]やがんモデルマウスの利用可能性[250]を利用すべきである。がん患者におけるCOVID-19ワクチン接種の有効性と安全性を前向きに、あるいは後向きに調査する研究が強く奨励される。広く測定された免疫パラメータや血中スパイクプロテインレベルのデータを含む、より信頼性の高いデータベースの必要性は、他の研究者からも指摘されている[251]。これらの研究を総合すると、代替治療法(すなわち、化学的性質の異なるLNP)の開発など、臨床的実施の指針となる確かなデータが得られるはずである、COVID-19の積極的なワクチン接種が有効でない人(およびワクチン成分の一部にアレルギーのある人)のために、治療代替物(すなわち、異なる化学的性質をもつLNP、ACE2結合を起こしにくい閉鎖型のスパイク[252]、スパイクを標的としないワクチン[253]、免疫抑制された人において高い忍容性と免疫原性をもつCOH04S1[254]のようなプラットフォーム、非薬理学的介入[255]など)を開発することを含めて、臨床実施の指針となる確かなデータが得られるはずである。
結論
この包括的な文献レビューは、COVID-19遺伝子ワクチン、特にmRNAワクチンが、1984年にサザーランドとバイラーによって提唱されたがん発生のマルチヒット仮説を満たす可能性を強調することを目的としている。この可能性が間違っていることを証明することは、医学の第一原則を満たすために必要なステップ:「primum non nocere」(「まず害をなすなかれ」)である。実際、世界的な危機はすべて、健康と福祉に途方もない困難をもたらす。しかし、このような例外的な事態は、科学的基準を下げる正当な理由にはならないはずだ。このことは、世界中の脆弱なハイリスク集団を守ることを目的とした予防薬に特に関連している。正確には、COVID-19に対する新規mRNAベース・ワクチンの成功は、効果的で容易に展開可能なワクチンが緊急に必要とされている、最も致命的な感染症のいくつか(すなわち、マラリア、結核、HIV/AIDS)に対する解決策として、mRNA技術に対する広範な関心を生み出した。しかし、概説された発癌促進メカニズムのいくつかは抗原非依存性であるため、mRNAベースのナノ医薬品が将来的に疾病の管理・予防方法をさらに変革する前に、現在の安全性に関する懸念に早急に対処すべきである。