Contents
Role of Iron Chelation and Protease Inhibition of Natural Products on COVID-19 Infection
pubmed.ncbi.nlm.nih.gov/34070628/
掲載:2021年5月25日
概要
SARS-CoV-2のパンデミックにより、新しい有効な治療法の開発が国際的に求められているが、未だに特定の治療法はなく、患者は一般的な治療法や支持療法に頼るしかない。肺線維症を含む様々な呼吸器疾患は、鉄分濃度の上昇と関連しており、ウイルス感染の進行を促進する可能性がある。最近の研究では、いくつかの天然成分が鉄代謝に影響を与えることで、ウイルス感染に対する最初の障壁として機能する可能性が示されている。さらに、最近の研究では、SARS-CoV-2感染症の治療にプロテアーゼ阻害剤を併用することが提案されており、ウイルスの感染性におけるウイルスプロテアーゼの役割が強調されている。本レビューでは、鉄キレート剤およびプロテアーゼ阻害剤として作用し、SARS-CoV-2感染に対抗することができる数多くの天然物について、文献およびドッキング研究による分析に焦点を当てている。
キーワード
SARS-CoV-2; COVID-19; 鉄キレート剤; プロテアーゼ阻害; 天然物
1. はじめに
コロナウイルスは、その表面が王冠のような形をしていることから名づけられた、エンベロープ型の一本鎖および正鎖のRNAウイルスで、らせん状のヌクレオカプシドを持っている。動物やヒトの急性・慢性の呼吸器疾患や中枢神経系疾患の原因となることが知られている[1]。重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は,主にアンジオテンシン変換酵素2(ACE2)受容体を発現している肺,心臓,腎臓,内皮などの組織に感染し,全身症状を引き起こす[2]。また,最近では,呼吸器や嗅覚上皮に多く発現しているニューロリピン-1が,ウイルスとACE2受容体との相互作用を促進することで,SARS-CoV-2の感染力を高める役割を果たしていることが明らかになっている[3]。現在、新型コロナウイルス019(COVID-19)による大パンデミックが続いており、選択的なワクチンを含む効果的な治療法の開発が国際的に求められている。しかし、いまだに特異的な治療法はなく、患者は酸素供給、グルココルチコイド、ヒト血清アルブミンなどの一般的な支持療法に頼るしかない[4]。抗ウイルス剤,クロロキン,遺伝子組み換えモノクローナル抗体などの一部の治療法は有望な効果を示しているが,SARS-CoV-2の症例数が増加していることを考慮すると,さらなる治療法の選択肢を模索し,新たな治療ターゲットを検討する必要がある[5]。ウイルス感染に影響を与える因子の中で、鉄は重要な役割を果たしており、ウイルスの進行を促進すると同時に、炎症プロセスを悪化させる両刃の剣のような働きをしている。一方、ウイルスと宿主細胞の融合を妨げるために重要なプロテアーゼを阻害することは、天然物などの従来とは異なる薬剤の活性を利用することで、強調することができる。
鉄のホメオスタシスの乱れは、酸化ストレスや炎症反応を引き起こし、全身に影響を及ぼすびまん性内皮炎の潜在的な原因の1つである[6]。急性呼吸窮迫症候群(ARDS)や肺線維症などの様々な呼吸器疾患は、鉄濃度の上昇と関連しており、ウイルス感染の経過を促進する可能性がある[7,8,9]。ウイルスの複製に対する鉄の依存性と、ウイルス感染によってもたらされる宿主の鉄代謝の変調は、ウイルスのライフサイクルにおける細胞の鉄のホメオスタシスの重要性を浮き彫りにし、ウイルス感染症の治療における鉄キレート戦略の開発につながっている。現在、米国食品医薬品局(FDA)で臨床使用が認められている鉄キレート剤は、デフェロキサミンやデフェラシロクスなど数少ない。これらの薬剤は、鉄イオンとの強い選択的な親和性により、遊離の鉄と結合し、鉄を貯蔵するタンパク質から鉄を取り除くことができる[10,11]。最近の研究では、人間の自然免疫に含まれるいくつかの天然成分が、ウイルス傷害に対する最初のバリアとして機能する可能性があることが示されており、この観点から、補助的治療としてのラクトフェリンの予防的役割の可能性に関心が高まっている[12,13]。ラクトフェリンはヒトから分泌される糖タンパク質で、非特異的な防御システムに属し、ウイルス感染に対して極めて重要な役割を果たすことが知られており、鉄代謝を調節することができる。ラクトフェリンの主な機能は、1分子あたり2つのFe3+を高い親和性で可逆的にキレートし、pH値が3.0になるまで鉄を結合することである[14]。ラクトフェリンは、遊離した鉄を封じ込め、鉄のホメオスタシスを回復させることで、酸化ストレスや炎症を軽減し、主にサイトカインストームやCOVID-19の病理に関連している[15,16,17]。
プロテアーゼは、ペプチド結合の加水分解によるタンパク質の異化作用であるタンパク質分解に関与する酵素である。タンパク質分解プロセスは、消化、血管新生、骨のリモデリングなど、生体内の正常な生理機能に必要である[18]。エンベロープ型ウイルスでは,翻訳後のタンパク質分解活性化は,宿主との融合,ひいてはウイルスの感染性にとって重要なステップである。膜受容体とタンパク質分解活性化の両方が、感染した宿主でのウイルスの効果的な拡散に不可欠であり、病原性のレベルを決定する[19]。プロテアーゼは,エンベロープの存在とは無関係に,さまざまなウイルスで同定されている。アデノウイルスにはシステインプロテアーゼが存在し,ヒト免疫不全ウイルス1型(HIV1)にはアスパラチルプロテアーゼのファミリーが見られる。さらに,C型肝炎ウイルス(HCV)やヘルペスウイルス,SARS-CoV-2のように,さまざまなウイルスに存在するプロテアーゼは,特にセリンプロテアーゼのファミリーに属している[20]。いくつかのプロテアーゼ阻害剤は,SARS-CoV-2を含む,宿主細胞への侵入がプロテアーゼ活性に厳密に関連しているウイルスの感染に対抗するための選択薬として考えられてきた[21,22,23]。最近の研究では,SARS-CoV-2感染症の治療に,抗HIV薬(ロピナビル/リトナビル,ラミブジン,テノホビル)を含む既存の薬剤の併用を提案するものはほとんどなかった。その結果,プロテアーゼが新たな魅力的な標的として認識され,ウイルスのセリンプロテアーゼを標的とする代替化合物の深い研究が行われるようになった[24,25]。最近のin silico研究では,COVID-19の活性に関与する主要なプロテアーゼを標的とする植物成分(グリチルリチン,トリプタンスリン,レイン,ベルベリンなど)の可能性が報告されている。得られた結果は,ウイルスプロテアーゼとの高度な相互作用と低い結合エネルギーを示しており,天然化合物が発揮する好ましい薬剤的特性につながっている[26]。
以上のことから、鉄キレート剤やウイルスプロテアーゼ阻害剤としての効果が証明されている多くの天然物(表1)は、SARS-CoV-2感染後に上昇する炎症状態や相対的な酸化ストレスを制御・軽減し、さらにウイルスの複製を阻止する作用を示す可能性が示唆された。
2. 鉄とSARS-CoV-2
鉄は、酸素運搬、酸素感知、電子伝達、エネルギー代謝、DNA合成など、生命維持に必要な多くの細胞プロセスにおいて極めて重要な役割を果たす必須元素である[27]。鉄は、ウイルスの複製をはじめ、ATPの生成、細胞の生存、フェロトーシス、DNA/RNAの合成と修復などのプロセスに必要である[28]。コロナウイルスの複製を維持するには、細胞内の鉄濃度が低いことが必要であるが、鉄が不足するとウイルスの転写、翻訳、組み立て、エキソサイトーシスが阻害される[29]。鉄を貯蔵する主な場所はフェリチンであり、そのコアには最大4500個の鉄分子を運ぶことができる[30,31]。実際、強い炎症状態では、サイトカインがフェリチンを刺激し、組織の鉄貯蔵量の主な調節因子であるヘプシジンの合成を促進する[32]。この点に関しては、COVID-19感染症の患者で高レベルのフェリチンが報告されている[33,34,35]。一方では、SARS-CoV-2がヘモグロビンのβ鎖の1つを攻撃することで、ヘムから鉄が解離し、その結果、体内の遊離鉄とフェリチン濃度が上昇する[11,34,36,37,38]。他方では、COVID-19感染によって引き起こされる炎症が原因の1つとされており、IL-6,IL-1β、IFN-γの顕著な過剰発現により、ヘプシジン濃度が上昇する[6,39,40]。ヘプシジンは、重要な鉄調節ホルモンとして、腸管やマクロファージで鉄を封じ込め、細胞内のフェリチンレベルを高め、鉄輸出タンパク質であるフェロポーティンを阻害することで貯蔵細胞からの鉄の流出を防ぐ[41]。Ehsaniは最近、ヘプシジンタンパク質とSARS-CoV-2スパイク糖タンパク質の細胞質尾部の遠いアミノ酸配列との間に類似性があることを想定しており、サイトカインを介した炎症プロセス、呼吸器感染症、および全身の鉄調節の間で相互作用する要因の調査ルートの可能性を強調している(表2)[42]。
3. プロテアーゼ阻害とSARS-CoV-2
文献で報告されているように,SARSコロナウイルスの感染は,宿主のACE2受容体だけでなく,膜貫通型セリンプロテアーゼ2(TMPRSS2)によるウイルスのスパイク(S)タンパク質のプライミングにも依存している。Sタンパク質の切断は、ウイルスと宿主の膜融合と、その結果としての細胞侵入につながる必要なステップである[43,44]。証明にはさらなる臨床データが必要であるが、いくつかの研究では、COVID-19の予防にプロテアーゼ阻害剤の使用が示唆され、SARS-CoV-2感染患者の初期臨床管理にロピナビル/リトナビル配合剤などの抗レトロウイルス薬の投与を推奨している[25,45,46]。さらに,TMPRSS2の強力な阻害剤であるメシル酸ナファモスタットとメシル酸カモスタットが,重症患者のCOVID-19感染症の臨床症状,特に凝固障害の可能性がある症例に対する有望な予防的選択肢として,SARS-CoV-2の細胞侵入を阻止するために使用できることが示されている[25,43,47,48,49,50]。SARS-CoV-2のプロテアーゼに着目した新たな治療法の開発を目的に、最近のコンピュータ研究では、複製と転写に重要なコロナウイルスの酵素であるSARS-CoV-2のメインプロテアーゼ(Mpro)を標的とした新たなリード化合物を発見・同定する可能性が注目されている[51]。
4. 材料と方法
ドッキング研究は,以前に発表された論文で使用されたプロトコルに従って行われた[52].すべての化合物は「Flare preparation ligand」[52]を用いて構築し,エネルギーを最小化した。プロテアーゼの座標は,1.75オングストロームの解像度を持つコード6Y2Eで,protein databankからした。文献によれば,結合部位はTAEDMLNと名付けられた特定の領域に同定された。触媒ドメインは、残基41から残基145の間、具体的にはアミノ酸45から51に位置しており、右電荷は「Flare protein preparation」で計算した。ドッキング計算は、Flareの「Accurate but Slow」設定で行い、タンパク質とリガンドの結合の自由エネルギーを正確に見積もることができるdGスコアを得ました。最適なドッキングポーズは、Flareを用いたリガンド-タンパク質複合体のエネルギー最小化によって改良された。最後に、各複合体の安定性を向上させるために、一定の温度で短時間(5nsの生成)の分子力学的実行を行い、その後、結合部位に関与するすべての原子の迅速な最小化を行った。
5.α-リポ酸
α-リポ酸(ALA)は,1,2-ジチオラン-3-ペンタン酸やチオクト酸としても知られており,原核細胞や真核細胞のほぼすべてに存在する天然物質である(図1)。ALAの抗酸化物質および金属キレーターとしての能力は,グルタチオン(GSH)やビタミンE,Cなど,いくつかの抗酸化物質の酸化型を還元することを可能にする[53]。鉄キレート剤としてのALAの有効性は,試験管内試験および生体内試験で鉄過剰状態を模擬したクエン酸鉄アンモニウム(FAC)との併用療法で実証されている。間葉系幹細胞にALAを投与すると、FAC処理後に活性酸素が減少し、ミトコンドリアの膜電位と完全性が回復した。ALAの直接的な抗酸化作用には、GSHの増加が関連しており、これにより細胞の抗酸化防御機能が強化される。その結果、ALAは細胞内のGSH量を増加させることで、NRF2(核内因子赤血球2関連因子)経路の活性化を防ぎ、ヘムオキシゲナーゼ1(HO-1)の発現を低下させることがわかった。同じ結果がゼブラフィッシュの生体内試験モデルでも確認されており、鉄過剰負荷の存在下でALAを処理すると、ヘムオキシゲナーゼ1b(HMOX1b)ミトコンドリアスーパーオキシドディスムターゼ(mtSOD)フェルロポーチン1(FPN1)の発現が有意に減少した[54,55]。Zhaoらは,さまざまな生体内実験を行い,ALAを鉄キレート剤として全身に投与することで,AMD(加齢黄斑変性症)モデルマウスの光による網膜変性を予防できることを示した[56]。アルツハイマー病やパーキンソン病などの神経変性疾患では,脳内の鉄濃度が異常に高いことが知られている。ALAの神経保護効果は,6-ヒドロキシドーパミン(6-OHDA)で誘発されたPDモデルで検証され,活性酸素の有意な減少と鉄代謝レベルの改善を示したことから,鉄代謝機能障害や酸化ストレスを伴う神経変性疾患の治療に対するALAの可能性が確認された[57]。
図1 SARS-CoV-2ウイルスの主プロテアーゼの結合部位におけるα-リポ酸(暗赤色)のドッキング位置
水と水素はわかりやすくするために省略した。
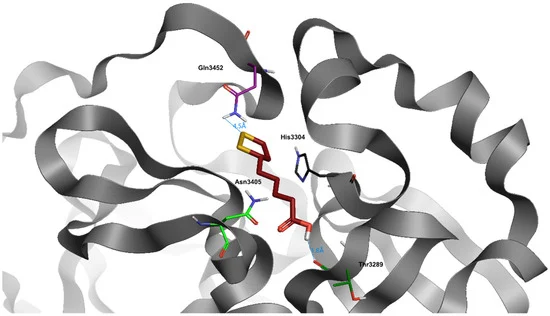
α-リポ酸は優れたdG(-8006)を示している(表3)。当然のことながら、この化合物は立体的なフットプリントが小さいため、結合部位に容易に入り込むことができる。
また、Thr3289とは分子のカルボキシル基を介して、Gln3452とはNH-S結合を介して、ダイナミクスの時間を通して安定した水素ブリッジを確立している。
6. ケルセチン
ケルセチンは,食物中に最も多く含まれるフラボノイドであり,特にタマネギ,クランベリー,ブルーベリー,お茶,リンゴなどに豊富に含まれている(図2)[58]。ケルセチンを含む多くのポリフェノール化合物は,強力な鉄キレート剤である。ほとんどのポリフェノールと同様に、ケルセチンは、ほとんどがグリコシド結合体として食品に含まれているが、腸管内でグリコシダーゼの作用により速やかにアグリコンに変換される[59]。ケルセチンは、十二指腸における非ヘム鉄の吸収を著しく低下させる。そのメカニズムは、十二指腸粘膜による鉄の取り込みと保持の増加、組織鉄プールの減少および腸細胞における非ヘム鉄輸送体の発現の減少、ヘプシジンの発現増加による鉄の枯渇などである[60]。ラットの生体内試験モデルにおいて、ケルセチンを経口投与すると、2価の金属トランスポーター-1(DMT1)およびFPNのmRNAレベルがダウンレギュレートされたが、逆にCaco-2細胞を用いた試験管内試験モデルで同じ実験を行ったところ、ケルセチンはDMT1およびFPNのmRNAおよびタンパク質の発現に影響を与えなかった[61]。鉄過剰症の生体内試験モデルにおいて、ケルセチンを投与してもデフェロキサミンを投与した場合と比較して有意な差は認められず、血清および組織の鉄を減少させ、IL-6を減少させ、IL-10の発現を増加させることで炎症状態を亢進させることが示されている[62]。ウイルス感染に対してケルセチンを使用すると、プロテアーゼ阻害剤としての強力な能力を発揮することが様々な研究で報告されている。BachmetovらはHCV NS3セリンプロテアーゼの触媒活性に対するケルセチンの直接的な阻害効果を示し、Yaoらはケルセチンがエンテロウイルス71(EV71)の3Cプロテアーゼ活性を強力に阻害し、EV71の複製をブロックすることを示した[63,64]。同様の抗複製活性は、中東呼吸器症候群コロナウイルス(MERS-CoV)やSARS-CoVの計算機研究でも調べられ、ケルセチンとウイルスの3C様プロテアーゼの触媒部位との間に強い相互作用があることが証明されている[65,66,67]。また、重要なウイルス酵素(逆転写酵素、インテグラーゼ、プロテアーゼ)の有望な阻害剤であるケルセチンとビタミンCの共同投与は、高リスク集団における予防や、COVID-19患者の治療における支援療法として提案できると報告されている。この相乗的な抗ウイルス作用は、抗酸化作用や免疫調整作用など、異なる化合物の複数の特性が重なり合っていることや、アスコルビン酸がケルセチンを再利用してその効果を高めていることに起因すると考えられる[68]。
図2 SARS-CoV-2ウイルスの主プロテアーゼの結合部位におけるケルセチン(暗赤色)のドッキング位置
水と水素はわかりやすくするために省略した。
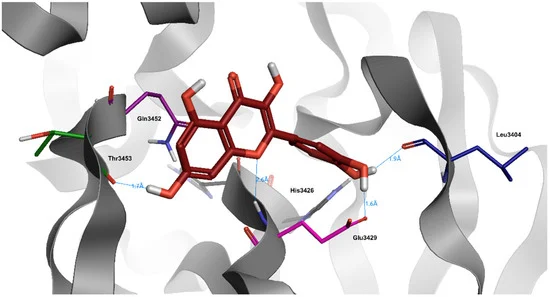
ケルセチンはフェノール基の数が多く、非常に特殊な構造をしており、Glu3429,His3426,Leu3404と水素結合を生成することができ、ドッキングスコア(-8.0)でも証明されている(表3)。トリヒドロキシクロミウム-4-イオン部分は、その広範な正電荷のためか、ダイナミクスの間中、常に水にさらされている。
7.カフェー酸
カフェ酸(CA)は,植物の二次代謝によって生成されるフェノール化合物で,人間の食生活に含まれる主要なヒドロキシ桂皮酸である(図3)。CAとその代謝物は,金属イオン,特に鉄と結合し,フェントン反応など,これらの金属が媒介する酸化還元反応に影響を与えることが,いくつかの研究で明らかにされている[69,70,71]。さらに,CAやロスマリン酸などのカフェオイル部位を持つ関連化合物の抗ウイルス活性も報告されている。作用機序はまだ解明されていないが,鉄キレート剤は,ウイルスの糖タンパク質Bと細胞表面のヘパラン硫酸プロテオグリカンとの間の細胞外付着を標的にしている可能性を示唆する証拠がある。ヘパラン硫酸プロテオグリカンを細胞付着に利用できるCA-鉄錯体の影響を最も受けるウイルスは、単純ヘルペスウイルス(HSV1およびHVS2)A型インフルエンザおよびヒト免疫不全ウイルス(HIV)である[72]。HIVに対するCAの活性は,鉄錯体の形成だけではないことが示されている。Wangらは,HIVインテグラーゼに対する既知の阻害活性に加えて,CA誘導体がHIVプロテアーゼに対する阻害活性を有することを示し,CAを新しい抗HIV薬候補のリード化合物として利用することを示唆している[73]。CAのフェネチルエステル誘導体のウイルスプロテアーゼに対する阻害効果は,HCVでも研究されており,CA化合物はNS3プロテアーゼの発現を低下させる能力を示し,ウイルスの複製を減少させた[74]。最近の論文では,CA誘導体がSARS-CoV-2の主要プロテアーゼであるMproを顕著に阻害することが報告されている。いずれの研究でも,CA誘導体はSARS-CoV-2 Mproの基質結合ポケットに結合し,すでに主張されているN3プロテアーゼ阻害剤であるネルフィナビルよりも高い効力と結合エネルギーを持つことが示されている[75,76]。
図3 SARS-CoV-2ウイルスの主プロテアーゼの結合部位におけるカフェ酸(暗赤色)のドッキング位置
水と水素はわかりやすくするために省略した。
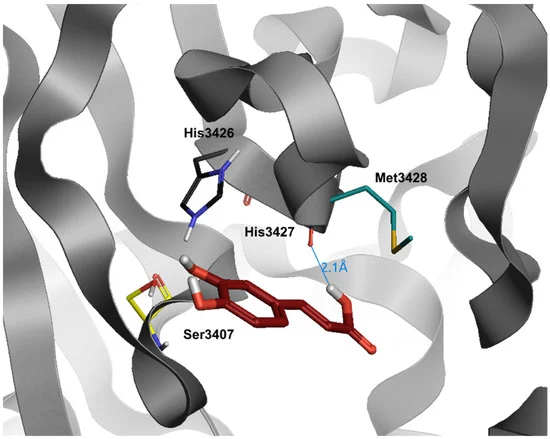
ケルセチンと一部似ているが、構造が単純化されているカフェ酸は、結合ポケットに最も深く入り込む可能性を維持しているが、前の分子とは対照的に、多くの水素結合を確立する能力を失っている(dG = -6.3)(表3)。実際、唯一の水素結合は、カルボキシル基の部分のHis3427に向かって発生している。また、カフェ酸は他の化合物に比べて、ダイナミクスシミュレーション時のレイアウトが変化しやすい。
8. フィチン酸
フィチン酸(ミオイノシトール六リン酸,IP6)は,試験管内試験および生体内試験の条件下で,強力な抗酸化剤および鉄触媒によるヒドロキシルラジカル生成の阻害剤として認められている(図4)。穀物や豆類によく含まれるIP6は、2価のミネラルをキレートしてその吸収を低下させるため、一般的には抗栄養物質と考えられてきたが、同じ性質を持つため有益な物質とも考えられている[77,78]。フィチン酸は、ヒト赤血球において、ラジカルのOH形成を抑制し、鉄とアスコルビン酸によって触媒される脂質過酸化を減少させることが示された[79]。Xuらは、パーキンソン病の細胞モデルにおいて、IP6が、鉄過剰の状態で、1-メチル-4-フェニルピリジニウム(MPP+)によるアポトーシスからドーパミン神経細胞を保護することを報告した[80]。また,IP6は,アスベストをラットに気管内投与した後に生じた肺の炎症と線維化を改善することが試された。プロリルヒドロキシラーゼやリジンヒドロキシラーゼなど,コラーゲンの分泌には鉄依存性の酵素が必要であることから,IP6は鉄キレーターとして,肺の毒性で生じた線維化を抑制する重要な能力を示したのである。さらに、IP6は肺線維症の原因となるリンパ球の機能を制限することが示唆された[81]。他の研究では、脂質過酸化の抑制における鉄キレーターとしてのIP6の抗酸化活性が示された。IP6は,Caco-2細胞において,リノール酸の自己酸化およびFe2+/アスコルビン酸誘発の過酸化を抑制することができた[82]。さらに,宮本らは,IP6とその加水分解物(IP2,IP3,IP4,IP5)の両方に強い鉄イオンキレート作用があり,鉄イオンによる脂質過酸化を防ぐことができることを明らかにした。その結果、3つ以上のリン酸基を持つIP6の副生成物は、脱リン酸によってその効果が低下するものの、脂質過酸化を抑制する能力を維持していた[83]。
図4. SARS-CoV-2ウイルスの主プロテアーゼの結合部位におけるフィチン酸(暗赤色)のドッキング位置
水と水素はわかりやすくするために省略した。
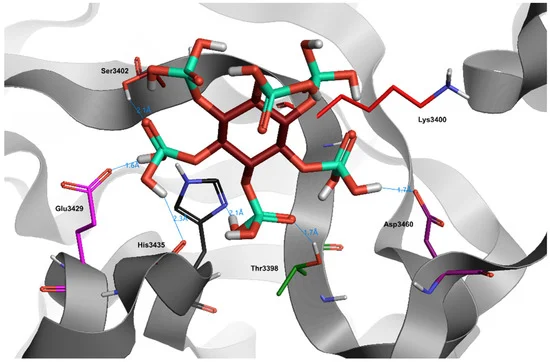
多くのリン酸基を持ち、その結果として高い総結合容量を持つにもかかわらず、フィチン酸の立体的に複雑な構造は、受容体ポケットへの容易な挿入を妨げ、低いドッキングスコア(-1.5)で証明された(Table 3)。この結果は、分子の過剰な水分露出によって正当化される。実際、Phytic Acidは、単一のアミノ酸結合部位(Glu3429)および他の外部部位(His3435,Tyr3398,Asp3460,Ser3402)と水素結合を形成することができるが、周囲の水に邪魔されて、得られた結合は不安定な結果となった。
9. クルクミン
クルクミン(diferuloylmethane, (E, E)-1,7-bis (4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione)は,インドのハーブであるウコンから抽出された黄色の天然物である(図5) [84]。クルクミンには,抗炎症作用,抗酸化作用,抗ウイルス作用,抗腫瘍作用など,さまざまな有益な薬理作用が証明されている[85,86]。クルクミンは、細胞や組織内の鉄代謝のタンパク質を調節することが報告されており、鉄キレート剤としての特性が確認されている。クルクミンは、そのポリフェノール構造のため、多くの異なる金属イオン、特に鉄と複合体を形成する[87]。フェントン反応やその他の鉄触媒による酸化ストレス経路を阻害することで,クルクミンは化学予防剤として作用し,DNA,脂質,タンパク質などの重要な細胞標的に対する酸化的傷害を軽減することができる[88]。Jiaoらは、体内の鉄分レベルが低いマウスの生体内試験モデルを用いて、鉄分の枯渇を引き起こすさまざまな方法を説明しながら、クルクミンが鉄分のホメオスタシスにどのように影響するかを示した。クルクミンは、ヘモグロビン、ヘマトクリット、血清鉄、トランスフェリン飽和度などの鉄代謝の血液学的パラメータを劇的に減少させた。クルクミンは、ヘモグロビン、ヘマトクリット、血清鉄、トランスフェリン飽和度などの血液学的パラメータを劇的に減少させた。さらに、クルクミンは鉄調節タンパク質(IRP)の活性にも影響を与えた。逆に、鉄過剰状態では、IRPが不活性化され、フェリチンmRNAの翻訳が促進される[89]。高濃度の食餌性鉄とクルクミンを併用したマウスでは、IRPsの活性が有意に上昇したことが報告されている[90]。鉄過剰症を伴う再生不良性貧血のモデルマウスにおいて、高用量のクルクミンを投与すると、ヘプシジンとその調節因子である骨形成タンパク質(BMP-6)Sekelsky Mothers Against DPP(SMAD)およびトランスフェリン受容体2(TfR2)がアップレギュレートされることが報告されている。クルクミンを投与すると、免疫および鉄過剰症によるアポトーシスから造血を保護し、デフェロキサミンよりも有効な鉄キレート効果を生体内で発揮した[91]。1990年代以降、多くの研究がクルクミンの抗ウイルス特性に焦点を当て、プロテアーゼ阻害剤としての活性を調査し、その後、HIVプロテアーゼの阻害とHIV複製の付随的減少という注目すべき結果を得た[92,93,94]。フラビウイルス(デングウイルスおよびジカウイルス)を対象とした他の研究では、NS2B-NS3プロテアーゼのアロステリック阻害が発見され、クルクミンが活性部位と重ならない空洞に結合することでその効果を発揮したことから、クルクミンをリード化合物として使用し、新しい低分子アロステリック阻害剤を設計することが示唆された[95]。幅広い植物性化合物の抗SARS-CoV活性について行われた研究によると、Wenらは、ウイルスの複製に必須であるSARS-CoV 3CLプロテアーゼ活性に対するクルクミンの有意な阻害効果を示し、クルクミンが抗SARS-CoV剤として有望であることを示した[96,97]。この目的のために、近年、いくつかの分子ドッキング研究が行われ、クルクミンが主要なウイルスプロテアーゼの阻害を含む様々な方法でSARS-CoV-2の複製を阻害するのに有効であることが示唆された[98,99,100,101]。得られたデータは、クルクミンの化学誘導体が、SARS CoV-2の主プロテアーゼ酵素を阻害することで、COVID-19感染症に対して有意な活性を示す可能性を示唆している[99,101,102,103]。
図5 SARS-CoV-2ウイルスのメインプロテアーゼの結合部位におけるクルクミン(暗赤色)のドッキング位置
水と水素はわかりやすくするために省略した
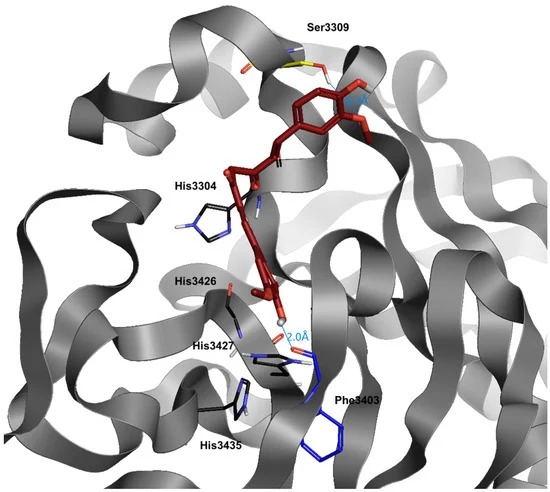
クルクミンは、ウイルスプロテアーゼのポケット内で大きな結合能力を持っている。その高い回転能力を持つ構造により、dG(-8.1)で示されるように、最適な方法で受容体ポケットに適応することができる(表3)。クルクミンの最適なドッキング位置は、メトキシル基を持つSer3309(プロテアーゼの先端部分)と、反対側のフェノール基を持つPhe3403である。
表1 COVID-19関連疾患に対する天然物の効果
| 天然物 | 効果 | 参照 |
|---|---|---|
| ラクトフェリン | 鉄キレート化による酸化ストレスや炎症の軽減 | [ 17 ] |
| グリチルリチン | SARS-CoV-2 プロテアーゼ M pro の阻害 | [ 26 ] |
| トリプタントリン | SARS-CoV-2 プロテアーゼ M pro の阻害 | [ 26 ] |
| ライン | SARS-CoV-2 プロテアーゼ M pro の阻害 | [ 26 ] |
| ベルベリン | SARS-CoV-2 プロテアーゼ M pro の阻害 | [ 26 ] |
| ケルセチン | SARS-CoV-2 プロテアーゼ 3CL pro の阻害 | [ 66 ] |
| コーヒー酸 | SARS-CoV-2 プロテアーゼ M pro の阻害 | [ 76 ] |
| クルクミン | SARS-CoV-2 プロテアーゼ 3CL pro の阻害 | [ 97 ] |
表2 COVID-19感染症における鉄の関与
| 研究の種類 | 鉄代謝 | 参照 |
|---|---|---|
| クリニカル | 貧血患者では、炎症マーカーのレベルが上昇していました。 高フェリチン血症; フェリチンレベルの上昇と サイトカインmRNAの過剰発現との相関 |
[ 33 ] |
| メタアナリシス | 生存者 と比較して、非生存者では血清フェリチンのレベルが上昇していることがわかっています。 |
[ 34 ] |
| メタアナリシス | 重度の患者で は、非重篤な患者と比較してフェリチンレベルが有意に増加しました |
[ 35 ] |
| クリニカル | 高いフェリチンレベル | [ 36 ] |
| クリニカル | 高いフェリチンレベル | [ 37 ] |
| メタアナリシス | SARS-CoV-2はヘモグロビンのベータ鎖の1つを攻撃 し、ポルフィリンからの鉄の解離と循環への放出を引き起こします |
[ 38 ] |
| クリニカル | 鉄過剰とヘプシジン過剰発現 | [ 40 ] |
| 計算上の | ヘプシジンとコロナウイルススパイク糖タンパク質の類似点 | [ 42 ] |
表3 天然物とその構造とドッキングスコア(dG)
| 名前 | 構造 | dG |
|---|---|---|
| α-リポ酸 | 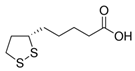 |
−8.0 |
| ケルセチン | 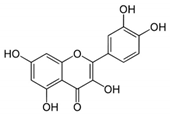 |
−8.0 |
| コーヒー酸 | 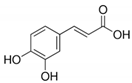 |
−6.3 |
| フィチン酸 | 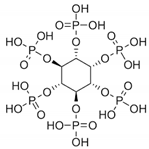 |
−1.5 |
| クルクミン | 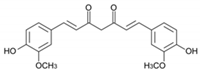 |
−8.1 |
10. 結論
COVID-19の発症時には、体内の鉄分が増加することで活性酸素が発生し、酸化ストレスや肺の損傷を引き起こし、その後の肺の線維化や肺機能の低下につながる[7]。また、鉄分の過剰摂取がウイルスの複製を促進し、感染症の重症化に重要な役割を果たしていることが明らかになっている[27]。デフェロキサミンやラクトフェリンのような物質は、その鉄キレート作用により、血清や体内組織での鉄の利用率を低下させ、COVID-19感染後の肺の損傷や線維化を防ぐことが示されている[11,12]。これと並行して、最近の結果では、プロテアーゼ阻害の可能性がある化合物が、SARS-CoV-2感染に立ち向かうための新しい候補として挙げられている[104,105]。本レビューでは、鉄キレート剤およびプロテアーゼ阻害剤としての活性が十分に示されたいくつかの重要な天然物の効果を紹介し、要約した。これは、COVID 19感染に関連する病理学的文脈に対する新しい可能な治療戦略への関与を示唆している。
