www.ncbi.nlm.nih.gov/pmc/articles/PMC6681233/
要旨
食品サプリメントまたは機能性食品の使用は、過去数十年の間に著しく増加しており、特に現代のライフスタイルと先進国の食糧不足の両方を補うために使用されている。
食品サプリメントは、習慣的に栄養不足を是正したり、特定の生理機能をサポートすることを目的としているにもかかわらず、患者の健康を改善したり、心血管疾患、嚢胞性線維症、癌、肝臓および消化器疾患などの多くの慢性疾患の症状を緩和したりするために、一般的な薬物療法と組み合わせて使用されることが多い。
近年、患者の食生活への関心が高まり、ビタミンや抗酸化物質を豊富に含むサプリメントや機能性食品の使用は、パーキンソン病(PD)などの神経変性疾患の治療や予防に非常に重要な役割を果たしている。天然化合物、植物化学物質、ビタミン、およびミネラルは、酸化ストレス、フリーラジカル形成、および神経炎症のような疾患の発生に関与する主要な生理学的メカニズムのいくつかとは対照的に、パーキンソン病の臨床症状を予防、遅延、または緩和することができる。
本レビューの目的は、パーキンソン病患者の臨床的枠組みを改善するために、サプリメントや機能性食品に一般的に含まれる特定の生体分子や生物原性元素を使用することを支持する科学的証拠を収集することである。
キーワード
パーキンソン病、サプリメント、機能性食品、抗酸化物質、抗炎症、神経保護、天然化合物
1. はじめに
食品サプリメントの使用は、過去数十年の間に、特に先進国において大幅に増加しており、その傾向は今後数年にわたって増加すると予想されている[1]。このような増加の理由は、主に現代、工業化のプロセス、そして重要な栄養素が不足している食糧源に起因していると考えられている。さらに、人々が採用する傾向がある熱狂的なライフスタイル、また、平均寿命の増加と慢性疾患の発生率は、食糧不足を補うために特定の栄養素の摂取に常に注意を提供している。
近年、医療栄養市場に対する前向きな見通しが評価され、サプリメントの恒常的な利用により 2016年の世界の栄養補助食品市場は1,331億ドルに達し、9.6%のCAGR(複合年間成長率)で加速し、2024年には2,780億2,000万ドルに達すると予測されている[1]。ビタミン系サプリメントは、2024年末までに世界シェアの48%を占めると予測されている。欧州食品安全局(EFSA)は、食品サプリメントを「栄養学的または生理学的効果を有する栄養素またはその他の物質を濃縮した供給源であり、用量の形で販売されているもの」と定義している。ビタミン、ミネラル、アミノ酸、必須脂肪酸、食物繊維、様々な植物やハーブの抽出物などを含むが、これらに限定されない幅広い栄養素や他の成分が、食品サプリメントに含まれている可能性がある」[2]。この文脈では、食品サプリメントの役割は、特定の成分の適切な摂取によって栄養不足を補い、その結果、いくつかの生物学的プロセスをサポートすることにある。これらの製品は薬理作用をシミュレートすることができず、病気の発症を治療または予防することができないため、医薬品ではないことを強調しておくことが重要です[3]。実際、サプリメントに関するクレームはEFSAによって厳しく規制されている。EFSAは、科学的文献の詳細な評価を行った後に、そのビタミンや一般的に問題となっている栄養素がどのような観点から有益な栄養効果を発揮するかを示すことができる[4]。
それにもかかわらず、栄養補助食品は、心血管疾患、嚢胞性線維症、癌、ヒト免疫不全ウイルスおよび後天性免疫不全症候群、肝臓および消化管疾患、および栄養状態に関連する疾患などの多くの慢性疾患のために、しばしば薬理学的治療と組み合わせられている[5,6]。さらに、神経変性疾患の治療や予防、特に高齢者層においても栄養は非常に重要な役割を果たしている[7]。
最近では、機能性食品や食品サプリメントの摂取が、パーキンソン病(PD)などの加齢関連疾患の管理に大きく貢献することが強調されている[8]。実際、サプリメントや果物、野菜、香辛料に含まれる天然化合物、フィトケミカル、ビタミン、ミネラルは、慢性神経変性疾患の臨床症状を予防、遅延、緩和し、認知機能、学習、一般的な脳の状態、ウェルビーイングを改善することができる[9]。
本レビューの目的は、パーキンソン病患者の臨床的枠組みを改善するために、サプリメントや機能性食品に一般的に含まれる特定の生体分子の使用を支持するための科学的証拠を収集することである。科学的文献データを分析することで、どのビタミン、ミネラル、または異なる分子が、酸化ストレスや神経炎症などのパーキンソン病に関連する生理現象を打ち消したり、緩和したりするのに有用な潜在的な特性を発揮することが示されているかを特定することが可能になるだろう。
2. パーキンソン病
パーキンソン病は、振戦、筋硬直、動作の遅さ(徐動性)前かがみの姿勢(姿勢不安定)などの運動症状の発症を特徴とする変性神経障害である[10]。さらに、気分や感情の障害、無気力、無気力、抑うつ、認知機能障害や幻覚、睡眠障害、複雑な行動障害などの非運動症状もみられる。パーキンソン病は常に人口の1-2‰が罹患しており、アルツハイマー病とともに最も一般的な神経疾患の一つである [11]。
パーキンソン病は60歳以上の高齢者の約1%が罹患し、人生の6年目から9年目までの10年間で5~10倍に増加する[12]。パーキンソン病の発症には、疾患の枠組みが完全に解明されていないにもかかわらず、環境因子と遺伝因子の両方が関与している[13]。
神経病理学的機序については、主な証拠として、黒質のパー・コンパクト体と脊髄のドーパミン作動性ニューロンの喪失が挙げられる。前者は運動制御を司るが、後者は様々な心理的作用を司る。
ニューロン変性の最も重要な結果の1つは、多くの生物学的機能に関与するドーパミン(DA)の減少である[14]。さらに、パーキンソン病の影響を受けた脳は、レビー小体とレビーニューライトの存在によって特徴づけられる [15]。
レビー小体は、いくつかの異なる脳領域に存在する死んだニューロンの細胞質に埋め込まれたタンパク質(α-シヌクレイン、パーキン、およびその他のタンパク質)の凝集体からなる。α-シヌクレインの凝集は、可溶性モノマーが最初にオリゴマーを形成し、その後、徐々に合体して大きな不溶性フィブリルを形成することで始まる[16]。
これら2つの主要な臨床的証拠を超えて、パーキンソン病には異なる分子機構が関与しており、すべてが互いに関連しており、疾患の生理学的病理学に直結しており、神経変性過程を悪化させる一種の悪循環に陥っている(図1)。
図1 パーキンソン病(PD)の病因に関与する主要な分子機構の相互作用
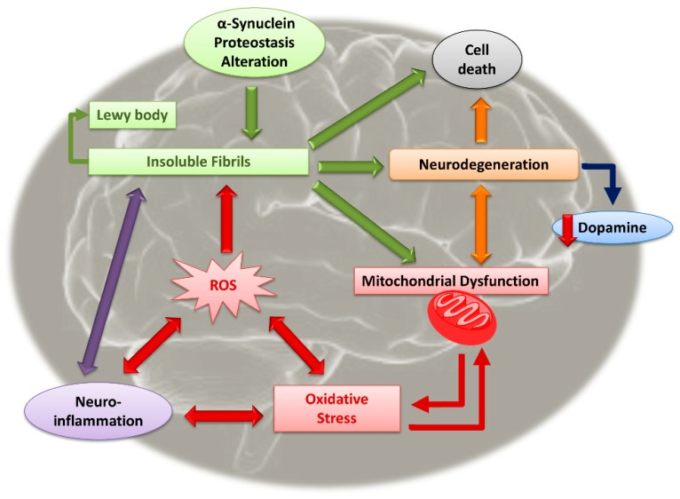
神経細胞のミトコンドリア機能不全とパーキンソン病の病因とを相関させる証拠がある[17,18]。この機能障害はα-シヌクレインの異常蓄積と関連しており、正常なミトコンドリア機能の変化を引き起こし、神経細胞の変性と強い酸化ストレスを引き起こす[19,20]。後者はパーキンソン病患者の神経組織、特に酸化ストレスおよび代謝ストレスに対して特に脆弱なニグラル・ドーパミン作動性ニューロンのレベルで悪化する [21,22]。
神経炎症の存在はパーキンソン病のもう一つの特異的な特徴であり、疾患の進行に重要な役割を果たしている。炎症はミトコンドリアレベルでのエネルギー代謝障害にも依存しており、これによりミクログリアが活性化され、プロスタグランジン、サイトカイン、ケモカイン、補体、プロテイナーゼ、活性酸素種(ROS)活性窒素種(RNS)を含む多数のプロ炎症性メディエーターが相対的に産生されるようになる [23,24]。
これらの証拠はすべて、ドーパミン作動性ニューロンの変性、線条体の運動領域におけるドーパミン作動性伝達の低下、したがって細胞死につながる[22]。さらに、パーキンソン病はコリン作動系やセロトニン作動系などの他の2つの神経伝達複合体の変化を引き起こす。特に、パーキンソン病患者ではコリン作動性およびムスカリン受容体の減少が強調されており、認知機能および運動機能に関連した負の結果をもたらしている[25]。パーキンソン病の診断は、疾患の症状が明らかになる前には困難である [26]。
さらに、パーキンソン病患者のほとんどは、睡眠覚醒周期の調節障害、気分や感情の認知障害、自律神経機能障害、感覚や痛みなどの非運動症状も持っている [27]。
現在利用可能な治療法は、運動障害を抑制するために線条体内のドーパミンのレベルを回復させることを目的としており、レボドパ(L-DOPA)は、パーキンソン病の治療のためのゴールドスタンダードである[28]。L-DOPAによる治療は、一連の薬理学的戦略を伴って、末梢のドーパミン代謝を抑制し、そのバイオアベイラビリティーを改善することで、その投与による運動合併症を減少させることを目的としており、また、パーキンソン病患者のQOLを圧迫する前述の非運動症状をコントロールするための更なる治療法も目的としている[29,30,31]。
近年では、内科的治療に加えて、運動、グループ療法、栄養学、食物補給などの非薬理学的な代替療法が行われるようになってきている [32,33,34]。最近では、パーキンソン病などの加齢関連疾患の管理は、機能性食品または食品サプリメントの消費と関連している。実際、抗酸化物質、ビタミンおよびミネラルを含む食品を豊富に含む健康的な食事、または食品サプリメントの使用は、パーキンソン病の症状および関連する病理学的機序を軽減および/または対照するのに役立ち得る[35,36]。
3. パーキンソン病における酸化ストレスおよび神経炎症
神経細胞やグリア細胞における酸化ストレス、フリーラジカルの発生、活性酸素の発生は、パーキンソン病や他の神経変性疾患の発症に寄与し、大きな役割を果たしている[21,37]。特に、黒質ドーパミン作動性ニューロンは酸化ストレスに対して特に脆弱であると考えられている。高エネルギーに加えて、ドーパミンとその代謝物のレベルの上昇も酸化ストレスを引き起こす可能性がある[39]。最後に、ミトコンドリアの機能不全は当然のことながら酸化ストレスの増加レベルにつながり、リソソームが枯渇し、前者が後者の変化を増加させ、後者が逆の変化を増加させるという悪循環が形成される[40]。
同時に、脳内の抗酸化防御機構は貧弱であるため、フリーラジカル攻撃に対する防御作用が制限され、特に神経変性疾患の進行中には、細胞の抗酸化能力がさらに低下する。抗酸化物質は、フリーラジカルや反応性種を消去することができ、アポトーシス細胞死の発症やドーパミン作動性黒質細胞経路の神経変性を防ぐことで、パーキンソン病の治療に有益な効果をもたらす。
同じレベルで、神経炎症はパーキンソン病の発症に重要な役割を果たしており、ミクログリアの活性化とプロ炎症性メディエーターおよび毒性メディエーターの増幅を強調している[41]。特に、α-シヌクレイン不溶性フィブリルの存在は、グリア細胞やその他の免疫/炎症性細胞を活性化し、炎症性サイトカイン、ケモカイン、神経毒性メディエーターの放出を伴い、ドーパミン作動性ニューロンの神経変性を誘導する[42]。さらに、毒性のある不溶性フィブリルもまた、パーキンソン病において直接的な炎症促進活性を有し、神経変性および神経細胞死に寄与している(図1)[43]。
最後に、末梢免疫細胞および炎症性細胞は、欠損した血液脳関門(BBB)を介して脳に移動し、神経炎症を直接またはグリア細胞およびニューロン細胞を介して増加させる[41]。サプリメントまたは機能性食品から抗炎症性化合物を摂取することは、神経炎症の抑制または低減につながり、PD症状を改善し、神経変性の程度を低下させることができる。
4. パーキンソン病の予防・管理に有用な天然化合物
多くの分子や天然化合物が、酸化ストレスや神経炎症など、この病気を支配する生理学的メカニズムを打ち消すことで、パーキンソン病の症状を緩和することが科学的に証明されている。さらに、いくつかの分子は、神経保護作用や神経調節作用を有することが示されている。
表1に分析した分子を示し、各化合物について、実験的に示された有益な効果と、パーキンソン病の治療における積極的な発症率を支持する実行されたメカニズムを記載している。
表1 化合物の有益な効果とそれに関わるメカニズムの概要
| 分子 | 有益な効果 | 機構 | 参照。 |
|---|---|---|---|
| コエンザイムQ10 | 抗酸化 神経保護 |
コエンザイムQ10は、その1,4-ベンゾキノン構造により、フリーラジカルスカベンジャーとして作用する強力な抗酸化剤である。それはミトコンドリアの電子伝達系の酸化還元成分でもあるため、神経細胞のミトコンドリア活性の調節を通じて神経保護を発揮する可能性がある。 | [ 44、45、46、47、48、49、50 ] |
| リポ酸 | 抗酸化 抗炎症 神経保護 |
ジチオラン環は、その酸化型と還元型で、リポ酸を強力な抗酸化剤にする。抗炎症剤として、NF-κBやTNF-αなどの炎症性サイトカインを阻害する。神経保護は、システインの細胞内レベルを高め、グルタチオンレベルを高めることによって与えられる。 | [ 51、52、53、54 ] |
| N-アセチルシステイン | 抗酸化 神経保護 |
N-アセチルシステインのチオール基は、直接的な抗酸化剤としてもグルタチオン前駆体としても機能する。ミトコンドリア複合体IおよびIVの活性を高め、神経細胞における活性酸素(ROS)の蓄積を防ぐ。 | [ 55、56、57、58、59、60 ] |
| ビタミンE | 酸化防止剤 | ビタミンEは、水素原子をフリーラジカルに供与することにより、いくつかのROSのスカベンジャーとして機能し、その結果、それらの反応性と毒性を低下させる。 | [ 61、62、63、64、65、66 ] |
| カルバクロール | 抗酸化剤 抗炎症性 神経調節 |
カルバクロールは抗酸化酵素の生成を誘発し、酸化ストレスを調節する。抗炎症効果は、炎症誘発性サイトカインの産生を減らすことによって発揮される。カルバクロールはアセチルコリンエステラーゼ活性を阻害することもでき、PDの記憶力と認知能力にプラスの効果をもたらす。 | [ 67、68、69 ] |
| クルクミン | 抗酸化 抗炎症 神経保護 |
クルクミンは、フェノール環とジケトン基のおかげで、優れたフリーラジカルスカベンジャーである。ミトコンドリア複合体Iを酵素のニトロ化とその後の阻害から保護し、ミトコンドリアの機能障害を軽減する。抗炎症作用および神経保護作用は、炎症カスケードを媒介するケモカインの調節によって発揮される。 | [ 70、71、72、73、74、75、76、77、78 ] |
| オメガ3 脂肪酸 |
酸化防止剤 抗炎症剤 |
オメガ3脂肪酸は、フリーラジカルスカベンジャーとして作用するROS形成を減少させる。それらはまた、好中球および単球の走化性、ならびに炎症誘発性サイトカインの産生を減少させる。 | [ 79、80 ] |
| 乳漿タンパク | 酸化防止剤 | ホエイプロテインはシステインの優れた供給源であるため、グルタチオンの生成を増加させ、酸化ストレスを軽減することができる。 | [ 81、82 ] |
| ビタミンD 3 | 抗酸化神経保護 | ビタミンD 3阻害する酸化ストレスは、フリーラジカルの形成を減少させ、シグナル伝達経路オートファジーを増強することによって神経毒性を減少させる。神経保護は、パーキンソン病患者で観察される内皮機能障害を軽減することによって発揮される。 | [ 83、84、85、86、87 ] |
| クレアチン | 抗酸化 神経保護 |
クレアチンは、フリーラジカルと抗酸化剤として作用するROSを対比することができる。さらに、それはホスホクレアチンの生成を通じてミトコンドリアの活動を刺激することができ、したがってATPの生成と脳内のエネルギー恒常性を調節する。 | [ 88、89、90、91 ] |
| メラトニン | 酸化防止剤 | メラトニンには興味深い抗酸化作用があり、おそらくインドールグループに関連している。抗酸化作用は、神経細胞で抗酸化触媒が低下するのを防ぐことによっても実行される。 | [ 92、93、94、95、96 ] |
| ナイアシン (ビタミンB 3) |
抗酸化 神経保護 |
ナイアシンとその活性型ニコチンアミドは、酸化ストレスを軽減する。神経保護は、ミトコンドリア複合体IレベルでのATP産生に不可欠な補因子であるニコチンアミドアデニンジヌクレオチド(NAD)の生合成に関与しているために達成される。 | [ 97、98、99、100、101、102 ] |
| ビタミンC | 酸化防止剤 | ビタミンCは優れた抗酸化物質であり、ROSレベル、脂質過酸化、および酸化ストレスの軽減に適している。また、他の抗酸化物質の再生にも役立つ。 | [ 103、104、105、106 ] |
| 6-ショウガオール | 抗酸化 抗炎症 神経保護 |
α、β-不飽和ケトン部分は、6-ショグソルを優れたフリーラジカルスカベンジャーにする。それは、プロスタグランジンEおよびTNF-αやインターロイキン-1βなどの炎症誘発性サイトカインの産生を減少させることにより、抗炎症特性を持っている。神経保護は、ミクログリアの活性化を阻害することによって評価される。 | [ 107、108、109 ] |
| β-カロテン | 酸化防止剤 | β-カロテンは優れたフリーラジカルスカベンジャーである。その構造内の多数の共役二重結合は、この化合物の独特の抗酸化特性を与える。 | [ 110、111、112、113 ] |
| リコピン | 酸化防止剤 | リコピンは優れたフリーラジカルスカベンジャーである。その構造内の多数の共役二重結合は、この化合物の独特の抗酸化特性を与える。 | [ 114、115、116、117、118 ] |
| フラボノイド ケルセチン エピガロカテキン-3-ガレート イチョウ葉エキス |
抗酸化 抗炎症 神経保護 神経調節 |
フラボノイドの抗酸化活性は、15炭素骨格上の官能基の配置に依存する。フリーラジカルスカベンジャー能力に加えて、それらは炎症性サイトカインの過剰産生を調節し、炎症誘発性メディエーターを減少させ、神経保護を与える。この最後の特性は、線条体ドーパミンの増加と、ニューロンの生存率を高める細胞生存/細胞周期遺伝子の調節によっても発揮される。 | [ 119、120、121、122、125、126、127、128、134、135、136 ] |
4.1. コエンザイムQ10
ユビキノンとも呼ばれるコエンザイムQ10(CoQ10,図2)は、動物やほとんどのバクテリアに存在する1,4-ベンゾキノンである。天然の供給源はマグロやサーモンなどの食品、内臓肉、全粒穀物などであるが、最近ではCoQ10を豊富に含む食品のサプリメントも人気がある。
CoQ10は、電子輸送チェーンの構成要素であり、ATPの形でエネルギーを生成する好気性細胞呼吸に参加している。この分子は、電子輸送鎖における重要な電子キャリアとしてだけでなく、フリーラジカル消去抗酸化物質としても作用する[44]。特に、いくつかの試験管内試験研究では、CoQ10が神経毒性の複数のモデルにおいて神経保護効果を有することが示された。
また、CoQ10の経口投与は、MPTP誘発マウスPDモデル(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン、MPTP)で治療した1歳マウスの線条体におけるドーパミンおよびドーパミン作動性軸索の喪失を減少させることも強調されている[45,46]。それにもかかわらず、パーキンソン病の管理におけるCoQ10の役割については議論の余地がある。
図2 検討された天然化合物の化学構造

Shultsと共同研究者らは2002年に、各群20人の被験者を対象とした前向き無作為化二重盲検試験において、プラセボと3種類のCoQ10の投与量(300,600,1200mg/日)を比較する第II相試験を実施した[47]。著者らは、高用量のCoQ10は安全で忍容性が高く、プラセボと比較して補酵素を投与された患者の障害が軽減され、パーキンソン病における進行性の機能低下を遅らせることを明らかにした。
さらに 2003年にMullerらは、単施設、並行群、プラセボ対照、二重盲検試験を実施し、4週間の治療期間中にCoQ10 360mgを毎日経口投与した場合の症状反応を調べた[48]。その結果、CoQ10の経口投与はパーキンソン病患者において中等度の有益な効果をもたらすことが示唆された。
これに対して 2007年のStorchらは、Shultsらの研究と同じプロトコルと最大投与量(1200mg/日)を適用した臨床研究を行ったが、3ヶ月間の治療後、中年期のパーキンソン病においては評価できるほどの有益性は認められなかった[49]。
さらに最近、パーキンソン病の治療に対するCoQ10の有効性に関する定性的および定量的な結論を強調するためにメタアナリシスが行われた[50]。最終的な結果は、CoQ10はパーキンソン病患者において安全で忍容性が高いことを示したが、臨床的有用性を示す証拠は示されなかった。パーキンソン病における進行性の機能低下を遅らせる上でのCoQ10の役割を確認するためには、追加の試験が必要である。
4.2. リポ酸
リポ酸(LA、図2)は、ヒトの体内で自然に合成される化合物であり、いくつかの食品にも含まれている。抗酸化活性や抗炎症活性を示すだけでなく、フリーラジカルの形成を抑制することから、潜在的な治療価値を持っている[51]。
2018年のZhangらは、パーキンソン病の生体内試験マウスモデルにおいてLAの抗酸化性および抗炎症性を調査しただけでなく、L-DOPA投与に関連したジスキネジアの副作用を軽減するLAの能力も評価した[52]。6-OHDA標識ラット(6-ヒドロキシドパミン、6-OHDA)をL-DOPA治療と併用してLA(31.5mg/kgまたは63mg/kg)で治療したところ、LAは薬物の抗PD効果を損なうことなく、用量依存的にL-DOPA誘発性ジスキネジアを減少させることが強調された。さらに、LAは脂質過酸化の産物であるマロンジアルデヒドを減少させ、グルテート(GSH)活性を増加させた。著者らは、LAはL-DOPAと併用することで、有望な疾患修飾療法として推奨できると結論づけた。
Jalali-NadoushanとRoghaniは、6-OHDA誘発パーキンソン病のマウスモデルにおいて、この化合物の効果(50および100mg/kgの用量で)を調査し、特に100mgの用量では、LAが行動テストでの回転を有意に減衰させることを強調した[53]。これらの結果は、LAが酸化ストレス負荷の減衰により、6-OHDA神経毒性に対する神経保護を部分的に提供できることを確認している。
Liらは、リポ多糖(LPS)誘発性炎症性PDモデルを用いて、LAの抗酸化性および抗炎症性を試験した [54]。LPSによる治療後、ミクログリアの活性化を誘導するために、マウスにLAを1日1回100mg/kgで投与した。その結果、運動機能障害の改善、α-シヌクレイン蓄積の減少、炎症性分子の活性化の減少が認められ、LAは神経保護、抗神経炎症、抗酸化作用を発揮し、パーキンソン病の進行を食い止める有望な薬剤となっている。
4.3. N-アセチルシステイン
N-アセチルシステイン(NAC、図2)は、硫酸化システインアミノ酸のN-アセチル化誘導体である。SH基は活性酸素と積極的に対比することができ、分子に抗酸化特性を付与する[55]。同時に、NACおよびその類似体は、GSH前駆体として作用することにより、生理的な抗酸化活性に寄与する[56,57]。
パーキンソン病の管理におけるNACの潜在的な保護特性は、動物モデル研究で評価され、ミトコンドリア複合体IおよびIV活性を増加させ、活性酸素の蓄積を防止することにより、酸化的損傷の賢明な減少を実証し、このようにしてドーパミン誘発細胞死の保護につながることが示された[58]。
2013年のHolmayらは、NACの投与前後のパーキンソン病患者のGSHレベルを測定することで、NACの潜在的な抗酸化特性を調査した[59]。その結果、NACを静脈内注射した後、パーキンソン病患者の脳と血液中の抗酸化GSHレベルにブーストがあり、仮説されていたパーキンソン病の欠乏とGSH活性の低下を補うことが可能であることが示された。
2016年のMontiらは、試験管内試験および生体内試験モデルを用いて、パーキンソン病におけるNACの潜在的な保護特性を強調した[60]。最初のモデルでは、プラセボと比較して、ロテノンで処理された細胞のドーパミン作動性ニューロンの生存率が増加したことが明らかになった。
臨床研究では、NACで治療されたPD群では尾状突起と胸骨におけるドーパミントランスポーター結合が増加し、対照群では測定可能な変化は見られなかったことから、以前に観察された保護効果が確認された。
4.4. ビタミンE
ビタミン E は、4 種類のトコフェロールと 4 種類のトコトリエノールを含む 8 種類の脂溶性化合物のグループで、植物油、全粒穀物、バター、卵に豊富に含まれている。これらはいくつかのヒトの生物学的機能に関与しており、α-トコフェロール(図2)はビタミンEの主要な形態として、優先的に吸収され、ヒトの体内に蓄積される。それは抗酸化剤として作用し、ヒドロキシルラジカルやペルオキシラジカルを含むいくつかの活性酸素のスカベンジャーであり、脂質の過酸化を抑制することができる[61]。パーキンソン病の管理におけるこの分子の潜在的な神経保護特性をよりよく理解するためにいくつかの臨床試験が行われたが、その結果は論争の的となっている[62]。
Fahnは、初期のパーキンソン病患者にアスコルビン酸とビタミンEの組み合わせを投与することを最初の試験的な非盲検試験で試みた[63]。この試験の主要エンドポイントは、対照と比較して患者がL-DOPAまたはドパミンアゴニストによる治療を必要とするまでの病状の進行であり、その結果、抗酸化剤の併用投与を受けた患者ではL-DOPAが必要となるまでの期間が2.5年延長されたことが示された。
Zhangらは、詳細かつ妥当性のある半定量的な食事頻度調査を行った2つの大規模コホートの男女におけるパーキンソン病の発生を記録しており、抗酸化ビタミンの補給はパーキンソン病のリスクとは関連していないが、食事性ビタミンEを多く摂取している男女ではパーキンソン病のリスクが有意に減少することを強調している[64]。
それにもかかわらず、別の臨床試験では、Scheiderと共同研究者らは、PD発症における長期的な食事性抗酸化物質摂取の役割の可能性を考慮した[65]。その結果、ビタミンEはパーキンソン病の臨床的特徴を改善したり、機能低下を遅らせたりする効果を示す証拠を示さなかった。
デプレニル(セレギリン)とα-トコフェロールのパーキンソン病の進行を遅らせる効果を調べるために大規模な臨床試験が実施された(DATATOP試験、Deprenyl and tocopherol antioxidative therapy of parkinsonism)[66]。この観察では、デプレニルは障害の進行を遅らせるが、α-トコフェロールは効果がないことが示された。パーキンソン病における機能の進行性低下を遅らせるビタミンEの役割を確認するためには、さらなる試験が必要である。
4.5. カルバクロール
カルバクロール(図2)は、バジル、ローズマリー、タイム、オレガノなど多くの芳香植物に含まれるフェノール性モノテルペンである。バジル、ローズマリー、タイム、オレガノなど多くの芳香植物に含まれるフェノール性のモノテルペンで、最後のものはカルバクロールを濃縮した精油の割合が最も高い。このモノテルペンの特性についていくつかの研究が行われ、抗菌作用、抗真菌作用、抗炎症作用、抗酸化作用、神経調節作用など多くの薬理学的特性が強調されている[67,68]。神経調節薬として、ドーパミン作動性ニューロンの活性を調節する能力があることから、カルバクロールのPD治療への使用は興味深いものとなっている。
Haddadiらは、パーキンソン病のマウスモデルにおけるカルバクロールの効果を実験的に評価した[69]。動物に6-OHDAを投与してパーキンソン病の典型的な症状の発症を誘導し、その後、治療した動物の運動能力および認知能力を決定するためのさまざまな試験を行った。特に、アポモルヒネ誘発回転試験では、カルバクロールを投与した群と投与していない群との間に差がないことが示された。受動的回避記憶試験では、カルバクロールを25mg/kgの濃度で投与したマウスは、対照群と比較して明らかな改善を示した。最後に、テールフリック試験では、カルバクロール投与群と対照群の間に差は認められなかった。著者らは、カルバクロールは痛みや運動症状に影響を与えることなく、認知障害の改善を示したと結論づけている。
4.6. クルクミン
クルクミン(ジフェルロイルメタン、図2)は、アジアに広く分布する植物であるCurcuma longaの根茎から抽出されたポリフェノールである。根茎から抽出した粉末は、香辛料として、また東洋医学では自然療法として利用されている。クルクミンが誇る特性には、抗酸化作用、抗炎症作用、神経保護作用などがあり、パーキンソン病の治療に好影響を与える可能性がある[70]。
Wangらは科学文献の分析を行い、クルクミンとパーキンソン病に関する113の研究を収集した[71]。その中で、特定の包含基準により、13の研究をパーキンソン病の動物モデルにおいてクルクミンが発揮することができる効果との関連性があると評価した。特に、著者らが述べた3つの主要な知見は、クルクミンが抗炎症作用、抗酸化作用、および抗アポトーシス作用を発揮することである。抗炎症特性は5つの研究で強調されており、クルクミンは多数の金属によって引き起こされるDNA損傷を減衰させ、プロ炎症性サイトカインの存在を減少させた[72,73,74,75,76]。いくつかの研究で発表された抗酸化特性は、生体内の活性酸素レベル、脂質過酸化、およびNOの生成を減少させるクルクミンの能力を実証した[72,76,77]。最後に、抗アポトーシス特性は2つの研究で確認されており、クルクミンはプロアポトーシス細胞タンパク質レベルを減少させ、パーキンソン病の動物モデルで検討された脳組織に神経保護を付与した[73,78]。
4.7. オメガ3脂肪酸
オメガ3脂肪酸は、多価不飽和構造のバックボーンの一部である最後のメチル基から3つ離れた原子にある二重結合を主な特徴としている(図3)。オメガ3は、冷水魚(サケ)や魚油、クルミ、食用種子、亜麻仁油などの食品や、魚油をソフトカプセルにした栄養補助食品に含まれている。これらのタイプの脂肪酸は、動物の脂質代謝の重要な構成要素であり、ヒトの食事や生理において重要な役割を果たし、血中のコレステロールやLDL(低密度リポタンパク質)のレベルを低下させることに貢献している[79]。
図3 主要な多価不飽和脂肪酸オメガ3の化学構造

これらの既知の機能に加えて、Taghizadehらは、パーキンソン病患者の臨床徴候および代謝状態に対するオメガ3脂肪酸とビタミンEの併用の効果を評価し、対照群に対して二重盲検で実施した無作為化臨床試験を評価した[80]。治療群にはオメガ3脂肪酸(1000mg)とビタミンE(400IU)が3ヵ月間投与された。その結果、オメガ3脂肪酸とビタミンEの併用は、パーキンソン病の病期を評価するために用いられる選択評価尺度の有意な改善につながることが示された。さらに、オメガ3脂肪酸とビタミンEの併用は、プラセボと比較して高感受性C反応性蛋白質を減少させ、総抗酸化能を増加させたことから、パーキンソン病患者におけるオメガ3脂肪酸とビタミンEの併用は、PD症状の発症だけでなく、活性酸素産生の管理や酸化ストレスの軽減にも良好な効果があることが実証された。
4.8. ホエイプロテイン
ホエイによって得られるタンパク質は、異なるラクトグロブリン、血清アルブミン、および免疫グロブリンの混合物であり、さらに重要なことに、それはシステインの優れた食事源である。いくつかの研究では、ホエイタンパク質がGSHを増加させる能力を強調しており、この複雑な混合物がGSH合成をブーストして酸化ストレスを減少させることができることを示唆している[81]。
2016年のTosukhowongらは、パーキンソン病患者を対象にプラセボ対照二重盲検試験を実施し、血漿GSH、血漿アミノ酸、および統一パーキンソン病評価尺度の修正に対するホエイプロテイン補給の効果を調査した[82]。
その結果、ホエイ補給群のみで、血漿中の還元GSH、血漿中分岐鎖アミノ酸(BCAA)必須アミノ酸の血漿中濃度が有意に上昇した。疾患修飾率はどちらの群でも有意に改善されなかったことから、ホエイ蛋白質の補給はパーキンソン病患者の血漿中還元グルタチオンを有意に増加させ、臨床転帰に有意な変化がないことが示された。
4.9. ビタミンD3
ビタミンD3(コレカルシフェロール、図4)は、皮膚が太陽からの紫外線(UV-B)を浴びると内因性に生成される。ビタミンD3を含む食品は、タラ肝油、マグロ、コイ、サケ、脂の乗ったチーズ、キノコ類など一部の食品に限られている。そのため、サプリメントから直接摂取することができる。ビタミンDのグループに属する脂溶性ステロイドの中で、ビタミンD3は、カルシウムの吸収や骨の成長調節など、さまざまな生理的プロセスに関与しているため、最も重要なものの一つである。最近、いくつかの研究では、筋肉や内分泌器官だけでなく、中枢神経系にも関与している可能性があることが強調され、パーキンソン病の管理における神経保護剤として積極的な姿勢を示している[83]。
図4 検討した天然化合物の化学構造

Wangらは、6-OHDA病変マウスに対するビタミンD3の神経保護効果を生体内試験および試験管内試験で研究した[84]。その結果、ビタミンD3を8日間前処理すると、病変マウスの運動機能が有意に回復することが示された。神経化学的解析の結果、ビタミンD3投与マウスは対照マウスに比べて酸化ストレスからの保護とDAニューロンの枯渇が減少した。
Jangらは、活性型ビタミンD₃のオートファジー調節作用を試験管内試験のPDモデルで調べた[85]。その結果、活性型ビタミンD₃は活性酸素レベルを低下させ、細胞生存に関連する細胞内シグナル伝達タンパク質のレベルを増加させることが示された。
さらに、いくつかの臨床研究では、ビタミンD3がパーキンソン病にプラスの効果があることが示唆されている。
最初の証拠は 2008年の研究でEvatらによって記述されたもので、対照群の36%に比べて、パーキンソン病患者の55%ではビタミンD3のレベルが不足していたというものである[86]。
Knektらはフィンランドの集団を対象としたコホート研究を実施し、1978-1980年から 2007年末までの間に、パーキンソン病の発症に関する情報を収集し、同時に体内のビタミンD3濃度の血清指標である25-ヒドロキシビタミンDのレベルを測定した[87]。その結果、ビタミンD3のレベルが高いほどPD発症のリスクが低いことが示され、この疾患に対するビタミンD3の潜在的な神経保護活性の重要な示唆を与えている。
4.10. クレアチン
クレアチンは、脊椎動物に自然に存在する窒素性のグアニジン分子で、筋肉や神経細胞へのエネルギー供給に役立っている(図4)。この分子は通常、アスリートが高強度の嫌気性反復運動で最大出力とパフォーマンスを向上させるために使用されているが、試験管内試験および生体内試験のPDモデルでは、抗酸化特性、ミトコンドリア機能障害の軽減、神経保護特性のエビデンスもある[88]。
Matthewsらは、パーキンソン病のMPTP誘発マウスモデルにおけるクレアチンの神経保護効果を評価した [89]。その結果、クレアチンまたはシクロクレアチンの経口投与は、マウスのMPTP誘発性ドーパミン枯渇に対して有意な保護効果を示し、ドーパミン作動性ニューロンの変性が減少したことが示された。
Yangらは、パーキンソン病のMPTPマウスモデルにおいて、CoQ10とクレアチンの組み合わせが相加的な神経保護効果を発揮するかどうかを検討した[90]。MPTP投与後、2つの抗酸化分子を併用すると、MPTP投与マウスの神経細胞における脂質過酸化と病理学的α-シヌクレイン蓄積が有意に減少し、相加的な神経保護効果が得られた。
これらの肯定的な結果にもかかわらず、Benderらは60人のパーキンソン病患者を対象にクレアチンの効果について2年間のプラセボ対照無作為化臨床試験を実施し、クレアチンが患者の気分を改善し、ドーパミン作動薬の投与量をより少なくすることにつながったが、疾患修飾には効果がなかったことを強調している[91]。さらなる臨床試験により、PD治療におけるクレアチンの臨床的有用性が明らかになる可能性がある。
4.11. メラトニン
メラトニンは松果体で産生されるホルモンであり(図 4)睡眠覚醒タイミング、血圧調節、季節性生殖などの概日リズムの同期化に関与している。さらに、いくつかの研究では、メラトニンが関連する抗酸化特性を発揮する能力が報告されている[92]。
特に、Antolinらは、MPTP誘発マウスのPDモデルにおいて、メラトニンが抗酸化物質として作用する能力を報告している[93]。その結果、メラトニンは、MPTPの慢性投与によって誘発される損傷とは対照的に、神経細胞死を防ぐことができ、誘発された酸化ストレスや硝酸ストレスに対抗することで、黒質細胞経路における神経細胞の変性を防ぐことが示された。
Dabbeni-Salaらは、パーキンソン病の6-OHDA動物モデルにおいてメラトニンの神経保護作用を実証した[94]。著者らは、治療したマウスでメラトニンの保護活性を観察し、ミトコンドリア酸化性リン酸化酵素の活性が増加し、神経細胞の酸化ストレス障害が減少したことを示した。
最後に、2つの研究では、マウスにメラトニンを投与しても、MPTP誘発毒性からニグラル・ドーパミン作動性ニューロンを保護する効果がないことが示された。いずれの研究の結果も、ニューロンの酵素レベルとDA濃度はメラトニン投与マウスと対照マウスの間で差がないことを示している[95,96]。
4.12. ナイアシン(ビタミンB3)
ビタミンB群は、すべての組織の複数の生化学的経路における酵素補因子として関連する役割を持ち、細胞の代謝に重要な役割を果たす水溶性ビタミンの一群である。ビタミンB群の良い摂取源としては、豆類(豆類、豆類)全粒穀物、ジャガイモ、バナナ、そして何よりも肉類が挙げられる。おそらくビタミンの最も一般的な使用は、主にスポーツ選手のための代謝ブースターとして、そして吸収の問題とエネルギー生産のためのニーズの増加[97]のためにビタミンBの摂取量を補完する必要があるかもしれない高齢者のためのものである。ビタミンB群のうち、ナイアシンはヒトの代謝に不可欠な成分であり、その活性型ニコチンアミドはATPの産生に不可欠な補酵素NADHとNADPHの前駆体であり、その欠乏はペラグラの原因となる(図4)。パーキンソン病の生理現象の一部はミトコンドリアの機能不全と細胞のエネルギー障害に関連しているため、ナイアシンは多くの代謝経路での役割のため、低用量でも神経保護および抗酸化機能を有することが強調された[83]。
Jiaらは、MPP+誘発PD(1-メチル-4-フェニルピリジニウム、MPP+、ミトコンドリアの酸化的リン酸化を阻害することで作用する神経毒)の細胞モデルにおいて、ニコチンアミドのミトコンドリア機能と酸化ストレスに対する効果を研究した[98]。その結果、ニコチンアミドはMPP+の毒性からヒト細胞を有意に保護し、細胞の生存率と抗酸化物質の生成を高め、DNA損傷を減少させることが示された。
Andersonらは、MPTP誘発マウスのPDモデルにおけるニコチンアミドの可能性を検討した [99]。ニコチンアミドの投与量の違い(125,250,または500mg/kg i.p.)の中で、最高用量のニコチンアミドのみが、MPTPで治療された動物において線条体DAレベルの回復と神経保護を示した。
臨床研究では、高ナイアシン食とパーキンソン病のリスク低下との間に正の相関が示された[100]。興味深いのは、本来の目的は高トリグリセリド血症の治療であったにもかかわらず、ナイアシンを3ヵ月間経口投与(500mgを1日2回)したところ、特発性パーキンソン病患者の硬直と徐動運動が有意に改善されたという事例である[101]。それにもかかわらず、副作用(容認できない悪夢や皮膚の発疹)があり、この結果の枠組みをよりよく理解することはできなかった。
最後に、人口ベースの症例対照研究では、デトロイト大都市圏の50歳以上の高齢者のみを対象に、パーキンソン病の危険因子として栄養摂取量を評価したが、ナイアシンの顕著な臨床効果は認められなかった[102]。ナイアシンのパーキンソン病に対する有効性と副作用を検証するためには,さらなる臨床観察が必要である。
4.13. ビタミンC
ビタミンC(アスコルビン酸、図4)は、多くの生理機能に関与しているため、人体において重要な役割を果たしている。さらに、優れた抗酸化物質であり、活性酸素、脂質過酸化、酸化ストレスの存在を減らすのに有用である[103]。ビタミンCの主な摂取源は野菜や果物、特に柑橘類やパプリカであり、近年ではビタミンCを豊富に含む食品が市場に出回るようになってきている。
ビタミンCの抗酸化活性はパーキンソン病の管理において重要な意味を持つ可能性があり、Sershenらは、MPTP治療の前にアスコルビン酸(100mg/kg)を投与することでMPTP神経毒性に関与する活性酸素誘導体を減少させることを生体内試験で実証している[104]。
Seitzらは、ヒト神経細胞の試験管内試験モデルにおいて、ビタミンCとL-DOPA/dopamine濃度との間に相関がある可能性についての研究を行った[105]。特に、培養液にビタミンCを添加すると、L-DOPAとドーパミンの産生が増加することが示されたが、これは主に代謝レベルでの増強と、L-DOPAとドーパミンの産生に関与する酵素の遺伝子発現の両方に起因している。
最後に、HughesらはビタミンCなどの抗酸化物質の摂取とPD発症リスクとの関連を検討した[106]。1000例以上のパーキンソン病患者を分析したところ、ビタミンCの摂取がパーキンソン病のリスクを低下させることが観察された。しかし、著者らは追跡調査の数年分のデータがないため、この相関関係を確認することができなかった。
4.14. 6-ショガオール(Zingiber officinale由来
Zingiber officinaleは、東南アジア原産のジンギョウソウ科の草本植物で、香辛料や民間療法として広く利用されている。英名ジンジャーで商品化され、熱帯・亜熱帯全域で栽培されている。白やピンクの花芽の房を作り、黄色の花を咲かせ、ジューシーで多肉質の根茎を持ち、植物の有効成分である精油(ジンジベレンを主成分とする)ショウガオール、ショウガオール(辛味の主成分)樹脂、粘液などを含んでいる。
これらの中で、6-ショガオール(図4)は、パーキンソン病の治療のための興味深い特性を強調した[107]。
Parkと共同研究者らは、試験管内試験および生体内試験のPDモデルにおいて、この化合物の神経保護および抗炎症特性を研究した[108]。その結果、MPP+に曝露されたラット中脳細胞を6-shogaolで処理すると、ドーパミン作動性誘導細胞の消失が抑制され、対照群と比較してニューロン細胞数が98.37%±10.27%となったことが示された。同じ細胞培養において、6-シャガオールは、用量依存的な方法でMPP+誘発性の神経炎症性因子の産生を抑制することができた。6-シャガオールは、マウスのMPTP誘発性運動障害を対照群と比較して減少させる能力を示し、このショウガ抽出物は、ドーパミン作動性ニューロンを保護し、パーキンソン病の炎症経路を抑制し、典型的なパーキンソン病の運動症状を改善することができることが示された。
Haらは、6-ショウガオールの抗炎症効果を一次ミクログリア細胞およびLPSによって誘導された生体内試験の全身性炎症モデルで評価した[109]。その結果、一過性の大脳虚血において、ミクログリアの抑制を介して有意な神経保護効果を示し、パーキンソン病の主要な病態メカニズムの一つである神経炎症の抑制にショウガオールが積極的に関与していることが示唆された。
4.15.β-カロテン
β-カロチン(プロビタミンA、図5)は、2つのレチニル基で構成されているため、ビタミンAの前駆体であり、小腸の粘膜でβ-カロチンジオキシゲナーゼによって分解されてビタミンAを形成することができる。抗酸化物質として、非常に高い効率で一重項酸素を消去することができ、フリーラジカル反応を抑制することができる[110]。β-カロテンの毒性が非常に低く、フリーラジカルを消去する効果が期待できることから、抗酸化予防活性を評価するいくつかの臨床試験が行われており、その中にはPD疾患の予防や対照としても評価されているものもある。
図5 β-カロテンとリコピンの化学構造

Yangらは、2つの集団ベースのコホート(女性38.937人、男性45.837人)を対象に、食事によるβ-カロテンの摂取と抗酸化能力、およびPDリスクの低下とをプロスペクティブに関連づけた[111]。その結果、β-カロテンなどの抗酸化サプリメントを継続的に摂取することで、活性酸素の影響を中和して酸化ダメージを軽減することで、パーキンソン病に対して保護効果を発揮することが示唆された。
Onoらは、β-カロチンの試験管内試験での潜在的な抗フィブリル原性およびフィブリル破壊活性を用量依存的に評価した[112]。
最後に、Etminanらは、観察研究のメタアナリシスにより、β-カロテンの摂取がパーキンソン病のリスクに及ぼす影響を研究したが、β-カロテンの食事摂取に関するデータを含む研究の数が少ないためか、β-カロテンによる保護効果を強調することはできなかった[113]。
4.16. リコピン
リコピンはβ-カロテンの非環状異性体で、11個の共役二重結合と2個の非共役二重結合を持ち、カロテノイドグループに属している(図5)。果物や野菜の赤色に寄与する天然化合物である。トマト、スイカ、ピンクグレープフルーツ、アプリコットなどに含まれている。共役二重結合の数が多いため、リコピンは最も強力な天然の抗酸化物質の一つである。天然カロテノイドの中でも最も高いフリーラジカルに対する捕捉能力を持ち、α-トコフェロールやβ-カロテンに比べて一重項酸素の消去効果が10倍、47倍であり、他の抗酸化物質に比べてそれぞれ2倍、10倍の活性酸素を打ち消す能力を持っていることが実証されている[114,115]。
Kaurらは、ロテノン誘発パーキンソン病における酸化ストレスと神経行動異常に対するリコピンの潜在的な抗酸化活性を評価した[116]。著者らは、ロテノン処理ラットにリコピン10mg/kgを30日間経口投与したところ、対照と比較してリコピンの活性が39%上昇した。さらに、リコピンの投与により、膜脂質過酸化の指標であるマロニルアルデヒドのレベルが低下し、対照と比較してGSHのレベルが75.35%、スーパーオキシドジスムターゼ(SOD)のレベルが12%上昇した。これは、ロテノン処理ラットの認知障害と運動障害の部分的な逆転を伴っていた。
Premaと共同研究者らは、パーキンソン病の生体内試験モデルにおけるリコピンの神経保護活性を調査した[117]。リコピン(5,10,20mg/kg/日、経口)を投与すると、MPTPによって誘発される線条体DAの枯渇が用量依存的に保護された。また、リコピンの神経保護効果はミトコンドリア機能障害の軽減と神経炎症の軽減に関連している可能性があり、例えば、3-ニトロプロピオン酸によって誘発されたミトコンドリア機能障害と酸化ストレスの生体内試験モデルに対するリコピンの神経保護効果を調査したSandhirら[118]のように、いくつかの研究でもリコピンの神経保護効果が示唆されている。リコピンの投与は、誘発されたミトコンドリア機能障害と酸化ストレスに対して保護効果を示し、活性酸素形成と脂質過酸化の重要な減少を示した。これらの知見は、リコピンサプリメントの有益な効果の証拠を提供し、パーキンソン病の管理における神経保護および強力な抗酸化天然化合物としての治療の可能性を示唆している。
4.17. フラボノイド
フラボノイドは、植物および真菌の二次代謝物の一種であり、化学的には複素環ピロン環で連結された2つのベンゼン環からなる炭素数15の骨格に基づいており、その構造変化に基づいて6つのサブクラスに分類されている(図6)。
biomolecules-09-00271-g006.jpgである。
図6 フラボノイドの化学構造

フラボノイドの一般的な供給源は、パセリ、玉ねぎ、ブルーベリーなどのベリー類、紅茶、緑茶、すべての柑橘類、イチョウ葉、赤ワイン、ダークチョコレートなどのいくつかの食品である。これらの一般的な食品と並んで、最近食品サプリメントとして人間の栄養のために再評価されている新しい製品は、炭水化物、脂質、タンパク質、ビタミン、およびミネラルの豊富な供給源であることが証明されている花粉である[119]。さらに、花粉は抗酸化物質の主要な供給源の一つであり、その化学組成を特徴づける栄養素の中で最も豊富な分子であるフラボノイド(ほとんどがグリコシル化されている)の90%以上に代表されるフェノールプロファイルを持つ[120]。
フラボノイドは、抗酸化作用、抗炎症作用、抗アポトーシス作用、脂質低下作用などの生物学的効果により、多数の健康上の利点を提供することができるが、その中にはパーキンソン病のリスクの低下も含まれている[121]。
2018年にJungとKimは、パーキンソン病の管理におけるフラボノイドの予防的・保護的役割に関する科学的文献の概要を提供した[122]。著者らは、フラボノイドを6つの主要なサブクラス-フラボン、フラボノール、フラバノン、フラバノール、イソフラボン、アントシアニン-に分類した上で、単一分子とパーキンソン病との関係を支持するさまざまな研究を記述した。フラボノイドがパーキンソン病において発揮する主な役割は、酸化ストレスからニューロンを保護すること、神経炎症を抑制する能力、重要なニューロンの細胞内シグナル伝達経路と相互作用する能力である。これらのシグナル伝達経路には、プロテインキナーゼや脂質キナーゼのシグナル伝達が関与しており、標的分子のリン酸化状態を変化させたり、遺伝子発現を調節したりすることで、神経細胞の機能に強く影響を与えている。このことは、フラボノイドがパーキンソン病の予防のための有望な天然物である可能性を示唆しており、治療薬として採用される可能性があることを示唆している。
フラボノイドを多量に含む食品および食品サプリメントの中には、日常の食事に広く利用されているものがあり、それらを常時摂取することで、パーキンソン病の発症を予防したり、すでにこの疾患に苦しんでいる患者の臨床的枠組みを改善したりすることが可能である。
4.17.1. ケルセチン(花粉から)
ケルセチン(3,30,40,5,7-ペンタヒドロキシル-フラボン)は天然のフラボノイドで、ブロッコリー、ピーマン、赤玉ねぎ、リンゴ、ブドウなどのほとんどの植物、果物、野菜に含まれている。主な供給源は花粉であり、存在するフラボノイドの中で優勢なフラボノイドとしてグリコシル化された形でケルセチンが存在している[123]。ケルセチンが抗炎症性、抗腫瘍性、免疫調節性、神経保護性を有することは科学的に証明されている[124]。
この最後の特徴は、認知機能障害と酸化ストレスを引き起こすコルヒチンで治療されたマウスに対するケルセチンの神経保護効果を評価したKumarらによる生体内試験研究で確認された[125]。ケルセチンの慢性投与はマウスの記憶力に明らかな改善を示し、神経細胞の生化学的アッセイでは、活性酸素と脂質過酸化の有意な減少を示した。
Sriraksaらは、6-OHDA損傷ラットにおける酸化ストレスと記憶障害を打ち消すためのケルセチンの有効性を生体内試験で評価することで、以前の知見を確認した[126]。このように、6-OHDA 病変ラットを対象に、病変発生前後にケルセチンを投与したところ、対照群と比較して認知機能の顕著な改善が見られたほか、誘導酸化ストレスによる障害の軽減が見られた。
4.17.2. エピガロカテキン-3-ガレート(緑茶由来
緑茶は、ツバキ sinensis の非処理の葉で得られたお茶の亜種である。すべての商業化されたお茶のように、それは中国の起源を持っており、何世紀にもわたって日本から中東に、様々 なアジアの地域で消費されている。近年では、緑茶も世界の残りの部分でより多くの人気となっている、主にリスクの癌、心血管疾患、糖尿病、神経変性疾患[127,128]の予防を含むいくつかの健康上の利点は、それが主張しているため。緑茶は、フラボノイドが豊富で、その中で最も重要なものの一つは、(-)-エピガロカテキン-3-ガレート(EGCG)フラバノールのサブグループの化合物の一部であり、それはPD [129]の発症を打ち消すことに貢献することができる興味深い抗酸化特性を提示する。
Guoらは、6-OHDA処理したマウスのPDモデルにおける緑茶の神経保護効果を組織化学的観点から評価し、活性酸素からの著しい保護、脂質過酸化の減少、細胞内の亜硝酸塩および硝酸塩レベルの低下を確認した[130]。
Levitesらは、6-OHDAマウスのPDモデルを用いた生体内試験研究を通じて、緑茶のポリフェノールの潜在的なフリーラジカル消去活性を実証した[131]。結果は、酸化ストレスの減少と6-OHDAで治療する前に緑茶抽出物を受けた動物の細胞死に影響を与える遺伝子プロモーターの活性化の阻害を示した。
Hellenbrandらは、対照群と比較したパーキンソン病患者の食生活に関する症例対照研究において、緑茶の摂取とパーキンソン病の発症との間の相関関係の可能性を検討した[132]。その結果、食事で緑茶を定期的に摂取している人の間では、PD発症のリスクが中程度に低いことが示された。
最後に、Siddiqueらは、正常なヒトαシヌクレイン(h-αS)を神経細胞で発現しているショウジョウバエのトランスジェニックモデルにおけるEGCGの役割を研究した[133]。その結果,0.25,0.50および1.0μg/mLのEGCGを投与すると、用量依存的に運動機能障害を遅延させるとともに、PDモデルハエの脳内の酸化ストレスおよびアポトーシスプロセスを減少させることが示された。
4.17.3. イチョウ葉エキス
イチョウ葉は、伝統的な漢方薬で何世紀にもわたって使用されている部門銀杏藻の唯一の生きている種である。フラボノイドとテルペノイドを豊富に含むその抽出物は、パーキンソン病の管理に有益な効果を持つ可能性がある[134]。
WuとZuは、MPTP処理したマウスのイチョウ葉エキスの神経保護効果を調査した[135]。イチョウ葉エキスをMPTP投与の7日前に前処理したところ、MPTP誘発性神経毒性が有意に減少した。神経保護のメカニズムとして考えられるのは、フリーラジカルの形成に対するフラボノイドやギンコロイドの抗酸化特性である。さらに、フロロメトリックアッセイでは、モノアミン酸化酵素B(MAO B)の活性を試験管内試験で阻害し、黒質直腸ドーパミンニューロンの変性やアポトーシスをさらに減少させる抽出物の能力が強調された。
Rojasらは、パーキンソン病のマウスモデルにおいてイチョウ葉エキスのフリーラジカル消去活性を確認した[136]。MPTPを投与する前または24時間後に投与したマウスでは、コントロールと比較して線条体ドーパミンレベルの消失が有意に減少した。また、脂質過酸化と抗酸化酵素活性を測定することにより、酸化ストレスレベルを決定した。イチョウ葉エキスの投与後、脂質過酸化は減少したが、SOD、グルタチオンペルオキシダーゼ(GPx)グルタチオンレダクターゼの活性が増強されたことから、イチョウ葉エキスの神経保護作用は、フリーラジカル消去作用、脂質過酸化の減少、いくつかの抗酸化酵素を刺激する能力と関連していることが示唆された。
5. 結論
主に神経変性疾患がある場合の健康的な老化は、正しい薬物療法を行うことで可能であるが、食事や食品の補給が重要な要素となることが多く、近年ではサプリメントや機能性表示食品の利用が急増している。近年、サプリメントや機能性食品の利用が急増しており、あらゆるニーズに対応した多様な製品を提供する市場が拡大している。パーキンソン病の治療には、神経変性の原因となるメカニズムを対比させることで、病気の症状を軽減するのに役立つ可能性のある生体分子が豊富に含まれたバランスのとれた食事が必要となる。さらに、バランスのとれた食事と、ビタミン、抗酸化物質、または抗炎症作用と神経保護作用を有する元素に基づいた食品の使用は、通常の薬物療法を補完するものとして効果的に作用し得る。
このレビューで分析された分子は、パーキンソン病の病態生理学的メカニズムに対抗することに積極的に寄与することが示されている。検討された分子のほとんどは、顕著な抗酸化能を有しており、パーキンソン病に特徴的な酸化ストレスに対抗するために重要である。他の分子は、抗炎症性を有するため、あるいは、異なる分子機構を介して、ドーパミン作動性ニューロンの神経保護を誘導することができるため、有用である。
それにもかかわらず、天然および/または植物由来の分子の使用には時間が重要な役割を果たしている。なぜなら、通常、それらの分子は短期間では即効性または具体的な利益を示さないが、長期間にわたって継続的に使用することで、いくつかの病態の治療、特にパーキンソン病のような遅効性の神経変性疾患の治療において、いくつかの利益をもたらすことができるからである。
