Contents
Drug Repurposing for Parkinson’s Disease: The International Linked Clinical Trials experience
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8017145/
Published online 2021 Mar 19
Simon R. W. Stott,1 Richard K. Wyse,1,* and Patrik Brundin2
要旨
パーキンソン病を対象とした国際共同治験(iLCT)プログラムは、一つの疾患に焦点を当てた最も包括的な医薬品再利用プログラムの一つである。2010年に計画されて以来、このプログラムは急速に成長し、パーキンソン病(PD)の疾患修飾を目的とした16種類の薬剤について、7つの臨床試験が完了し、15の臨床試験が進行中である。本レビューでは、本プログラムの歴史、構造、プロセス、および進捗状況を概観する。このレビューでは、本プログラムの歴史、構造、プロセス、進捗状況を概観し、本プログラムで優先的に選択され、その後臨床試験で評価された薬剤の例を紹介する。このレビューの目的は、他の治療分野でも検討可能なテンプレートを提供することである。
キーワード パーキンソン病、神経変性、疾患修飾、神経保護、薬剤再利用
はじめに
1973年4月、米国食品医薬品局(FDA)は、パーキンソン病(PD)の症状を緩和するためのアマンタジンの使用を承認した。この抗ウイルス剤がPDの治療薬として承認されたのは、患者と医師の間で交わされた1つの逸話がきっかけとなっている。しかし、現在利用可能なPD治療薬と同様に、アマンタジンは、PDに罹患している人に、運動関連の特徴(徐動性、硬直性、安静時振戦)を一時的に緩和する症状をもたらすだけである。疾患の進行を遅らせたり、止めたりすることができる疾患修飾薬の開発に成功し、広く普及させることは、600万人から1000万人の患者と、その家族にとって、世界的に大きなアンメット・ニーズとなっている。現在、医薬品の再利用は、病気の進行速度に大きな違いをもたらす治療法を見出すことができると期待されている。
薬剤再利用(Drug repurposing)は、薬剤再配置(Drug repositioning)再ファイリング(Reprofiling)再タスク(Re-tasking)と呼ばれることもあるが、本来の医学的適応を超えた、承認薬や治験薬の新たな用途を特定する戦略である(Pushpakom er al 2018)。これは、臨床開発に必要なステップの数を減らし、薬を規制当局の承認まで持っていくための時間と費用を削減することができるため、効率的で魅力的なアプローチである。ほとんどの承認済み医薬品の臨床プロファイルおよび薬物動態/力学はすでに非常によく特徴づけられているため、多くの場合、研究者は直接第2相評価に移行し、関心のある新しい適応症における有効性の兆候を探ることができる。3,600種類以上の医薬品が利用可能であり(米国FDA 2019年)それぞれの医薬品は1つまたは多くの場合複数の生物学的標的に対して生物学的に活性化されるため、適応症横断的な試験を行う機会が豊富にある。現在、世界中の数多くの営利団体や学術団体が、関心のある病状に対する医薬品開発を促進するために、医薬品の再利用を採用している。洗練された医薬品評価プロセスは、主要なステークホルダーによって確立されている。その成功した効果的な例が、パーキンソン病に焦点を当てた国際連動型臨床試験(iLCT)プログラムである。
2010,Cure Parkinson’s Trust(CPT)は、臨床試験の連動を計画し始め、後に「国際臨床試験連動プログラム」と改名した。当初は 2003年にWalter Koroshetz氏らが立ち上げた「Committee to Identify Neuroprotective Agents for Parkinson’s」(CINAPS)プログラムの先駆的な取り組みに大きな影響を受けてた(Ravina et al 2003)。CPTは、前臨床のパーキンソン病モデルにおいて疾患を改善する可能性のある、再利用に適した薬剤を検討するために、関連する多様なスキルを持つ専門家からなる国際委員会を、毎年2日間の会議で開催することを目指していた。iLCTでは、後述するように、再利用を検討している各薬剤について、その薬剤の特性や、なぜその薬剤がPDでの試験に適しているのかという科学的・臨床的根拠に関する資料を作成している。毎年、20種類以上の薬剤がiLCT委員会のメンバーに提示され(表1)委員会はそれらの薬剤に優先順位をつけ、評価された治療薬の中でどの薬剤が臨床試験に進むのに最も適しているかを決定することになってた。このプロセスに続いて、CPTは実用性を検討し、iLCT委員会が選んだ優先順位の高い治療法の今後の臨床試験を取り仕切るように命じられた。このアプローチはうまくいっており、今日まで、最初の設立以来、定期的に委員会を拡大しながら、その構造をほぼ維持している。iLCTプログラムは現在9年目を迎え、PDの神経衰弱を修正する可能性のある多くの異なる個別の生物学的メカニズムを標的とする薬剤を探索する臨床試験を開始した。このレビューでは、優先順位付けのプロセスについて簡単に説明し、現在進行中のiLCTプロジェクトの例をいくつか紹介する。
表1 国際共同治験委員会(International Linked Clinical Trials Committee)
- 委員長 Patrik Brundin教授、Van Andel研究所、米国
- Andrew Lees教授(英国、ユニバーシティ・カレッジ・ロンドン)
- ジョンズ・ホプキンス大学(米国) Ted Dawson教授
- ハーバード大学 マイケル・シュワルツチャイルド教授(米国)
- キャロライン・タナー教授(カリフォルニア大学、米国)
- ロチェスター大学 カール・キーブルツ教授(米国)
- ケンブリッジ大学 ロジャー・バーカー教授(英国)
- バンダービルト大学 ジェフ・コン教授(米国)
- ハワード・フェデロフ教授(カリフォルニア大学、米国)
- ハーバード大学 デービッド・サイモン教授(米国)
- ピッツバーグ大学 ティム・グリーナミーア教授(米国 ペンシルバニア大学 ジョン・トロヤノフスキ教授(米国)
- トム・フォルティニー教授(ユニバーシティ・カレッジ・ロンドン、英国)
- Flint Beal教授(米国・ワイルコーネル医科大学)
- マーク・マットソン教授(米国・NIH)
- デービッド・サルザー教授(コロンビア大学、米国)
- ディミトリ・クレインク教授(ノースウェスタン大学、米国)
- マーク・クックソン教授(米国・NIH)
- マイケル・J・フォックス財団、ブライアン・フィスク博士(米国)
- カミーユ・キャロル博士(プリマス大学、英国)
- David Devos教授(フランス・リール大学)
iLCTのプロセス
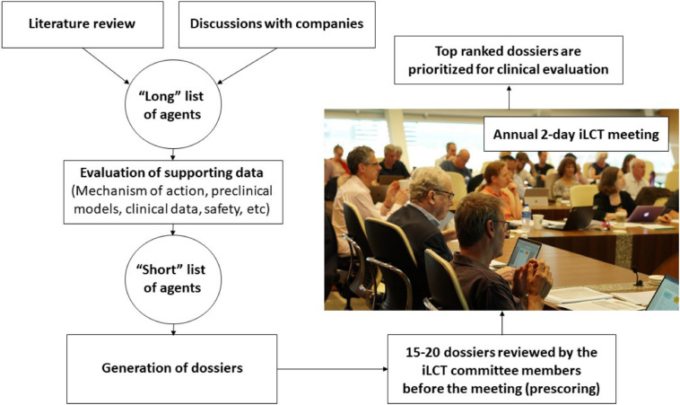
CPTの研究チームとiLCT委員会のメンバーは、現在進行中のPD研究を継続的に調査し、前臨床のPDモデルでの実験や、時には疫学研究からの情報に基づいて、疾患修飾作用を持つ可能性を示唆する分子の情報を収集する(図1)。9月に開催されるiLCTの年次総会に先立って、それぞれの薬剤について、潜在的な長所と短所を説明した書類が作成される。理想的なのは、その薬剤が過去にヒトで試験され、明確な安全性の説明、薬物動態、薬力学のデータがすでに得られていることである。また、免疫系や腸などの末梢に作用機序があると提案されている場合を除き、許容可能なバイオアベイラビリティと中枢神経系への浸透性が証明されている必要がある(もちろん、PDの症状のほとんどは中枢神経系の病理学的変化に関連しているが)。PDのモデル(できれば複数のモデルで、複数の研究室から得られたもの)での有望な結果に加えて、薬剤への曝露(薬剤の本来の治療目的で患者を治療する場合)とPDの発症率の低下とを関連付ける可能性のある疫学データがあれば、裏付けとなる証拠とみなされる。
図1 iLCT 科学委員会の会議で使用されるプロセスのフローチャート
各書類は別々のセクションに分かれている(図2)。最初のセクションでは、その薬剤に必要な背景情報(ブランド名、薬効分類、生物学的標的など)をまとめた表を提供する。
次に、3〜4段落の導入部があり、パーキンソン病患者を対象としたこの分子の臨床試験を正当化するための仮説と主要な論拠を概説している。さらに、書類の作成に誰が関わったのか、どのような臨床試験やパーキンソン病患者のサブポピュレーションが考えられるのかについて、委員会のメンバーに説明する文章がある。このセクションの後には、主な前臨床試験の証拠と、候補薬を検討すべき理由を裏付ける臨床的根拠が記載されている。科学的背景」では、議論されている生物学的経路の概要と、それがPDとどのように関連しているかを読者に説明している。介入の概要」では、薬剤の性質(分子量、作用機序)を掘り下げ、その開発の歴史を説明している。前臨床データ」と「臨床開発」では、その薬剤(データが限られている場合は関連分子)を用いた実験や臨床試験の概要を示している。要約」では、なぜその薬剤がPDの臨床試験に値するのかを簡潔に説明し、PDの特定のタイプ(例:遺伝子)症状(例:認知機能障害)ステージ(初期または後期)に焦点を当てて試験を行うべきかどうかについての記述を含むことができる。
図2 各エージェントの iLCT 用紙のレイアウト

書類は年次総会の 2~3 週間前に iLCT 委員会に電子的に送付され、委員会は各書類の予備的なスコアを提供することになっている。このスコアをもとに、20~25件の書類をトリアージし、年次総会で委員会メンバーの間で公開討論される15件の書類に絞られる。iLCTミーティングは、米国ミシガン州グランドラピッズのVan Andel Instituteまたは英国ウィンザーのCumberland Lodgeで2日間にわたって開催される。ヴァン・アンデル・インスティテュートは 2012年にCPTと提携し、iLCTのプロセスをコーディネートしている。各年次総会では、トリアージプロセスから選出された最終的な15件の書類が、指定された2名の委員によって個別に発表された後、委員会全体で議論され、(トリアージ段階とは)異なるスコアリングシステムを用いて他の治療候補者と一緒にランク付けされる。平均点を算出し、上位3~5剤を優先的にパーキンソン病患者を対象とした第2相試験の可能性を検討することになる。
iLCT委員会の書類リストおよび審議内容は公開されない。これは主に安全上の理由によるもので、薬剤の中には誤った使い方をすると有害な影響を及ぼすものもあるからである。さらに、会議で議論される情報の中には、機密性が高く(未発表のデータ)一般には公開されないものもある。iLCT会議は非公開の会議であるが、重要な点として、常に参加者を受け入れる意識がある。そのために、主要なステークホルダーの多くの代表者を会議に招待している(PD研究の主要な慈善団体からNIHやNINDSのような政府組織まで)。さらに、PD研究支援者コミュニティの患者会員も招待され、各書類に対する意見を積極的に求めている。会議に出席したすべての人が、発表された各書類や試薬について意見やコメントを述べることができるが、スコアを出すのはiLCT委員会のメンバーだけである。
医薬品の優先順位が決定すると、キュアパーキンソンズ・トラスト、ヴァンアンデル研究所、およびパートナー団体は、その治療薬の臨床試験を開始することが義務付けられる。このプロセスにより、7つの試験が完了し、15の分子が16の進行中の試験(そのうち1つは第3相試験)でテストされている。以下のセクションでは、iLCT委員会が優先的に取り組んできた医薬品の例を紹介する。具体的には、その薬剤の歴史、委員会による優先順位付けの裏付けとなる証拠、PDに対する臨床開発の現状について説明する。
GLP-1受容体アゴニスト
2012年にiLCT委員会が最初に優先順位をつけた薬剤は、長時間作用型のグルカゴン様ペプチド-1(GLP-1)受容体作動薬であるエキセナチド(Bydureon; Brundin er al 2013)であった。GLP-1受容体作動薬は、グルコースレベルに依存したインスリンの放出とβ島細胞の増殖を促進し、同時にβ島細胞のアポトーシスを減少させる(Buse er al)。 インスリン分泌促進作用に加えて、GLP-1受容体アゴニストは、神経毒性およびシヌクレイノパシーPDモデルの両方において有益な神経保護特性を示す(Harkavyi et al 2008,Li et al 2009,Liu et al 2015,Chen et al 2018,Yun et al 2019,Zhang et al 2019)。GLP-1受容体は中枢神経系全体に存在しており、エキセナチドは脳にアクセスすることができる(Kastin and Akerstrom, 2003)。
パーキンソン病患者を対象としたエキセナチドの無作為化単盲検第2相試験が 2010年にUniversity College London, Institute of Neurologyで開始された。12カ月間の治療において、exenatideは中等度のパーキンソン病患者において安全かつ良好な忍容性を示すことがわかった。今回の非盲検試験では、本剤の投与により、PD症状(MDS-UPDRSに基づく)が平均2.7ポイント改善した。この改善は、従来のPD治療のみを受けていた対照群での2.2ポイントの減少と比較された(Aviles-Olmos et al 2013)。しかし、さらに注目すべきは、この最初の試験の参加者の一部を対象とした追跡調査で、観察された有益な効果がエキセナチド治療終了後少なくとも12カ月間は持続することが示唆されたことである(Aviles-Olmos et al 2015)。
iLCT委員会による優先順位決定後、パーキンソン病患者を対象としたエキセナチドの第2相試験が開始された。この試験は、60名のパーキンソン病患者を対象とした無作為化二重盲検プラセボ対照試験として構成された。48週間の治療後、エキセナチド治療群は、プラセボ治療の対照群と比較して、彼らのMDS-UPDRS III運動機能の進行を統計的に有意に減少させた(Athauda er al)。 そうすることで、この治療法は、この試験の事前に定義された主要な結果を満たした。追加の事後解析では、エキセナチドに対する最良の反応者の臨床的特徴について仮説を生み出す洞察が得られ、発症時の年齢が若く、試験時の罹患期間が10年未満である傾向が示唆された(Athauda er al 2019b)。2回目のポストホック解析では、標的の関与を示す方法として神経細胞由来のエクソソームの使用を検討し、GLP-1受容体の刺激の増加と一致する脳のインスリン、Akt、およびmTORシグナル伝達経路の変化を明らかにした(Athauda er al 2019a)。
これらの結果はPDコミュニティ内で興奮を呼び、現在、第3相臨床試験が開始されている(ClinicalTrials.gov, n.d.g)。現在、合計200人のパーキンソン病患者が募集され、無作為に割り振られて、エクセナチドまたはプラセボのいずれかを週1回投与する二重盲検法で治療を受け、上記の過去の研究よりもはるかに長い96週間の追跡調査が行われている。結果は2024年に出る予定である。この第3相試験に加えて、他の2つのGLP-1受容体作動薬(それぞれII型糖尿病の治療薬として既に承認されている)も、特定のパーキンソン病患者サブグループを対象に、iLCTプログラムの直接的な成果として臨床試験が行われている。リラグルチドの第2相試験は現在、カリフォルニア州で実施されており(ClinicalTrials.gov, n.d.l)60名のインスリン抵抗性のパーキンソン病患者が参加している。また、フランスでは、158名の早期パーキンソン病患者を対象としたLixisenatideの全国規模の第2相試験が実施されている(ClinicalTrials.gov, n.d. o)。これらの試験結果は 2021年から22年にかけて入手できる予定である。
iLCTプログラムのような、大規模で強固な医薬品再利用プログラムの心強い副産物として、幅広い研究コミュニティに刺激を与えることができる。この現象は、現在PDのために臨床開発されている他のGLP-1受容体アゴニストの開発でも見られた。
例えば、バイオテクノロジー企業のNeuraly社は現在、NLY01と呼ばれる新規のペグ化長時間作用型GLP-1受容体作動薬をPDの第2相試験で試験している(ClinicalTrials.gov, n.d.a)。他の企業も、GLP-1受容体作動薬をPDを対象とした第2相試験で評価しており、韓国のPeptron社のPT320(ClinicalTrials.gov, n.d.m)や、Novo Nordisk社の長時間作用型GLP-1受容体作動薬Semaglutide(ClinicalTrials.gov, n.d.h)などがある。エキセナチドのiLCT臨床試験の結果、GLP-1受容体作動薬は、新規かつ重要なクラスのPD治療薬となり、今後数年間で、その真の可能性と、特定のサブグループのパーキンソン病患者において長期的な疾患修飾に特に適しているかどうかについて、より多くのことがわかるようになるであろう。
アンブロキソール
2009,去痰剤である塩酸アンブロキソール(以下、アンブロキソール)は、FDA承認薬のスクリーニング試験において、リソソーム酵素であるβ-グルコセレブロシダーゼ(以下、GCase)のシャペロンとして同定された(Maegawa et al 2009)。アンブロキソールは、欧州では粘液分泌過多を伴う呼吸器疾患の治療薬として広く使用されているが、今回の新たな知見は、PDへの再利用の可能性を示唆するものであった。GCaseをコードするGBA1遺伝子の変異は、PDに関連する最も一般的な遺伝的危険因子の一つである(Sidransky er al 2009)。機能的には、GCaseはリソソーム酵素であるが、変異型のGCaseは小胞体に捕捉され、プロテアソーム分解される(Maor er al)。 これが、特定のGBA1変異を伴う病態(PDやゴーシェ病など)でリソソーム機能障害が生じると考えられているメカニズムである。GBA1関連PDでは、キャリアーは特発性PDと同様の表現型を示するが、一般的に症状の発現が早く、認知機能障害のリスクも高くなる(Beavan and Schapira, 2013)。
GCaseシャペロン機能の発見後、アンブロキソールは、トランスジェニックPDマウスモデル、GBA関連パーキンソン病患者の線維芽細胞、およびヒト以外の霊長類の脳において、GCaseの中枢神経系レベルを上昇させることが示された(McNeill et al 2014,Migdalska-Richards et al 2016,2017)。また、アンブロキソールは、変異型GCaseの小胞体からリソソームへの移行を改善し、GBA1変異を有する細胞のGCase活性を高める(Maor er al)。 さらに、ヒトα-シヌクレインを過剰発現させたマウスにおいて、アンブロキソールの投与は、脳内のα-シヌクレインおよびリン酸化α-シヌクレインの両方のレベルを低下させることがわかった(Migdalska-Richards et al 2016)。
こうした前臨床試験の良好な結果に基づき 2014,iLCT委員会はアンブロキソールをPDの臨床評価に優先的に採用し、「AiM-PD」(ClinicalTrials.gov, n.d.d)試験が開始された。このフェーズIIa試験では、18名のパーキンソン病患者を対象に、アンブロキソールの用量を増やしながら(1日あたり1260mgまで)6カ月間投与した。AiM-PD試験の結果は最近発表され(Mullin er al 2020)アンブロキソールが6カ月間の投与でPDコホートにおいて安全かつ良好な忍容性を示し、脳脊髄液サンプル中のGCaseタンパク質レベルを約35%有意に上昇させ、標的への関与を示す証拠となった。臨床評価では一定の効果が認められたが、本試験はオープンラベルであり、投与期間も6ヵ月と短かったため、結果の解釈には注意が必要である。現在、PDにおけるアンブロキソールの有効性を評価するために、より大規模なフェーズIII試験が計画されている。
iLCT試験の開始後、アンブロキソールの追加臨床試験が開始された。ロンドン(カナダ)で行われている第2相試験では、70人のPD認知症患者を対象にアンブロキソールを検討している(ClinicalTrials.gov, n.d.c; Silveira er al 2019)。さらに、今年はノルウェーで「Ambroxol in New and Early Dementia with Lewy Bodies (ANeED)」試験が開始される予定である(Rongve er al)。 この試験は、レビー小体型認知症の前駆症状および軽度認知症におけるアンブロキソールの第IIa相多施設共同試験となる。また、Ambroxolは、60名のゴーシェ病患者を対象としたフェーズII試験において、12カ月間の評価が行われている(ClinicalTrials.gov, n.d. e)。
ウルソデオキシコール酸(Ursodeoxycholic Acid)
Ursodeoxycholic acid(UDCA)は、肝臓で合成される二次胆汁酸の一種で、医学的にはウルソジオールという名称で胆石症や原発性胆汁性胆管炎の治療に用いられている。2013年に行われた薬剤スクリーニング実験では、パーキン(PARK2)患者由来の線維芽細胞におけるミトコンドリア機能障害に対する救済効果を2000種類の分子で評価した結果、ミトコンドリアの膜電位を改善し、ATPレベルを正常化する能力を持つUDCAとその関連分子が注目された(Mortiboys er al)。 また、LRRK2 (G2019S) 変異に伴うミトコンドリア機能障害に対して、変異PDキャリアーの線維芽細胞でも、トランスジェニックのショウジョウバエでも、有益な効果があることが報告された(Mortiboys et al 2013,2015)。また、PDの追加モデルでは、UDCAの神経保護特性が明らかにされている(Amaral et al 2009,Chun and Low 2012,Abdelkader et al 2016,Carling et al 2020)。最近の研究では、パーキンソン病患者の血漿中に非共役胆汁酸が増加していることが示唆され、胆汁酸代謝の摂動が基礎的な疾患プロセスの一部であることが暫定的に示唆されている(Yakine-Diop er al)。
2015,iLCT委員会はUDCAを最優先事項とし、The University of Sheffieldの研究者によって臨床試験が開始された(Payne er al 2020)。UDCA in Parkinson’s study」(UP試験)は 2019年初頭に開始された無作為化二重盲検プラセボ対照試験である。この試験では、早期PD(診断から3年未満)の患者を対象に、48週間のUDCAの連日投与(30mg/kg)を行う。この試験の結果は2021年に期待されている。
UP試験は、PDにおけるUDCAを検討している唯一の臨床試験ではない。最近、5人のパーキンソン病患者を対象とした経口UDCAの小規模な非盲検前向き多段階投与試験が終了した(Sathe er al 2020)。この試験では、この治療法はパーキンソン病患者にとって安全で忍容性が高く、ATPの緩やかな増加とATPase活性の低下に関連していることがわかった(UP試験でも検討されているMRSイメージングに基づく)。
シンバスタチン
スタチンは、HMG-CoA還元酵素(コレステロール生合成の律速酵素)の阻害剤であるが、神経保護作用も示しており、特に中枢神経系に浸透しているスタチンであるシンバスタチンが注目されている(Tong et al 2018,Yan et al 2018,Mattii et al 2019,Simchovitz et al 2019,Hanan et al 2020,CarrollとWyse 2017年にレビュー)。また、最近では、シンバスタチン治療が進行性核上性麻痺の発症リスクを低減し、症状の発現を遅らせる可能性が示唆されている(Bayram et al 2020)。シンバスタチンは 2012年に開催された第1回iLCT委員会で優先的に使用され、PD-STATと呼ばれる英国での大規模な全国規模の第2相試験で臨床試験が行われた。この試験では、中等度のパーキンソン病患者230人を募集し、シンバスタチンまたはプラセボのいずれかを24カ月間毎日投与した(Carroll er al 2019)。この試験の予備的な結果は2020年9月に発表され、シンバスタチンはPDにおいて安全であるが、その経過を修正しないことが示された。
鉄キレート剤
α-シヌクレインの凝集に加えて、PDは特定の脳領域での鉄の蓄積とも関連している(Mochizuki er al)。 このような鉄の上昇は、αシヌクレインの凝集を加速させるだけでなく(Ostrerova-Golts et al 2000年)酸化ストレスや神経変性を直接引き起こす可能性がある(Deas et al 2016)。これらの関連性を考慮して、鉄キレートはPDの治療オプションとして検討されており、前臨床データでは支持されている(Finkelstein et al 2016,Carboni et al 2017,Das et al 2017)。鉄キレート剤のデフェリプロンは 2012年のiLCT会議で優先的に使用されたもう一つの薬剤である。現在、PDを対象とした2つの大規模な第2相試験が行われている(ClinicalTrials.gov, n.d.f, n.d.n)。さらに 2019年のiLCT委員会では、2つ目の鉄キレート剤が最近、優先的に開発された。その化合物はATH434と呼ばれ、Alterity Therapeutics社(高田製薬との共同開発)が開発している。ATH434の前臨床データでは、複数のPDモデルにおいて運動能力を改善することが示唆されている(Finkelstein et al 2017)。さらに、健康なヒトボランティアを対象とした第1相の安全性、忍容性、薬物動態データ(Alterity Therapeutics, n.d.; ANZCTR, n.d.)から、本剤の安全性と忍容性が高いことが裏付けられている。CPTとiLCTは現在、この薬剤をパーキンソン病患者を対象とした臨床試験に導入する方法を検討している。
その他の検討事項
上述した分子は、iLCT委員会によって優先順位が付けられ、現在すでにPDへの再利用のための臨床評価が行われている薬剤の一部である。しかし、このプロセスには課題がないわけではない。以下では、薬剤再利用の際に起こりうる障害について説明する。
ターゲットが正しくても薬剤が間違っている?
しかし、薬剤の特異性、最適な投与量、中枢神経系への浸透性(PDの場合)などの詳細は、薬剤再利用の取り組みに影響を与える。その一例として、PDに対する非受容体チロシンキナーゼであるAbelson(c-Abl)の阻害が挙げられる。cAblは、幅広い生理機能を持つユビキタスなキナーゼである(Hantschel and Superti-Furga, 2004)。DNAの損傷や細胞のストレスによって活性化される。前臨床データでは、PDのモデルにおいてcAblキナーゼが活性化されるだけでなく、cAbl阻害剤が実験室で神経変性とそれに伴う運動の問題を救済するのに有効であることが示された(Hebron et al 2013,Imam et al 2013,Karuppagounder et al 2014,Mahul-Mellier et al 2014,Lee et al 2018)。このような前臨床の知見に基づき、iLCT委員会は2013年にcAbl阻害剤であるニロチニブを優先的に使用した。しかし、試験が開始される前に、7人の進行したPD認知症患者を対象にニロチニブを評価した小規模な非盲検パイロット試験の結果が 2016年の神経科学学会で発表された。この結果は、潜在的なベネフィットを示唆するもので、後に発表された(Pagan et al 2016)。これらの知見は、メディアや患者の間でも大きな興奮を呼んだ。最初の非盲検試験の結果が世界中で大々的に報道されたことと、多くのパーキンソン病患者が非盲検で服用し始めていた(非常に高価な)薬剤が入手可能になったことから、PDにおけるニロチニブを評価するための大規模な第2相試験、PD-ニロチニブ試験(ClinicalTrials.gov, n.d.i)とNilo-PD(ClinicalTrials.gov, n.d.j)が実施された。これらの試験結果は現在報告されており(Pagan et al 2020; Simuni et al 2020)本剤はPDの進行に影響を及ぼさなかっただけでなく、実際に脳に到達したのはごく限られた量であったことが示唆されている(CSF/血清比は0.2~0.3%)。 cAblはPDの重要な標的であると考えられるが、ニロチニブはPDにおけるこの経路を評価するための最適な薬剤ではなかったのではないかと論じられる。幸いなことに、現在、より効率的に脳にアクセスするcAbl阻害剤が臨床試験されている(例えば、Sun/SPARC Pharma Advanced Research CompanyのcAbl阻害剤K-0706(ClinicalTrials.gov, n.d.k)やInhibikase TherapeuticsのcAbl阻害剤IKT-148009(ClinicalTrials.gov, n.d.b)など)。
投与方法と製剤化
リパーパスのもう一つの課題は、投与量の決定であり、本来の疾患の治療に用いる場合とは大きく異なる可能性がある。前臨床モデルや非ヒト霊長類を用いた試験は、このプロセスを支援するが、ヒトに対して有効な用量を確立することは、迅速な翻訳を妨げる可能性がある。同様に、新しい適応症では、再利用された薬剤の新しい製剤(または投与方法)が必要になる場合がある。これは、アンブロキソールの臨床試験プログラムで経験した。前述の第2相試験では、参加者は、現在の治療法である対症療法に加えて、1日21錠の錠剤を自己投与する必要があった。重い治療の要求は、特に長期の試験ではコンプライアンスに影響を与える可能性がある。このようなケースでは、さらなる臨床的進歩を効果的に遂げるために、再処方が必要になるかもしれない。
知的財産
特許の失効は、再利用プログラムにとって恵みであると同時に呪いでもある。知的財産(IP)がない場合、再利用の臨床試験を開始することは、より困難な事業となる。臨床グレードの薬剤やプラセボを製造し、必要に応じてカプセル化すれば、臨床試験に多額の追加コストがかかる。しかし、特定の治療法に関する特許にまだ寿命がある場合、知的財産権の保有者が関心を寄せる理由になることがよくある。その結果、新しい適応症のための臨床試験を実施するための資金援助や、少なくとも薬剤とプラセボの入手が可能になる可能性がある。知的財産権の保有者にとっての関心は、試験を実施することであり、これにより、その薬剤の将来の誘導体への投資を正当化するために必要な概念実証が得られる可能性がある。このような経路探索試験は、新規経路のバイオマーカーを評価・検証する機会でもあり、疾患の治療に最も適した要件にさらにマッチするように設計された次世代の分子の試験に使用することができる。
リパーパス≠古い薬剤
薬剤の再利用は、臨床的に承認されている薬剤だけに限定して考えるべきではない。新しい薬剤が次々と臨床試験に導入されており、関心のある疾患領域に「再利用」できる可能性のある新しい治療法が次々と生み出されている。IPホルダーは、経済的な理由から非常に特定の適応症に焦点を当てているかもしれないが、iLCTのような薬剤再利用プログラムは、他の適応症におけるこれらの分子への関心を喚起するのに役立つ。バイオテック企業は、高価な臨床試験を実施するための株主のリソースが限られているかもしれないが、第三者(研究慈善団体など)が試験を実施するための資金を整理することができれば、追加の医療分野を検討するのに十分な臨床グレードの薬剤(およびプラセボ)を持っていることがよくある。
患者からの意見の重要性
iLCT委員会の主な任務は、適切な薬剤の選択である。審議の重要な部分は安全性に集中しており、患者の福利厚生についてもかなり考慮されている。iLCTの会議では毎回、PDコミュニティの代表として患者支援者が招待され、議論に対する彼らの意見が求められ、大いに評価される。検討されるすべての薬剤について、特定の治療法が対象となるコホートの潜在的な治療法として適切であるかどうかを特に考慮しなければならない-移動の実用性や患者の主な年齢層を考慮して。薬剤の処方や投与回数などの要素が議論されることもある。患者支援者が提供する生活体験からは独自の洞察が得られ、これが、委員会で検討された薬剤のうち、最終的に臨床試験に入るものに影響を与えることがある。
結論
薬剤の再利用は、これまでPDの治療に有用な対症療法を提供してきたが、このアプローチがPDコミュニティに疾患修飾性の治療法を提供する待望の手段となることを我々は期待している。iLCTは9年前から実施されているが、試験される薬剤の中には、対象となる個々の生物学的標的に対して必ずしも理想的な薬剤ではないものもあるが、薬剤再利用のアプローチは、特定の生物学的経路やプロセスの疾患関連性を臨床的に評価するためのより迅速な方法である。また、GLP-1アゴニストの例に見られるように、このような臨床試験を開始することで、より適切な分子を設計・開発するための刺激にもなる。このような活動により、従来の医薬品開発のアプローチよりも早く、疾患を改善する新しい治療法がPDコミュニティにもたらされることを期待している。
著者の貢献
掲載されているすべての著者は、本研究に実質的、直接的、知的に貢献し、出版を承認した。
利害の衝突
PBは、Axial Biotherapeutics、Calico Life Sciences、CuraSen、Fujifilm Cellular Dynamics, Inc.、Idorsia Pharmaceuticals Ltd.、IOS In review Press Partners、LifeSci Capital, LLC、Lundbeck A/S、Living Cell Technologies Ltd.からコンサルタントとして商業支援を受けている。Lundbeck A/SおよびRocheから助成金/研究の商業支援を受けている。また、AcouSort ABおよびAxial Biotherapeuticsに出資しており、NILO-PD試験の運営委員を務めている。SSとRWは、金銭的またはその他の利益相反を表明しておらず、PD助成金を提供する国際的な慈善団体に雇用されている。
