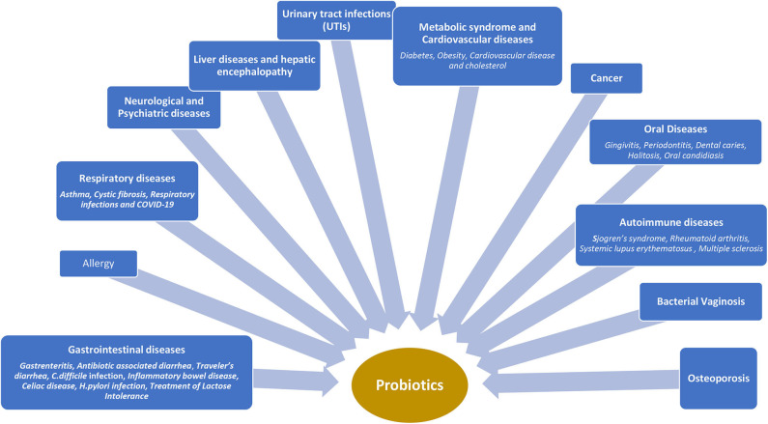
Contents
Probiotics in Medicine: A Long Debate
www.ncbi.nlm.nih.gov/pmc/articles/PMC7544950/
要旨
最後の年の間にプロバイオティクスは、複数の疾患の予防と治療における使用のための臨床医の注目を集めた。プロバイオティクスの主な作用機序は、強化された粘膜バリア機能、病原体との直接拮抗、腸管上皮における細菌の付着と侵入能力の阻害、免疫系のブーストアップ、中枢神経系の調節などが含まれている。
腸内細菌叢と肝臓との間には、いわゆる「微生物-腸-肝臓軸」と呼ばれる相互のコミュニケーションが存在すること、また、腸内細菌叢と中枢神経系との間には「微生物-腸-脳軸」と呼ばれる相互のコミュニケーションが存在することが認められている。
また、最近では、細菌・ウイルス感染症における「腸-肺軸」が、細菌・ウイルス感染症では、肺炎に対する宿主防御の役割を持つ肺胞マクロファージの活動を腸内細菌叢が増幅させることから、かなり議論されている。
ヒトの健康維持には、正常な腸内細菌叢の重要性が認識されている。腸内バランスが乱れると、感染症、自己免疫疾患、アレルギーなどの疾患状態が発生する可能性がある。プロバイオティクスは、正常な腸内細菌叢のバランスを維持し、免疫システムを改善することで、このような病態を予防し、さらには症状を軽減するアジュバント療法として有望なアプローチであると考えられる。
本レビューでは、プロバイオティクスが投与されることができるすべての異なる疾患をグローバルに記載している。現在までに、胃腸障害、抗生物質による下痢、アレルギー、呼吸器感染症の予防において、プロバイオティクスの臨床的使用を支持するより強力なデータが提供されている。
ここでは、呼吸器感染症症状の軽減におけるプロバイオティクスの役割について議論し、パンデミックCOVID-19の治療アプローチの補助薬としてプロバイオティクスを使用する可能性に焦点を当てている。しかしながら,プロバイオティクスの治療効果を評価するためには,大規模なサンプルを用いた臨床研究が必要であることは科学者の間で認められており,臨床での有効性と安全性についての強いエビデンスが得られている。
キーワード
プロバイオティクス、薬、腸、COVID-19,肺、アレルギー、乳酸菌、ビフィズス菌
プロバイオティクスは生きている非病原性微生物であり、十分な量(少なくとも10^6個の生存可能なCFU/g)を与えられた場合、腸内の微生物バランスを改善し、代謝に参加することで宿主に有益であるべきである(1)。
さらに、プロバイオティクスは、そのような特定の特性を有することが知られている:酸pHへの耐性、胆汁耐性、膵液への耐性、腸管上皮細胞における接着および浸潤能力(2)。上記の特性は、消化管内での生存と腸内バランスの改善を可能にする(2)。
過去数年の間に、プロバイオティクス微生物の使用は、有益な方法でマイクロバイオームを調整するために適用されており、このように人間や動物の健康を脅かす感染症との戦いに適用されている(3)。プロバイオティクスの使用は、感染症に対する抗生物質の過剰使用や誤用による抗菌薬耐性の低下を可能にする抗生物質の代替となることもある(4, 5)。抗生物質耐性の蔓延は、ヒトの病原体の間で大きな公衆衛生上の問題となっている(4)。さまざまなメカニズムによる抗生物質耐性の進展は、感染症の治療がうまくいかない結果を招く可能性がある。
それにもかかわらず、FDAも、より多くのEFSAは、安全な食品補助食品として分類されているにもかかわらず、健康問題を予防または治療するためのプロバイオティクスの使用を承認していない(6, 7)。どちらの当局も、プロバイオティクスの効果を示すために人間を対象としたかなりの研究が行われていないことと同様に、作用メカニズムの効率的な説明が不足していることが、誤った特性化と健康への主張の原因となっている。
日本の厚生省は別の方針を持っているようである。特定保健用食品表示(特定保健用食品)は、特定のプロバイオティクス製品に与えられるもので、健康表示を認めるものである(8)。
乳酸菌とビフィズス菌は主にプロバイオティクスとして報告されている。これらの細菌の属は、かなりの集団で人間の腸で分離されている。ラクトバチルスは、プロバイオティクスとして最も意味のある種を含んでいる:L. acidophilus、L. rhamnosus、L. bulgaricus、L. reuteri、L. casei、L. johnsonii、L. pantarum。これらの菌株は、胃酸に対して耐酸性があり、腸管細胞への付着性が良好である。
ビフィズス菌は、特徴的な横紋状の形態を有することから、アクチノバクテリウム属に属する。ビフィドバクテリウムのプロバイオティクス種としては、B. animalis、B. bifidum、B. breve、B. infantis、B. lactis、B. longumなどが挙げられる。
Streptococcus thermophilus、Enterococcus faecalis、Enterococcus faecium、Pediococcus、およびいくつかのバチルス、ならびに酵母Saccharomyces boulardiiおよびSaccharomyces cerevisiaeもまた、いくつかのプロバイオティクス特性を示す。
プロバイオティクス微生物は、私たちの腸内細菌叢の一部であるが、他の生態学的環境にも存在している。しかし、プロバイオティクス特性は株に関連しており、さらには組織に依存していることを明らかにしなければならない。したがって、プロバイオティクスの効果は、すべての細菌種にも、すべての人間の組織にも普遍的ではない。
初期の腸の植民地化は、私たちの免疫システムを強化することにより、特定の疾患に対する保護を提供するように思われる(1)。これまで、病原体に対する適切かつ効果的な「バリア効果」を誘導するためには、どの細菌種が必要かはわかっていなかったが、この「バリア効果」は、プロバイオティクスと呼ばれる有益な食品を提供することで強力に支持されるようである(3)。具体的には、このような食生活を通じ、乳酸菌(フィルミキュート属)とビフィズス菌(アクチノバクテリア属)に支配された有益な微生物群が登録されている(9)。
国際プロバイオティクス・プレバイオティクス科学協会(2014)(8)は、代謝副産物、細菌分子成分、死滅した微生物が何らかの有益な効果をもたらす可能性があると宣言している;プロバイオティクスは腸内環境(酸性pH、酵素、胆汁酸塩など)での生存能力が高くなければならず、その活性と有効性は生存能力と関連しているという実在の確信にもかかわらず(10)プロバイオティクスは腸内環境(酸性pH、酵素、胆汁酸塩など)での生存能力が高いことが必要である。現在では、全菌使用よりも安全性が高いと考えられる生物活性を有する可溶性の細菌成分を「ポストバイオティクス」と呼ぶようになっている(11)。
プロバイオティクス菌株の特性については、生化学的プロファイル、腸管細胞への付着性や侵入性など、複数の研究が行われている(12)。さらに、薬物動態学的研究(半減期、腸管透過性、得られた用量の相関性、便中での持続性)が報告されている(13)だけでなく、宿主によるプロバイオティクス株の耐性と細菌叢への入力に関する研究も行われている(14)。すべての上記のテストと研究は、食品医薬品局(FDA)(米国)の頭字語の下でプロバイオティクス与えられた株を特徴づけることを許可している “GRAS”(一般的に安全として認識されている)専門家(6)によって安全と考えられている食品サプリメントを意味する。
経膣分娩や帝王切開による新生児の細菌の植民地化は、免疫システム、食事、環境だけでなく、他の多くの関与する要因(1)に関連して徹底的に研究されている。病院のスタッフ、個人的な習慣、感染症、ストレス、ホルモンの状態、ワクチン接種および老化は、実際に「マイクロバイオーム」と呼ばれる細菌叢の確立のための重要な要因であるようである(1)。
新たな技術的応用が明るみに出ていた。次世代シークエンシング(NGS)法は、16SリボソームRNA遺伝子(r RNA)のシークエンシングやメタゲノムシークエンシングなどがある。間違いなく、技術の発展は科学者に高度な知識を与え、人間の生態系における共生微生物、共生微生物、病原微生物の共同体を深く理解することを可能にした。微生物は、私たちの腸内の複数の代謝プロセスに参加し、重要な栄養素を合成して生産するだけでなく、病原性細菌を撃退することができる。この目的のために、米国の「ヒトマイクロバイオームプロジェクト」(米国国立衛生研究所、NIH、http://commonfund.nih.gov/hmp/)(15)とヨーロッパのmetaHIT共同事業(https://www.gutmicrobiotaforhealth.com/metahit/)(16)は、様々なヒトの部位における細菌集団の構成を詳細に明らかにすることができた。
間違いなく、食事がマイクロバイオータ組成の主役である。食事は、私たちの腸内生態系の消費嗜好に応じて、異なるタイミングで化学物質を導入することで構成されている(17, 18)。一方、宿主の生理、免疫学的状態、代謝能力は、細菌のコロニー化や特定の微生物種の存在に対する反応を調節している(1)。
腸関連リンパ組織(GALT)システムは、侵入から腸壁を保護することができる免疫学的要素によって供給された腸壁に座っている。抗生物質による治療後のGALTの機能不全、不適切な食事やストレスは、腸内細菌叢の異常と腸管透過性の増加につながる(1,19)。GALTの機能不全は、免疫力の低下をもたらし、効率が悪いか、または悪化させる。したがって、感染症だけでなく、アレルギー(22)や自己免疫(炎症性)疾患(23-25)などの免疫介在性疾患(20,21)と同様に、微生物相と宿主の間の平衡の混乱、いわゆるディスビオーシスの後に発生する可能性がある。これらの線に沿って、プロバイオティクスは宿主の免疫系を刺激し、バリア効果を介して微生物腸内バランスを維持するため、これらの問題に有益であるように思われる(1)。
プロバイオティクスは、異なるメカニズム(1, 20)を通じてその効果を発揮するようである(図1)。
図1 プロバイオティクスの作用機序と性質
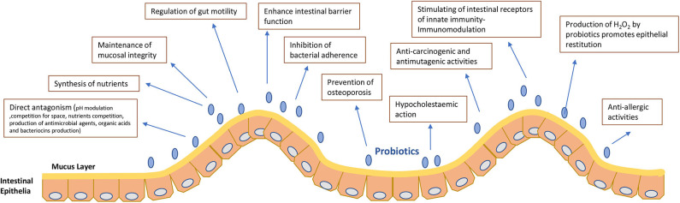
– 腸内腔と壁の空間の競争(空間配置理論)(26,27)。
– 病原性細菌とプロバイオティクスの間の拮抗は、腸内の限られた量に見出された栄養素との競争によって生じる(26)、またはpH調節によって生じる。プロバイオティクスによる上皮の酸性pHの維持(27, 28)。
– 上皮細胞または細菌のエネルギー源として報告されている栄養素の合成(26)。
– 粘膜の完全性の維持。腸管上皮は腸管粘膜層の一部である。この上皮は単層であり、上皮細胞の間の座は膜貫通型のタンパク質によって強固に一体化されている。腸粘膜にはさらに2つの層があり、この上皮の単分子膜を括っているのが、前頭葉扁桃腺と筋状粘膜である。プロバイオティクスは、上皮接合部を強化し、粘膜バリア機能を維持することで、胃粘膜の完全性に細胞保護作用を示す(29)。
–腸管バリア機能を強化する。バリア効果(1)を介して微生物腸内バランスの保全。
– 腸管運動性の調節(30)。腸管の運動性だけでなく、消化管の反射や分泌機能は、腸壁にある腸管神経系(ENS)によって制御されている。それは感覚、運動、インターニューロンとグリア細胞の複雑な神経ネットワークで構成されているので、ENSは第二の脳として考えられている。この静脈では、中枢神経系(中枢神経系)と腸内細菌叢との間の相互通信がある。中枢神経系は、腸の運動性や透過性を変化させることで、あるいは神経内分泌細胞から分泌されるメディエーターを介して、微生物叢に影響を与える(30)。
– 骨粗鬆症の予防。研究は、プロバイオティクスのサプリメントは、両方の骨密度を増加させ、原発性(エストロゲン欠乏症)と二次性骨粗鬆症から保護することができることを示した(31)。
– 低コレステロール血症作用(32)。低コレステロール血症作用は細菌種が関係している。異なるメカニズムが提案されている。胆汁酸の脱コンジュゲーション(30)内因性または外因性コレステロールの同化(33)コレステロールと遊離胆汁酸の微生物細胞への結合(34)または遊離胆汁酸の共沈(34)。
– 抗発がん性、抗変異原性、抗アレルギー活性(35-37)。動物を対象とした研究やヒトを対象としたコホート研究では、乳製品の摂取と大腸がんのリスクとの間に相関関係があることが示されている。いくつかの株の抗がん活性は、発がんの非常に初期の段階でDNA破壊を阻害または減少させるプロバイオティクス株の能力に関連している。
– プロバイオティクスによるH2O2の産生は、上皮の修復を促進する(38)。
– 抗菌剤、有機酸、バクテリオシンの産生(39-41)は、病原体の着床を防ぐ腸管ムチンの産生を刺激する。
– 自然免疫の受容体、プロ炎症性サイトカインの生産を引き起こし、マクロファージによる貪食の開始につながるTLRsを刺激することにより、腸管免疫系(1,42)上のそれらの作用。
具体的には、いくつかのプロバイオティクスは、CD4 +およびCD8 + Tリンパ球の活性化と、病原体を中和するためにlamina propria plasma cellsによるIgAの分泌を誘導する一方で、他のプロバイオティクスは、Th1炎症反応および炎症性サイトカインIL-12,TNF-aの産生を抑制し、Tregリンパ球を刺激する(39)。したがって、これらのプロバイオティクスは免疫の補助剤として、あるいは炎症反応の抑制剤として多面的な役割を持っているように思われる。
抗生物質が感染症の治療に重要な役割を果たしていることは間違いないが、抗生物質の制御不能な使用は、深刻な生態系への影響だけでなく、人間の健康への影響ももたらしている。例えば、マルチ耐性株の増加や人間のフローラの変化、特に腸内細菌叢とその機能の変化などが挙げられる(5)。このような流れの中で、プロバイオティクスは抗生物質の「非侵襲的」な代替療法または共同療法として提案されてきた。すでに述べたように、プロバイオティクスは正常な人間のマイクロバイオータを有益な状態に維持するのに役立つ。
WHOによると、プロバイオティクスは “生きた微生物であり、適切な量を摂取した場合、宿主に健康上の利益をもたらす “とされている。歴史的には、メチニコフがプロバイオティクスの使用を提案した最初の科学者でした。プロバイオティクスは、摂取するための食品サプリメントとして、または単一またはいくつかの系統の組み合わせを含む錠剤や粉末の形で医薬品として使用することができる。プロバイオティクスの効果を発揮するためには、1億から100億個の微生物を摂取しなければならないと一般的に認められている。
消化器系の病気
間違いなく、プロバイオティクスの使用を支持する最も強力な証拠は、胃腸疾患の治療に関連しており、特に急性の下痢に関連している。
胃腸炎
プロバイオティクスは、腸の病理学的にも科学的にも関心が高い。その効果は複数の臨床研究で報告されている(表1)。
表1 消化器疾患におけるプロバイオティクスの使用について
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 胃腸炎 | -乳酸桿菌 | (43) |
| -ラクトバチルスF19およびL.ロイテリ | (44、45) | |
| -L。カゼイ(431株) | (45、46) | |
| -S。サーモフィラス菌とB.ビフィダム( TH-4 + BB12株) | (46、47) | |
| -L。アシドフィルス(NCFM株)+ B.ラクティス(Bi-07株) | (48) | |
| 抗生物質関連下痢および旅行者下痢 | -Lactobacillus GG、E。faecium(SF68株)およびS. boulardii | (49、50) |
| –サッカロマイセス・セレビシエ変異型ブラウディCNCM I-1079 | (51、52) | |
| -Lactobacillus Rosell-52、Bifidobacterium Rosell-175、Lactobacillus Rosell-11 | (51、52) | |
| – L.ロイテリDSM 17938アシドフィルス及びL LB(低い効力) | (53) | |
| クロストリジウム・ディフィシル感染症 | -S。boulardii、ラクトバチルス属。 | (54 – 58) |
| 炎症性腸疾患 | -Escherichia大腸菌Nissle 1917または乳酸菌GG | (59 – 63) |
| -ビフィズス菌属 およびL.アシドフィルス | (59 – 63) | |
| -S。boulardii | (64) | |
| -LactobacillusGGおよびL.johnsonii | (65) | |
| セリアック病 | -ビフィズス菌属 およびL.アシドフィルス、さまざまな | (59 – 63、66) |
| ヘリコバクターピロリ感染症 | -ビフィズス菌BB-12 | (67) |
| -L。アシドフィルスLa-5 | (13) | |
| 乳糖不耐症 | -Lactobacillusdelbrueckii亜種bulgaricusおよびS.thermophilus | (68) |
大腸菌、サルモネラ菌、シゲラ菌、カンピロバクター菌、ロタウイルス、ノロウイルスなどのウイルスは、腸の炎症を引き起こす胃腸炎の最も頻繁な原因の一つである。乳酸菌株は、市販のプロバイオティクスの主役である。ラクトバチルス菌株は、大腸菌やC. difficileという病原体に対して有効であることが示されている(43)。
具体的には、ラクトバチルスF19株とL.ロイテリ株は、免疫状態を高めることで消化管微生物叢に好影響を与えている(44, 45)。同様に、Lactobacillus casei (431strain)は、免疫応答を高め、小児の下痢性疾患の早期回復に貢献している(45, 46)。ストレプトコッカス・サーモフィルスとビフィズス菌(TH-4+ BB12株)は子供のロタウイルス下痢症と疝痛のリスクを低下させる(46, 47)。ラクトバチルス・アシドフィルス(NCFM株)+ビフィドバクテリウム・ラクティス(Bi-07株)は、腹部の浮遊感を軽減することで、消化管生態系に有益な効果をもたらす(48)。
抗生物質に関連した下痢と旅行者の下痢
ラクトバチルスGG、エンテロコッカス・フェシウム(SF68株)サッカロミセス・ブーラルディイは、経口補水療法に加えて、抗生物質関連下痢症の予防、C. difficile大腸炎の治療、胃腸炎の治療に強く推奨されている(49,50)(表1)。サッカロミセス・セレビシエ変種boulardii CNCM I-1079は、記載されているように、抗生物質関連下痢症および旅行者の下痢症の急性症例の治療および予防のために、成功裏に投与されてきた(51,52)。同じ著者(51,52)は、ラクトバチルス・ローゼル-52株、ビフィドバクテリウム・ローゼル-175株、およびラクトバチルス・ローゼル-11株が病原体の侵入を防止し、旅行者の下痢を治療することができることを観察した。
それにもかかわらず、ラクトバチルス・アシドフィルスの市販株が、細菌を含まないマウスの消化管内の腸球菌からバンコマイシン耐性のバンA遺伝子を獲得したことが、試験管内試験および生体内試験での研究で示されている(69)。
同様に、Enterococcus faeciumのSF68株がvan A遺伝子クラスターの受容体である可能性があることに注意すべきである(70)。このように、Enterococcus faeciumのSF68株のプロファイルは、この株を含むプロバイオティクスの安全性についての懸念につながっている(70)。
これらの研究は、グリコペプチド耐性遺伝子の潜在的な受信者である可能性のある腸球菌を含むプロバイオティクス食品を消費する際の潜在的な健康リスクの問題を裏付けている(70)。
EFSAおよび動物飼料に使用される添加物および製品または物質に関するパネル(FEEDAP)(2008)に続いて、微生物阻害濃度(MIC)抗微生物基準は、最も一般的なプロバイオティクスのために指定されている:ラクトバチルス、ストレプトコッカス・サーモフィルス、ペディオコッカス、ラクトコッカス、ロイコノストック、エンテロコッカス、ビフィドバクテリウム、プロピオニバクテリウム、およびバチルス。
さらに多くの研究により、ラクトバチルス菌株の糖ペプチド耐性が腸球菌とは異なることが明らかになり、プロバイオティクスとして使用されるラクトバチルス菌株のバンコマイシン耐性に関して安全性が強調されている(71)。
L. reuteri DSM 17938とL. acidophilus LBは推奨度が低い(53)。コクランの研究(72)では、全年齢の被験者を対象に急性感染性下痢に対するプロバイオティクスの有効性が研究され、下痢の持続時間が1日短縮されたことが示されている。エビデンスが弱く、方法論の限界に疑問があることは間違いない。
Clostridioides difficile(旧Clostridium)感染症 仮性膜性大腸炎
前述したように、プロバイオティクスはクロストリジウム・ディフィシル(Clostridium difficile)大腸炎の治療の一環として投与することができる(表1)。我々はここ数年の間にこの部分に関心を集中している。C. difficileに対するプロバイオティクスの投与の効果は、いくつかの研究で評価されていたが、疑わしい結果となっている(73)。スイスの研究では、プロバイオティクスの作用は、抗生物質後の偽膜性大腸炎を発症する患者の基本的なリスク(5%以上)に依存していることがわかっている(55,74,75)。
C. difficile感染は、抗生物質後の院内下痢、いわゆる偽膜性大腸炎の原因である。この感染は、抗生物質治療の結果としての腸内細菌叢の変化や、旅行などの他の原因によるマイクロバイオームの変化によるものである(76)。
Clostridioides difficileとその胞子は環境中にユビキタスに存在するため、ヒトの腸をコロニー化することができる(74)。腸管粘液は、Clostridium difficileによる結腸のコロニー化に重要な化学戦術因子であると考えられている(55)。最近、Clostridium difficileのパンデミックは、いくつかの国で観察されているこの嫌気性細菌の極めて病原性の高いクローン、すなわち遺伝子型027と078に関連しているようである (77, 78)。この感染は中毒性メガコロンを誘発し、腸管穿孔や敗血症性ショックを引き起こす可能性がある (73)。スイスでは、この病気は報告義務がなく、クローン078のみが分離されている(74,75)。
院内株を対象としたヨーロッパの世界的な調査では、リボタイプ078はヨーロッパで11番目に頻度が高かった。この研究に登録された欧州 14 カ国のうち、ギリシャは、毒性のあるリボタイプ 078 を持つ株の 10%以上を占めてた (54)。また、ギリシャでは、多ウイルス性の遺伝子型027は見つかっていないが、遺伝子型017と126が優勢である(79)。スペインでは、患者では遺伝子型078と126が優勢です(80)。世界的に南ヨーロッパ(ギリシャ、イタリア、ポルトガル、スペイン)では、遺伝子型078と126と017が最も一般的に優勢な遺伝子型である(77)。ジェノタイプ017はブルガリアおよびポーランドでも見られる(79)。
特筆すべきは、クロストリジウム・ディフィシル(Clostridium difficile)感染症の患者のほとんどが長期の抗生物質にさらされており、併存疾患を抱えており、高齢者であることである。この病気のパンデミックは抗生物質、特にフルオロキノロン系、セファロスポリン系、ペニシリン系の乱用と密接に関係しているようである(78)。しかし、ほとんどの症例は院内感染であり(64%)市中感染の症例と比較すると(79)院内感染の方が多いのが現状である。
欧州臨床微生物学・感染学会(ESCMID)(2009)は、クロストリジウム・ディフィシル感染症の治療ガイドラインを発表した(73)が、抗生物質、免疫療法、毒素結合性樹脂・ポリマー、プロバイオティクス、糞便・細菌性腸管移植など、さまざまな治療プロトコルを検討している。ガイドラインは病状に応じて規定されている。推奨される抗生物質は、バンコマイシンとフィダクソマイシンが中心で、以前に比べてメトロニダゾールは少なくなっている。再発例では、経口抗生物質治療と併用して糞便移植を行うことが推奨される。プロバイオティクス(Saccharomyces boulardii、Lactobacillus spp.)も経口抗生物質治療と併用して投与される(54,56-58)。
プロバイオティクス(Saccharomyces boulardii、Lactobacillus spp.)もまた、経口抗生物質治療と組み合わせて投与することができる(55)。
いくつかの研究では、C. difficile下痢症におけるプロバイオティクス予防の有益な効果について中程度のエビデンスが示されているが(56, 57)、コクラン研究の分析では、CDIの治療において抗生物質治療にプロバイオティクスを併用することが示唆されている(58)。しかし、免疫不全患者におけるSaccharomyces boulardiiの使用に関する研究では、浸潤性疾患の発生が示された(81, 82)。予防薬としてのプロバイオティクスの使用に関する別の研究では、非閉塞性腸間膜虚血による死亡率の増加が示された(83)。
したがって、ESCMIDガイドラインではCDIの補助的治療としてプロバイオティクスを推奨していない。
ヨーロッパのガイドラインに同意して、米国感染症学会(IDSA)は米国ヘルスケア疫学協会(SHEA)とともに同様のガイドラインを発表し、エビデンスの欠如からプロバイオティクスは推奨されないとまとめている(84)。
炎症性腸疾患
プロバイオティクスは炎症性腸疾患に効果があるようである(85,86)(表1)。大腸炎の動物モデルを用いた研究では、炎症状態の低下と炎症メディエーターの発現が示されている。
様々なプロバイオティクスの投与研究では、治療効果の点で依然として差がある。Escherichia coli Nissle 1917やLactobacillus GGなどのプロバイオティクスを用いた潰瘍性大腸炎の治療では、再発率に差はなく、単に再発しない間隔が長くなると報告する著者もいるが、Bifidobacterium spp.やL. acidophilusを内科的治療に補充することで臨床反応が改善されることを認める著者もいる(59-63)。また、メサラジンによる内科的治療の補助としてプロバイオティクスを長期投与すると、小児患者で寛解が観察されるようである(87)。S. boulardiiをメサラジンと組み合わせて投与すると、かなりの効果があることが示されている。プロバイオティクスはクローン病の治療にも応用されている(64)。Lactobacillus GGとLactobacillus johnsoniiを投与した場合、再発はほとんど認められなかった(65)。
袋炎は、大腸手術の結果としての袋の裏地の炎症である。この文脈では、いくつかの研究者がプロバイオティクスを使用して69%の被験者に寛解をもたらした活動性パウチ炎の治療に使用している(65, 88)が、他の研究者はパウチ炎の治療におけるプロバイオティクスの有効性を疑っている(66)。
セリアック病
今日まで、グルテンがセリアック病の引き金となることはよく知られている。それにもかかわらず、腸内細菌叢が病気の発症と進行に一定の役割を果たしている可能性が示唆されている(66)。セリアック病患者の腸内細菌叢の異常は、Bacteroides spp.の豊富さとBifidobacterium spp.の減少によって特徴づけられる腸内細菌叢の研究で報告されている(66)。これは、プロバイオティクスがこの状態に有益な効果をもたらす可能性があることを示唆しているかもしれない(表1)。
その他の腸に関連する病理学
ビフィズス菌BB-12の摂取は、ヒトのヘリコバクター・ピロリ感染に影響を与える(67)。同様に、L. acidophilus La-5もヘリコバクター・ピロリに影響を与え、免疫効果を高め、下痢症状を緩和する(13)(表1)。
乳糖不耐症の治療
乳糖不耐症は、乳製品に含まれる乳糖を消化できないことによる。世界人口の60%が罹患していると言われている(89)。しかし、乳糖不耐症は、北欧・アメリカでは5~15%、南米・アジア・アフリカでは50~100%と、国によってかなり差がある。ヨーグルトに含まれるLactobacillus delbrueckii subspecies bulgaricusやS. thermophilusはβ-ガラクトシダーゼという酵素を持っているため、乳糖に対する不耐症を改善することができる(68)(表1)。最近の無作為化二重盲検試験では、乳糖不耐症の臨床症状を緩和するために与えられた発酵乳および未発酵乳の調製物に含まれるプロバイオティクス細菌の効率が示された(89)。
アレルギー
アレルギーは、通常は無害な環境中の物質に対する免疫系の過敏反応の悪化から生じる。これらの物質はアレルゲンと呼ばれ、通常、薬物、食品、草や木の花粉、昆虫、昆虫の咬傷や刺傷、ホコリダニ、ペットのふけ、化学物質、ラテックスなどが含まれる。
免疫系の耐性メカニズムにおけるこの過敏性は、腸内細菌叢によって調節されているようである(90)。腸内細菌叢の異常はアレルギーの発症に関与していると考えられている(91)。プロバイオティクスは、アレルギー性鼻炎、喘息、アトピー性皮膚炎、食物アレルギーなどのアレルギー性疾患の治療に成功している(90)。しかし、その使用についてはまだ論争がある。
2つのメタアナリシスでは、プロバイオティクスの使用によるアトピー性皮膚炎の予防効果の改善が報告されている(92,93)。乳酸菌単独および乳酸菌とビフィズス菌との併用は、一般集団だけでなく産前・産後の高アレルギーリスク集団にも早期に投与した場合、特にアトピー性皮膚炎の発症を予防するようである(93)(表2)。
表2 アレルギーにおけるプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| アトピー性皮膚炎 | –ラクトバチルス | (93) |
| -ラクトバチルス+ビフィズス菌 | (93) | |
| -L。パラカゼイ | (94、95) | |
| -L。サリバリウス(LS01) | (94、95) | |
| -L。発酵槽 | (94、95) | |
| アレルギー性鼻炎 | -L。カゼイ、L。ラムノサス、L。ジョンソニイEM1、L。アシドフィルス、L。ガセリ、L。パラカゼイ | (96 – 99) |
| -B.lactis NCC2818(ネスレ) | (100) | |
| -L。パラカゼイ(LP-33株) | (101) | |
| -Lactobacillus GG(LGG)+ L. gasseri、L。acidophilus+ Bifidobacterium lactis | (102 – 104) | |
| -VSL#3(4つのラクトバチルス+3つのビフィドバクテリウム+1つのストレプトコッカスサーモフィレス) | (102 – 104) | |
| -ラクトバチルス+ビフィズス菌 | (105) | |
| -L。カゼイ | (106) | |
| アトピー性湿疹 | -ビフィズス菌BB-12 | (90、107、108) |
| -B。longum、B。clausii、E。コリニッスル(EcN)1917 | (90、107、108) |
ラクトバチルス・パラカセイ、ラクトバチルス・サリバリウス(LS01株)ラクトバチルス・フェルメンタムも小児の抗アレルギー剤としてアトピー性皮膚炎の治療に使用されている(94,95)。アトピー性皮膚炎などのアレルギー疾患へのプロバイオティクスの使用は有望である(109)。
当初は単一のプロバイオティクス株で治療が成功していた。アレルギー性鼻炎の治療に用いられている乳酸菌の中で最も一般的なものは、Lactobacillus casei、Lactobacillus rhamnosus、Lactobacillus johnsonii EM1,Lactobacillus acidophilus、Lactobacillus gasseri、Lactobacillus paracaseiである(96-99)。
前述のように、ビフィズス菌BB-12はアトピー性湿疹の症状を緩和する。
ビフィドバクテリウム・ロンガム(Bifidobacterium longum)バチルス・クラウジー(Bacillus clausii)およびEscherichia coli Nissle(EcN)1917もまた、医薬として使用されている(107,108)。
ビフィドバクテリウム・ラクティスNCC2818(ネスレ)やラクトバチルス・パラカセイ(LP-33株)を使用することで、アレルギー性鼻炎の症状の重症度が軽減されるようである(100,101)。
最近では、複数のプロバイオティクス株を組み合わせての治療が可能となった。Lactobacillus GG(LGG)+L. gasseri、L. acidophilus+Bifidobacterium lactisの他、4個の乳酸菌+3個のビフィズス菌+1個のStreptococcus thermophilusからなる市販の混合物VSL#3も併用されている(102-104)。
アレルギー性鼻炎に対しては、乳酸菌+ビフィズス菌の組み合わせが最もポピュラーで成功しているようである(105)。
ダニアレルギーの子供にラクトバチルス・カセイを投与したところ、症状の頻度と重症度が低下した(106)。
食物アレルギーの予防または治療におけるプロバイオティクスの役割に関する研究が行われたが、矛盾する結果が得られた(90, 110)。菌株の不均一性、治療期間、投与量の不均一性が、おそらくこの違いの一部を説明しているはずである。
呼吸器疾患
喘息
ここ数年、ほとんどの先進国で喘息や呼吸器疾患の増加が観察されている(111)。
以前に議論したように、腸内細菌叢はアレルギー性疾患の発症に重要な役割を果たしている。
動物の喘息の実験モデルにおいて、正常な腸内細菌叢の変調が登録されている(112)。喘息のリスクがある子供の腸内微生物異常は、特定の細菌属が完全に欠落していることを示した(112)。そのため、これらの「欠損細菌」をマウスモデルに投与すると、気道炎症の低下が認められ、喘息の原因菌としての役割が示唆されている(112)。最近では、Enterococcus faecalis FK-23が喘息の過敏性を抑制し、Th17細胞の発生を抑制することが示唆されている(113)(表3)。
表3 呼吸器疾患におけるプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 喘息 | エンテロコッカスフェカーリスFK-23 | (113) |
| 嚢胞性線維症 | -さまざまな | (114 – 118) |
| 呼吸器感染症(グローバル) | L.ラムノサスGG | (119) |
| L.ロイテリDSM17938 | (120) | |
| L.ロイテリATCC55730 | (121) |
しかし、メタアナリシスと二重盲検ランダム化比較試験では、プロバイオティクス治療からの実質的な利益を認識していなかった(122-124)。
嚢胞性線維症
嚢胞性線維症は、上皮細胞膜上での塩化物イオンとナトリウムイオンの移動を調節するCFTRタンパク質をコードするCF膜貫通コンダクタンスレギュレーター(CFTR)遺伝子の変異によって引き起こされる常染色体劣性疾患である。その結果、全身の厚い粘液の蓄積を伴うイオン輸送の障害が生じ、呼吸不全を引き起こし、他の多くの全身疾患(主に消化器系)と一緒に呼吸不全を引き起こす。さらに、呼吸器管の粘膜クリアランスの低下は、イオン輸送障害と組み合わされて、緑膿菌をはじめとする呼吸器管内の他の病原体の増殖を可能にし、これらの病原体は反復的な治療によってますます耐性を獲得し、結果として反復的な炎症反応を引き起こす(114)。
慢性呼吸器疾患以外にも、嚢胞性線維症は前述のように消化器疾患(膵臓、胆道、腸)と関連しており、慢性炎症や栄養物質の吸収不良を引き起こす。
プロバイオティクスは、嚢胞性線維症(115)を含む特定の気道疾患に有望であるように思われる(表3)。嚢胞性線維症の場合にはバイオシスがあり、頻繁な抗生物質治療はマイクロバイオータのバランスを崩すことができる(116)。この文脈では、プロバイオティクスの使用が、この病気の肺の増悪率を減少させる可能性があるとして研究されている(117, 118)。
呼吸器感染症とCOVID-19
L. rhamnosus GGは、乳児の呼吸器感染症および消化器感染症のリスクを低減する(119)。
ウイルス性呼吸器感染症は、集団の罹患率および死亡率に影響を与える。パターン認識受容体(PRR)は、自然免疫応答の主要なセンサープレーヤーである。多くのパターン認識受容体(RRR)の発現は、炎症の間に肺細胞で悪化する。この静脈では、マクロファージ、単球、好中球は、PAMPs(病原体関連分子パターン)およびDAMPs(危険関連分子パターン)のレベルを増加させることによって応答している(125)。
侵入者の病原体は、特異的な免疫応答をもたらす結果として、PAMPsの特異的な固有のプロファイルを有することが知られている(126)。PAMPsは病原体の生存に必要な分子であり、宿主によって産生されることはない。ウイルスでは、主要なPAMPは核酸または糖タンパク質である。PAMPは、病原ウイルスを排除し、抗原提示細胞や特異的適応免疫を活性化するために、サイトカイン、ケモカイン、その他の共刺激分子の発現を誘導するPRRによって認識されなければならない(127, 128)。病原体認識のための最も研究されているPRRは、膜糖タンパク質であるTLR(Toll Like Receptor)である(129)。
ウイルス感染時の病原体認識と宿主防御のパターンには明らかな多様性があることは間違いない。
一方、PRRはDAMP(Danger-Associated Molecular Patterns)と呼ばれる危険信号を認識し、炎症反応を促進する(130)。その結果、TLRsの刺激は、疾患の発症からの保護に極めて重要である。
Toll様受容体(TLR)の発現に対するプロバイオティクスの調節効果は、いくつかの疾患例で観察された(131)。具体的には、プロバイオティクスはTLR4の発現を最小化することで炎症を阻害または軽減する(132)。この意味で、大規模な無作為化比較試験(PROSPECT Investigators and the Canadian Critical Care Trials Group)が実施され(PROSPECT Investigators and the Canadian Critical Care Trials Group)呼吸器関連肺炎(VAP)を有する集中治療室(ICU)の重症患者にプロバイオティクスを使用することで、この重症患者にプロバイオティクスの有益かつ有益な効果が示された(133)。
コロナウイルスが呼吸器疾患や時には消化器疾患を引き起こすことは長い間知られていたが、SARS-CoV-2は、その伝染性と予想外の死亡率の結果、COVID-19パンデミックのため、最近では私たちの関心を独占している。
コロナウイルスは、ERGIC(ER-ゴルジ中間コンパートメント)の内腔に局在しているため、自然界ではほとんどのエンベロープ型ウイルスとは異なることが認識されている。ERGICは、感染細胞から感染性ウイルスを放出するための分泌経路において、小胞体とゴルジ体の間を仲介している(134)。ここでは、Eタンパク質の大部分が局在しており、感染性ウイルスの集合および出芽に参加している。
感染確立のための宿主でのウイルス複製は、宿主-ウイルスPPI(タンパク質-タンパク質相互作用)を介して起こることが知られている(135,136)。SARS-CoV-1では、Eタンパク質は5つの宿主タンパク質(Bcl-xL、PALS1,シンテニン、ナトリウム・カリウム(Na+/K+)ATPase α-1サブユニット、ストマチン)と結合しているとしか言われていない。(135).
最新の情報によると、コロナウイルスは、細胞内のPDZタンパク質に結合するPBM含有タンパク質をコードしている。これらのタンパク質は、アンカリング受容体タンパク質において重要な役割を維持している(135)。それと並行して、Eタンパク質の相互作用パートナーは、p38マイトジェン活性化プロテインキナーゼ(MAPK)阻害剤として同定されている。p38マイトジェン活性化プロテインキナーゼ(MAPK)の阻害剤がマウスの生存期間を延長することが研究で示されているように、これが重要な治療手段であることは明らかである(137, 138)。
乳酸菌は、HSP27誘導性ポリリン酸(ポリP)画分を含んでいる。プロバイオティクス由来のポリリン酸塩は、インテグリン-p38 MAPK経路を介して上皮バリア機能を強化し、腸の恒常性を維持する能力を有する(139)。
コロナウイルスを標的としたほとんどの治療法は現在のところ効果がないため、コロナウイルスプロテインEのより多くの相互作用パートナーを明らかにすることは、治療アプローチを強化する可能性がある。
L. reuteri DSM 17938は、上気道および胃腸症状に対して有益な効果を示した(120)。
同様に、L. reuteri ATCC 55730は、スウェーデンの労働者の呼吸器および消化器症状を緩和することが示されている(121)。
ここ数年、細菌やウイルス感染症における腸-肺軸がかなり議論されている(140)。腸内細菌叢は肺胞マクロファージ機能を増幅させ(140)、その結果、肺炎時には腸内細菌叢が保護メディエーターとして作用すると考えられている(141)。
ここでは、呼吸器疾患におけるプロバイオティクスの効率化のメカニズムを明らかにすることの重要性を述べ、予防や現場での治療法としてのプロバイオティクスの利用を可能にする可能性を示した。
結論として、我々はまだこの複雑な問題の先端を引っ掻いただけであるとして、ウイルス性および他の呼吸器疾患における治療薬としてのプロバイオティクスの役割を定義するために、より多くの知識が必要である。
神経学的および精神疾患
ここ数年の間に、神経疾患の予防と治療のためのプロバイオティクスの使用に対する関心が高まっている(表4)。最近の研究では、神経疾患や脳疾患の病態形成におけるマイクロバイオータの潜在的な役割が述べられている(150-152)。
表4 神経・精神疾患におけるプロバイオティクスの使用について
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 神経疾患および精神疾患 | – L.ラムノサス | (142 – 144) |
| 自閉症スペクトラム障害(ASD) | –アシドフィルスL. Rosell-11 -Various |
(145 – 147) |
| 自己免疫性重症筋無力症 | いろいろ | (148) |
| 自己免疫性脳脊髄炎 | いろいろ | (149) |
中枢神経系と腸の間には、いわゆる「微生物-腸-脳軸」(150,152)という相互作用があると考えられており、腸内細菌叢と脳の相互作用のモデルとなっている。
肉体的・心理的ストレスは、腸内・膣内マイクロフローラの制御を妨害する可能性がある。腐敗菌Clostridium spの数がストレス下で多く見られる(153, 154)。
ストレスや環境因子などの初期のライフイベントが腸内微生物叢に影響を与える可能性がある(155)。
ラクトバチルス・ラムノサスの摂取は、γ-アミノ酪酸(GABA)受容体の転写を調節し、したがって感情行動を制御したという研究報告がある(154)。腸内微生物叢は、腸管神経を介して脳に信号を伝達するGABAに影響を与える(142)。
正常な腸内細菌叢は、上皮タイトジャンクションを改善して腸の透過性を低下させることで腸のバランスを維持する(150)。そうでなければ、細胞が損傷を受けた場合には、脊髄神経細胞や迷走神経の活性化だけでなく、複数の免疫反応や炎症反応が生じる(156)。その結果、中枢神経系に影響を及ぼす炎症性サイトカインが産生される(156)。
自閉症スペクトラム障害(自閉症スペクトラム障害)は、社会性、感情、コミュニケーション能力に問題のある行動を引き起こす発達障害である。腸内細菌と自閉症との間には関連性があるようである(145,146)。
以上のことを考慮すると、腸内細菌叢が神経・脳の発達と調節、バランスが崩れた場合の一般的・精神的な健康への影響において極めて重要な役割を果たしていることが理解できる。母体栄養はプロバイオティクスを含むため、新生児の腸内細菌叢に重要な役割を果たしている(1)。
研究では、神経疾患の治療におけるプロバイオティクスの潜在的な効果が示されている(143)(表4)。
プロバイオティクスのポジティブな効果は、自己免疫性重症筋無力症(148)、自己免疫性脳脊髄炎(149)の進行や運動行動(144)にも観察されている。さらに、プロバイオティクスは神経保護特性を持ち(157)、認知にも好影響を与えるようである(158)。
反社会的行動、コミュニケーション、集中力の問題の改善は、プロバイオティクス株L. acidophilus Rosell-11を2ヶ月間投与した自閉症スペクトラム障害の子供のコホート研究で観察された(147)。
プロバイオティクスは、上記の神経疾患の治療において研究されてきた。しかし、それらの有効性に関する現在の証拠は乏しい。すでに議論されているように、その効率はひずみ、組織、および用量に依存する。
実施された研究は、選択された母集団の特徴、母集団のサイズ、実施された治療法および処置、および適切な株または株の混合物の点で一様ではない。
プロバイオティクスの副作用のまれなケースが観察されている(159)。また、神経系の未熟さ、精神遅滞および他の重度の神経発達問題は、副作用の潜在的に高いリスクを持つ患者を素因としていることは注目に値する。
間違いなく、プロバイオティクスの作用機序が完全に理解されれば、神経疾患に対するプロバイオティクスの安全性と効率性の問題を評価することができるであろう(140)。
肝臓疾患と肝性脳症
中枢神経系と肝臓の間には、いわゆる “微生物-腸-肝臓軸 “と呼ばれる相互のコミュニケーションがある。これにより、肝受容体(Toll様受容体)と細菌のリポ多糖類との間には相互作用がある。腸管の不均衡が生じて腸管透過性が変化すると、免疫反応や炎症反応が生じ、肝障害を引き起こす可能性がある。また、腸で吸収された栄養素は肝臓に到達する。
肝硬変は、腸内マイクロバイオータ(160)のビフィズス菌種の存在の変化に関連していると思われる。
さらに、腸内細菌叢の変化は、B型慢性肝炎(161)、原発性硬化性胆管炎(160)、肝細胞癌の増殖(161)の患者において観察されている。B型肝炎ウイルス関連肝硬変患者とB型慢性肝炎患者では、腸内細菌叢に多様性が観察された(160,161)。
肝性脳症は腸内細菌叢と密接な関係がある(162)。腸内微生物のアミノ酸に対する代謝活動は、肝臓で不活性化された有害物質(NH3,フェノール類、アミン類、フェノール酸)の産生をもたらす。しかし、肝不全が起こると、これらの物質は不活性化されずに循環に入り、血脳関門を越えて肝性脳症を引き起こし、昏睡状態に陥る。
肝性脳症の治療の主力はラクツロースとラクチトールであり、これらの下剤は血中アンモニア濃度を低下させるため、プレバイオティクスと考えられている。さらに、彼らはまた、大腸のpHを変化させ、消化管通過を改善し、糞便窒素排泄を増加させることによって作用する(163)。
この同じ精神で、プロバイオティクスは肝性脳症の補助的治療法としても提案されている。
乳酸菌、より具体的には乳酸菌およびビフィズス菌が肝性脳症に最も有効な種であるように思われるが、Clostridium butyricum、Escherichia coli Nissle 1917,Streptococcus salivarius、およびSaccharomyces boulardiiも使用されている(164)(表5)。
表5 肝臓病におけるプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 肝硬変 | ビフィズス菌sp。 | (160) |
| 肝性脳症 | -Bifidobacterium sp 。、Lactobacillus sp 。、C。butyricum、E。coliNissle 1917、S。salivarius、S。boulardii | (164) |
| -C。ブチリカム、B。インファンティス | (162、165) |
21の試験のメタアナリシスによると、プラセボ/無治療と比較した場合、プロバイオティクスは肝性脳症の治療に有益であるように思われるが、ラクツロースと比較して優れているとは思われない(165)。
肝性脳症の治療以外にも、プロバイオティクスは有益な効果を持つ再発予防のための予防薬としても研究されている(166)。
腸内細菌叢の変化が肝疾患を誘発していることを踏まえ、肝疾患の治療のためにプロバイオティクスによる腸内細菌叢の調整に関心が高まっていることが報告されている(167)。しかし、この有効性に関する現在のエビデンスは不明である。前述したように、プロバイオティクスの効率は厳密には菌株、組織、用量に依存する。
プロバイオティクスの有効性と安全性に関する知見を得るためには、適切な菌株を用いたプロバイオティクス治療の標準化された手順と、母集団の大きさや特徴の精緻な選択を伴う質の高い無作為化臨床試験を進める必要がある。これらの観点から、プロバイオティクスは、肝性脳症に対するいくつかの意味合いを除いて、ほとんどの肝疾患の治療に推奨することはできない。
泌尿器科疾患
細菌性膣炎とは、数種類の細菌が過剰に増殖し、乳酸菌が減少することで膣内フローラのバランスが崩れることで起こる膣炎のことである。生殖年齢の高い女性ほど膣炎を発症することが多いようである。
歴史的には、1892年のAlbertとDöderleinは、女性の全体的な健康における膣内細菌叢の重要性を述べている(168)。
Lactobacillus spp.および具体的には種L. crispatusは健康な女性の細菌叢で優勢である(169)。知られているように、乳酸菌 spp は病原体による植民地化から膣を保護する乳酸を生産する。しかし、バランスが乱れて、乳酸菌が減少しているか、または欠けているとき、膣症が発生する。
このような流れの中で、科学者たちは、乳酸菌の経口投与または膣内投与によって、膣内細菌叢のこのアンバランスを回復させようとしてきた(170,171)(表6)。
表6 Genito-Urinary tract感染症におけるプロバイオティクスの使用。
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 細菌性膣炎 | -ラクトバチルス属 | (169) |
| -L。crispatus | (169) | |
| -L。アシドフィルス | (170、171) | |
| -L。ラムノサスGR-1 | (170、171) | |
| -L。ファーメンタムRC-14 | (170、171) | |
| ガードネレラバジナリス | -ラクトバチルス属 | (172) |
| -L。アシドフィルス | (172) | |
| 尿路感染症(UTI) | -ラクトバチルスラムノサスGR-1 | (173) |
| -L。ロイテリRC-14 | (173) | |
| -L。代田稔 | (173) | |
| -L。crispatus CTV-05 | (173 – 175) | |
| -L。ラムノサスGG | (173) |
しかし、乳酸菌の作用機序は不明のままである。乳酸の産生が酸性環境を作ることで病原体の定着を阻害すると主張する科学者もいるが(1)、試験管内試験研究では、特定の乳酸菌によるH2O2またはバクテリオシンの産生が、細菌性膣症に関与する病原体から保護することが述べられている(176,177)。このように、膣上皮へのガードネレラ膣炎菌の付着は、ラクトバチルス菌株によって阻害される(172)。また、L. acidophilusのG. vaginalis NCTC 11292に対する静菌効果は、NaOHの添加やH2O2のカタラーゼ変性により培養pHがアルカリ性になると60%低下したという研究結果がある(172)(表6)。
さらに、L. acidophilusまたはLactobacillus rhamnosus GR-1とLactobacillus fermentum RC-14を2ヶ月間延長投与することは、膣炎治療に有益であると思われる(170,171)。
結論として、プロバイオティクスは細菌性膣症の膣内不均衡の予防と治療に有効である。実施された研究は心強いものである。プロバイオティクスが膣炎の予防と治療に有効であるかどうか、またどの菌株が関与すべきかを定義するためには、さらなる研究と臨床研究が必要である。
尿路感染症(UTI)は最も一般的な感染症の一つである。女性の尿道の短さは、女性の尿路感染症の頻度が高いことと関連している。これらの感染症は、合併症を伴わないものと合併症を伴うものに分けられ、膀胱炎、腎盂腎炎、発熱性尿路感染症、前立腺炎、尿路由来菌血症などがある。尿路感染症の多くは、主に糞便細菌叢からの尿路病原体が尿路に侵入した場合、または細菌血症を介して腎臓に播種した場合、または医療介入(尿道カテーテル、泌尿器科手術)を受けた場合に起こる。臨床症状は、無症候性の細菌尿症から尿道炎、膀胱炎、前立腺炎、腎盂腎炎、細菌血症まで様々である。
尿路結石は、多くの入院、罹患率、死亡率、そして最も重要なのは微生物抵抗性の開発に起因する重要な経済的影響と関連している(178-180)。
多剤耐性の開発により、医師は高額な治療費を最小限に抑えるために、よりマイルドな予防治療を求めるようになってきている(181)。
尿路感染症に対するプロバイオティクスの効果については、まだ議論の余地がある(181-183)(表6)。あるチームはプロバイオティクスの投与による利益はないとしているが(182)他の科学者は平均的な罹患期間の短縮と感染率の大幅な低下を観察している(181, 184)。
PubMedで関連記事を検索した拡張レビューでは、尿路の潜在的な病原性細菌に対する予防薬としてのプロバイオティクスの有効性と安全性が示されている(185)。Lactobacillus rhamnosus GR-1とL. reuteri RC-14が最も効果的なプロバイオティクス株であると考えられ、L. casei ShirotaとL. crispatus CTV-05が続いた(185)。L. crispatusのUTIに対する効果は多くの著者によって観察されている(186, 187)。
逆に、L. rhamnosus GGは十分な効果が示されていない(185)。プロバイオティクスの活性と効率は、特定の投与株に密接に関係しているように思われる。したがって、その使用の安全性の問題については、すべての著者が同意している(185)。
メタボリックシンドロームと心血管疾患
糖尿病
腸内マイクロバイオームは糖尿病の発症に役割を果たしているようである。動物を用いた研究では、ラクトバチルスとビフィズス菌のいくつかの種が2型糖尿病の重症度を予防または軽減する可能性があることが示されている(188)(表7)。
表7 メタボリックシンドロームや心血管疾患におけるプロバイオティクスの使用について
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 糖尿病 | -乳酸桿菌 | (188) |
| -ビフィズス菌 | (188) | |
| –さまざまな | (189 – 191) | |
| 肥満 | -さまざまな | (175) |
| 心血管疾患とコレステロール | -乳酸桿菌 | (41、188 – 192) |
| -ビフィズス菌 | (41、188 – 192) | |
| –さまざまな | (41、183、188 – 190、192) |
ヒトを対象とした研究では、代謝変化、酸化ストレス、および炎症を正当化する要因を評価することが試みられてきた(188)。
乳酸菌は抗酸化活性を示す。糖尿病患者は、インスリンに悪影響を及ぼす高レベルのプロ炎症性サイトカイン[TNF-a、IL-6,bキナーゼ阻害剤(IKKb)およびJun N末端キナーゼ(JNK)]を有する恒常的な全身性炎症を特徴とする。乳酸菌は、炎症状態を調節することにより、2 型糖尿病の特定の集団の治療に臨床的にプラスの効果がある。
12の無作為化比較試験のメタ分析では、プロバイオティクスが2型糖尿病における空腹時血漿グルコース(FPG)とグリコシル化ヘモグロビン(HbA1c)を大幅に改善したことが示された(189)。同様に、血糖コントロールの改善で2型糖尿病(2型糖尿病)を開発している人のプロバイオティクスサプリメントの役割は、全体的に有益な効果を示した(190)。
私たちの体は、人間の細胞内の酸化を引き起こすフリーラジカル(活性酸素)の生産を結果として持っている別の物理化学的または病理学的条件にさらされている。そのため、恒常性を維持するために内因性の抗酸化メカニズムを開発した。酸化ストレスは、フリーラジカル(活性酸素)と抗酸化メカニズムの間の不均衡が起こっているときに発生している(193)。糖尿病の場合、脂質過酸化、酵素系の障害だけでなく、グルタチオン代謝の障害が観察される。
糖尿病の病因は、その後、活性酸素種(ROS)の増加レベルが存在するように、強力な酸化ストレスによって特徴付けられる(194)。
生きたプロバイオティクスを含むヨーグルトの摂取は、2型糖尿病患者の抗酸化状態と空腹時血漿グルコース(FPG)レベルを改善するようである(191)。
肥満
ヒトの消化管マイクロバイオータの意義は、肥満の場合にも述べられている。
肥満は、消化管生態系の構造的および機能的変化と関連している。肥満患者の腸内微生物叢は、バクテロイデス属の細菌数の増加によって特徴付けられる。Firmicutes属の細菌の数が少ないことが観察される。
特定の細菌集団の多様性および豊富さは、肥満につながる代謝経路を誘発し得る(173)。
肥満は、肥満者に記録されている(39)炎症メディエーターの高レベルに起因する2型糖尿病や心血管疾患の重要な危険因子である。プロバイオティクスと抗生物質の投与は、農場動物の体重増加を刺激するために使用されている(3, 40)。しかし、著者(174)によってそれらの有効性には論争がある。
ヒトでは、プロバイオティクスの補充は、代謝パラメータの値を減少させるようであり、肥満成人の体重増加の減少につながる(175)(表7)。
乳酸菌は下痢の治療を受けた子供の体重増加と関連している(195)。疑いもなく、肥満におけるプロバイオティクスの役割を推定するためには、より多くの研究が必要である。
心血管疾患とコレステロール
心血管疾患は、欧米では死因の中心となっている。
動物およびヒトを対象とした複数の研究により、コレステロール値と冠動脈性心疾患のリスクとの間に重要な相関関係があることが示されている。食事介入は、心血管疾患の予防のための脂肪(低飽和脂肪食)の低下を示唆している。
乳酸菌を含む発酵乳製品を含む食事の補足は、心血管疾患を緩和する血中コレステロールを下げることにあると思われる(表7)。
このような観点から、ビフィズス菌や乳酸菌は、非常に有望な効果を持つ食品として研究されてきた。
しかしながら、プロバイオティクスの抗高コレステロール血症の可能性の作用機序は、まだ研究中である。いくつかの科学者は、細胞表面へのコレステロールの結合および/または成長した細胞によるコレステロールの同化と細胞膜へのコレステロールの取り込みを含む細胞パターンを提案している(196)。他の科学者は、むしろ胆汁酸塩ヒドロラーゼを介した胆汁の脱炭酸、脱炭酸胆汁とコレステロールの共沈(192)またはオリゴ糖による短鎖脂肪酸の生産(41)からなる化学的パターンを受け入れている。
癌
消化管(GI)がんは大きな健康問題であり、全がんの20%を占め、世界のがん死亡原因の9%を占めている(1977)。
ヒト腸内細菌叢の役割は、がん疾患において広く議論されてきた。微生物叢のアンバランスが癌と関連しているようである。最も代表的な例の一つは、S. bovis/S. equinus complex感染と腸管がん(主に大腸がん)との相関関係である(198)。
機能性食品やプロバイオティクスは、がんの発生に対する保護的な役割を持っているようで(表8)術後の炎症の発生率を低下させる効果もあるようである(206)。
表8 癌や癌細胞株でのプロバイオティクスの使用について
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 腫瘍細胞のアポトーシス | -L。カゼイ | (199) |
| -B。longum | (199) | |
| -L。アシドフィルス | (199) | |
| HT-29、SW 480、Caco-2を含むヒト結腸癌細胞株の阻害 | B. adolescentis SPM0212 | (200) |
| ヒト胃癌細胞および結腸癌細胞における抗増殖およびアポトーシス促進効果 | -L。パラカゼイIMPC2.1 | (201) |
| -L。ラムノサスGG | (201) | |
| -L。アシドフィルス606 | (202) | |
| -LGG / Bifidobacteriumanimalissubsp。ラクトコッカスラクチス | (203) | |
| 抗腫瘍活性 | -Bacillus polyfermenticus | (204) |
| -L。アシドフィルスNCFB1748 | (205) |
いくつかの研究者によって示されているように、プロバイオティクスは消化管癌に対して抗増殖性およびプロアポトーシス特性を有している(207, 208)(表8)。
同様に、ラクトバチルス・カセイ(Lactobacillus casei)ビフィドバクテリウム・ロンガム(Bifidobacterium longum)およびL.アシドフィルス(L. acidophilus)で発酵させた牛乳は、腫瘍細胞のアポトーシスに対して有益な効果を示した(199)。
さらに、細胞株では、Bifidobacterium adolescentis SPM0212 が HT-29,SW 480,および Caco-2 を含む 3 つのヒト結腸癌細胞株の増殖を抑制することが観察されている (200) (表 8)。
ラクトバチルス・パラカセイIMPC2.1株およびL.ラムノサスGG株の抗増殖作用およびプロアポトーシス作用は、ヒト胃癌細胞および大腸癌細胞のいずれにおいても観察されている(201)(表8)。
さらに、Bacillus polyfermenticusによって抗腫瘍活性が示されている(204)。
さらに、L. acidophilus 606(202)、LGG/Bifidobacterium animalis subsp. lactis(203)もヒト大腸癌細胞に対して活性を示している。
L. casei Shirotaは、糞便酵素活性を低下させることにより、腸内環境の悪化を防ぎ、膀胱癌に効果があることが報告されている(205)。また、L. acidophilus NCFB 1748でも糞便酵素活性の低下が観察されており、癌リスクや放射線治療に関連した下痢を減少させることが報告されている(205)。
それにもかかわらず、上記の研究のほとんどは、消化管癌におけるプロバイオティクスの効率性を示す試験管内試験、細胞株または動物モデルで行われた。前述したように、これらの研究では、プロバイオティクスには抗発がん性効果、抗変異原性効果、腫瘍細胞の分化過程の異常、腫瘍遺伝子発現の改変、発がん性細菌の抑制、免疫系や腸内バランスの改善などの特性があるとされている(206)。
しかし、これらの効果を誘発するメカニズムは完全には解明されていない。プロバイオティクス株に関連した効率性と安全性、さらには癌の種類や病期に応じた投与方法や投与量についての知識を深めることができる具体的な臨床試験で、ヒトを対象としたこれらの研究を拡大することが最も重要な関心事である(206)。
骨粗鬆症
ヒトおよび動物実験では、プロバイオティクスの補給は骨と骨格を強化するので、骨量減少の予防と治療の治療手段になる可能性があることが示されている(31)。さらに、プロバイオティクスは一次性エストロゲン欠乏症や二次性骨粗鬆症からも保護する(31)(表9)。
表9 骨粗鬆症におけるプロバイオティクスの使用。
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 骨粗鬆症 | -さまざまな | (31) |
口腔内疾患
歯肉炎は歯肉に限った炎症であるが、歯周炎では炎症が歯周囲組織や歯槽骨にまで及んでいる。
P. gingivalis、A. actinomycetemcomitans、T. forsythia、Staphylococcus intermedius、Candida albicans、T. denticolaは歯周炎に関連する主な病原体である。
ラクトバチルス・サリバリウスWB21は、口腔内のマイクロバイオータを調節し、歯肉炎および歯周炎のリスクを低減する(209)(表10)。プロバイオティクスを含む歯ぐきを噛むか、またはローチにすることで、歯周病を改善することができる(214)。
表10 口腔内疾患におけるプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| 歯肉炎 | -L。サリバリウスWB21 | (209) |
| 歯周炎 | -L。サリバリウスWB21 | (209) |
| 虫歯 | -L。ロイテリ | (210) |
| -さまざまな | (211) | |
| 口臭 | -さまざまな | (212) |
| 口腔カンジダ症 | -L。ラムノサスGG | (213) |
虫歯は細菌が作った酸が原因の虫歯である。過剰なショ糖に続いて、口腔内で発見されたレンサ球菌ミュータンス菌は歯のエナメル質に付着し、歯のエナメル質の脱灰を引き起こす。プロバイオティクスはミュータンス連鎖球菌のレベルを低下させることができる。ラクトバチルス・ロイテリ(Lactobacillus reuteri)牛乳で発酵させたヨーグルトを2週間摂取すると、口腔内のストレプトコッカス・ミュータンス菌の個体数が最大80%減少することが報告されている(210)(表10)。さらに、プロバイオティクスを含む液体やロゼは、ストレプトコッカス・ミュータンスのレベルを低下させる(211)。
口臭(慢性的な口臭)とは、口腔衛生不良やう蝕、歯周炎などの口腔内の状態が原因で、特に午前中に揮発性硫黄化合物が生成されることに起因する不快な口臭のことである。揮発性硫黄化合物の減少は、プロバイオティクスによって生成されるH2O2によって観察される。さらに、プロバイオティクスは口腔内でのコロニー化を競う(212)(表10)。
最後に、口腔カンジダ症(口腔トラッシュ)は、口腔粘膜上のC. albicansが口腔粘膜を主にコロニー化することに起因する日和見性真菌症である。カンジダ症は、免疫のある患者や高齢者、長期の抗生物質投与を受けている患者などで、口腔内の正常な微生物バランスが乱れた場合に発症する。L. rhamnosus GGは、我々の口腔内微生物叢の正常な構成要素であるC. albicansの有病率を減少させるようである(213)(表10)。
自己免疫疾患
ディスビオーシスはシェーグレン自己免疫症候群の病因と関連しており(215)、ヒトマイクロバイオームと疾患の臨床症状との間には相互作用があると考えられる。いずれにしても、もしヒトマイクロバイオームがシェーグレン病の発症に重要な役割を果たしていることが明らかになれば(215)、次のステップとして、免疫抑制療法の補助的治療としてプロバイオティクスを投与するなど、新たな有望な治療アプローチが考えられる(表11)。
表11 自己免疫疾患におけるプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| シェーグレン症候群 | -さまざまな | (215) |
| 関節リウマチ | -さまざまな | (23、216) |
| 全身性エリテマトーデス | -さまざまな | (23、216) |
| 多発性硬化症 | -さまざまな | (23、216) |
ワクチンアジュバント
免疫応答を高めるためにラクトバチルス・カセイ431を、インフルエンザワクチンのアジュバントとしてラクトバチルス・フェルメンタム株VRI 003(PCC)を使用し、運動耐久性を向上させた(217,218)(表12)。
表12 ワクチンアジュバントとしてのプロバイオティクスの使用
| 病状 | プロバイオティクス | 参考文献 |
|---|---|---|
| ワクチンアジュバント | ラクトバチルスカゼイ431 | (217、218) |
| インフルエンザワクチンのアジュバント | Lactobacillusfermentum株VRI003(PCC) | (217 – 219) |
プロバイオティクスは、インフルエンザワクチンを接種した成人の血清転換率および血清保護率に応じてオークションを行うことで、免疫原性レベルの上昇に有効であることが示された(219)(表12)。
議論
腸の正常なマイクロバイオータは、体の防御(1)や、感染症、自己免疫疾患、アレルギー疾患などの複数の疾患の発生において非常に重要な役割を果たしている(218-222)。プロバイオティクスは、腸内細菌叢の適切なバランスを維持することで、これらの病気の症状を予防・軽減したり、補助療法として利用したりするための現代的なアプローチであると考えられている(114)。
プロバイオティクスおよび機能性食品として、Align B. infantis (4 mg/capsule 14 11億CFU)、Activia yogurt (B. lactis; 1億個/gあたりの細菌数)、Culturele (L. rhamnosus GG (L. rhamnosus: 100億個/g))など、菌株の組成および可能性の異なる多数の市販製品が開発されている。rhamnosus:1カプセルあたり100億個の細菌+インスリン200mg)子供用カルチャーレ(L. rhamnosus:1包あたり15億個の細菌)フロラジェン(L. acidophilus:1カプセルあたり200億個の細菌)フロラスターS. boulardii lyo:1カプセルあたり250mg)ハウエル(L. acidophilus/B. lactis:1カプセルあたり100億個の細菌)ケフィア(L. lactis. l. rhamnosus、L. plantarum、L. casei、L. acidophilus、L. reuteri、Leuconostoc cremoris、Streptococcus diacetylactis、S. florentinus、B. longum、B. breve、B. lactis:1カプセルあたり100億個)ケフィア(L. lactis. breve, B. lactis: 70~100億CFU/カップ)ラクチネックス(L. acidophilus, L. bulgaricus: 106 CFU/タブレット、109 CFU/パケット)レプフレッシュプロB(L. rhamnosus, L. reuteri: 50億CFU)レプフレッシュプロB(L. rhamnosus, L. reuteri: 50億CFU)。reuteri:1カプセルあたり50億CFU、膣用)VSL#3(L. acidophilus、L. plantarum、L. paracasei、L. bulgaricus、B. breve、B. infantis、B. longum、S. thermophilus:2カプセルあたり2,250億個の細菌)ヤクルト(L. casei:80mLボトルあたり80億個の細菌)ウルトラピュア(Saccharomyces boulardii CNCM I-745:250,00mg、50mg/キャップ)(223)。
プロバイオティクスの副作用(224)として、腹痛、緩い便、膨満感、ガス、鼓腸などが報告されている。
さらに、プロバイオティクスは「生きた生物」であるため、副腎皮質ステロイド療法や他の免疫抑制治療を受けている患者、移植や腫瘍患者、特に化学療法を受けている患者など、免疫不全の患者には使用が推奨されていない。また、プロバイオティクスによる感染性心内膜炎の報告があるため、補綴弁のある患者にはプロバイオティクス治療は推奨されていない(225)。
また、CYP酵素の役割を深く理解することも重要である(226)。CYP酵素は、多くの治療薬を活性化または不活性化する過程で重要な役割を果たす酵素のスーパーファミリーを代表する。腸内マイクロバイオームの高い代謝率は、薬物の代謝における反応を触媒する多くの酵素によるものである。腸内細菌叢のこの高い酵素活性は、ヒト糞便マイクロバイオータの主要な細菌株におけるP450の存在と関連している。多くの腸内細菌株がCYP酵素(P450)を持っているという事実は、生きているプロバイオティクスがP450活性を発現するならば、薬物の代謝とそのバイオアベイラビリティに影響を与える可能性があるのではないかという疑問を生じさせる。(226).
さらに、腸管バリアが障害されると(226-228)、この代謝が影響を受ける。間違いなく、プロバイオティクスの役割は、腸内マイクロバイオームの欠乏やアンバランスを回復し、保護効果を確立することである。そうは言っても、プロバイオティクスの腸内マイクロバイオームへの作用だけでなく、腸内マイクロバイオータの高い酵素活性については、まだ解明されていない。今後の試験では、様々な疾患状態、環境毒性や化学物質の曝露、栄養状態におけるチトクロムCYP(P450)の役割の多因子関連を明らかにすることに焦点を当てるべきであることは明らかである。それはまた、プロバイオティクスの有効性は厳密に株と受信した用量に依存していることをもう一度言及する価値がある。
プロバイオティクスは、非特異的な免疫応答を刺激し、いくつかの疾患状態を改善し、アレルギーを軽減することにより、免疫系に有益な影響を与える(図2)。
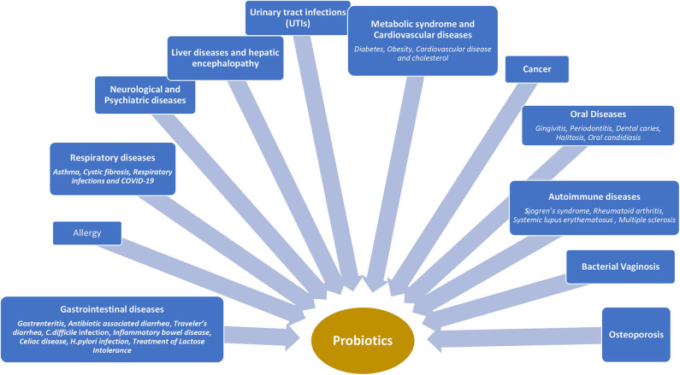
図2 異なる疾患状態におけるプロバイオティクスの臨床的使用
よく知られているように、病原体は、免疫、炎症、細胞増殖において重要な役割を維持している転写因子活性化核因子-κB(NF-κB)を活性化することにより、上皮細胞の炎症性反応を誘導する。プロバイオティクス株がこの因子をブロックすることで上皮免疫活性化に効果があるというエビデンスがある(229)。
プロバイオティクスの投与は、複数の方法で免疫システムを改善する;全身的に天然抗体IgMおよびIgGレベルの産生を刺激し、局所的および全身的にIgA抗体を増加させ、インターフェロン(230)およびサイトカインの存在を調節する貪食能を増加させる(231)。この精神において、プロバイオティクスは、ヒトマクロファージ応答に続く初期炎症に関連している可能性のある免疫賦活効果を示している(231)。
乳酸菌およびビフィズス菌のようなプロバイオティクス微生物との早期の腸内植民地化が、多くの異なるタイプの疾患からのその後の保護を提供することが強調されている。さらに、ビフィズス菌および乳酸菌によって支配される有益なプロバイオティクス微生物叢は、β-グルコロニダーゼおよび発がん物質のレベルを減少させるそれらの能力に続くがんのリスクを減少させることによって、腸内微生物叢を修正することができる(37)。
さらに、プロバイオティクスは、病原体を抑制するために抗菌物質、バクテリオシンを産生し、pHを低下させ(232)、病原体と栄養素を競合させ、最終的には腸管バリア機能を強化することができる(1, 224)。
腸管バリアの完全性は、健全な腸内生態系の特徴である(233)。議論されているように、多くの要因がこの問題に寄与している。
様々な試験管内試験および動物実験では、ヒトのマイクロバイオータの重要性とプロバイオティクス治療による粘膜バリア機能の改善が示唆されている(3, 234)。
前述したにもかかわらず、これらの研究の結果をヒト集団に外挿することには困難がある。
様々な疾患や状態、特に抗生物質の複数回投与が失敗した後の感染症において、プロバイオティクスの予防的・治療的効果を評価するために、複数の臨床試験が実施されてきた。
この時点では、プロバイオティクスの治療効果を評価するために、より多くの臨床研究が大規模なサンプルを用いて実施されるべきであることが触媒的であることを裏付けている。プロバイオティクスの選択基準、有効性と安全性の問題だけでなく、プロバイオティクスの能力は株に依存しているように思われるという事実も考慮されるべきである。
このレビューでは、異なる疾患状態におけるプロバイオティクスの応用と治療の可能性に関する現在の知識をまとめようとしたが、プロバイオティクスの有効性と安全性のプロファイルに関する十分な証拠がないため、プロバイオティクスの使用は長期的な議論の対象となっている。