Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8995832/
Gut.2022 May;71(5):1020-1032.
2022年2月1日オンライン公開doi:10.1136/gutjnl-2021-326789
pmcid: pmc8995832
Willem M de Vos,#1,2Herbert Tilg,#3Matthias Van Hul,#4andPatrice D Cani#4
概要
腸内細菌叢は、現在、宿主の健康を制御する重要な要素のひとつと考えられている。事実上、私たちの身体のすべての部位には微生物が生息しており、臓器との様々なクロストークが示唆されている。分子生物学的手法(メタゲノム、メタボローム、リピドミクス、メタトランススクリプトームなど)の発展により、宿主と様々な微生物の間で起こる複雑な相互作用が徐々に明らかにされつつある。現在、腸内細菌叢の逸脱は、肥満、2型糖尿病、肝脂肪症、腸管疾患(IBD)、いくつかのタイプの癌を含む多くの疾患と関連している。したがって、免疫、エネルギー、脂質、グルコース代謝に関わる様々な経路が影響を受けていることが示唆される。
このレビューでは、この分野における現在の理解を批判的に評価することに特に注意を払った。腸内細菌が病気の予防や発症にどのように関係しているかを説明する数多くの分子メカニズムが議論されている。
短鎖脂肪酸、胆汁酸、トリメチルアミンN-オキシドなどのよく知られた代謝産物から、エンドカンナビノイド、生理活性脂質、フェノール由来化合物などの最近同定された分子アクターまで、幅広く検討する。エンドプロフェッサー・エンドプロダクト)、およびペルオキシソーム増殖因子活性化受容体α(PPARα)およびγ(PPARγ)、アリール炭化水素受容体(AhR)、Gタンパク質共役型受容体(GPR41、GPR43、GPR119、武田薬品Gタンパク質共役型受容体5)といった特異的受容体について考察している。
このように、腸内細菌と健康を結びつける複雑さと分子的側面を理解することは、すでに開発されている新しい治療法の基礎となるものである。
キーワード 腸内細菌学、肥満、腸管バリア機能、肝臓、プロバイオティクス
ヒト腸内細菌叢
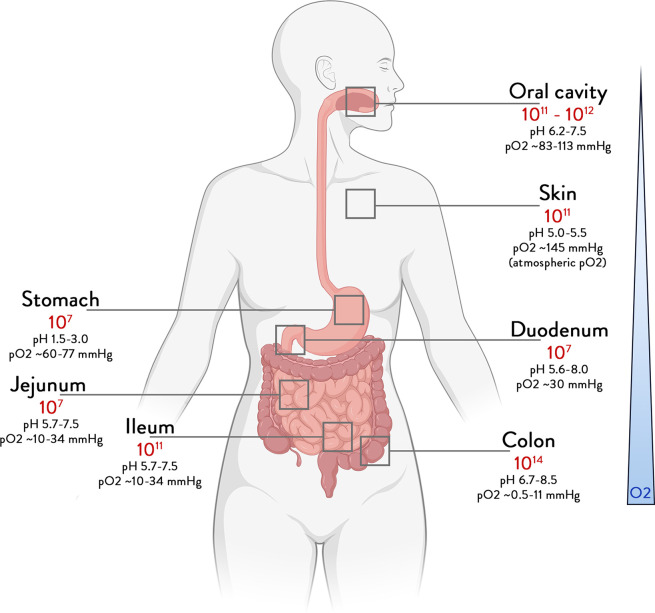
ここでいうヒトマイクロバイオームとは、生まれたときから私たちの体に定着し、垂直方向に移動する微生物、その遺伝子、その産物の集合体として考えられている。1 2身体のあらゆる部位に生息しているが(図1)、最も微生物数が多いのは、これまで広く研究されてきた腸内である。3ここでは、腸内細菌、その活動、メディエーター分子が私たちの健康にどのように貢献できるのかについて、主要かつ最新の知見をレビューする。
図1 体の部位別のバクテリアの総量
細菌濃度と体積から導き出された、異なる臓器における細菌数の境界線。190 191
健康な人の場合、口腔内や唾液のマイクロバイオームには何百万もの微生物が含まれており、それらは毎日食事とともに飲み込まれるが、胃の酸性度、十二指腸以降での胆汁酸(BA)、消化酵素、抗菌タンパク質の生産など多くの要因によって腸への定着が阻害されることになる。その他にも、pH、酸素濃度、酸化還元電位などの化学的パラメータ、粘液、胆汁、抗体などの生物学的産生、さらには腸管構造、蠕動運動、通過時間などの物理的側面など、非常に多くの主要変数がさらに下流の微生物コロニーに影響を与える(図1)。十二指腸吸引液の微生物量は経口試料の1000分の1であり、類似した微生物群から構成されているにもかかわらず、小腸に沿った微生物の濃度勾配が見られる4。その結果、小腸には、酸素に強いファーミキューテスやプロテオバクテリアを中心に、1グラムあたり数千から数億の細胞が存在するようになった。大腸の通過時間は小腸の十数倍であるため、1グラムあたり最大1,000億個の微生物群集が最大で数日間存在することになる5 6。そのため、大腸のマイクロバイオームは主に嫌気性細菌によって支配されており、数千の種と数百万の遺伝子が、Firmicutes(主にRuminococcaceaeとLachnospiraceae)、Bacteroidetes、Actinobacteria、Proteobacteria、Verrucomicrobia(Ackermansia)7-10の主要系統の間で分布する(図1)。糞便として排出されるこのバイオマスは、通常、腸内細菌叢と呼ばれるものを構成しており、多くの疾患と関連し、食事や薬剤によって高度に修正可能である(表1)。腸内細菌叢は、クロストリジョイデスディフィシル感染症やその他の疾患を再発する患者の治癒が確認されている便微生物移植(FMT)の出発材料となっている。11-15
表1 マイクロバイオームと疾患に関するPubMed掲載論文
| 疾患名 | PubMed検索 | PubMed検索 |
| “疾患とマイクロバイオーム” | “疾患・微生物/臨床試験” | |
| IBD | 2867 | 36 |
| セリアック病 | 524 | 20 |
| 過敏性腸症候群 | 1516 | 96 |
| 大腸がん | 1525 | 43 |
| 肝臓疾患 | 4927 | 113 |
| 膵臓疾患 | 766 | 20 |
| 肥満 | 7146 | 292 |
| 2型糖尿病 | 2155 | 99 |
| 非アルコール性脂肪性肝疾患 | 1383 | 31 |
PubMed検索2021年12月15日。
小腸は体内で最も大きな粘膜面を持ち、食物がさらに消化・吸収され、腸管受容体や免疫・神経細胞のほとんどが存在し、微生物と宿主のクロストークに欠かせない存在としてますます重要視されている。実験的にアプローチすることは難しいが、近年、サンプリング、送達、あるいは検査のためのカテーテルやカプセルを含む様々な新しい技術が開発されている。16-18また、回腸吻合術で得られた小腸排水を調べたところ、湿重量1gあたり最大1億個の微生物が存在し、食物摂取や処理を反映して昼夜のリズムを示し、個人化されたコミュニティを形成していることがわかった19。このようなサンプルの機能解析(トランスクリプトミクスと標的メタボロミクス)およびメタゲノム解析により、コロニー形成するStreptococcus属とLactobacillus属は、糖の取り込みと利用について宿主と競合し、Veillonella属の基質となる乳酸と酢酸を生成してプロピオン酸に変換する非常に有効な輸送系を大量に発現することがわかった(※20)。20特別に開発されたカテーテルを用いた最近の研究により、これらの群集が確認され、腸管内で最も表面が広く、糖、タンパク質、脂質の消化・吸収を担う空腸と比較して、十二指腸の微生物相はpHに相関した高い組成動態を示すことが明らかとなった。5 21十二指腸と空腸の間には連続性があるが、より近位の回腸には大腸を思わせる大きな粘液層があり、Bacteroidia属、Ruminococcaceae属、Lachnospiraceae属などの嫌気性菌が定着しており、これらの一部はBAs変換にも関与している(「生物活性脂質/胆汁酸」のセクションを参照)。21 22
十二指腸とその微生物は、様々な代謝性疾患およびおそらくは免疫性疾患の主要な要因として浮上している。23メタボリックシンドロームや自己免疫疾患の症状を緩和するFMTの十二指腸投与から、このことを支持し、さらに新しい知見が得られた。24-26さらに、乳酸菌の生菌または死菌の十二指腸灌流は、宿主の免疫反応に影響を与えることが分かっており、ヒトでの発見のための実験系を提供している。27-29これについては、最近、Anaerobutyricum soehngenii(以前はEubacterium halliiとして知られていた)30の十二指腸への単回投与が、メタボリックシンドローム被験者において膵島タンパク質1Bの再生遺伝子の十二指腸発現レベルをほぼ10倍上昇させ、また血清グルカゴン様ペプチド1(GLP-1)と第二胆汁酸塩が上昇し、それによってグルコースに対する反応の改善が説明された可能性を分析する際に活用されている。31 32
腸内には明らかな垂直勾配が存在するが、水平勾配も存在し、大腸で最も広範囲に研究されている。重要なのは、酸素、酸化還元、粘液の勾配が存在し、それが粘膜表面から内腔へと広がり、結果として微生物群集の構造を形成していることである33。33大まかに言えば、粘液分解性で微好気性のAkkermansia muciniphilaが通常支配する粘液分解コンソーシアムから始まり、酪酸産生、プロピオン酸産生のRuminococcaceae、Lachnospiraceae、Bacteroidia、さらに水素と二酸化炭素をそれぞれ酢酸とメタンに変えるhomoacetogenとmethanogensなどの嫌気的なコミュニティで終息している。
腸内細菌と様々な腸管・腸管外疾患
腸内細菌は、いくつかの腸および腸外疾患と関連があるとされている。腸内細菌とその関連性を調査する多くの大規模な研究は、腸管疾患(IBD)35、セリアック病36、過敏性腸症候群(IBS)37、大腸がん(CRC)38、慢性肝疾患3940または膵疾患などの特定の消化管(GI)障害において実施されている。41 42IBDは腸の炎症性疾患の代表的な疾患であり、腸内細菌叢の組成の逸脱と関連し、特に炎症が活発でBAs、短鎖脂肪酸(SCFAs)、アシルカルニチン経路などの代謝物障害を背景に、実際に通性嫌気性菌の脱却が報告された。35別の頻度の高い炎症性腸疾患であるセリアック病のリスクを持つ乳児における縦断的解析では、発症前にDialister invisus、Parabacteroidesspp、Lachnospiraceaeなどのいくつかの微生物種やトリプトファン代謝物などの特定の代謝物が増加する一方で、Faecalibacterium prausnitziiやClostridium clostridioformeなどの様々な抗炎症菌株が減少することが示されている36機能性腸疾患であるIBSでは、発症前から炎症が起こりやすい。36消化管の機能障害として頻度の高いIBSは、腸内細菌叢および関連代謝産物のIBSサブタイプ特異的変化と関連しており、特にプリン代謝が影響を受けていることが分かっている。37下部消化管に最も多く見られる悪性腫瘍であるCRCは、乱れた腸内細菌叢と説得力のある相関を示し、Fusobacterium nucleatum、Escherichia coli、Bacteroides fragilisなどの特定の細菌(その一部は口腔内細菌叢由来)が関与していることが分かっている。38慢性肝疾患、特に肝硬変などの進行性肝疾患は、微生物の異常によって特徴付けられ、プレバイオティクス、プロバイオティクス、抗生物質を用いた介入研究のデータから、腸内細菌がこれらの疾患に重要な役割を果たすことが十分に立証されている。40膵臓腺がんは、欧米でますます認知されている悪性腫瘍であるが、腫瘍内のマイクロバイオーム組成が宿主の免疫反応や疾患の自然史に影響を及ぼすことから、腸内マイクロバイオームの障害とも関連性が指摘されている42。42
腸内細菌は、2型糖尿病(2型糖尿病)や非アルコール性脂肪肝疾患(NAFLD)などの肥満および肥満関連疾患において、過去何年にもわたって広範囲に研究されていた。多くの研究が腸内細菌群の変化を肥満と関連付けることを試みており、実際にAkkermansia muciniphilaなどの特定の細菌株を用いた介入研究により、肥満関連パラメータに対する効果が示されている。432型糖尿病はまた、アジアおよびヨーロッパの集団において、腸内細菌叢の障害によって特徴づけられている。44 452型糖尿病では、微生物の変動はインスリン抵抗性の有無と強い相関があり、いくつかの研究では、腸内細菌がグルコース調節に影響を与えることが示唆されている。46NAFLDは、現在、欧米で最も一般的な慢性肝疾患であり、肥満、メタボリックシンドローム、2型糖尿病の境界領域にある典型的な代謝異常と考えられている。NAFLD、特に非アルコール性肝脂肪症のような線維化や進行した病期の場合、腸内細菌-肝臓軸が役割を果たすという証拠が増えてきている。47いくつかの研究により、NAFLDは、特定の腸内細菌科、大腸菌の増加、F. prausnitziiの減少によって特徴づけられることが明らかにされている。また、最近のデータでは、NAFLDのマイクロバイオームの逸脱や不安定性は長年にわたって存在し、NAFLDや2型糖尿病の発症に先行している可能性さえあることが示唆されている。48腸内細菌叢が調査されているGIおよび代謝性疾患の数は増加している(概要については表1を参照)。
腸内細菌と代謝異常:分子的アクター
腸内細菌群は、代謝異常の様々な側面の制御に重要な役割を担っている。この制御は、特に、微生物叢による多種多様な代謝産物の産生と、シグナル伝達経路を活性化または阻害し、宿主の健康に有益にも有害にもなりうる宿主細胞上の受容体との相互作用に依存する(図2)。
図2 栄養源や代謝源に応じて腸内細菌叢が産生する分子や代謝物、およびその由来化合物
BSCFA、分岐型SCFA、LPS、リポポリサッカライド、PAMP、病原体関連分子パターン、SCFA、短鎖脂肪酸。
このような相互作用に関与する細菌の代謝産物は非常に多様であり、低分子から高分子まで多岐にわたっている。SCFAなどの細菌代謝の副産物から、ペプチドグリカンやリポポリサッカライド(LPS)などの細菌の健全性に必要な複雑な高分子まで含まれる(図2)。
これらの代謝物の量と利用可能性は微生物組成に依存するため、食事や環境因子によって調節される。49-51主な分子的要因について以下に説明する。
短鎖脂肪酸と宿主の健康への影響:分子メカニズム
小腸は栄養素の分解、乳化、吸収に非常に特化しており、消化を免れる栄養素はほとんどない。例えば、通常の状態では、脂肪は1日5g未満しか結腸に到達さない。同じ原理で、単純炭水化物(糖の分子に分解される)とほとんどのタンパク質(アミノ酸に変換される)も消化・吸収されるが、摂取量によっては、一部のタンパク質が大腸に到達することになる。逆に、食物繊維などの複合糖質は難消化性で、体内で消化するのに必要な酵素がないため、小腸で消化されずに残ってしまう。しかし、大腸では、特定の常在菌によってエネルギー源として利用される。様々な腸内細菌が、これらの難消化性炭水化物を様々なSCFAs分子(酢酸、酪酸、プロピオン酸など)へと代謝する。SCFAsは化学的によく知られており、健康への影響もすでに広く報告されている。52-54これらの化合物は、腸内および肝臓、脂肪組織、筋肉、脳などの遠隔地における多数の代謝経路を制御している(図3)。55-57現在、これらの微生物代謝産物は、エネルギー恒常性、グルコース/脂質代謝、炎症、さらには免疫や癌の調節に至るまで、数多くの生理学的効果に寄与していることが知られている。52
図3
健康な状態でも病的な状態でも、腸内細菌叢と宿主の健康を結びつける分子メカニズムは同じである。健康な状態では、結腸細胞は酪酸をミトコンドリアでのβ酸化によりエネルギー基質として利用し、それによって酸素を消費し、内腔の嫌気状態を維持することに直接的に寄与している。また、酪酸はペルオキシソーム増殖剤活性化受容体γ(PPARγ)と結合し、誘導性一酸化窒素合成酵素(iNOS)を抑制して一酸化窒素の産生を低下させ、最終的に硝酸塩の産生を低下させることが知られている。逆に、病的な状況では、内腔の酪酸が少ないとPPARγ活性が低下し、解糖が増加し、酸素消費量が減少する。これはiNOSの高発現と関連しており、iNOSはより多くのNOを産生し、最終的に特定の病原体にとって利用可能な硝酸塩を増加させる。酪酸はまた、制御性T細胞(Treg)などの免疫細胞を刺激し、炎症を抑えることができる。
核内転写因子であるアリール炭化水素受容体(AhR)は、健康な結腸細胞で高発現し、活性化している。一方、AhRのアゴニストは、低発現または活性が低下すると、腸管バリア機能に変化をもたらすことがある。
腸内分泌細胞(L細胞)は、短鎖脂肪酸(SCFAs)、特定のエンドカンナビノイド(eCBs)および胆汁酸(BAs)によって活性化されるいくつかの重要な受容体を発現している。これらの受容体が活性化されると、グルカゴン様ペプチド(GLP)-1、GLP-2、ペプチドYY(PYY)などの主要な腸内ペプチドの分泌が増加する。腸内細菌とこれらの分子の相互作用は、腸管伝染性の低下、インスリン分泌とインスリン感受性の改善、食物摂取量の減少、血漿脂質の低下、肝脂肪症や代謝性内毒素症の回避に寄与している。これらの効果はすべて、炎症の抑制と関連している。逆に、病的な状況では、逆の効果が観察されている。
一連の実験的研究のおかげで、発酵性食物繊維を豊富に含む食事(例えばプレバイオティクス)が体重増加、脂肪量増加、インスリン抵抗性およびエネルギー摂取量を減少させることができる分子メカニズムの多くが発見された。その中で、プレバイオティクスを用いて腸内細菌叢を調節すると、GLP-1、GLP-2、ペプチドYY(PYY)などのL細胞によって産生されるいくつかの腸ペプチドの内因性生産(すなわちmRNAとペプチド)および門脈分泌が増加することが明らかにされた(図3)。59-61 63-65
レジスタントスターチやアラビノキシランを微生物発酵させてSCFAを生成すると、血漿中のGLP-1およびPYYレベルの上昇につながる同様の生理的効果が得られるため、これらの効果は1種類の発酵性糖質のみに限定されるものではない。66-69しかしながら、発酵性繊維の化学構造は、生成される酪酸、酢酸またはプロピオン酸の量が繊維の種類に依存するので、SCFA生成プロファイルに直接関連する。例えば、イヌリンはプロピオン酸生成性があるのに対し、レジスタントスターチはより酪酸生成性があるとされている。注目すべきは、いくつかの大腸菌が代替経路を利用して、リジンなどのアミノ酸から酪酸を、フィチン酸などの植物化合物からプロピオン酸を生成していることである。70 71SCFAsの供給源は食事から得られるが、腸管上皮細胞を覆っている腸管粘液の発酵を通じて宿主自身から得られることもあるということは注目に値する。72
SCFAは、回腸末端と大腸に特異的に多く存在する腸内分泌L細胞の表面に発現する特定のGタンパク質共役型受容体に作用して、腸内ペプチドの分泌を刺激する。これらの受容体は、Gタンパク質共役型受容体(GPR)43(または遊離脂肪酸受容体2(FFAR2)およびGPR41(またはFFAR3)と呼ばれ(図4)73、さまざまな組織や細胞タイプ(例えば、脂肪細胞、免疫細胞)にも発現している。74-76GPR43または GPR41のいずれかを欠損したマウスモデルを用いて、腸内ペプチドの分泌にマイクロバイオームが果たす重要な役割が明らかにされた。これらの受容体を欠くマウスは、SCFAsまたは特定のプレバイオティクスに曝露した後、GLP-1およびPYYの分泌が減少することを示す(図3)。77-79
図4
大腸細胞や内分泌細胞は、微生物環境からのシグナルを感知し、伝達することができる様々な受容体を発現している。微生物/病原体関連分子パターン(PAMPs)、微生物叢からのリポ多糖(LPS)は、toll-like receptor(TLRs)を含むパターン認識受容体によって検出される。Amuc_1100は、Akkermansia muciniphilaの外膜に発現するタンパク質で、TLR2を介してシグナルを送り、腸管バリア機能を改善し、炎症を抑えることが示されている。ある種の微生物が分泌する代謝物(例:エンドカンナビノイド(eCB)、微生物による食事成分の消化(例:短鎖脂肪酸(SCFA)、あるいは宿主由来の因子の変換(例:eCBsおよび胆汁酸)により発生した代謝物は、様々な受容体や経路を通じて感知され、腸の完全性と宿主の健康状態を変化させることができる。CB1、CB2、カンナビノイド受容体タイプ1およびタイプ2;TRPV1、過渡受容体電位カチオンチャネル・サブファミリーVメンバー1;FXR、ファルネソイドX受容体;AhR、アリールハイドロカーボン受容体。GPR119、GPR43、GPR41、Gタンパク質共役型受容体119,43,41;MYD88、骨髄分化一次応答88;PPARα/γ、ペルオキシソーム増殖因子活性化受容体αおよびγ;TGR5、武田薬品Gタンパク質共役型受容体5。
よく知られた役割や作用機序に加え、いくつかのSCFAはこれまで考えられてきたのとは異なる機能を発揮しているのかもしれない。例えば、酪酸は大腸細胞の増殖と腸管バリアの維持に不可欠なエネルギー源として何度も説明されてきた。しかし、最近の研究から、酪酸は大腸の細胞とコミュニケーションをとることで、微生物の環境にも強い影響を及ぼしていることが分かってきた。実際、腸管内腔部には酸素が豊富に存在し、上皮に向かってその濃度が徐々に低下することは、腸内炎症のリスクを高めることが示されている腸内細菌科(Proteobacteria門)のような通性嫌気性菌とは対照的に、嫌気性菌が上皮の近くに留まるための重要な条件となる(図3)。80 81酪酸は、ミトコンドリアでのβ酸化を活性化することにより、大腸の嫌気性状態の制御に寄与している。酪酸は、大腸細胞の核内受容体ペルオキシソーム増殖剤活性化受容体γ(PPARγ)を活性化することにより、大腸細胞から管腔部への酸素の拡散を制限し、嫌気状態を維持する。また、PPARγの活性化は、誘導性一酸化窒素合成酵素をコードする遺伝子の発現を抑制し、それによって、病原性のある通性嫌気性菌(Enterobacteriaceae)の増殖に用いられる特定のエネルギー源であるNO産生、ひいてはルーミナル硝酸レベルを減少させる(図3)。
同様の観察は、IBD、癌、肥満、糖尿病などの重度の腸内炎症を持つヒトにおいても行われており52 82-84、そこでは腸内細菌科細菌の増加量が検出されている。
驚くべきことに、これらの疾患はすべて、SCFA(主にプロピオン酸と酪酸)を産生する細菌の減少とも関連していることが、多くの論文で指摘されている。85これは例えば、F. prausnitzii、A. muciniphila、そして最近ではDysosmobacter welbionisなどのケースである。また、Anaerostipes属やAnaerobutyricum属は、酢酸の存在下で、アセチルCoA経路を使って乳酸から酪酸を生成することが知られている(87)。87これらは小腸だけでなく、様々な細菌が乳酸を産生する大腸でも栄養連鎖を形成することができる。腸内環境に望ましくない酸である乳酸が蓄積されると、消化管障害が引き起こされる。このことは、メタボリックシンドロームの被験者に対する酪酸菌A. soehngeniiの介入によるいくつかの利点を説明できる可能性がある。32 88
プロピオン酸や酪酸の他に、コハク酸の影響も研究されている。コハク酸はクレブスサイクルの中間体として最もよく知られており、ミトコンドリアの酸化的リン酸化の基質と考えられているが、細菌からの代謝産物でもある。この中でコハク酸は、主にプロピオン酸合成の重要な中間体であると考えられていたため、古典的には無視されてきた。現在、コハク酸とインスリン抵抗性、肥満、炎症との間には、有益な関連性と反対の関連性の両方が報告されているため、コハク酸の役割は、主に議論の余地が残っている89。90-93
リポポリサッカライド/病原体関連分子パターン
腸管バリアは、環境を監視し、微生物の侵入や有害な刺激から宿主を守る、複雑でダイナミックな物理的・化学的構造の集合体である。環境からやってくるこれらの有害な成分の中には、いわゆる病原体関連分子パターン(PAMPs)があり、その中でも細菌のLPSは原型となるクラスである。94
LPSはグラム陰性菌の細胞膜に存在する内毒素で、炎症反応の強力な活性化因子であり、少量のLPSが循環器内に放出されただけでも炎症反応を引き起こすのに十分である。
LPSをはじめとするPAMPsは、微生物や感染因子を感知し、防御反応を示す特定のパターン認識受容体(PRR)を活性化することによってその活性を発揮する。PRRには4つの主要なサブファミリーがある:Toll-like receptor(TLR)、nucleotide-binding oligomerisation domain-leucine-rich repeats(LRR)–containing receptors、retinoic acid-inducible gene 1(RIG-1)-like receptors(aka RIG-1-like helicases) and the C-type lectin receptorsである。95その中でも、ヒトでは10メンバー(マウスでは13メンバー)からなる受容体ファミリーであるTLRは、最もよく特徴付けられている。TLRの各々は、病原体に由来する異なる微生物成分に対する反応を媒介する。典型的な例としては、細菌のリポタンパク質を感知するTLR2と、細菌のLPSを認識するTLR4がある。97TLRは、外部刺激(PAMPs)98と組織損傷に由来する内部シグナル(損傷関連分子パターン:DAMPs)の両方を幅広くカバーしている(図3および4)。これらのリガンドは、核酸から脂質、低分子化合物から高分子まで、様々な形態と大きさで存在している。TLRは、マクロファージ、好中球、樹状細胞、ナチュラルキラー細胞、マスト細胞、好塩基球、好酸球などの免疫細胞、さらには腸管上皮細胞などの体細胞にも広く分布している99。これらの細胞の活性化は、抗原提示細胞の活性化を誘導し、それによって自然免疫反応と適応免疫反応の橋渡しをし、微生物の侵入をかわしたり、損傷した組織を修復しようとして、シグナル伝達カスケードを刺激するのだ。この炎症反応は感染を排除するために必要であるが、TLRの過剰な活性化は免疫恒常性の崩壊につながり、炎症性サイトカインやケモカインの持続的な産生は、炎症性疾患や自己免疫疾患のリスクを増大させる可能性がある。これは、高脂肪食と体重増加が、腸管伝染性の上昇とそれに続く循環血漿LPSの全身的(軽度)上昇と関連している、代謝性内毒素血症におけるケースである。これは、2型糖尿病、NAFLD、慢性腎臓病、アテローム性動脈硬化症などの様々な慢性疾患の病理学的特徴である低悪性度炎症の状態を引き起こすものである。38 39 101 102興味深いことに、異なる種類の細菌からのLPSは、腸管バリア機能、脂肪の炎症、腸のグルコース吸収、血糖値、インスリン、インクレチンに異なる影響を与え、代謝性内毒素血症レベルの宿主代謝への正味の影響は、腸内細菌叢組成に依存して変化し得ることを示している。103
PRRの発現の乱れは、炎症に有利な微生物叢の組成の変化と関連している。例えば、細菌のフラジェリンによって活性化されるTLR5を欠損したマウスは、大腸炎やメタボリックシンドロームを発症し、微生物叢の変化と関連する。104 105
TLRによる下流シグナル伝達経路の活性化は、骨髄分化因子88タンパク質(MyD88)に依存していることが示されている(図4)。MyD88は、TLR3106を除くすべてのTLRに必須のアダプタータンパク質であり、腸のMyD88の欠失は、食事誘発性肥満、糖尿病および炎症から部分的に保護し、食事誘発性肥満時に抗炎症性のエンドカンナビノイド(eCBs)の増加、抗菌ペプチド産生の回復および腸制御性T細胞の増加をもたらす。107
PAMS/DAMPS、PRR、マイクロバイオーム、病態がどのように相互作用しているかを完全に理解するには、まだ多くの疑問が残っているが、この複雑な相互作用に関する理解が深まるにつれ、炎症依存性疾患に対する新しい治療の可能性が開かれつつある。
生理活性脂質
エンドカンナビノイド系
この20年間、eCBシステムは、その幅広い生理作用のために、広く研究されてきた。eCBシグナルシステムは、エネルギー、グルコース、脂質代謝、免疫、炎症、そして最近では微生物と宿主の相互作用に重要な役割を果たしていると考えられている。108109
歴史的には、1988年に最初の内因性カンナビノイド受容体タイプ1(CB1)がカンナビス・サティバの精神活性化合物であるΔ9-テトラヒドロカンナビノールによって活性化することが確認され110、続いて1993年に第2の受容体、カンナビノイド受容体タイプ2(CB2)が発見された。111両受容体はGPRであり、共通のシグナル伝達機構を有している。112最初に同定された内因性アゴニストは、アナンダミド(N-アラキドノイルエタノールアミド(AEA)であった。AEAは、N-アシルエタノールアミン(NAE)ファミリーに属する大きな生理活性脂質群の主要メンバーの1つである。113同定された2番目の主要なリガンドは、2-アラキドノイルグリセロール(2-AG)であった。114これら2つの主要な化合物の発見以来、eCBファミリーは拡大し、もはやCB1およびCB2受容体に特異的な活性を持つeCBだけに限定されなくなった。例えば、いくつかのeCBは、PPARαやPPARγ、またGPR55やtransient receptor potential vanilloid type-1(TRPV1)のような他の膜受容体と相互作用する(図4)。いわゆる「真の」eCB、すなわちCB1およびCB2に結合できるeCBの他に、原型となるeCBに構造的に類似した多数の化合物が、CB1またはCB2のeCB受容体を直接活性化せずにeCB反応を妨害することが示されてきた。これらの分子はすべてeCB様化合物または同族体と呼ばれ、他のNAEまたはアシルグリセロールファミリーのメンバーを含む生理活性脂質である。115 116しかし、eCB様化合物はそれ自体で薬理活性を発揮することもある。例えば、N-オレオイルエタノールアミン(OEA)やN-パルミトイルエタノールアミン(PEA)はPPARαやTRPV1を活性化し、OEA、N-リノレイルエタノールアミン(LEA)、2-オレオイルグリセロール(2-OG)はGPR119を活性化することが可能である。最近、1-パルミトイルグリセロール(1-PG)と2-パルミトイルグリセロール(2-PG)の両方がPPARαアゴニストであることが明らかにされた(図4)。118
2010年、腸管バリア機能の調節に関わる代謝系のうち、eCB系が大きな役割を担っていることが明らかにされた。108肥満や糖尿病になると腸のeCB系が変化し、CB1依存性の機序で腸の伝染性を誘発するAEAが増加することがわかったのが始まりである。108興味深いことに、このeCBシステムの調子の変化は、腸内細菌叢の変化と関連していた。さらに、強力なeCBアゴニストによるeCBシステムの薬理学的活性化は、脂肪生成を増加させ、腸のバリアを崩壊させた。119一連の独立した研究において、遺伝的肥満マウスと糖尿病マウス(ob/obとdb/db)の両方で、腸内細菌叢の組成が大きく変化し、それが全身の組織代謝とeCB系の緊張に関連していることから、腸内細菌叢、脂肪組織代謝およびeCB系の間の関連性が確認されている。120 121これらのデータを総合すると、eCB系に属する特定の生理活性脂質と腸内細菌叢、脂肪組織の発達および腸の機能との間に関連性があることが強く支持される。
さらにそのメカニズムを解明し、これらのNAEの合成が代謝異常の発症や腸内細菌叢の変化に関与しているかどうかを実証するために、脂肪細胞、腸管上皮細胞、肝細胞のいずれかで重要な合成酵素であるN-アシルホスファチジルエタノールアミン加水分解特異的ホスホリパーゼD(NAPE-PLD)を不活性化したいくつかのモデルマウスが作成されている。122-125
脂肪細胞のNAPE-PLDを欠失したマウスは、通常のカロリー食で肥満、インスリン抵抗性および炎症を自然発症し、高脂肪食誘発性代謝障害に対してより感受性が高いことがわかった。122NAPE-PLDの脂肪細胞特異的欠失は、脂肪組織における発熱プログラム(すなわち、褐変/帯電)を減少させ、腸内細菌叢の組成に大きな変化をもたらした。さらに、脂肪組織NAPE-PLD欠損マウスから無菌レシピエントマウスに微生物叢を移植すると、全体の表現型が再現された。122腸内細菌叢の因果関係が示唆された。腸管上皮細胞のNAPE-PLDを欠失させた場合、異なる表現型が生じた。マウスは高脂肪食に初めてさらされると過食になり、その後、食事誘発性肥満と肝脂肪症を悪化させた。この現象は、腸-脳軸の異常によるもので、視床下部のPomcニューロンにも変化が見られ、腸内と血漿中のeCBsの変化で説明できそうである。驚くべきことに、このモデルでは腸内細菌叢も影響を受けており、細菌叢を調節することで表現型が部分的に元に戻る可能性がある。123最後のモデルとして、肝細胞のNAPE-PLDを欠失させたマウスは、通常の食事で高脂肪食様の表現型(すなわち、脂肪量増加、肝脂肪症、肝炎症)を呈した。これらの効果は、BAsのような腸内細菌叢の影響を受けることが知られている他の主要な生理活性脂質の変化と関連していた。124これらのデータや動物モデルを総合すると、eCBシステムは、NAPE-PLDを介して、生理活性脂質の産生を介して腸内細菌叢と対話し、この酵素の調節異常が代謝性合併症につながることが示唆された。
腸内細菌叢とeCBシステムの制御との関連性をさらに探るため、無菌マウスのエンドカンナビノイドホーム(eCBome)を異なる時点の従来型マウスのものと比較検討した。eCBomeは、50以上の受容体と代謝酵素、20以上の脂質メディエーターからなるeCBシステムの延長線上にあり、重要な機能を有している。126腸のeCBome遺伝子発現と脂質メディエーターレベルに年齢依存的な変化が見られた。対照マウスのドナーの糞便を年齢を合わせた無菌マウスに移植すると、驚くべきことに、これらの変化のいくつかが、すでに1週間後には逆転していた。126これらの一連の研究は、腸内細菌叢が宿主のeCBomeに直接影響を及ぼしていることを実証している。
結論として、すべての証拠が、宿主のeCBシステムと腸内細菌叢の間の双方向のクロストークを指し示している。しかし、この関係には多くの謎が残っており、それを解明するためにはさらなる研究が必要である。さらに、最近、腸内細菌叢が特定のeCBを産生することが明らかになった。このことは、微生物と宿主の相互作用を探る新たな機会を開くとともに、いくつかの新しい治療標的候補を提供する。
胆汁酸
ヒトのコール酸(CA)やチェノデオキシコール酸(CDCA)(ネズミのムリコール酸(MCA)などの一次BAsは、肝臓でコレステロールから合成される両親媒性分子である。128CDCAは、胆汁中に分泌され胆嚢に貯蔵される前に、グリシンまたはタウリンに抱合される可能性がある。食物が摂取されると、BAsは小腸に放出され、食餌性脂肪の消化吸収を補助する。腸内のBAsの約95%は回腸で再吸収され、肝臓に戻され再分泌される。この腸肝循環は1日に数回行われ、高血糖、脂質異常、肥満を防ぐために全身のグルコース、脂質、エネルギーの恒常性を維持し、消化器系および循環器系の炎症性代謝疾患から保護するための重要な生理的メカニズムである。129この非常に効率的なループを抜け出し、大腸に到達するのはごく一部のBAsに過ぎない。これらのBAsはその後、受動的に循環に再吸収されるか、または糞便を介して排泄される。BAsの損失は、de novo肝合成によって補われる。この合成は、ヒトでは小腸でシグナル伝達する線維芽細胞成長因子19(FGF19)によって制御される(げっ歯類ではFGF15)。
BAsの主な機能は、コレステロール、トリグリセリドおよび脂溶性ビタミンの消化・吸収を調節することであるが、近年、BAsがシグナル伝達分子として機能することから、内分泌機能も果たすことが認識されるようになってきている。さらに、BAsはいくつかの受容体を活性化することにより、上皮細胞の増殖、遺伝子発現、脂質、グルコースおよびエネルギー代謝を調節することが明らかにされている。これらの受容体は、ビタミンD受容体130、プレグナンX受容体131、構成的アンドロスタン受容体132、ファルネソイドX受容体およびGタンパク質共役型胆汁酸受容体1(武田Gタンパク質共役型受容体5(TGR5)とも呼ばれる)(図4)である。これらの受容体は、肝臓、腸、筋肉、褐色脂肪組織、中枢・末梢神経系など多数の組織に存在し、シグナル伝達カスケードを仲介して、BA、脂質、糖質の代謝やエネルギー消費、炎症に関わる遺伝子の発現を活性化する。FXRおよびTGR5受容体を介したシグナル伝達は、エネルギーおよび代謝の恒常性の維持に不可欠であることが知られているPYYおよびGLP-1などのGIホルモンの分泌にも関連している(図3および図4)。グルコース、脂質およびエネルギー代謝の制御におけるBAsの役割については、以前にレビューされているので128133 134、ここでは詳細なレビューは省略させてもらう。
一次BAsは、腸管内のあらゆる場所で腸内細菌によって修飾されやすい。この修飾には、胆汁酸塩ヒドロラーゼ(BSH)活性による脱共役(アミノ酸残基の除去)、水酸基の除去(デヒドロキシル化)、酸化(脱水素化)、エピメリゼーションによる更なる代謝が含まれる。135 136この結果、デオキシコール酸、リトコール酸、ウルソデオキシコール酸(ネズミでは一次BAだが、ヒトでは二次BA)などの二次BAが形成されることになる。このようなバクテリアによる代謝は、BAのバイオアベイラビリティと生物活性を変化させ、その結果、BAが関与する代謝反応に影響を与える。137BAsは、そのシグナル伝達能力および腸内細菌叢によって化学的に変換されることから、微生物叢由来のシグナル伝達代謝物とみなすことができる。興味深いことに、BSHは食物摂取後に放出され、腸管に沿って異なる微生物群集に出会うという時空間的パターンが認識される。BSH活性は、小腸に生息する種を含む、系統学的に異なる多くの細菌部門に分布する多種多様な細菌によって実行され得る一方で138、他の反応は、腸の遠位に存在する、より特殊な細菌種に限定されると考えられている。したがって、腸内細菌叢が宿主の代謝に果たす役割を十分に理解するためには、BAsを変換する能力を持つさまざまな細菌の関与を研究することが不可欠である。最近の百寿者を対象とした研究では、百寿者特有の腸内細菌叢の特徴が、加齢に伴う病気や慢性炎症、感染症に対する感受性の低下を、独自の二次的なBAを生成することによって部分的に説明できる可能性が示唆された。このことは、腸内細菌叢の組成を調節することによってBAプールを操作することが、病気と闘うための実行可能な方法であることを示唆している。139
アリール炭化水素受容体:エネルギー代謝、炎症、腸内細菌叢との関連性
アリール炭化水素受容体(AhR)は、脊椎動物の細胞内に遍在しており、リガンド結合後にこの転写因子が活性化される。AhRのリガンドは、環境中のトリガー、栄養由来のシグナル、様々な植物化学物質、トリプトファンなどの細菌の代謝物など、数多く存在している(図2)。AhRがリガンドと結合すると、AhRは核内に移動し、二量体化分子であるAhR nuclear translocatorと結合して、免疫や炎症過程に関わる多くの遺伝子の転写を引き起こす(図3)。細菌の産物や代謝物が活性化因子として重要な役割を果たすことから、過去数年にわたり、AhRと腸内細菌叢の相互作用を解明しようとする報告がなされている(図3,4)。重要なことは、このAhR経路がエネルギー代謝やメタボリックシンドロームにも関連していることである。なぜなら、前臨床および臨床環境において、トリプトファンをAhR結合性誘導体に代謝する能力がメタボリックシンドロームにおいて低下していることが確認されているからである141。141乳酸菌の投与によりAhRリガンドが増加し、腸管バリアの改善や肝脂肪症の軽減と並行して代謝機能が改善されることが示された。天然由来のAhRリガンドであるインディゴは、強力な抗炎症作用を持ち、乳酸菌と重要なバリアサイトカインのインターロイキン(IL)-10およびIL-22をアップレギュレートすることにより、高脂肪食誘発性肥満および代謝障害から保護する。142インドール-3-エタノール、インドール-3-ピルビン酸、インドール-3-アルデヒドなどの微生物トリプトファン代謝物は、ミオシンIIAやエズリンなどのアピカルジャンクション複合体の完全性に影響を与えることによって腸管上皮バリアを保護する。腸内細菌叢が大きく損なわれている疾患である実験的アルコール性肝疾患において144、AhRリガンドの誘導と6-ホルミルインドロ(3,2-b)カルバゾール(Ficz)の投与がアルコール性肝疾患を改善することがわかった。145Caspase recruitment domain family member 9-/-マウスは大腸炎にかかりやすく、その微生物群はトリプトファンをそれぞれの代謝産物に代謝することができない。146この微生物叢を野生型マウスに移植すると大腸炎が増加するが、AhRリガンドを多く含む乳酸菌で処理すると改善される。AhR経路は、セリアック病のような他の炎症性GI疾患にも大きな影響を与える可能性がある。さらに、DQ8を発現する非肥満性糖尿病マウス(ヒトMHCクラスII DQ8のみを持つトランスジェニックマウス)では、高トリプトファン食、大量のAhRリガンドを産生するリモシラクトバチルス・ロイテリ菌による処理、またはAhRリガンドFiczによる処理によってグルテン暴露後の腸の病理が減少する。147無菌マウスは、表皮バリアの分化と修復に障害があり、特にケラチノサイトのAhRを欠くマウスは、皮膚感染症やバリア障害に非常にかかりやすく、特定の細菌群によるコロニー形成でバリアが回復した。このモデルにおいて、腸内細菌が腸-皮膚軸とされる部分でどのような役割を果たすかは、まだ確定されていない。148したがって、AhR経路は、微生物-上皮バリア-代謝および免疫機能の界面における原型的な経路を反映している。
主要な細菌とその特異的な分子
シグナル伝達代謝物の多くは、多数の異なる腸内細菌によって産生されるため、その特異性は限定的である。しかし、様々な細菌が、宿主とユニークな相互作用をする特異的な分子を作ることができる(図2-4)。そのため、特定の毒素を作ったり、多糖類を合成して免疫系を回避したり、宿主に受容体を合成させ、侵入を可能にするような病原体が、非常によく知られている。しかし、最近の研究では、共生する可能性のある腸内細菌に見られる、新しくユニークな宿主シグナル伝達分子が同定された。例えば、バクテロイデス属が産生する免疫調節多糖類やスフィンゴ脂質149150、エンテロコッカス属が形成するムロペプタイド151などが挙げられる。
形成されるユニークな分子の特別なクラスは、同じ種の1つまたはいくつかの株によって遺伝的にコード化されるタンパク質である。いくつかは詳細に研究されており、多くの場合、分泌される際に宿主の受容体と相互作用する可能性のある安定した、あるいは翻訳後修飾されたタンパク質、あるいは細胞外皮に位置するタンパク質が含まれている。これらの中には、プロバイオティクスとしてすでに広く販売されている細菌に由来するものもある。L. acidophilusNCFMは、DC-SIGN受容体にシグナルを送る大型でおそらくグリコシル化した表面層タンパク質を生成し、152L.rhamnosus GGの90 kDaピルスタンパク質SpaCは、プロバイオティクスとして販売されているものである。rhamnosusGGの90kDaのSpaCは、樹状細胞上のDC-SIGN受容体に特異なシグナル伝達能力を持つ部分的にグリコシル化された粘液結合タンパク質であり152153、いくつかのBifidobacterium属に見られる毛巣位置Tadタンパク質は大腸持続性と上皮増殖を促進させる。154 155最近研究されているタンパク質は、大腸菌のカゼイン溶解性プロテアーゼB(ClpB)で、α-メラノサイト刺激ホルモンの抗原模倣体であり、血漿GLP-1とPYY産生の増加を通じて満腹感を増大させる。156ClpBタンパク質は、乳酸菌やビフィズス菌など様々な細菌から部分的に分泌されることが分かっている有名な月見草タンパク質である。しかし、ClpBを産生するHafnia alveiもヒト試験で満腹感をある程度抑制することが判明しており、ClpBの特異性はそれほど高くないのかもしれない。157
A. muciniphilaの生きたまま低温殺菌したものを投与した場合の有効性が、ヒトの臨床試験で証明されていることを考えると、43 118 158A. muciniphilaからシグナル伝達能を持つタンパク質が最近いくつか同定されていることは驚くには当たらない。最近の例では、P9と呼ばれる84 kDaのタンパク質(Amuc_1831遺伝子にコードされている)が、マウスに経口投与したところ、血清GLP-1を誘導することが判明した。In vitroの研究では、P9が細胞間接着分子2受容体と相互作用することが示された。159 160最近発見されたもう一つのタンパク質は、A. muciniphila50 kDa Amuc_1434*タンパク質で、腫瘍壊死因子関連アポトーシス誘導リガンド(TRAIL)を介したアポトーシス経路で、LS174T細胞の生存率を抑制することが見出された161。しかし、これらのタンパク質はいずれもA. muciniphila以外の多くの細菌に存在し、酵素活性を示唆するプロテアーゼとして注釈されており、いずれも細胞外に局在していないことから、その活性に細胞溶解が必要である可能性も否定できない。さらに重要なことは、その安定性である。これは、低温殺菌したA. muciniphila細胞が、ヒトおよびマウスモデルにおいて、生細胞と同等かそれ以上の効果を示したことから、注目されるところである。43 162 163これらの議論はすべて、TLR2にシグナルを送ることが発見されたもうひとつのA.muciniphilaタンパク質には当てはまらない(図4)。163これは、30 kDaのAmuc_1100タンパク質で、Verrucomicrobia以外の他の細菌とほとんど相同性がない外膜タンパク質として定義されており、実際、毛糸関連タンパク質であることが示唆されている。164さらに、Amuc_1100は耐熱性があり、マウスモデルで食事誘発性肥満を防ぐことが示された。1633つのタンパク質の絶対量を比較すると、ムチンによって成長したA. muciniphilaのプロテオームでは、Amuc_1100が他の2つのシグナル候補よりもはるかに多く存在することが明らかであった。165したがって、今後の比較研究によって、ヒトで観察されたA. muciniphilaの活性を説明できるのはどのタンパク質か、またはその組み合わせかを明らかにする必要がある。
新たに発見された分子、健康への影響とそのターゲット
SCFAs、BAs、PAMPs、腸管ペプチド(GLP-1、PYY)など、宿主代謝、腸管バリア、炎症の調節因子として知られている分子以外に、「エンテロシン」という新しい分子群の役割が浮かび上がってきている。エンテロシンという概念は最近導入され、「腸神経系(ENS)を標的として十二指腸の収縮を調節する能力を持つ、腸に由来する分子」と定義されている。エンテロシンは、化学的に多様であり、ホルモン、生理活性ペプチド/脂質、栄養素、微生物叢および免疫因子に関連することがある」。166
この概念は、2型糖尿病患者がグルコースの吸収を促進し、高血糖を引き起こす十二指腸の運動機能亢進を特徴とする、という観察に基づいている。166 167十二指腸の収縮は視床下部によって感知され167-170、糖尿病の間は十二指腸運動亢進が脳への異常な求心性神経メッセージを作り出すことが証明されている。169 171逆に、ENSニューロンへの作用により十二指腸の自然な収縮を回復させると、腸脳軸が回復し、インスリン感受性が改善される。166
腸内細菌、脳機能、糖代謝の関連は、この分野の研究においてホットトピックとなっており、ENSの役割は、糖尿病などの疾患に取り組むための新しいターゲットとして浮上した。メタボリックシンドロームの緩和を目的として、プロバイオティクス、プレバイオティクス、糞便移植など、腸内細菌叢を調節する戦略について様々な論文が発表されているが、エンテロシンなどの腸内細菌の特徴について述べているものはほとんどない(ないとは言い切れない)。
糖代謝に関与する新規の腸管分子や受容体を求めて、腸内細菌叢を変化させ糖尿病を改善することが知られている特定の繊維の作用について検討した。オリゴフルクトースの投与により、腸管神経細胞の活動を制御して十二指腸収縮頻度を低下させた。その結果、高血糖が抑制され、糖尿病マウスの脂肪組織における炎症マーカーが減少した。170リピドミクス解析により、このオリゴフルクトース摂取が、大腸細胞内の腸管生理活性脂質(12-ヒドロキシエイコサテトラエン酸(12-HETE)の存在量を選択的に増加させることが明らかになった。驚くべきことに、糖尿病マウスに12-HETEを投与すると、糖代謝が改善された。12-HETEの効果は、生体外でも確認された。さらに、この生理活性脂質が十二指腸の収縮力に作用する分子メカニズムは、ミューオピオイド受容体(MOR)(エンケファリンによって活性化される)およびPPARγの存在に依存していることを発見した。前臨床試験で得られた知見は、糖尿病患者の十二指腸において、健常者と比較して12-HETEレベルが低下し、プロエンケファリンおよびMORの発現が減少していることを示すヒトのデータによって裏付けられた。170
IBDに対するサプリメントを用いた様々なアプローチにより、抗炎症作用を有する新たな生理活性脂質が同定された。172大腸炎治療のプロバイオティクスとして販売されている、よく研究されている大腸菌Nissle1917株(EcN)の質量分析を利用し、3-hydroxyoctadecaenoic acid(C18-3OH)濃度が上昇していることを発見した。C18-3OHを経口投与すると、大腸炎が減少することを発見したのである。腸内細菌叢に存在する他の細菌がC18-3OHを産生するかどうかを調べるため、オリゴフルクトースを用いて腸内細菌叢を調節したところ、C18-3OHの産生が確認された。著者らは、オリゴフルクトースの抗炎症作用が、大腸のC18-3OH濃度の上昇に関連していることを見出した。最後に、この生理活性脂質を産生する特定のバクテリアを同定し、C18-3OHがPPARγを活性化することによって作用することを発見した。172
これら2つの例を総合すると、腸内細菌叢は、代謝や炎症の制御に関わる宿主の受容体(図3)に作用する、推定上の多数の生理活性化合物(図2)の供給源であることがわかる。
健康にとって望ましい代謝物もあれば、有害な代謝物もあるが、その根拠は関連研究や動物実験に由来するものばかりである。最近、悪影響を及ぼす代謝物として、糖化最終生成物(AGE)であるフルクトセリン、トリメチルアミンN-オキシド(TMAO)、イミダゾールプロピオン酸(IMP)の3つが研究対象になっている。
AGEsは、タンパク質やアミノ酸の遊離アミノ基が還元糖と反応し、熱処理によって食品中に生成されるメイラード反応生成物で、生物学的利用能の低い化合物を形成する。AGEsの受容体の活性化による炎症反応の促進、173 174腸管伝染性の上昇(AGEsと大腸上皮の相互作用の増大)、その結果としての細菌毒素の全身循環への流出などが、一連のメカニズム証拠から明らかにされている。175フルクトセリシンはリジンとグルコースから生成されるアマドリ産物で、主要な食餌性AGEsの一つである。以前の研究では、大腸菌はフルクトースエリシンを呼吸する能力を持っていることが示されていた176。176しかし、最近の研究では、Intestinimonas属の細菌が新規の経路で酪酸に変換することが明らかになった。また、フルクトースエリシンを分解する能力は、実験的および計算機的に、母乳栄養児ではなく、粉ミルク栄養児にのみ観察された。これは、熱処理後の粉ミルクにこの化合物が多く含まれていることと関係があるかもしれない。177フルクトースエリシンやその他のAGEsが2型糖尿病やその他の疾患とどのような因果関係があるのか、またその変換に腸内細菌が関与しているのかについては、さらなる研究が必要であると思われる。最近の研究では、もう一つの主要なAGEであるN-ε-カルボキシメチルリジンがCloacibacillus属やOscillibacter属によって完全に利用されることも報告されている178。
TMAOは、野菜、果物、肉、魚介類によく含まれ、細菌の浸透保護剤として知られるベタイン、コリン、L-カルニチンなどの第四級アミンの摂取に関連している。179 180Proteobacteriaを含むいくつかの腸内細菌は、TMAリアーゼとその活性化酵素(CutCD)を介して、これらの第四級アンモニウムイオンをアセトアルデヒドとトリメチルアミン(TMA)に変換することができる。TMAはその後、血流に入り、肝臓のフラビンモノオキシゲナーゼによってTMAOに変換される可能性がある。最近の研究では、血清中のTMAOが動脈硬化および心血管疾患リスクと強く関連していることが示されている。181さらに、TMAOは、マウスモデルにおいて動脈硬化性プラークの形成を促進することが示されている。182さらに、TMAOは一般的な尿毒症の毒素である。183したがって、これらの第四級アンモニウムイオンを、TMAや他のTMAO前駆体につながらない化合物に代謝することを理解することに、大きな関心が持たれている。Eubacterium limosumとその近縁の腸内細菌E. maltosivoransの生化学的および経路解析から、細菌細胞区画を含む新しいプロセスでベタインおよび他の第四級アミンを脱アミノ化し、酢酸および酪酸を生成することが明らかになり、新しい知見が得られている。184-186後者の細菌は非常に近縁で、独自のビタミンB12依存性代謝経路を持つように見えるが、これはIMPの生産につながる可能性があるヒスチジンの代謝には当てはまらない。2型糖尿病患者の血清中では、IMPの濃度が上昇していることが示されている187。187最近、腸内細菌がヒスチジンからIMPを産生し、mammalian target of rapamycin complex 1依存経路を通じてインスリンシグナルと耐糖能に障害を与えることが明らかになった。188Streptococcus mutansとEggerthella lentaという無関係な2つの細菌がIMP産生菌として同定されており、多くの代謝物が、系統的な関係を持たない複数の腸内細菌群によって産生されているという事実が確認されている。これらの例から、望ましくない化合物の生成に腸内細菌が関与していることがわかるが、これらを無毒化し、さらには酪酸のような有益なシグナル伝達能を持つ生成物に変換する新しい嫌気性細菌も確認された(図2および3)。
総論と展望
この20年間で、かなりの進展があった。初期の臨床観察から、より機械的なアプローチへと、腸内細菌叢と健康の分野は、反論の余地のない因果関係へと発展しつつある。しかし、実際には相関関係しか証明されていないのに、因果関係を主張する研究がまだ数多く存在する。相関関係から因果関係への移行は、腸内細菌叢の調節に基づく、あるいは特定の活性化合物の使用による推定介入策をより良く設計するために、重要かつ必要なステップであり続けている。多くの努力とオミックス解析の進歩により、科学界は徐々に個別化医療へと向かいつつあり、マイクロバイオーム時代は明らかに、将来の医療と栄養アプローチにおけるパラダイムシフトの重要な部分となっている。
脚注
ツイッターマティアス_ヴァンホル、@MicrObesity
WMdV、HT、MVH、PDCは等しく貢献した。
訂正のお知らせ本記事はOnline First掲載後に修正されたものである。図3が拡大された。
寄稿者PDCは、原稿の全体的な内容の構想に関する提案書を作成した。PDC、HT、WMdV、MVHは提案書を修正、訂正、承認した。PDC、HT、WMdV、MVHは、内容の収集、主要文献の選択、原稿の執筆、批評を行った。PDCとMVHは図表を作成した。PDC、HT、WMdV、MVHは、いずれも最終版の原稿を修正した。PDC、HT、WMdV、MVHは、この論文に等しく貢献した。
資金提供PDCはFRS-FNRS(Fonds de la Recherche Scientifique)の研究ディレクターであり、FNRSからの助成金を受けている(Projet de Recherche PDR-convention.FNRS-T003021、CDR-convention.CDR-convention.FNRS-T003021)。FNRS T.0030.21、CDR-convention:J.0027.22、Frfs-welbio:WELBIO-CR-2017C-02E,WELBIO-CR-2019C-02R,EOS: program no.30770923、EOSプログラムNo.40007505).WMDVはオランダ科学研究機構のSIAM Gravitation Grant(024.002.002)の支援を受けている。HTは、オーストリア交通・イノベーション・技術省、オーストリアデジタル・経済省、チロル州、ザルツブルク州、ウィーン州から資金提供を受けた研究開発Kセンター(COMETプログラム-Competence Centers for Excellent Technologies)であるExcellence Initiative VASCage(Centre for Promoting Vascular Health in the Ageing Community)の支援を受けている。
競合する利益PDCとWMdVは、代謝異常の治療におけるAkkermansia muciniphilaおよびその成分の使用に関する特許出願の発明者である。PDCとWMdVは、A-Mansia Biotechの共同設立者である。PDCはEnterosysの共同設立者である。WMdVはCaelus Healthの共同設立者であり、Eubacterium halliiの使用に関する特許の発明者である。
証明とピアレビュー受託研究、内部査読あり。