Potential therapeutic roles of retinoids for prevention of neuroinflammation and neurodegeneration in Alzheimer’s disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6676868/
要旨
天然および合成のいずれのレチノイドも、レチノイン酸受容体およびレチノイドX受容体のような特定の核内受容体を使用して、細胞内の特定のシグナル伝達経路を活性化する。レチノイン酸シグナル伝達は、中枢神経系において極めて重要である。
レチノイン酸シグナル伝達経路の障害は、中枢神経系、特に成人脳において重篤な病理学的プロセスを引き起こす。レチノイドは、神経のパターニング、分化、正常な発生における軸索の伸長、および脳の機能において主要な役割を果たしている。レチノイン酸シグナル伝達の障害は、神経炎症、酸化ストレス、ミトコンドリアの機能不全、神経変性を引き起こし、進行性アルツハイマー病を引き起こす。
アルツハイマー病は、高齢者の認知症や記憶喪失の最も一般的な原因である。不活性なコリン作動性神経伝達がアルツハイマー病患者の認知障害の原因となっている。マウスにおけるレチノイン酸の欠乏または剥奪は、空間学習および記憶の喪失と関連している。レチノイドは、アルツハイマー病で活性化されるミクログリアおよびアストロサイトにおけるケモカインおよび神経炎症性サイトカインの発現を阻害する。レチノイン酸受容体やレチノイドX受容体を刺激することで、アミロイドの蓄積が遅くなり、神経変性が抑制され、マウスのアルツハイマー病の発症を防ぐことができる。
本稿では、天然および合成レチノイドの化学と生化学、アルツハイマー病の神経炎症や神経変性を予防するレチノイドの可能性について述べた。
キーワード
アルツハイマー病、アミロイドプラーク、神経原線維性血管障害、神経炎症、神経変性、レチノイド
序論
レチノイドは、ビタミンAの天然および合成誘導体であり、これらの化合物は、ヒトの脳の発達および正常な機能において重要な役割を果たすことが知られているため、脳の健康および疾患において顕著である(Das er al)。 そこで、既知および新規のレチノイドの化学および生化学を理解し、脳疾患、特にアルツハイマー病の治療へのそれらの潜在的な治療的応用に大きな関心が寄せられている。ビタミンA代謝物であるレチノイン酸(RA)は、核内受容体スーパーファミリーの受容体に結合し、細胞内の多くの遺伝子の発現を制御する能力を持っているため、生理機能のほとんどを担っている(Lerner et al 2012)。レチノイドは、酵素、神経伝達物質輸送体や受容体、転写因子、細胞表面受容体、神経ペプチドホルモンをコードする多くの遺伝子の発現を調節する能力があると高く評価されている(Goodman, 2006)。レチノイドは、レチノイン酸受容体(RARα、β、γ)やレチノイドX受容体(RXRα、β、γ)などのレチノイド受容体との相互作用を介して標的遺伝子の転写を行うが、これらの受容体は、それ自体が転写調節因子であり、脳の扁桃体、前頭前野、海馬領域で高度に発現していることが知られている(Goodman and Pardee, 2003)。核内受容体の特定のDNA部位への結合は、標的遺伝子の発現を抑制または活性化する(Khorasanizadeh and Rastinejad, 2001)。RAおよびその受容体の機能的応答は、多くの共活性化因子および共抑制因子によって調節される(Jenster, 1998; Xu et al 1999)。共活性化因子および共抑制因子は、クロマチンを修飾し、および/または標的遺伝子の転写を調節するための典型的な転写機械と相互作用する(Lee et al 2001)。
RARβおよびRXRγ遺伝子のレチノイド欠損または変異は、動物における空間学習および記憶の阻害、ならびにうつ病の発症と関連していることが知られている。ビタミンAを摂取しないラットでRARαの発現を抑制すると、脳血管内にアミロイドβ(アミロイドβ)ペプチドが沈着することが研究で明らかになった(Shudo er al)。 レチノイドは、神経保護を提供するための神経炎症反応の予防に重要な役割を有する(Lee et al 2009)。レチノイドは、ミクログリアにおけるサイトカインおよび炎症性分子の発現をダウンレギュレートすることが知られている(Goncalves et al 2013)。レチノイド受容体のアゴニストは、コリンアセチルトランスフェラーゼ遺伝子および小胞体アセチルコリントランスポーター遺伝子の発現を増加させ、コリン性神経伝達を増強する(Mufson et al 2008)。
現在では、通常65歳以上の高齢者がアルツハイマー病患者であることが広く知られている。加齢はアルツハイマー病発症の主要な危険因子である。現在、アルツハイマー病は世界で1500万人以上が罹患している最も一般的な神経変性疾患である(Andreeva et al 2017)。アルツハイマー病の人口動態は世界的に急速に拡大している。臨床観察では、アルツハイマー病と認知症および記憶喪失との関連性がしっかりと示されている。神経病理学的には、アルツハイマー病は、脳の側頭葉におけるアミロイド斑の神経外蓄積と神経内神経原線維のもつれを特徴とする。アミロイド斑はアミロイドβペプチドの凝集体であるのに対し、神経原線維絡みは高リン酸化タウタンパク質である(Querfurth and LaFerla, 2010)。これらのタンパク質の凝集体の蓄積は、神経炎症、酸化ストレス、ミトコンドリア損傷を誘発し、神経細胞だけでなく、脳内の白質の喪失にもつながる。新たな証拠は、アルツハイマー病の病理は、異常なアミロイドβとタウタンパク質の間の複雑な相互作用に起因する可能性があることを示唆している(図1)。アルツハイマー病の「アミロイド仮説」によれば、脳内のニューロンの細胞外空間におけるアミロイドβ凝集体の蓄積が、アルツハイマー病患者の神経変性および認知機能低下の病因を駆動する主な原因である(Hardy and Allsop, 1991; Musiek and Holtzman, 2015)。アミロイド仮説の強さは、アルツハイマー病における遺伝的欠陥との整合性にあるが、アルツハイマー病におけるいくつかの重要な問題を説明する上で欠陥がある。アミロイドβを標的にしてアルツハイマー病を治療するための薬剤を開発しようとする試みはすべて失敗に終わっている(Karran and De Strooper, 2016)。一方、アルツハイマー病の「タウ仮説」では、タウタンパク質の過剰なリン酸化が神経原線維のもつれの形成とアルツハイマー病の進行の主な要因であるとしている(Kametani and Hasegawa, 2018)。アミロイド仮説の主な弱点は、アミロイドプラークをアルツハイマー病の神経変性のためのタングル形成に結びつける生化学的経路を決定的に特定できないことである(Götz et al 2004;Eriksen and Janus 2007)。アルツハイマー病における病態については他にも多くの仮説があり、これらの仮説に基づく多くの薬剤がアルツハイマー病治療のために開発されている(Du er al)。 アルツハイマー病は多面的な疾患であるため、アルツハイマー病の治療を成功させるためには、複数の治療作用を有する薬剤の開発や、多様な活性を有する薬剤の組み合わせによる病態抑制作用を有する薬剤の開発が必要であることが明らかになってきている。
図1 アルツハイマー病における異常なアミロイドβ(アミロイドβ)とタウタンパク質の複合的な相互作用による神経炎症と神経変性を模式的に示したもの
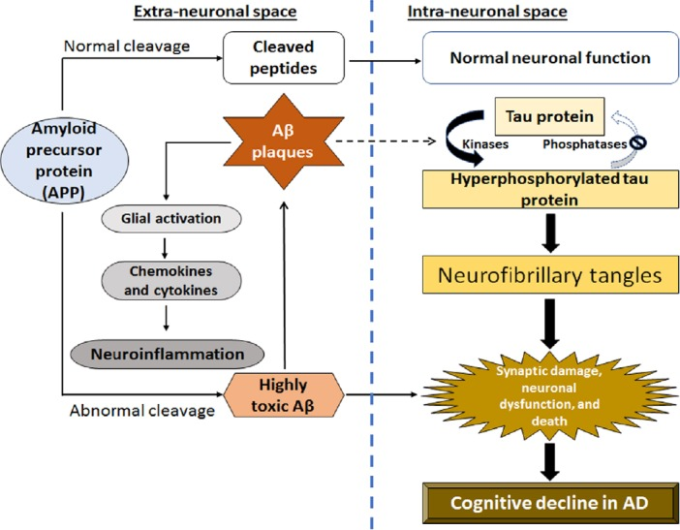
アミロイドβは神経細胞外のプラークに集積し、異常なタウ蛋白質は神経細胞内で空間学習や記憶に関わる脳の特定領域に集積する。アミロイドβプラークの蓄積が顕著になった後、異常なタウ蛋白質は脳全体に急速に広がり、重大な神経炎症、神経変性、認知障害を引き起こす。
本総説では、アルツハイマー病における神経炎症や神経変性の予防のための天然および合成レチノイドの複数の治療的役割について述べている。レチノイドに関する新規かつ革新的な研究アイデアを推進することで、次世代の研究者が新たな多能性レチノイドを設計・合成し、将来的にアルツハイマー病患者の病態予防のための強力な治療薬として使用できるようになることを期待している。
天然・合成レチノイドの化学と生化学
レチノイドが胚性および出生後早期の脳の発達および機能において重要な役割を果たすことは以前から知られている(Jiang et al 2012;Cunningham and Duester 2015;Bonney et al 2018)。しかし、増加する証拠の体は、レチノイドシグナル伝達も成体脳の機能において重要な役割を果たしていることを示している(Lane and Bailey, 2005; Kour and Rath, 2016; Mishra et al 2018)。ビタミンA(レチノール)は、脳の正常な機能だけでなく、胚発生、細胞分化、細胞増殖、アポトーシスなどの多くの生物学的プロセスを調節する最も多機能な天然レチノイドである(Khillan, 2014)。レチノールは、一般に、多くのカラフルな果物や野菜、または肝臓、卵黄、または乳製品などの動物性のソースから供給されるプロビタミンAカロテノイドから生産される。カロテノイドは動物の小腸でビタミンA(レチノール)に変換される。多くの光合成植物、細菌、一部の菌類は、プロビタミンAカロテノイドを生合成する能力を持っている。しかし、動物は、体内にビタミンAを蓄積するために、カロテノイドを食事源から消費しなければならない(WeberおよびGrune 2012;GreeenおよびFascetti 2016)。
レチノイドは、ビタミンAに関連する化合物のグループであり、その天然および合成誘導体を含み、4つのイソプレノイド単位がヘッド・トゥ・テール的に結合したものである。レチノイドはレチノイドを定義する基本的な化学構造を持っている(図2)。レチノイドは、酸化剤、光または過度の熱の存在下で容易に酸化および/または異性化を受ける共役二重結合の存在により不安定である。アルコール基とカルボン酸基を含むレチノイドはメタノールとエタノールに可溶であるが、エステル化された長鎖脂肪酸はアルコールにはわずかにしか溶けないが、ヘキサンには非常によく溶ける。疫学研究は、プロビタミンAカロテノイドのより高い食事摂取量が、アルツハイマー病を含む多くの脳疾患の低リスクと関連しているという仮説への支持を貸す(Li et al 2012;FiedorおよびBurda 2014;Lakey-Beitia et al 2017;Yang et al 2017)。ビタミンAはまた、視覚のチューニングを効果的に増加させ、加齢黄斑変性を予防する(Cheung and Eaton, 2013; Harrison, 2019)。カロテノイド前駆体と天然レチノイドの化学構造は、比較的長い鎖共役ポリエンを含んでいる(図3)。カロテノイドおよびレチノイドは、450nm付近の可視スペクトルおよび紫外スペクトルの光を吸収し、325〜380nmのレイジ内でそれぞれ吸収する共役ポリエン系で構成されている(Furr, 2004)。カロテノイドやレチノイドの推定には比色法が一般的に用いられている。
図2 天然のレチノイドであるレチノイン酸(RA)の基本的な化学構造と異なる部分について
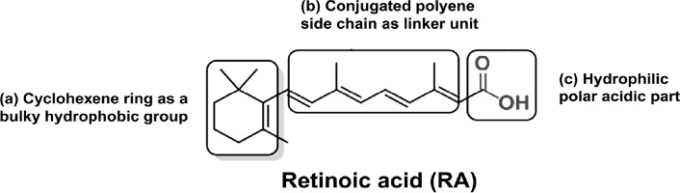
レチノイドの化学構造は3つの部分から成り立っている。(a)嵩高い疎水性基として働くトリメチル化シクロヘキセン環、(b)リンカー単位として働く共役テトラエン側鎖、(c)極性炭素-酸素官能基を持つ親水性の代表的なカルボン酸部分である。レチノイド」という言葉には、ビタミンAの内因性(天然に存在するもの)のものと、合成誘導体の大群が含まれているだけである。
図3 天然のカロテノイドとレチノイドの化学構造
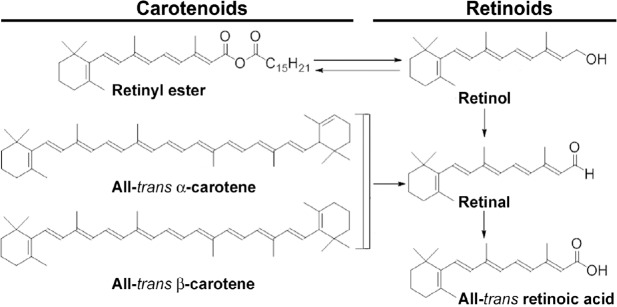
カロテノイドの前駆体はビタミンAの前駆体で、濃色野菜や黄色野菜、ニンジン、果物などの植物性食品に含まれている。天然レチノイドは、ビタミンA(レチノール)の化学的誘導体である。天然レチノイドは、肝臓、腎臓、卵、乳製品などの動物性食品に含まれている。
レチノイドの化学合成には、多くの研究がWittig反応を用いて酢酸レチニルとRAのエチルエステルを合成している(Maercker, 1965)。しかし、Wittig反応は主にシス異性体を合成するが、天然のレチノイドではトランスオレフィン結合が最も頻繁に観察される。過去数十年の間に、Wittigオレフィン化に代わる多くの改良や代替法が発明されていた。ホナー・ワッズワース・エモンズ修飾では、ホスホニウム塩をホスホネートエステルで置換することで、トランスまたはE-オレフィンが生成された。つの研究者グループ(Julia and Arnould, 1973; Koch and Gartner, 1997)は、レチノイド合成において同様のオレフィン化技術を採用した。最近、研究者たちは、古典的な拡張ポリエン鎖なしで完全に機能するレチノイド受容体アゴニストを開発することができることを示している。オール-トランス-レチノイン酸(ATRA)やシス-RA(これらはCyp26やイソメラーゼなどの多くの細胞質酵素によって代謝される)の毒性プロファイルやオフターゲット結合が問題となっており、新規薬理学的薬剤としての潜在能力が十分に活用されなかった。これらの問題を克服するために、合成化学のコミュニティは、SAR(構造活性関係)解析と計算モデルを用いて、多くの合成レチノイドを開発してきた(Altucci er al)。
創薬プロセスおよびシグナル伝達経路におけるいくつかの天然および合成レチノイドにスポットを当てた多くの優れたレビューおよび研究論文が発表されている(Kagechika and Shudo, 2005; Das et al 2014; Haffez et al 2018; Chisholm et al 2019)。現在、臨床薬として使用されている主要な合成レチノイドはいくつかある(図4)。臨床的には、イソトレチノイン(13-シス-RA)は、イソトレチノイン治療中に正常範囲内である血液学的パラメータにいくつかの変化が生じるが、尋常性にきびの治療に最も効果的な薬剤である(Gencoglan et al 2018)。イソトレチノイン治療は忍容性が高く、不妊症の男性の精子生産を改善した(Amory et al 2017)。フェンレチニドまたはN-(4-ヒドロキシフェニル)レチナミドは、臨床で抗がん剤として開発されている(Cooper et al 2017)。耐容性の高いベキサロテン単剤療法は、皮膚T細胞リンパ腫に有効であり(濱田 et al 2017)また、末梢性T細胞リンパ腫患者にも有効性を示している(Farhan et al 2019)。R667(0.2-1mg)の16日間までの多回投与は、肺気腫患者において良好な忍容性を示した(Chiu et al 2007)。タザロテンは、プラーク性乾癬に対して非常に効果的な治療薬であり、12週間の治療後にプラーク上昇およびスケーリングが有意に減少した(Tanghetti et al 2018)。その有効性および忍容性は、外用コルチコステロイドとの併用により、さらに向上させることができる。タザロテンとハロベタソールの組み合わせの新しい外用剤形は、プラーク性乾癬の最適な管理戦略を提供するように思われる(Tanghetti et al 2018)。5年間の臨床試験は、最終的には、その様々な医薬製剤中のアダパレンが、尋常性にきびに対する現在の治療法に重要な付加物であることを確立した(Millikan, 2001)。私たちの研究グループは、ボロレチノイドの合成に成功しており、そのうちのいくつかは前臨床試験で使用されている(Zhong er al)。
図4 臨床薬として使用される主要な合成レチノイドの化学構造をいくつか紹介する
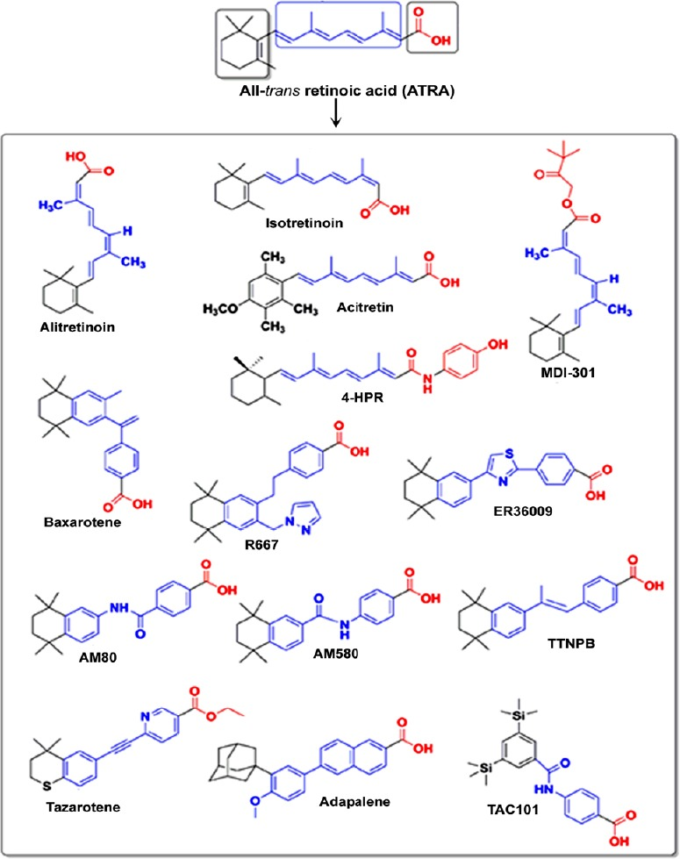
合成レチノイドは、臨床で高い治療効果を得て副作用をなくすことを目的に、全トランスレチノイン酸(ATRA)から製造されている。米国で臨床使用が承認された最初の経口投与合成レチノイドは、13-シス-レチノイン酸(イソトレチノイン)であった。黒は疎水性基、青はリンカー単位、赤は極性炭素-酸素官能基を示す。
天然および合成レチノイドの両方が、中枢神経系(CNS)の傷害および疾患における機能的な神経保護のために広範囲に研究されている(Mey, 2006; Chakrabarti et al 2016)。RAの生合成のプロセスは、レチノールのレチナールへの変換、またはレチナール自体の変換のいずれかから始まる(図5)。ビタミンAとしても知られるレチノールは、食物源から得られる(Sommer and Vyas, 2012)。RAは、2つの酸化ステップによってレチノールから生合成されなければならない。レチノールは、レチノール脱水素酵素の作用とNAD+のNADHへの変換を介してレチノールに変換される(Lidén and Eriksson, 2006; Hong er al)。 網膜から、RAは次の酸化ステップで生合成される。この生合成反応は、網膜アルデヒド脱水素酵素(RALHDまたはALDH)として知られる酵素を必要とし、一般的な酵素はALDH1A1-3およびALDH8である(Duester,2008;Kedishvili,2016)。細胞質において、レチノールは細胞性レチノール結合タンパク質(CRBPs)に結合し、一方、RAは細胞性RA結合タンパク質(CRABPs)に結合する(Napoli, 2017)。CRBPは2つのクラス(CRBP type IおよびII)に分かれており、同様にCRABPも2つのクラス(CRABP type Iおよびtype II)に分かれており、類似しているがアミノ酸配列およびリガンド結合が異なるRARおよびRXRにRAを運ぶ。キャリアタンパク質CRBPsはレチノールの輸送と代謝に関与し、CRABPは多くのRAシグナル伝達経路の調節と核内受容体へのRAの利用可能化に関与している(Zhang et al 2012)。
図5 細胞内でレチノイン酸(RA)を生合成するための出発物質としてビタミンA(レチノール)が使用されている
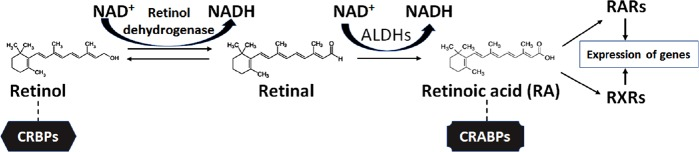
細胞質では、レチノールは細胞内のレチノール結合タンパク質(CRBP)と結合して移動し、代謝に関与しているが、RAは細胞内のRA結合タンパク質(CRABP)と結合して移動し、多くのシグナル伝達経路を制御している。また、RAはCRABPsの助けを借りて核内受容体(RARsやRXRs)に移動し、特定の遺伝子を発現させることができる。RARs.レチノイン酸受容体;RXRs:レチノイドX受容体。
アミロイドベータオリゴマーの神経細胞外での増加とアルツハイマー病の病因を導くアミロイドベータ疫病の蓄積
脳内のニューロンへの情報伝達には、一定量のアミロイドβが必要である。新たなエビデンスは、融合後の膜の回復から、融合と神経伝達物質の放出のためのシナプス小胞のトラフィッキング、ドッキング、プライミングまで、シナプス小胞サイクルの様々な段階でのアミロイドβの生理的機能と病理学的機能の両方を示している(Ovsepian et al 2018)。軸索末端における神経伝達物質の貯蔵および放出のメカニズムは、広く知られているシナプス小胞サイクルの仮説(Südhof, 1995)にまとめられており、これはアミロイドβ産生の主要な部位でもある(Müller et al 2017)。(i)神経細胞の活動がアミロイドβの形成を誘発し、(ii)アミロイドβの増加が興奮性シナプス伝達の減少を引き起こすという2つの知見(Kamenetz et al 2003)は、アミロイドβが通常負のフィードバックシグナル伝達経路として機能し、シナプス活動の増加がアミロイド前駆体タンパク質(APP)のアミロイドβへの処理を増加させ、シナプス活動を低下させるという仮説につながった(Venkitaramani et al 2007)。最近の報告では、アミロイドβの異なるアイソフォーム、濃度、および凝集状態が、シナプス機能および機能不全に異なる影響を与える可能性があることが示唆されている(Gulisano et al 2018)。内因性アミロイドβの阻害は、シナプス可塑性および記憶を損なうことから、このペプチドが脳の健全な機能に不可欠であることを強く示唆している。しかし、オリゴマー性アミロイドβの増加は、アルツハイマー病の病因の最も早い兆候であるシナプス機能不全と関連している。
現在、アルツハイマー病の主要な病理組織学的特徴は、脳の異なる領域(扁桃体実質、海馬、大脳新皮質)におけるアミロイドβペプチドの凝集からなるアミロイド斑の蓄積であることが広く知られている(Reiss et al 2018)。APPのプロテオリシスは、2つの異なる経路におけるα-、β-およびγ-セクレターゼの選択的な作用によって起こり得る(図6)。APPの非アミロイド原性切断は細胞表面で起こり、APPの内部化およびそのアミロイド原性処理は、アミロイドβの産生、放出およびオリゴマー化をもたらす一方で、APPの非アミロイド原性切断は細胞表面で起こる。アミロイドβペプチドは、36〜43個のアミノ酸を含んでいてもよいが、APPから産生される。アミロイドβペプチドは、APPの膜貫通ドメインおよび細胞外ドメインの一部であり、695,751,および770アミノ酸のいくつかのアイソフォームとして生じる。APPタンパク質分解の非アミロイド性(正常)経路では、α-セクレターゼを用いてAPPαと呼ばれるN末端フラグメントと膜結合したC末端フラグメントαが生成され、神経保護的なAPPαはシナプス形成、神経突起の伸長、神経細胞の生存を促進する役割を果たしていると考えられる。膜中では、C末端フラグメントαはγ-セクレターゼによって切断され、可溶性のN末端フラグメント(p3)と膜結合したC末端フラグメント(APP細胞内ドメイン(AICD)と呼ばれる)が得られる。AICDの機能には、転写調節を介した核内シグナル伝達や、異なるタンパク質との関連付け能力を介した軸索輸送が含まれている可能性がある。APPタンパク質分解のアミロイド原性(異常)経路は、β-セクレターゼを用いて、APPβと呼ばれるN末端断片と膜結合したC末端断片βを生成した後、C末端断片βをγ-セクレターゼで切断し、可溶性のN末端断片(アミロイドβ)と膜結合したC末端断片(AICD)を従来通り生成する。特筆すべきは、アミロイドβは神経細胞の機能に必要とされるが、細胞外空間に蓄積されることにより、脳内にアミロイドβプラークを形成する凝集を引き起こすことである。アミロイドβが神経細胞やシナプス機能に及ぼす悪影響は、最終的にアルツハイマー病の神経変性を引き起こす。
図6 2つの異なる経路でのアミロイド前駆体タンパク質(APP)のタンパク質分解とアルツハイマー病脳の神経変性におけるアミロイドβ(アミロイドβ)プラークの役割
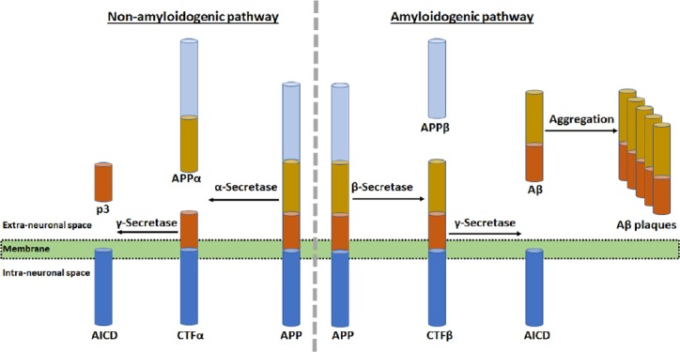
APPのタンパク質分解の非アミロイド原性(正常)経路は、N末端フラグメント(APPαと呼ばれる)と膜結合C末端フラグメントα(CTFα)を生成する。その後、膜中でCTFαが切断され、可溶性のN末端フラグメント(p3)と膜結合したC末端フラグメント(APP細胞内ドメイン(AICD)と呼ばれる)が得られる。APPタンパク質分解のアミロイド原性(異常)経路は、N末端フラグメント(APPβと呼ばれる)と膜結合C末端フラグメントβ(CTFβ)を産生する。その後、CTFβが切断され、以前と同様に可溶性のN末端断片(アミロイドβ)と膜結合C末端断片(AICD)が生成される。細胞外空間でのアミロイドβの蓄積は、その凝集を引き起こし、脳内にアミロイドβプラークを形成する。
2つの異なる経路でのAPPの処理とその代謝物の理解は、アルツハイマー病のための新しい治療法の開発に不可欠である(O’Brien and Wong, 2011)。最近の多くの研究により、APPの処理制御だけでなく、APPとその代謝物の生理的・病理学的機能も明らかになってきている(Zhang et al 2011, 2012)。非アミロイド生成経路は、α-およびγ-セクレターゼを利用してペプチドを生成し、有用な神経栄養作用を提供する(Allinson et al 2003; Haass et al 2012)。対照的に、アミロイド原性経路は、β-およびγ-セクレターゼを用いて、アミロイドβペプチドを産生する(Sinha et al 1999;Franchiss et al 2002)。産生されたアミロイドβペプチドは、蓄積および凝集を起こしやすい。アミロイド原性経路を介して優勢に産生されるアミロイドβペプチドは、40残基の長さ(アミロイドβ1〜40またはアミロイドβ40)であり、アミロイドβ40のモノマーは無毒である。わずかな割合のアミロイドβペプチドは、長さ42残基を含む(アミロイドβ1-42またはアミロイドβ42)。アミロイドβ42の血漿レベルの増加は、アルツハイマー病の発生と相関している(Mayeu et al 1999)。アミロイドβ42は2つのアミノ酸を余分に持っているため、それは、アルツハイマー病の病因に寄与する神経毒性アミロイド沈着物の形成につながる可能性のあるミスフォールディングと凝集のより大きな傾向を持っている(Ahmed er al)。 凝集したアミロイドβ42ペプチドの蓄積につながる合成・処理・クリアランスの異常がアルツハイマー病の出発点であると考えられてたが、これまでの研究では、アミロイドβ42ペプチドの合成・処理・クリアランスの異常がアルツハイマー病の出発点であると考えられてた。以前は、アミロイドβ42プラークの蓄積が神経原線維のもつれの形成を促進し、最終的には神経細胞死に至ることが示唆されていたが、現在では、アミロイドβの蓄積ではなく、可溶性のアミロイドβが認知症に関係していることが明らかになっている(Nimmrich and Ebert, 2009)。可溶性アミロイドβオリゴマーはシナプス機能を特異的に阻害し、アルツハイマー病の神経病理と関連している(Lesné et al 2013)。アミロイドβオリゴマーは神経細胞死を誘発しないことが知られているが、シナプス機能障害の延長は、最終的には、アルツハイマー病脳内の記憶をエンコードし、検索する能力を廃止したシナプスの変性を引き起こす。シナプス機能不全におけるアミロイドβ42の暗示は、アルツハイマー病における治療的介入のための新たなターゲットを提供する可能性がある(Marsh and Alifragis, 2018)。
アルツハイマー病における病態形成のための神経原線維絡みの神経内形成
神経原線維性頻脈は、高リン酸化タウタンパク質の凝集体であり、現在最も広くアルツハイマー病の主要マーカーと考えられている(Kolarova et al 2012;Sierra-Fonseca and Gosselink 2018)。しかしながら、神経原線維性のもつれが形成される前に神経細胞の有意な損失が起こり、神経原線維性のもつれが神経細胞の損失のわずかな量(約8%)を占めることが実証されている(Kril et al 2002)。神経原線維性もつれ負荷の増加のみが、アルツハイマー病患者の重症度と慢性的な攻撃性と関連している(Lai et al 2010)。ニューロンのアーキテクチャをサポートすることに加えて、微小管は、ニューロン内の栄養素、分子、および情報を追跡し、効率的に輸送することが知られている(Dent and Baas, 2014)。繊維状タンパク質のタウは、微小管の安定性を維持する役割を担っている(Feinstein and Wilson, 2005)。タウタンパク質の糸は、グリコーゲン合成酵素キナーゼ3やp70 S6キナーゼなどのキナーゼによる過リン酸化により、絡まったりねじれたりするため、微小管が不安定になって崩壊し、アルツハイマー病患者のニューロン輸送系全体の崩壊を引き起こしている(Brion, 1998)。さらに、最近の研究では、タウタンパク質の他の翻訳後修飾(グリコシル化、糖化、プロリル異性化、開裂または切断、ニトロ化、ポリアミン化、ユビキチン化、スモイル化、酸化)(Martin et al 2011)や、タウ自己凝集(Farías et al 2011)がアルツハイマー病患者の病因や神経変性に大きく関与していることが示唆されている。
アルツハイマー病における神経炎症と神経変性
アルツハイマー病の2つの主要な神経病理学的特徴は、アミロイド斑へのアミロイドβペプチドの細胞外蓄積、および高リン酸化タウタンパク質の神経原線維内形成のもつれであり、その両方が神経炎症および神経変性に寄与することが知られている(Hung et al 2016; Cai et al 2018)。神経炎症性応答は、アルツハイマー病における病態形成に高度に関与している(Shadfar et al 2015;Sawikr et al 2017;Ahmad et al 2019)。慢性的な神経炎症や脂質恒常性の障害は、アルツハイマー病の病因や神経変性につながる可能性がある(Hampel, 2012)。抗セラミド抗体は、アルツハイマー病のマウスモデルにおいて、アミロイドプラーク形成と血清エクソソームを増加させることが報告されている(Dinkins et al 2015)。アルツハイマー病患者の脳では、活性化されたミクログリアとアストロサイトがプラークの非常に近くに存在し、グリア細胞の活性化がアミロイドβプラークの形成に関連している可能性を示唆している(Wyss-Coray and Mucke, 2002)。ミクログリア細胞は、その貪食活性を増大させることにより、アミロイドβ42オリゴマーの認識および除去に主要な役割を示す(Zotova et al 2011;Sha et al 2014)。しかし、より最近の研究では、アミロイドβ42オリゴマーの慢性的な注入が持続的な神経炎症を誘導し、ラット海馬のミクログリアを活性化し、アルツハイマー病で見られるような空間記憶の低下につながることが示唆されている(Fekete et al 2018)。
ミクログリアの慢性的な活性化は、インターロイキン(IL)-1,IL-6,および腫瘍壊死因子αなどの様々なケモカインおよびサイトカインを放出し(Akiyama et al 2000)神経炎症およびアルツハイマー病の進行を誘導する破滅的な効果のために補体系を活性化することが以前に実証されている(Holmes et al 2009)。血清コレステロールの高レベルが有意にアミロイドβプラークの蓄積につながるアミロイドβ代謝のためのAPP処理を促進することができるので、コレステロールは、アルツハイマー病の病因に役割を果たしている(LedesmaとDotti 2012)。コレステロールの恒常性維持に関与する遺伝子の発現の変化は、アルツハイマー病の病因における重要な危険因子であることが知られている(Rogaeva et al 2007)。アミロイドβプラークと自然免疫応答との間の相互関係は広く特徴づけられており、最近の研究では、タウ病理と自然/適応免疫応答との間の相互作用の存在が示唆されている(Laurent et al 2018)。異常な活性化または貪食機能の低下のいずれかに起因する不適切なミクログリア機能は、加齢中およびアルツハイマー病の発生過程において起こり得、最終的に神経変性に寄与する神経炎症につながる(Labzin et al 2018)。早期の疾患誘発性神経炎症は、アルツハイマー病患者における重度の認知障害または認知症の提示の数十年前に開始される可能性がある(Eikelenboom et al 2010; Cuello 2017)。アルツハイマー病前臨床段階の確定診断の探索を続ける中で、初期の神経炎症や中枢神経系の複数の機能不全経路が有望な治療ターゲットになり得ると考えられている(Cuello, 2017; Elfakhri et al 2019)。
アルツハイマー病治療のための現在入手可能な処方薬
アルツハイマー病の治療法はまだない。しかし、現在、アルツハイマー病患者の認知症状や行動症状の改善のために、いくつかの処方薬が利用可能である(Ghezzi et al 2013;Kumar et al 2015)。アセチルコリンエステラーゼ阻害薬およびグルタミン酸受容体拮抗薬は、米国食品医薬品局(FDA)によりアルツハイマー病治療のために承認されており、最近ではアルツハイマー病の薬物療法において他にもいくつかの進歩が見られている(Khoury et al 2017)。アルツハイマー病の臨床段階(初期、中等度、重度)に応じて、一般的に処方される4つの薬剤が使用されている(図7)。ドネペジル(アリセプト®)は、アルツハイマー病の全病期に対してFDAによって承認されている(Lee et al 2015;Kim et al 2017)。リバスチグミン(エクセロン®)(Birks and Grimley Evans, 2015)およびガランタミン(ラザダイン®)(Lilienfeld, 2002)は、軽度から中等度のアルツハイマー病に対してFDAにより承認されている。アリセプト®、エクセロン®、ラザダインはアセチルコリンエステラーゼ阻害剤であり、認知機能(学習・記憶)を改善する(Rodda et al 2009)。しかし、これらの薬は、吐き気、嘔吐、食欲不振、排便率の増加などの副作用を示する(小林 et al 2016)。また、アセチルコリンエステラーゼ阻害薬は時間の経過とともに効果が低下していく。メマンチン(Namenda®)は、中等度から重度のアルツハイマー病段階の治療薬としてFDAに承認されている主要な薬剤です(岸 et al 2018)。ナメンダ®は経口活性型グルタミン酸受容体拮抗薬であり、記憶力、注意力、理性、言語、単純作業を行う能力を改善することができる(松永 et al 2015)。しかし、アルツハイマー病患者ではめまい、頭痛、錯乱、便秘などの副作用を引き起こす(Perras, 2005)。そこで、アルツハイマー病 の異なるステージの治療に主に使用されている処方薬、その作用機序、有益な効果、さらには副作用について、読者が素早くスキャンして情報を抽出できるように(表1)記載した。
図7 米国食品医薬品局(FDA)で承認されている、臨床段階の異なるアルツハイマー病の治療薬である
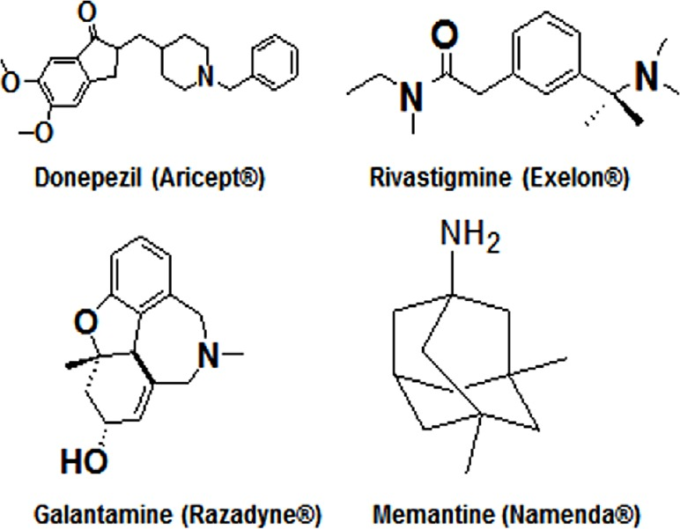
アリセプト®、エクセロン®、ラザダインは、アセチルコリンエステラーゼという酵素による神経伝達物質アセチルコリンの分解を阻害することで、アルツハイマー型認知症患者の脳内神経伝達物質のレベルを高め、作用を高めるアセチルコリンエステラーゼ阻害剤である。ナメンダ®」は、神経伝達物質であるグルタミン酸がアルツハイマー型認知症患者の脳内で過剰に生成されるのを阻害するグルタミン酸受容体拮抗薬である。
表1 現在、アルツハイマー病のさまざまなステージの治療に使用できる処方薬
| 薬 | アルツハイマー病の病期に処方される | 作用機序 | 有益な効果 | 副作用 |
|---|---|---|---|---|
| ドネペジル(アリセプト®) | すべての段階 | 脳内のアセチルコリンの分解を阻害するコリンエステラーゼ阻害剤です。 | 薬はアセチルコリンレベルを維持するので、脳の機能、記憶、思考を改善し、症状の悪化を遅らせたり遅らせたりすることがあります。 | 吐き気、嘔吐、下痢、筋肉のけいれん、倦怠感、体重減少、食欲不振を引き起こします。 |
| リバスチグミン(エクセロン®) | 軽度から中等度 | 脳内のアセチルコリンとブチリルコリンの分解を防ぐコリンエステラーゼ阻害剤です。 | 薬はアセチルコリンレベルを維持するので、脳の機能、記憶、思考を改善し、症状の悪化を遅らせたり遅らせたりすることがあります。 | 吐き気、嘔吐、下痢、体重減少、食欲不振、消化不良、筋力低下を引き起こします。 |
| ガランタミン(ラザダイン®) | 軽度から中等度 | これは、アセチルコリンの分解を阻害するが、ニコチン性受容体を刺激して脳内により多くのアセチルコリンを放出するコリンエステラーゼ阻害剤です。 | この薬はアセチルコリンの放出を刺激するので、特定のメッセージに応答するように神経細胞を強化します。 | 吐き気、嘔吐、下痢、食欲不振、めまい、頭痛を引き起こします。 |
| メマンチン(ナメンダ®) | 中程度から重度 | これは、過剰なグルタメートの毒性作用を防ぐN-メチルD-アスパラギン酸拮抗薬です。 | それは精神機能と日常活動を行う能力の有意な改善を示しています。 | めまい、頭痛、下痢、錯乱、便秘を引き起こします。 |
FDAが承認した治療法は、治療法も病気の好転も約束していない。これらの治療法は、しかし、いくつかの アルツハイマー病 の症状を一時的に緩和する可能性があるし、したがって、健康関連の生活の質を改善し、施設のケアに個々 の アルツハイマー病 患者の配置をやや遅らせるのに役立つ (Atri 2011)。アセチルコリンエステラーゼ阻害薬やグルタミン酸受容体拮抗薬を含む現在のアルツハイマー病治療薬はすべて、多面的な疾患であるアルツハイマー病において、限られた範囲であり、限られた利益をもたらすものである。現在の治療法では、アルツハイマー病の病態形成に重要なアミロイドβ凝集を標的とすることができるものはまだない。アルツハイマー病の発症を予防するためには、複数の経路を標的とした強力な薬剤を設計し、発見するための新たな道筋を早急に探究する必要がある。アルツハイマー病のための現在の治療アルゴリズムおよび将来の可能性のある治療法は、非常に最近のレビュー論文で広範囲に記述されている(Grossberg et al 2019)
アルツハイマー病における神経炎症の予防のためのレチノイド
神経炎症は、アルツハイマー病の発症に重要な役割を果たしている(Regen et al 2017)。炎症は、脳のシナプス機能障害および神経変性を引き起こす。過剰な神経炎症性メディエーターの産生は、アミロイドβペプチドおよび高リン酸化タウタンパク質の産生および凝集を誘導する。アミロイドβペプチドと高リン酸化タウタンパク質の凝集体はケモカインやサイトカインを産生する。激しい神経炎症性反応は、この疾患の動物モデルと同様に、アルツハイマー病患者において定期的に検出される(Johnston et al 2011)。マクロファージおよびミクログリアは、脳内のファゴサイトーシスを介してアミロイドβ凝集体を除去するためのスカベンジャーとして機能する(WeitzおよびTown 2012)。しかし、神経炎症性サイトカインの存在は、このファゴサイトーシスをブロックすることが知られている(Weitz and Town, 2012)。最適なミクログリア機能は、スキャベンジングタスクに必要であるが、脳内のこれらの細胞の慢性的な活性化はまた、プロ炎症反応、酸化ストレス、神経保護性レチノイドの分解、およびRAシグナリングのダウンレギュレーションを引き起こし、周囲の健康なニューロンの変性を促進する(Regen et al 2017)。
アルツハイマー病の病態形成の間、アミロイドβ刺激シグナル伝達経路は、プロ炎症性サイトカイン(例えば、IL-1β、IL-6,腫瘍壊死因子α)ケモカイン(例えば、C-Cモチーフケモカインリガンド2)および急性期タンパク質、ならびに反応性窒素種および活性酸素種の合成および放出を誘導し、プラーク形成をさらに促進し得る(Fiala, 2010)。アストログリア症、ミクログリア症、慢性神経炎症は、アルツハイマー病患者の顕著な特徴である(Weisman et al 2006)。アミロイドβはアストロサイトやミクログリアによるプロ炎症性サイトカインやケモカインの産生を誘発するが、レチノイドはアストロサイトやミクログリアに発現するRARとの相互作用により、これらのプロ炎症性メディエーターの産生を抑制することができる(Shudo er al)。 レチノイドはRARやRXRの活性化を引き起こし、アストロサイトやミクログリアの機能を変調させて、プロ炎症性サイトカインやケモカインの産生を抑制することが報告されている(Sodhi and Singh, 2014)。
神経炎症反応の予防は、アルツハイマー病治療における最も重要な目標の一つである。神経炎症の予防に対するレチノイドの役割は、以前の研究により、神経変性過程において報告されている(Kuenzli et al 2004)。レチノイドはIL-6の生成を有意に阻害するので(Zitnik et al 1994; Kagechika et al 1997)レチノイドによるIL-6のダウンレギュレーション戦略は、アルツハイマー病に対する有用な治療法である可能性がある。レチノイドは、リポ多糖誘導性またはアミロイドβ誘導性腫瘍壊死因子α産生を抑制し、核内因子κBの核内転座を阻害することにより、活性化ミクログリアにおける誘導性一酸化窒素合成酵素の発現を阻害することが観察されている(Dheen et al 2005; Kaur et al 2006)。さらに最近の研究では、ATRAが老齢ラットにおけるリポ多糖誘発性神経炎症、アミロイド生成、記憶障害を抑制し(Behairi et al 2016)神経幹細胞の増殖を促進し、ミクログリアの活性化抑制とともにADモデルマウスの海馬における成体神経新生につながることが示されている(Takamura et al 2017)。
RARアゴニストAm80(タミバロテン)の神経炎症抑制作用をリポ多糖類誘発性神経炎症モデルを用いて生体内試験で検討した結果、Am80は脳由来の神経栄養因子の産生を促進し、病理学的条件での神経保護を提供することが示された(Katsuki er al)。 Am580は、アミロイドβに曝露した培養皮質ニューロンにおいて炎症性細胞死を抑制することを示した(Jarvis er al)。 レチノイドは、アルツハイマー病を含む様々な神経変性疾患において、神経炎症反応の抑制やアミロイドβ凝集体の貪食促進に重要な役割を果たしている。現在、レチノイドやカロテノイドがアルツハイマー病の神経炎症を予防するために作用する分子機構を理解するために、激しい研究活動が行われている(Mohammadzadeh et al 2017)。
レチノイドとカロテノイドは強力な抗炎症作用と抗酸化作用を有するため、神経保護を提供する。それらは、認知機能を改善するために、アミロイドβの産生および蓄積の抑制、酸化ストレスの抑制、およびプロ炎症性メディエーターの分泌の抑制などの複数のメカニズムを介して、アルツハイマー病の進行を抑制することができる(Mohammadzadeh et al 2017)。これらの最近の研究はすべて、レチノイドおよびカロテノイドが複数の経路を介して働き、アルツハイマー病における強力な神経保護効果を提供することを強く示唆している。ごく最近の報告では、ATRAが、ラット脳におけるクラスIIIヒストン脱アセチル化酵素であり、タンパク質のサーチュインファミリーのメンバーであるサーチュイン1,および核因子カッパBの発現の調節によって神経炎症を減衰させることが示唆された(Priyanka et al 2018)。
アルツハイマー病の神経変性予防のためのレチノイド
カロテノイドの食事補給は、アルツハイマー病を含むいくつかの神経変性疾患の予防に重要な役割を果たすことが示されている(Obulesu et al 2011)。レチノイドは、神経細胞のパターニング、分化、軸索の伸長、および軸索の再生に関与している(Maden, 2007; Puttagunta and Di Giovanni, 2012)。レチノイドの欠乏は、正常な脳の発達および機能の障害をもたらし、その結果、アルツハイマー病を含む様々な神経変性疾患の症状の出現をもたらす(Etchamendy et al 2003; Sánchez-Hernández et al 2016; Zeng et al 2017)。研究は、レチノイドが特定の神経細胞型の生成を誘導し、損傷後の軸索をさらに再生することを示している(Maden, 2007)。さらに、レチノイドは、成体ニューロンおよび神経幹細胞の分化状態の維持、ならびに成体脳におけるシナプス可塑性、学習および記憶のための適切なレベルのレチノイドシグナル伝達に関与している(Lane and Bailey, 2005; Tafti and Ghyselinck, 2007)。したがって、レチノイドは、脳機能の正常な維持、およびアルツハイマー病を含む脳の様々な神経変性疾患の治療に不可欠であるように思われる(Dräger 2006;Fukasawa et al 2012;Niewiadomska-Cimicka et al 2017)。
ビタミンAおよび他のレチノイドは、生体内でのアミロイドβプラークの形成を直接阻害することができ、アルツハイマー病における神経保護およびその結果としての病因の予防のためのレチノイドの潜在的な治療的役割を示している(Lerner et al 2012)。RAは、脳内コリン作動性ニューロンにおけるアセチルコリンの神経伝達物質機能を有意に増強することが提案されている(Szutowicz et al 2015)。コリン作動性ニューロンの変性は、認知機能および記憶機能の障害に寄与する(Schliebs et al 2011)。RAおよびその誘導体のコリノ栄養特性は、アルツハイマー病の治療におけるそれらの使用を正当化する可能性がある(Sodhi and Singh 2013; Szutowicz et al 2015)。マウスモデルにおけるアルツハイマー病の効果的な治療は、RARαおよびRARβ(アゴニストAm80またはタミバロテンとの)およびRXR(パンアゴニストHX630との)の共活性化を必要とした(Kawahara et al 2014)。この研究では、Am80(0.5mg/kg)とHX630(5mg/kg)の17日間の共同投与により、アミロイドβPP23マウスの記憶障害が有意に改善されたが、いずれかの薬剤の単独投与では治療効果は認められなかったことが報告されている。しかし、これらの研究者らは、RARおよびRXRアゴニストとの併用投与による潜在的な副作用は報告していない。
RXRアゴニストであり、レキシノイドとしても知られるベキサロテンは、マウスモデルにおけるアルツハイマー病の治療のための最近の研究で再利用されている(Mariani et al 2017)。ADマウスにベキサロテンを水に分散させ、1日100mg/kgの用量で経口投与し、生後3.5カ月または7.5カ月のいずれかで治療を開始し、15日間継続した。ベキサロテン投与により、記憶力、嗅覚十字馴化、ニューロン生存率が改善され、プラーク負荷、アストログリア症、炎症性遺伝子の発現が減少した。合わせて、ベキサロテン治療はニューロンの損失を減少させ、シナプスの完全性のマーカーを増加させ、侵攻性アルツハイマー病のマウスにおける認知力の改善につながった。しかし、この研究では、ベキサロテン治療の副作用は報告されなかった。ベキサロテンは、通常、上述のように癌治療の選択的レキシノイドとして使用されるが、現在、アルツハイマー病における臨床試験の実行可能な候補として浮上している(Koster et al 2017)。がん患者に1日300mg/m2までの用量でベキサロテンを投与したところ、トリグリセリドが最大2.5倍に上昇し、半数以上の患者が甲状腺機能低下症を経験した(Marshall et al 2015)。トリグリセリドおよびコレステロール値の上昇は、治療の中止後に正常レベルに回復し、ベキサロテンによる治療中の抗リポデミック療法により、臨床的に管理可能であった。全体的に、ベキサロテンおよび類似のレキシノイドの作用機序は、長期間服用すると高齢のアルツハイマー病患者においてより有害な影響を示す可能性のある、ヒトでは明らかな副作用を示しているため、いまだに論争の的となっている(Koster et al 2017)。
結論
幹細胞のターンオーバー、細胞の可塑性、組織再生などの進行中のプロセスを制御するために、天然および合成のレチノイドとその受容体アゴニストの応用が研究されている。レチノイドのシグナル伝達障害はアルツハイマー病の病態を促進する。レチノイドは低分子であるため、組織内に容易に侵入することができ、治療薬として有望な候補となっている。低用量で、または他の神経保護剤との併用により、非標的組織における不要な副作用を最小限に抑えることが可能である。レチノイドは、プラーク形成、神経炎症反応、脳内神経変性など、この病気の複数の病態をブロックすることができるので、アルツハイマー病治療のための新しい治療戦略を表している。レチノイドの治療応用は多くの研究がなされているが、受容体サブタイプやアイソタイプに特異的なレチノイドの合成(毒性の低減、標的外結合、特異性の向上)が非常に重要になる。これらの課題を解決するために、当研究グループでは、アルツハイマー病をはじめとする神経変性疾患の治療薬として有望な薬理学的薬剤として、新規ボロレチノイドの設計・合成を行っている。
