Contents
Potential implications of SARS-CoV-2 oral infection in the host microbiota
オンラインで公開2020年11月29日
Zhenting Xiang,a,b Hyun Koo,a,c Qianming Chen,d Xuedong Zhou,b Yuan Liu,a and Aurea Simon-Soroa,e
要旨
体内への入り口である口腔は、コロナウイルス疾患2019(COVID-19)の世界的な大パンデミックを引き起こしたSARS-CoV-2感染症の発症に重要な役割を果たしている可能性がある。利用可能なデータは、口腔が感染の活発な部位であり、SARS-CoV-2の重要なリザーバーである可能性があることを示している。口腔表面が多様な微生物群集によってコロニー化されていることを考えると、ウイルスが宿主微生物叢と相互作用している可能性が高い。
SARS-CoV-2に感染した患者は、口腔および腸内マイクロバイオータに変化が見られる可能性があり、一方、経口種はCOVID-19患者の肺で発見されている。さらに、口腔、肺、腸のマイクロバイオーム間の相互作用は動的に発生しているようであり、口腔内の微生物群集が呼吸器疾患や消化器疾患に影響を与える可能性がある。しかし、SARS-CoV-2感染が口腔内微生物叢の局所的な恒常性を変化させるのか、積極的に異菌症を引き起こすのか、あるいは体間相互作用に影響を与えるのかは不明である。
ここでは、SARS-CoV-2の経口感染が呼吸器および消化管の局所および遠隔のマイクロバイオーム(口腔軸)に及ぼす潜在的な影響についての概念的な枠組みを提供する。この分野の研究により、SARS-CoV-2 の病原メカニズムや感染経過、COVID-19 の臨床症状など、ヒト宿主のさまざまな部位における病態をさらに解明することができると考えられる。
キーワード: 重症急性呼吸器症候群コロナウイルス2,アンジオテンシン変換酵素2(ACE2)口腔腸軸、口腔肺軸、微生物相
序論
COVID-19の世界的な脅威は、SARS-CoV-2の感染、伝播、および早期発見に関する知識を前進させるために、これまでにない規模とペースで研究努力に拍車をかけている[1]。しかし、SARS-CoV-2 の感染メカニズムや口腔内および全身の健康への影響をさらに理解するためには、出入り口である口腔は依然として見落とされたインターフェースである。唾液中のウイルスの検出および ACE2 受容体を豊富に含む口腔組織の利用可能性 [2] は、口腔が SARS-CoV-2 の重要な貯蔵庫となりうることを示しており、これは呼吸器および消化管への侵入口として機能し、感染と臨床症状の両方に影響を及ぼす可能性がある。SARS-CoV-2に感染した患者では、病原性口腔内細菌が多く蓄積しているようであり、口腔内マイクロバイオームの異常菌が呼吸器症状や消化器症状の重症度に影響を与える可能性がある[3,4]。したがって、口腔は SARS-CoV-2 による感染の確立と COVID-19 合併症の重症度に重要な役割を果たしている可能性がある。ここでは、SARS-CoV-2の口腔感染が口腔、肺、腸のマイクロバイオームに及ぼす潜在的な影響に焦点を当てる。「口腔-気道軸」の研究は、COVID-19の病因をさらに理解し、この世界的危機を食い止めるための正確な診断法と正確な治療法の開発に役立つ、より統合された概念的枠組みにつながる可能性がある。
SARS-CoV-2の潜在的な口腔リザーバー
現在進行中のCOVID-19パンデミックでは、感染者において回復後の臨床症状の再発が出現している。また、レトロスペクティブなデータから、SARS-CoV-2の再活性化の可能性も示されている[5]。さらに、無症状者や回復した患者では、呼吸器症状が消失した後にウイルスが脱落することが報告されている[6,7]。これらの観察から、SARS-CoV-2が活動状態または潜伏状態で後遺症の発生源として作用する解剖学的リザーバーに持続する可能性があるかどうかについて疑問が生じている。さらに、口腔内に組織貯留層が存在することで、局所的および遠位に生物学的変化が生じ、疾患の合併症を悪化させ、回復時間を遅らせる可能性がある。
SARS-CoV-2の感染性は、このウイルスが細胞内に侵入する能力に依存しており、細胞内に侵入する際にACE2がウイルススパイク蛋白質と相互作用する主要な受容体であるという明確な証拠がある[8]。口腔は体内への最初の侵入口の一つであることから、このウイルス感染とコロニー化の経路がCOVID-19の発症に重要である可能性が高い[2,9]。Songらによるトランスクリプトームデータ解析により、ACE2およびTMPRSS2が唾液腺で発現していることが示された[10]。先行研究では、唾液腺上皮細胞がACE2の発現上昇を示すことが示されている[11]。例えば、小唾液腺では肺よりもACE2の発現が高く、唾液腺がSARS-CoV-2感染の重要な部位である可能性が示唆された。支持されたエビデンスは、重篤な患者におけるSARS-CoV-2の高発現を示しており、これは感染の後期段階での高ウイルス負荷または唾液腺の機能不全を示唆するものであった[12]。さらに、SARS-CoV-2は急性唾液腺炎やそれに伴う痛み、炎症、唾液腺の分泌機能障害などの症状を誘発する可能性があることが示唆された[13,14]。唾液中のSARS-CoV-2検出率が高いことに加えて[15]、最近の論文では、回復期にある患者の唾液中のSARS-CoV-2陽性が報告されている[16]。Xuらは、無症候性感染を介したCOVID-19の広がりは、おそらくSARS-CoV-2の潜在的なリザーバーとして機能する感染した唾液腺から分泌される汚染された唾液から来るかもしれないと述べている[9]が、しかしながら、より多くの証拠が必要である[17]。
ACE2 はまた、公開 bulk-seq RNA データセットを通して決定されたように、口腔粘膜でも発現しているようである [2]。様々な臨床症状の中で、SARS-CoV-2陽性患者はしばしば舌の痛みや嗅覚や味覚の喪失を含む味覚障害を訴えているが[18]、これは舌の上皮細胞におけるACE2の高発現、あるいはSARS-CoV-2による神経細胞やグリアの直接感染の可能性と関連していると考えられる[19]。しかし、非神経細胞への一次感染が化学的知覚をどのように変化させるのか、そのメカニズムについてはさらなる研究が必要である。また、SARS-CoV-2陽性患者では口腔粘膜病変が報告されている[20]。さらに、ACE2シェダーゼ(ADAM17およびADAM10)およびエンドペプチダーゼ(CAPN1およびCA末梢神経系1)の濃縮発現は、口腔粘膜の異なる部位でのウイルスの高い膜融合活性を示しており[21]、ウイルスのリザーバーである可能性を示唆している。
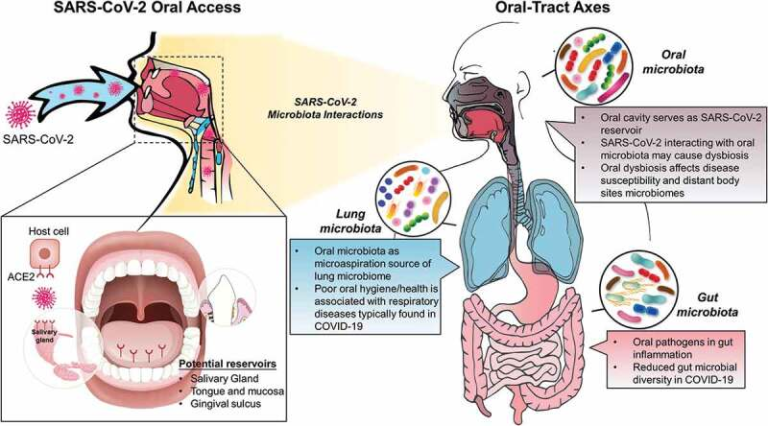
SARS-CoV-2のもう一つの潜在的なニッチは歯肉溝であり、酵素や炎症性分子が放出されて微生物のコロニー化を促進する微生物のニッチとして確立されている[22]。単純ヘルペスウイルス、エプスタインバーウイルス、ヒト乳頭腫ウイルス、およびヒトサイトメガロウイルスはすべて、臨床的に健康な歯肉溝および歯周ポケットの両方で検出されている[23]。歯肉溝での高いウイルス増殖のこれらの観察は、これらの隙間に現れる微生物とウイルスとの共生関係に起因する可能性がある[24]。さらに、歯肉溝液(GCF)は、感染した歯周細胞から放出されたSARS-CoV-2,または歯周組織内の末端毛細血管複合体から放出されたSARS-CoV-2を保有していると推測されており、これらはその後唾液と混合して口腔内に到達する可能性がある[25,26]。しかし、正確な測定のためにGCFを単離する技術的な限界があるため、この可能性の検証は困難である[27]。これらを合わせると、口腔は SARS-CoV-2(図 1)の重要な貯蔵庫となり、局所的に、また相互に関連する体の部位、特に上気道と下部消化管の両方で宿主に影響を与える可能性がある。
図 1. SARS-CoV-2 の経口感染が局所および遠隔のマイクロバイオームに与える影響の概念的枠組み
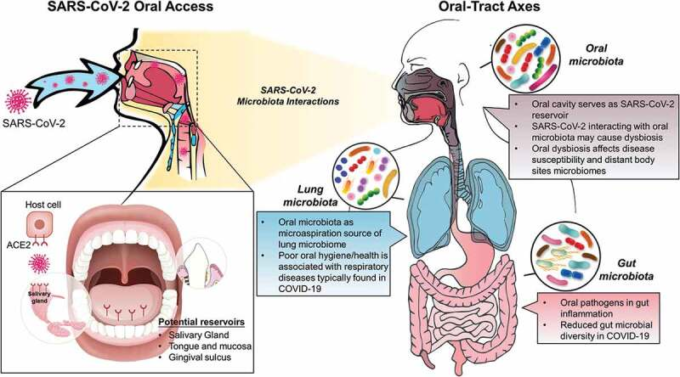
左側のパネルは、口腔内感染における SARS-CoV-2 の潜在的なリザーバーを示している。右側のパネルは、現在の知見と、口腔/消化管および呼吸器系におけるウイルスの相互作用の可能性を示しているが、これらはまだほとんど解明されていない。
SARS-CoV-2の経口感染は局所および遠隔のマイクロバイオームに影響を与えることができるか?
環境に曝された人体のあらゆる表面が多様な微生物群集によってコロニー化されており、それは人間の健康と一体的に結びついているため、ウイルスが宿主マイクロバイオータと相互作用を持つことは当然のことである。初期の証拠は、肺マイクロバイオータの微生物多様性とウイルス感染との関係を示唆している[28]。同様に、局所マイクロバイオームは、SARS-CoV-2のようなウイルス感染によって乱され、異生物学的なコミュニティをもたらす可能性がある[29]。インフルエンザウイルス感染の有無にかかわらず肺炎患者の口腔咽頭微生物叢を解析するために、非バイアスなハイスループットシーケンシング法を用いたこれまでの研究では、インフルエンザウイルス感染後にシュードモナスとバチルスの種数が有意に増加する一方で、プレボテラ、ヴィヨネラ、およびナイセリアの種数は有意に減少していることが明らかになった[30]。最近、COVID-19患者でも鼻咽頭の微生物相が変化し、Fusobacterium periodonticumが有意に減少したことが明らかになった[31]。しかし、SARS-CoV-2経口感染が局所的な微生物生態学的不均衡や腸内細菌叢の異常を引き起こすかどうかについては、さらなる調査が必要である。さらに、SARS-CoV-2感染は、患者を共感染およびスーパー感染に陥れ、疾患の重症度および死亡率の増加につながる可能性がある[32]。細菌および真菌の共感染によって引き起こされる機会感染および合併症は、COVID-19の診断および治療において意味を持つ可能性がある[33,34]。研究はさらに、呼吸器ウイルスだけでなく、全身性感染ウイルスもSARS-CoV-2と共感染しうることを明らかにしている[35,36]。
逆に、微生物相は、粘膜免疫防御などの宿主応答を刺激することで、非常在微生物のコロニー化とその後の感染を間接的に媒介することができる[37]。したがって、加齢または全身性疾患によって引き起こされる常駐性微生物叢の異常は、COVID-19の感受性および/または転帰を変化させる可能性がある[29]。さらに、マイクロバイオータの構造および機能の破壊は、常駐微生物と宿主との間の恒常性、および微小環境および栄養素の利用可能性を変化させ、ウイルスへの感染感受性を大きく変化させる可能性がある[38]。しかし、口腔内微生物叢とSARS-CoV-2感染症の感受性との関係はまだ十分に理解されておらず、臨床的にも利用可能な動物モデルを用いたさらなる研究が必要である。
口腔内の局所的な微生物相とウイルスの相互作用に加えて、異菌性微生物相またはウイルス自体が遠位臓器の微生物活動に影響を与える可能性がある。解剖学的には、口腔は消化管と呼吸器管の間の共通の接続部である(図1)。微生物学的には、口腔は非常に多様なニッチであり、腸や肺にも見られるいくつかの細菌種を含んでおり、身体部位のマイクロバイオームがつながっていることを示唆している[39]。例えば、歯周病原体および歯周炎における免疫応答は、最近、腸内炎症の発生に関与していることが示唆されている[4]。さらに、口腔内の不良な健康状態と病原性細菌の蓄積は、肺炎などの呼吸器疾患と関連している[22]が、COVID-19患者の肺マイクロバイオームに口腔種が見られる[3,40]。したがって、SARS-CoV-2による口腔感染とその局所・遠位微生物叢への影響が、感染の重症度や臨床転帰に大きな役割を果たしうるかどうかを検討することはもっともらしい。
口腔腸軸:口腔と消化管
口腔-腸軸は、口腔が消化管の第一器官である代謝的・解剖学的接続である。消化器系を統合する各器官の環境は、管路全体に関連するが特徴的な微生物群を保有している[41]。健康な個体では、口腔内細菌は大腸のマイクロバイオータの中に存在することがあり、下部消化管の供給源として口腔内マイクロバイオームからの細菌の排出が示唆されている[42]。非生物学的マウスでは、ヒト口腔マイクロバイオーム関連種がマウスの腸内にうまくコロニー化することができ、口腔から腸内マイクロバイオームへの潜在的な接続が示唆された[43]。下部消化管疾患では、以前に特定の病態(大腸がん、関節リウマチ、炎症性腸疾患など)と関連していた腸内マイクロバイオータは、口腔内マイクロバイオーム異常症または腸内細菌の存在と相関していた [44-46]。
最近の知見では、腸内炎症性疾患における口腔内マイクロバイオームの影響が指摘されており、口腔内細菌が下部消化管に移動して腸内炎症を悪化させる可能性が示唆されている。炎症性腸疾患では、Fusobacteriaceae, Pasteurellaceae, Veillonellaceaeなどの口腔内細菌が腸内に存在する可能性がある[47]。さらに、腸内細菌(Klebsiella/Enterobacter種)は、腸内に限局的にコロニー化し、炎症性腸疾患モデルで大腸炎を促進する可能性があることがわかった[4]。我々は最近、動物モデルにおいて、抗菌薬による口腔内マイクロバイオームの破壊に続いて、特定の口腔内細菌が下部消化管臓器に転座しうることを発見し、局所的な乱れが遠隔部位のマイクロバイオータの変化を引き起こしうることを示した(Simon-Soroら、未発表)。
COVID-19患者では、細菌性および真菌性日和見病原体が腸内マイクロバイオームにおいて増加したレベルを示しており[48]、腸内マイクロバイオータの完全性がSARS-CoV-2によって乱され、その結果、ディジーバイオティックなコミュニティが生じる可能性があることを示唆している[29]。この概念と一致するように、横断的研究により、COVID-19患者では腸内細菌の多様性が有意に低下し、日和見病原体の相対的な存在率が高く、有益な共生体の相対的な存在率が低いことが明らかにされた [49]。SARS-CoV-2感染が口腔および腸内マイクロバイオータに局所的にだけでなく、遠くにつながった体の部位でどのように影響を与えるか、またそれらのマイクロバイオーム相互作用を理解することは、COVID-19の病原メカニズムに関する新たな知見につながる可能性がある。
口腔-肺軸:口腔と呼吸器
上気道を通る口腔-肺軸は、口腔と肺の体の部位を結んでいる[50]。口腔および鼻腔微生物は、肺マイクロバイオームの主な供給源として発見されている。健康な被験者では、マイクロアスピレーテッド口腔内細菌組成はプレボテラやヴィヨネラに富む肺微生物群集に類似していることが明らかになっている[51]。疾患では、口腔内マイクロバイオーム異常に関連した肺の異常を発見し、口腔が下気道への微生物ゲートウェイであることを示唆している[52]。さらに、口腔内で発見された呼吸器病原体は、急性疾患の入院患者で報告されているように、微吸気によって肺に到達し、呼吸器疾患の原因となる可能性がある[50]。
劣悪な口腔衛生は他の部位の日和見病原体の存在と関連しており、歯周炎などの口腔疾患は喘息や肺炎と強く関連している[22]。また、これまでの研究では、口腔内微生物異常症につながる口腔衛生不良が肺機能の低下を加速させ[53]、肺炎の発生率を増加させる可能性があることも示されている[54]。人工呼吸器関連肺炎における口腔内と肺内の細菌病原体を重ね合わせたデータ解析から、舌の微生物叢が潜在的なリザーバーであることが示唆された[55]。
嚢胞性線維症(CF)では、歯肉下プラーク中の緑膿菌と肺での検出との間に相関関係があることが以前に報告されており、口腔がCF患者における病原体のコロニー化のゲートウェイである可能性を示唆している [56]。逆に、肺移植後の患者の口腔咽頭微生物叢では、嫌気性切片性細菌が増加し、多様性と豊富性が減少し、コミュニティ全体で深刻な腸内細菌叢の異常が見られた。このことから、肺の介入は口腔微生物叢に障害を引き起こすことが示唆された[52]。
Prevotella、Veillonella、およびCapnocytophagaのような口腔内で発見された日和見病原体がSARS-CoV-2に感染した患者の肺で確認されているので、この双方向の関係はCOVID-19に関連している可能性がある[40,57]。歯周病関連サイトカインは、口腔内の病原体を呼吸器に吸引することで呼吸器上皮を変化させ、ウイルスの付着を促進する可能性がある。したがって、口腔内マイクロバイオームは肺感染およびSARS-CoV-2による微生物のコロニー化に影響を与える可能性がある[58]。
まとめると、我々は利用可能なデータに焦点を当て、SARS-CoV-2感染が口腔内マイクロバイオームに及ぼす潜在的な影響、および肺および腸内マイクロバイオームとの関連性について概念的な枠組みを提供した(図1)。口腔は SARS-CoV-2 の豊富な貯蔵庫であり、COVID-19 の重症度、臨床症状、感染に影響を与える「口腔内軸」における局所および遠隔のマイクロバイオームの相互作用を変化させる上で重要な役割を果たしている可能性がある。
同様に、細菌、ウイルス、および真菌を含む数百の微生物が口腔内に存在し得る[59]が、これもまた、SARS-CoV-2感染に影響を与え得る。しかしながら、SARS-CoV-2感染が以下のような影響を及ぼすかどうかは不明である。
- (i) 常駐する微生物叢の局所的な恒常性を変化させるか、
- (ii) 生殖異常を積極的に促進するか、
- (iii) 既にバランスを崩した微生物叢をさらに混乱させるか(例えば、プラークコントロールの低下や炎症によって引き起こされる)および/または
- (iv) 生体交差部位の相互作用に影響を与えるか
は不明であり、さらなる臨床研究および生体内試験での機構論的研究が必要とされる。多くの未解決の疑問が残っている。口腔内マイクロバイオームはどのようにSARS-CoV-2の侵入に影響を与えるのか?口腔内はSARS-CoV-2のための貯蔵庫なのか、それとも潜在的なニッチなのか?口腔内細菌叢とCOVID-19感染患者の重症度との間には相関関係があるか?疾患や薬物(シェーグレン症候群や抗うつ剤など)による唾液の流れや成分の劇症的な影響は、SARS-CoV-2の経口感染や呼吸器・消化管全体に影響を与える可能性はあるか?
メタゲノミクスと臨床データのさらなる統合は、COVID-19の共感染、および口腔内マイクロバイオームとウイルスに起因する合併症との関連性を明らかにするのに役立つかもしれない[3]。COVID-19における「口腔軸」の重要性を考えると、口腔、肺、腸の各部位にまたがる臨床サンプルのマルチオミクス研究は、宿主マイクロバイオームの役割とSARS-CoV-2感染(およびその逆)への影響、および病原メカニズムをさらに解明する可能性がある。このような統合的な評価は、感染の経過や臨床症状の理解を深めるだけでなく、COVID-19の診断、治療、予後を改善するための新たな方法を明らかにし、この世界的な健康危機を制御し、社会を回復させるための既存の武器を強化することができるかもしれない。
著者寄稿
Z. X.は原稿の構想、デザイン、原案を担当し、H.K.は原稿の構想、デザイン、原案、修正を担当し、A.S.は原稿の構想、デザイン、原案、修正を担当し、Y.L.は原稿の構想、デザイン、原案、修正を担当した。Y.L.は構想、デザイン、原案、原稿の修正に貢献した。
ディスクロージャー・ステートメント
著者からは利益相反の可能性は報告されていない。