Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8399393/
薬剤学.2021 Aug; 13(8):1147.
2021年7月27日オンライン公開 doi:10.3390/pharmaceutics13081147
pmcid: pmc8399393
概要
がんは、人間の主要な死因の一つである。がん治療の進歩や診断方法の有効性の向上にもかかわらず、がんは依然として致死率が高く、多くの場合、治療が非常に困難である。がん治療において併用療法は、治療の副作用を最小限に抑え、治癒に大きな影響を与える可能性のある有望な選択肢と考えられている。
また、抗がん剤治療の効果を高めることができるかもしれない。さらに、併用療法は、がん組織への薬物の送達を著しく増加させることができる。光線力学的療法とハイパーサーミアは、併用療法の有効性を証明する理想的な例と思われる。これら2種類の療法は、異なるメカニズムでがん細胞を殺し、さまざまなシグナル伝達経路を活性化することができる。
PDTとハイパーサーミアはともに、腫瘍とそれを包む血管網の灌流に重要な役割を担っている。併用療法の主な目的は、がん細胞が特定の治療薬に対してより敏感になるような別々の作用機序を組み合わせることである。このような治療法は、がん治療の効果を高め、将来的にはがん治療のプロセスを最適化することに貢献する可能性がある。
*
キーワード 光線力学療法(PDT)、温熱療法、化学療法、放射線療法、外科的治療、がん、併用療法、低酸素、ドラッグデリバリー
1.はじめに抗がん剤併用療法の目的
がんは、私たちの社会にますます影響を及ぼしている病気である。世界中で死亡率が高くなる原因の一つとなっている。がんは世界的な死亡原因の第一位であり、先進国では非感染性疾患(NCD)の中で1位または2位にランクされている[1]。
大半の場合、現在のがん治療法は有効ではない。2020年には、新たながん患者数は180万人以上、がん関連死亡者数は60万人と予測されている[2]。これらの数字は、がん患者の3人に1人がこの病気で死亡していることを示している[2]。
一般的な治療法としては、外科的介入、化学療法、放射線療法などがある。がんの種類によっては、新しい、より一般的な治療法(例えば、メラノーマに対する免疫療法)がある[3]。
抗腫瘍治療の問題点としては、全身毒性、疼痛、免疫力低下、貧血などが挙げられる(使用する治療法にもよる)。したがって、治療量はがん細胞と闘うのに十分なほど多く、同時に深刻な副作用を防ぐために十分なほど少なくする必要がある。問題は、がん細胞はどこで治療に対する耐性を獲得するのか、ということである。
投与された薬剤や放射線に対するがん細胞の耐性や、全身治療の高い毒性は、がん治療における新しいアプローチの開発に寄与している。そこで、腫瘍の治療に用いられている様々な利用可能な方法を組み合わせる試みがなされている。
この戦略の主な目的は、次の治療因子に対して細胞を感作することにつながる異なる作用機序を組み合わせることである。このように、併用療法は、がん治療の効果を高め、正常細胞に対する毒性(化学療法剤の投与量を減らすことによる)を低減することに貢献するため、患者にとって有望な治療法である。
1.1.併用療法-定義、長所、短所
併用療法とは、少なくとも2種類の標準的な治療法を適用した治療法と定義されている。最も一般的な併用療法は、おそらく2種類の化学療法剤を適用することである。しかし、それは同じ種類の治療法である。異なる種類の治療法の組み合わせで最も一般的なのは、化学療法と放射線療法を適用するものである。
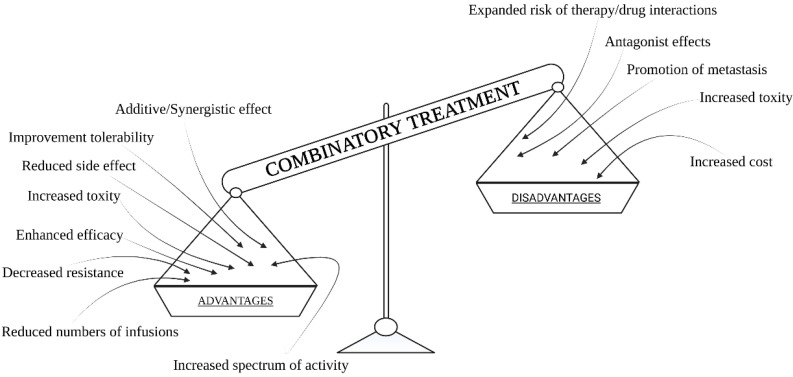
併用療法は、最も効果的な治療効果をもたらす。この方法を用いることで、より高い治療効果が得られ、化学療法剤の毒性も軽減される(図1)。
併用療法の効果は、相加的なものと相乗的なものがある。これらの利点は、抗がん剤治療が多くの生物学的経路を標的としていることに由来している。がん治療に加えて、腫瘍の発達を遅らせたり、化学療法や放射線療法などに対する腫瘍の耐性を低下させることも可能である。
このアプローチは、単剤療法よりもはるかに大きな効果を期待できる。がん細胞は、2つの治療法が同時に及ぼす有害な影響に適応できないことが多いと推測されるからだ[4]。そのため、より多くの疑問に答え、標準的な治療と組み合わせの結果について深い知識を持つことが必要である。
図1 併用治療の長所と短所。
がん細胞を死滅させるだけでなく、治療技術の組み合わせによって異なる経路を標的とすることで、がん細胞がより攻撃的で耐性を持つようになるリスクを低減することができる[4]。
この戦略の間違いない利点は、一般的に、治療が特定のメカニズムに照準を合わせることができる、そのような治療要素の最適化を達成する可能性があることである。使用する薬剤に対する耐性を減らすことができることはすでに述べたとおりだが、攻撃性や転移も減らすことができ、がんとの闘いの効果を高めることに貢献する。
マルチモジュール方式では、がん腫瘍の不均一性を考慮することができるため、すべてのがん細胞を死滅させる可能性が高くなる。最も重要なのは、寛解後の薬剤耐性やがん再発の原因となることが知られているがん幹細胞集団を後年殺すチャンスがあることを証明することである[5,6]。
併用療法は、個々の単剤療法の投与量を減らすことで副作用を軽減することも可能である。残念ながら、異なる治療法を併用することで、患者への害が増すこともある[7]。
光線力学的療法とハイパーサーミアの使用による更なる副作用を強調することは価値がある。もう一つの重要な問題は、伝染性の増加による転移の促進である[8]。しかし、これは単純な問題ではない。これはかなり複雑な問題である。がん細胞は治療後、腫瘍内の血管を通過して、全く別のニッチで生き延びなければならず、一筋縄ではいかないからだ。
*
そのため、原因薬剤の特定が困難となり、どの薬剤の投与量を減らすべきかの評価が困難になる可能性がある。治療薬の作用が類似しており、副作用のプロファイルも類似している場合、副作用の蓄積により、より重篤な臨床症状が引き起こされる可能性がある[4]。
併用療法の問題点(同時に不利な点)は、その費用である。単剤療法を用いる方が、2つ以上の治療法を用いるよりもはるかに安価であることは広く知られている。さらに、2つ以上の治療法を最大限に活用する方法についても、いくつかの疑問がある。
それは「治療濃度域」の特定に関するもので、最大限の効果を得るためには、どのタイミングで第2段階の治療を行うのが最適なのか?次に、どの方法を先行させるべきか、そして最良の結果を得るためにそれぞれの治療をいつ開始すべきか。併用療法の問題は個々の問題であり、腫瘍血管やがんの種類によって異なるが、個々のがんの種類やステージに適した様々な方法を組み合わせることで、驚くべき結果を得ることができる。
特に、最小限の毒性で最大の効果を得るためには、2種類以上の抗がん剤の相互作用を理解した上で、併用療法を行うことが重要である。結論として、併用療法の新しい質は、特定の腫瘍に対して選択された抗がん剤から生まれ、時間軸の中で進化していくものである。そのためには、治療メカニズムに関する深い知識が必要である。一方、臨床ではすでに多くの併用療法プロトコルが使用されており、作用機序をよく理解しないままうまく適用されている。
1.2.がんとの闘いにおける行動戦略と最も大きな成功例
がん治療における併用療法は、化学療法、放射線療法、温熱療法、光線力学的療法や手術、免疫療法などをさまざまに組み合わせて行うことにより、非常に興味深い結果が得られている。
現在、がん治療では、化学療法、放射線療法、そしてしばしば手術の併用療法が一般的に行われている。この方法によって、がんの発生を効果的に阻止し、現在の知見に基づく最善の結果を得ることができる(しかし、がんの3例中1例は患者の死亡に至っている)。
しかし、がん患者の3分の1が死亡するという現状がある。コンピュータモデルを用いた多くのシミュレーションにより、可能な治療法を組み合わせてがん治療戦略を最適化することが行われている[9,10,11]。
最適化のための重要な要素は、がんの種類とその侵襲性の程度との関連で、薬剤とその投与量、および光と放射線の投与量である。また、放射線量を分割して照射することがより重要であり、より良い結果をもたらすことが証明された[12,13]。
*
さらに、がん組織を切り出し、健康な組織にマージンをとって、化学療法サイクルを併用することで、最良の結果が得られ、腫瘍の転移も抑えることができる。また、長期的かつ選択的な作用による標的治療と効果増強が可能になる。選択された方法に対する細胞周期の発生や様々な段階での細胞の抵抗性を考慮することで、より大きな効果を得ることができるのである。
科学的研究により、放射線に対して最も抵抗性のある段階、すなわちS期(複製期)に存在する細胞は、ハイパーサーミアに対しても非常に敏感であることも示されている[14]。したがって、ハイパーサーミアは、さらなる治療段階において、細胞のX線に対する感作を可能にすると結論づけられた[15]。
併用療法を考えるとき、熱化学療法、熱放射線療法、熱化学放射線療法などの概念に出会うことがある。熱放射線療法を考えると、一般的な作用機序は、主に放射線に鈍感ながん細胞を破壊する可能性があることである。また、電離放射線の影響を受けてDNAの損傷が修復される過程を阻害する。
このようなアプローチにより、がん治療における併用療法はより効果的な治療結果をもたらす。また、今回紹介した温熱療法の概念をがん治療に応用すると、化学療法に対するがん細胞の感受性が高まり、抵抗性が低下することが観察される。このアプローチでは、化学療法剤のがん部位への蓄積を増加させることが可能である[15,16]。
これらのことは、この補完的な方法の有効性を高めることに貢献し、この文脈では、ハイパーサーミアなどの現象に関連している。確かに、新しいクラスの化学療法薬や、増殖速度に依存しない薬剤や細胞周期の位相に依存する薬剤の使用、毒性が重複しない薬剤の組み合わせの試み、作用機序の異なる薬剤の組み合わせ[17]、さらに標的リポソームなどの薬剤添加の方法など、様々な作用機序は治療効果を著しく高め、併用治療の重要性を示している。
一方、熱化学放射線療法の使用は、多剤併用療法が最も有益で最良の結果をもたらすことを示している[18]。研究者たちは、ハイパーサーミアと放射線療法、およびシスプラチンなどの化学療法剤を用いた化学療法との相互作用を研究してきた。科学的研究によると、相乗効果が得られるが、それはこの3剤併用療法がシスプラチンに耐性のない細胞株に対して使用される場合に限られることが示されている[19,20]。
光線力学的療法を考慮すると、この化学療法との併用療法は、がん細胞の直接破壊と腫瘍周囲の血管への強い影響により、かなり良好な結果をもたらす。異なるPDTプロトコルが血管系を著しく損傷し、あるいは治療部位の血流と組織の酸素化を一時的に増加させることが示された[21]。
しかし、光線力学療法の結果、すべての細胞が破壊されない場合、第2波で化学療法を使用することにより、PDTを生き延びた残りのがん細胞を死滅させることができる。さらに、PDTは免疫系に強い影響を与えることが示された[22]。このように、方法を組み合わせることで、がんを食い止めたり、完治に導くことができるのである。
*
2015~2020年に実施された併用療法(治療タイプが混在している)の一覧を表1に示した。GLOBOCAN 2018[1]による世界で最も多い4つのがんと、私たちの興味から選択した膵臓がんについてのみデータを示している。
表1 終了した、抗がん剤併用療法;2015年~2020年に開始した試験(ClinicalTrials.gov)
| 癌 | 併用療法スキーム | トライアルデザイン | クリニカルステージ | OS中央値 * (月) | PFS中央値 * (月) | ClinicalTrial.gov ID | 参考までに。 |
|---|---|---|---|---|---|---|---|
| 非小細胞肺がんステージIII | 化学放射線療法と免疫療法
免疫療法 |
cis-/カルボプラチン+ビノレルビン+エトポシド/ペメトレキセド、放射線、およびニボルマブ | IIステージ | 38.8 | 12.7 | [23] | [24,25] |
| 切除不能な非小細胞肺がん | 化学療法、放射線療法 | ビノレルビン、シスプラチン、放射線治療 | IIステージ | 35.6 | 11.5 | [26] | [27] |
| 小細胞肺がん | 化学療法と免疫療法
免疫療法 |
パクリタキセルとペムブロリズマブ | IIステージ | 9.2 | 5.0 | [28] | [29,30] |
| 非小細胞肺がん | 化学療法と免疫療法
免疫療法 |
カルボプラチン/パクリタキセルとSB8(ベバシズマブのバイオシミラー製剤の提案)
カルボプラチン/パクリタキセル+ベバシズマブ |
IIIステージ | 14.90
15.80 |
8.5
7.9 |
[31] | [32] |
| 非小細胞肺がん | 化学療法と免疫療法
免疫療法 |
ニボルマブ+イピリムマブ EGFR
ニボルマブ+イピリムマブ ALK 実験:EGFR化学療法未実施のニボルマブ+カルボプラチン+ペメトレキセド ニボルマブ+カルボプラチン+ペメトレキセド ALK chemo-naive |
IIステージ | 22.3
7.6 7.75 5.9 |
1.3
0.7 4.65 2.8 |
[33] | – |
| 小細胞肺がん | 免疫学と放射線治療 | デュルバルマブ、トレメリムマブについて
デュルバルマブ、トレメリムマブと低分割放射線治療・定位放射線治療との併用療法 |
IIステージ | 2.8
5.7 |
2.1
3.3 |
[34] | [35] |
| 非小細胞肺がん | 標的療法と免疫療法
免疫療法 |
エンサルチニブとデュルバルマブ | I/IIステージ | – | – | [36] | – |
| 非小細胞肺がん | 外科手術と免疫療法 | クライオサージェリーとNK免疫療法 | I/IIステージ | – | – | [37] | [38]。 |
| 肺の新生物 | 凍結療法とターゲット療法 | 凍結療法とイコチニブ | IV期 | – | – | [39] | – |
| 非小細胞肺がん | 化学療法と免疫療法
免疫療法 |
アテゾリズマブとカルボプラチンとパクリタキセルの併用療法(APC)
アテゾリズマブ、ベバシズマブ、カルボプラチン、およびパクリタキセル(ABCP) ベバシズマブ、カルボプラチン、パクリタキセル(BCP) |
IIIステージ | ITT *集団において。ACP = 19.5 vs. ABCP = 19.8 vs. BCP = 14.9 | ITT *集団において。ACP = – vs. ABCP = 8.4 vs. BCP = 6.8 | [40] | [41,42,43,44] |
| 小細胞肺がん | 化学療法と免疫療法
免疫療法 |
イリノテカンとジヌツキシマブ | II/IIIステージ | 6.9 | 3.5 | [45] | [46] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
パクリタキセルとデュルバルマブ | I/IIステージ | – | – | [47] | – |
| 乳がん | 化学療法と免疫療法
免疫療法 |
ナブパクリタキセルとデュルバルマブ(MEDI4736)の併用療法
エピルビシン・シクロホスファミド・ドゥルバルマブ(MEDI4736) |
IIステージ | – | – | [48] | [49] |
| 乳がん | 化学療法と標的療法
治療 |
エリブリンとPQR309 | I/IIステージ | – | – | [50] | [51] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
ドセタキセル・カルボプラチン・トラスツズマブ併用療法
エピルビシン、シクロホスファミドに続き、ドセタキセルとトラスツズマブを投与 |
IIステージ | – | – | [52] | [53] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
シクロホスファミドとペムブロリズマブ | IIステージ | – | – | [54] | – |
| 乳がん | 外科手術と免疫療法 | クライオサージェリー、NK免疫療法 | I/IIステージ | – | – | [55] | – |
| 乳がん | 化学療法と免疫療法
免疫療法 |
非ペジル化リポソーム型ドキソルビシンとトラスツズマブ | Iステージ | – | 7.2 | [56] | [57,58] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
ドセタキセルとペルツズマブ、トラスツズマブ | IV期 | – | 23.0 | [59] | – |
| 乳がん | 化学療法と免疫療法
免疫療法 |
エリブリンとデュルバルマブ | Iステージ | – | – | [60] | [61] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
ドセタキセル・ぺルツズマブ(ペルジェタ)・トラスツズマブ(ハーセプチン)併用療法 | IIIステージ | – | 18.7 | [62] | [63] |
| 乳がん | 標的療法と免疫療法
免疫療法 |
イブルチニブ、デュルバルマブ | I/IIステージ | 4.2 | 1.7 | [64] | [65] |
| 乳がん | ホルモン療法
ホルモン療法と 標的治療 |
レトロゾールとパルボシクリブ | IV期 | – | – | [66] | – |
| 転移性乳がん | 化学療法と標的療法
治療 |
パクリタキセル・S81694 | I/IIステージ | – | – | [67] | – |
| 乳がん | ホルモン療法
ホルモン療法と 標的治療 |
レトロゾールとニンテダニブ | Iステージ | – | – | [68] | [69] |
| 乳がん | ホルモン療法
ホルモン療法と 標的治療 |
レトロゾールとリボシクリブ | IIステージ | – | – | [70] | [71] |
| 乳がん | 化学療法と免疫療法と
ホルモン療法 |
エピルビシン、シクロホスファミド、ニボルマブ、トリプトアリン、エキセメスタン | IIステージ | – | – | [72] | – |
| 乳がん
骨支配性転移性乳がん |
免疫療法、ホルモン療法、放射性医薬品 | デノスマブとタモキシフェン/フルベストラントとRa-223ジクロライド | IIステージ | – | 7.4または16(骨優位性転移) | [73] | [74] |
| エストロゲン受容体陽性乳がん
受容体陽性乳がん |
ホルモン療法
ホルモン療法と 標的治療 |
タモキシフェンとTAK-228 | IIステージ | – | – | [75] | [76,77] |
| 乳がん | 化学療法と免疫療法
免疫療法 |
ドセタキセルとペルツズマブ、トラスツズマブ | IIIステージ | エヌエー | 14.5 | [78] | [79] |
| 前立腺がん | ホルモン療法
療法と 免疫療法 |
アビラテロンとTRC105
エンザルタミドとTRC105の併用療法 |
IIステージ | – | – | [80] | |
| 前立腺がん | 免疫療法と手術 | huJ591および89Zr-J591と根治的前立腺切除術の併用 | Iステージ | – | – | [81] | – |
| 去勢抵抗性前立腺がん
抵抗性前立腺がん |
化学療法と
凍結免疫療法と 免疫療法 |
シクロホスファミドと樹状細胞を用いた凍結免疫療法とイピリムマブ | Iステージ | – | 5(150日) | [82] | [83] |
| 前立腺がん | ホルモン療法
ホルモン療法と 標的治療 |
EnzalutamideおよびLY3023414 | IIステージ | – | 7.5 | [84] | [85] |
| 去勢抵抗性前立腺がん | 免疫療法・放射性医薬品 | アテゾリズマブとラジウム223ジクロライド | Iステージ | 16.3 | 3.0 | [86] | [87] |
| 前立腺がん | ホルモン療法
治療と手術 |
アパルタミドと根治的前立腺摘除術について | IIステージ | – | – | [88] | – |
| 前立腺がん | ホルモン療法
ホルモン療法と 標的療法 |
プレドニゾンとアパルタミド/酢酸アビラタロンとニラパリブの併用療法 | Iステージ | – | – | [89] | [90,91] |
| 前立腺
骨転移性がん |
ホルモン療法
ホルモン療法、放射性医薬品 |
エンザルタミドとラジウム223ジクロライド | IIステージ | – | – | [92] | [93] |
| 前立腺がん | ホルモン療法
ホルモン療法と 標的治療・放射線治療 |
酢酸リュープロリド/酢酸ゴセレリン/デガレリクス、PLX3397、放射線療法 | Iステージ | – | – | [94] | – |
| 結腸癌 | 化学療法と免疫療法
免疫療法 |
TAS-102(トリフルリジン/チピラシル)およびパニツムマブ | I/IIステージ | – | 5.8 | [95] | [96,97] |
| 大腸がん | 化学療法と標的療法
治療 |
ヒドロキシクロロキン、エンティノスタット、レゴラフェニブ | I/IIステージ | – | – | [98] | – |
| 固形がん
大腸がん |
免疫療法と標的治療
治療 |
マグロリマブとセツキシマブ | I/IIステージ | 9.5
7.6 |
3.6
1.9 |
[99] | [100] |
| 転移性
大腸がん |
化学療法と標的療法
治療 |
FOLFIRIおよびAflibercept | IIステージ | 12.6 | 7.4 | [101] | – |
| 転移性
大腸がん |
化学療法と標的療法
治療 |
ペメトレキセドとエルロチニブ | IIステージ | 7.3 | 2.5 | [102] | [103] |
| 転移性
大腸がん |
免疫療法と標的治療
治療 |
スパルタリズマブ、レゴラフェニブ | Iステージ | – | – | [104] | – |
| 転移性
大腸がん |
化学療法と免疫療法
免疫療法 |
TAS-102(トリフルリジン/チピラシル)とベバシズマブの併用療法
カペシタビン、ベバシズマブ |
IIステージ | 18.0
16.2 |
9.2
7.8 |
[105] | [106] |
| マイクロサテライト安定化再発・難治性大腸がん
大腸がん |
免疫療法と標的治療
治療 |
AvelumabとTomivosertib(eFT508)。 | IIステージ | – | – | [107] | [108] |
| 大腸
新生物 |
化学療法と免疫療法
免疫療法 |
mFOLFOX6およびBI 695502 | IIIステージ | 19.4 | 10.5 | [109] | – |
| 大腸
新生物 |
化学療法と標的療法
治療 |
mFOLFOX6およびSelinexor | Iステージ | – | – | [110] | [111] |
| 難治性
転移性 大腸がん |
化学療法と免疫療法
免疫療法 |
TAS-102(トリフルリジン/チピラシル)およびニボルマブ | IIステージ | – | 2.2 | [112] | [113,114] |
| 大腸がん | 免疫療法と標的治療
治療 |
デュルバルマブとペキシダーチニブ | Iステージ | – | – | [115] | – |
| 大腸がん | 免疫療法と標的治療
治療 |
アテゾリズマブ、コビメチニブ | IIIステージ | 8.87 | 1.91 | [116] | [117] |
| 大腸がん | 免疫療法と標的治療
治療 |
アテゾリズマブ、ベバシズマブ、コビメチニブ | Iステージ | [118] | – | ||
| 大腸
新生物 |
化学療法と標的療法
治療 |
FOLFIRIとセツキシマブ | IIIステージ | – | 11.4 | [119] | [120,121] |
| 転移性
大腸がん |
化学療法と免疫療法
免疫療法 |
イリノテカンとAZD1775 | Iステージ | – | – | [122] | [123] |
| 転移性
大腸がん |
化学療法と標的療法
治療 |
TAS-102(トリフルリジン/チピラシル)およびBrontictuzumab | Iステージ | – | – | [124] | – |
| 転移性
大腸がん |
化学療法と標的療法
治療 |
FOLFIRIとOMP-131R10 | Iステージ | – | – | [125] | – |
| 大腸がん | 免疫療法と標的治療
治療 |
ペムブロリズマブ、AMG820 | I/IIステージ | 38.963 | 5.396 | [126] | [127] |
| 膵臓腺癌(PDAC) | 局所焼灼療法と免疫療法
免疫療法 |
非可逆的エレクトロポレーション法(IRE)と同種異系γδT細胞 | I/IIステージ | 14.5 | 11 | [128] | [129] |
| 膵臓
新生物 |
局所焼灼療法と免疫療法
免疫療法 |
非可逆的エレクトロポレーション法(IRE)とNK細胞 | I/IIステージ | – | – | [130] | – |
| 転移性
膵臓がん |
標的治療と
化学療法 |
RX-3117(フルオロシクロペンテニルシトシン)、アブラキサン | I/IIステージ | – | – | [131] | [132] |
| 進行・転移性膵臓がん
転移性膵臓がん |
化学療法と標的療法
治療 |
Gemcitabine, nab-paclitaxel, LED225 (Sonidegib) | I/IIステージ | 6.0 | – | [133] | [134] |
| 膵臓がん | 化学療法と標的療法
治療 |
GemcitabineおよびBP31510(Ubidecarenone, USP)について | Iステージ | – | – | [135] | [136] |
| 膵臓がん | 免疫療法と標的治療
治療 |
ペムブロリズマブ、オラプテスドペゴル | I/IIステージ | – | 1.87 | [137] | [138,139] |
| 膵臓がん | 免疫療法・放射線療法 | ニボルマブ、カビラリズマブと定位放射線治療(SBRT)の組み合わせ | IIステージ | – | – | [140] | [141] |
| 膵臓がん | 化学療法と非可逆的エレクトロポレーション法 | ゲムシタビンと非可逆的エレクトロポレーション法(IRE)。 | Iステージ | – | – | [142] | – |
| 膵臓がん | 化学療法と免疫療法
免疫療法 |
FOLFOXおよびPegilodecakin | IIIステージ | 5.8 | 2.1 | [143] | [144] |
| 膵臓がん | 化学療法と免疫療法
免疫療法 |
nab-Paclitaxel、Gemcitabine、ALT-803 | I/IIステージ | – | – | [145] | [146] |
| 転移性
膵臓がん |
免疫療法と標的治療
治療 |
ペムブロリズマブ、アカラブルチニブ | IIステージ | – | 1.4 | [147] | [148] |
| 転移性
膵臓がん |
免疫療法と標的治療
治療 |
デュルバルマブとガルニセルチブ | Iステージ | 5.72 | 1.87 | [149] | [150,151] |
| 膵臓がん | 化学療法と免疫療法
免疫療法 |
nab-パクリタキセル、ゲムシタビン
セリクレルマブ |
Iステージ | – | – | [152] | – |
| 膵臓がん | 化学療法と
放射線治療 |
mFOLFIRINOXと定位放射線治療(SBRT) | IIステージ | – | – | [153] | – |
| 膵臓がん | 化学療法と免疫療法
免疫療法 |
GemcitabineおよびM7824 | I/IIステージ | – | – | [154] | – |
| 膵臓
新生物 |
化学療法と標的療法
治療 |
ナブ-パクリタキセル、ゲムシタビン
ナパブカシン |
IIIステージ | – | – | [155] | [156,157] |
表1終了した、抗がん剤治療を組み合わせた介入臨床試験;2015~2020年に開始された試験(ClinicalTrials.gov – 最終評価日:2021年4月26日)。
情報は、ClinicalTrials.govから、「条件または疾患」で検索して取得した。条件は「肺がん」「乳がん」「前立腺がん」「大腸がん」「膵臓がん」、募集状況は「終了」、試験タイプは「介入試験(臨床試験)」で検索した。試験開始:2015年1月1日から2020年12月31日まで。* OS-全生存期間、*PFS-無増悪生存期間、NE-推定不能、*ITT-intention-to-treat。
2.光線力学療法とハイパーサーミアに関する一般的な情報
2.1.ピーディーティー
この記事では、組み合わせ戦略の非常に興味深い例として、PDTとハイパーサーミア治療に焦点を当てる。そのため、このセクションでは、選択した治療法とその作用機序に関する基本的な情報を記載している。光線力学療法(PDT)には、光増感剤(PS)、PSを励起する適切な波長の光、および酸素という3つの独立した要因が必要である。
光増感反応は酸素がなくても可能であるが、光線力学反応は定義上酸素を含むことに注意しなければならない。がん治療としてのPDTの主な利点は、その二重の選択性に基づいている。PSは新生物の組織によく蓄積する薬物であり、光は照射された領域に局在するPSのみを活性化することができる。
理想的には、PSと光が別々に作用しても無害であり、酸素の存在下で両者が一緒に作用すると、致命的な武器である活性酸素種(ROS)を作り出すことができる。光増感色素は、薬になるために光を必要とするプロドラッグと理解することができる。がん治療におけるPDTは、がん組織だけに選択的に集積し、光照射前は最小限の毒性で、ある波長域の光照射後は高い毒性を示すことが理想とされている。
同時に、健康な細胞には光毒性作用を及ぼさないことが必要である。光増感剤は、組織への光浸透の観点から、約600~1200nmの範囲の光を吸収して効果的に作用する必要がある(低い波長の光は内因性色素に吸収され、長い波長の光は水に選択的に吸収される)。光増感剤には、その化学構造によって分類されるいくつかの亜世代[158,159,160,161]がある。
第一世代の光増感剤の代表的なものにヘマトポルフィリンがある。ポルフィリンやポルフィリン誘導体は、第二世代光増感剤の代表格である。さらに、皮膚がんの治療に使われる5-アミノレブリン酸(ALA)はPDTにかなり多く使われている。
この化合物は、4つのピロール分子がメチレン架橋で結合したものである。ポルフィリン誘導体のもう一つの例はクロリンである。これは、構造中の二重結合を変化させた化合物で、赤外線スペクトルの光をより強く吸収することができる。クロリンは赤外線で励起されるため、光で組織をより深く伝染することができる。
また、これらの化合物は体外に排出されるのが早く、約24〜48時間で排出されることから、毒性は低いと考えられる。バクテリオクロリン・アレフタロシアニンもまた、抗癌剤治療において非常に有望な光増感剤である[162]。
前臨床試験や臨床試験では、非常に有望な結果が得られている。その良い例が、前立腺癌に対するTOOKAD[163,164,165,166]と頭頸部癌に対するLUZ11[167]で、これらは臨床試験が進んでいる光増感剤である。
光は光線力学療法と切っても切り離せない要素である。太陽放射が多くの疾患の治療に利用できるという理論は非常に古いものである[168,169]。
アルビニズムや乾癬などの病気は太陽放射で治せると主張されていた。1903年、Niels Finsenは光線療法に関する業績でノーベル賞を受賞した。彼は紫外線を使って皮膚結核を治療した。その後、光線力学療法は皮膚がんの治療に使われるようになった。
波長は光増感剤の吸収スペクトルに合わせて調整する必要がある。PDTでは異なる光源、例えばダイオード、キセノン、ハロゲンレーザーを使用することができる[170]。注目すべきは、波長が長いほど、そのビームが組織内に深く浸透することである。したがって、約700nmの場合、光の浸透深さは約1.5cmである(光のパワー密度は距離の2乗に関連して減少する)。
*
PDTの最後の必要要素は酸素、特に分子状酸素であり、組織中に溶け込んでいる。酸素の存在により、一重項酸素、ヒドロキシルラジカル、スーパーオキシドアニオンラジカルなどの活性酸素種が生成される。治療の効果は、酸化の影響下での細胞毒性作用と考えられている。
PDTの原理を考える場合、この3つの要素の組み合わせが基本となる。この3つの要素は単独では安全であると考えられているが、組み合わせによって細胞に影響を与え、その破壊に寄与することで光線力学療法が有効となり、様々な疾患の治療に利用されるようになってきている。PDTにおけるフリーラジカルや活性酸素の生成機構は、大きく分けて2つある。
*
タイプ Iのメカニズムは、酸素濃度が低く、フリーラジカルの形態が存在する場合に起こる。この機構では、励起された光増感剤と照射された腫瘍組織との間で電子または水素原子の授受が行われる。光化学反応の結果、ラジカルまたはアニオンラジカルが形成されている。酸素濃度が生理的濃度に近い場合、タイプⅡのメカニズムが発生する。三重項状態にある光増感剤と励起された一重項酸素の間でエネルギーの移動が起こる。
*
光線力学的療法の基本的な情報をまとめると、この方法は癌の代替治療法である。メリットとしては、化学療法や手術に比べて毒性が低いこと、選択性が高いこと、副作用が少ないことなどが挙げられる。しかし、この方法にはデメリットもある。残念ながら、外部光源に依存するため、PDTは主に皮膚や直下、内臓の内壁にできた腫瘍の治療に適している[171]。
*
さらに、PDTの静脈内投与は全身毒性を引き起こす可能性があり、血管新生の異常、血液成分との非特異的相互作用、およびがん病巣における線維芽細胞の存在により、PDT増感物質の一部しかこの治療でうまく使用できない[171,172,173]。
残念ながら、腫瘍内での酸素消費は腫瘍の低酸素状態を悪化させ、PDT治療の失敗につながる可能性がある[174,175,176]。
この方法はまた、かなり高価である。特に、特殊な装置のコストが高い。さらに、適切な光増感剤を選択することは非常に困難である。患者にとって毒性があってはならないし、可能な限り副作用を少なくしなければならない。また、PDTは日光に対する一時的な過敏症を引き起こす可能性があることも言及しておく価値がある。
2.2.ハイパーサーミア
ハイパーサーミアとは、体温が生理的な標準値よりも上昇した状態のことである。ハイパーサーミア療法では、必要な部位に局所的または選択的に体組織の上昇を制御する。それを達成するために多くの技術を使用することができ、それぞれに長所と短所がある。
例えば、接触加熱は表在組織を加熱する最も簡単な方法であるが、著しい温度勾配を発生させ、生物学的効果の不均一性の原因となる可能性がある。一方、超音波、高周波、赤外線など、さまざまな種類の波を使用することができ、それぞれ異なる組織パラメータに基づいて有効である(必要な効果に基づいて長所または短所を考慮する)。
高精度の装置と高度な線量計および治療計画の要件は、このグループの加熱技術にある。例えば、金ナノロッドは近赤外光によって活性化される可能性がある。しかし、この後者の加熱方法は、最も正確である可能性がある一方で、さまざまな影響因子があるため、実行するのが最も難しい方法でもある。
体温の上昇が炎症や病気について知らせてくれることは広く知られており、免疫系の防御機構の一つでもある。人間の正常な体温は、36.2℃から37.5℃の範囲である[177]。
表2は、人体の特定部位の温度範囲を示している。
人間の正常体温は36.8℃であると報告されている[178]。
表2
人体の特定部位の温度範囲。
| 温度範囲 (℃) | 人体の選択領域 |
|---|---|
| 36.32-37.76 | 直腸 |
| 35.76-37.52 | ティンパニック |
| 35.61-37.61 | 尿 |
| 35.73-37.41 | 経口 |
| 35.01-36.93 | 腋窩 |
一般に、全身的な温熱療法と局所的な部位特異的温熱療法に区別される。さらに、どちらのタイプにおいても、高体温は生物自体によって発生することもあれば(例えば、減少、炎症)、人為的に誘導することもできる(例えば、放射線照射など)。
生物学的観点からは、確立された組織温度に基づく、もう一つの分類が不可欠である。ハイパーサーミアは、39℃以上の温度と定義され、腫瘍、がん組織に対する熱の選択的効果により、高温の影響によってがん細胞の死滅を促進する[179]。
*
40℃から43℃の温度範囲は、がんの治療における温熱療法の文脈で最も一般的に使用されている[180,181]。軽度の温熱療法は、41℃から43℃の範囲での体温上昇である[182]。
ハイパーサーミアは古くからがんの治療に用いられてきた[183]。多くの研究により、人工的な温度上昇が癌細胞を損傷することが示されている。ハイパーサーミアは血管新生プロセスに影響を与え、構造を損傷して腫瘍サイズを縮小させることもできる[16,184]。
この点では、標的療法の一手法である。しかし、ハイパーサーミアは、例えば、薬物の蓄積を改善することによって、その効果を高めるために、他の方法と組み合わせて使用される[185,186,187]。非常に頻繁に、ハイパーサーミアは、化学療法または放射線療法と併用される[188]。
*
ハイパーサーミアの主な目的は、その後の治療法に対してがん細胞を感作することであり、物理的な補助治療として理解することができる。感受性の高い細胞は、X線や化学療法剤に対する抵抗力が弱くなるはずだと考えられている。
例えば、高温で処理された細胞は、この修復に関与するタンパク質を変性させることにより、薬剤誘発性DNA損傷の修復を阻害する可能性がある[189]。
上述のように、ハイパーサーミアはその部位によって分けることができる。外部または内部のエネルギー源を用いて行う局所的ハイパーサーミア、臓器灌流による局所的ハイパーサーミア;全身的ハイパーサーミアもある[190]。
局所温熱療法の原理を考えると、腫瘍部位を特定し、腫瘍のある部位のみを加熱することになる。適切な熱量を与えるために、赤外線、超音波、またはマイクロ波波長レーザーを使用することができる。皮膚の外側を温めることと、体内を発熱させる光源を持つ適切なプローブを導入することの両方が可能である。
ハイパーサーミアでは、組織の加熱をコントロールすることが重要である。この療法のすべての要素を制御するためには、選択した加熱部位を正しく位置づけ、加熱源を適切な場所に設置し、温度上昇を常にモニターする必要がある。効率的なハイパーサーミア治療のさらなる重要な要素は、組織温度の確立時間(プラトー)とそれを達成するのに必要な時間(ランプ)である。
それに基づいて、総エネルギー付与量を計算することができる。熱量は安全で、例えば痛みを伴う火傷などを起こさずに期待通りの結果をもたらすものでなければならない。この方法は様々な副作用をもたらす可能性があることを強調しておく。最も一般的な副作用は、火傷、腫れ、出血である。
したがって、ハイパーサーミアは慎重に適用する必要があり、非常に選択的に作用する必要があり、加熱領域は非常によく推定される必要がある。組織の種類によって加熱の仕方が異なることを述べておく。脂肪は、よく灌流された筋肉とは異なる方法で加熱され、温度が蓄積される。
例えば、熱拡散を遅らせる制御されていない灌流、静脈や動脈の熱拡大の可能性に影響を与える特異な血管構造などである。ハイパーサーミアは、ナノ粒子が使用される薬物輸送の補助療法として成功することが証明されるかもしれない。
薬物輸送を助けることができるナノ粒子の例として、フラーレンがあり、これは腫瘍領域への薬物の送達を目標にすることができる[191]。
*
温熱療法は通常、支持的な方法として用いられるが、タンパク質-脂質細胞膜の損傷を引き起こすだけでなく、細胞内タンパク質の変性を引き起こすことによって、直接細胞死に寄与することができる[180]。高熱はまた、細胞骨格タンパク質の解体、変性、および再組織化をもたらす[192]。
前述のように、高熱は化学療法剤によるDNA損傷の修復を担うタンパク質の分解にもつながり、その結果、相同組換えの過程におけるDNA二本鎖切断の修復を阻害する[193,194]。
高温での細胞死は、アポトーシスとネクローシスの両方によって起こりうる。高温療法の推定生物学的分子機構は、とりわけ、熱ショックタンパク質(HSP)の発現、アポトーシスの誘導と調節、および細胞におけるシグナル伝達と薬剤耐性の調節に基づいている。
ハイパーサーミアは、直接的に細胞死を引き起こすことがある。細胞死の誘導は、抑制タンパク質であるp53に依存している可能性がある。また、アポトーシスは主にBax-またはBak-タイプのタンパク質のカスケード全体を伴うプロカスパーゼ2の活性化によって引き起こされると考えられている[181]。
*
ハイパーサーミアは、免疫系にも影響を与える。腫瘍局所ハイパーサーミアでは、局所加温により腫瘍部位へのNK細胞やマクロファージの流入が観察される。さらに、ハイパーサーミアは免疫系を活性化し、免疫反応を生じさせると言われている。
HTはTNF-αのレベルを上げるのに役立つ。TNF-αおよびIL-1-βのようなサイトカインの分泌を伴う免疫系からのかなり迅速な反応は、免疫系の防御機構の活性化に寄与する[195]。
ハイパーサーミアは、現在、より安全で最良の結果を得るために改良されている。ハイパーサーミアの経過をモニターするために、ナノ金を使用することが提案されている。さらに、この技術は、腫瘍の位置をより効率的に加熱し、それに応じて長い治療ウィンドウを得て、より効果的に薬剤を腫瘍部に導入したり、腫瘍部にX線を照射したりするために最適化されつつある。
一般に、ナノ金粒子は赤外線を吸収して、ナノ金が配置された領域を加熱すると考えられている[196]。よりよい治療効果を得るために、ハイパーサーミアは改良され、新しい治療の可能性が生まれつつある。
3.なぜハイパーサーミアとPDTが治療に使われるのか?なぜ、併用治療に適しているのか?
ハイパーサーミアと光線力学療法は、うまくいけば化学療法や放射線療法に比べ、比較的副作用が少ないため、治療に用いられている。確かに、ここでは投与量が重要であるが、他の従来の方法と比較して、PDTおよびハイパーサーミアは毒性が低く、有害性が少なく、安全である[197]。PDTおよびハイパーサーミアが併用治療の良い選択肢として考慮されるべき理由は、以下の通りである。
3.1.選択性
これらの治療法の選択性に関して言えば、PDTの光増感剤と、金ナノロッドなどのハイパーサーミアに用いられるナノ粒子が重要である。これらの化合物は、周辺組織よりも腫瘍に集中的に局在する。PDTやハイパーサーミアに必要な光は、選択された領域で使用することができ、熱や活性酸素の生成は、適切な波長の光が適用された標的領域で強烈になるであろう。
これらの感度は、環境中の酸素濃度、pH、あるいは光増感剤などのナノ粒子の構造などに依存する場合がある。光増感剤は病変部の特定の場所に蓄積され、適切な波長の光によって活性化され、その結果、励起された形態が行われる。その結果得られるエネルギーで活性酸素を生成し、光線力学反応(ROSカスケード)を起こすことができる。
*
PDTの結果については、この方法の選択的操作の結果である病的組織内のみの病変の切除という概念が考慮されることが非常に多い。さらに、光線力学療法で使用される特定の光増感剤と、それが選択された光源を使用してどのように選択的に励起されるかに依存する。
*
ある種の温熱療法を引き起こすために必要なナノ粒子は、がん組織への選択的な集積能力も持っている。
3.2.精度
PDTやハイパーサーミアの精度を出すためには、これらの治療で使用される光源が重要な役割を果たす。ハイパーサーミアやPDTには、高いビームコリメーションを持つレーザーが使用でき、がん病巣に非常に精密に照射することができる。赤色光は最もよく使われており、組織の深部まで浸透させることができる。
しかし、光ファイバーの精密な応用により、青色や緑色の光による治療(侵襲を最小限に抑える)の新しい可能性が開かれつつある。これにより、PDTとハイパーサーミアを用いて、体表の病変と体内の腫瘍の両方を治療することができるようになった。
様々な研究によると、より短い波長の光を用いることによっても、良好な治療効果が得られることが分かっている。特に表面変化の治療では、波長400nm程度の青色光で1mm程度まで浸透させることができ、かなり十分な効果が得られる。その結果、皮膚に最適に働きかけ、皮膚の深層部には浸透しない。
PDTやハイパーサーミアを最適化するプロセスも、治療全体の精度を高めるために重要である。患者のニーズに応じて、光源、光の長さ、パワーを調整することは、非常に重要である。ハイパーサーミアと光線力学療法の組み合わせでは、組織を局所的に加熱する温度帯を適切に選択することが重要である。
例示的なメカニズムとして、光増感剤として興味深い選択肢であるポルフィリンを用いたPDTとハイパーサーミアの組み合わせがある[198]。これらは膀胱癌の治療に使用されており、ミトコンドリア活性酸素を効果的に生成することができる[199]。
*
使用される光増感剤は光で励起されると毒性を示すため、ALAでは1日だけ光に当てないよう患者に勧めることがある。光を用いない場合でも、わずかに光増感されることがある[200]。PDTにおける理想的な選択肢は、選択された場所に正確に到達することができるナノ光増感剤である[201]。
一般に、PSは光にさらされなければ安全で無毒である。PDTで重要な光ファイバーとプローブの使用も大きな意義がある。それらは、例えば体内など、到達しにくい領域へのアクセスを可能にする。この戦略は、前立腺癌の治療で非常に成功している[202]。
よく行われたPDTは、適切に機能している組織に過度のダメージを与えることなく腫瘍を縮小させることができることを言及しておく必要がある。また、腫瘍反応の著しい増大も観察された。
抗腫瘍効果は、適用する熱の種類と量、使用する特定波長の光の種類と量、および光増感剤(例:光力学的反応の機序、細胞局在性、生体内分布、薬物動態)、ならびに作用順序(温熱療法とPDTの時間差、PS投与と照明の時間持続)により異なることが明らかにされている。光線力学的療法の最適化に関しては、光増感剤の投与量とレーザー出力が極めて重要である。
*
ハイパーサーミア現象は、起こりうる副作用を最小限に抑えるために、非常に正確な方法で細胞を感作することができる。ハイパーサーミアでは、局所組織や腫瘍を加熱するエネルギーを適切に供給する。治療中の温度は、通常40℃から最高45℃程度まで上昇し、健康で適切に機能している非病原性組織への損傷のリスクをほとんど伴わずに安全に加熱することができる[203]。
健康な組織とがん細胞を区別するのは、健康な組織が温度調節と適切な熱交換に優れているという事実である。対照的に、腫瘍内のがん細胞や組織は、血液供給が不十分なため、効率的に熱を放散することができない。したがって、熱は保持され蓄積され、構造を損傷することになる。
研究によると、S期、すなわち複製過程にある細胞は、ハイパーサーミアに対してより感受性が高い[204,205]。
ハイパーサーミアのメカニズムという文脈では、この方法は外部と内部に分けられる。皮膚にできた腫瘍の治療では、病巣内で発熱するアプリケータが使用され、そのおかげで、がん患部に熱が誘導され、アプリケータ内だけ温度が上昇する。しかし、重要な臓器にある腫瘍などの内部加熱には、安全に熱を届けるためにプローブが使われ、体内の特定の部位だけを加熱することができる。
周辺組織の加熱制御が問題になるため、ナノ粒子を選択的に集積することで加熱精度を高めるために利用される。次の戦略は、異なる組織の性質、例えば導電性を利用して、特定の組織タイプを加熱することである。例えば、高周波照射による加熱である。
3.3.腫瘍細胞に対する広範な効果
ハイパーサーミアは、光線力学療法と同様に、細胞に対して多因子効果を有することを強調する価値がある。PDTとハイパーサーミアは、癌治療の組み合わせとして、このような2つのモジュールを適用したときに生じる相乗効果により、最良の結果をもたらすと思われる。
ハイパーサーミアと光線力学療法の一般的なスキームは、ハイパーサーミアの場合に起こる、温度を上げ、がん細胞が存在する部分を加熱することで、同時にmitROSの量を増やすという事実に基づいている。
このことから、ハイパーサーミアによる処理は、mitROSの量を増やすことでがん細胞特異的PDT活性を高め、それによって排出タンパク質ABCG2の発現が低下し、排出トランスポーターの量が減少することで細胞内に化合物が蓄積されることがわかった[206]。
また、光線力学療法の治療中に用いられる温熱療法とヘマトポルフィリン誘導体の存在との相互作用の例もある。その後、次のような相互作用を検討することができる。すなわち、温熱療法は、光線力学療法の結果として生じた損傷の修復を阻害し、より良い治療結果を得るためにPDTによって生じた損傷を維持することを目的とした累積効果が存在すると言える。
HpDは腫瘍に蓄積され、レーザーで励起されることがある。光線力学療法中に、治療時にHpDが蓄積した場合、別の治療法として温熱療法を追加で行うと、治療効果を高めることができる相乗効果が見られる。
*
PDTにおける細胞死の分子メカニズムは、PSの蓄積量[207]、細胞内または腫瘍区画内のPSの局在[208,209]、PSの作用機序[162]、酸素利用率[210]、光量[211]、ROS後の損傷の種類と部位[212]、細胞、組織修復能[213]によって左右される。
このようなメカニズムは、直接的に癌細胞死を誘導することができる。PDTおよびハイパーサーミアの結果、ミトコンドリア活性酸素種(mitROS)が生成され、腫瘍部におけるHpD(ヘマトポルフィリン誘導体)の蓄積レベルが増加する。
HpDの蓄積量の増加は、PDTの活性を刺激し、増加させることが示されている。MitROSは、HCP-1(ヘムキャリアプロテイン1)の発現調節に影響を与える。前述のHpDはヘマトポルフィリンの誘導体であり、翻ってHCP-1はヘム1キャリアータンパク質である。
このタンパク質は、ポルフィリンの輸送を可能にする。ハイパーサーミアを最初に適用する2モジュール療法を用いると、がん細胞の死滅という点で重要な活性酸素の産生が増加する[214]。
しかし、レーザー出力が200mW/cm-2で、41℃から42℃の範囲の温熱を約10分間行う20分間のPDTは、がん細胞の損傷に何らかの影響を与え、その結果、がん細胞を死亡させるという結果が示されている[215]。
HCP-1の発現が増加すると、ポルフィリンの輸送がより効果的になり、がん細胞に蓄積され、PDTの効果が高まるという事実から、その結果に気付くことができる[206]。さらに、mitROSを増加させると、HCP-1の発現が増加するだけでなく、ABCG2タンパク質の発現がダウンレギュレートされることが示されている[206]。
特に、がん細胞によるこれらのトランスポーターの過剰発現は、化学療法剤に対する耐性の発現の重要な要因であると同定されている。さらに、ABCG2タンパク質(BCRP)は、ポルフィリンを排泄して細胞内のポルフィリンホメオスタシスを維持することが示されている[216]。
PDTを用いた腫瘍の破壊は、以下の方法で行われる:まず、アポトーシスが起こるが、ネクローシスも起こりうる。PDTの文脈における細胞死の別の興味深いメカニズムは、オートファジーの役割である[217,218]。
光増感剤は静脈内、腫瘍内、または皮膚に軟膏として投与することができるが、効果的に吸収され、かなり浸透する。腫瘍内部の壊死領域との関連で、研究者はPSが用量依存的に蓄積する証拠を発見している。
光線力学療法中の高用量は、かなり高濃度の光増感剤と同様に、一般に壊死経路の細胞死を誘発する。対照的に、光増感剤と光の両方が低用量であれば、アポトーシスによる細胞死を促進する[219]。
*
細胞レベルでのハイパーサーミアは、細胞ストレスの誘発を可能にする。さらに、熱は細胞にダメージを与えたり、細胞死を引き起こしたり、温度を上昇させたりすることで細胞に影響を与えるが、それはまた細胞の防御機構を活性化させることもできる[205]。
この現象は、細胞やタンパク質の誘導に大きな影響を与える。高熱の結果として、熱ショックタンパク質(HSP)が誘導されている[220]。細胞膜は熱に極度にさらされ、損傷を受ける可能性があることは注目に値する[221]。ハイパーサーミアは、主として細胞の修復能力を低下させ、その結果、治療効果が増大する。
3.4.腫瘍の血流増加
PDTやハイパーサーミアは、血管や血流にも影響を及ぼす。また、いくつかのPDTプロトコルは、細胞死による腫瘍組織の灌流増加を誘導し(これは細胞数の減少および腫瘍内圧の低下につながる)[222]、さらに血管新生の刺激、および血管新生シグナル伝達[223] (例えば、光力学的反応の結果としての酸素消費は抗低酸素機構を誘導するかもしれない)という仮説もある。
*
ハイパーサーミアに関しては、発生した熱が人為的に血管の血流を増加させるため、その後の治療で使用する薬剤に影響を与える。例えば、化学療法サイクルに使用すると、化学療法剤が新生物細胞に入りやすくなり[191]、はるかに高い温度と増加した血流が、新生物細胞を化学療法に感作する[185]。
3.5.血管の剪定と低酸素症
腫瘍内部の血管の損傷によっては、腫瘍自体の損傷につながる可能性がある。また、併用療法では作用機序が変化する可能性を考慮することが重要である。このような多剤併用治療を行うことで、異なる結果が得られ、がん細胞の障害や微小環境に異なる影響を与える可能性があることに注意しなければならない。
予測できない効果を避けるために、試験管内試験と生体内試験で併用治療のメカニズムを調べる必要がある。PDTとハイパーサーミアの両方が用量依存的、時間依存的な結果をもたらす可能性があることを言及しておく必要がある。
あらゆる形態の化学療法との協力の中で、ハイパーサーミアは、血管を通る流れがより効果的である領域への薬剤の送達を強化することができる。この効果を利用して、光増感剤を灌流が不十分な腫瘍部位に送達することができる。その結果、PDTはより効果的になることができる[224]。
灌流不全部位は低酸素状態でもあり、酸素欠乏により光線力学的反応が制限されると考えられている。しかし、血流の変化は組織の酸素化にも影響を与えることがある[225]。
*
特定の症例や条件下では、特に腫瘍が高血管化した場合、光線力学療法の影響で血管が破裂することがある。これにより、腫瘍への栄養と酸素の供給が妨げられる可能性がある。例えば、PDTは組織の壊死を促進したり、組織の再酸素化を誘導することができる[21]。
組織灌流への影響にも注意を払う必要がある。PDTによる低酸素組織の治療にはまだ問題がある(光力学的反応を行うには酸素分子が存在する必要があるため)。しかし、新世代の光増感剤とその改良がこの問題の解決に役立つと推測されている[226]。
PDT治療により、治療後の特定の時間帯に癌の酸素化が促進され、「治療濃度域」が形成されることが観察された。PDT後のこの特定の時間に、例えば放射線治療などの何らかの追加的な治療が、酸素増進効果のおかげでより効果的に行えるようになる。
*
腫瘍の微小環境もまた、ハイパーサーミアにとって重要である。温熱療法中、すなわち腫瘍領域の温度が上昇すると、血管を通る血流が著しく増加し、同時に血管の灌流が増加することがある。これにより、栄養と酸素の濃度が増加する。したがって、少なくともしばらくの間は、低酸素の領域が解消される可能性がある。
また、腫瘍の低酸素状態はかなり頻繁に起こる(酸素分圧が低く、一般に10mmHg以下)。低酸素領域は、軽度/中等度のハイパーサーミア治療により酸素化することができる:数度の加熱により腫瘍への血流が増加し、その結果、酸素レベルが上昇する[227]。
このような前処理は、細胞を放射線療法に対する抵抗力を低下させることができる。ハイパーサーミアは、細胞を放射線に対してより敏感にする[15]。低酸素もまた、温熱療法の文脈では極めて重要である。高熱は細胞をより感作させ、それ故に低酸素の領域を持ち上げることができる;これは高熱による細胞破壊を促進する。
3.6.がんに対する炎症反応
さらに、PDTは局所的な炎症を誘発することがある。この場合、様々な炎症誘発性物質を刺激する[228]。PDTは、光線力学療法で治療した腫瘍に好中球を移動させ、これはインターロイキンだけでなくケモカインの発現と関連している[229]。
*
光線力学療法の影響で、光が照射され活性酸素が生成されると、血管が拡張し、サイトカインやタンパク質の分泌が促進され、炎症や免疫反応の引き金に関連する様々な成長因子やメディエーターが分泌される。これにより、好中球やマクロファージがPDTを適用した部位に移動するよう刺激される。その結果、研究結果によると、がん細胞はより速く破壊されることになる。また、細胞障害性であることが知られているT-CD4とT-CD8リンパ球もここで活性化される。
*
そのおかげで、アポトーシス、すなわちプログラムされた細胞死のメカニズムが活性化される。PDTは、ハイパーサーミアと同様に、免疫系を警戒させることができる。温度の上昇は、HSPの発現を増加させる可能性があり、これも免疫系の活性化に寄与する[230]。
ハイパーサーミアを用いて温度を著しく上昇させると、ネクローシスの状態を伴う[231]。温度上昇の結果、HSP70が活性化され、免疫系が活性化される[232]。軽度のハイパーサーミアの場合、アポトーシスが多くなる[233]。
3.7.腫瘍に対する長期的な免疫応答の誘導
長期的な免疫学的側面も忘れてはならない。がん治療中、免疫反応を覚えておくことは非常に重要である[234]。体温を上げると免疫系が刺激され、防御機構に好影響を与えるので、病気との闘いに役立つ[235]。
免疫学的なレベルでは、温熱療法は免疫細胞の活性化と発現を可能にし、クラスIIとクラスIの両方のMHCに影響を与えることを強調する価値がある[235]。温度上昇の影響下に存在するメカニズムの中で、DCにおけるMHCクラスII、CD80、CD86、CD40の増加による発現の調節におけるハイパーサーミアの役割は言及に値する[236]。
また、樹状細胞がこのプロセスに関与していることも大きな意義がある。LPSによって誘導されたマクロファージや樹状細胞では、NF-κBが活性化される。さらに、サイトカインの産生が活性化される[237]。腫瘍細胞の表面では、MHCクラスIの発現が増加する[238]。さらに、TLR4の発現も増加する[235]。
3.8.ターゲティングの可能性
PDTで使用される光増感剤とハイパーサーミアで使用されるナノ粒子は、特定の生物学的メカニズムをターゲットにすることができ、同時に後続の治療モダリティと適合させることが可能である。併用療法の文脈では、化学療法物質は、「治療濃度域」によって、腫瘍組織により集中的に蓄積される可能性がある[21]。この方法は選択的であり、光増感剤とナノ構造の組み合わせの問題は、ますます議論されるようになっている[239,240]。
別の「治療濃度域」メカニズムとして、腫瘍組織における灌流/酸素の促進がある。PDTやハイパーサーミアなどのがん治療におけるさまざまなタイプのナノ構造の出現は、標的部 位への効果的な薬物送達方法を設計する可能性を高めている。
このような粒子は、脂質や高分子ナノ構造体、ナノメタル粒子であり、その表面に標的リガンド、治療薬を付着させる性質を持つか、あるいは治療薬の担体である可能性がある。標的ナノ粒子の使用は、全身毒性を低減させるという利点を有する[241]。薬剤は、VEGF受容体のような特定の生物学的構造を標的として設計することができる[235]。
*
PDTの課題の1つは、組織切除と灌流促進効果のバランスをとるために治療を最適化することである。これを達成する一つの方法は、光増感剤の注入(例えば、全身、腫瘍内)と照明の間の時間帯を工夫することである。したがって、光増感剤と光量により、例えば血管標的光線力学療法(VTP)と細胞標的光線力学療法 (CTP)のような異なるタイプの効果を誘導することができる[21]。
光線療法と他の治療法、例えば化学療法との併用は、相乗的な治療効果をもたらす可能性がある。腫瘍標的治療薬の標的としてよく用いられるのは、腫瘍細胞の膜に存在する受容体であり、様々な代謝経路を含む細胞シグナル伝達を担っている。これらの受容体は、ナノ粒子によって阻害または活性化することができる。
しかし、腫瘍の不均一性により、がんをうまく標的にすることは難しく、そう簡単ではない。腫瘍内の腫瘍細胞は互いに異なるため、ある治療法に対する反応が細胞ごとに異なる可能性がある。これは、細胞表面の受容体の構造、細胞膜表面での受容体の発現、受容体の数の違い、細胞の種類によって受容体のセットが全く異なることなどが原因である。
ナノメディシンでは、腫瘍の標的を増幅することでこの問題を回避することが可能である。これには、表面受容体など既存の標的分子の数を増やす方法、ダブルターゲット法、つまり2つの腫瘍特異的因子に同時に作用させる方法、新しい治療標的である人工受容体の導入、リガンドへの親和性を高めるためにタンパク質やペプチド構築受容体を改変し、標的治療で使用できるようにする、という4つの方法がある。このようなソリューションのおかげで、がん細胞の転移や薬剤耐性を抑えることができる[241]。
3.9.ナノメディシン
現在、ナノメディシンはがん治療の文脈でも使われている。これは、非常に有望な科学分野である。ナノメディシンは、標準的な治療と診断の有効性を高め、安全性を向上させることができる[242]。PDTとハイパーサーミアは共にナノメディシンのある側面を利用しており、特に、より効果的な薬物送達を含む効果的な治療を可能にしている[243]。
薬物を含む多くの化学化合物をナノ粒子と結合させることによるナノコンジュゲートの作成に関連する研究が集中的に行われており、腫瘍の好適部位への輸送・送達がより良好に行われる。さらに、ハイパーサーミアに使用される光増感剤およびナノ粒子の中には、特定の生物学的標的、たとえば、VEGF 受容体を狙うように設計できるものがある[244]。
このことは、次の治療法で包括的に扱うことができる特定の生物学的メカニズムを標的とする機会をもたらす。もう一つの重要な生物学的効果は、ナノメディシンを含むアクティブターゲティングのための受容体発現を増加させることである[245]。
*
PDTにおけるナノメディシンの使用は、使用する光増感剤の生体内分布の大幅な改善につながり、非常に選択的に腫瘍部位に到達させることができるため、治療の効果を直接的に高めることができる[200]。
PDTの場合、一般的に知られているフラーレンを使用することができ、光増感剤として作用させることができる。カーボンナノ材料としてのフラーレンは、これらの材料を薬物キャリアとして使用する場合、素晴らしい選択肢となる[246]。
さらに、PDTでは光増感剤を輸送するためにリポソームが使用されている。リポソームは、副作用の量を減らし、より効果的に腫瘍部位に到達させるのに役立つ。これは、薬物送達の一般的なナノスケールの修正であり、効能を高め、薬物薬物動態に利益をもたらす[247]。
さらに、PDTは、光増感剤が量子ドットを添加することで改変されるナノテクノロジーも使用しており、これも素晴らしい解決策と思われる[248]。
光増感剤に接続し、量子ドットのタスクは、光増感剤を標的として細胞に直接送達し、目的の治療領域への薬物輸送においてさらなる強化を提供することである[249]。
*
ハイパーサーミアは、ナノメディシンの分野でも非常に重要である。治療プロトコルは常に改良され、この技術を用いた治療法は修正されている。主な焦点は、局所的または全身的な発熱に影響を与えるためにナノ粒子を使用することである。この目的のために、金ナノ粒子を使用することができる。
金ナノ粒子は、近赤外線領域の光を吸収する能力があることが特徴で、これにより腫瘍を加熱することができる。さらに、ナノゴールドは、腫瘍領域におけるX線照射の線量を増加させることができるとも仮定されている[250]。
もう一つの非常に興味深いナノ粒子は銀で、その任務もまた適切な量の熱を発生させることであり、これにより薬物を細胞または組織のより深いところに浸透させることができる[251]。一方、銀ナノ粒子は、ハイパーサーミアから生じる特殊な創傷被覆材にも使用することができる[251]。
さらに、強磁性体は、磁気ハイパーサーミアの場合にも使用される。Ni-Cuは、この目的に使用できる分子の一例である。低濃度では毒性はないが、高濃度では、腫瘍細胞に対する毒性作用が観察される[252]。
ナノメディシンとナノテクノロジーのもう一つの興味深い側面は、溶液や生体システムの温度を、細胞レベルでさえも決定できるナノ温度計の使用である[253]。このような温度計の一般的な動作原理は、蛍光に感温し、蛍光強度の変化を捕らえるナノ粒子の使用に基づいている[253]。
*
つまり、PDTとハイパーサーミアは、がん治療の効果を高めるために貢献しているのだ。これらの方法は、化学療法の場合には薬物送達の副作用を軽減し、放射線に対する細胞の耐性を低下させるので、補完的な方法であるが、これらの方法単独では確実に害が少ないからである[238]。
私たちは、これらの治療法が併用療法の良い解決策になると思われ、臨床医がより深く探求すべきであると主張する。科学的証拠に基づいて、これらの方法は間違いなく治療の有効性と効率を高める。
要約すると、PDTとハイパーサーミア治療の現象は類似しており、どちらの治療法も細胞レベルで癌に警告を発し、細胞死を誘発することができる。これらの治療法はまた、組織の灌流に影響を与え、栄養分の減少または増加を通じて組織の酸素化(低酸素)に影響を与えることができる。また、局所的および全身的な免疫反応を誘発することができる。
4.PDTやハイパーサーミアと併用される他の方法は?
抗がん剤治療としてのPDTやハイパーサーミアは、放射線療法、化学療法、免疫療法、手術と併用されることがほとんどである(表3)。
これらの方法は、様々な組み合わせで適用することが可能である。2つの方法だけを組み合わせても、多剤併用療法でも、同等の効果が得られる。すべては、がんの種類、攻撃性、転移性、部位、得たい治療効果によって決まる。最良の結果を得るために適切で最適な治療法を選択するためには、これらすべての要素を考慮する必要がある[254,255]。
表3
ハイパーサーミアや光線力学療法などの臨床併用療法。
| 抗がん剤併用療法におけるハイパーサーミア | ||||||||
|---|---|---|---|---|---|---|---|---|
| 組み合わせ治療のスキーマ | 癌 | 試行錯誤の段階 | 国名 | 試験開始日-試験終了日 | 入会案内 | 試行錯誤の結果 | クリニカルトライアルGov ID | 参考までに。 |
| H(FRWBH)+R+CH | 頭頸部がん | 1相 | ドイツ | 2018-2020 | 10 | 対象となった全患者のLRCとOSの中央値はそれぞれ10カ月と9カ月であった。* COVID-19により、発熱域全身温熱療法(FRWBH)の全サイクルを受けた患者は5名のみであった。 | [262] | [263,264] |
| H+CH+S
(ハイペック+CRS) |
胃がん | 1相 | 米国 | 2016-2018 | 4 | – | [265] | – |
| H + CH | 膀胱
癌 |
1期(初期) | 米国 | 2008-2011 | 15 | 追跡期間中央値3.18年で、67%が別の膀胱癌の再発を経験し(筋層への浸潤はなし)、13%が上部管再発を経験した。 | [266] | [267] |
| H + CH + S
(IPHC + CRS) |
付録のがん
大腸がん 癌 |
1相 | 米国 | 2007-2007 | 16 | – | [268] | [269] |
| H + S + CH
(ハイペック) |
腹膜腔がん | 1相 | 米国 | 2007-2011 | 17 | – | [270] | – |
| H + CH + LS | 肺がん | 1相 | 米国 | 1999-? | – | – | [271] | – |
| H+TT | 肝臓腫瘍 | 1相 | イギリス | 2014-2017 | 10 | – | [272] | [273,274,275] |
| S+HIPEC+IT | 卵巣腺癌卵管腺癌、原発性腹膜癌 | 1相 | フランス | 2011-2015 | 30 | 診断から29.3カ月、CCRS+HIPEC後のフォローアップ期間中央値は23カ月であった。CCRS + HIPECによるDFS中央値は16.7カ月、CCRS + HIPEC後の2年DFSとOSはそれぞれ27%と71%であった。術後のPFS中央値は16.7カ月であった。 | [276] | [277] |
| H + DT | 非小細胞肺がん | 1相
2相 |
中国 | 2015-2018 | 97 | OS中央値はActive群9.4カ月、Control群5.6カ月、PFS中央値はActive群3.0カ月、Control群1.85カ月。PFSの中央値は、実薬群で3.0カ月、対照群で1.85カ月であった。 | [278] | [279,280] |
| H + CH | 乳がん | 1相
2相 |
米国 | 2006-2016 | 29
(トライアルA=18 トライアルB=11) |
試験A:TTLP、PFS、OSはそれぞれ4.9カ月、4.8カ月、9.0カ月。試験B:11人中6人に臨床的に有意なQoLの改善が認められた。 | (試験A)[281](試験B)[282] | [283] |
| H+CH+S
(ハイペック+CRS) |
大腸がん | 1相
2相 |
イタリア | 2006-2010 | 20 | 追跡期間中央値は、HIPEC群65.2カ月、対照群34.5カ月だった。5年全生存率(OS)は、HIPEC群81.3%、対照群70.0%であり、HIPECの方が良好であった。 | [284] | [285] |
| H+CH+S
(ハイペック+CRS) |
腹膜
癌腫症 |
1相
2相 |
フランス | 2007-2011 | 18 | – | [286] | – |
| H + R + S + CH | 肉腫 | 1相
2相 |
米国 | 1999-2007 | 15 | – | [287] | [288] |
| H+CH+S+CH(ヒペック+S+CH) | 卵巣癌、卵管癌、原発性腹膜癌 | 1相
2相 |
ベルギー | 2010-2015 | 19 | 追跡期間中央値は30.9カ月、PFS中央値は33.2カ月であった。OS生存期間は未到達であった。 | [289] | [290] |
| H+CH+S+CH(ヒペック+S+CH) | 大腸がん | 2相 | 中国 | 2016-2020 | 100 | – | [291] | – |
| H+CH+S+CH(ヒペック+S+CH) | 胃
癌 |
2相 | 中国 | 2015-2020 | 100 | – | [292] | – |
| H + CH + R | 直腸癌 | 2相 | ドイツ | 2012-2017 | 78 | 3年後のOS、DFS、LC、DCの評価値はそれぞれ94%、81%、96%、87%であった。ハイパーサーミアに伴う高い累積温度は、患者の腫瘍退縮をより強く示していた。 | [293] | [294]。 |
| H+CH+S
(ハイペック+LS) |
消化器がん | 2相 | 米国 | 2014-2020 | 21 | 転移病変の診断日からのOS中央値は30.2カ月であった。初回の腹腔鏡下HIPECからのOS中央値は20.3カ月だった。 | [295] | [296,297] |
| H+R | 前立腺
癌 |
2相 | 米国 | 1997-2003 | 37 | 追跡期間中央値70カ月(18-110カ月)、7年OSは94%であり、61%が無再発であった。 | [298] | [299] |
| H+CH+S
(ハイペック+CRS) |
非腫瘍性小円形細胞腫(DSRCT)肉腫 | 2相 | 米国 | 2011-2018 | 22 | 診断時からの推定OS中央値は58.44カ月(20人の忍耐に対して)だった。 | [300] | [301] |
| CRS + HIPEC + EPIC | 腹膜
癌腫症胃癌 |
2相 | スウェーデン | 2005-2009 | 18 | 全治療を受けた8名のOSは14.3カ月であった。CRS+HIPEC+EPIC群の忍耐力のある患者のOS中央値は10.2カ月であった。6名の患者が巨視的根治手術(CC0)を受け、このサブグループのOSは19.1カ月であった。 | [302] | [303] |
| H+CH+S
(ハイペック+CRS) |
腹膜
癌腫症、大腸癌、虫垂癌腹膜中皮腫、腹膜偽粘液腫、胃癌 |
2相 | 米国 | 2011-2020 | 51 | – | [304] | – |
| H+CH+S
(ハイペック+CRS) |
副腎皮質がん、腹膜がん
癌腫症 |
2相 | 米国 | 2013-2018 | 11 | 追跡調査期間中央値は23カ月であった。IP-PFSの中央値は19カ月であった。OSの中央値は未到達であった。 | [305] | [306] |
| H+CH+S+CH
(iphc + crs + ch) |
大腸がん | 2相 | 米国 | 2002-2012 | 27 | 追跡期間中央値は40.4カ月であった。OSとPFSの中央値はそれぞれ43.0カ月と9.3カ月であった。 | [307] | [308] |
| H + CH | 肉腫 | 2相 | 米国 | 1996-2003 | 34 | – | [309] | – |
| H + CH | メラノーマ | 2相 | 米国 | 1995-2000 | 34 | – | [310] | – |
| H+CH+S
(ハイペック+CRS) |
卵巣
癌 |
2相
3相 |
大韓民国 | 2010-2020 | 184名(HIPEC, 92名; 対照群, 92名) | 2年PFSはHIPEC群43.2%、対照群43.5%、5年PFSはHIPEC群20.9%、対照群16.0%であり、5年OSはHIPEC群51%、対照群49%であった。
5年OSは、HIPEC群と対照群でそれぞれ51.0%と49.4%であった。NACを投与された女性では、PFSの中央値はHIPEC群が20カ月、対照群が19カ月、OSの中央値はHIPEC群が54カ月、対照群が51カ月であった。 NACを投与したサブグループでは、2年PFSはHIPEC群37.2%、対照群29.5%、5年OSはHIPEC群47.9%、対照群27.7%であり、HIPEC群では、2年PFS、5年OSは対照群に比べ減少した。PFSで20カ月、OSで30カ月後。 |
[311] | [312] |
| H+B | 子宮頸部
癌 |
3相 | ポーランド | 2006-2009 | 224 | 初期および後期の合併症の分布については、HT群と非HT群との間に統計的な差は認められなかった。 | [313] | [314] |
| H+CH+S+CH
(HIPEC+CRS+CH)である。 |
大腸がん
原発 腹膜腔がん |
3相 | フランス | 2008-2015 | 265 | 追跡期間中央値は63.8カ月、OS中央値は細胞減量手術+HIPEC群で41.7カ月、細胞減量手術群で41.2カ月であった。 | [315] | [316] |
| CRS+HIPEC(ハイペック | 卵巣
癌 |
3相 | オランダ | 2007-2017 | 242 | OS中央値は、手術+HIPEC群で45.7カ月、忍耐の手術群では33.9カ月だった。 | [317] | [318,319,320] |
| H + CH | 肉腫 | 3相 | ドイツ | 1997-2012 | 340 | 追跡期間中央値は11.3年であった。化学療法とハイパーサーミアに無作為に割り付けられた患者は、ネオアジュバント化学療法のみに無作為に割り付けられた患者と比較して生存率が延長し、5年生存率はそれぞれ62.7% vs 51.3%、10年生存率は52.6% vs 42.7%であった。 | [321] | [322,323] |
| H+B | 子宮頸部
癌 前立腺 癌 |
N/A | 米国 | 2009-2020 | 13 | – | [324] | [325] |
| H + CH | 膀胱
癌 |
N/A | トルコ | 2012-2017 | 44 | 中リスク群、高リスク群では、24カ月目の無再発生存率はそれぞれ78.6%、80%、無増悪生存率は92.6%、76.7%であった。 | [326] | [327] |
| PDT + TT | 基底細胞
癌腫 |
1相 | 米国 | 2015-2017 | 4 | ORRは、90%がCR、10%がPRであった。 | [328] | [329] |
| PDT + CH | 膵臓がん | 1相 | 米国 | 2013-2018 | 12 | 追跡期間中央値10.5カ月、PFSは2.6カ月、OSは11.5カ月であった。 | [330] | [331] |
| PDT + S | 非小細胞肺がん | 1相 | 米国 | 2014-2018 | 8 | – | [332] | – |
| PDT + S | 頭頸部がん | 1相 | 米国 | 2006-2018 | 15 | 48カ月の臨床経過観察では、OSが10名、PFSが7名であった。主要目的は、腫瘍切除直後のHPPHを介した術中補助PDTの安全性を確認し、治療に安全に使用できるレーザー光の最高線量を決定することであった。 | [333] | [334] |
| PDT + B | 肺がん | 1相 | 米国 | 1993-2004 | – | – | [335] | – |
| PDT + ER | バレット食道の初期がん | 2相 | 米国 | 2005-2012 | 73 | – | [336] | – |
| PDT + S | 悪性中皮腫 | 2相 | 米国 | 1999-2010 | 12 | – | [337] | – |
| PDT + S | 非黒色腫皮膚がん | 2相 | 米国 | 1993-2007 | – | – | [338] | – |
| PDT + CH | 脳室周囲
胆管がん |
3相 | 大韓民国 | 2009-2013 | 43 | 併用療法を受けた患者は、PDT単独療法を受けた患者に比べ、1年SRが76.2%対32%と高く、OS延長中央値は17カ月対8カ月であった。PFSの中央値は併用療法で10カ月、PDT単独療法で2カ月であった。 | [339] | [340] |
表3がん患者における温熱療法とPDTの併用療法を含む、完了した介入臨床試験。
情報はClinicalTrials.gov(最終評価日:2021年4月26日)から、「条件または疾患」で検索して取得した。条件または疾患:’がん’、その他の用語。ハイパーサーミア」または「PDT」、募集状況:「完了」、試験タイプ:「介入研究(臨床試験)」で検索した。
併用療法のシェーマ。H-ハイパーサーミア、R-放射線療法、CH-化学療法。PDT-光線力学的療法、TT-標的療法、S-手術、DT-薬物療法、B-ブラキセラピー、ER-内視鏡切除術、LS-腹腔鏡手術、FRWBH-発熱域全身高熱療法、CRS-減量手術、HIPEC-高熱腹腔内化学療法、EPIC-術後早期の腹腔内化学療法、IT-免疫療法を指す。
(局所領域制御(LRC)、無増悪生存期間(PFS)、全生存期間(OS)、局所進行までの時間(TTLP)、局所制御(LC)、遠隔制御(DC)、無病生存期間(DFS)、全奏功率(ORR)、完全奏功(CR)、部分奏功(PR)、生存率(SR)、非該当(N/A)).
*
治療時間枠は、非常に慎重に考慮されなければならない。一般に、治療によって引き起こされる「治療時間枠」は、治療後に特定の時間だけ発生し、継続する[256]。
温熱療法、化学療法、および/または放射線療法を組み合わせた治療法は、臨床でかなり頻繁に使用されている。この関連で、温熱療法は主として癌性腫瘍の再酸素化の役割を果たす。したがって、腫瘍の再酸素化は、放射線療法に対する肯定的な反応を高め[257]、また化学療法に対して細胞を感作する可能性がある。
また、膵臓がんでは、ゲムシタビンとシスプラチンおよびハイパーサーミアの併用が、単独療法よりも良好な結果をもたらすことが示された[258]。一方、進行子宮頸癌の臨床試験では、トリプルモード治療が用いられた。その結果、74%の患者が再発症状なしに生存し、さらに5年全生存率は66.1%に達した[259,260]。
*
一方、PDTはネオアジュバント、アジュバント、反復アジュバント治療として手術と併用することができ、また放射線や化学療法との併用もうまくいっている。例えば、ラパマイシン、Bcl-2拮抗薬などのアポトーシス調節因子は、PDTによるがん細胞死を増加させることが示されている。
PDTと放射線治療の併用は、抗がん作用の強化につながる。例えば、症候性肺がん患者に対する光線力学療法と高線量小線源療法の併用は、忍容性が高く、満足のいく結果が得られた[261]。
4.1.相乗効果について
相乗効果の一般的な考え方は、様々な因子が相互作用することである。さらに、がん治療の文脈では、治療法同士の協力が含まれる。相乗作用と相加作用の違いは、相乗作用の場合は相互の影響に基づくメカニズムであるのに対し、相加作用の場合は個々の方法とその効果を足し合わせたものであることである。
相乗効果は、個々の治療法の合計よりも大きな影響を与え、より良い結果をもたらすはずで、そこに新しい治療品質が生まれるのである。相乗効果という現象を治療の文脈で考えると、様々な治療技術をマルチモジュールまたは複合的に適用する場合、方法の相互効果を強化することと定義できる。
このアプローチは、望ましい治療結果を強化するように設計されている。このような結果は、少なくとも2つの要因、2つの物質、あるいは治療という文脈では2つの方法を扱っているときにのみ生じる。相乗効果によって、治療の効果が高まることは間違いない。
モジュール化することでカスケードが始まり、治療効果に好影響を与えるため、併用療法を支える重要なアプローチとなる。もちろん、相乗効果は必ずしもポジティブである必要はない。残念ながら、部位効果も増強されることがある。それでも、併用療法を設計する目的は、抗がん剤の効果を高めると同時に、治療による有害な影響を軽減することである。
*
異なる治療法を組み合わせることで相乗効果が得られれば、がん細胞の増殖抑制、細胞骨格の破壊、ひいてはアポトーシスの確率を高めることができるのである。また、血管にダメージを与え、化学療法や放射線療法に対するがん細胞の抵抗力を低下させる。
さらに、使用する薬剤の作用機序を強化する。作用機序の異なる化学療法剤を併用する場合、相乗効果という概念が問題になることがかなりある。シスプラチン、ゲムシタビン、ビノレルビンは、肺がん治療においてプロテアソーム阻害剤と併用することも可能である。
科学的な研究によれば、上記の方法でかなり良い結果が得られている。さらに、アブラキサンとゲムシタビンを併用することで、興味深い効果を得ることができる。まず、ナブパクリタキセルをマウスに注射し、次にゲムシタビンを注射するという方法である。
この治療法は、6サイクル行われた。この実験では、高周波の電磁波(Radio Frequency-RFと呼ばれる)が使用された。RFを使用することで、腫瘍部分に温熱を誘導することができた。この実験では、このような治療法の有効性が示された。PANC-1同所腫瘍の大きさの減少が観察された[341]。
一方、血管の少ないマウス4T1腫瘍は、ハイパーサーミアの使用後、血管系の機能増加が最も大きいという特徴があり、著者らによれば、化学療法の使用を含む治療において有益である可能性がある[342]。
一方、PDTに関しては、ハイパーサーミアは血管新生に影響を与える腫瘍血管の損傷を引き起こすことができ、PDTと同様に細胞膜を損傷するため、これら2つのアプローチ間の相乗効果の発生を可能にする可能性がある[343]。
*
相乗効果の結果を論じるとき、通常、異なる方法を用いてがんを治療する場合、全体的な考え方は、順次作用することであることを強調する価値がある。ある方法は、前に使用した方法を補完し、強化する必要がある。
重要なのは、この方法によって、薬物、化学療法剤、光増感剤、放射線の使用量を少なくすることができ、治療の副作用を減らすことができることである。相乗効果が生じると、不可逆的な損傷(例えば、細胞の修復能力に影響を与えることによって)や放射線感受性が増加し、亜致死損傷に関しても増加することは強調する価値がある。
例えば、ある治療成分が最初に免疫反応を引き起こし、次に抗血管新生剤として作用し、その後がん細胞を標的にすることができるなど、異なるメカニズムも警告されることがある。さらに、低酸素状態のがん細胞の感受性を高めるだけでなく、あらゆる損傷の修復の阻害が起こる可能性がある。また、腫瘍内の化学療法剤の濃度上昇も著しい。
4.2.PDTとハイパーサーミアによる腫瘍治療の試み
科学的研究、出版物、および科学論文は、皮膚がん(例えば、メラノーマ、眼球メラノーマ、結腸がん、膀胱がん、食道がん、乳がん、頭頸部がん、肺がん)等のがんに対する光力学療法およびハイパーサーミアによる治療について述べている[344,345](2009年 12月現在)。白血病のような心血管系や循環系に関連するがんの治療という文脈で、PDTやハイパーサーミアの使用による治療に関連する研究についての情報を見つけることは困難である。
したがって、この2つの方法の具体的かつ一般的な原理を理解した上で、選択するがんは皮膚の表面、すなわちこの場合はメラノーマの性質を持つあらゆるがん病巣、または体内のがんである。
さらに、これらの方法は、肝臓、肺、膵臓など、私たちの身体に関連する臓器の治療にも使用され、その中で、このような非常に重要な構造を損傷することが非常に容易であるという事実のために、手術が選択肢とならない場所で腫瘍性病変が検出される。
PDTとハイパーサーミアは補完療法として扱われるため、固形がんや原発性腫瘍はもちろん、転移傾向のある悪性腫瘍の治療にも用いられている。したがって、光線力学療法やハイパーサーミアによるがんの治療の試みは、最も一般的ながんに対して実践されているようである[347,348]。
5.併用療法による薬物の取り込みとデリバリーへの影響
温熱療法と光線力学療法は、がん治療中の薬物送達と吸収に重要な役割を果たす。温熱療法は、おそらく薬物送達のレベルを変えることができる。それは、腫瘍の位置や構造に関連したある種の制限を解除することができる。さらに、細胞骨格そのものを変化させることができる。細胞骨格への一時的な損傷は、腫瘍を取り囲む細胞および血管の変形を引き起こし、その結果、薬物輸送が促進される[349]。
また、温熱療法は血管の伝染性を高め[350]、腫瘍病巣部への薬物送達に大きな影響を与え、使用する薬物の効果を向上させることも強調する価値がある。
がん治療治療における薬物送達の有効性は、意図的に改善されつつある。革新的な最新のキャリアを使用して、新生物病巣内での薬物の取り込み、吸収、輸送をより効果的にする標的治療[351] は、良いアプローチであると思われる。
このアプローチにより、薬物の分布と毒性に関連する多くの否定的で望ましくない副作用を取り除くことができる。他の治療法、例えば化学療法と組み合わせたPDTは、ほとんどの場合、化学療法剤の投与量をかなり少なくすることができる[352]。
薬剤耐性の問題は著しく軽減され、また毒性も軽減される。これらの治療法の使用による相乗効果により、所望の治療効果を得るために必要な投与量を下げることができる。
ハイパーサーミアやPDTの際にリポソームを使用するなど、薬物やそのデリバリーに何らかの変更を加えると、薬物の吸収にも大きな影響を与える。このアプローチは、効率的な送達と腫瘍領域での薬物の結合を確実にし、がん細胞に大きな影響を与え、細胞障害を引き起こす[353]。
熱的側面の使用を含む療法は、温度が著しく上昇する所定の領域における薬物放出速度を増加させる可能性もある[354]。
熱切除に関連する薬物輸送の文脈では、重要な問題がある。ハイパーサーミアによって誘導される高温の影響下で、様々な腫瘍形成促進因子を活性化することによって、癌細胞の増殖を増加させることが可能であることは興味深いことである[355]。
PDTの一部としての正常化も言及する価値がある。正常化効果は、血管の構造と機能の両面で一時的な正常化が起こるという事実に基づくものである[356]。
これによって、より良い治療結果を得ることができる個別の治療窓口が形成される。PDTによる血管の正常化という文脈では、ある種の物質を腫瘍組織の近傍に送達することに関する問題も存在する。これらの物質は、過剰な血管新生に対して働くと考えられている。
抗VEGF血管新生阻害剤は、損傷、変形、および漏出した血管をある程度規則正しく回復させ、腫瘍周辺組織の酸素供給を増加させるように設計されている[357]。これらの治療法の使用に伴って起こる血管の閉塞は、極めて重要である[358]。
温度上昇の影響を受けて、腫瘍組織は温熱作用により体積が増加する。その結果、腫瘍内部の圧力が変化する。腫瘍部分の圧力が低下すると、漏出が生じる。その結果、組織の周囲の圧力が上昇する。さらに、適切に選択された併用療法は、発生した熱の影響下でまず薬剤が送達され、血管が閉塞した後、血管剪断機構により治療物質が腫瘍内に閉じられることが理想的である。
量子ドットのように、ナノ粒子を診断やがんの治療に役立てようという試みがなされていることも特筆すべき点である。特に、がんの初期病変や早期ステージをより効果的に検出することが可能になる。また、ナノ粒子を用いた構築物を腫瘍部に使用する場合、ナノ金を使用することで薬剤の分布に寄与する。
さらに、ナノ粒子を抗体と組み合わせることで、治療効果を高めることができる。これはかなり有望なアプローチである。ナノ粒子は、多くの治療法に使用することができる。ナノ粒子と化学療法との組み合わせに関しては、このアプローチは、腫瘍領域に特異的に化学療法薬を送達する効率を高めることを主目的としている[359]。
その結果、治療の有効性が高まる可能性があり、特異的に作用するという事実のために、化学療法剤の毒性に関連する副作用を低減することが可能である。放射線療法と、このがん治療の方法とナノ粒子を組み合わせる場合、ナノ粒子の仕事は、がん細胞を感作することである。
例えば、金ナノ粒子は、特定の場所でフリーラジカルの産生が増加するため、その部分がより酸化され、低酸素状態が減少し、一定量の電離放射線に対して細胞がより敏感になることから、放射線治療の効果を高めることができる。
ナノ粒子は、PDTにおいてもその役割を担っている[360]。
光増感剤の担体が作られ、これは通常の担体よりもはるかに効果的に腫瘍領域に到達することができる。ハイパーサーミアの文脈では、磁気特性を示すナノ粒子を使用することが極めて一般的である。その結果、この治療法における代替エネルギー源として使用される[361]。
ハイパーサーミアの文脈における金ナノ粒子は、サーモアブレーションにも使用されている。この現象は、腫瘍の破壊を可能にする。一般に、ナノテクノロジーは、癌治療の文脈で重要で重要な役割を果たし始めており、現在治療で使用されている方法とナノ粒子を組み合わせることは、現在はるかに一般的になっている[362]。
これは将来的に有望な結果をもたらし、ナノ粒子の使用のおかげで、患者をより効果的に治療し、治療の副作用を最小限に抑えることが可能になる。これらの側面をすべて考慮すると、ハイパーサーミアと光線力学療法の両方が、薬物送達の点で有益であることを明確に述べることができる。上記の治療方法を使用することで、治療効果がより有益になり、薬物送達の問題やより良い吸収を改善することができる。
6.光線力学的療法とハイパーサーミアの併用療法
PDTとハイパーサーミアは併用することも可能である。特に、ハイパーサーミアは、PDTの低酸素の問題を解決することができる。Kelleherらはラット腫瘍の研究において、アミノレブリン酸に基づく光線力学療法(ALA-PDT)と43℃の局所温熱療法を同時に行う複合治療が、その成分の合計よりも効果的であることを実証した[363]。
さらに、温熱療法とクロロフィル光線力学療法(Bchl-ser-PDT)の併用では、腫瘍の酸素化が低下し、酸化的グルコース回転から解糖的グルコース回転に切り替わり、血管崩壊と流れのうっ滞が腫瘍消滅の重要な要素になることが示された[364]。
*
しかし、非常に有効な精密治療として広く認知されているPDTにおいて、低酸素状態の腫瘍に使用するための改良が重要な課題として残されている。低酸素の問題を解決する一つのアプローチは、PDTとハイパーサーミアの組み合わせであろう。
Liらは、低酸素腫瘍に対して、腫瘍に深く浸透すると同時に、光照射後に酸素を供給することができるポリマーベシクルの利用を実証している。すなわち、光照射後、過酸化水素を酸素に分解できる熱効果が誘発され、その後、660nmでの照射後、光照射の影響下で一重項酸素でコポリマーを分裂させてベシクルを迅速に不安定化し、クロリンe6/シペートを結合した光活性ポリ(アミドアミン)デンドリマー(CC-PAMAM)の放出を可能にした[365]。
*
さらに、黒川らは、ハイパーサーミア(42 ℃)による処理がミトコンドリア活性酸素種(mitROS)の産生を増加させ、それによってがん細胞におけるPDTの効果を高めることも示している。この現象のメカニズムは、mitROSによるheme carrier protein-1 (HCP-1)の発現レベルの上昇とABCG2トランスポーターの発現レベルの低下の両方による可能性が最も高いと考えられた[206]。
7.現在、がんの多剤併用療法で使用されている組み合わせの提案
放射線療法、化学療法、外科的手術は、がんの治療において信頼できる選択肢である[366]。現在、がんの治療には、化学療法と放射線療法を併用した多剤併用療法がかなり多く用いられている。さらに、標準的な治療法が基づいているメカニズムを改善することによって、治療効果を高める試みも行われている。その中でも、薬物、光増感剤、化学療法剤などのデリバリーについては、副作用を最小限に抑え、選択的に作用させることが重要である。
そのため、リポソームを用いて薬剤を送達したり、活性スペクトルの異なる化学療法剤を用いて治療効果を高めたりすることができる。また、遺伝子治療を用いた研究も行われ、新しい薬剤の設計も行われている。さらに、健康な組織を傷つけずに治療効果を上げるために、放射線を利用したガンマナイフやサイバーナイフなどの新しいメカニズムが開発されている。
7.1.放射線治療
放射線治療はがん治療において重要な位置を占めており、その主な目的はがん細胞の増殖能力を奪うことである。放射線は、それが通過する組織の細胞にエネルギーを蓄積する物理的要因であり、そしてこの蓄積されたエネルギーががん細胞を殺したり、がん細胞の死滅につながる遺伝子変化を引き起こしたりする[367]。
高エネルギー放射線による細胞殺傷の主なメカニズムは、細胞の遺伝物質であるDNAを損傷し、それによって細胞がさらに分裂して増殖する能力を阻害することである[367,368]。
放射線療法を改善する目的は、がん細胞への放射線量を最大化すると同時に、がん細胞に隣接しているか放射線を浴びている健康な細胞の被曝を最小限に抑えることである[367]。放射線療法は、手術、化学療法、免疫療法などの他の治療法と併用して行われることもある。
*
現在、一般的に行われているのは、「小線源療法」と「遠隔放射線治療」である。小線源療法は、放射線源を腫瘍にできるだけ近づけて治療する方法である。放射線を腫瘍に直接当てて治療するのが、小線源治療のメカニズムである。しかし、遠隔放射線治療では、放射線源はがんの領域内の組織から一定の距離を置いて配置される。
放射線治療の文脈では、放射線治療中に起こるいわゆる5Rの原理、すなわち再分配、再増殖、再酸素化、修復、および放射線感受性を強調する価値がある[369]。
放射線は、電離放射線(X線、ガンマ株など)と、電子、陽子、アルファ粒子、中性子による粒子線に分類される。生物学的な作用機序は、放射線の種類によって異なる(例えば、線状伝達エネルギーと細胞損傷の関連性)。一方、がん組織のパラメータは、がん細胞の分裂時の活性も大きければ、電離放射線に対する感受性が高まるなどの効果を誘発する。
しかし、分化の度合いが高ければ、細胞の放射線に対する感受性は低くなる。また、腫瘍の酸素化度も重要な要素である。腫瘍の酸素濃度が低いと、がん細胞は放射線に弱くなる(酸素濃度が高い組織では、酸素増加率は2.5~3倍)。放射線治療と関連して、目の悪性腫瘍の治療法として、陽子線治療という非常に興味深い方法がある。
この技術は、ブラッグピックを使って腫瘍にエネルギーを注入し、同時に腫瘍の周囲の健康な組織も安全に保たれる[370]。陽子線は、原発性癌細胞の転移能を抑制することができることが示された。
*
放射線治療の方法とメカニズムの結果、腫瘍の一時的な成長抑制または成長遅延、腫瘍の退縮が起こることがある。これらのメカニズムは、細胞周期の期間、細胞増殖分画の大きさ、あるいは細胞消失速度に影響されることがあるが、考慮しなければならない要因はたくさんある。
*
放射線治療を含む併用療法の潜在的なニーズという観点からは、いくつかの要因を考慮する必要がある。上述した細胞の放射線感受性(細胞周期、酸素増加など)については、放射線抵抗性の克服が主なニーズである。例えば、メラノーマはメラニンの蓄積(放射線防護の役割を果たす色素の蓄積)により、放射線治療に対してかなり抵抗性がある。
さらに、メラニンを含むがん細胞は低酸素状態であるため、低LET放射線に対する耐性が高い。細胞の分化度が高いことも、この抵抗性に寄与している[371]。
メラニンが存在するメラノーマの治療では、その役割はフリーラジカルを消去することである。このメカニズムにより、この色素を放射線防護剤のカテゴリーに入れることができる。電離放射線、例えばX線の影響からメラニンを保護するのだ。
特筆すべきは、この色素が、放射線照射中に生成されるフリーラジカルを不活性化することによって、放射線耐性を高めていることである。補完的な治療がうまくいけば、メラノーマの活性酸素に対する感受性を高めることができる。
*
組織の酸素化が不十分であるなど、放射線治療の限界は補完療法を用いることで克服することができる。その一つがハイパーサーミアで、通常、補完的に腫瘍を加熱することで、がん細胞の増殖抑制、破壊、あるいは放射線療法を含む様々な治療法への感受性を高めることを目的としている。
ハイパーサーミアと放射線治療の併用は相乗効果を示し、特に単独で適用すると通常放射線に抵抗性を示す細胞周期のS期にあるがん細胞に対する殺傷効果を高める[19]。
熱と放射線の相乗効果は、熱増強比(TER)として定義され、放射線に対する熱過敏性の大きさを、放射線単独および温熱療法との併用後の生存率商として定義する[372](Thermal Enhancement Ratio)。
温熱療法の効果には、放射線誘発性DNA損傷の修復を阻害し、それによって放射線治療の細胞毒性効果を増大させることが含まれるが、これらに限定されない[372]。
さらに、標的細胞の代謝活性を低下させることにより、熱は腫瘍の酸素需要を減少させ、腫瘍組織の酸素化も増加させるので、ハイパーサーミアは利用できる最も強力な放射線増感剤の1つである[373]。
*
放射線療法の限界を克服するもう一つのアプローチは、光線力学的療法との併用である。光線力学療法では、可視光線または近赤外線によって活性化され、酸素分子にエネルギーを伝達して活性酸素種を発生させる光増感剤が用いられる[373]。
特定の条件下では、光増感剤の中には放射線増感剤として作用するものがある。放射線治療と光線力学的療法の併用、すなわち電離放射線の組織浸透と光線力学的療法の併用により、浸透深度の問題を軽減し、健康な組織へのダメージを最小限に抑えつつ、臨床効果を低下させずに放射線量を低減することが可能となる[374]。
さらに、適切な光増感剤を放射線療法と併用することで、がん細胞の細胞毒性およびアポトーシス死が大幅に増加する可能性がある[375]。
核DNA損傷による細胞死が主目的である光線力学療法と放射線療法の併用は、光線力学療法が数種類のDNA損傷を誘発することから、細胞死における相乗効果の可能性がある[376]。
さらに、光線力学的療法は、炎症とがん細胞に対する免疫反応を誘発することで、免疫系の反応を改善することも可能である。光線力学療法による免疫刺激のメカニズムとしては、急性炎症反応による腫瘍抗原提示の増強、樹状細胞の活性化、局所および末梢リンパ節への誘導、細胞障害性Tリンパ球および NK細胞の刺激、免疫記憶の形成と将来的な腫瘍増殖抑制が考えられる[255]。
7.2.化学療法
化学療法は、抗がん剤治療の中でも非常に幅広いカテゴリーに分類される。化学療法剤の使用により、アポトーシスの誘導、有糸分裂の阻害、細胞周期の乱れなどが引き起こされる。静注薬は、アルキル化剤、アルカロイド、抗生物質、代謝拮抗剤に分類される。
チロシンキナーゼ阻害剤もまた、非常に重要な新規薬剤である。これらは、細胞のDNAまたはRNAを標的とすることによって細胞増殖に影響を与え、代謝拮抗薬はプリンまたはピリミジン代謝酵素に作用し、アルカロイドは細胞骨格と有糸分裂に作用する[377]。
化学療法の主な問題の1つは、効果的、安全、かつ選択的な薬物送達である。化学療法は、毒性の即時の兆候(皮膚や毛髪、骨髄や血液、消化管や腎臓などに影響が見られる)だけでなく、慢性毒性の後期の兆候(薬剤耐性、発癌性)を含む副作用の存在に関連している[377]。
化学療法の効果を高め、副作用を軽減するために、作用機序の異なる様々な薬剤の併用が行われる。さらに、複数の化学療法剤を使用することで、薬剤耐性に対抗することができる。また、毒性が重複しない薬剤を組み合わせて使用することで、化学療法の全体的な成績も向上する。
そして、治療による望ましくない副作用を恐れることなく、腫瘍に投与する薬剤の量を増やすことができるのである。1種類の薬剤の投与量を増やすと毒性が出るので、副作用を減らすためにこの方法がよく使われる。したがって、異なるグループの薬剤を組み合わせた方が毒性が低く、適用する治療量が増えるのでより効果的だと思われる。
作用機序の異なる薬を使う場合も同じだ。この場合、ある薬に感受性のない細胞は、この組み合わせのもう一つの薬にすでに感受性のある状態になっている。薬剤耐性癌の治療は、化学療法に限らず重要な問題である。この薬剤耐性のメカニズムは、化学療法剤だけでは腫瘍の内部に直接到達できないことが影響していると思われる。
それでも、このアプローチには、薬剤の灌流を改善し、腫瘍内での治療化合物の蓄積を高めるなど、他の課題もある。高温により細胞やその周囲に変化を与えるハイパーサーミアは、それを補完する良い手法と思われる。がん細胞の直接的な焼灼に加えて、温度の上昇は、特に熱に敏感な担体に対して薬物放出を誘発することができる[378]。
また、37℃から43℃への昇温は、細胞膜の伝染性を高め、ナノ粒子の吸収を促進することが知られており、同様にキャリアと細胞膜の相互作用を高める可能性がある[379]。
特に、クラスリンやカベオラを介したエンドサイトーシスのようなエネルギー依存性の経路は、高温での細胞膜の伝染性を高めることに関与し、その結果、薬剤やキャリアの内包を増加させる[378,379]。
高熱は血流にも影響を与え、したがって薬物分布も変化させる。確かに、腫瘍における熱による血流の変化は、腫瘍の血管系は熱を放散する能力が低く、高熱治療中に損傷を受けやすいため、通常の組織で起こる変化とは異なる。
しかしながら、穏やかな熱は腫瘍内の血流を増加させ、化学療法ががん細胞により大きな効果を与えることを可能にすることは注目に値する[373] ;したがって、ある種の腫瘍では、比較的低い温度まで加熱すると血流が増加する。一方、より高い温度(43℃または44℃)では、血管の閉鎖がより強く、より長く続くことになる[380]。
*
熱は、より効率的な薬物送達を可能にするだけでなく、多くの化学療法剤の細胞毒性も変化させることができる。多くの場合、相乗効果は、温度が上昇するにつれて薬剤が細胞を殺す速度が継続的に変化することで確認することができる。
ほとんどのアルキル化剤、白金化合物、またニトロソウレア剤の細胞毒性は、アルキル化速度定数の増加、薬剤吸収の増加、致死または亜致死の薬剤誘発ダメージの修復の阻害などの熱による増強によって、温度上昇とともに直線的に増加するのが普通である[381]。
*
さらに、温熱療法は、薬物送達が悪いために化学療法に比較的抵抗性のある腫瘍の低酸素中心部に位置する腫瘍細胞に対する殺傷効果を高める可能性がある。さらに、化学療法薬の中には、腫瘍の細胞毒性を誘導するために、フリーラジカルを発生させるために酸素を必要とするものもある。
温度が上昇すると生化学反応の速度が上がり、細胞の新陳代謝が活発になり、その結果、酸化ストレスが増加することが知られている。高温にさらされると、ミトコンドリア呼吸鎖の機能障害、あるいはNADPHオキシダーゼやキサンチンオキシダーゼという酵素の活性上昇により、活性酸素のレベルが上昇する可能性がある[382]。
7.3.外科的介入
手術は、現在のがんの三大治療法の一つであり、最も古い治療法でもある。がんの治療において最も重要な役割を担っている。その適用範囲は、病変の診断、すなわち診断のための生検から、腫瘍塊の縮小、さらには健康な組織のマージンをとって病変を完全に切除する根治的治療まで、多岐にわたる。
早期の新生物、特に転移がない場合には、健康な組織のマージンをとって腫瘍を完全に切除することが最も効果的な治療法である。腫瘍手術中に十分なマージン不足が生じると、有害な治療結果や病気の再発のリスクが最小化される[383]。
場合によっては、腫瘍の好ましくない位置または播種性転移の存在によって、腫瘍の切除が不可能になることがある。したがって、特に血管系領域の手術の場合、その他の重要な領域の場合、および隣接組織に腫瘍が浸潤している場合には、必要なマージンを確保することが常に可能であるとは限らない。
この問題は、肝細胞癌、膵管腺癌(PDAC)、神経芽腫、消化管神経内分泌腫瘍などの新生物に当てはまる。血管の侵襲は、静脈または動脈などの侵襲を受けた血管の外科的切除および再建によって解決できることもあるが、これらの処置は、特に動脈の場合、患者にとってリスクの増加につながる[384,385]。
*
結論として、適切な切除断端が得られないと、外科的および腫瘍学的に予後不良のリスクが高まり、これは通常、腫瘍が大血管に浸潤している場合に起こる[385]。
腫瘍病巣全体を切除できない場合は、手術と放射線療法を併用することが多い。術後放射線療法は、がんの再発リスクを低下させるとともに、特に腫瘍のみを切除し、その周囲の通常の組織を少量しか切除しなかった場合や、がん細胞が陽性であるマージンを残した場合に、残存するがん細胞を破壊するのに有効である。
術後放射線治療の適応は、切除縁が不十分な場合だけでなく、切除の根治性が不確かな場合、組織にびまん性のがん病巣が浸潤している場合、腫瘍の分化度が低い場合などにも適用される。したがって、ほとんどの場合、手術と放射線治療の併用などの治療法のみが、がん細胞を破壊する唯一の方法であるのが普通である[373]。
*
手術不可能な血管に近すぎるために外科的に切除できない腫瘍領域の問題に戻ると、1つの興味深い補完的な方法がある:局所的で穏やかなハイパーサーミアの使用である。均一で穏やかな加熱を行うことにより、血管を取り囲む腫瘍を破壊すると同時に、これらの繊細な構造を損傷から保護することができる[385]。
41~46℃の範囲での温度上昇は、癌幹細胞の除去を含む癌細胞の死滅と、癌細胞のプロテオミクスプロファイルの変化をもたらし、同時に通常の細胞を保護することが(膵管腺癌の例で)示されている[385]。
*
また、手術の補完的な方法として、化学物質(光増感剤)と光、酸素の相互作用による複雑な細胞死現象を利用した光線力学的療法がある。光線力学的療法は安全で効果的な方法として認識されており、そのため標的の正確さでがん治療においてユニークな役割を担っている。治療した病巣を取り囲む健康な構造物を損傷することはなく、アクセスが制限されたがん腫の治療に適用される[386]。
全身的な光線力学療法では光増感剤の分布が広いが、健康な組織よりも癌組織に蓄積する可能性が高く、多部位の深部照射が可能であり、標準または最小限の外科的アクセスと組み合わせて術中に行うことができる[386]。
その結果、光増感剤のがん細胞への優先的な蓄積を、適切な照射の選択とともに利用することで、外科的切除ができない残存腫瘍片を除去することが可能となる。光線力学療法は、癌を緩和するためのネオアジュバント療法として、手術前に使用される場合もある。
*
光線力学療法は、がん細胞を破壊するだけでなく、病変部を検出する光診断に用いられる蛍光現象とも密接な関係がある。前述のように、紫外光と可視光では、健康な組織と異常な組織の光学的性質が異なる。内因性の発色団により、組織によっては特徴的な蛍光発光帯を示すが、疾病の進行に伴い、これらの発色団成分が変化する[386]。したがって、適切な波長を用いることで、自家蛍光光診断の基礎となる画像を得ることができる[386,387]。
この方法は、組織診断のための最適な生検部位を決定するのに役立つと思われる。内因性発色団の使用に加えて、光増感剤を外因性発色団として使用し、蛍光を増強することができる[386]。
このような増強された光診断法の使用は、切除縁に存在する可能性のある残存腫瘍浸潤を示すことができる外科手術において特に有用である。さらに、脳外科手術において、肉眼では見えない腫瘍の残骸を除去する際や、顕微鏡の手術器具を使用する際に使用することができる[386,388]。
8.治療模倣因子としての低酸素症
低酸素現象は、O2分圧が特定の組織に特有の臨界閾値以下に低下した状態、あるいは生化学的な観点からはO2制限電子輸送として定義される[389]。
癌細胞では、血管新生不良や酸素消費量の増加、病的な血管構造、貧血など、いくつかの機序により低酸素状態がしばしば発生する。低酸素は0.01%未満(無酸素)から5%の範囲の酸素張力で、慢性、急性、または周期的であり、がん細胞に対して異なる影響を及ぼす[390]。
放射線生物学の観点からは、pO2<10mmHgで定義される低酸素率(腫瘍内の低酸素体積の割合)が治療反応に極めて重要である[391]。
*
低酸素状態は、がん細胞をより攻撃的にし、あらゆる種類の治療に対する抵抗力を高める。腫瘍内の酸素量は、腫瘍の病期や大きさ、細胞の代謝にも依存する。腫瘍の低酸素に関連するシグナル伝達経路は、通常、HIF誘導型低酸素因子によって誘導される。
HIF-1αおよびHIF-2αの過剰発現は、血管新生、攻撃性、および治療に対する抵抗性の増加を引き起こす[392]。
低レベルの酸素は通常、腫瘍に見られる。それは、血管の障害、不適切な構造によって引き起こされるかもしれない。腫瘍の低酸素化は、がん治療における深刻な課題であり、低酸素化した腫瘍は、酸素が十分に供給された腫瘍よりも治療がはるかに困難であることが多い。
*
低酸素の発生は、腫瘍の大きさや種類に依存せず変化することが示された。これは間違いなく治療抵抗性を高める要因である。腫瘍を形成するがん幹細胞(CSC)は、誘導、進行、および転移能の増加の潜在的なイニシエーターとして認識されている。
さらに、がん幹細胞は、腫瘍をより不均一にし、腫瘍の破壊を直接目的とするあらゆる治療法に対する抵抗性に確実に影響を与える。このとき、低酸素ニッチが低酸素の現象を決定する可能性がある。低酸素そのものが、幹細胞の表現型に実際に寄与している因子であると考えられている。
低酸素ニッチでは、幹細胞は発癌性細胞になり、さらに転移を引き起こす。低酸素状態の細胞は治療に対する感受性がはるかに低く、腫瘍内に血管の混沌としたネットワークが存在するため、化学療法剤を蓄積する能力が著しく低下する[393]。
*
腫瘍が低酸素状態になると、通常、がん治療が効かなくなる。残念なことに、この状況は癌の転移を増加させる。低酸素状態の細胞は、正常状態の細胞と比較して、より攻撃的であることは間違いない。低酸素状態の細胞は栄養不足であり、低酸素ニッチを形成する過酷な微小環境に適応しているためだ。
低酸素環境の違いの一例として、酸性pHと低pO2の相関が挙げられる[394]。腫瘍部位が加熱されると、そのような細胞は適切に増殖し、規則的な代謝を行う細胞よりも損傷および死に対して感受性が高くなるはずだ。腫瘍の周囲に壊死があれば、ほとんどの場合、がん細胞の収縮が観察されることは強調に値する。一方、がん幹細胞はそのような環境でも生き残ることができ、将来のがん再発の原因となる可能性がある。
ハイパーサーミアとそれに伴う腫瘍部位の温度上昇は、がん細胞に影響を与える。体温調節のメカニズムが障害されつつあり、血管の損傷により効率的な熱放散が行われない[393]。
*
存知のように、腫瘍の中には酸素濃度の低い領域が存在する。この状態は、放射線に対する抵抗力が強いため、治療の選択肢を狭めることになる。この現象に対抗するためには、腫瘍内の酸素の利用可能性を高める必要がある。この目的のために、ハイパーサーミアが使用されることがある。
腫瘍に栄養、薬物、酸素を供給している血管の血流を増加させる。血管の血流が増えれば、腫瘍自体や周辺組織の酸素化も確実に改善されるはずだ。このアプローチのおかげで、少なくともしばらくの間は低酸素の状態を減らすことができ、それによって与えられた時間枠の中で細胞を放射線に感作することが可能になり、DNA損傷の場合には修復機構が弱められることになる[395]。
*
一般に、低酸素領域は灌流が悪く、薬物蓄積能に影響を及ぼす。低酸素状態の細胞が抵抗性を示す理由の一つは、亜致死量の化学療法剤の濃度に関係していると推測される。その結果、がん細胞はABCトランスポーターの存在により、薬物を除去する能力を獲得し、治療に対する抵抗性が強くなる。
低酸素状態では、ABCG2の発現制御が高まり、光増感剤の腫瘍部位への集積が少なくなるため、より多くの細胞が生存できるようになる。このため、光線力学療法はあまり効果的でなくなる[364,396]。
さらに、腫瘍の低酸素分画の細胞は細胞周期のG0期にあることが非常に多く、DNA合成を停止させるなどの設計の化学療法薬に対する耐性が高くなる。このような問題は、血管からの距離に依存して蓄積される光増感剤の局在に影響を与える可能性がある。
(a)アクティブターゲティング:薬物がGLUT-1のような分子標的に対して親和性を持つ場合、(b)パッシブターゲティング:例えばpH、親油性、サイズなどにより、薬物が低酸素画分に局在する可能性がより高い場合である。
時間スケールでの受動的ターゲティングは、光増感剤にとって非常に興味深いオプションであり、PSの注入と照明の間の時間間隔を長くすることで、灌流の悪い領域でのPSの局在を改善できることが示された[21]。
*
化学療法に感受性がある細胞は、主に比較的速い増殖速度を特徴とするタイプの細胞であり、このことは、通常増殖の程度がはるかに遅い低酸素状態の細胞を区別し、化学療法剤がゆっくりと分裂する細胞には作用しないことを意味する。薬物耐性は、細胞周期を停止させた結果として生じることがある。状態を変えて細胞の代謝速度を下げたり、DNAの複製速度を上げることも重要な役割を果たす。
さらに、低酸素はオートファジーに寄与し、がん細胞のプロアポトーシスと生存の両方を引き起こす可能性がある。また、低酸素に起因するオートファジーが薬剤耐性の発生と関連していることが報告されている[397]。
オートファジーのプロセスは、損傷した細胞成分の分解を可能にし、それは化学療法剤の使用によって起こるであろうアポトーシスの前の一種の応答である[398]。例えばシスプラチンの使用は防御反応の刺激を可能にし、その結果、AMPKとmTORの誘導と調節を通じてオートファジープロセスが開始される[399]。
低酸素は、腫瘍が切除された部位の手術によって引き起こされることもある。腫瘍学的手術は、新生物細胞の移動および転移の能力を高め、同じ場所に腫瘍を再発させる[400]。
*
現在、がんの高濃度低酸素状態が関与するPDTを改善する研究が進められている。PDTにおいて、低酸素は明らかに深刻な問題である。なぜなら、がん細胞における酸素の不足は、活性酸素の産生を大幅に低下させるからだ。低酸素条件下で効果的な腫瘍反応を達成するためには、何らかの形で腫瘍の再酸素化を促進するように併用療法を最適化する必要があるであろう[343]。
低酸素誘導因子(HIF)の腫瘍抵抗性に対する作用も重要である。低酸素分圧は、多面的なHIFs関連シグナル伝達カスケードを誘導し、血管新生、アポトーシス、転移、または細胞代謝を調節することができる。PDT後、低酸素状態は、短期間または長期間に渡って腫瘍内部で観察されることが非常に多い[21]。
非常に短い低酸素期間であっても、HIFsと血管新生の促進を引き起こす可能性があることを強調しておく必要がある。併用治療戦略のひとつに、PDT後のVEGFの阻害がある。要約すると、光線力学療法の文脈では、低酸素細胞に作用するいくつかの光増感剤が存在する。
それらは酸素濃度の低い細胞でのみ放射線に対する感度を選択的に上昇させる。X線による腫瘍の破壊は、放射線や薬剤に非常に耐性のある低酸素細胞の存在によってしばしば妨げられることも注目すべき点である。この文脈で強調する価値があるのは、腫瘍の低酸素はしばしば局所的な現象であるということである。
腫瘍内の低酸素領域の位置を決定することにより、この領域により多くの放射線を照射することが可能となり、治療指数を高めることができることが示唆される[391]。
*
低酸素状態は、がん細胞を放射線に対して抵抗性にし、酸素濃度の非常に低い腫瘍の微小環境下でがん細胞が生存することを可能にする。低酸素状態のおかげで、細胞は遺伝物質の損傷を抑制する能力が高まっている。細胞が低酸素状態にあるとき、ヒストンの翻訳後修飾とDNAのメチル化が起こる可能性がある[401]。
周知のように、放射線治療中にはDNAへの直接的、間接的な損傷があり、低酸素による遺伝物質への損傷がなく、何らかの補償があれば、放射線治療の効果はない。また、低酸素状態では酸化ストレスに対する抵抗力が増大し、放射線治療が効かなくなる。放射線感受性の程度を下げるのは、主にHIF-1αが関係しており、放射線治療に対する腫瘍の感受性の程度に大きく関わっているようである[402]。
*
この場合、腫瘍の酸素化した外部部分を効果的に治療するために、分割された放射線療法を使用することが利用可能な選択肢の1つである。このアプローチにより、以前に低酸素状態であった腫瘍細胞が再酸素化され、まだ生存可能であり、この時点で放射線療法をPDTと組み合わせて、以前に低酸素状態であった腫瘍部分を効果的に治療することができる[343]。
これは、腫瘍の血管系を標的として、腫瘍の血管新生を開始させ、腫瘍組織の再酸素化につながることが示されている[403,404]。しかし、腫瘍の血管新生が腫瘍の成長をもたらすという事実のために、この解決策は慎重に検討されなければならない。
低酸素は間違いなくがん治療に悪影響を及ぼし、あらゆる方法の有効性を低下させ、病気の発症を早めることに関連する。間違いなく、低酸素の腫瘍環境がPDTを含む併用療法の効果に与える影響も大きく、様々な治療法を評価する際に考慮されるべきである。
9.結論
がんの不均一性と疾患の複雑性から、提案された治療手順は個別化されるべきである。がんの種類、特定のバイオマーカー、病期、併存する疾患などは、治療計画を立てる際に考慮すべき長い要因のほんの一部に過ぎない。治療法の選択には、常にがん細胞との戦いと副作用の最小化とのバランスを見つけることが必要である。
副作用を抑え、がん細胞を集中的に破壊し、抗がん免疫力を高めるには、併用療法が最も有望な方法の一つである(図2)。その中で、光線力学的療法とハイパーサーミア療法は、補完療法として最適な候補と考えられる。
第一に、どちらも部位特異的であり、アポトーシス、ネクローシス、およびさまざまな種類の細胞死を誘導することによって、がん細胞を直接殺すことができる。
第二に、どちらの方法も腫瘍の灌流と血管構造に用量依存的に大きな影響を及ぼし、次のことを達成することができる:
- (a)血管の剪定、流れの遮断、重度の低酸素(熱切除と血管標的PDT);
- (b)血液灌流の刺激により、良好な組織灌流と腫瘍内部への効果的な薬剤集積(軽度高熱療法、細胞標的PDT)をもたらすことが可能である。
最後に、温熱療法とPDTは、腫瘍内部の局所的な強い免疫反応(炎症)を誘発するだけでなく、がんに対する全身的な反応を誘発することができる。PDTやハイパーサーミアだけでも、化学療法、免疫療法、放射線療法、手術と同様に、特定の種類のがんに対して有効であることが示された。
しかし、現在の統計では、がん患者の3人に1人は治癒不可能とされている。科学者は常に新しい治療法を開発しているが、私たちがすでに知っていることから新しい質を引き出すことにもっと注意を払うべきかもしれない?臨床経験では、併用療法は単に基本的な治療法の総和ではなく、最適化されたマルチモジュール治療が新しい質を生み出し、治癒を見出すのに役立つことが分かっている。
このような治療の実施には、何よりも有能な人材と専門的な設備が必要である。これらの治療法を効果的に行うには、治療期間を設定することが重要である。最も重要なことは、このような治療を開始するためには、治療の作用機序だけでなく、ナノドラッグの作用の速度論を徹底的に理解する必要があることである。これらすべてが、より高い治療の成功につながるのである。
図2 細胞、血管、免疫レベルでのハイパーサーミアとPDTの効果
謝辞
Martyna Krzykawska-Serdaは、国立科学センター(ポーランド)の支援(助成金番号UMO-2018/29/B/NZ5/02954)に感謝する。アレクサンドラ・ビエニアは、ヤギェロニア大学に感謝する。
本研究は、ヤギェロニア大学のStrategic Programme Excellence Initiativeの下、Priority Research Area POB BioSからの助成金によって行われた。すべての図はBioRender.com(出版権およびライセンス権の確認-25 June 2021)を使用して作成された。
資金調達
本研究は、国立科学センター(ポーランド)、助成番号UMO-2018/29/B/NZ5/02954の助成を受けて行われた。
利益相反
申告すべき利益相反はない。