Contents
Light stimulation of mitochondria reduces blood glucose levels
初公開: 2024年2月20日
要旨
ミトコンドリアは代謝を制御しているが、太陽光はその速度に影響を与える。赤色光(670nm)による光バイオモジュレーション(PBM)は、ミトコンドリア膜電位とアデノシン三リン酸産生を増加させ、グルコース需要を増加させる可能性がある。ここでは、グルコース負荷試験を用いて、健常被験者のPBMが血糖値を有意に低下させることを示す。670nmの光を15分間照射すると、グルコース摂取後の血糖上昇の程度が、グルコースチャレンジ後2時間にわたって積算して27.7%減少した。最大グルコーススパイクは7.5%減少した。その結果、670nmの光を用いたPBMは、食後の血糖値スパイクを減少させるために用いることができる。この介入は、身体に有害な血糖変動を減少させる可能性がある。
1 はじめに
ミトコンドリアは、酸素とグルコースを使ってエネルギー豊富なヌクレオシドであるアデノシン三リン酸(ATP)を産生し、細胞代謝のエネルギーを供給している。ATPの生産は、加齢や病気によって減少する。可視域から近赤外域にまたがる~650~900nmの長波長光による光バイオモジュレーション(PBM)は、ミトコンドリアのATP産生をアップレギュレートし、活性酸素種も減少させることが立証されている[1-5]。PBMによるこのアップレギュレーションは、種や動物界を超えて保存されている[6-9]。
長波長の光は、ミトコンドリアの電子輸送鎖にあるシトクロムCオキシダーゼによって吸収される。これにより電子輸送活性が上昇し、ミトコンドリア膜電位とATP産生が増加する[10]。また、長波長の光は、回転式ATPポンプを取り囲むナノ水の粘性を低下させ、その効率を向上させるという証拠もある[11]。
ミトコンドリアによるATP産生の670 nm PBM誘発性アップレギュレーションは、ATP産生が低下している老化またはチャレンジした系で顕著である[4,5,12]。また、中枢神経系(CNS)のような代謝活性の高い領域では、より顕著である。その結果、加齢によって減少したATPは、ハエ全体では~30%改善され[13]、マウスの網膜では15%、マウスの脳では~50%改善される[5]。
670nmの光を1回照射すると、3時間以内に効果が現れ、最長で5~7日間影響を与えることができる[8]。決定的に重要なのは、このような改善は、体全体に伝達される血清サイトカインシグナルに大きな変化をもたらすということである[14]。これがアブスコパル効果を仲介している可能性がある。この効果はがん治療において確立されており、原発性腫瘍に特異的な放射線を照射すると、遠位に位置する二次性腫瘍が縮小する。同様に、マウスの背中に670nmのPBMを選択的に照射すると、パーキンソン病モデル[16]や糖尿病網膜症モデルマウスの網膜が改善することが示されている[17]。
ATP産生の改善は、機能のポジティブな変化につながることが示されている。これには、ハエにおける運動能力や感覚・認知能力の範囲[9]、動物モデルとヒトの両方における視覚能力の向上[8,18]が含まれる。このような効果が広く一般的に見られるのは、CNSの細胞内の膜ポンプが、モダリティに関係なく、正常な機能を維持するために大量のATPを消費するからである。
670nmのPBMはミトコンドリア呼吸を改善し、全身に影響を及ぼすことが証明されており、ATP産生の増加はグルコース消費の増加を要求する。したがって、血漿グルコースレベルの変化からこのことを検出できるかもしれないという仮説を検証する。この仮説を支持する証拠は、昆虫において光が循環グルコース濃度を調節できるという発見から得られている[19]。我々は、670nmのPBMが、標準的な経口ブドウ糖負荷試験の過程でヒトの循環血漿グルコース濃度に及ぼす影響を調べることによって、この仮説に取り組む。
2 方法
2.1 研究コホート
本研究は、ロンドン大学シティ健康心理科学研究倫理委員会(ETH2122-1596)の承認を得た。すべての研究が関連するガイドライン/規則に従って実施され、参加者全員がインフォームド・コンセントを得たことを確認する。本研究はヘルシンキ宣言に従って実施された。30名の健康な参加者を募集した:670nmのPBM群15名(平均年齢41.1±13.1歳)、プラセボ群15名(光なし、平均年齢38.3±13.7歳)。彼らは既知の代謝性疾患はなく、薬物も服用していなかった。脂肪率はグルコース代謝に影響するため、各参加者の肥満度は測定されなかった。
2.2 研究プロトコル
参加者は、募集時点で670nmのPBM群とプラセボ(光なし)群のいずれかに無作為に振り分けられた。すべての参加者は、7日間にわたり2回の空腹時経口ブドウ糖負荷試験(OGTT)を行い、毎回75gのブドウ糖を150mLの水に摂取した。毛細血管血中グルコース濃度は指プリックテストで記録し、呼吸終末二酸化炭素分圧(EtCO2)は安静時に15分ごとに2時間測定した。両群のすべての患者について、初診時に対照OGTTが記録された(図1A)。
図1 研究プロトコルとデータ解析デザイン
研究プロトコルのフロー図(A)とデータ解析の概要(B)。(A)30人の参加者が無作為に670nm光バイオモジュレーション(PBM)群とプラセボ群に割り付けられた。各参加者は2回の診察のために来院した。1回目の来院時には、空腹時経口ブドウ糖負荷試験(OGTT)を行い、その間に循環血糖濃度と呼気終末CO2(EtCO2)を測定した。彼らは7日以内に2回目の訪問を受け、その間にまず670nm PBM(670nmPBM群)または光照射なし(プラセボ群)のいずれかの介入を受け、その後2回目のOGTTが行われ、血糖値/EtCO2データが収集された。(B)データは3つの比較セットで分析された。まず訪問2からの2つの介入データセットを比較し、介入タイプの統計的差異を決定し、プラセボ効果を除外した(B1)。個人のOGTT反応にばらつきがあるため、この比較で偽陽性の結果が出るリスクを抑えるため、各参加者のデータを訪問1の間に採取された対照の結果と比較し、一対の参加者分析を行った(B2、B3)。B)には、循環血糖(グルコース)とEtCO2に関する各比較結果への図番号リンクが含まれている。
7日以内に、2回目のOGTTが実施され、その際、670nm PBM群は、グルコースを摂取する45分前に15分間の670nm光照射を受けた。プラセボ群の参加者は、15分間同じ位置に置かれたが、670nmの光は照射されなかった(図1A)。光のエネルギーとタイミングは、以前の研究[12]と一致している。
解析のためにOGTT間で3つの比較が行われた(図1B)。比較1:670nmのPBMとプラセボの介入結果を比較した。群間比較から得られた知見が、個人の反応間の顕著な変動によるものではないことを確認するために[20]、一対参加者分析も実施した。個人の対照OGTT反応データ(訪問1時に得られた)を、介入(訪問2)後の同じ個人のOGTT反応データと比較した。比較2:670nmのPBM群内での一対参加者分析、比較3:プラセボ群内での一対参加者分析。さらに、OGTTに対する反応の個人間のばらつきが知られていることから、対になった解析の前後に被験者内解析も実施することで、有意差を検証した。このペア解析は、介入を実施しなかった来院と介入(プラセボまたは670nm光照射)を実施した2回目の来院との間の個人の変化を報告する。670 nmのPBMは、1回の照射後、~5~7日間効果が持続すると報告されている[8]。また、個人のOGTT反応曲線は長期間にわたって変化することが報告されている[21]。したがって、これらの未知の変数の影響を避けるために、クロスオーバー研究デザインは実施されなかった。
2.3 経口ブドウ糖負荷試験と血糖モニタリング
参加者は、OGTTの少なくとも10時間前から一晩絶食し、水のみを摂取した。最初の指穿刺による毛細血管血糖値の測定は、感度が実証されている血糖モニター(Kinetik Wellbeing、英国)を用いて行った[22]。その後、参加者は75gのブドウ糖を水(総量150mL)に溶かし、2分以内に摂取した。グルコース摂取後、さらに0分(絶食)、15分、30分、45分、60分、75分、90分、105分、120分後に指プリックで血中グルコース濃度を測定した。
2.4 呼吸器の測定
呼気終末二酸化炭素分圧(EtCO2)と呼吸数は、血糖と同じ時間間隔で測定された。これは、PC-900B Handheld SideStreamEtCO2モニター(PROACT medical社、英国)と鼻カニューレを用いたカプノメトリーによって行われた。
2.5 光照射
参加者の2回目の来院時に、OGTT測定の前に介入が行われた。670 nm PBM群では、最初の血糖測定直後に、参加者は背中の上部800cm2の領域に670 nmの光を40 mWcm-2(28800 J)の強度で15分間照射した。これは、皮膚細胞と僧帽筋を含むその下の筋肉組織を照らすことになる[23]。光は発光ダイオード(LED)で照射された;ピーク波長670 nm、半値電力帯域~10 nm (Light Power Health, UK)。LEDアレイは参加者の背中から400mmの位置に設置され、光の漏れを防ぐため、参加者の皮膚に当たるシールドで囲まれていた。プラセボ群も同じ手順を行ったが、プラセボ介入中はLEDアレイのスイッチを入れなかった。
2.6 統計分析
初期循環血糖濃度およびEtCO2分圧は参加者間でばらつきがあるため、絶対値とともに0分(空腹時)の初期測定値からの偏差を解析に用いた。2時間のOGTTにおける血中循環グルコース濃度は、経時的な循環血糖の曲線下面積を測定することにより決定した。これは、連続した時間間隔におけるデータ点間の線形性を仮定して実施された。2群の介入結果(670nm PBM vs. プラセボ)を比較するために、各介入はまずその群の対照OGTTデータに対してベースラインされ、各参加者についてこれに対する相対値で表された。有意差の検定には、一般線形モデルを用いた反復測定分散分析(MANOVA)とポストホックMann-WhitneyU検定を用いた。参加者内のデータを比較するペアデータ分析には、ポストホックWilcoxon Signed Rank Testを用いた(いずれも両側検定、SPSS v25)。エラーバーは平均値の標準誤差を算出した。グループの年齢範囲は標準偏差とともに報告されている。
3 結果
3.1 赤色光が血糖値に及ぼす影響
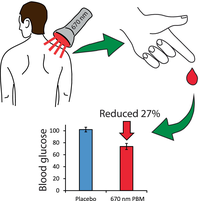
OGTTデータは、データが絶対値から作成されたか、または時点0分に対してベースライン化されたかにかかわらず、グルコース摂取後最初の30分間にわたって、670nm PBM群とプラセボ群で同様であった(図2A,B)。時点0分に対してデータをベースライン化すると、グルコース摂取後の血中グルコース濃度の偏差が報告される。670nmのPBM介入の効果を曲線下面積でプラセボと比較すると、PBMは全体の血糖濃度を7.3%低下させた(図2C、p=0.0061)。最初のグルコース測定値に対してベースライン解析したデータでは、摂取後の血糖上昇は27.7%減少した(図2D、p=0.0002)。
図2 670nmの光バイオモジュレーション(PBM)は血糖値を低下させる
経口ブドウ糖負荷試験(OGTT)の45分前から670nmの光を15分間照射(n=15)すると、プラセボ介入(光なし、n=15)と比較して、45分後の時点から血糖値が有意に低下した。これは、絶対血糖濃度を比較したときに観察され(A)、各参加者の時点0分からの血糖値の変化を分析することによって確認された(B)。曲線下面積分析によると、総循環グルコース濃度が7.3%減少し(C、p =0.0061)、グルコース消費後のグルコース濃度上昇が27.7%減少した(D、p =0.0002)*p<0.05、**p<0.01、***p<0.005。エラーバーは平均値の標準誤差。
反復測定ANOVAにより、絶対血糖濃度(p =0.035)およびベースライン・データからの摂取後のグルコース濃度の上昇(p =0.049)に有意差があることが確認された。事後分析では、負荷後45分、60分、75分、90分の時点において、両測定値における有意な低下が強調された(図2A,B)。
OGTT反応には個人差があり[20,24]、グループ間で観察された結果に影響を及ぼす可能性がある。所見を確認するために、介入なし(対照)の個人の反応と、その後の670nm PBM後の結果を比較する、一対の参加者分析を実施した(図3A-H)。670 nm PBM群では、PBMは絶対血糖濃度を低下させた(図3A)、p=0.08 MANOVA、Wilks’ lambdaF=40.5、p<0.001は、個々の時点における有意性の可能性を示した。個々の時点における有意差は、事後分析によって確認された。これらのデータをタイムポイント0に再基準化すると、血糖値は同様に低下した(図3B、p<0.001)。どちらの比較方法でも(図3A,B)、post hoc分析では、ブドウ糖摂取60分後の濃度に有意差があり、2時間後に元に戻るまで有意差は維持された。
図3 670nmの光バイオモジュレーション(PBM)は、個人内の経口ブドウ糖負荷試験反応を変化させる
PBM前後の経口ブドウ糖負荷試験(OGTT)反応を比較したペア参加者分析(A-D)。670nmのPBMは、個人において、絶対血糖濃度(A)およびOGTTの時点0分からの血中偏差(B)を減少させた。曲線下面積分析では、PBM後のOGTT中の総血糖濃度が7.9%減少し(C、p=0.0012)、その結果、摂取後の偏差が26.3%減少した(D、p=0.0008)。(E-H)単一集団内でのグルコース応答は、プラセボ介入について上記と同様に実施された;絶対血糖濃度の比較、またはOGTTの0分からの変化の分析では、有意差は認められなかった。***p<0.005、nsは有意ではない。エラーバーは平均値の標準誤差。
OGTT中の絶対グルコース濃度は、曲線下面積分析を用いて評価され、これは、PBM後のOGTT中の絶対血糖濃度の7.9%減少を示した(図3C、p =0.0012)。再吸収後の血糖変化のベースライン・データは、670nmのPBM後に26.3%減少した(図3D、p=0.0008)。
プラセボ群の参加者内データで、プラセボ対照とプラセボ介入の結果を比較すると、対照来院時と介入来院時の血糖値に差はなかった(図3E-H)。
この研究では、血糖値スパイクに対する670 nm PBMの効果も検討した。670 nm PBMとプラセボの介入を比較すると、到達したグルコース濃度のピーク値が12.1%減少し、10.8mmol/Lから9.5mmol/Lに減少した(p= 0.0102;図4)。これとは別に、670nm群内のペア解析では、最大グルコースピーク値が10.3mmol/Lから9.5mmol/Lへと7.5%減少した(p= 0.0054)。これらの変化は、皮膚表面積の~4%を占める800cm2の組織面積に15分間曝露しただけで得られたものである[25]。
図4 血糖値スパイクに対する670nm光バイオモジュレーション(PBM)の効果
670nmのPBM介入とプラセボ介入を比較すると、到達した最大血糖濃度は有意に低下した。同じ参加者の対照結果(灰色のバー)と比較すると、670nm PBM(赤色のバー)後に到達した最大血糖濃度の有意な低下が観察された。プラセボ介入後の最大経口ブドウ糖負荷試験結果は、同じ参加者グループの先行コントロール(青棒)と比較した場合、差は観察されなかった。*p<0.05、**p<0.01、nsは有意ではない。エラーバーは平均値の標準誤差。
3.2 呼気二酸化炭素に対する赤色光の影響
血中グルコースの減少は、グルコースの酸化の増加、またはグリコーゲンとしてのグルコース貯蔵の増加から生じる可能性がある。酸化の亢進はCO2産生の上昇につながり、呼気中に検出される可能性がある。ここで、EtCO2はすべての糖負荷試験中に上昇した(図5A-C)[26]。670 nmのPBM介入とプラセボ介入との間に有意差は観察されなかった(図5A)。しかしながら、OGTTの時間経過にわたって、670nm PBM介入とそのペアとなる参加者対照の来院結果との間にEtCO2の有意差が観察された(MANOVA、p =0.03;図5B)。呼吸数については、いずれの介入においても有意差は観察されなかった。
図5 670nmの光バイオモジュレーション(PBM)は呼気二酸化炭素分圧を上昇させる
絶食経口ブドウ糖負荷試験後、2時間にわたり15分ごとにサイドストリームカプノメトリーにより呼気終末二酸化炭素分圧(EtCO2)を記録した。グルコース摂取後に予想される呼気二酸化炭素分圧の上昇は、各観察において両群で観察された(A-C)。670 nm PBM群とプラセボ群との間に統計学的有意差は認められなかった(p= 0.21)(A)。670 nm PBM群では、670 nmの光を15分間照射すると、各参加者の対照データ(visit 1)と比較して、EtCO2の有意な増加が認められた(多変量分散分析、p= 0.03)(B)。ポストホック解析によると、670 nm PBMのコントロールビジットデータ(B)と比較した場合、60分後のEtCO2が統計的に有意に増加した。対照群とプラセボ群の介入結果との間に統計学的有意差は観察されなかった(C)。*p< 0.05.エラーバーは平均値の標準誤差。
4 考察
この研究により、670nmへの15分間の単回曝露が、標準的な経口ブドウ糖負荷試験を用いて血糖を有意に低下させることが示された。また、呼吸の上昇と一致する呼気CO2への影響も限定的である。グルコースは重要な栄養素であるが、血中濃度が高い状態が続くと、血管内皮細胞において炎症とインスリン抵抗性が引き起こされる[27]。食後(食後)グルコースの循環濃度を低下させることは、血糖ホメオスタシスに障害のある人には有益である。しかし、食後高血糖の程度やその他の血糖値の変動は、糖尿病合併症の発症に関与している可能性がある[28]。間欠的な高グルコース曝露は内皮細胞のアポトーシス率をさらに上昇させるため、持続的な高血糖よりも変動はより有害である[29]。それゆえ、臨床的介入には、血糖値の急激な変動を最小限に抑えるための実践が日常的に含まれている[30]。我々は、670nmのPBMがグルコース消費後に到達する最大グルコースレベルを低下させ、したがってグルコーススパイクを制限する介入を提供することを報告する。しかし、この研究は、糖尿病患者ではなく、健常人を用いて行われたことを強調しておくことが重要である。われわれのデータと糖尿病被験者との間の橋渡しはまだなされていない。
波長670nmのPBMは、ミトコンドリア膜電位を改善し、酸化的リン酸化の促進によってATP産生を増加させることが実証されている。これは中枢神経系機能の改善につながることが示されている。これは、ハエからヒトまで、種を超えて維持されている[1,2,4,8,12,31,32]。670 nmのPBMの影響は、代謝需要の高い組織や、加齢や疾患によって衰えた組織で顕著である。その広範な好影響は、特に中枢神経系における膜ポンプによる大きなエネルギー需要にかかっていると思われる。
マウスにおける670 nmのPBM後のATPの増加は、網膜で~20%、脳で50%以上である[5]。ハエ全体では~30%である[13]。ATP産生の増加にはグルコースと酸素が必要であるため、670 nm PBMには血中グルコースを減少させる能力があるのではないかという仮説を立てた。今回発表されたデータは、この仮説と一致している。
この研究では、参加者はグルコース摂取の45分前に670nmのPBMを照射され、循環血中グルコース濃度は摂取45分後に有意に低下し、効果の発現は~1.5時間であることが明らかになった。この低下は、局所的な光照射のみで観察された。しかしながら、670nmのPBMはアブスコパル効果を有することが示されている[17、33]。局所のミトコンドリア機能をシフトさせると、他の遠位器官でもミトコンドリアが変化することが示されている[34]。670 nmのPBMに暴露されたマウスでは、シグナル伝達分子として働く能力を持つ多数の循環サイトカインが広範かつ有意に変化していることから、この現象が起こる可能性のあるシグナル伝達経路が最近明らかになった[14]。あるいは、血液中には無細胞で呼吸能力のあるミトコンドリアが含まれているという議論もある[35,36]。これらもまた、局所的な670nmのPBMの全身的影響に関与している可能性がある。
波長670nmの光が糖尿病に影響を与えるかどうかについては、まだ解明されていない。しかし、光がミトコンドリアの機能に影響を与えることは明らかである。長波長、特に670nmの光は、ミトコンドリアの機能を向上させ、全体的な生理機能やパフォーマンスの向上につながることが一貫して示されている[1,10,12,17,37]が、短波長の光はミトコンドリア機能を低下させる[38–40]。建築環境におけるLED照明の主なピークである450nmにさらされると、ヒトの血圧が有意かつ急速に低下し、心拍数も有意に増加する。両方のシフトは、曝露期間中持続する[41]。ヒトを対象とした468nmのPBMを使用した実験でも、同様に生理機能が阻害され、暴露中に血糖値が著しく上昇した[42]。LED照明は、基本的に青色優位である。これは、短波長の光が蛍光体素子を刺激するために使用され、その後、人間の目によって知覚され、より広いスペクトル範囲の白色光を生成するためである。しかし、LEDには基本的に長波長がない。450nm付近に強いピークを持つが、620nmを超える波長はほとんどない[43–45]。したがって、太陽光がない状態でLEDに長時間さらされると、血糖値の調節障害など、人間の健康に長期的に重大な影響を及ぼす可能性がある。この問題はまだ十分に解明されていないが、公衆衛生上の問題となる可能性が高い。
資金調達情報
この研究はSight Research UKの支援によるものである。
利益相反声明
著者らは利益相反がないことを表明している。





