Neurological manifestations of COVID-19: available evidences and a new paradigm
link.springer.com/article/10.1007%2Fs13365-020-00895-4
要旨
近年パンデミックしているコロナウイルスは、重症急性呼吸器症候群コロナウイルス2(SARS-CoV2)によって引き起こされる病原性・高感染性のウイルス感染症である。パンデミックが進行している現在、SARS-CoV-2が神経機能に悪影響を及ぼし、さらには重篤な神経障害を引き起こすことが示唆された多くの報告が出てきている。
COVID-19に関連する神経学的症状は、頭痛、めまい、うつ病、無感覚、脳炎、脳卒中、てんかん発作、およびギラン・バレー症候群を含む多くの他のものと一緒に。中枢神経系の病変は予後不良や病状の悪化と関連している可能性がある。
ここでは、SARS-CoV-2によるCOVID-19感染症における神経系の関与の証拠と現在知られている神経学的症状をレビューする。
SARS-CoV-2の332のヒト標的遺伝子を脳関連疾患との関連性に基づいて優先順位付けし、73の候補遺伝子を同定した。
その結果、脳の様々な領域における時空間発現と進化的不寛容性の解析により、73の候補遺伝子に優先順位をつけた。これらの遺伝子は、COVID-19に関連する神経症状の指標となる可能性があり、COVID-19に関連する中枢神経症状の予防や治療のための治療標的となる可能性があると考えられる。
序論
SARS-CoV-2として知られる新型コロナウイルスの発生は、世界中の医療関係者を悩ませている。無症候期であっても高い感染性と伝達性を有することから、世界中で急速にウイルスが伝播し、パンデミック状況に陥った。COVID-19パンデミックは、1918年のインフルエンザパンデミック以来の規模である。COVID-2019の最初の症例は、2019年12月8日に中国の武漢で創設された(Thompson 2020)。2020年7月の週半ばの時点で、COVID-19の報告症例数は世界で1380万人を突破し、死亡者数は59ラクスを超えている。臨床医や病理医は、肺が主な標的であるにもかかわらず、ウイルス感染は心臓、血管、腎臓、腸、脳など他の臓器にも広がる可能性があることを認識していた(Wadman et al 2020)。
COVID-19は、26〜32kbサイズのゲノムからなる1本鎖陽性感覚RNAウイルスである。平均直径は100nmであり、球状、または楕円形である。組換え率は最大25%であり、スパイク(S)タンパク質のような形をした王冠で外部から覆われており、これもまた頻繁に変異することができる(Wrapp er al)。 これらの特徴は、時間の経過とともに感染性を変化させるウイルスの適応性を示している。通常、血圧を調節するのに役立つアンジオテンシン変換酵素2(ACE2)受容体は、肺に豊富に発現している。COVID-19のスパイク蛋白質がACE2受容体に結合して細胞に侵入し、感染症を発症する(Yan er al)。 ウイルスが宿主の細胞機械を制御すると、ウイルスは他の細胞に感染するための無数のコピーを作り始める。
COVID-19は、主に呼吸器系に影響を与える;しかしながら、SARS-CoV-2が神経侵襲性であり、神経学的合併症をもたらすことを示唆する証拠が豊富に存在する(Troyer et al 2020;Gklinos 2020;Leonardi et al 2020)。学術検索データベースであるDimension(https://www.dimensions.ai/)を介して文献検索を行うと、検索語 “COVID-19と神経系 “に関連する1500以上の出版物が見つかった。
Ellulら(Ellul er al)。 2020)による最近の更新されたレビューでは、COVID 19患者における神経学的症状の証拠が増加していることが示されており、神経学的症状を有するCOVID 19患者は約901例報告されている。神経学的合併症は他のコロナウイルスではまれであるが、中枢神経系および神経系合併症の最小頻度は、SARSでは0.04%からMERSでは0.20%、SARSでは0.05%からMERSでは0.16%であった(Ellul er al)。 2020)。
Whittakerら(Whittaker er al)。 2020)による系統的に更新されたレビューでは、31の研究をまとめてCOVID-19の神経学的症状について論じている。これらの研究では、ギランバレー症候群(GBS)、頭痛、嗅覚障害、急性脳血管事故などの症状が報告されていた。
2020年3月初旬に、北京大丹病院は、中枢神経系(中枢神経系)に影響を及ぼすCOVID-19患者のウイルス性脳炎の最初の症例を報告した。研究者らは、ゲノムシークエンシングにより脳脊髄液(脳脊髄液)中のSARS-CoV-2の存在を確認した(Xiang et al 2020)。その後、日本では、鼻咽頭陽性がなくても脳脊髄液中にSARS-CoV-2が確認された別のウイルス性脳炎の症例が報告されており、直接感染の可能性や血行経路などの間接的な感染経路の可能性が示唆されている(Moriguchi er al)。 2020)。武漢から 2020年1月16日から 2020年2月19日までの間に連続して入院したCOVID-19患者214人のレトロスペクティブシリーズでは、患者の神経学的症状が記載されている(Mao er al)。 2020a)。COVID-19患者214人中126人(58.9%)が非重症感染症であったのに対し、88人(41.1%)は呼吸状態に基づく重症感染症であった。発症時の症状は、発熱(61.7%)、咳(50.0%)、食欲不振(31.8%)が最も多かった。78人(36.4%)の患者に神経学的症状が認められた。これらの神経学的症状は、中枢神経系(24.8%)、末梢神経系(8.9%)、骨格筋損傷(10.7%)に分類された。中枢神経系症状の患者では、めまい(16.8%)、頭痛(13.1%)が最も多く報告されていたのに対し、末梢神経系症状の患者では、味覚障害(5.6%)、嗅覚障害(5.1%)が最も多く報告されていた。これらの他に、高血圧、糖尿病、脳血管障害、悪性・慢性腎臓病などの疾患が分析された。COVID-19を有する58人の集中治療患者を対象としたフランスの症例シリーズでは、69%が激越や錯乱を伴う脳症であり、そのうち67%は皮質脊髄路徴候を有していた。退院した33%には性機能不全症候群が認められた(Helms et al 2020a; Helms et al 2020b)。
パンデミックの指数関数的な段階の最初の3週間で、英国全体のサーベイランスシステム(CoroNerve)は、年齢中央値71歳(範囲は23~94歳)のCOVID陽性症例153例を報告した。153例のうち77例(62%)に脳血管障害が認められ、その内訳は虚血性脳卒中57例(74%)、脳内出血9例(12%)、中枢神経系血管炎1例であった。2番目に多かったのは39例(31%)で、精神状態の変化があり、そのうち脳症が16例(41%)、脳炎が7例(44%)であった。残りの23人(59%)は精神症状を呈しており、その中には精神病10人(43%)、神経認知(認知症様)症候群6人(26%)、情動障害4人(17%)が含まれていた(Varatharaj er al)。
最近、Rogersらによるシステマティックレビューおよびメタアナリシス(Rogers er al)。 2020)では、異なる疾患段階におけるSARS-およびMERS-CoVの神経精神症状が示された。急性期には不眠(41.9%)、不安(35.7%)、記憶障害(34.1%)、抑うつ(32.6%)、錯乱(27.9%)などの症状が認められた。発病後の段階では、睡眠障害(100%)、外傷性記憶(30.4%)、疲労感(19.3%)、記憶障害(18.9%)、過敏性(12.8%)、不安(12.3%)、不眠(12.1%)、抑うつ(10.5%)が多く認められた。さらに、別の研究では、集中治療室患者の65%にせん妄(錯乱)が認められ、その後死亡した患者の21%に意識変化が認められたという証拠があった(Rogers er al)。 2020)。
非常に最近の研究では、74歳の男性COVID-19患者の脳組織の透過型電子顕微鏡検査により、ウイルスの神経侵襲性および中枢神経系への伝達経路の可能性が示された(Paniz-Mondolfi et al 2020)。この研究では、前頭葉に80〜110nmのウイルス粒子が存在し、内皮細胞の小胞にも存在していることが明らかになった。また、ウイルス粒子の内皮壁内または外への出血は、脳微小血管内皮細胞を横切って神経系へのウイルスの出入りを示している。また、神経細胞体には、ウイルス粒子を内包した細胞質液胞が拡大しており、その中には明瞭な茎状の突起を持つウイルス粒子が含まれてた。また、剖検報告では、死亡した患者の脳組織浮腫と部分的な神経細胞変性が明らかにされている(Xu er al)。 さらに、インドでは、72歳の患者が急性発症小脳失調症に続いて脳症を呈した。診断したところ、SARS-CoV-2誘発性肺炎であることが示され、神経学的症状がCOVID-19の初期症状である可能性があることが明らかになった(Lahiri and Ardila 2020)。
神経系におけるSARS-CoV-2感染へのルート
コロナウイルスの神経侵襲性は共通の特徴として説明されてきた。SARS-CoVとSARS-CoV-2の類似性が高いことから、これらのウイルスも同様の可能性があると考えられる。コロナウイルスは、直接的な経路と間接的な経路を含む複数の経路で脳内に侵入する可能性がある(図1)。
図1
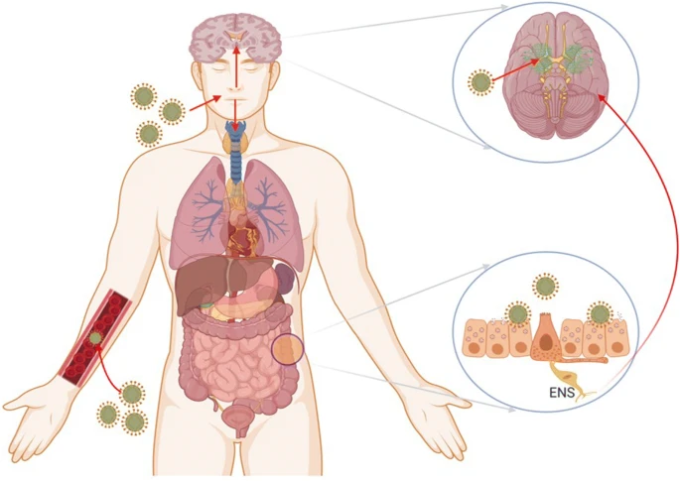
図1
SARS-CoV-2によるコロナウイルス感染と神経障害のメカニズム。コロナウイルスは嗅神経、血液循環、脳幹のACE2、免疫傷害、神経経路を介して直接神経系に侵入し、神経障害を引き起こす可能性がある。消化管内のCOVID-19感染は、腸管神経系(ENS)とその交感神経求心性ニューロンを利用して中枢神経系に到達する可能性がある
ウイルスは、血液脳関門の内皮細胞、脈絡叢の血液-脳脊髄液関門の上皮細胞に感染したり、炎症性細胞を利用して中枢神経系に侵入したりして侵入する(骨髄細胞のトラフィッキング)。さらに重要なことは、ウイルスは、中枢神経系に到達するために逆行性軸索輸送を利用することができるということである。逆行性軸索輸送は、嗅覚系、呼吸器系、および腸管神経系のネットワークを介して起こる可能性がある。鼻細胞に感染した後、ウイルスは直接、おそらく嗅球を介して脳に侵入し、視床や脳幹などの特定の脳領域に急速に拡張し、炎症や脱髄反応を引き起こす可能性がある(Bohmwald et al 2018)。ウイルス感染が鼻腔に感染し、嗅覚や味覚の障害を引き起こす可能性があると説明されている。COVID-19は、呼吸器ネットワークの末梢神経末端に侵入した後、シナプス結合ルートを介して中枢神経系へのアクセスを獲得する可能性があることを示すエビデンスが増加している(Li er al)。 2020)。
また、SARS-CoV-2は、消化管感染時に腸管神経系(ENS)の交感神経求心性ニューロンを利用して中枢神経系へのアクセスを獲得する可能性がある(Toljan 2020)。COVID-19の疫学調査では、初期症状から集中治療に至るまでの平均時間は約8日であり、ウイルスの窓の期間は髄質ニューロンに侵入して壊滅的な打撃を与えるのに十分な期間であることが示されている(Wang er al)。 2020)。COVID-19患者では、神経障害の既往がある場合には状態が悪化する可能性がある。
SARS-CoV-2が宿主の細胞に侵入するための受容体はACE2である。ACE2は血管収縮や血圧の制御にも大きく寄与しており、心血管系の機能と関連している。ACE2は、肺、腎臓、腸、脳など多くの細胞で発現している。脳では脳幹核にも発現しており、心肺機能の調節に関与している(Baig er al)。 このように、スパイク蛋白質と脳幹核内のACE2受容体との相互作用は、COVID-19患者の呼吸障害をも伴う可能性がある。COVID-19の生存者である武漢大学の医学大学院生は、意識を維持しなければならず、激しいケアの間、継続的かつ積極的に呼吸しなければならない自然な呼吸について訴えた。そうでなければ、彼女が眠ってしまった場合、自然呼吸を失ったために死ぬ可能性がある(Li er al)。 2020)。このウイルスは、他の神経刺激性ウイルスと同様に、神経細胞を越えて遠くの脳の標的に拡散する可能性がある(McGavern and Kang 2011)。ウイルスが肺から髄質に移動し、シナプスから脳内の心肺ニューロンに移動した場合でも、心肺ニューロンへの感染は自発呼吸を阻害して機能を正常に終了させる可能性がある(Wu er al)。 ACE2受容体は毛細血管内皮にも発現している。ACE2と相互作用することでウイルスはBBBを損傷し、血管系を攻撃することで中枢神経系へのアクセスを得る可能性がある(Wu and Yang 2020)。
また、ウイルスは血液循環を介して大脳循環に到達する可能性がある。ミルコ循環内の血液循環の緩慢さは、毛細血管内皮に発現しているACE2受容体とスパイクタンパク質の結合を促進する可能性がある。さらに、ウイルス粒子の増加による内皮内膜の損傷は、ウイルスの脳へのアクセスを容易にし得る。ウイルスが神経組織に到達すると、スパイクタンパク質は、神経細胞上に発現しているACE2受容体と相互作用し、ウイルス複製のサイクルを開始し、実質的な炎症を伴わずに神経細胞の破壊を伴い、これは過去数年のSARS-CoVの症例で見られている(Baig er al)。 オランダのCOVID-19患者の報告では、血液の異常な凝固が認められた。血栓は破れて体の様々な部分に移動することができ、肺に着地して重要な動脈を塞ぎ、肺塞栓症を引き起こすことさえあり、COVID-19患者ではこれが重要であると報告されている。血栓による脳の動脈の閉塞は脳卒中を引き起こす可能性がある(Wadman et al 2020)。
神経学的症状
神経学的な症状や合併症は、中枢神経系と末梢神経系に分けられる。
中枢神経系の症状
中枢神経系の症状としては、てんかん、運動失調、脳炎、意識障害、急性出血性壊死性脳症(ANE)、頭痛などがある。脳炎とは、脳の炎症性病変のことで、神経組織の病変や神経細胞の損傷などがある。森口らは、日本で脳炎を合併した24歳の患者を報告しており、発熱後に発作と意識不明を伴って入院した(Moriguchi er al)。 2020)。Wongらは、運動失調、両側顔面脱力、複視、オシロプシアを有する40歳の男性の別の症例を英国から報告した。13日前に発熱と進行性の息切れがあり、その後、生産性の高い咳と下痢が続いていた(Wong et al 2020)。頭痛およびめまいは、COVID-19患者に関連する非特異的な軽度の症状と考えられている。脳症は、患者の40%で報告されている(Mao et al 2020a)。Filatovら(Filatov er al)。 2020)は、慢性肺疾患およびパーキンソン病とともに多発性疾患の病歴を有する74歳の男性が、咳と発熱を伴って病院の救急部を受診した症例を報告した。初診では特に問題はなく、帰宅したが、その後、容態が悪化した状態で再来院し、COVID-19陽性と診断された。急性出血性壊死性脳症(ANE)は、サイトカインストームが原因で発症し、血液脳関門の障害や神経炎症を引き起こし、脳の機能障害を引き起こす。
また、ウイルス感染は「サイトカインストーム」を引き起こし、それに反応して神経系の障害を引き起こす。サイトカインは、健康な免疫応答を作り出す小さな化学的に誘導されたシグナル分子である。サイトカインストームでは、少数のサイトカインのレベルが必要以上に急上昇し、それに反応して体の免疫細胞が健康な組織を攻撃し始める。ANEは神経炎症を引き起こし、脳の機能不全を引き起こす(Poyiadji er al)。 2020)。ターンでTヘルパー細胞によって活性化されているIL-6の生産の増加を主に特徴とするサイトカインストームに起因するANEによって引き起こされる神経炎症は、GM-脳脊髄液を産生した。サイトカインストームはまた、インターロイキン、インターフェロン、単球、マクロファージ炎症性タンパク質、および腫瘍壊死因子の急増を引き起こし、炎症の亢進をもたらすことがある。この全身的な炎症は、患者に重度の脳症を引き起こし、脳卒中につながる可能性がある(Mehta er al)。 壊死性出血性脳症の症状は、COVID-19患者のCTスキャン画像およびMRIスキャンから裏付けられている。サイトカインまたはケモカイン経路を介して、またはT細胞を介して、免疫介在事象は、最終的に、血管漏出、脱髄、補体および凝固カスケードの活性化、および末梢臓器損傷につながる可能性がある(Natoli et al 2020; AhmadおよびRathore 2020)。ウイルス感染を介して引き起こされ、免疫系を伴う神経系の損傷は、COVID-19症状の重症度と正の相関がある。
Poyiadjiら(Poyiadji er al)。 2020)は、米国からANEに関連したCOVID-19の最初の症例を報告した。咳、発熱、精神状態の変化の3日間の病歴を持つ女性患者が病院に現れた。COVID-19陽性、単純ヘルペス1・2ウイルス陰性であった。その後,脳のMRI検査で複数の領域で病変が増強していることが確認され,ANEの発症が確認された。
COVID-19感染時には、患者は脳血管事故を起こす可能性が高い。Sharifi氏ら(Sharifi-Razavi er al)。 2020)は、半意識状態で救急入院した79歳のCOVID-19患者の症例を報告しており、ここ数日で発熱と咳を呈していた。CTスキャンの報告では、右半球内に大量の出血があり、脳室内とくも膜下の拡張が認められた。著者らは、ACE2受容体の調節障害が脳の自律神経系、交感神経副腎系、脳血流の調節障害につながっている可能性が示唆された。COVID-19に感染したオランダ人患者では、血液の異常な凝固が認められた。血栓は破れて体の様々な部分に移動することができ、それは肺に着地して重要な動脈を塞ぎ、COVID-19患者では重要であると報告されている肺塞栓症を引き起こす可能性さえある。血栓による脳の動脈の閉塞は、脳卒中を引き起こす可能性がある(Wadman et al 2020)。
サイトカインストームと高炎症反応は急性骨髄炎を引き起こす可能性がある。Kang Zhao氏は武漢からの症例を報告しており、66歳の男性が発熱と体の痛みの症状で入院し、その後、腸や尿の制御不能な漏出を伴うT-10の急性弛緩性下肢麻痺と感覚レベルの麻痺を発症した。その後、胸部CTスキャンで観察されたパッチ状の肺炎とともに、PCR検査でCOVID-19の陽性感染が確認された(Zhao er al)。
末梢神経系の症状
末梢神経系の症状としては、骨格障害、無感覚、化学感覚障害、ギラン・バレー症候群(GBS)などがある。COVID-19陰性例と比較して、COVID-19患者の方が、無感覚症と化学感覚機能障害が高かった。生物学者のAlessandro Laurenzi氏をはじめ、イタリアの多くのCOVID-19患者が味覚と嗅覚の喪失を訴えていた(Yeager 2020)。最近のヨーロッパの多施設研究では、417人のCOVID-19患者が調査され、その中で85.6%の患者が嗅覚機能障害と診断され、88.8%の患者が味覚障害を報告していた。耳鼻咽喉科医はCOVID-19感染の併発症状として突発性無呼吸症または低呼吸症を報告していた。そのうち、嗅覚機能障害がCOVID-19症状の前に出現した患者は11.8%、COVID-19症状の後に報告した患者は65.4%、COVID-19全身症状と同時に報告した患者は22.8%であった。最初の8日以内に、約72.6%の患者が嗅覚機能を回復した(Lechien er al)。
Maoら(Mao er al)。 2020b)は、中国人214人を対象とした研究で、フランス地方のCOVID-19陽性患者では味覚機能障害や嗅覚障害は報告されていないが、味覚と嗅覚にそれぞれ5.6%と5.1%の障害が認められたと報告している。
これまでに中国、イラン、イタリアでCOVID-19とギランバレー症候群(GBS)との関連症例が8例報告されている。最初に報告されたGBSの症例は、中国武漢市の61歳の女性であった。この患者は急性の脚力低下と重度の疲労感を訴えて入院した(Zhao er al)。 神経伝導検査と筋電図検査では、神経根と末梢神経の炎症が認められ、脱髄性多発性神経障害を示唆していた。検査ではCOVID-19陽性であり、治療後は良好な運動回復を示した。
Sedaghatら(Sedaghat and Karimi 2020)は、四肢麻痺と両側顔面麻痺につながる上行性麻痺と診断される2週間前から発熱、咳、不規則な呼吸困難を呈していた61歳の糖尿病患者のイランからの症例を報告した。神経伝導検査や筋電図検査を行った結果,急性運動・感覚軸索神経障害が示唆された。
Camdessancheらは、2日間の咳嗽と発熱の既往歴を持つ64歳の男性で、COVID-19の検査で陽性となり、その後、入院9日目に手足の麻痺と全肢の脱力が進行し、起伏と振動感覚の喪失を伴い、その後、嚥下障害と呼吸不全を発症したと報告している(Camdessanche et al 2020)。
Viraniら(Virani er al)。 2020)は、呼吸困難につながる上半身麻痺が急速に進行したために入院し、後にCOVID-19陽性と判定されたGBSを有する54歳の男性の症例を米国から報告している。呼吸器関連の問題はCOVID-19患者では一般的であり、GBS発症の原因となっていることから、GBSはCOVID-19の神経学的合併症と考えるべきである。
Maoらの報告で報告された骨格筋損傷は、重症群では約19.3%、非重症群では約4.8%であった(Mao et al 2020a)。中国からのJinらの報告では、発症15日後に下肢の脱力と圧痛を発症したCOVID19の60歳男性が報告されている(Jin and Tong 2020a)。これは、ウイルスが筋肉組織に直接作用することによるものかもしれないし、感染を媒介とした免疫反応を介して産生される血清中のサイトカインの反応が上昇し、結果として骨格筋にダメージを与えている可能性もある(Ahmad and Rathore 2020)。
疾患遺伝子関連データによる遺伝子の優先順位付け
SARS-CoV-2タンパク質と相互作用することが知られているヒトの331遺伝子のリストをGordanらの研究(Gordon er al)。 2020)から取得した。331遺伝子の遺伝子-疾患関連データは、GeneORGANizerデータベース(Gokhman er al)。2017)から取得した。GeneOrganizerデータベースは、ヒト表現型オントロジー(HPO)とDisGeNETツールからキュレーションされたヒトの遺伝子疾患、遺伝子表現型、遺伝子発現領域のデータを提供している。また、そのうち73個の遺伝子が脳内で発現しており、その遺伝子の疾患関連と遺伝子-フェノタイプ関連をGeneOrganizerデータベースから検索した結果を掲載している。また、Human Phenotype Ontology (HPO)データベースに分類された表現型を持つ遺伝子については、さらなる研究の対象とした。表1は、COVID-19タンパク質と選択された73の遺伝子との相互作用を示している。また、その際には、その遺伝子の遺伝子間の相互作用を調べるために、遺伝子間の相互作用を調べるために、遺伝子間の相互作用を調べるために、遺伝子間の相互作用を調べるために、遺伝子間の相互作用を調べるために、遺伝子間の相互作用を調べた。これら73の遺伝子をDAVID(Sherman and Lempicki 2009)を用いて遺伝子オントロジー(GO)解析を行ったところ、これらの遺伝子は酸化還元、ヌクレオチド結合、電子キャリア活性、輸送、神経細胞のアポトーシス制御などのエネルギー代謝に富むことが明らかになった(図2b)。KEGG経路濃縮解析により、これらの遺伝子がアミノアシルtRNA生合成に関与していることが明らかになった。
表1 脳内で発現しているCOVID-19ターゲット
図2
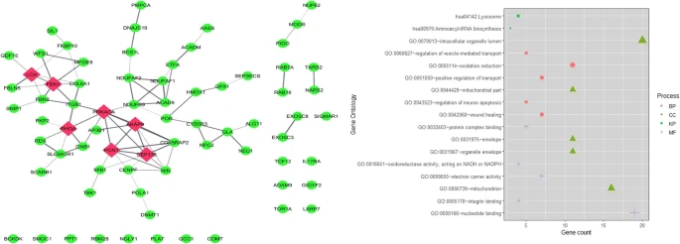
図2
(a) ヒトSARS-CoV-2相互作用遺伝子331個のうち73個の遺伝子の蛋白質-蛋白質相互作用(PPI)ネットワーク(遺伝子オルガナイザーデータベースを用いた脳関連疾患との関連を示す)。赤色のノードはネットワーク内のハブ蛋白質を示す。(b) GOおよびKEGG解析による遺伝子の機能エンリッチメント解析
さらに、遺伝子セットのエンリッチメント解析のためのウェブベースのサーバーであり、遺伝子リストの集合的機能の異なる要約を提供するEnrichr(Kuleshov er al)。 DisGeNET(Pinero er al)。 2020)を用いた疾患エンリッチメント解析では、知的障害、発達・認知遅延、精神・運動遅滞、全身性低血圧と有意に関連する遺伝子が多いことが明らかになった(図3a)。また、Jensen DISEASE(Pletscher-Frankild er al)。 2015)解析によるエンリッチメントでは、神経変性疾患、知的障害、ミトコンドリア複合体I欠乏症と高い関連性を持つ遺伝子が示された(図3b)。全体として、これらの結果は、SARS-CoV-2感染後の神経学的症状に遺伝子シグネチャーが大きく関与していることを明確に示している。
図3に示すように、SARS-CoV-2感染後の神経症状には遺伝子シグネチャーが大きく関与していることが明らかになった。
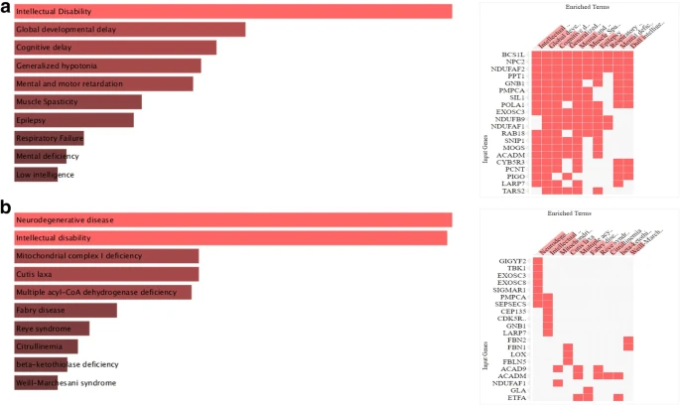
図3
Enrichrウェブサーバを用いた疾患ベースのエンリッチメント解析。(a)DisGNet、(b)Jensen DISEASEで得られた上位遺伝子の遺伝子セットエンリッチメント解析
ネットワーク解析プラグインを用いて、ネットワークのトポロジカル特性である連結度や中心性を計算したところ、連結度や中心性の値が高い7つの遺伝子がハブ遺伝子であることがわかった。ハブ遺伝子とは、ネットワークを制御する上で最も影響力のある遺伝子と考えられている。ハブ遺伝子はLOX、FBN1、PRKACA、RHOA、PCNT、AKAP9、CEP135であった。これらの遺伝子の多くは、SARS-CoV-2のNSP13(PRKACA、CEP135、PCNT、AKAP9)と相互作用することが判明した(Gordon et al 2020)。NSP13は、5つのドメインからなる596アミノ酸長の三角錐型タンパク質である(Mirza and Froeyen 2020)。それは、NTP依存的な方法で一本鎖への二重鎖オリゴヌクレオチドの巻き戻しを触媒する上で重要な機能を果たす。LOXタンパク質は、SARS-CoV-2のORF8と相互作用する。SARS-CoV-2のORF8はウイルスの複製に必須である。薬剤CCT-365623は、0.89μMのIC50を有するLOXの阻害剤である(Gordon er al)。 2020)。タンパク質RHOAはSARS-CoV-2のNSP7と相互作用し、FBN1はSARS-CoV-2のNSP9と相互作用する(Gordon er al)。 2020)。
ヒトプロテインキナーゼcAMP活性化触媒サブユニットα(PRKACA)は、環状アデノシン一リン酸(cAMP)依存性キナーゼ触媒サブユニットαをコードする。ヒトの体内では、PRKACAは脳、骨格筋、心臓など複数の組織で発現している。PRKACAの発現量の増加は、原発性色素性結節性副腎皮質疾患(PPNAD)を引き起こす。PPNADは稀な疾患であり、ACTH非依存性クッシング症候群(CS)として発現する。この疾患では、患者は、うつ病、情緒不安定、気分の変化、精神病、不安、精神悪化、激越、糖尿病、および高コルチコソリズムに悩まされる(Carney and Young Jr 1992)。135 kDaのセントロソームタンパク質(CEP135)は、細胞周期を通してセントロソームに位置し、その局在は微小管ネットワークとは独立している保存されたアルファらせん状タンパク質である。CEP135は、セントリオールの形成と伸長に重要な役割を果たしている。ペリセントリン(PCNT)タンパク質は、セントロソームに発現しており、ペリセントリオール物質(PCM)の重要な一部である。PCNTは繊毛形成、微小管核生成、有糸分裂などの複数の役割に関与しており、PKAやPKCβIIなどの複数のシグナル伝達タンパク質のセントロソーム足場としても機能している(Endoh-Yamagami er al)。 小頭症を含む複数の疾患で報告されており、しばしば精神遅滞を伴うことが知られている(Endoh-Yamagami er al)。 フィブリリン-1(FBN1)は、ミクロフィブリルに重合する構造高分子である。これは、長期的に力に耐える構造的な支持を提供する。FBN-1に関連する疾患の症状には、閉塞性睡眠時無呼吸症候群や脳卒中も含まれる。A kinase anchor protein 9 (AKAP9)は、450 kDaの大型の足場タンパク質である。また、セントロソームおよびゴルジ局在型プロテインキナーゼN関連タンパク質(CG-NAP)としても知られている。それは、セントロソームおよびゴルジ装置上のいくつかのプロテインキナーゼおよびホスファターゼのアセンブリに役立つ。AKAP9は、ゴルジ体の完全性を維持するために必要であり(Witczak et al 1999)、ゴルジ体のシス側の微小管核形成に必要である(Larocca et al 2004)。
Ras homology family member A (RHOA)は、GTPase familyのRhoタンパク質をコードする。Rhoタンパク質は、GDP不活性状態とGTP活性結合状態の間を循環することにより、分子スイッチとしてシグナル伝達に機能している(Quilliam er al)。 GTPアーゼのRhoファミリーは、神経細胞の発生の様々な局面で重要な役割を果たしており、例えば、神経突起の伸長とその分化、樹状突起棘の形成とその維持、軸索のパスファインディングなどが挙げられる。RHOAの活性化は、アクチン細胞骨格の異なる構造への再編成を導く(Govek er al)。 2005)。
リシルオキシダーゼ(LOX)は、エラスチンおよびコラーゲン中のリジン残基を酸化することにより細胞外マトリックスの形成および修復、ならびにこれらの線維性タンパク質の安定化において重要な役割を果たしている(Kumari er al)。 LOXは、B型肝炎、C型肝炎、およびアルツハイマー病を含む多くの疾患に関連している。COVID-19患者の多くは、LOX関連疾患でも報告されているように、感染後に脳卒中を報告した。
時空間発現解析による遺伝子の優先順位付け
選択された73遺伝子の時空間発現解析を研究するために、BEST(Brain Expression Spatio-Temporal)ウェブサーバー(http://best.psych.ac.cn/#)を利用する(Guo er al)。 2019)。このウェブサーバーは、健康なヒトの脳から生成された事前に統合された空間時空間発現データを参照して、遺伝子発現パターン解析を行う。このサーバーは、BrainSpan Atlas、Allen brainmap、GTExなどから得られた8つのヒト脳発現データセットを利用している。共発現遺伝子のクラスタを同定するために、8つの発現データセットのうち5つのデータセットについて、重み付き遺伝子相関ネットワーク解析(WGCNA)を行った。
BrainspanのRNA-seqデータとGTExのRNA-seqデータを用いて、異なる脳領域(空間パターン)と年齢段階(時間パターン)における選択された遺伝子の発現パターンを解析した結果を図4に示す。見られるように、新生児期から成人期後期にかけて、ほとんどの遺伝子がアップレギュレートされていた(図4a、b)。高年齢になると、小脳、視床下部、黒質、海馬、前頭前野で中等度にアップレギュレーションされていた(図4b)。これらの遺伝子の嗅球、視床、大脳皮質領域でのダウンレギュレーションは、感覚系、記憶、認知の障害を示している。
図4
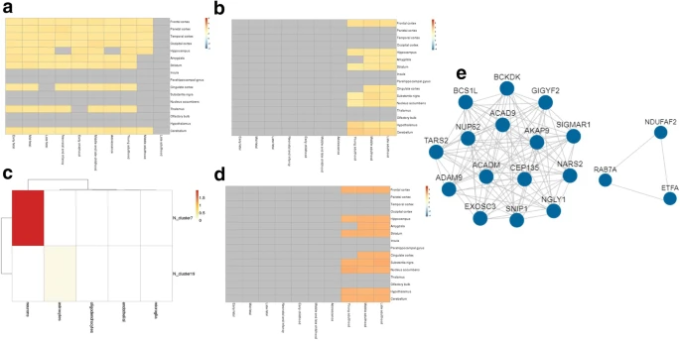
図4
73遺伝子のBEST結果。遺伝子の時空間発現ヒートマップ (a) RNA-Seq BrainSpanデータセット、(b) RNA-Seq GTExデータセット、(c) RNA-Seq GTExによる細胞型富化ヒートマップ、(d) 富化したクラスターの発現ヒートマップ、(e) 富化した遺伝子のコア共発現ネットワーク。
さらに、WGCNAによって生成された共発現遺伝子クラスター富化解析は、これらの遺伝子が神経細胞では優勢に富化し、アストロサイトではわずかな範囲で富化していることを示した(図4c)。最も有意に濃縮されたクラスターは、最も有意な遺伝子が含まれるニューロンに存在する。発現ヒートマップ(図4d)によると、このクラスターに含まれる遺伝子は、複数の脳領域で発現しており、後期になると発現していることがわかった。次に、濃縮されたクラスターに含まれる遺伝子を用いて、タンパク質-タンパク質相互作用ネットワークを構築した(図4e)。このクラスターに濃縮された14の遺伝子のうち、SNIP1(Smad nuclear-interacting protein1)とACADM(Acyl-CoA dehydrogenase、 mitochondrial)遺伝子が共発現ネットワークの中で最も多くのつながりを持っていることがわかった(図4e)。SNIP1は、スプリソソームの構成要素としてプレmRNAスプライシングに重要な役割を果たし、マイクロRNA(miRNA)の生合成に関与している。また、NF-kappa-Bをダウンレギュレートする。一方、ACADMはミトコンドリア脂肪酸β酸化や脂質代謝に関与している。
遺伝子病原性解析による遺伝子の優先順位付け
我々は、個々の遺伝子が病気の原因となりやすいかどうかを予測するために、新しいフレームワークであるEvoTol(Rackham er al)。2015)を用いて遺伝子の優先順位付けを実装した。73個の遺伝子についてEvoTolによる進化的不寛容化研究を行ったところ、中枢神経系の平均発現が100TPM以上で50パーセンタイル以下の遺伝子が6個存在することがわかった。また、末梢神経系、成体脳、胎児脳についてもロバストに発現している遺伝子を同定した(図5a)。これらの病原性遺伝子は、CYB5R3、ITGB1、COL6A1、NPC2、RHOA、RAB7Aを病原性の低下に応じて配列したものである。解析からわかるように、CYB5R3(チトクロームb5還元酵素3)というタンパク質は病原性が高く、中枢神経系での発現が少ない。CYB5R3の可溶性アイソフォームはヘモグロビンの適切な機能を助け、膜結合型アイソフォームは脂肪酸の分解と形成、コレステロールの形成、様々な分子や薬剤の分解に関与している。SARS-CoV-2 NSP7やORF3タンパク質と相互作用し、ヒト宿主における電子輸送プロセスを阻害する(Gordon er al)。
図5
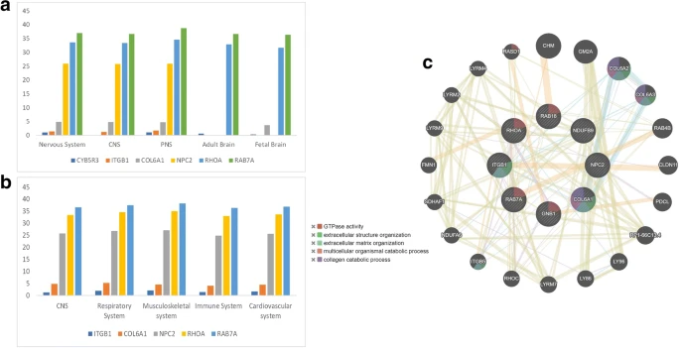
図5
EvoTolによる遺伝子優先順位付け解析。(a) 神経系と脳における進化的不耐性遺伝子の発現。(b) ヒト組織特異的系における疾患原因遺伝子の濃縮度。各組織型について、平均発現が100TPMを超える遺伝子をロバスト発現遺伝子として同定した。(c) 5つの病原性遺伝子のGeneMANIAネットワーク
また、EvoTolは、細胞型および組織特異的な遺伝子発現パターンに関する情報と統合して、組織特異的な文脈における病原性に関して遺伝子をランク付けすることができる。この情報は、ヒトシステムの障害における疾患遺伝子の優先順位付けに有用であることを証明することができる。我々は、異なるヒトシステムにおいて、ロバストに発現し、最も不寛容な遺伝子(50パーセンタイル以下)を同定した(図5b)。これらの高病原性遺伝子はすべての系で一貫して発現しており、これらの遺伝子がCOVID-19の多系関与を説明できることを示した。
さらに、これら8つの病原性遺伝子が遺伝子相互作用ネットワークに存在するかどうかを調べるために、GeneMANIA(Warde-Farley et al 2010)を用いてネットワーク解析を行い、タンパク質相互作用ネットワークを得た(図5c)。このタンパク質ネットワークは、主にGTPase活性と細胞外組織に富むことがわかった。
COVID-19受容体と相互作用する遺伝子の同定
最近、COVID-19ウイルスのスパイクタンパク質がACE2およびTMPRSS2受容体と強い結合親和性を示し、ウイルスが宿主の体内に入ることを可能にすることが確立された(Zou er al)。 2020)。したがって、ACE2およびTMPRSS2受容体と相互作用する遺伝子は、ウイルス-受容体相互作用の後、これらの遺伝子が最初に情報を受け取るため、著しく重要である。また、COVID-19受容体と直接相互作用する遺伝子の発現が変化すると、ウイルスが受容体に結合できなくなる可能性があり、治療標的となる可能性がある。複数の文献、uniportデータベース、および文字列データベース(Wicik er al)。 2020; Consortium 2019; Szklarczyk er al)。 2015)から、ACE2およびTMPRSS2受容体と相互作用する遺伝子のリストを検索した。脳内で発現を示す73の遺伝子のうち、インテグリンβ-1(ITGB1)という遺伝子がACE2受容体と直接相互作用することを同定した(図6a)。ITGB1はACE2受容体と結合し、ACE受容体とは結合しないことが知られている。ACE2は、そのエクトドメインにインテグリンに対する高度に保存された結合ドメインを有する(Clarke er al)。 ITGB1遺伝子は、ECM受容体相互作用、癌におけるプロテオグリカン、細胞接着分子、軸索誘導、Rap1シグナル伝達経路、PI3K-AKTシグナル伝達経路など多くの重要な経路で役割を果たしている(Kanehisa er al)。 2016)。さらに、ITGB1の時間的発現パターンを調べるために、ヒト脳トランスクリプトームプロジェクト(HBT; …hbatlas.org/pages/hbtd)を利用した。HBTプロジェクトでは、ヒトの脳のトランスクリプトームデータを提供している。図6bに�
図6
図6
(a) 73個の遺伝子とCOVID-19受容体との相互作用。ITGB1遺伝子はACE2受容体との相互作用を示す(四角い形)。(b) HBTから得られたヒトの生涯にわたる脳6領域におけるITGB1の発現レベルを示す。
また、ITGB1は、神経管欠損症、肉腫、乾癬、脳低酸素症、リンパ腫、白血病などの多くの疾患との関連を示し、複数の癌との関連もある(Stelzer er al)。 2016)。また、ITGB1は神経の骨髄化を調節しており、これは骨髄化が神経を絶縁し、情報の流れの速度を増加させることから重要なプロセスであり、正常な中枢神経系の骨髄化に必要とされている(Barros er al)。 また、我々のネットワークにおけるITGB1は、ハブ遺伝子(FBN1、PRKACA、RHOA)のうちの3つの遺伝子(赤色の六角形)とも相互作用していることが確認された(六角形)。
結論
COVID-19の神経学的症状の根底にある病態生理は完全に理解されていない。この分野の研究が増えているにもかかわらず、これら2つと臨床的影響を十分に相関させるためには、より多くのデータが必要とされている。医師は、呼吸器症状とは別に、脳炎、発作、痙攣、痙攣、味覚と嗅覚の喪失などの神経学的症状を考慮すべきである。
COVID-19の神経侵襲性の長期的な影響は、多発性硬化症などの神経変性疾患のリスクを高める可能性がある。本研究では、脳関連疾患との関連性に応じて、SARS-CoV-2のヒト標的73遺伝子を同定した。また、脳内での時空間発現に応じた遺伝子の優先順位付けと進化的不寛容解析により、病原性遺伝子を同定した。
また、ネットワーク解析により、脳内で高発現しているACE2結合タンパク質であるITGB1を同定した。このタンパク質は、COVID-19患者の中枢神経症状の予防や治療のための創薬標的となる可能性がある。
