Contents
pubmed.ncbi.nlm.nih.gov/32845365/

Low-Dose Naltrexone for Chronic Pain: Update and Systemic Review
フィリップ・S・キム1 – マイケル・A・フィッシュマン1
AI 解説
この記事は、「慢性疼痛に対する低用量ナルトレキソン:最新情報と系統的レビュー」と題され、慢性疼痛治療における低用量ナルトレキソン(LDN)の使用に関する最新の研究と理解を評価し、説明しています。以下は、記事の主要な内容の要約です。
概要
- 目的: 慢性疼痛治療における低用量ナルトレキソンの臨床使用に関する現在の理解を評価すること。
- 最近の知見: 前臨床および臨床研究により、慢性疼痛治療における低用量ナルトレキソンの使用がさらに解明された。
低用量ナルトレキソンの作用機序
- LDNは、線維筋痛症、炎症性腸疾患、多発性硬化症などの慢性疼痛に関連する症状を軽減することが期待されています。
- 作用機序は、中枢神経系におけるグリア細胞の調節と炎症性化学物質の放出の調節にあるとされています。
慢性疼痛に対するナルトレキソンの使用
- LDNは、オピオイド受容体拮抗作用を超えて、神経炎症過程に作用するとされています。
- 低用量では、鎮痛作用と抗炎症作用が報告されています。
安全性と副作用
- LDNは、アルコール依存症やオピオイド依存症に対するFDA認可の用量と比較して、低用量で特異的な作用を持つとされています。
- LDNの使用に関する安全性と副作用については、さらなる研究が必要であるとされています。
結論と今後の方向性
- LDNは、慢性疼痛治療において期待以上の効果を示しており、臨床の場でさらに研究されるべきであるとされています。
- LDNの臨床使用に関する最近の科学的証拠が提示されており、その使用例、投与量、他の治療法との相乗効果についての理解はまだ比較的浅いとされています。
要旨
総説の目的
本総説の目的は、慢性疼痛治療における低用量ナルトレキソンの臨床使用に関する現在の理解を評価し、説明することである。
最近の知見
最近の前臨床使用および臨床研究により、慢性疼痛治療における低用量ナルトレキソンの使用がさらに解明された。
要約
低用量ナルトレキソン(LDN)は、線維筋痛症、炎症性腸疾患、多発性硬化症などの慢性疼痛に関連する症状を軽減することが期待されている。LDNの機序は神経炎症の調節、具体的には中枢神経系におけるグリア細胞の調節と炎症性化学物質の放出にあるようである。これらの作用は、アルコール依存症やオピオイド依存症に対する食品医薬品局(FDA)認可の用量と比較すると、低用量で特異的であるように思われる。我々は、LDNが期待以上の効果を示しており、臨床の場でさらに研究されるべきであるというエビデンスをレビューする。
キーワード
ナルトレキソン. 慢性疼痛 . 線維筋痛症 . 神経炎症
はじめに
慢性疼痛は、米国が直面している最も重要な公衆衛生問題の一つであり、直接的・間接的な影響を及ぼしている。慢性疼痛の有病率と経済的コストは、他の健康問題をしのぐものであり、米国の成人1億人が罹患し、少なくとも年間6,000億ドルのコストがかかっている。[1]。慢性疼痛は、心臓病、糖尿病、癌を合わせたよりも多くのアメリカ人に影響を及ぼしている。
慢性疼痛は複雑な疾患であり、一般的には、生物学的、心理学的、社会的インプットが病因、慢性化、重症度、個人への影響に影響を与えるという観点から説明される。疼痛に対する複合的治療は、これらの各領域に対処することで、この疾患に罹患している人々の苦痛を相乗的に軽減し、機能を回復させようとするものである。本稿では、慢性疼痛の治療におけるLDNの役割に焦点を当てるが、薬物療法は、心理療法(例:マインドフルネス瞑想、認知行動療法)、リハビリテーション、介入療法、補完/代替療法など、複数の治療法を用いたより広範な疼痛ケア戦略の一部であるべきであることを忘れてはならない。
ナルトレキソンは、経口活性オピオイド受容体拮抗薬として1963年に開発され、オピオイドおよびアルコール中毒の治療に使用されている。アルコール中毒またはオピオイド使用障害の医療補助療法の適応でFDAの承認を受けており、1日50~100mgの用量で処方される。
1日1~5mgの低用量ナルトレキソン(LDN)は、オピオイド受容体拮抗作用を超えて、グリア細胞などの炎症細胞が関与する神経炎症過程に作用するようである。低用量では、鎮痛作用と抗炎症作用という逆説的な反応が報告されている。[2-]。これらの低用量では、オピオイド受容体拮抗作用の親和性閾値には達していない。
最も研究されている疾患は、線維筋痛症、クローン病、多発性硬化症、複合性局所疼痛症候群(CRPS)などの慢性神経炎症性疾患である。線維筋痛症は、疲労、睡眠障害、認知障害とともに、びまん性の筋骨格痛と機械的刺激に対する痛覚過敏を特徴とする慢性疼痛症候群である。クローン病は、痛みと症状をコントロールするための経口鎮痛薬の選択肢が限られている、もう一つの慢性神経炎症性疾患である。多発性硬化症は、典型的な自己免疫性神経炎症である。CRPSは有効な治療法が限られているが、LDNを用いた治療法が文献的に報告されている。これらの疾患に伴う痛みや苦痛は、コントロールが難しいことで有名であり、QOLに大きな影響を与える。多くの患者や医師は、このような症例で痛みをコントロールするために慢性的なオピオイドを使用したがらない。しかし、実際に症状を緩和する非オピオイドの選択肢はほとんど存在しない。
LDNに対する科学的関心は、症例報告や臨床研究、基礎研究の発表によって徐々に開花してきた。ジェネリックの配合薬の主な課題の一つは、研究に対する商業的支援がないことである。LDN研究トラスト(www.ldnresearchtrust.org)は、LDNの使用を支援し、その臨床的有効性と適応に関する研究を促進するために 2004年に英国で設立された。治療的成功のシグナルはあるようだが、このシグナルは薬物の適応と用量反応曲線を理解するためのさらなる研究によって調整されなければならない。本総説の主要な範囲は、慢性疼痛症候群に対するLDNの臨床使用に関する最近の科学的証拠を提示することであり、その使用例、投与量、他の治療法との相乗効果についての理解はまだ比較的浅いということを理解することである。
薬理学的特性
ナルトレキソンはよく知られたオピオイド受容体拮抗薬であり、現在、中毒治療のために1日50~100mgの典型的な用量で臨床使用されている。ナルトレキソンまたは17-(シクロプロピルメチル)-4-5-エポキシ-3,14-ジヒドロモルフィナン-6-オンは、μ-オピオイド受容体に対して最も親和性の高い非選択的純粋なオピオイド受容体拮抗薬である。[3]。ナルトレキソンはほぼ完全に吸収され(96%)、経口バイオアベイラビリティは初回通過代謝により5~40%である。半減期は4時間で、肝臓で98%まで代謝され、主な活性代謝物は6-β-ナルトレキソールである。この代謝物と未代謝のナルトレキソンは腎排泄される。ナルトレキソンはナロキソンに似ているが、経口バイオアベイラビリティが高く、半減期が長い。[4]。
慢性疼痛に対するナルトレキソンの使用
PubMedとGoogle Scholarのデータベースで公表されている英文文献を検索したところ、臨床および基礎科学研究の文脈で以下の用語が出てきた: 「低用量ナルトレキソン」、「ウルトラ低用量ナルトレキソン」、「超低用量ナルトレキソン」である。一般に、投与量の緩やかな定義は以下の通り: 「低用量ナルトレキソン」は、1日1.5mgから4.5mgと思われる。「ウルトラ低用量ナルトレキソン」と「超低用量ナルトレキソン」は100mcg/日前後と思われる。
低用量ナルトレキソンの作用機序
LDNの作用は、直線的な用量効果曲線では説明できず、むしろホルミシスの例として説明される。ホルミシスとは、低用量の拮抗薬が弱い作動薬として作用する一方で、全量投与すると阻害薬として作用するという逆説的な状況である。[5]。LDNのこの作用機序の仮説は、オピオイド作動薬に慢性的に暴露されると後根神経節細胞の活動電位持続時間が短縮されるが、はるかに低用量のオピオイド作動薬では逆の作用が起こり、活動電位持続時間が延長されるという観察に部分的に基づいている。[6]。1995年、CrainとShenは、超低用量ナルトレキソン(10ng/kg皮下投与)がこの活動電位延長を遮断し、モルヒネの抗侵害受容作用を増強するとともに耐性を低下させることを示した。[6]。オピオイド治療と併用する低レベル拮抗作用の概念は、その後、多くの組み合わせやシナリオで検討されてきた。しかし、オピオイド治療を併用せずにLDNを使用することを支持する臨床経験を説明するものではない。
LDNの作用機序は、オピオイドに対するホルミシス用量応答に基づいている。[6]。オピオイドを慢性的に投与すると、Gタンパク質共役型受容体であるmu-オピオイド受容体(MOR)がGiからGsに移行し、抑制状態から刺激状態に移行する。オピオイドアゴニストがGiとGsの両方に結合すると、反応は活性化され、Gs共役性の刺激反応はあまり見られなくなる。慢性的な曝露により、Gs共役刺激はMORの活動電位の延長を伴ってカスケードする。[7]。この現象の臨床症状には、オピオイド誘発性の痛覚過敏、耐性、依存などがある。このポピュレーションシフトは、モルヒネとともに低用量のオピオイド拮抗薬を併用投与することで防ぐことができる。[8]。
オキシコドンへのナルトレキソンの添加がMOR-Gs結合に及ぼす影響を、速度脊髄神経結紮(SNL)モデルで評価した。脊髄オキシコドンを反復投与するとGs結合が誘導され、アロディニアと温熱痛覚過敏を引き起こした。ウルトラ低用量ナルトレキソン(3mcg/kg)を添加すると、オキシコドンの効果が増強され、この神経障害性疼痛モデルにおけるアロディニアが大幅に減少し、カップリング選好性がGiに戻った [7]。興味深いことに、ヒトにおいて、オキシコドン+ウルトラ低用量ナルトレキソンの研究では、2mcg/日のナルトレキソンではオキシコドン単独よりも鎮痛作用が増強されたが、4mcg/日のナルトレキソンでは増強されなかった [9–]。
オピオイドを用いない場合の研究では、LDN(0.5~4.5mg)は、グリア細胞の調節を通じて中枢神経系に抗炎症効果を示した。LDNはToll様受容体4(TLR-4)アンタゴニストとして作用する [10] 。ミクログリアのTLR-4活性化は、インターロイキン-1(IL-1)、腫瘍壊死因子α(TNF-α)、インターフェロン-β、一酸化窒素などの炎症性最終産物の産生と放出をもたらす。神経因性疼痛におけるLDNの作用機序として提案されているのは、侵害受容神経経路周辺の炎症を抑えることで、中枢性感作の開始と伝播が抑制されるというものである。これらの化合物によって産生される炎症環境は、伝達過敏を引き起こす。侵害受容神経経路の末梢および中枢の感作は、痛覚過敏とアロディニアを引き起こす。中枢性の感作は、線維筋痛症や複合性局所疼痛症候群など、様々な慢性疼痛症候群の統一的な特徴であると考えられている。
MOR-セカンドメッセージングを媒介する要素は、フィラミンA(FLNA)と呼ばれる足場となるタンパク質フィラメントである [8, 9]。FLNAは、ナロキソンとナルトレキソンの高親和性結合部位と相互作用する。結合すると、MOR-Gscouplingが減少し、Gi-couplingが活性化される。その結果、オピオイド作動薬の鎮痛作用が増強される。FLNAにはもう一つ、オピオイド拮抗薬との結合部位がある。オピオイド作動薬とオピオイド拮抗薬の両方の部位が飽和すると、オピオイド作動薬の良好なプロフィールは減少する。これらの親和性部位は、ウルトラ低用量ナルトレキソンのホルミシス応答を反映している。
低用量ナルトレキソンのもう一つの機序は、基礎オピオイド受容体シグナリングのアップレギュレーションに関与している可能性がある [12] 。低用量では、拮抗作用の逆説的効果により、エンドルフィン、メトエンケファリン、オピオイド成長因子の増加が観察され、生理的な基礎オピオイドシグナル伝達がアップレギュレーションされる。アップレギュレーションは、μ-オピオイドとδ-オピオイドの発現増加につながる。上昇したエンドルフィンは、気分や幸福感の改善といった神経心理学的な利益をもたらす可能性がある [13, 14]。興味深いことに、あるパイロット研究では、LDNが大うつ病の気分を改善したことが示されている [15] 。FLNAは脳内のドーパミン作動性(D2、D3)受容体にも存在し、うつ病治療の臨床的標的となる可能性がある [16] 。うつ病の病態生理学は複雑であるが、皮質基底核報酬系における異常なドーパミン作動性D2受容体の関与が示唆されている [17] 。大うつ病患者では、脳脊髄液中のドパミン代謝産物であるホモバニリン酸(HVA)が減少し、線条体のドパミン輸送密度が低下している [18, 19]。鎮痛、QOL、幸福感の改善のメカニズムは、オピオイド作用だけでなく、ドーパミン作用にも関係しているのだろうか?
ミクログリアやその他の炎症性細胞の活性化は、炎症性因子や興奮性因子を産生し、全身性の疼痛感受性、疲労、認知障害、睡眠障害、気分障害、倦怠感といった「病気症候群」を引き起こす可能性がある [20] 。グリア細胞の活性化が続くと、炎症性化学物質が放出され、神経障害状態が伝播する。リポ多糖を投与されたラットでは、水を求めてご褒美バーを押さないなど、抑うつ行動が見られる「病気症候群」が見られる [21] 。インターロイキン-1βの外因性投与は、動物に痛覚過敏を誘発することが示されている [21] 。がん性疼痛では、白血病や骨髄異形成症候群が、治療前の サイトカインレベルの上昇や認知障害と関連する疾患である ことから、「病気症候群」が認められている [21]。さらに調査を進めると、サイトカインやその他の炎症性メディエーターの産生を担う転写因子である核因子κBの活性調節異常との関連が明らかになった。エタネルセプトは腫瘍壊死受容体拮抗薬であり、関節リウマチの治療に有効である。この治療を受けている患者は、幸福感の改善について述べている。免疫調節は、ある種の痛みを伴う病態を治療するための道筋であることは明らかである。しかし、従来の免疫抑制剤および/または生物学的免疫抑制剤を慢性的に使用することには多くのリスクがある。しかし、従来の免疫抑制剤および/または生物学的免疫抑制剤を慢性的に使用することには多くのリスクがある。非全身の免疫抑制剤で神経炎症を微妙に調節できるというコンセプトは魅力的である。
低用量オピオイド拮抗薬の臨床経験
オピオイド作動薬を併用した場合と併用しない場合のオピオイド拮抗薬の臨床経験は、ケースシリーズと少数のランダム化試験に限られている(表1参照)。ある症例研究では、従来の治療に抵抗性の糖尿病性多発神経炎患者に、ナルトレキソンを1日2mcg、メサドンと併用投与したところ、効果がみられた [24] 。別の著者は、15人の患者を対象とした無作為化二重盲検前向きパイロット試験において、ナルトレキソン100mcg BIDの経口投与がモルヒネ持続投与患者の鎮痛を増強したことを示した [25].最大の改善は日常痛スケールでみられたが、サンプル数が少ないため統計的有意差には至らなかった。
複合性局所疼痛症候群
複合性局所疼痛症候群(CRPS)は、治療選択肢が限られている重度の神経障害性疾患である。一般に、この症候群は軟部組織や整形外科的損傷から始まり、血管運動性の変化や持続的な神経障害状態を伴う。長期間持続するCRPS患者2人のケースシリーズでは、低用量ナルトレキソンを用いて有意な疼痛緩和が認められた [26] 。低用量ナルトレキソンを投与して2ヵ月以内に、患者は主観的な疼痛の軽減、起立および歩行耐容能の改善を認めた。彼らはLDNでケタミンの使用を減らすことができた。また、病的肥満、睡眠時無呼吸、エーラス・ダンロス症候群、小腸内細菌過多症という重篤な医学的問題を有する難治性の長期CRPSの症例が報告された [27] 。患者は低用量ナルトレ キソンに反応し、CRPSは完全に寛解した。
線維筋痛症
線維筋痛症は、衰弱性の神経炎症性疾患と考えられている。線維筋痛症患者を対象とした小規模の対照研究では、LDNが疼痛緩和とQOLの改善をもたらすことが示唆され、示されている [4] 。
プラセボを2週間投与した後、ナルトレキソン4.5mgを8週間投与し、その後2週間の休薬期間を設けた [4]。6人の患者の結果、疼痛、疲労、ストレスなどの症状が30%軽減した。初期の赤血球沈降速度が高い患者は、ナルトレキソンに対する反応性の予測因子であることが示された。
同じ研究グループによって、低用量ナルトレキソン(4.5mg)を12週間、プラセボを4週間投与する20週間の無作為プラセボ対照クロスオーバー二重盲検試験が行われた [2-]。主要アウトカムは疼痛とQOLであった。31人の患者が疼痛、生活満足度、気分の有意な改善を認めた。重大な副作用は認められなかった。プラセボ群に比べ、鮮明な夢と頭痛が多くみられた。患者が副作用を認めた場合は、1日3mgまで減量した。同じグループによるこれらの研究のフォローアップとして、低用量ナルトレキソン投与中の患者のサイトカインプロファイルを評価する別の研究が行われた [28] 。8人の女性を対象とした10週間の単盲検試験が終了した。その結果、炎症性サイトカイン値、特にIL-6、TNF-αが有意に減少し、痛み、気分、満足感の有意な主観的改善が認められた。27週間後、低用量ナルトレキソンを投与された患者は、新たな副作用なしに改善を持続した(図1)。
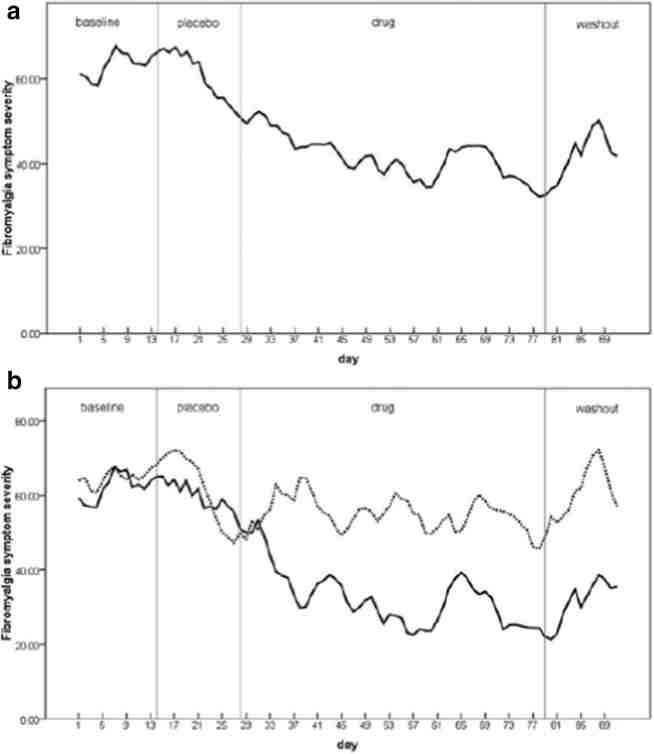
図1 プラセボおよび低用量ナルトレキソン投与による、
自己報告による線維筋痛症の全体的な日常症状(0~100のスケール、100が最も重度)。セクションはベースライン、プラセボ、薬物、ウォッシュアウトである。a 全参加者のデータ(N = 10)。 b 薬物反応者(プラセボより30%以上症状が軽減;実線、N = 6)と非反応者(破線、N = 4)に分けたデータ [4]。(許可を得て転載)
多発性硬化症
多発性硬化症は、低用量ナルトレキソンに反応する可能性のある典型的な自己免疫性神経炎症性疾患である。多施設共同非盲検パイロット試験において、進行性の多発性硬化症患者40人が6ヵ月にわたって低用量ナルトレキソンによる治療を受けた [29] 。痙縮の統計学的に有意な減少が認められた。薬物の忍容性は良好で、大きな副作用はなかった。興味深いことに、末梢血単核球においてβ-エンドルフィンのレベルが有意に増加した。
再発寛解型の多発性硬化症患者215人を対象としたレトロスペクティブ研究では、10年間にわたってLDNが投与された。患者の77%が重大な副作用はなかったと回想し、6%が不眠症、5%が悪夢を見た。患者の60%が疲労の改善を、75%がQOLの改善を報告した [30] 。対照的に、多発性硬化症のQOLに対するLDNの有効性を検討するために、17週間と8週間の2つの無作為プラセボ対照試験が行われた [31, 32]。96人の患者を対象とした17週間の研究では、健康感を除くQOL指標に統計的な差はみられなかった。60人の患者を対象とした8週間の研究では、QOLの指標における精神的健康の要素に有意な改善がみられた。
別のレトロスペクティブ研究では、多発性硬化症患者をグラチラマー酢酸塩のみと低用量ナルトレキソンで比較した [30] 。炎症の磁気共鳴マーカー、歩行距離、血清炎症マーカーの比較では群間差は認められなかった。LDNの使用は忍容性が高く、標準的な多発性硬化症治療薬であるグラチラマーアセテートと併用可能であった。
炎症性腸疾患
クローン病などの炎症性腸疾患は、痛覚過敏や腹痛などの臨床症状を伴う神経炎症状態として注目されている。炎症性腸疾患に対するナルトレキソンの使用を評価する複数の研究が行われた。
過敏性腸症候群の被験者42人を対象に、LDNのパイロット研究が行われた [33] 。この非盲検試験では、1日0.5mgのナルトレキソンが4週間にわたって使用された。患者の75%以上が疼痛の軽減を認め、反応者とみなされた。
最も初期の研究の1つは、組織学的に活動性のクローン病患者17人を対象とした非盲検試験であった。低用量ナルトレキソン4.5mgが12週間にわたって毎日投与された。治療後、患者の89%が奏効し、クローン病活動性指数(CDAI)は70%低下した。患者の67%が疾患寛解を達成した。QOL指標の改善はLDN群で有意であった [34] 。
最近のコクランレビュー(2018年)では、クローン病の寛解導入のための方法としてLDNが評価されている [35] 。小児患者12人を含む46人が参加した2件の研究が確認された [34, 36]。両試験とも無作為プラセボ対照試験で、成人では12週間、小児では8週間にわたって有効性を評価した。クローン病活動性指標(CDAI)が臨床的、統計的に有意に70ポイント低下したことが成人患者の83%で確認された。内視鏡的評価では、プラセボ群とLDN群で差はなかった。これらの小児患者の25%がLDN群で完全寛解を示したのに対し、プラセボ群では完全寛解はみられなかった。薬物の忍容性は良好で、睡眠障害、疲労、悪心、頭痛などの軽い副作用はあまりみられなかった。
慢性腰痛と変形性関節症
治療効果を評価するために、オキシコドンとULDNの併用に関する2つの臨床試験が行われた。最初の臨床試験は、慢性腰痛患者719人を対象に、ULDNを1日2または4mcgとオキシコドン最大80mgを1日4回に分けて併用する試験が行われた [37] 。被験者は、プラセボ、オキシコドン1日6回投与、オキシコドン+ULDN1日6回投与、オキシコドン+ULDN1日2回投与に1:2:2:2の割合で無作為に割り付けられた。オキシコドン1日10mg投与から開始し、毎週最大オキシコドン1日80mgまで増量するか、安定した疼痛コントロール≦2または副作用による制限を達成するまでの初期漸増期間を経た。すべての治療群でプラセボと比較して有意な疼痛緩和が認められ、オキシコドン+2mcg/日のULDNが最も良好な結果を示した。この群では、便秘、傾眠、そう痒などのオピオイド関連の副作用が少なかった。ナルトレキソン(2mcgまたは4mcg)を投与された患者群では、オキシコドン単独投与と比較して、1日あたりのオピオイド消費量が12%少なかった-実際、1日2回の併用療法は、鎮痛という点では1日4回のオキシコドン単独療法と同等であった。この研究では有意な脱落率があったため、結果の解釈には注意が必要である。同じ研究グループが、変形性関節症の疼痛に対してULDNとオキシコドンを併用した同様の臨床試験を行っており、そこでも同様の結果が得られているが、脱落率が高いことも指摘されている[38]。(図2参照)。興味深いことに、反応にはジェンダー差が認められ、女性では有意な疼痛緩和が認められたが、男性では認められなかった。
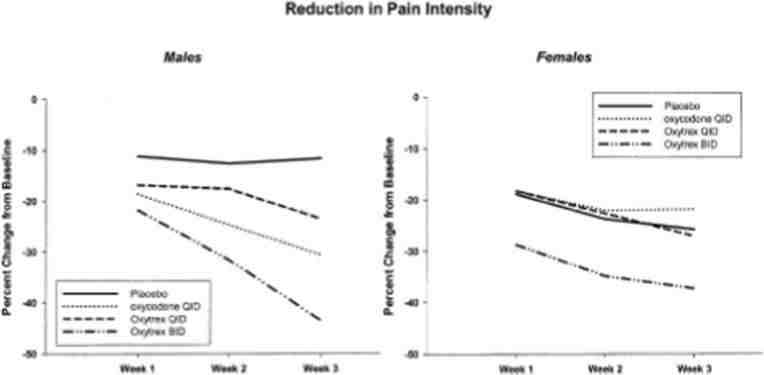
図2 男女における疼痛強度の減少
オキシトレックス(オキシコドン+ULDN)2回/日投与は、男女ともに疼痛強度のスコアを最も低下させた。3週目では、オキシトレックスの2回投与は、男性ではプラセボより有意に良好であり、女性ではオキシコドンより有意に良好であった[38]。(許可を得て転載)
安全性と副作用
低用量ナルトレキソンは配合剤であるため、入手可能な薬理学的情報は限られている [39] 。入手可能な情報には、高用量ナルトレキソンに関するものがあり、適応症はオピオイドおよびアルコール使用障害治療である。このオピオイド拮抗薬の主な副作用の1つにオピオイド離脱が挙げられているが、低用量では臨床的にこのような作用は見られないことを忘れてはならない。興味深いことに、オキシコドンと共にULDNを併用投与された被験者では、投与中止後の離脱症状の発現率が低かった [37] 。添付文書には、1日300mgを超える投与による肝細胞傷害のリスクが警告として記載されている。通常の1日量50~100mgのナルトレキソンは安全と考えられている。複雑な再発寛解型多発性硬化症患者において、低用量ナルトレキソンと関連する可能性のある免疫関連血小板減少症の症例が1例報告されている [40] 。臨床診療および臨床試験では、1日4.5mg未満の低用量ナルトレキソンは、吐き気、睡眠障害、悪夢、鮮明な夢などの副作用が少ない。悪夢や鮮明な夢がある場合、それらは時間の経過とともに減少するか、夜ではなく朝の服用タイミングによって改善するようである。LDNがオピオイド服用中の患者のオピオイド離脱を促進することは、あったとしてもまれである。慢性的なオピオイド継続投与が維持されている患者には、ULDN(1日0.5mg未満)を使用することが著者の推奨するところである。
結論と今後の方向性
LDNの臨床使用に関する最近の研究は、慢性疼痛状態に神経炎症過程が関与しているという概念を支持している。今後の前臨床研究では、神経炎症状態のメカニズムと分子標的に焦点を当てるべきである。臨床研究では、ファーストパス・メカニズムを避けるために、舌下、粘膜下、髄腔内、局所など、他のデリバリー・システムを検討することもできる。より厳密で長期的な臨床研究を行う必要があるが、現実的には政府からの支援や商業化の立場からの支援が必要である。
健全な前臨床試験と優れた安全性プロファイルに基づけば、LDNとULDNの臨床使用は慢性疼痛患者における合理的な選択肢とみなされるべきであり、中枢性感作の症状を呈する患者においては早期の治療選択肢と考えられる。慢性疼痛患者にとって、FDAが承認した他の代替薬が存在しない場合、多くの臨床的状況が存在する。慢性疼痛症候群に対して適応外薬や配合薬を使用することは、現代の臨床では一般的である。1983年から2018年までのFDAの医薬品承認プロセスを最近レビューしたところ、医薬品承認が進化しており、特に治療困難な治療領域において、実験的で緊急性の高い用途のために、より多くの医薬品を承認しなければならないという圧力があることが示された [41] 。オピオイドが蔓延し、慢性疼痛にオピオイドが処方されるようになったこの時代において、LDNを含む代替戦略の位置づけを早期に検討する必要がある。
