Contents
Less Can Be More: The Hormesis Theory of Stress Adaptation in the Global Biosphere and Its Implications
ncbi.nlm.nih.gov/pmc/articles/PMC8000639/
オンラインで公開2021年3月13日
フォルカー・シルマッハー(Volker Schirrmacher)
レティツィア・ポリート(学術編集者)
要旨
ホルミシス理論によると、ストレス因子に対する用量反応関係は、低用量の刺激と高用量の抑制によって特徴づけられる。ホルミシス理論によれば、ストレス因子の用量反応関係は、低用量での刺激と高用量での抑制という特徴があり、低用量での最適値を持つ非線形関係である。
細胞によるストレス応答は、適応した生命力とフィットネスにつながる。物理的ストレスは、熱、放射線、運動などによって与えられる。化学的ストレス要因には、酸素(ROS)窒素(RNS)炭素(RCS)などの活性種、発がん性物質、リチウム(Li)やケイ素(Si)などの元素、銀(Ag)カドミウム(Cd)鉛(Pb)などの金属がある。人為的な化学物質としては、農薬(植物毒、除草剤)工業化学物質、医薬品などがある。生化学的ストレスは、毒素、医療用医薬品(細胞増殖剤、精神医薬、非ステロイド系炎症抑制剤など)断食(食事制限)などによって発揮される。
酵素と基質、抗原と抗体、抗原提示細胞と同種のT細胞の間のキーロック相互作用は、生物学、生化学、免疫学の基本である。そのルールは、直線的な用量反応関係に従うものではない。
この総説では、生物学的ストレッサーの例として、オンコロイドウイルス(例:がんの免疫療法)とホルミシス(例:メラトニン、ストレスホルミシス)を挙げている。
細胞のストレス適応の分子メカニズムには、タンパク質品質管理システム(PQS)とプロテアソーム、小胞体、ミトコンドリアのホメオスタシスが関わっている。また、転写因子(Nrf2など)マイクロRNA、熱ショックタンパク質、イオン性カルシウム、酵素(グルタチオンレドックス酵素、DNAメチルトランスフェラーゼ、DNA修復酵素など)が重要な構成要素となっている。細胞の成長制御、細胞間コミュニケーション、微生物感染によるストレスへの抵抗には、成長因子、サイトカイン、ケモカイン、インターフェロン、およびそれらの受容体が関与している。進化におけるホルミシスの効果は、細胞の保護と生存、進化の柔軟性、エピジェネティックな記憶など、多岐にわたる。ホルミシス理論によれば、これは生物圏全体、例えば古細菌、バクテリア、菌類、植物、動物界にも当てはまる。
キーワード
酸化ストレス、低線量放射線、代謝スイッチ、ホメオスタシス、エピジェネティックメモリー、ワールブルグ効果、メモリーT細胞、骨髄、Nrf2,オンコリシス、免疫原性細胞死
1. はじめに
ホルミシスとは、ストレス因子に対して低用量の刺激と高用量の抑制という用量反応関係を示すものである。例えば、発がん性物質であるダイオキシンがラットの乳がん発生に及ぼす影響が挙げられる。低用量領域では、ダイオキシンがない場合や高用量の場合と比較して、腫瘍の発生頻度が大きく減少する[1]。化学療法剤、抗生物質、非ステロイド性炎症抑制剤(NSAIDs)毒素などの用量反応曲線を調べると、直下では毒性のある副作用が軽減されるU字型の曲線が見られる[2]。
ホルミシスは,進化的に古くから存在する細胞の二相性の用量反応であり,一般化しやすい現象である[2]。2005年に作成されたホルミシスデータベースには,広く多様な約900種類の化学物質や物理剤に関する5600件の用量反応関係が含まれている[3]。炭化水素でさえ,毒性学的閾値の100倍までの用量で生物相にホルミシスを引き起こす [4]。
線形非閾値モデル(LNTM)は、電離放射線への高線量被曝による晩期障害を低線量域に外挿するもので、実際に現在の放射線防護政策の基礎となっている。しかし、分子進化生物学、がん免疫学、疫学、動物実験などの進歩により、LNTMの有効性と信頼性に重大な疑問が投げかけられている[5]。ホルミシスは、発がん性物質および非発がん性物質のリスク評価の中心的な概念として浮上している。ホルミシスは,臨床医学にとって重要な意味を持っている[6]。
この総説は,ミトコンドリアに関する前回の総説 [7] と同様に,地球上におけるこの現象の進化から始まる。ホルミシス効果は,免疫系に特別な注意を払いつつ,生化学的・分子的な観点から説明されている。また,精神医学,神経変性疾患,心血管疾患,メタボリックシンドローム,自己免疫疾患,癌などの分野における臨床的意義についても例示されている。また、植物細胞におけるホルミシス効果も説明されており、農業への影響も示唆されている。この総説では、適応的ストレス反応の古来からの起源に光を当て、その世界的な有効性を明らかにしている。
2. 進化的起源
2.1. 進化の始まり
何十億年もの間、地球上の生命は環境の変化に適応しなければならなかった。シアノバクテリアによる光合成の発明により、嫌気性の大気は次第に酸素(O2)で満たされるようになった。そこで、大気中のこの新しい元素の毒性に対処するために、バクテリアの中で抗酸化ネットワークが進化したのである。グルタチオン(GSH)システムがその例である。バクテリアを数時間酸素にさらすと、転写レベルでホルミシス反応が見られ、Nrf2(核因子赤血球2関連因子)を介してGSH合成に関わる酵素の発現が上昇する。また、光合成細菌では、最終的にエピジェネティックや遺伝子レベルでも適応が起こっている[8]。
ケモディフェンスシステム
化学的防御システムは,有害物質から生物を守るために非常に早い時期に進化したことが提案されている。そのメカニズムは,例えば,親油性化合物,親水性化合物,酸化剤,酸性物質,遺伝毒性物質,金属などが関係している。後に進化する免疫防御システムとの類似性から,化学防御システムは,以下のように特徴づけることができる:若いうちは部分的に未熟,誘導性,非特異性,特異性[9]。
QS(Quorum Sensing)受容体を介したホルミシス
水溶液の水素イオン濃度(H+またはH3O+)(pHによる対数測定)が細菌のホルミシス反応に影響を与えることが実証された。ある化合物のpHプロファイルは,Vibrio qinghaiensis sp.-Q67の発光反応に影響を与えた[10]。ホルミシスを示す化合物は,ルシフェラーゼのβサブユニットよりもαサブユニットに結合しやすかった[10].スルホンアミド(SA)が細菌のQS細胞間コミュニケーションに及ぼすホルミシスのメカニズムを調べるため,アリビブリオ・フィシェリ菌の発光を調べた。その結果、SA はクォーラムセンサーの LitR タンパク質に作用し、その活性型を変化させることが示唆された。これにより、LitR(QSシグナル受容体、[11])にホルミシス作用が起こり、発光に影響を与えることが示唆された[12]。SAは、低用量ではアデニル酸シクラーゼと結合し、高用量ではジヒドロプテロエート合成酵素と結合することが報告されている。新たな知見として、このホルミシスシステムにおけるエネルギー源の役割が明らかになった[13]。
紫外線からの保護
モノテルペンであるカンファー,ユーカリプトール,トゥジョンの保護作用を大腸菌K12で調べた。その結果はホルミシス反応と一致していた。低用量では、これらの薬剤は、紫外線による突然変異誘発や発癌物質である4-ニトロキノリン-1-オキシド(4NQO)によるDNA鎖切断からバクテリアを保護した。同様の効果は、DNA修復能力の高い哺乳類のVero細胞でも見られた[14]。
電離放射線ホルミシス
発光性海洋細菌を用いて放射線ホルミシスと毒性を調べた。生物発光強度を生理学的パラメータとして用い、アルファ線およびベータ線を放出する放射性核種(アメリシウム241,ウラン235+238,トリチウム)への曝露の影響を調査した。3つの連続した反応段階が検出された。1)影響のない状態(ストレス認識)(2)活性化(適応反応)(3)抑制(生理機能の抑制、すなわち放射線毒性)[15]。
グリコホルミシス(Glycohormesis)
酵母菌の細胞を用いた実験により、ホルミシスは、エネルギーフラックスが増加した際に蓄積する毒性代謝物を細胞が処理できることを明らかにした[16]。活性カルボニル(RCS)種と活性酸素(ROS)種は、進行性糖化最終産物(AGEs)の生成と酸化ストレスを通じて細胞の損傷を引き起こした。メチルグリオキサール(MG)で前処理を行うと、代謝が変化し、タンパク質品質管理システム(PQS)が活性化された。その結果、ミトホルミシスに加えて、グリコホルミシスも存在することがわかった。代謝ストレスとタンパク質毒性ストレスの直接的な関連性が示唆された。シャペロンシステムの操作などの特定の治療的介入は,薬剤開発や,糖尿病(DM)や神経変性疾患などのRCSやROSレベルの上昇を伴う疾患の治療のための新しい分野を開くかもしれない[16].
絶食ストレスと分化誘導
食事制限ストレスは,粘菌の繁殖サイクルを誘導することができる。粘菌(Dictyostelium)は、真菌王国Mycotaの前に古細菌から分離した枝に属している。2005年に発表されたプロテオームに基づく真核生物の系統樹は、6つの古細菌のプロテオームに基づいている。マラリア原虫(Plasmodium faciparum)緑藻(Clamydomonas reinhardtii)イネ(Oryza sativa)トウモロコシ(Zea mays)魚(Fugus rubripes)蚊(Anopheles gambiae)の6種類の古細菌プロテオームを用いて 2005年に真核生物の系統樹を作成した。これにより,粘菌はアメーバ動物と呼ばれる枝に属することが明らかになった[16]。Dictyostelim discoideumは,構造的・機能的に重要な情報源である。食事制限のストレスがかかると,単細胞が凝集し,ポリケチド分化誘導因子-1を介して茎細胞の分化が誘導される。茎の上にある子実体では,さらに分化のステップが起こる[17].このように,絶食は,単細胞生物から多細胞生物への変化を含む,生殖サイクルのシグナルを誘導した。
断食が誘発するオートファジー
別の調査の目的は、ホルミシスのメカニズムとして、断食誘発性オートファジーによる抗酸化細胞保護効果を検証することであった。動物モデルとして、海産カタツムリ(Common periwinkle, Littoria littoria)を用いた。これらのカタツムリは、7日間藻類の餌を絶つことで、肝膵臓の消化細胞(肝細胞の類似体)に増大したオートファジー反応を誘発した。断食は、リソソーム膜の安定性、脂質過酸化の減少、リソソーム/細胞トリグリセリドの減少など、細胞の健康状態を著しく向上させた。それは、潜在的に有害なリポフスチン(タンパク質性の凝集体の老化色素)を減少させた[18]。
断食、小胞体(ER)ストレス、プロテオスタシス
線虫などの研究では,食事制限によってプロテオスタシスが改善され,寿命が延びることが示された。そのメカニズムは、小胞体ホルミシスである。小胞体のアンフォールドタンパク質応答(UPR)により、細胞内のプロテオスタシスが維持されたのである[19]。
環境ストレスへの対応
線虫では,環境ストレスが,生殖細胞からソーマへのコミュニケーションを介して,遺伝的な生存の優位性を誘発することが示された。発生段階で様々なストレス要因にさらされた動物は,酸化ストレスやタンパク質毒性に対する抵抗力が高まった。この抵抗性の増加は、エピジェネティックな変化を介して、ストレスのない条件で成長した次の世代に伝えられた。親の体細胞では、インスリン/インスリン様成長因子(IGF)シグナルエフェクターDAF-16/FOXOと熱ショック因子HSF-1が、エピジェネティックメモリーの形成を仲介していた。この記憶は、生殖細胞内のヒストンH3リジン4トリメチラーゼ複合体によって世代を超えて維持された。記憶の誘発には,体細胞組織における転写因子(TF)SKN-1(哺乳類のNrf2に相同)が必要であった[20]。
穏やかなストレスが老化や寿命に及ぼすプラスの影響は,主にワーム(C. elegans)や昆虫(Drosophila melanogaster)の細胞で研究され、記録されている[21].過重力[22]や軽度の寒冷ストレス[23]などの軽度のストレスは,動物のパフォーマンスを保護・向上させる。ホルミシスは、
- プレコンディショニング、コンディショニング
- プレトリート
- クロス・トレランス
- アダプティブ・ホメオスタシス
など、複数の名称で知られている[24]。食事制限(DR)、絶食(FA)、寒冷暴露(CE)はホルミシスストレスモデルである[25]。急速ストレス硬化(RCH)は、低温に対する最も早い順応反応として知られており、特に甲殻類、陸生節足動物、両生類、爬虫類などの外温動物にとっては、温度変化に対処するための重要な適応であるとされている。1987年にScience誌に掲載された論文である。Sarcophaga crassipalpisというハエを-10℃で2時間冷熱ショックを与えたところ、80%以上が死亡した。しかし,同じ冷熱ショックの前に0℃に30分だけさらすと,死亡率は50%以下に低下した[26]。種を超えたRCHに関連する分子メカニズムとしては
- 対立遺伝子の変異
- 転写(熱ショックタンパク質,低温保護剤の合成など)
- 翻訳(カルシウムシグナル,酸化還元バランスなど)
- 翻訳後修飾(p38/MAPキナーゼ,mRNAモニタリングなど)
- 生化学的変化(低温保護剤の蓄積,膜の流動性など)
などの生物学的プロセスが明らかになった[26]。
時を経て,ホルミシスは生物学の基本概念として認識されるようになった。ホルミシスは,例えば,毒性学,微生物学,医学,公衆衛生,農業などにも影響を与えている[27]。
表1は,パートIIの主な特徴,メカニズム,効果の概要を示したものである。
表1 ホルミシスの進化的側面
| ストレス機能 | インデューサー/モジュレーター/ターゲット I / M / T |
モルメカニズム | 効果 |
|---|---|---|---|
| 酸化ストレス | グルタチオンシステム(M) | TF Nrf2 | 恒常性 |
| Chemodefence | 金属、遺伝子毒性(I) | 誘導性 | 保護 |
| pH | スルホンアミド(I) QS luxR(M) |
アデニル酸シクラーゼ | エネルギー |
| UVライト | モノテルペン(M) | 4NQO | UV保護 |
| 放射線 | 発光海洋 細菌(T) |
3つの応答レベル | 適応応答 |
| RCSとROS | 酵母のPQS(M) | ミトルメシス、 グリコホルメシス |
保護 |
| 断食 | Dictyostelium(M)による単細胞から多細胞への形質転換 | ポリケチド 分化 誘導因子1 |
生殖 サイクル |
| 断食 | 海洋カタツムリ(T) カエノラブディティス(ワーム)(T) |
オートファジー SNK-1 / Nrf |
リポフスチン エピジェネティックな記憶の減少 |
ホルミシスとは、進化的に古い細胞の二相性の用量反応であり、一般化しやすい現象である。I = インデューサー、M = モジュレーター、T = ターゲット、RCS = 活性炭素種、ROS = 活性酸素種、QS luxR = クオラムセンシングシグナル受容体、PQS = タンパク質品質管理システム、TF = 転写因子、Nrf2 = 核因子赤血球2関連因子、4NQO = 発がん性物質4-ニトロキノリン-1-オキシド、SNK-1 = 哺乳類のNrf2との相同性。
2.2. Nrf2と抗酸化・抗炎症の細胞応答におけるその役割
転写因子Nrf2と相同性のあるタンパク質は、線虫C. elegansにすでに存在していた。哺乳類におけるNrf2シグナル伝達経路は、抗酸化遺伝子の発現制御や抗炎症機能の発揮に重要な役割を果たしている。最近、その詳細が明らかにされた[28]。哺乳類の細胞内では,正常な恒常性を保つために,Kelch-like ECH-associated protein 1 (Keap1)がE3リガーゼとホモ二量体を形成している。この複合体(Keap1-Cul3-RBX1)は,Nrf2のKeap1結合ドメインと相互作用し,Nrf2のユビキチン化と分解を導く[28]。
Keap1の特定のシステイン残基は、反応性が高く、ROS、RNS、H2Sなどの求電子物質や小胞体ストレスによって共有結合による修飾を受けやすい。これらの重要なシステインのS-スルフェニル化、S-ニトロシル化、S-硫酸化により、Keap1の構造が変化する。これにプロテインキナーゼによるNrf2のリン酸化が加わり、Nrf2の解離と安定化が促進される。その後、Nrf2の核内移行、small Mafタンパク質(sMaf)とのヘテロ二量体化、抗酸化応答要素(ARE)への結合が起こり、ヘムオキシゲナーゼ-1(HO-1)などのARE駆動型遺伝子の転写が引き起こされる[28]。
このNrf2のシグナル伝達経路に加えて、Nrf2は、炎症を引き起こすNFκB(nuclear factor kappa-light-chain-enhancer of activated B)経路を妨害する。炎症は、病原体の感染や組織の損傷など、さまざまな生物学的脅威に対する反応である。まず、感染シグナルおよび/または組織損傷シグナルの検出が行われる。このようなシグナルは、病原体関連分子パターン(PAMPs)や損傷関連分子パターン(DAMPs)によって媒介される。これらの外因性および内因性の分子パターンは、免疫細胞に発現しているパターン認識受容体(PRR)を介して認識される。Toll-like receptor (TLR)やinflammosomeは、特定の免疫シグナル伝達経路を活性化し、その結果、NFκBを活性化する。
TLRの活性化に対する反応は、まずNFκB/IkB複合体がリン酸化され、NFκBがIκBから解離することで始まる。続いて、NFκBが核に移動し、炎症性サイトカイン(インターロイキン-1-β(Il-1ß)IL-6,腫瘍壊死因子-α(TNF-α)など)をコードする遺伝子が誘導・転写される。これらのサイトカインは、単球や好中球などの免疫細胞を、感染や組織の損傷部位に呼び寄せる。これらのサイトカインが活性化されると、活性酸素や窒素種(ROS、RNS)が生成され、タンパク質やDNAなどの高分子の損傷を引き起こす。創傷治癒などの正常な生理状態では、修復によって好中球のそれ以上の侵入が阻止され、組織の恒常性が回復される。
しかし、慢性的な「炎症」では、細胞損傷のリスクは何倍にも膨れ上がる。持続的な炎症反応は組織の損傷を引き起こす。ケモカインやプロスタグランジンが放出されると、さらに炎症細胞が集まってきて、呼吸バーストが起こり、酸化ストレスが上昇する。NFκBやNrf2などの転写因子の活性化は、炎症のシグナルカスケードや酸化ストレス応答の重要な構成要素である。活性酸素によって活性化される上述のNrf2/HO-1軸は、炎症においてNFκBを妨害することができる。これには、NFκBの活性化の阻害、IκB-αの分解の阻害、NFκBの分解、NFκBの核転位の阻害などがある。これらの複雑な制御相互作用に関する最新の洞察は、最近、優れたレビューがなされている[28]。表2は,Nfr2の概要と,抗酸化および抗炎症の細胞応答における役割を示したものである。
表2 Nrf2とその抗酸化および抗炎症細胞応答における役割
| ストレス要因 | 応答(パートA) | 応答(パートB) | 効果 |
|---|---|---|---|
| ROS、ER | 1.Nrf2のリン酸化とKeap複合体からの放出2.Nrf2 -Pの核への乗換え |
3. cMafによるヘテロ二量体化、4。ARE への結合 5. HO-1、NQO1、GCLMの転写 |
抗酸化 |
| TLR | 1.NFκBのリン酸化とIKK複合体からの放出 2.NFκBの核への移行 3.炎症性サイトカインの誘導 |
4.Nrf2を介したHO-1発現の誘導 5.Nrf2を介したNFκB活性化の阻害 6.IkB-aの分解の遮断 7.Nrf2を介したNFκBの分解8.Nrf2を介した 核移行の阻害 |
抗炎症 |
Nrf2は、抗酸化遺伝子の発現をコントロールする重要な役割を果たしており、最終的には抗炎症機能を発揮する。Nrf2=Nuclear factor erythroid 2-related factor,Keap=Keap1-Cul3-RBX1複合体,ROS=Reactive oxygen species,ER=Endoplasmic Reticulum,TLR=Toll-like receptor,cMaf=small Maf proteins,HO-1=Heme oxygenase-1,NQO1=NADPH quinone oxidoreductase I,GCLM=Glutamate-cystein ligase modifier subunit,NFκB=Nuclear factor kappa B (p50/p65). IKK=IκBとNFκBとの複合体;IκB=アンキリンリピート含有NFκB制御タンパク質。
3. 低線量放射線(LDR)が媒介する免疫系のホルミシス効果
高線量放射線(HDR)は通常、免疫抑制を引き起こす。これに対し、低線量放射線(LDR)は様々な免疫反応を調節し、免疫ホルミシスの特性を示す。ホルミシス効果には、自然免疫の細胞と適応免疫の細胞が含まれる[29]。
3.1. 低線量放射線と自然免疫
低線量放射線は、細胞増殖を刺激し、細胞障害機能を促進することで、NK細胞の活性を高めることができる[30]。これは、p38/MAPK(mitogen-activated protein kinase)シグナル伝達経路と関連していた[30]。また,低線量放射線はマクロファージのM1極性への分化を促進することが報告されている。この細胞は誘導性一酸化窒素合成酵素(iNOS)に陽性であり、効果的なT細胞免疫療法を指揮することができた。また、低線量放射線は、刺激を受けたマクロファージの酸化バーストに影響を与えることが報告されている[32]。樹状細胞(DC)に対する低線量放射線の影響については、相反する報告がなされている。DC前駆体に0.5Gyを試験管内試験で照射しても、リポポリサッカライド(LPS)によって誘導される表面マーカーの発現やサイトカインのプロファイルには影響を与えなかった[33]。一方、別の研究では,0.05Gyの前処理をしたDCは、T細胞に対して最も高い増殖誘導能力を示し、インターロイキン(IL)-2,IL-12,IFN-γの産生を増強することが報告されている[34]。
3.2. 低線量放射線と適応免疫
低線量放射線は,試験管内試験および生体内試験において,CD4+ヘルパーT細胞の反応を増強することが報告されている[35].同様に、低線量放射線治療後にCD8+細胞傷害性T細胞(CTL)の反応が増強されることが報告されている[36]。その分子メカニズムには,活性化された生存/シグナル伝達タンパク質(NFκB,p38/MAPK,c-Jun N-terminal kinase(JNK)など)が関与している可能性が高い。[37]. また、低線量放射線は、免疫増強サイトカイン(IL-2およびIL-4)の産生を増加させ、主要な免疫抑制サイトカイン(トランスフォーミング成長因子-ß1(TGF-ß1))の産生を減少させた。[37]. さらに、CDマーカー(CD3,CD2,CD4,CD28など)は、低線量放射線によって発現が増加した[38]。制御性T細胞(Tregs)に関しては、低線量放射線後のマウスやラットで著しく減少したことを示す研究もある[39]。Tregの抑制活性を媒介する最も関連性の高いサイトカインであるIL-10も、低線量放射線によって減少した[40]。
低線量放射線はまた、B細胞の行動の多くの側面に影響を与える。低線量放射線は、NFκBの活性化および細胞分化分子であるCD23の誘導を通じて、B細胞の分化を調節することができる[41]。低線量放射線は、グローバルなゲノムDNAメチル化を増加させ[42]、酸化的リン酸化(OXPHOS)から好気的な解糖への代謝シフトを促進することができる。これは、ヒトB細胞の放射線耐性の向上につながる[43]。
結論として、低線量の治療用照射は、バックグラウンド照射(ラドン温泉など)と同様に、免疫学的観点からは破壊的ではなく有益である[43]。
4. 免疫系におけるその他のホルミシスの影響
免疫系は、環境化合物(化学物質など)物理的影響(背景照射、大きな温度変化)あるいは医療(薬剤)や食品との相互作用によるホルミシス作用の影響を継続的に受けている[44]。低レベルの活性酸素は,細胞内の主要な抗酸化経路(チオレドキシン(TRX)やGSHなど)や,それらの転写調節因子であるNrf2を活性化する[45].
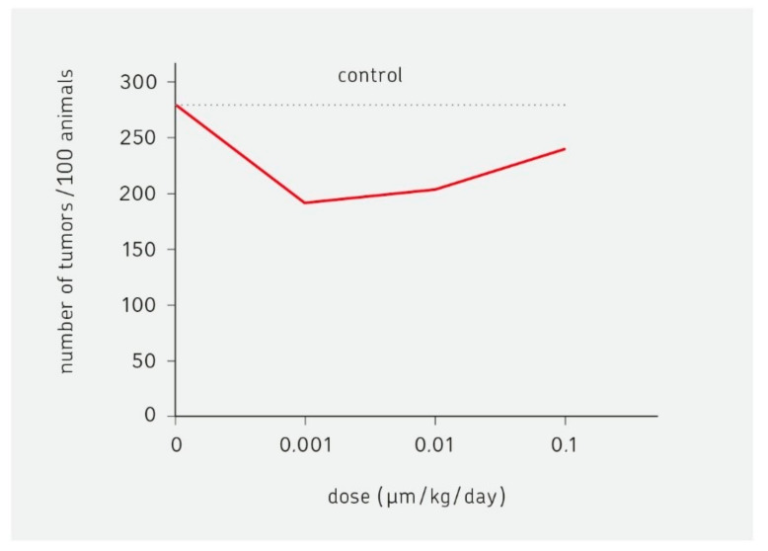
2003年には,発がん物質(ダイオキシン)によるホルミシス効果が報告された[46]。この実験では,ラットの乳がん発症に対するダイオキシンの影響が検証された。その結果を図1に示する。低線量域では、ダイオキシンを含まない場合と、100倍量の発がん物質を投与した場合とで、腫瘍の発生頻度が大きく減少している。曲線の形は、UまたはJ、逆ベルと表現される。この効果のメカニズムは解明されていない。低線量域での免疫系の活性化が一つの可能性である。
図1 ホルミシス効果の例
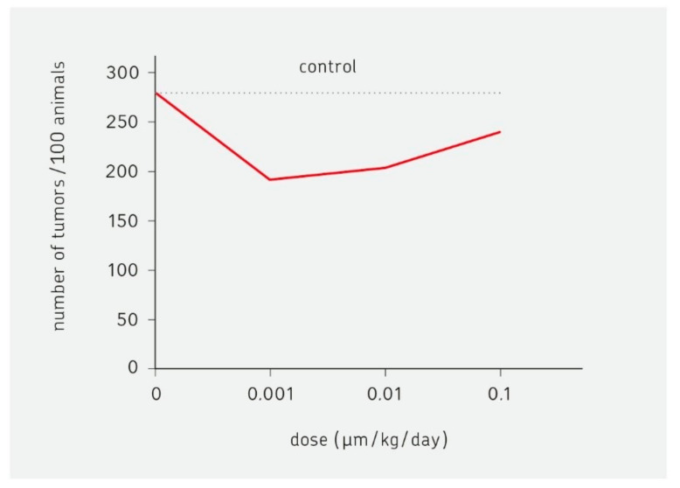
ダイオキシンがラットの乳がんの発生に及ぼす影響を示したもの。低用量(0.001mm/kg/day)では、腫瘍の発生が強く抑制される。Kaiser, J. [46]による。
4.1. 免疫学的記憶による保護
免疫学的記憶は、適応免疫系の主要な特徴である。全身の免疫モニタリングは、中枢、エフェクター、および末梢のメモリーT細胞(MTC)を含む循環細胞に基づいている。局所的な免疫モニタリングは、組織に常駐するMTCに基づいている。定常状態では、MTCのホメオスタシスは、様々なサイトカイン、転写因子、および代謝燃料の制御下にある[47]。
哺乳類は、食物の入手可能性が変動する中で進化していた。一過性の食事制限(DR)が免疫系に及ぼす影響がマウスで研究されている。食事制限下では,MTCは二次リンパ系器官で崩壊し,骨髄(BM)に蓄積した。グルココルチコイドはBMの反応を調整し、脂肪生成を含むエネルギー保存状態をとりながら、BMの大規模なリモデリングを行った。ケモカイン受容体CXCR4とそのリガンドであるCXCL12,およびBMの栄養因子の相互作用がT細胞の蓄積に寄与した。このようにして、BMは免疫学的記憶を保護し、最適化した。DR下でのMTCのBMへのホーミングは、感染症や腫瘍に対する保護の強化と関連していた[47]。
4.2. 生物学的脅威に対するホルミシス効果としてのマクロファージによる長寿と組織保護の増加
ショウジョウバエ(Drosophila melanogaster)を用いた研究では、病原性真菌の胞子にチャレンジすると、寿命と繁殖力が増加する一方で、抗真菌免疫機能が低下することが報告されている[48]。このように、毒素やその他のストレス要因への低レベルの曝露による有益な効果は、必ずしも、そしてすべての条件下で、免疫系を助けるとは限らない[48]。
別の研究では、マクロファージの活性化パターンにホルミシスを介した用量依存性の変化が認められた。マクロファージの活性化や偏りは、生物学的脅威から身を守るための適応として進化していた。本研究では 本研究では、(1)多くの薬理学的、化学的、物理的な物質が、炎症促進状態と抗炎症状態の間のシフトを媒介すること、(2)これらのシフトは、ホルミシスに特徴的な二相性の用量反応関係を示すこと、を明らかにした。また、本研究では、プレコンディショニングも同様に、マクロファージの分極化による組織保護を媒介することが明らかになった。しかし,この場合,方向性は抗炎症性の表現型に向かっていた[49].
マイクロバイオームもホルミシスに影響を与える。文献を調べてみると、発がんや治療に影響を与えていることがわかった。微生物には、がんのリスクを擾乱し、放射線照射後のホルミシスを高める能力があることが記録されている[50]。
4.3. スポーティな運動による免疫系へのホルミシス効果
スポーティな運動は、自然/炎症反応に影響を与える。このような影響は、主に交感神経系(SNS)や視床下部-下垂体-副腎(HPA)軸によって媒介される。副腎からのストレスホルミシス(カテコールアミンおよびグルココルチド)が重要な役割を果たしている [51]。表3は、パートIIIおよびIVの主な特徴、メカニズム、および効果の概要を示している。
表3 免疫系におけるホルミシスの作用
| ストレス要因 | センサー/変調器/ターゲット S / M / T |
モルメカニズム | 効果 |
|---|---|---|---|
| 低線量放射線 | NK細胞(S) | p38 / MAPK | 細胞毒性 |
| 低線量放射線 | マクロファージ、M1(S) | iNOS、 酸化的バースト |
T細胞免疫療法のオーケストレーション |
| 低線量放射線 | CD4およびCD8T細胞(S) T制御性細胞(S) |
p38 / MAPK、NFκB、 JNKIL -10ダウン |
サイトカイン分泌、 CTL活性の ダウンレギュレーション |
| 低線量放射線 | B細胞(S) | NFκB、CD23 | OXPHOSは好気性グリコシル化に移行します |
| 真菌胞子毒素 | ショウジョウバエ(T) | 寿命と繁殖力の向上; 免疫機能の低下 | |
| 生物学的脅威、 微生物による感染 |
マクロファージ(S) | M1 / M2シフト | 組織保護 |
| 一過性の食事制限(DR) | メモリーT細胞(M)、骨髄での保存 | CXCR4 / CXCL12 脂肪生成 |
強化された保護機能 |
免疫系は、環境化合物のホルミシス作用、物理的な影響、薬物や食物との相互作用などの影響を継続的に受けている。S = Sensor, M = Modulator, T = Target; 低線量放射線 = Low dose radiation; MAPK = Mitogen-activated protein kinase; iNOS = Inducible nitric oxide synthase; NFκB = Nuclear factor kappa B; JNK = c-Jun N-terminal kinase; CXCR4 = Chemokine receptor; CXCL12 = chemokine; OXPHOS = Oxidative phosphorylation.
5. 臨床的意義
5.1. 毒性化合物の低刺激性効果
ホルムアルデヒド(FA)はその最初の例である。これは室内環境汚染物質で、発がん性物質に分類される。ヒトK562白血病細胞とヒト16HBE乳頭上皮細胞を異なる濃度のFAに曝した。低濃度のFAは、CyclinD-cdk4(サイクリン依存性キナーゼ4)やE2F1(E2F転写因子1)などの細胞分裂の鍵となる分子を誘導することで、両細胞種の増殖を促進した。さらに、ピルビン酸キナーゼアイソザイムM2(PKM2)、グルコース,グルコーストランスポーター1(GLUT1)、乳酸,乳酸脱水素酵素A(LDHA)といったウォーバーグ効果の主要分子も増加した[52]。
2つ目の例は,過酸化水素である。低線量放射線(<100mGy)は,水の放射線分解の安定した生成物としての過酸化水素(H2O2)のナノモル放出を媒介する。H2O2は、最近、中心的な酸化還元シグナル分子として認識されている。低線量放射線は、Nrf2/Keap1やNFκBのような既知の分子マスタースイッチを利用して、適応抵抗性を促進する。低線量放射線はH2O2シグナルを介してそのホルミシス作用を媒介することが提案されている[53]。
5.2. 精神科領域
リチウム(Li)は,精神医学においてホルミシス作用を持つ化合物の一つである。Liの塩には,-炭酸塩,-酢酸塩,-硫酸塩,-クエン酸塩,-オロチン酸塩,-グルコン酸塩などがある。これらの塩は、精神科領域の医薬品として、躁病やうつ病の治療、治療抵抗性統合失調症の治療などに使用されている。ショウジョウバエを用いた新しい研究では、Liが長寿を促進することが示唆されている。その延命メカニズムには、グリコーゲン合成酵素キナーゼ-3(GSK-3)の阻害と転写因子Nrf-2の活性化が関与している。Nrf-2の活性化レベルが高いとストレス耐性が付与され、低いとさらに長寿が促進されることがわかった[54]。
5.3. 神経変性疾患
現在では、神経炎症が神経疾患の共通の特徴であることが認められている。細胞質のインフラマソームは多量のタンパク質からなる複合体である。これらは自然免疫系の一部である。炎症性カスパーゼを活性化し、炎症性サイトカイン(インターロイキン(IL)-1b、IL-18,Il-33など)を活性化させる。これらのサイトカインは、神経炎症や脳の病理を促進する。アルツハイマー病(AD)における最も特徴的な受容体ファミリーは、ヌクレオチド結合オリゴマー化ドメイン様受容体ファミリー、ピリン・ドメイン含有3(NLRP3)インフラマソームである。最近の総説では、ホルミシスの概念が紹介され、そのメカニズムと神経保護への応用の可能性が示されている。また,栄養学的な抗酸化物質であるスルフォラファンとヒドロキシチロソールの有用性を提案している[55]。
神経ペプチド受容体である下垂体アデニル酸シクラーゼ活性化ポリペプチド受容体1(PAC1-R)は,神経保護作用を媒介する。最近,H2O2がこの受容体のプロモーター活性に対してホルミシス効果を発揮することが報告された[3]。PAC1-Rは,よく知られた神経保護作用,向神経性作用,神経新生作用を媒介しており,神経変性疾患の重要な創薬標的となっている。今回の研究は,神経系に対する低用量活性酸素の生理的効果をさらに明らかにするのに役立つかもしれない[56]。
クルクミンは,Curcuma longa Linnの根茎から得られるポリフェノール化合物で,もう一つの神経保護作用を持つ抗酸化物質ホルメチンである。一般的には、料理の色付けや風味付けのためのスパイスとして使用されている。神経変性疾患におけるその潜在的な保護的役割の共通点は、主にヘムオキシゲナーゼ-1システムによる細胞のストレス反応の増強である[57]。クルクミンは、ミトコンドリアのターンオーバー、オートファジー、アポトーシスの間の複雑なクロストークを媒介する[58]。最近、クルクミンは、ネズミの筋肉細胞において、ミトコンドリアの融合/伸長、生合成、および機能向上を促進することにより、活性酸素ホルミシスを制御することが報告された[57]。クルクミンの安全性については、慢性的な補給を提案する前に、リスクとベネフィットのバランスを慎重に分析する必要がある。同様の結論は、神経保護効果を得るために高麗人参によるホルミシスが提案されていることからも導き出される[59]。
イソリキリチゲニン(IsoLQ)は、抗酸化作用を持つフラボノイドであり、小胞体ストレスの誘発物質である。腎臓細胞株にIsoLQを前処理すると、ERストレスを介したホルミシスが誘発されることが示された[60]。ホルミシスの用量反応を引き起こす他の薬剤としては,クロロキン[61]や,緑茶の主要成分である(-)-エピガロカテキン-3-ガレート(EGCG)が挙げられる[62]。いずれの薬剤も、神経保護作用を高めることが実証されている。
神経系の損傷は,全身麻酔やそれに関連する外科手術による罹患率や死亡率の高い原因となっている。冷温療法は神経保護のための処置である。ある研究では,海馬のスライス培養を用いて,ミクログリア由来のサイトカインを介した神経免疫シグナルを調べた[63].
低レベル光/レーザー療法(LLLT)による経頭蓋脳刺激は,非破壊的かつ非熱的に神経生物学的機能を調節する別の戦略である。LLLTの作用機序は,ミトコンドリア呼吸鎖の末端酵素であるシトクロム酸化酵素による光子エネルギーの吸収に基づいている。LLLTはミトコンドリア呼吸を促進することで、ホルミシス的な用量反応効果と脳領域の活性化の特異性により、神経保護と認知機能の強化を提供することができる[64]。
5.4. 心血管疾患(心血管疾患)
低レベルの活性酸素は、新生児ラット心室筋細胞の無酸素/再活性化傷害に対する感受性を低下させ、虚血/再灌流の生体内試験マウスモデルにおいても深い保護をもたらすことが示された。活性酸素のレベルが高くなると、試験管内試験では細胞内のCa2+のホメオスタシスとミトコンドリアの機能が徐々に変化し、機能障害や死に至ることがわかった。活性酸素のレベルは、ミトコンドリアを標的としたレドックスサイクラーMitoParaquat(MitoPQ)によって制御されていた。このデータは,低レベルの活性酸素は心臓を保護し,高レベルの活性酸素は心臓に悪影響を及ぼすというホルミシスモデルを支持するものである[65]。
最近の研究では,NLRP3-ノックアウトマウスと野生型マウスを比較して,心臓の老化におけるNLRP3フラマソームの役割を調べた。NLRP3を欠損させると,心筋の加齢に伴うミトコンドリアの動態変化が防げることがわかった。野生型マウスでは、メラトニンの補給は、Nrf2-抗酸化能力の回復と加齢によって変化したミトコンドリアの超微細構造の改善に加えて、抗アポトーシス作用を有していた[66]。
5.5. メタボリックシンドローム
メタボリックシンドローム(MetS)には、肥満、インスリン抵抗性、高血圧、アテローム性脂質異常症が含まれる。メタボリックシンドロームは、2型糖尿病(2型糖尿病)心筋梗塞、脳卒中のリスクを高めることに関連している。MetSは、世界中の成人の20〜30%が罹患していると推定されている[7]。2型糖尿病は、心血管疾患の過剰なリスクをもたらす。2型糖尿病は、心血管疾患の過度なリスクをもたらすものであり、血管反応性の障害が先行している。(-)-エピカテキン(EPICAT)は、血管拡張剤として知られる植物化合物で、酸化ストレスを受けた血管モデルにおいて、ミトコンドリアの酸化還元レベルを調節する。このデータは,EPICATが用量依存的に作用し,ホルミシスを示すことを示している[67]。
神経可塑性と脳の健康を維持するために,Mark Mattsonは間欠的な代謝切り替え(IMS)を提案した[68]。動物モデルの研究に基づき、マイナスのエネルギーバランスの時間帯(短期間の断食および/または運動)とプラスのエネルギーバランスの時間帯(食事と休息)を切り替えることで、一般的な健康と脳の健康を最適化することができると提案した。β-ヒドロキシ酪酸(BHB)は、空腹時や長時間の運動時に脂肪酸から生成されるケトン体で、細胞のエネルギー源として機能する。BHBは、脳由来の向神経性因子の発現を誘導するシグナル分子として機能する。哺乳類ラパマイシン標的(mTOR)はセリン・スレオニンプロテインキナーゼで、栄養素(グルコースとアミノ酸)が豊富にあるときに、細胞のタンパク質合成を促進し、オートファジーを抑制するという極めて重要な役割を果たしている[57]。代謝スイッチに関わる生化学的経路は,臓器では肝臓,腸,脳を,細胞では肝細胞,脂肪細胞,神経細胞,アストロサイトをつないでいる。絶食と運動は、グルコースからケトンへの切り替え(生体エネルギーの挑戦)と細胞のストレス耐性(分子のリサイクルと修復経路)につながる。食事、休息、睡眠は、ケトンからグルコースへのスイッチ(回復期)と、細胞の成長と可塑性経路(ミトコンドリアの生合成、シナプス形成、神経新生)につながる[68]。
ベルベリン(Ber)の細胞保護メカニズムの一部として,ミトコンドリアのホルミシス反応(mitohormetic response)が提唱されている。これは,植物(Coptis chinensis)から抽出される主要な生理活性化合物であり,抗糖尿病作用を有する。Berは主にミトコンドリアに集積する。電子伝達鎖(ETC)やミトコンドリアDNA(mtDNA)に関連する酵素やその他のタンパク質を標的にして、エネルギーホメオスタシスを乱し、翻訳ストレスを誘発する。このストレスは、以下のような方法でマイトホルミン反応を誘発する。(1)ROSを介した酸化還元経路、(2)AMP/ATPを介したAMPK経路、(3)NAD+/NADHを介したサーチュインズ経路、(4)UPRmt経路を介して、ミトコンドリアのホメオスタシスを制御・維持し、細胞が不利な状況に適応できるようにする[69]。
5.6. 自己免疫疾患
自己免疫疾患は、亢進した免疫系が正常な組織を攻撃することで生じる。免疫系に対する低線量放射線の調節効果は、体内の免疫微小環境に依存しているようである。低線量放射線を繰り返し使用することで,関節リウマチ患者の破骨細胞の活動が著しく抑制されることが報告されている[70].低線量放射線の抗炎症作用は、低線量放射線が自己免疫疾患に影響を与える重要なメカニズムであることが示唆された[71]。また、紫外線照射は、免疫系と自己免疫疾患の発生に影響を与えた[72]。低線量放射線は、炎症性サイトカインの発現を抑制し、Tregsの割合をアップレギュレートし、自己抗体の産生を減少させた[73]。自己免疫疾患の状況では,低線量放射線は未熟なDC(imDC)から成熟したDC(mDC)への変化を阻害し,マクロファージのM2への分化・極性化を誘導した。全体として、低線量放射線は自己免疫疾患における免疫異常の悪影響を調整する能力があるようである[29]。
5.7. 急性呼吸困難症候群(ARDS)
低線量放射線は抗炎症表現型を誘導することができるため、COVID-19誘発性の急性呼吸窮迫症候群に対する治療法の一つとして提案されている[74]。この新型ウイルスによって誘導される2相性の免疫反応について説明されている[75]。SARSやMERSのパンデミックから得られた教訓がまとめられている[76]。他の病原性ウイルスからの教訓も説明されている[77]。
臨床専門家会議であるFront Line COVID-19 Critical Care Alliance(FLCCC)は、入院患者を対象とした中核療法であるメチルプレドニゾロン、アスコルビン酸、チアミン、ヘパリン、共励剤(MATH+)をベースとした治療プロトコルを策定した[78]。最近では、COVID-19に対して強力な抗ウイルス・抗炎症作用を持つ抗寄生虫薬のイベルメクチンが追加された。2020年12月18日のアップデートでは、COVID-19の予防と治療におけるイベルメクチンの有効性を示す新たなエビデンスがレビューされている[79]。
5.8. 多剤間相互作用
慢性疾患を持つ高齢患者では、しばしば影響を受ける各臓器が1つまたは複数の異なる薬剤で治療される。これは、臨床教育が臓器指向であり、薬物療法を優先しているためである。多剤併用療法は、臨床的には薬物療法の効果が低下することで現れる。おそらく、ミトコンドリアの調節不全に基づいた介入を行うことで、多剤使用を減らすことができるであろう[7]。
薬物の大量消費は、環境中での薬物の存在(例:食肉中の抗生物質)と相まって、結果に関する懸念を引き起こす。最近の研究では,個体および混合薬物の急性毒性を分析した。この研究では、ジアゼパム、メトホルミン、オメプラゾール、シンバスタチンという医薬品をテストした。被験体はAllivibrio fischeriという細菌であった。単体での毒性はオメプラゾールが最も高かった。混合物の毒性を調べたところ,相乗効果,拮抗効果,ホルミシス効果が認められたが,これらは副産物の形成によるものであると考えられる。この研究は,化学物質は相互作用や修飾を受け,混ざり合い,互いの毒性作用を強めたり無効にしたりする可能性があることから,混合物を用いた研究を増やすことが急務であることを示している[80].表4は,パートVの主な特徴,メカニズム,効果の概要を示したものである。
表4 臨床的意味合い
| ストレス要因 | シンドローム/モジュレーター/ ターゲットS / M / T |
モルメカニズム | 効果 |
|---|---|---|---|
| 有毒な化合物Li | 精神医学(S) | GSK-3、Nrf-2 | 耐ストレス性 寿命 |
| Ag-ナノ粒子(Ag-NPs) | 星状細胞腫細胞(T) | MuDおよびp38 / ERK | 有益 |
| ホルムアルデヒド | 気管支上皮細胞(T) | CyclinD-cdk4、E2F1 | ワールブルク効果 |
| 低線量放射線 | H 2 O 2シグナリング(M) | Nrf2 / Keap1、NFkB | レドックスシグナリング |
| ROS | 神経変性 疾患(S)、 クルクミン(M)インフラマ ソーム(T) |
ミトコンドリア、オートファジー、アポトーシス | 保護 |
| 低線量放射線 | 自己免疫疾患(S) | サイトカインのTreg阻害のアップレギュレーション | 悪影響の規制 |
| H 2 O 2 | NLRP3インフラマソーム(T) | PAC1-R | 神経保護、神経栄養および神経新生の影響 |
| ROS | 心血管疾患(S)、 MitoPQ(M) |
Ca 2+ホメオスタシス、ミトコンドリアホメオスタシス | 心臓保護 |
| ROS | 血管細胞(T)、 EPICAT(M) |
血管拡張 | ミトコンドリアの酸化還元調節 |
様々な臨床症候群におけるホルミシス誘導剤の作用機序 Syndrome = Field of clinical implication; M = Modulator; T = Target; 低線量放射線 = Low dose radiation; NLRP3 = Nucleotide-binding oligomerization domain-like receptor family, pyrin domain-containing inflammasome; ROS = Reactive oxygen species; GSK-3 = Glycogen synthase kinase-3; Nrf-2 = Nuclear factor erythroid 2-related factor; MuD = Mushroom body defect,有糸分裂時の紡錘体機能に寄与する微小管関連タンパク質;ERK = Extracellular-regulated protein kinase;CyclinD-cdk4 = CyclinD-cyclin-dependent kinase 4;E2F1 = E2F転写因子1;Keap1 = Kelch-like ECH-associated protein 1;PAC1-R = Pituitary adenylate cyclase-activating polypeptide receptor 1;EPICAT = (-)-Epicatechin.
6. がん治療では少ない方がいいのか?
6.1. 歴史的側面
癌治療の発展は、手術から補助放射線療法、化学療法、ホルミシス療法へと長い道のりを歩んできた。ある時代には多くのドグマが支配的であり、それが間違っていることが証明された。その例を挙げよう。例えば、(1)1891年から 1981年まで支配していた根治手術、超根治手術、超根治手術のドグマ[81]、(2)1980年から 2000年まで支配していた積極的な高用量化学療法(CT)のドグマ[82,83]。
より攻撃的でない治療法が可能な例:早期乳がん患者は、手術+アジュバントCTで治療される。2016,Cardosoらは、早期乳がんの治療決定の助けとなるゲノムリスクを判定する新しい70遺伝子シグネチャー検査(MammaPrint)に関する論文をNew England Journal of Medicineに発表した[83]。無作為化された第III相試験では、6693人の早期乳がん女性が登録され、ゲノムリスクと臨床リスクが決定された。マンマプリントに基づいて再発の臨床リスクが高く、ゲノムリスクが低い女性は、CTを受けないであった。その結果、遠隔転移を伴わない5年生存率は、CT治療を受けた患者と同等であった。臨床的リスクが高い早期乳がんの女性の約46%はCTを必要としないかもしれないと結論づけられた[84]。これは、少なくともゲノムリスクの低い患者では、より積極的でない治療法が可能な例である。
免疫学やホルミシス研究の進展に伴い、化学療法剤や電離放射線の作用機序を抜本的に再評価する必要があるという証拠が増えてきた。癌治療に適用されたホルミシスの概念は、治療薬の作用様式が異なる用量で存在することを示唆している。したがって、パラダイムの変更が必要となる。CTの場合、これは最大耐量の概念から低間欠的(メトロノミックなど)な治療への変更を意味すると思われる。放射線治療では、低線量かつ正確な定位的ターゲティングにより、抗原放出性(免疫原性)の放射線を腫瘍に照射し、周囲の正常組織を温存することができるかもしれない。新たな免疫療法と相まって、将来の癌治療は、より局所的な剥離手術、CTの再配置、および免疫療法や標的療法と組み合わせた放射線治療で構成されるかもしれない[85]。
6.2. 標的療法、溶血性ウイルスおよびがんワクチンのホルミシス的側面
6.2.1. 低分子インヒビター(SMI)のホルミシス的側面
哺乳類ラパマイシン標的(mTOR)は、特にがんの好気性解糖を制御している。mTORは、グルコース、アミノ酸、脂肪酸、脂質、ヌクレオチドの代謝を制御している。mTORや解糖に関連するがん関連分子を標的とするには、低分子阻害剤(SMI)が適しているかもしれない[86]。SMIは、酵素の機能的(例えばチロシンキナーゼ)活性を阻害するために、酵素の活性部位に最適に適合しなければならない。つまり、用量反応関係は非線形であり、分子酵素と阻害剤の比率が1:1の時に最適となる。
6.2.2. 免疫系による抗原認識のホルミシス的側面
Paul Ehrlichが行った毒素と抗毒素の沈殿の研究に見られるように、抗原と抗体の相互作用は、等価点において、分子の鍵と錠の比率が1:1であることを明らかにした。同様のルールで、T細胞と抗原の相互作用が行われる。T細胞による抗原の分子認識には3つの参加者がいる。すなわち、抗原断片(1.ペプチド)がプレゼンター分子(2.MHCタンパク質)と複合体を形成し、この複合体が認識分子である抗原特異的T細胞受容体(3.TCR)に認識されるのである。抗原ペプチド-MHC(pMHC)複合体とそれに対応するTCRが、コスティミュレーショナルシグナルの存在下で最適に適合した場合にのみ、T細胞の応答が開始される。
ワクチンの用量反応が直線的でないのは、細胞間の相互作用にも関係している。T細胞応答の開始には、T細胞がDCなどの専門的な抗原提示細胞(APC)と相互作用することが必要である。T細胞が反応を起こすには、DCなどの専門的な抗原提示細胞(APC)との相互作用が必要である。同種のT-APCの相互作用は、ある抗原(例えば、A)のTCRを持つT細胞が、Aを発現するAPCを見つけたときに起こる。このような相互作用は、ワクチン接種部位の排出リンパ節、脾臓、BMで起こる可能性がある[87,88]。BMからのメモリーT細胞と腫瘍抗原(TA)を提示するDCとの間の認知された相互作用は、生体内試験での双方向の細胞刺激、生存、および抗腫瘍活性を明らかにした[89]。
6.2.3. 癌溶解性ウイルスおよび癌ワクチンのホルミシス的側面
ホルミシスの役割は、オンコロイドウイルス(OV)療法のメカニズムにも当てはまるように思われる。オンコリス(ウイルスによる腫瘍細胞の選択的破壊)の系統的な研究は1960年代に始まった。マウスの腹腔内で増殖した腹水腫瘍細胞を用いた研究では、ウイルスの投与量が少なくても多くても効果がないことがわかった。中間的な用量でのみ、巨視的に見えるオンコライジングが生じた。用量反応曲線は、ホルミシスのようにベル型でした[90]。
以下では、オンコライズ・ニューカッスル病ウイルス(NDV)に焦点を当てます。著者は1980年代からこの鳥類パラミクソウイルスを研究していた。その目的は、オンコリシスではなく、抗腫瘍ワクチン接種であった。最初の印象的な知見は、1985年に侵攻性ESbマウスリンパ腫モデルで得られたものである。(1). 放射線を照射したESb細胞を術後にワクチンとして接種しても、微小転移に対する防御効果はなく、すべてのマウスは2〜3週間で死亡した。一方、NDVに感染させた照射済みESb細胞を術後にワクチン接種すると(ESb-NDVワクチン)約50%の長期生存が得られた。オンコリシスと同様に、免疫原性のあるワクチンを得るためには、中間量のウイルスを使用する必要があった[91]。(2). さらなる研究により、ESb-NDVワクチンは、未感染のESbワクチンによる刺激と比較して、試験管内試験でESb免疫脾臓細胞における腫瘍特異的CD8+媒介CTL応答の増強を引き起こすことが明らかになった[92]。CD4+媒介Tヘルパー細胞反応を分析した場合にも、同様の増強効果が得られた[93]。ウイルスと腫瘍細胞の比率を滴定する際、最適な反応には腫瘍細胞あたり約10個のウイルス粒子が必要であることがわかった[94]。(3). 1990年から 2008年の間(著者がドイツのハイデルベルグにあるドイツ癌研究センターで退職した時期)トランスレーショナルリサーチにより、ESb-NDVと相同性のあるヒトウイルス修飾ワクチンを作成することができた。これはNDV感染により改変された自己腫瘍細胞ワクチン(ATV-NDV)と命名された[95]。遅延型過敏症(DTH)皮膚反応は、がん患者を対象としたフェーズI試験で最初の免疫原性アッセイとして使用された。これらの研究では、ウイルスと腫瘍細胞の最適な比率は、腫瘍細胞あたり約10個のウイルス粒子であることが明らかになった[96]。(1)~(3)の結果は、ホルミシス効果としてよく解釈される。マウスとヒトで同様の用量反応が見られた。
ワクチンATV-NDVで得られた結果は、腫瘍細胞において単環式複製能力しか持たないレンズ原性NDV株Ulsterにも当てはまる。ドイツのケルン免疫腫瘍センター(IOZK)で2015年から使用されているDCベースのワクチンIO-VACR[97,98]では、患者由来のNDVオンコライセートは、多環式複製能力を示すメソジェニックNDV株で得られている。この場合、ウイルスと腫瘍細胞の比率は、腫瘍細胞1個あたり1個または0.1個のウイルス粒子にまで滴定することができる。腫瘍細胞ベース(ATV-NDV)またはDCベース(IO-VACR)のワクチンでは、通常100万個以上の腫瘍細胞が使用される。
IOZKで開発された個別化マルチモーダル免疫療法(IMI)のコンセプトは、NDVによる免疫原性細胞死(ICD)治療と変調電気温熱療法(mEHT)およびIO-VACR DCワクチン接種を組み合わせたものである。多形性膠芽腫(GBM)の成人患者70名を対象とした最近のデータ分析では、IMIを維持化学療法と併用することで、全生存率を向上させる戦略が得られることが明らかになった[99]。同じレビューの中で、GBMに対する無作為化比較免疫療法の臨床試験の概念が疑問視され、挑戦されている[99]。
Rho GTPaseであるRac1は、GBM細胞の移動と浸潤に重要な役割を果たしている。興味深いことに、Rac1はNDV感染の標的にもなっている。Rac1は、ウイルスの侵入、シンシチウムの誘導時、アクチンの再編成時に関与している[100,101]。NDVによって誘発されたシンシチウム形成は、AMPK(エネルギー感知型AMP活性化プロテインキナーゼ)-mTORC1-ULK1(オートファジー開始プロテインキナーゼ)経路の活性化を介して、オートファジーを誘発する[102]。このネットワークは,オートファジーや,細胞のエネルギーと栄養のホメオスタシスの維持に役割を果たしている。
固形腫瘍の微小環境には低酸素領域が存在し,そこでは明確な転写因子(すなわち低酸素誘導因子(HIF))が活性化されている.そこで、ベロ毒素型NDVを用いて、正常酸素状態と低酸素状態における明細胞癌に対する解毒効果を比較した。その結果、NDVは低酸素への耐性を破れることがわかった。細胞内のHIFレベルに関わらず、低酸素はオンコロイド活性を増大させることさえあった[103]。
治療に対する抵抗性は、がん治療の大きな障害となっている。NDVは、低酸素だけでなく、化学療法や放射線療法、アポトーシス、腫瘍壊死因子関連アポトーシス誘導リガンド(TRAIL)免疫チェックポイント遮断などの耐性を打破する可能性があることが報告された[104]。
ワクチン接種の前にがん患者にNDVを前処理することで、免疫調整効果が得られる。免疫細胞は、細胞質のRIG-I受容体および細胞膜に発現したI型インターフェロン受容体を介したシグナル伝達により、I型インターフェロン応答に向けてプライミングされる[105]。試験管内試験でNDVに感染すると、ヒトDCは18時間以内にDC1極性にプログラムされる。洗練された研究により、NDV感染に対するヒトDCの抗ウイルス反応は再現性が高く、779個の遺伝子のアップレギュレーションにつながる24個の転写因子のカスケードによって決定されることが明らかになった[106]。
上述したように、ワクチンの用量反応は直線的ではない。毒性学で要求される最大許容量の決定は、免疫学では無意味である。ワクチンATV-NDVに関しては、乳がん患者の術後ワクチン接種に関する最初の研究では、患者の生存率に基づいて、100万細胞以上500万細胞以下の投与量と、照射細胞の細胞生存率が50%以上であることを高品質のパラメータとして定義している[94]。患者の免疫系の能力と極性は、重要な他のパラメータであり、コンビナトリアル治療の負の影響の可能性もある。今後の最適化では、ワクチン接種のスケジュール、送達経路、バイオマーカーを調査する必要がある。全身性がん治療の副作用も重要なポイントである。最近の比較分析では、がんワクチンやオンコロイドウイルスは、他の全身療法に比べて、がん患者への副作用が非常に低いことが明らかになった [107]。
腫瘍細胞へのNDV感染によるホルミシス反応のさらなる証拠は 2002年に発表された「Dendritic cells pulsed with viral oncolysate potently stimulate autologous T cells from cancer patients」という論文で得られた[108]。この論文では、原発手術を受けた乳がん患者のBMには、がん反応性の記憶T細胞(MTC)が存在することが報告されている。これらは、乳がん細胞株MCF-7の溶解液またはNDV感染MCF-7細胞の溶解液でパルスしたDCで試験管内試験で刺激された。ELISPOT試験の結果、前者に比べて後者ではインターフェロンγ(IFN-γ)反応が有意に増加した。このような培養から得られた上清には、インターフェロンα(IFN-α)とインターロイキン15(IL-15)の力価が上昇していた。腫瘍細胞の細胞質内の外来ウイルスRNAとは別に、さらなる危険信号を、MALDI質量分析法、ウェスタンブロット、FACSサイトメトリー、ELISAテストを用いて分析した。MCF-7細胞にNDVを感染させると、ウエスタンブロットによるタンパク質の発現に多くの違いが見られた。著名なタンパク質のMALDI質量分析では,熱ショックタンパク質(HSP)が検出され,NDV感染によりリン酸化されることが明らかになった。HSP27であった[108]。
HSPは,分子シャペロンとして,細胞内のタンパク質のホメオスタシスに重要な役割を果たす保存されたタンパク質の大規模なファミリーを構成している。HSPは、様々なストレス因子からの保護にも関与している。さまざまなHSPファミリーのメンバーは、がん細胞の細胞膜上にも局在しており、がん治療の新たなターゲットになる可能性がある[109]。
2020年に行われた新しい研究では,酵母細胞にヒトHSP27を発現させると,複製寿命が延長し,ホルミシス反応が明らかになった。HSP27は,小さな熱ショックタンパク質で,熱ショックや酸化ストレスに対する細胞の応答能力を調節している。HSP27は、ATPに依存しないシャペロンとして機能し、プロテアソームによるタンパク質の分解に関与している。癌細胞ではCTに対する抵抗性を付与し、神経細胞ではHSP27がアルツハイマー病やパーキンソン病のモデルにおいて神経細胞の生存率を高める効果があるとされている[110]。
6.3. 低用量T細胞のトリガーと細胞障害性エフェクター機能
APCと接触すると、移動性T細胞はAPCの細胞表面をスキャンし、正確に適合するpMHC複合体の存在を確認する。このようなキーロックフィットの最大化のためのスキャンは、T細胞トリガーの低用量検出限界の説明になるかもしれない。TCRクラスターあたり4個のpMHCがあれば、トリガーには十分である。生体内のAPCの約10,000個のペプチドの大部分は、応答を誘発しない正常な自己ペプチドである[88]。
自然は、抗自己ペプチドの自己免疫反応性を制限するための寛容のメカニズムを発明した。胸腺でのT細胞の成熟期には、負と正の選択段階を経て中枢性寛容が生じる。これにより、TCRが非自己のペプチドと一緒に自己のMHC分子を認識する成熟したT細胞だけが、この器官から出て行くことになる[111]。
ある抗原Aに特異的なCTLとAを発現している腫瘍標的細胞との相互作用は、CTLと標的細胞の比率に依存し、それらはそれぞれの細胞毒性アッセイにおいて試験管内試験で定量化することができる。このような滴定曲線は線形ではない。CD4+ Tヘルパー細胞とCD8+ CTL前駆細胞との間の相互作用は、長期的な防御免疫反応の生成に重要である。したがって、Tヘルパー細胞エピトープを含むCD8+ペプチドワクチンは、ヘルパーエピトープを含まないものよりも優れている[112]。
6.3.1. mRNA ベースのワクチン
COVID-19に対するmRNAベースのワクチンは 2020年に大手製薬会社と協力して複数のスタートアップ企業が1年以内に開発した。その原理はすでに20年前に解明されている[113,114]。モデルTAとしてβ-ガラクトシダーゼ(β-gal)をコードするRNAを用いた2つの研究がある。1つの研究では、ポリカチオンペプチドのプロタミンで保護されたRNAと裸のRNAをマウスの生体内試験で使用し、特異的なCTLと抗体を誘発できることを示した[113]。もう1つの研究[114]では、RNAワクチン接種のさらなる最適化のために、さらに2つの革新的な手順を導入した。1)ワクチン接種部位としてのマウス耳介の使用、(2)自己複製する感染性RNAの使用。マウスの耳介は、他の一般的に使用される部位よりも優れたワクチン接種部位であることが以前に示されていた[115]。自己複製RNAワクチンは、セムリキ・フォレスト・ウイルスのレプリカーゼを利用して、β-galをコードするlacZ遺伝子のRNA発現を促する。 自己複製RNAを用いてlacZをトランスフェクトした腫瘍細胞に対する防御反応を得るには、lacZ DNAベクターと比較して、100倍少ないポリヌクレオチドの投与量で十分でした[114]。
このように、mRNAベースのワクチンは新しいものではない。20年前に行われた2つの研究のうち、1つはチュービンゲン(ドイツ)のHans-Georg Rammenseeの研究室で行われ、もう1つはハイデルベルク(ドイツ)のドイツがん研究センターでこのレビューの著者の研究室で行われた。
6.3.2. ペプチドベースのワクチン
ペプチドワクチンの接種は、特異的なT細胞の寛容誘導により、腫瘍の増殖を促進することが報告されている[116]。さらに、チロシンキナーゼ阻害剤スニチニブと併用した第Ⅲ相ペプチドワクチン接種試験で示されたように、コンビナトリアルがん治療がT細胞応答に悪影響を及ぼす可能性がある。このような結果は、ペプチドベースのワクチンによってがんに対するT細胞応答を誘発するための最適な条件を見つけるために、かなりの知識と注意が必要であることを示している。
最近のレビューでは、腫瘍患者の標準的な治療にペプチドワクチン接種を導入する前に解決しなければならない関連問題について論じている。例えば、標的抗原の選択、アジュバントの選択、ワクチン接種スケジュール、送達経路などである。加えて、臨床治療のコンセプトを明確にする必要がある。3つの異なる戦略が議論されている。(1)層別化、(2)倉庫ベースの個別化、(3)個別化である[118]。
6.4. ミトホルミシス、マクロファージ、ケースレポート
遺伝子変異、低酸素、栄養不足、薬物毒性などの有害因子により、小胞体にアンフォールドタンパク質が蓄積され、小胞体ストレスが発生する。がん細胞は生き延びるために、アンフォールドタンパク質応答UPRを引き起こす。ノンコーディングRNA(ncRNA)は、タンパク質の翻訳や不利な環境への適応を制御する上で重要な役割を果たしている[119]。ミトコンドリアもまた,UPR応答(UPR mt)を発揮することができる.最近の論文では、ストレスに選択的に適応するために、がん細胞をミトホルミシスゾーンに維持する上でのUPRmtの役割が議論されている[120]。
メチルグリオキサールと進行性グリケーションエンドプロダクト。癌細胞の好気的な解糖系への代謝のリプログラミングは、MGとAGEsの産生を促進する。MGは、低用量では腫瘍の成長を刺激し、高用量では腫瘍の成長を抑制するホルミシス効果を発揮することが報告されている。MGのスカベンジャーを使用することで、腫瘍を成長から死へと転換させることが可能である[121]。
多くの化学療法は、細胞内のROS濃度を高めることで細胞死を誘導する。持続的な薬剤の刺激により、腫瘍細胞はホルミシスプロセスを刺激し、それにより細胞は使用した薬剤に対して二相性の反応を示す。この枠組みの中で、β3アドレナリン受容体(β3-AR)は、がんにおける抗酸化の役割に適合する。SR59230Aのような選択的なβ3-ARアンタゴニストは、がん細胞を活性酸素濃度の増加に導き、細胞死を誘発する[122]。
古典的なホジキンリンパ腫(HL)の腫瘍関連マクロファージに関して、予後とのホルミシス的関係が報告されている。HLの76サンプルが、CD68またはCD163マクロファージ特異的モノクローナル抗体を用いた免疫組織化学的二重染色にかけられた。MYC癌遺伝子がマクロファージのM2特異的遺伝子の発現を制御していると考えられるため、免疫組織化学ではMYCを検出する試薬も用いた。マクロファージの数が多い症例は、通常、無病生存率(DFS)と全生存率(OS)が最も低かった。ほとんどのサンプルでは、中間的な数のマクロファージが、非常に少ない数や非常に多い数よりも良好な転帰と関連していた[123]。
ER陽性/HER2陰性乳癌において、Nrf2の高発現は、腫瘍浸潤リンパ球の増加および癌免疫と関連することがわかった。これは、いくつかの大規模な患者コホートの5443人の乳がん患者を対象としたin silico解析に基づいている。Nrf2の高い腫瘍は、免疫細胞(CD8+、CD4+、DC)や間質細胞(脂肪細胞、繊維芽細胞、ケラチノサイト)が多く浸潤していた[124]。一方、膠芽腫[125]や肺腺癌[126]では、Nrf2の発現による悪影響が報告されている。Nrf2の発がん性活性化を示す腫瘍体は、薬剤耐性や免疫逃避と関連していることがわかった[125,126]。
この章は、東京理科大学放射線バイオサイエンス学科の小島修二氏らによる2つの症例報告で締めくくられる。1つ目は、低線量電離放射線による癌と炎症(潰瘍性大腸炎)の治療を扱ったものである。3つの症例報告は、これらの疾患を持つ患者における低線量放射線ホルミシスの臨床的有効性を支持している[127]。2番目の出版物では、異なるタイプの癌に対する一次治療または補助治療としてのラドン療法の4つの症例が報告されている[128]。異なる種類の癌の治療や進行段階に応じた最適なラドン濃度を決定するために、臨床試験を行うことが推奨されている[128]。表5は、パートVIの主な特徴、メカニズム、および効果の概要を示している。
表5 癌に対する意味合い
| 特徴 | インデューサー/モジュレーター/ターゲット I / M / T |
モルメカニズム | 効果 |
|---|---|---|---|
| 小分子阻害剤(SMI) | mTOR(T): 好気性解糖、 トランケートされたTCA回路、 MG生成(M) |
ブドウ糖、アミノ酸、脂肪酸、脂質、ヌクレオチドの代謝 | 癌腫増殖のSMI 、 ホルメチンとしてのMGによる標的阻害 |
| 腫瘍溶解性ウイルス | NDV(I): 腫瘍崩壊、CTL誘導およびDTH反応性に最適な低用量 |
HSP27リン酸化、プロテアソームタンパク質分解 | 腫瘍崩壊、免疫原性細胞死(ICD)、免疫刺激 |
| SR59230A | ß3-アドレナリン受容体(M) | ROS と癌細胞死の増加 |
ホルミシス低用量抗がん効果 |
| 腫瘍浸潤マクロファージ | ホジキンリンパ腫(T) | CD68 +、CD163 | より良い予後に関連する中間数 |
| 低線量放射線 | がんと 大腸炎(T) |
放射線ホルミシス | 正の効果の3つの症例報告 |
| ラドン | がん(T)、 一次治療または補助療法 |
放射線ホルミシス | プラスの効果の4つの症例報告 |
mTOR = Mammalian target of rapamycin; I = Inducer; M = Modulator; T = Target; NDV = Newcastle disease virus; 低線量放射線 = Low-dose radiation; OXPHOS = Oxidative phosphorylation; TCA = Tricarbonic acid cycle; MG = Methylglyoxal; CTL = Cytotoxic T lymphocyte; DTH = Delayed-type hypersensitivity; HSP27 = Heat-shock protein 27.
7. 植物におけるホルミシス効果
ホルミシスは動物界だけでなく、植物界でもよく知られた現象である。しかし、そのメカニズムはまだ十分に解明されていない。最近の研究では、カドミウム(Cd)や鉛(Pb)で処理したトウモロコシを用いて、酸化ストレス、オーキシン(植物ホルミシス)光合成の役割を調べた。トウモロコシの苗において、ガス交換、クロロフィルαの蛍光、およびクロロフィル、フラボノール、オーキシン、H2O2の含有量を測定した。重金属によるシュート成長のホルミシス的刺激の共通点は,オーキシンとフラボノールの含有量の増加と,H2O2が対照植物と同じレベルに維持されることであった[129]。
ナノ粒子銀(AgNP)によるトウモロコシの処理は、植物の根に有益な、おそらくホルミシス作用をもたらす。しかし、トウモロコシの根茎の最近の分析では、トウモロコシへのナノシルバー使用による複数の意図しない重大な影響が明らかになった。具体的には、根茎の微生物群集構造と、原核生物と真核生物の両方の発現遺伝子を調査した。多様性分析では、豊かさが著しく低下していた。細菌門では、ChloroflexiやPlanctomycetesなどの一部のグループが有意に減少したが、他のグループ(Acidobacteria、Bacteroidetes、Proteobacteria (Alpha and Gamma)など)はナノシルバー暴露に応じて増加した。真菌門では、植物病原菌となりうるグループを含めて、存在量の増加が観察された。Diplodia属のある種は、トウモロコシの茎や穂の腐敗の原因となるが、この属はナノシルバー暴露下で5.5倍の増加を示した。自然のバイオコントロールの崩壊が植物病原体の増加を引き起こす可能性があると結論づけられた。メタトランスクリプトーム解析により、窒素循環の悪化、植物病原体の選択の可能性、植物ホルミシス効果が検出された。長期的には,作物の生産性や生態系の健全性に悪影響を及ぼす可能性がある [130]。
さらに,グリホサート,2,4-D,パラコートなどの一部の除草剤は,低用量でホルミシス反応を示する。活性酸素が生成されると,H2O2がシグナル分子として働き,細胞壁の可鍛性を促進し,内側への水の輸送を可能にして細胞の膨張を引き起こす [131,132]。
珪素(Si)は、植物の成長、発達、代謝などの反応にホルミシス的に影響を与えることが証明されている有益な元素である。Siは,地殻中で酸素に次いで豊富な元素である。リトスフィアの最大32%を占めている。Siは、酸素やアルミニウム(Al)マンガン(Mg)カルシウム(Ca)ナトリウム(Na)鉄(Fe)カリウム(K)などの元素と結合したケイ酸塩やSi鉱物として存在する。植物の場合、Siはモノシアル酸(Si(OH)4)としてのみ吸収される。その後、輸送され、主に細胞のアポプラストに蓄積される。植物中のSi濃度は、全乾燥質量の0.1%から 10%の間で変動している。世界で最も多く生産されている10種類の作物のうち7種類はSiを蓄積する作物であり、これらの作物はSiの施用に積極的に反応する。これらの作物には,イネ,コムギ,オオムギ,サトウキビ,ダイズ,テンサイが含まれる[133]。
トウガラシを用いた最近の研究 [133] では,発育初期の成長とクロロフィル,アミノ酸,糖分の濃度に対するSiのホルミシス的な用量反応が明らかにされた。Siはケイ酸カルシウム(CaSiO3)として養液中に添加した。Siはケイ酸カルシウム(CaSiO3)として養液中に供給し,0,60,125,250mgL-1の4段階で施用した。その結果,Siは濃度に応じて植物の成長や代謝に影響を与えた。Siは、アミノ酸の再固定化を促進するシグナルとして作用し、穀物の成長に伴う窒素需要の増加をサポートする可能性がある。Siは、植物のシグナル伝達系の主要な構成要素と相互作用する。これには、細胞のシグナル伝達に関与するタンパク質の水酸基への結合が含まれる。また、ストレス応答に影響を与える酵素のカチオン性コファクターと相互作用することで、シグナル伝達のモジュレーターとしても機能する。
植物は浮遊生物であるため、複雑な環境変化に対応できる独自のメカニズムを進化させてきた。今後、農学者への提言として、元素が不足している畑にSiを散布することが考えられる。世界的な気候変動の急速な進行は,農業と食糧生産の新たな課題につながっている[133]。表6は、パートVIIの主な特徴、メカニズム、および効果の概要を示している。
表6 植物における除草剤のハーメチック効果
| 除草剤 | 変調器/ターゲット M / T |
モルメカニズム | 効果 |
|---|---|---|---|
| 金属:CdまたはPb | ROS(M) | オーキシンとフラボノールの増加 | シュート成長のホルミシス刺激 |
| 金属:Ag-NP | トウモロコシ(T) | 植物の根へのプラスの効果 | 根茎への悪影響 |
| グリホサート、2,4-D、 パラコート |
ROS(M) | H 2 O 2シグナル伝達分子として | 細胞増殖を引き起こす水輸送の増加 |
| シリコン(Si) | Siアキュムレータ:リゼ、小麦、大麦、サトウキビ、大豆、テンサイ(T) | シグナル伝達に関与するタンパク質のヒドロキシル基へのSiの結合 | 成長、葉緑素、アミノ酸、糖質に対するホルミシス効果 |
ホルミシス作用を持つ除草剤の例。M = Modulator, T = Target, Cd = カドミウム, Pb = 鉛, Ag-NP = 銀ナノ粒子, ROS = 活性酸素種, H2O2 = 過酸化水素。
8. ホルミシスの一例としての古代の環境ストレス反応
環境ストレス応答(ESR)は、もともと酵母で発見された。環境ストレス応答(ESR)は、もともと酵母で発見されたもので、反対に制御された大きな遺伝子群からなる、迅速で一過性の転写反応が特徴である。ESRのようなグローバルなプログラムでは、ストレスに応じてトランスクリプトームの大部分が迅速かつ一過性に再プログラムされる。ESRは,さまざまなストレス条件に応じて誘導されることから,中核的な転写反応であることが示唆される[134]。
真核生物やバクテリアには,クロスストレス保護や適応といったコアストレス応答の特徴が見られる。枯草菌,リステリア菌,大腸菌などのモデル生物では,温度ストレスや浸透圧ストレスに対するクロスストレス防御が報告されている。ストレスに対する適応反応は、真菌類においても報告されている。最近の系統学的な証拠から、真核生物は生命樹の古細菌の枝の中から生まれた可能性が示唆されている[135]。そのため、古細菌もESRを発揮できるかどうかを調べることは非常に興味深いことであった。
古細菌の基本的な転写機構は、真核生物のそれと同様に、一般的な転写因子(TF)B(TFIIBと相同)TATA結合タンパク質、およびRNAポリメラーゼ(Pol)から構成され、転写を開始する。古細菌のストレス応答性TFは、バクテリアのTFに似ている。このようなTFは、金属、糖、代謝物などのシグナルリガンドと直接結合して、転写を活性化したり抑制したりすることができる。最近、古細菌のグローバルな転写プログラムを解析した研究がある[135]。古細菌のモデル生物としては,Halobacterium (Hbt. salinarum) が挙げられる。この古細菌種は,真核生物に類似したESRを示すことが明らかになった。これは、典型的な4つの基準を満たしていた[135]。
1. グローバルで定型的な転写リプログラミング
比較対象とした酵母(S. cerevisiae)細胞では,868個の遺伝子がESRに関与しており,ゲノムの14%以上を占めていた。そのうち283個の遺伝子が誘導され、585個の遺伝子が抑制されていた(それぞれiESR、rESR)。Hbt. salinarumの細胞では、iESRには724遺伝子、rESRには276遺伝子が含まれていた。このことは、真核生物と同様に、古細菌においても、一見バラバラに見える細胞内プロセスの大規模な転写調整が行われている可能性を示唆している。
2.異なる機能に富む誘導遺伝子と抑制遺伝子
酵母のiESR遺伝子は、糖質代謝、タンパク質の折り畳みと分解、酸化ストレスに対する防御、細胞内シグナル伝達など、様々な防御・損傷修復プロセスをコードしている。酵母のrESR遺伝子は、リボソームの合成や処理などの翻訳や、RNA Pol IおよびIII依存性の転写など、最適な成長に関連する機能に富んでいる。Hbt. salinarum細胞のiESR遺伝子では、機能分類のない遺伝子のみが有意に濃縮されており、今後の研究の必要性が示唆された。一方、Hbt. salinarum細胞のrESR遺伝子では、より明確な結果が得られた。抑制された遺伝子は、大・小リボソームサブユニットの生合成と組み立て、ペプチド生合成、代謝プロセス、ATP代謝プロセス、翻訳の制御に関わる機能に集中していた。リボソームの生合成や翻訳に関わる遺伝子の抑制は、2つの細胞種に共通していた。
3. ストレスの強さに依存した転写反応の持続時間と大きさ
酵母細胞では、極端な熱ショック(25°C~37°C)の方が、低い熱ショックよりも大きな転写反応を誘発した。Hbt. salinarum細胞では、酸化ストレスに関して反応の持続時間と大きさが試された。これは、酸化還元サイクル剤であるパラコートによってもたらされた。低濃度は0.25mM、高濃度は4mMであった。Hh高濃度処理では、低濃度処理と比較してより大きな変化が見られた。遺伝子発現は、150分後にはほぼ処理前のレベルに戻った。
4.ストレス曝露に特異的な転写反応の誘導
同様に、酸化ストレスから回復したHbt. salinarumの培養液は、ESRのような転写特性を示すことなく、速やかに基本的な発現レベルに戻った。また、過酸化水素で処理した場合にも、同様の非回復的な動態が観察された。
結論として、Hbt. salinarumは、周囲の環境の変化を感知すると、ゲノムの大部分を誘導・抑制することで特徴づけられる一過性の転写動態を示す(基準1および基準2)。この反応は、ストレス条件に特異的で、ストレスの大きさに敏感である(基準3および4)。さらに,TrmBファミリーのタンパク質が古細菌のESRの制御因子の候補であることが示唆された[134]。
古細菌の種を超えてテストされたストレス因子は、好塩菌の低浸透圧ショック、超好熱菌の極端な温度など、対象となる極端な生物のそれぞれのニッチに特有のものであった。共通の傾向として、急速な成長に必要な中核的な細胞プロセスをコードする遺伝子が、ストレス時に抑制されることがわかった。特に、翻訳の抑制は、種やストレス条件を問わず報告されている。このように、ESRの保存された特徴として、グローバルなゲノム全体の転写プログラムについて語ることは適切である。表7は、パートVIIIの主な特徴、メカニズム、効果の概要を示している。
表7 アルカイックな環境ストレス応答
| 環境ストレッサー | 種/遺伝子/転写 | 応答クリテリウム |
|---|---|---|
| 熱ショック 25°Cから37°C |
Halobacterium salinarum iESR:724遺伝子 rESR:276遺伝子 |
1.グローバルでステレオタイプな転写の再プログラミング |
| 熱ショック 25°Cから37°C |
H.salinarum リボソームの生合成と翻訳に関与する遺伝子の抑制 |
2.異なる機能が強化された誘導および抑制遺伝子 |
| パラコート レドックスサイクリング剤 |
H. salinarum 4 mMは、0.25mMよりも高い応答を引き起こしました |
3.ストレスの強さに依存する転写応答の持続時間と大きさ |
| 37°Cから25°Cへの相互環境シフト | H. salinarumESRの ような転写特性のないストレスからの迅速な回復 |
4.ストレス曝露に特有の転写応答の誘導 |
iESR = Induced environmental stress response; rESR = Repressed environmental stress response.
9. グローバルな側面
約20億年前、光合成を行うシアノバクテリアの老廃物である酸素が、酸化ストレスを誘発した。次第に、活性酸素の生成は、生理的および病理的プロセスの原動力となってきた。低レベルの活性酸素は、細胞のホメオスタシスの維持や主要な転写因子(Nrf2/Keyap1,NFκB/IκB、AP-1,p53,HIF-1など)の制御に関与する幅広い経路において、酸化還元シグナル分子として重要な役割を果たしている[132]。
メラトニンは、概日リズムと協調して、ストレス適応反応に関与している[136]。このホルミシスは、動物では松果体で、植物ではストレス下で産生される。メラトニンによる二相性の用量反応関係については,かなりの証拠が示された。これは、広範な毒性学的および薬理学的ホルミシスの文献と類似していた。この時間生物学の例は、例えば医療においては、適切な投与量を見つけることがすべてではなく、薬物適用のための適切な時点も重要であることを意味する。
メラトニンは、ホルミシスの枠組みの中で、その後の健康上の脅威から生物を守るコンディショニングエージェントとして作用する可能性がある。メラトニンによるホルミシスを研究プロトコルに組み込むことで、神経精神疾患や癌の治療を強化できる可能性がある。また,植物の環境ストレスに対する保護や,植物の生産性の向上にも役立つ可能性がある[136]。
ホルミシスは,進化的変化や表現型の可塑性の救済を促進することが示唆されている[137]。遺伝的組換え,非致死的突然変異,移入可能な要素の活性化,あるいは遺伝子発現は,ホルミシスによって生物がストレス環境下で進化的適性を維持,あるいは向上させることを可能にするかもしれない分子メカニズムの一部である。これらのメカニズムは、植物から脊椎動物まで、生命の樹の上に存在する。エピジェネティック・メモリーの継承は,子孫に生存上の優位性を与える[20].
細胞のホメオスタシスには,プロテアソーム(P),小胞体(ER),ミトコンドリア(M)という3つの複雑な生化学的システムが働いており,これらがホルミシスに関与している。これらの構成要素は,PERM仮説で統一されている[138]。PERM仮説は、人間の環境や食生活に蔓延している、微量金属や植物化学物質などの多くの異質物質の有益な役割を、ホルミシスによって説明することができる。これらの物質は、細胞の生存(アポトーシス、オートファジー、細胞周期の調節、DNA修復、ターンオーバー)やストレス応答を支えるメカニズムに作用する。これらは、エネルギーバランス、酸化還元システム、高分子のターンオーバーに作用する。PERMを介した制御がオフラインであったり、損なわれていたり、制御不能であったりすると、活性種(RCS、ROS、RNS)やストレッサーが悪影響を及ぼす可能性がある。それは、メタボリックシンドローム、変性疾患、慢性炎症、がんなどの場合に当てはまるようである[7]。イオン化カルシウムは、PERM変調の正しいリズムを維持する役割を果たしているかもしれない[138]。
別の最近のレビューでは、環境的、物理的、栄養的なホルミシスが、細胞や組織の維持・修復システムの刺激や強化につながることが強調されている。運動、極端な温度(暑さや寒さ)放射線照射などは、物理的なホルメチンの例である。ホルミシス反応の分子メカニズムには、以下のような調節がある。1)グルタチオンの合成とそれに続く細胞の保護を活性化する転写因子Nrf2,(2)DNAのメチル化とエピジェネティクス,(3)マイクロRNAの調節などである[139]。
毒性学や薬理学の歴史を書き換えることは、パラダイムの変更を訴えることになる。これは、環境ホルミシスの基本的な生物学的基盤によるものである。最近、低用量の環境物質がオートファジーを誘導することが報告されているが、これは本質的にすべての細胞タイプを保護する重要な適応反応である。ホルミシスは、エピジェネティクスを介して世代を超えて行われることもある。レビュー担当者は、毒性学や薬理学の関係者に対して、単に害を避けるのではなく、公衆衛生を最適化することを目標に、リスク評価のプロセスを再検討するよう訴えている[140]。表8は、パートIXの主な特徴、メカニズム、および効果の概要を示している。
表8 地球上の生物圏におけるストレス適応
| ストレスタイプ | 例 | モルメカニズム | 効果 |
|---|---|---|---|
| 物理的 | 温度(熱、霜)、放射、運動 | Nrf2、グルタチオン DNAメチル化、 マイクロRNA |
細胞保護 アポトーシス、オートファジー、細胞周期調節、DNA修復および代謝回転 |
| 化学薬品 | ROS、Li、Si、Ag、Cd、Pb モノテルペン メチルグリオキサール |
プロテアソーム、小胞体、PQS、ミトコンドリア | 細胞の生存 エピジェネティックな記憶 進化の柔軟性 |
| 生化学 | 食事制限、 医薬品 |
グルコース-ケトンスイッチ PAC1-R |
代謝スイッチング 神経保護 |
| 生物学的製剤 | ホルミシス:メラトニン 腫瘍溶解性ウイルス:NDV |
カルシウム HSP27、I型IFN |
概日リズムへの適応腫瘍崩壊、免疫原性細胞死 |
NDV=ニューカッスル病ウイルス、Nrf2=Nuclear factor erythroid 2-related factor、PQS=Protein quality control system、PAC1-R=Pituitary adenylate cyclase-activating polypeptide receptor 1,HSP27=Heat-shock protein 27,IFN=Type I interferonの略。
10. 考察
ホルミシスは、非線形の用量反応関係の理論である。ホルミシスは、低用量のストレス因子にさらされた細胞がどのように反応するかについての多くの現象を説明することができるが、すべてではない。すべての反応が宿主の生存に有益であるとは限らない。このことは、一つの例で明らかになるであろう。腫瘍の休眠は、がん研究において重要な現象であるが、まだ十分に理解されていない。最近、肺がんや卵巣がんの休眠モデルを用いて、ストレスで活性化した好中球に由来する修飾脂質が、休眠中の腫瘍細胞の再活性化につながることが報告された。ストレスホルミシスは、好中球から炎症性のS100A8/A9タンパク質を急速に放出させる。これらはミエロペルオキシダーゼの活性化を誘発し、その結果、酸化した脂質が蓄積されることになる。好中球から放出されたこれらの脂質は、線維芽細胞成長因子経路をアップレギュレートする。これにより、腫瘍細胞が休眠状態から脱出し、新たな腫瘍病変が形成される[141]。このように、ストレス因子は有害な作用を及ぼすこともある。
発育中の免疫系は、環境中の化学物質や薬物によって破壊される新たな標的としての役割を果たしている。その影響は、後年の健康リスクに大きく影響する。ミトコンドリアの機能を最適化することは、胎児の発育において重要である。ミトコンドリアは、初期のシグナル伝達カスケードやエピジェネティック・プログラミングにおいて重要な役割を果たしている[142]。周産期には、エピジェネティックな刷り込みが行われるため、適切な栄養摂取が非常に重要だ。新生児脳損傷は,脂質過酸化の亢進を特徴とする鉄依存性の細胞死(フェロトーシス)と関連している[143].
ミトコンドリアは,環境毒素の標的となりやすく,現在の規制値では安全と考えられるレベルであっても,その可能性がある.最近,24種類の人為的な化学物質について,胚の酸素消費率(eOCR)への影響を調べた。各化学物質は、その濃度に応じて、固有のeORC反応プロファイルを示した。いくつかの化学物質では、非単調な用量反応効果とミトコンドリアホルミシスが検出された。著者らは,化学物質に対するミトコンドリアの反応は非常に動的であり,特定の化学物質のミトコンドリア毒性を決定する際には慎重な検討が必要であると結論付けている[144].
発達性免疫毒性(DIT)に関連した出生後の健康リスクの範囲は、出生前から新生児までの自然な発達の進行に影響される。妊娠すると、子宮内でTh2バイアスがかかる。これにより、新生児のTh1機能の獲得が遅れることになる。ホルミシスは、成人の免疫系を調節する重要な因子であることが示されているため、胎児、新生児、幼少期の免疫系に対する異質物質の用量反応効果に反対する可能性を理解するには、さらなる研究が必要である。近年、免疫機能障害と慢性疾患との直接的な関連性が明らかになってきている[145]。
この総説では、一過性の食事制限(DR)と断続的な代謝切り替え(IMS)のポジティブなホルミシス効果が報告されている。これは、世界中の飢餓や栄養失調の恒常的なストレスとは対照的である。1989年、飢餓問題の主要な専門家23名は、「ベラージオ宣言」において、飢餓を克服するための達成可能な4つの目標を定義した。すなわち、飢饉による死亡をなくすこと、世界の最貧世帯の半数の飢餓をなくすこと、母親と小さな子供の栄養不良を半減させること、そして、ヨウ素とビタミンAの欠乏を根絶することである[146]。2009,WHOとユニセフは、生後6カ月から60カ月未満の子どもの浪費を特定するために、WHOの成長基準への移行を推奨した。これにより、緊急食料援助を提供するための世界的なロジスティックシステムが進化した。世界的な栄養不良には、主要な公衆衛生問題である栄養関連の障害が含まれている。すなわち、子宮内発育遅延、タンパク質・エネルギー栄養不良、ヨウ素欠乏症、ビタミンA欠乏症、鉄欠乏性貧血、過体重・肥満である[147]。6ヵ月未満の乳児は、栄養調査から除外されることが多い。しかし,開発途上国では,多数の6カ月未満の乳児が浪費されているという事実がある.WHOの基準を用いた2011年のデータ分析では,世界で6カ月未満の約300万人の乳児が重度の浪費をしており,250万人が中等度の浪費をしていることが明らかになった[148].
ホルミシスの原理は,身体運動や運動能力トレーニングの分野にも入ってきている。自然免疫系に対する運動の影響は,特にHSP72などのストレスタンパク質によって左右される。定期的な運動は、ストレスホルミシスや炎症性サイトカインの存在を減少させることで、炎症やストレスのフィードバックが乱れている人の免疫・神経内分泌の安定化を誘発する。とはいえ、運動の生物医学的な副作用を考慮する必要がある[149]。進化生物学によると、生物はストレス下で成長を示すことがあるが、この現象は「抗重力性」と呼ばれている。コーチやアスリートにとって重要な問題は,アスリートが抗重力の基礎となる身体的,生理的,行動的な適応を身につけるために,どのようにトレーニング条件をデザインするかということである。最近の研究では、クライミングにおける抗重力のための最適なストレス負荷を決定する方法について述べられている。その中には、個別の負荷-反応プロファイルも含まれている[149]。
低用量影響研究の最近の進展は、環境毒性学や生態毒性学において、ハザードやリスク評価の質を向上させるための新たな手段を提供するものである [150]。除草剤ホルミシスは,除草剤やその他の植物毒の亜毒性量でよく観察される。しかし,隣接する圃場で意図せずに雑草がホルミシス量に曝されるという望ましくない影響を引き起こす可能性がある [151]。また、河口や湖に広がる環境汚染物質として、低濃度の除草剤の刺激効果があるかもしれない。その一例が植物プランクトンのブルームである。Microcystis aeruginosaとSelenastrum capricornutumを対象とした最近のホルミシス研究では,ブルームは除草剤によって引き起こされ,シトクロムb559,活性酸素,NOが関与していることが示唆されている[152]。環境毒性学や生態毒性学においては,リスク評価や健康の最適化のために,より信頼性の高い推定値を提供するための再考が必要であると提言された[150]。
ホメオスタシスとは,エネルギーと環境に関する細胞のバランスのシステムを表す。ミトコンドリアはホメオスタシスの維持に重要な役割を果たしている[7]。ホルミシスは、ホメオパシーと混同してはならないが、低用量のストレスに対する細胞の適応の生化学的メカニズムを説明している。
11. まとめと結論
ホルミシス理論について聞いたことがある人は少ないと思う。しかし、ホルミシスは地球上の生物圏における重要な原理であり、多くの分野に影響を与えている。この総説では、さまざまなタイプの細胞における低用量ストレス適応の例を数多く紹介している。ストレス因子は標的細胞にシグナルを誘導し、そのシグナルは細胞応答機構によって調節され、ホメオスタシスと細胞生存を維持する。ある転写因子(すなわち、Nrf2)は、ROS、熱、低線量放射線、Li、絶食などのストレス因子の調節に重要な役割を果たしている。タンパク質の品質管理システムには、プロテアソーム(P)小胞体(ER)ミトコンドリア(M)が関与している(すなわち、PERK)。同様の制御システムは、DNA、RNA、オルガネラ、生体膜を脂質で保護するためにも存在する。免疫系は、多細胞生物におけるもう一つの保護レベルである。微生物による感染から守り、一般的なホメオスタシスに貢献している。リガンドと受容体の間のキーロック相互作用は、直線的な用量反応関係とは異なる規則に従っている。
数十億年前の古細菌は、環境ストレス応答がなければ、進化の過程での極端な条件やその多様な変化に耐えられなかったかもしれない。環境ストレス応答は、典型的な基準を満たしており、例えば、ステレオタイプの転写リプログラミングや、異なる機能を持つ誘導遺伝子と抑制遺伝子の選択などが行われる。また、エピジェネティックなメカニズムやインポーチンティングが関与しており、エピジェネティックな記憶につながっている。これは進化の柔軟性に貢献する。
ホルミシス反応とその意味を理解することで、放射線生物学、毒性学、薬理学、医学、海洋生物学、農業など、多くの分野でパラダイムの転換が図られるはずである。
生きている細胞は、環境からのシグナルに反応して、直線的な関係のルールを変えることができる。その最たる例が、放射線の照射である。例えば、低線量であれば免疫系が刺激され、高線量であれば抑制される。ストレス適応のホルミシス理論は、地球上の生物圏における非線形の線量反応関係を説明しようとするものである。
Less Can Be More (少ないとが多いこともある)
この結論は、ホルミシス効果にも当てはまる。癌治療に関しては、手術、放射線、化学療法などの標準的な治療法の開発にもこの言葉が当てはまる。過激な手術、超過激な手術、超過激な手術というドグマは、局所手術とアジュバント療法の組み合わせに取って代わられた。積極的な高用量化学療法は、場合によっては低用量のメトロノミック・アプリケーションに変化した。高線量の放射線と低線量の放射線とでは、明らかに作用が異なる。高線量放射線は免疫系を抑制し、低線量放射線は免疫系を刺激する。このホルミシス効果の結果は、まだ臨床現場に導入されていない。この総説では、低線量放射線だけでなく、標的療法、オンコロイドウイルス、がんワクチンなどのホルミシス効果についても述べられている。
これらの例は、癌専門医のドグマやパラダイムを変えるのに十分である。がん治療によって重篤な有害事象(例えばWHOのグレード3~4)が発生すると、生物学的システムは何かが間違っているというシグナルを発する。また、多臓器不全の慢性疾患において、各臓器をそれぞれの薬物療法で治療すると、やはり何かがおかしくなり、多剤間の相互作用から予測できない結果が生じるという問題が生じる。
ホルミシスの理論はまだ理論である[153,154]。これを証明,反証,または修正するためにはかなりの研究が必要である。いずれにしても,この理論は,医学だけでなく,農業,エネルギー,地球の環境といったテーマに関しても重要だ[7]。
文献
1. Calabbrese E.J., Baldwin L.A. Hormesis: U-shaped dose responses and their centrality to toxicology. Trends Pharmacol. Sci. 2001;22:285–291. doi: 10.1016/S0165-6147(00)01719-3. [PubMed] [CrossRef] [Google Scholar]
2. Agathokleous E., Kitao M., Calabrese E.J. Hormesis: Highly generalizable and beyond laboratory. Trends Plant Sci. 2020;25:1076–1086. doi: 10.1016/j.tplants.2020.05.006. [PubMed] [CrossRef] [Google Scholar]
3. Calabrese E.J., Blain R. The occurence of hormetic dose responses in the toxicological literature, the hormesis database: An overview. Toxicol. Appl. Pharmacol. 2005;202:285–301. doi: 10.1016/j.taap.2004.06.023. [PubMed] [CrossRef] [Google Scholar]
4. Agathokleous E., Barcelo D., Tsatsakis A., Calabrese E.J. Hydrocarbon-induced hormesis: 101 Years of evidence at the margin? Environ. Pollut. 2020;265 Pt B:11846. doi: 10.1016/j.envpol.2020.114846. [PubMed] [CrossRef] [Google Scholar]
5. Fernàndez J.P.S. The downfall of the linear non-threshold model. Rev. Esp. Med. Nucl. Imagen. Mol. 2020;39:303–315. doi: 10.1016/j.remn.2020.05.006. [PubMed] [CrossRef] [Google Scholar]
6. Calabrese E.J. Hormesis: Principles and applications. Homeopathy. 2015;104:69–82. doi: 10.1016/j.homp.2015.02.007. [PubMed] [CrossRef] [Google Scholar]
7. Schirrmacher V. Mitochondria at work: New insights into regulation and dysregulation of cellular energy supply and metabolism. Biomedicines. 2020;8:526. doi: 10.3390/biomedicines8110526. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Sthijns M.M.J.P.E., Weseler A.R., Bast A., Haenen G.R.M.M. Time in Redox Adaptation Processes: From Evolution to Hormesis. Int. J. Mol. Sci. 2016;17:1649. doi: 10.3390/ijms17101649. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Rico A. Chemo-defence system. C. R. Acad. Sci. III. 2001;324:97–106. doi: 10.1016/S0764-4469(00)01281-6. [PubMed] [CrossRef] [Google Scholar]
10. Xu Y., Liu S., Chen F., Wang Z. pH affects the hormesis profiles of personal care product components on luminescence of the bacteria Vibrio qinghaiensis sp.-Q67. Sci. Total Environ. 2020;713:136656. doi: 10.1016/j.scitotenv.2020.136656. [PubMed] [CrossRef] [Google Scholar]
11. Jin L., Chen Y., Yang W., Qiao Z., Zhang X. Complete genome sequence of fish-pathogenic Aeromonas hydrophila HX-3 and a comparative analysis: Insights into virulence factors and quorum sensing. Sci. Rep. 2020;10:15479. doi: 10.1038/s41598-020-72484-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
12. Yao Z., Wang D., Wu X., Lin Z., Long X., Liu Y. Hormetic mechanism of sulfonamides on Aliivibrio fischeri luminescence based on a bacterial cell-cell communication. Chemospere. 2019;215:793–799. doi: 10.1016/j.chemosphere.2018.10.045. [PubMed] [CrossRef] [Google Scholar]
13. Sun H., Zhang X., Wang D., Lin Z. Insights into the role of energy source in hormesis through diauxic growth of bacteria in mixed cultivation systems. Chemosphere. 2020;261:127669. doi: 10.1016/j.chemosphere.2020.127669. [PubMed] [CrossRef] [Google Scholar]
14. Nicolic B., Vasilijevic B., Culafic D., Vukovic-Gacic B., Knezevic-Vukcevic J. Comparative study of genotoxic, antigenotoxic and cytotoxic activities of monoterpenes camphor, eucalyptol and thujone in bacteria and mammalian cells. Chem. Biol. Interact. 2015;242:263–271. doi: 10.1016/j.cbi.2015.10.012. [PubMed] [CrossRef] [Google Scholar]
15. Kudryasheva N.S., Rozhko T.V. Effect of low-dose ionizing radiation on luminous marine bacteria: Radiation hormesis and toxicity. J. Environ. Radioact. 2015;142:68–77. doi: 10.1016/j.jenvrad.2015.01.012. [PubMed] [CrossRef] [Google Scholar]
16. Zemva J., Fink C.A., Fleming T.H., Schmidt L., Loft A., Herzig S., Knieß R.A., Mayer M., Bukau B., Nawroth P.P., et al. Hormesis enables cells to handle accumulating toxic metabolites during increased energy flux. Redox Biol. 2017;13:674–686. doi: 10.1016/j.redox.2017.08.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Kubohara Y., Kikuchi H. Dictyostelium: An important source of structural and functional diversity in drug discovery. Cells. 2019;8:6. doi: 10.3390/cells8010006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Moore M.N., Shaw J.P., Adams D.R.F., Viarengo A. Anti-oxidative cellular protection effect of fasting-induced autophagy as a mechanism of hormesis. Mar. Environ. Res. 2015;107:35–44. doi: 10.1016/j.marenvres.2015.04.001. [PubMed] [CrossRef] [Google Scholar]
19. Matai L., Sarker G.C., Chamoli M., Malik Y., Kumar S.S., Rautela U., Jana N.R., Chakraborty K., Mukhopadhyay A. Dietary restriction improves proteasis and increases life span through endoplasmic reticulum hormesis. Proc. Natl. Acad. Sci. USA. 2019;116:17383–17392. doi: 10.1073/pnas.1900055116. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Kishimoto S., Uno M., Okabe E., Nono M., Nishida E. Environmental stresses induce transgenerationally inheritable survival advantages via germline-to-soma communication in Caenorhabditis elegans. Nat. Commun. 2017;8:14031. doi: 10.1038/ncomms14031. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Le Bourg E. Characterization of the positive effects of mild stress on ageing and resistance to stress. Biogerontology. 2020;21:485–493. doi: 10.1007/s10522-020-09870-2. [PubMed] [CrossRef] [Google Scholar]
22. Le Bourg E. Combining three mild stresses in Drosophila melanogaster flies does not have a more positive effect on resistance to a severe cold stress than combining two mild stresses. Biogerontology. 2017;18:275–284. doi: 10.1007/s10522-017-9689-5. [PubMed] [CrossRef] [Google Scholar]
23. Le Bourg E. Life-time protection against severe heat stress by exposing young Drosophila melanogaster flies to a mild cold stress. Biogerontology. 2016;17:409–415. doi: 10.1007/s10522-015-9629-1. [PubMed] [CrossRef] [Google Scholar]
24. Berry R., 3rd, Lopez-Martinez G. A dose of experimental hormesis: When mild stress protects and improves animal performance. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 2020;242:110658. doi: 10.1016/j.cbpa.2020.110658. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Shushimita S., Grefhorst A., Steenbergen J., de Bruin R.W.F., Ijzermans J.N.M., Themmen A.P.N., Dor F.J.M.F. Protection against renal ischemia-reperfusion injury through hormesis? Dietary intervention versus cold exposure. Life Sci. 2016;144:69–79. doi: 10.1016/j.lfs.2015.11.022. [PubMed] [CrossRef] [Google Scholar]
26. Teets N.M., Gantz J.D., Kawarasaki Y. Rapid cold hardening: Ecological relevance, physiological mechanisms and new perspectives. J. Exp. Biol. 2020;223 Pt 3:jeb203448. doi: 10.1242/jeb.203448. [PubMed] [CrossRef] [Google Scholar]
27. Calabrese E.J. Hormesis: Path and progression to significance. Int. J. Mol. Sci. 2018;19:2871. doi: 10.3390/ijms19102871. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
28. Saha S., Buttari B., Panieri E., Profumo E., Saso L. An overview of Nrf2 signaling pathway and ist role in inflammation. Molecules. 2020;25:5474. doi: 10.3390/molecules25225474. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. Cui J., Yang G., Pan Z., Zhao Y., Liang X., Li W., Cai L. Hormetic response to low-dose radiation: Focus on the immune system and its clinical implications. Int. J. Mol. Sci. 2017;18:280. doi: 10.3390/ijms18020280. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Yang G., Kong Q., Wang G., Jin H., Zhou L., Yu D., Niu C., Han W., Li W., Cui J. Low-dose ionizing radiation induces direct activation of natural killer cells and provides a novel approach for adoptive cellular immunotherapy. Cancer Biother. Radiopharm. 2014;29:428–434. doi: 10.1089/cbr.2014.1702. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Klug F., Prakash H., Huber P.E., Seibel T., Bender N., Halama N., Pfirschke C., Voss R.H., Timke C., Umansky L., et al. Low-dose irradiation programs macrophage differentiation to an iNOS+/M1 phenotype that orchestrates effective T cell immunotherapy. Cancer Cell. 2013;34:589–602. doi: 10.1016/j.ccr.2013.09.014. [PubMed] [CrossRef] [Google Scholar]
32. Schaue D., Marples B., Trott K.R. The effects of low-dose X-irradiation on the oxidative burst in stimulated macrophages. Int. J. Radiat. Biol. 2002;78:567–576. doi: 10.1080/09553000210126457. [PubMed] [CrossRef] [Google Scholar]
33. Jahns J., Anderegg U., Saalbach A., Rosin B., Patties I., Glasow A., Kamprad M., Scholz M., Hildebrandt G. Influence of low dose irradiation on differentiation, maturation and T-cell activation of human dendritic cells. Mutat. Res. 2011;710:32–39. doi: 10.1016/j.mrfmmm.2011.02.007. [PubMed] [CrossRef] [Google Scholar]
34. Shigematsu A., Adachi Y., Koike-Kiriyama N., Suzuki Y., Iwasaki M., Koike Y., Nakano K., Mukaide H., Imamura M., Ikehara S. Effects of low-dose irradiation on enhancement of immunity by dendritic cells. J. Radiat. Res. 2007;48:51–55. doi: 10.1269/jrr.06048. [PubMed] [CrossRef] [Google Scholar]
35. Song K.H., Kim M.H., Kang S.M., Jung S.Y., Ahn J., Woo H.J., Nam S.Y., Hwang S.G., Ryu S.Y., Song J.Y. Analysis of the immune cell populations and cytokine profiles in murine splenocytes exposed to whole-body low-dose irradiation. Int. J. Radiat. Biol. 2015;91:795–803. doi: 10.3109/09553002.2015.1068461. [PubMed] [CrossRef] [Google Scholar]
36. Shankar B., Pandey R., Sainis K. Radiation-induced bystander effects and adaptive response in murine lymphocytes. Int. J. Radiat. Biol. 2006;82:537–548. doi: 10.1080/09553000600877114. [PubMed] [CrossRef] [Google Scholar]
37. Rizvi A., Pecaut M.J., Slater J.M., Subramaniam S., Gridley D.S. Low-dose γ-rays modify CD4+ T cell signalling response to simulated solar particle event protons in a mouse model. Int. J. Radiat. Biol. 2011;87:24–35. doi: 10.3109/09553002.2010.518206. [PubMed] [CrossRef] [Google Scholar]
38. Liu S.Z., Zhang Y.C., Su X. Effect of low dose radiation on the expression of TCR/CD3 and CD25 on mouse thymocyte plasma membrane. Clin. J. Pathophysiol. 1995;11:2–5. [Google Scholar]
39. Liu R., Xiong S., Zhang L., Chu Y. Enhancement of antitumor immunity by low-dose total body irradiation is associated with selectively decreasing the proportion and number of T regulatory cells. Cell. Mol. Immunol. 2010;7:157–162. doi: 10.1038/cmi.2009.117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Liu X.D., Liu S.Z., Ma S.M., Liu Y. Expression of IL-10 in mouse spleen at mRNA and protein level after whole-body X-irradiation. Chin. J. Radiol. Med. Prot. 2001;22:10–12. [Google Scholar]
41. Rho H.S., Park S.S., Lee C.E. Gamma irradiation up-regulates expression of B cell differentiation molecule CD23 by NF-κB activation. J. Biochem. Mol. Biol. 2004;37:507–514. doi: 10.5483/BMBRep.2004.37.4.507. [PubMed] [CrossRef] [Google Scholar]
42. Ye S., Yuan D., Xie Y., Pan Y., Shao C. Role of DNA methylation in long-term low-dose γ-rays induced adaptive response in human B lymphoblast cells. Int. J. Radiat. Biol. 2013;89:898–906. doi: 10.3109/09553002.2013.806832. [PubMed] [CrossRef] [Google Scholar]
43. Lall R., Ganapathy S., Yang M., Xiao S., Xu T., Su H., Shadfan M., Asara J.M., Ha C.S., Ben-Sahra I., et al. Low-dose radiation exposure induces a HIF-1-mediated adaptive and protective metabolic response. Cell Death Differ. 2014;21:836–844. doi: 10.1038/cdd.2014.24. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Csaba G. Hormesis and immunity: A review. Acta Microbiol. Immunol. Hung. 2019;66:155–168. doi: 10.1556/030.65.2018.036. [PubMed] [CrossRef] [Google Scholar]
45. Muri J., Kopf M. Redox regulation of immunometabolism. Nat. Rev. Immunol. 2020 doi: 10.1038/s41577-020-00478-8. [PubMed] [CrossRef] [Google Scholar]
46. Kaiser J. Sipping from a poisoned chalice. Science. 2003;302:376–379. doi: 10.1126/science.302.5644.376. [PubMed] [CrossRef] [Google Scholar]
47. Collins N., Han S., Enamorado M., Link V.M., Huang B., Moseman E.A., Kishton R.J., Shannon J.P., Dixit D., Schwab S.R., et al. The bone marrow protects and optimizes immunological memory during dietary restriction. Cell. 2019;178:1088–1101. doi: 10.1016/j.cell.2019.07.049. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. McClure C.D., Zhong W., Hunt V.L., Chapman F.M., Hill F.V., Priest K. Hormesis results in trade-offs with immunity. Evolution. 2014;68:2225–2233. doi: 10.1111/evo.12453. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Calabrese E.J., Giordano J.J., Kozumbo W.J., Leak R.K., Bhatia T.N. Hormesis mediates dose-sensitive shifts in macrophage activation patterns. Pharmacol. Res. 2018;137:236–249. doi: 10.1016/j.phrs.2018.10.010. [PubMed] [CrossRef] [Google Scholar]
50. Clanton R., Saucier D., Ford J., Akabani G. Microbial influences on hormesis, oncogenesis, and therapy: A review of the literature. Environ. Res. 2015;142:239–256. doi: 10.1016/j.envres.2015.06.026. [PubMed] [CrossRef] [Google Scholar]
51. Ortega E. The “bioregulatory effect of exercise” on the innate/inflammatory responses. J. Physiol. Biochem. 2016;72:361–369. doi: 10.1007/s13105-016-0478-4. [PubMed] [CrossRef] [Google Scholar]
52. An J., Li F., Qin Y., Zhang H., Ding S. Low concentrations of FA exhibits the hormesis effect by affecting cell division and the Warburg effect. Ecotoxicol. Environ. Saf. 2019;183:109576. doi: 10.1016/j.ecoenv.2019.109576. [PubMed] [CrossRef] [Google Scholar]
53. Sies H., Feinendegen L.E. Radiation hormesis: The link to nanomolar hydrogen peroxide. Antioxid. Redox Signal. 2017;27:596–598. doi: 10.1089/ars.2017.7233. [PubMed] [CrossRef] [Google Scholar]
54. Castillo-Quan J.I., Li L., Kinghorn K.J., Ivanov D.K., Tain L.S., Slack C., Kerr F., Nespital T., Thornton J., Hardy J., et al. Lithium promotes longevity through GSK3/NRF2-dependent hormesis. Cell Rep. 2016;15:638–650. doi: 10.1016/j.celrep.2016.03.041. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Pennisi M., Crupi R., Di Paola R., Ontario M.L., Bella R., Calabrese E.J., Crea R., Cuzzocrea S., Calabrese V. Inflammasomes, hormesis, and antioxidants in neuroinflammation: Role of NRLP3 in Alzheimer disease. J. Neurosci. Res. 2017;95:1360–1372. doi: 10.1002/jnr.23986. [PubMed] [CrossRef] [Google Scholar]
56. Huang X., Li J., Song S., Wang L., Lin Z., Ouyang Z., Yu R. Hormesis effect of hydrogen peroxide on the promoter activity of neuropeptide receptor PAC1-R. J. Food Biochem. 2019;43:e12877. doi: 10.1111/jfbc.12877. [PubMed] [CrossRef] [Google Scholar]
57. Scuto M.C., Mancuso C., Tomasello B., Ontario M.L., Cavallaro A., Frasca F., Maiolino L., Salinaro A.T., Calabrese E.J., Calabrese V. Curcumin, hormesis and the nervous system. Nutrients. 2019;11:2417. doi: 10.3390/nu11102417. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58. Rainey N.E., Moustapha A., Petit P.X. Curcumin, a multifaceted hormetic agent, mediates an intricate crosstalk between mitochondrial turnover, autophagy, and apoptosis. Oxid. Med. Cell. Longev. 2020;2020:3656419. doi: 10.1155/2020/3656419. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
59. Calabrese E.J. Hormesis and Ginseng: Ginseng mixtures and individual constituents commonly display hormesis dose responses, especially for neuroprotective effects. Molecules. 2020;25:2719. doi: 10.3390/molecules25112719. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
60. Gòmez-Sierra T., Medina-Campos O.N., Solano J.D., Ibarro-Rubio M.E., Pedraza-Chaverri J. Isoliquiritigenin pretreatment induces endoplasmatic reticulum stress-mediated hormesis and attenuates cisplatin-induced oxidative stress and damage in LLC-PK1 cells. Molecules. 2020;25:4442. doi: 10.3390/molecules25194442. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. Calabrese E.J., Hanekamp J.C., Hanekamp Y.N., Kapoor R., Dhawan G., Agathokleous E. Chloroquine commonly induces hormetic dose responses. Sci. Total Environ. 2020;755 Pt 1:142436. doi: 10.1016/j.scitotenv.2020.142436. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
62. Calabrese E.J., Tsatsakis A., Agathokleous E., Giordano J., Calabrese V. Does green tea induce hormesis? Dose-Response. 2020;18 doi: 10.1177/1559325820936170. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
63. Antonnuci S., Mulvey J.F., Burger N., Di Sante M., Hall A.R., Hinchy E.C., Caldwell S.T., Gruszczyk A.V., Deshwal S., Hartley R.C., et al. Selective mitochondrial superoxide generation in vivo is cardioprotective through hormesis. Free Radic. Biol. Med. 2019;134:678–687. doi: 10.1016/j.freeradbiomed.2019.01.034. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64. Fernandez-Ortiz M., Sayed R.K.A., Fernandez-Martinez J., Cionfrini A., Aranda-Martinez P., Escames G., de Haro T., Acuna-Castroviejo D. Melatonin/Nrf2/NLRP3 connection in mouse heart mitochondria during aging. Antioxidants. 2020;9:1187. doi: 10.3390/antiox9121187. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
65. Keller A., Hull S.E., Elajaili H., Johnston A., Knaub L.A., Chun J.H., Walker L., Nozik-Grayck E., Reusch J.E.B. (-)-Epicatechin modulates mitochondrial redox in vascular cell models of oxidative stress. Oxid. Med. Cell. Longev. 2020;2020:6392629. doi: 10.1155/2020/6392629. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Mattson M.P., Moehl K., Ghena N., Schmaedick M., Cheng A. Intermittent metabolic switching, neuroplasticity and brain health. Nat. Rev. Neurosci. 2018;19:63–80. doi: 10.1038/nrn.2017.156. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
67. Zhu X., Wei Y., Yang B., Yin X., Guo X. The mitohormetic response a spart of the cytoprotection mechanism of berberine. Mol. Med. 2020;26:10. doi: 10.1186/s10020-020-0136-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
68. Mitchell H.M., White D.M., Kraig R.P. Strategies for study of neuroprotection from cold-preconditioning. J. Vis. Exp. 2010;43:e2192. doi: 10.3791/2192. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Rojas J.C., Gonzales-Lima F. Neurological and psychological applications of transcranial lasers and LEDs. Biochem. Pharmacol. 2013;86:447–457. doi: 10.1016/j.bcp.2013.06.012. [PubMed] [CrossRef] [Google Scholar]
70. Abdel Meguid M.H., Hamad Y.H., Swilam R.S., Barakat M.S. Relation of interleukin-6 in rheumatoid arthritis patients to systemic bone loss and structural bone damage. Rheumatol. Int. 2013;33:697–703. doi: 10.1007/s00296-012-2375-7. [PubMed] [CrossRef] [Google Scholar]
71. Tago F., Tsukimoto M., Nakatsukasa H., Kojima S. Repeated 0.5-Gy gamma irradiation attenuates autoimmune disease in MRL-lpr/lpr mice with suppression of CD3+CD4−CD8−B220+ t-cell proliferation and with up-regulation of CD4+CD25+Foxp3+ regulatory T cells. Radiat. Res. 2008;169:59–66. doi: 10.1667/RR1013.1. [PubMed] [CrossRef] [Google Scholar]
72. Artukovic M., Ikic M., Kustelega J., Artukovic I.N., Kaliterna D.M. Influence of UV radiation on immunological system and occurence of autoimmune diseases. Coll. Antropol. 2010;34:175–178. [PubMed] [Google Scholar]
73. Nakatsukasa H., Tsukimoto M., Tokunaga A., Kojima S. Repeated gamma irradiation attenuates collagen-induced arthritis via up-regulation of regulatory T cells but not by damaging lymphocytes directly. Radiat. Res. 2010;174:313–324. doi: 10.1667/RR2121.1. [PubMed] [CrossRef] [Google Scholar]
74. Dhawan G., Kapoor R., Dhawan R., Singh R., Monga B., Giordano J., Calabrese E.J. Low dose radiation therapy as a potential life saving treatment for COVID-19-induced acute respiratory distress syndrome (ARDS) Radiother. Oncol. 2020;147:212–216. doi: 10.1016/j.radonc.2020.05.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
75. Li G., Fan Y., Lai Y., Han T., Li Z., Zhou P., Pan P., Wang W., Hu D., Liu X., et al. Coronavirus infections and immune responses. J. Med. Virol. 2020;92:424. doi: 10.1002/jmv.25685. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Prompetchara E., Ketloy C., Palaga T. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac. J. Allergy Immunol. 2020;38:1–9. doi: 10.12932/AP-200220-0772. [PubMed] [CrossRef] [Google Scholar]
77. Fung S., Yuen K., Ye Z., Chan C., Jin D. A tug-of-war between severe acute respiratory syndrome coronavirus 2 and host antiviral defence: Lessons from other pathogenic viruses. Emerg. Microbes Infect. 2020;9:558–570. doi: 10.1080/22221751.2020.1736644. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
78. Kory P., Meduri G.U., Iglesias J., Varon J., Marik P.E. Clinical and scientific rationale for the “MATH+” hospital treatment protocol for COVID-19. J. Intensiv. Care Med. 2020;36:135–156. doi: 10.1177/0885066620973585. [PubMed] [CrossRef] [Google Scholar]
79. Kory P., Meduri G.U., Iglesias J., Varon J., Berkowitz K., Kornfeld H., Vinjevoll E., Mitchell S., Wagshul F., Marik P.E. Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19. Front Line COVID-19 CRITICAL CARE ALLIANCE. Prophylaxis & Treatment Protocols for COVID-19. [(accessed on 18 December 2020)];2020 Available online: covid19criticalcare.com/wp-content/uploads/2020/11/FLCCC-Ivermectin-in-the-prophylaxis-and-treatment-of-COVID-19.pdf.
80. Jacob R.S., de Souza Santos L.V., d’Auriol M., Lebron Y.A.R., Moreira V.R., Lange L.C. Diazepam, metformin, omeprazole and simvastatin: A full discussion of individual and mixture acute toxicity. Ecotoxicology. 2020;29:1062–1071. doi: 10.1007/s10646-020-02239-8. [PubMed] [CrossRef] [Google Scholar]
81. Fisher B. Biological research in the evolution of cancer surgery: A personal perspective. Cancer Res. 2008;68:10007–10020. doi: 10.1158/0008-5472.CAN-08-0186. [PubMed] [CrossRef] [Google Scholar]
82. Lowenbraun S., DeVita V.T., Serpick A.A. Combination chemotherapy with nitrogen mustard, vincristine, procarbazine and prednisone in lymphosarcoma and reticulum cell sarcoma. Cancer. 1970;25:1018–1025. doi: 10.1002/1097-0142(197005)25:5<1018::AID-CNCR2820250505>3.0.CO;2-A. [PubMed] [CrossRef] [Google Scholar]
83. Schirrmacher V. Quo Vadis Cancer Therapy? Lambert Academic Publishing; Beau-Bassin, Mauritius: 2017. pp. 1–353. [Google Scholar]
84. Cardoso F., van’t Veer L.J., Bogaerts J., Slaets L., Viale G., Delaloge S., Pierga J.-Y., Brain E., Causeret S., DeLorenzi M., et al. 70-Gene signature as an aid to treatment decisions in early-stage breast cancer. N. Engl. J. Med. 2016;375:717–729. doi: 10.1056/NEJMoa1602253. [PubMed] [CrossRef] [Google Scholar]
85. Gaya A., Akle C.A., Mudan S., Grange J. The concept of hormesis in cancer therapy—Is less more? Cureus. 2015;7:e261. doi: 10.7759/cureus.261. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
86. Fan H., Wu Y., Yu S., Li X., Wang A., Wang S., Chen W., Lu Y. Critical role of mTOR in regulating aerobic glycolysis in carcinogenesis (Review) Int. J. Oncol. 2020;58:9–19. doi: 10.3892/ijo.2020.5152. [PubMed] [CrossRef] [Google Scholar]
87. Feuerer M., Beckhove P., Garbi N., Mahnke Y., Limmer A., Hommel M., Hämmerling G.J., Kyewsky B., Hamann A., Umansky V., et al. Bone marrow as a priming site for T-cell responses tp blood-borne antigen. Nat. Med. 2003;9:1151–1157. doi: 10.1038/nm914. [PubMed] [CrossRef] [Google Scholar]
88. Schirrmacher V. New insights into mechanisms of long-term protective anti-tumor immunity induced by cancer vaccines modified by virus infection. Biomedicines. 2020;8:55. doi: 10.3390/biomedicines8030055. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
89. Bai L., Beckhove P., Feuerer M., Umansky V., Choi C., Solomayer F.S., Diel I.J., Schirrmacher V. Cognate interactions between memory T cells and tumor antigen-presenting dendritic cells from bone marrow of breast cancer patients: Bidirectional cell stimulation, survival and antitumor activity in vivo. Int. J. Cancer. 2003;103:73–83. doi: 10.1002/ijc.10781. [PubMed] [CrossRef] [Google Scholar]
90. Cassel W.A., Garrett R.E. Newcastle disease virus as an antineoplastic agent. Cancer. 1965;18:863–868. doi: 10.1002/1097-0142(196507)18:7<863::AID-CNCR2820180714>3.0.CO;2-V. [PubMed] [CrossRef] [Google Scholar]
91. Heicappell R., Schirrmacher V., von Hoegen P., Ahlert T., Appelhans B. Prevention of metastatic spread by postoperative immunotherapy with virally modified autologous tumor cells. I. Parameters for optimal therapeutic effects. Int. J. Cancer. 1986;37:569–577. doi: 10.1002/ijc.2910370416. [PubMed] [CrossRef] [Google Scholar]
92. Von Hoegen P., Zawatzky R., Schirrmacher V. Modification of tumor cells by a low dose of Newcastle disease virus. III. Potentiation of tumor-specific cytolytic T cell activity via induction of interferon-alpha/beta. Cell. Immunol. 1990;126:80–90. doi: 10.1016/0008-8749(90)90302-8. [PubMed] [CrossRef] [Google Scholar]
93. Schild H., von Hoegen P., Schirrmacher V. Modification of tumor cells by a low dose of Newcastle disease virus. II. Augmented tumor-specific T cell response as a result of CD4+ and CD8+ immune T cell cooperation. Cancer Immunol. Immunother. 1989;28:22–28. doi: 10.1007/BF00205796. [PubMed] [CrossRef] [Google Scholar]
94. Von Hoegen P., Weber E., Schirrmacher V. Modification of tumor cells by a low dose of Newcastle disease virus. I. Augmentation of the tumor-specific T cell response in the absence of an anti-viral response. Eur. J. Immunol. 1988;18:1159–1166. doi: 10.1002/eji.1830180803. [PubMed] [CrossRef] [Google Scholar]
95. Schirrmacher V., Haas C., Bonifer R., Ahlert T., Gerhards R., Ertel C. Human tumor cell modification by virus infection: An efficient and safe way to produce cancer vaccine with pleiotropic immune stimulatory properties when using Newcastle disease virus. Gene Ther. 1999;6:63–73. doi: 10.1038/sj.gt.3300787. [PubMed] [CrossRef] [Google Scholar]
96. Ahlert T., Sauerbrei W., Bastert G., Ruhland S., Bartik B., Simiantonaki N., Schumacher J., Häcker B., Schumacher M., Schirrmacher V. Tumor cell number and viability as quality and efficacy parameters of autologous virus-modified cancer vaccines in patients with breast or ovarian cancer. J. Clin. Oncol. 1997;15:1354–1366. doi: 10.1200/JCO.1997.15.4.1354. [PubMed] [CrossRef] [Google Scholar]
97. Schirrmacher V., Lorenzen D., Van Gool S.W., Stuecker W. A new strategy of cancer immunotherapy combining hyperthermia/oncolytic virus pretreatment with specific autologous anti-tumor vaccination—A review. Austin Oncol. Case Rep. 2017;2:1006. [Google Scholar]
98. Van Gool S.W., Makalowski J., Feyen O., Prix L., Schirrmacher V., Stuecker W. The induction of immunogenic cell death (ICD) during maintenance chemotherapy and susequent multimodal immunotherapy for glioblastoma (GBM) Austin Oncol. Case Rep. 2018;3:1010. [Google Scholar]
99. Van Gool S.W., Makalowski J., Fiore S., Sprenger T., Prix L., Schirrmacher V., Stuecker W. Randomized controlled immunotherapy clinical trials for GBM challenged. Cancers. 2021;13:32. doi: 10.3390/cancers13010032. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
100. Puhlmann J., Puehler F., Mumberg D., Boukamp P., Beier R. Rac1 is required for oncolytic NDV replication in human cancer cells and establishes a link between tumorigenesis and sensitivity to oncolytic virus. Oncogene. 2010;29:2205–2215. doi: 10.1038/onc.2009.507. [PubMed] [CrossRef] [Google Scholar]
101. Abdulla J.M., Mustafa Z., Ideris A. Newcastle disease virus interaction in targeted therapy against proliferation and invasion pathways of glioblastoma multiforme. Biomed. Res. Int. 2014;2014:386470. doi: 10.1155/2014/386470. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
102. Ren S., Rehman Z.U., Shi M., Yang B., Qu Y., Yang X.F., Shao Q., Meng C., Yang Z., Gao X., et al. Syncytia generated by hemagglutinin-neuraminidase and fusion protein of virulent Newcastle disease virus induce complete autophagy by activating AMPK-mTORC1-ULK1 signaling. Vet. Microbiol. 2019;230:283–290. doi: 10.1016/j.vetmic.2019.01.002. [
103. Ch’ng W.C., Stanbridge E.J., Yusoff K., Shafee N. The oncolytic activity of Newcastle disease virus in clear cell renal carcinoma cells in normoxic and hypoxic conditions: The interplay between von Hippel-Lindau and interferon-β signaling. J. Interferon Cytokine Res. 2013;33:346–354. doi: 10.1089/jir.2012.0095. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
104. Schirrmacher V., van Gool S., Stuecker W. Breaking therapy resistance: An update on oncolytic Newcasle disease virus for improvements of cancer therapy. Biomedicines. 2019;7:66. doi: 10.3390/biomedicines7030066. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
105. Schirrmacher V. Cancer vaccines and oncolytic viruses exert profoudly lower side effects in cancer patients than other systemic therapies: A comparative analysis. Biomedicines. 2020;8:61. doi: 10.3390/biomedicines8030061. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
106. Bai L., Koopmann J., Fiola C., Fournier P., Schirrmacher V. Dendritic cells pulsed with viral oncolysates potently stimalate autologous T cells from cancer patients. Int. J. Oncol. 2002;21:685–694. [PubMed] [Google Scholar]
107. Shevtsov M., Balogi Z., Khachatryan W., Gao H., Vigh L., Multhoff G. Membrane- associated heat shock proteins in oncolgy: From basic research to new theranostic targets. Cells. 2020;9:1263. doi: 10.3390/cells9051263. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
108. Camandona V.L., Rios-Anjos R.M., Alegria T.G.P., Pereira F., Bicev R.N., da Cunha F.M., Digiampietri L.A., de Barros M.H., Netto L.E.S., Ferreira-Junior J.R. Expression of human HSP27 in yeast extends replicative lifespan and uncovers a hormetic response. Biogerontology. 2020;21:559–575. doi: 10.1007/s10522-020-09869-9. [PubMed] [CrossRef] [Google Scholar]
109. Kurd N., Robey E.A. T-cell selection in the thymus. A spatial and temporal perspective. Immunol. Rev. 2016;271:114–126. doi: 10.1111/imr.12398. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
110. Melssen M., Slingluff C.L. Vaccines targeting helper T cells for cancer immunotherapy. Curr. Opin. Immunol. 2017;47:85–92. doi: 10.1016/j.coi.2017.07.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
111. Hoerr I., Obst R., Rammensee H.G., Jung G. In vivo application of RNA leads to induction of specific cytotoxic T lymphocytes and antibodies. Eur. J. Immunol. 2000;30:1–7. doi: 10.1002/1521-4141(200001)30:1<1::AID-IMMU1>3.0.CO;2-#. [PubMed] [CrossRef] [Google Scholar]
112. Fournier P., Wilden H., Schirrmacher V. Importance of retinoic acid-inducible gene I and of receptor for type I interferon for cellular resistance to infection by Newcastle disease virus. Int. J. Oncol. 2012;40:287–298. doi: 10.3892/ijo.2011.1222. [PubMed] [CrossRef] [Google Scholar]
113. Zaslawsky E., Hershberg U., Seto J., Pham A.M., Marques S., Duke J.L., Wetmur J.G., Tenoever B.R., Sealfon S.C., Kleinstein S.H. Antiviral response dictated by choreographed cascade of transcription factors. J. Immunol. 2010;184:2908–2917. doi: 10.4049/jimmunol.0903453. [PMC free article] [PubMed] [CrossRef
114. Schirrmacher V., Förg P., Dalemans W., Chlichlia K., Zeng Y., Fournier P., von Hoegen P. Intra-pinna anti-tumor vaccination with self-replicating infectious RNA or with DNA encoding a model tumor antigen and a cytokine. Gene Ther. 2000;7:1137–1147. doi: 10.1038/sj.gt.3301220. [PubMed] [CrossRef] [Google Scholar]
115. Förg P., von Hoegen P., Dalemans W., Schirrmacher V. Superiority of the ear pinna over muscle tissue as site for DNA vaccination. Gene Ther. 1998;5:789–797. doi: 10.1038/sj.gt.3300628. [PubMed] [CrossRef] [Google Scholar]
116. Toes R.E.M., Offringa R., Blom R.J.J., Melief C.J.M., Kast W.M. Peptide vaccination can lead to enhanced tumor growth through specific T-cell tolerance induction. Proc. Natl. Acad. Sci. USA. 1996;93:7855–7860. doi: 10.1073/pnas.93.15.7855. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
117. Rini B.I., Stenzl A., Zdrojowy R., Kogan M., Shkolnik M., Oudard S., Weikert S., Bracarda S.J., Crabb S., Bedke J., et al. IMA901, a multipeptide cancer vaccine, plus sunitinib versus sunitinib alone, as first-line therapy for advanced or metastatic renal cell carcinoma (IMPRINT): A multicentre, open-label, randomized, controlled, phase 3 trial. Lancet Oncol. 2016;17:1599–1611. doi: 10.1016/S1470-2045(16)30408-9. [PubMed] [CrossRef] [Google Scholar]
118. Nelde A., Rammensee H.G., Walz J.S. The peptide vaccine of the future. Mol. Cell. Proteom. 2021;20:100022. doi: 10.1074/mcp.R120.002309. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
119. Zhao T., Du J., Zeng H. Interplay between endoplasmic reticulum stress and non-coding RNAs in cancer. J. Hematol. Oncol. 2020;13:163. doi: 10.1186/s13045-020-01002-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
120. Kenny T.C., Gomez M., Germain D. Mitohormesis, UPRmt, and the complexity of mitochondrial DNA landscapes in cancer. Cancer Res. 2019;79:6057–6066. doi: 10.1158/0008-5472.CAN-19-1395. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
121. Nokin M., Dutieux F., Bellier J., Peulen O., Uchida K., Spiegel D.A., Cochrane J.R., Hutton C.A., Castronovo V., Bellahcene A. Hormetic potential of methylglyoxal, a side-product of glycolysis, in switching tumours from growth to death. Sci. Rep. 2017;7:11722. doi: 10.1038/s41598-017-12119-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
122. Calvani M., Subbiani A., Vignoli M., Favre C. Spotlight on ROS and ß3-adrenoreceptors fighting in cancer cells. Oxid. Med. Cell. Longev. 2019;2019:6346529. doi: 10.1155/2019/6346529. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
123. Werner L., Dreyer J.H., Hartmann D., Barros M.H.M., Büttner-Herold M., Grittner U., Niedobitek G. Tumor-associated macrophages in classical Hodgkin lymphoma: Hormetic relationship to outcome. Sci. Rep. 2020;10:9410. doi: 10.1038/s41598-020-66010-z. [PMC free article] [PubMed] [CrossRef]
124. Oshi M., Angarita F.A., Tokumaru Y., Yan L., Matsuyama R., Endo I., Takabe K. High expression of Nrf2 is associated with increased tumor-infiltrating lymphocytes and cancer immunity in ER-positive/HER2-negative breast cancer. Cancer. 2020;12:3856. doi: 10.3390/cancers12123856. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
125. Rocha C.R.R., Rocha A.R., Silva M.M., Gomes L.R., Latancia M.T., Tomaz M.A., de Souza I., Monteiro L.K.S., Menck C.F.M. Revealing temozolomide resistance mechanisms via genome-wide CRISPR libraries. Cells. 2020;9:2573. doi: 10.3390/cells9122573. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
126. Angeli J.P.F., Meierjohann S. NRF2 dependent stress defence in tumor antioxidant control and immune evasion. Pigment Cell Melanoma Res. 2020;34:268–279. doi: 10.1111/pcmr.12946. [PubMed] [CrossRef] [Google Scholar]
127. Kojima S., Tsukimoto M., Shimura N., Koga H., Murata A., Takara T. Treatment of cancer and inflammation with low-dose ionizing radiation: Three case reports. Dose-Response. 2017;15:1–7. doi: 10.1177/1559325817697531. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
128. Kojima S., Cuttler J.M., Inoguchi K., Yorozu K., Horii T., Shimura N., Koga H., Murata A. Radon therapy is very promising as a primary or an adjuvant treatment for different types of cancers: 4 case reports. Dose-Response. 2019;17:1–9. doi: 10.1177/1559325819853163. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
129. Malkowski E., Sitka K., Szopinski M., Gieron Z., Pogrzeba M., Kalaji H.M., Zieleznik-Rusinowska P. Hormesis in plants: The role of oxidative stress, auxins and photosynthesis in corn treated with Cd or Pb. Int. J. Mol. Sci. 2020;21:2099. doi: 10.3390/ijms21062099. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
130. Sillen W.M.A., Thijs S., Abbamondi G.R., De La Torre Roche R., Weyens N., White J.C., Vangronsveld J. Nanoparticle treatment of maize analyzed through the metatranscriptome: Compromised nitrogen cycling, possible phytopathogen selection, and plant hormesis. Microbiome. 2020;8:127. doi: 10.1186/s40168-020-00904-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
131. Jalai A., de Oliveira J.C., Jr., Ribeiro J.S., Fernandez G.C., Mariano G.G., Trindade V.D.R., Dos Reis A.R. Hormesis in plants. Physiological and biochemical responses. Ecotoxicol. Environ. Saf. 2021;207:111225. doi: 10.1016/j.ecoenv.2020.111225. [PubMed] [CrossRef] [Google Scholar]
132. Checa J., Aran J.M. Reactive oxygen species: Drivers of physiological and pathological processes. J. Inflamm. Res. 2020;13:1057–1073. doi: 10.2147/JIR.S275595. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
133. Trejo-Tellez L.I., Garcia-Jimenez A., Escobar-Sepulveda H.F., Ramirez-Olvera S.M., Bello-Bello J.J., Gomez-Merino F.C. Silicon induces hormetic dose-response effects on growth and concentrations of chlorophylls, amino acids and sugars in pepper plants during early developmental stage. Peer J. 2020;8:e9224. doi: 10.7717/peerj.9224. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
134. Hackley R.K., Schmid A.K. Global transcriptional programs in archaea share features with eukaryotic environmental stress response. J. Mol. Med. 2019;431:4147–4166. doi: 10.1016/j.jmb.2019.07.029. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
135. Sprang A., Saw J.H., Jorgensen S.L., Zaremba-Niedz-wiedzka K., Matijn J., Lind A.E., van Eijk R., Schleper C., Guy L., Ettema T.J.G. Complex archaea that bridge the gap between prpkaryocytes and eukaryocytes. Nature. 2015;521:173–179. doi: 10.1038/nature14447. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
136. Agathokleous E., Kitao M., Calabrese E.J. New insights into the role of melatonin in plants and animals. Chem. Biol. Interact. 2019;299:163–167. doi: 10.1016/j.cbi.2018.12.008. [PubMed] [CrossRef] [Google Scholar]
137. Constantini D. Hormesis promotes evolutionary change. Dose-Response. 2019;17 doi: 10.1177/1559325819843376. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
138. Chirumbolo S., Bjorklund G. PERM hypothesis: The fundamental machinery able to elucidate the role of xenobiotics and hormesis in cell survival and homeostasis. Int. J. Mol. Sci. 2017;18:165. doi: 10.3390/ijms18010165. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
139. Rossnerova A., Izzotti A., Pulliero A., Bast A., Rattan S.I.S., Rossner P. The molecular mechanisms of adaptive response related to environmental stress. Int. J. Mol. Sci. 2020;21:7053. doi: 10.3390/ijms21197053. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
140. Agathokleous E., Kitao M., Calabrese E.J. Environmental hormesis and ist fundamental biological basis: Rewriting the history of toxicology. Environ. Res. 2018;165:274–278. doi: 10.1016/j.envres.2018.04.034. [PubMed] [CrossRef] [Google Scholar]
141. Perego M., Tyurin V.A., Tyurina Y.Y., Yellets J., Nacarelli T., Lin C., Nefedova Y., Kossenkov A., Liu Q., Sreedhar S., et al. Reactivation of dormant tumor cells by modified lipids derived from stress-actvated neutrophiles. Sci. Transl. Med. 2020;12:eabb5817. doi: 10.1126/scitranslmed.abb5817. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
142. Rodriguez-Cano A.M., Caldaza-Mendoza C.C., Estrada-Gutierrez G., Mendoza-Ortega J.A., Perichart-Perera O. Nutrients, mitochondrial function, and perinatal health. Nutrients. 2020;72:2166. doi: 10.3390/nu12072166. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
143. Wu Y., Song J., Wang Y., Wang X., Culmsee C., Zhu C. The potential role of ferroptosis in neonatal brain injury. Front. Neurosci. 2019;13:115. doi: 10.3389/fnins.2019.00115. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
144. Babich R., Hamlin H., Thayer L., Dorr M., Wie Z., Neilson A., Jayasundara N. Mitochondrial response and resilience to anthropogenic chemicals during embryonic development. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 2020;233:108759. doi: 10.1016/j.cbpc.2020.108759. [PubMed] [CrossRef] [Google Scholar]
145. Dietert R.R., Piepenbrink M.S. The managed immune system: Protecting the womb to delay the tomb. Hum. Exp. Toxicol. 2008;27:129–134. doi: 10.1177/0960327108090753. [PubMed] [CrossRef] [Google Scholar]
146. Alloo F., Arizpe L., Belford T.S., Clark J., Csanadi J., Davies P.J., George S., Hyden G., Jonsson U. The Bellagio Declaration: Overcoming hunger in the 1990’s. Dev. Dialogue. 1989;2:177–184. [PubMed] [Google Scholar]
147. Elvevoll E.O., James D. The emerging importance of dietary lipids, quantity and quality, in the global disease burden: The potential of aquatic resources. Nutr. Health. 2001;15:155–167. doi: 10.1177/026010600101500403. [PubMed] [CrossRef] [Google Scholar]
148. Kerac M., Blencowe H., Grijalva-Eternod C., McGrath M., Shoham J., Cole T.J., Seal A. Prevalence of wasting among under 6-month-old infants in developing countries and implications of new case definitions using WHO growth standards: A secondary data analysis. Arch. Dis. Child. 2011;96:1008–1013. doi: 10.1136/adc.2010.191882. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
149. Hill Y., Kiefer A.W., Silva P.L., Van Yperen N.W., Meijer R.R., Fischer N., Den Hartigh R.J.R. Antifragility in climbing: Determining optimal stress loads for athletic performance training. Front. Psychol. 2020;11:272. doi: 10.3389/fpsyg.2020.00272. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
150. Agathokleous E., Calabrese E.J. Environmental toxicology and ecotoxicology: How clean is clean? Rethinking dose-response analysis. Sci. Total Environ. 2020;746:138769. doi: 10.1016/j.scitotenv.2020.138769. [PubMed] [CrossRef] [Google Scholar]
151. Belz R.G., Duke S.O. Herbicides and plant hormesis. Pest Manag. Sci. 2014;70:698–707. doi: 10.1002/ps.3726. [PubMed] [CrossRef] [Google Scholar]
152. Zhang Y., Calabrese E.J., Zhang J., Gao D., Qin M., Lin Z. A trigger mechanism of herbicides to phytoplankton blooms: From the standpoint of hormesis involving cytochrome b559, reactive oxygen species and nitric oxide. Water Res. 2020;173:115584. doi: 10.1016/j.watres.2020.115584. [PubMed] [CrossRef] [Google Scholar]
153. Kino K. The prospective mathematical idea satisfying both radiation hormesis under low radiation doses and linear non-threshold theory under high radiation doses. Genes Environ. 2020;42:4. doi: 10.1186/s41021-020-0145-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
154. Devic C., Ferlazzo M.L., Berthel E., Foray N. Influence of individual radiosensitivity on the hormesis phenomenon: Toward a mechanistic explanation based on the nucleoshutting of ATM protein. Dose-Response. 2020;18 doi: 10.1177/1559325820913784. [PMC free article] [PubMed] [CrossRef] [Google Scholar]