L-Carnitine Tartrate Downregulates the ACE2 Receptor and Limits SARS-CoV-2 Infection
pubmed.ncbi.nlm.nih.gov/33919991/
公開日:2021年4月14日
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は、現代史上最悪のパンデミックの1つの原因となっている。SARS-CoV-2は現代史上最悪のパンデミックの原因となっており,既存の治療法を再利用したり,新薬やワクチンを開発したりすることで,いくつかの予防・治療戦略が立案・評価されている。本研究では、L-カルニチン酒石酸塩をヒトとげっ歯類に投与すると、主要な宿主依存因子であるアンジオテンシン変換酵素2(ACE2)膜貫通型プロテアーゼセリン2(TMPRSS2)フーリンが有意に減少することを示した。これらの因子は、ウイルスの付着、ウイルススパイクのSタンパク質の切断、ウイルスの融合と侵入の呼び水となる。興味深いことに、ヒト肺上皮細胞であるCalu-3に酒石酸L-カルニチンを前処理すると、SARS-CoV-2の感染が用量依存的に有意に抑制された。また、感染の抑制は、ACE2 mRNAの発現量の有意な減少と一致していた。これらのデータは、L-カルニチン酒石酸塩がSARS-CoV-2の感染を抑制する可能性について、ヒトでの適切な試験を行うべきであることを示唆している。
キーワード
L-カルニチン; SARS-CoV-2; COVID-19; 運動; 炎症; ACE-2; フーリン; TMPRSS2
1. はじめに
重症急性呼吸器症候群コロナウイルス(SARS-CoV-1およびSARS-CoV-2)は 2002年から 2004年にかけてのSARSパンデミックの原因であり、最近では2019年12月に中国武漢で最初に検出されたコロナウイルス感染症2019(COVID-19)パンデミックアウトブレイクの原因でもある[1]。この病気の急速な広がりにより、2021年3月中旬現在、220カ国で1億2,000万人以上が罹患し、260万人以上の死亡者が出ている[2]。SARS-CoV-2は空気感染するウイルスで,主に肺や上気道を侵し[2],最終的には肺の損傷や呼吸困難を引き起こし,重症の場合には死に至ることもある。
最近発表されたデータによると,世界には237の既知のワクチン候補があり,そのうち64が臨床評価中で,9が第3相臨床段階にある[3,4]。ファイザー・バイオンテック社とモデルナ社のmRNAベースのワクチンに始まり、最近ではジョンソン・エンド・ジョンソン社のシングルショット・アデノウイルス・ベクターベースのワクチンなど、いくつかのワクチンが成人用として承認されている[5]。事態の緊急性から、加速した臨床開発の道が辿られ[3,6]、その結果、ワクチンの受容性が低下した[6]。ワクチン以外にも,抗体[7,8]や抗ウイルス剤[9,10]など,多くの予防法や治療法が開発されている。
ワクチンなどの治療薬開発の主なターゲットとなっているSARS-CoV-2のスパイクタンパクは,アンジオテンシン変換酵素2(ACE2)受容体との結合を介してウイルスの細胞への付着を媒介する[11,12]。フーリンや膜貫通型プロテアーゼセリン2(TMPRSS2)などの細胞内プロテアーゼによってスパイクが切断されると,ウイルスは融合プロセスを経て侵入し,肺上皮細胞などの特定の標的細胞で複製する[11,12]。ヒト気道細胞では、フーリンによるS1/S2位置でのスパイク切断、およびフーリンとTMPRSS2によるS2’位置でのスパイク切断により、ウイルスタンパク質がプライム化され、ウイルスの融合と侵入が可能になる[13,14]。これらのプロテアーゼは、現在、多くのSARS-CoV-2治療薬の潜在的な標的として研究されている[14]。
ACE2の生理的役割は、炎症を起こすアンジオテンシンIIを抗炎症作用のあるアンジオテンシン(1-7)に変換することで、血圧を下げ、炎症に対抗することである[14]。アンジオテンシンIからアンジオテンシンIIへの変換は、ACE1によって行われる。ACE阻害剤は、高血圧や心不全の管理のための標準治療として、単剤または多剤で一般的に処方され、臨床現場で広く使用されている[15]。ACE1の増加やACE2の減少は、炎症状態の亢進を反映している可能性がある[16]。特に、進行したCOVID-19患者では、炎症反応のピークとそれに続くサイトカインストームが報告されているため[17]、ACE2を標的とした治療法を検討する際には、ACE1/ACE2比をより低く、つまりより抗炎症的になるようにバランスをとることが重要だ。
L-カルニチンは、様々な健康効果を期待して、主に栄養補助食品として使用されているアミノ酸様分子である[18,19,20]。L-カルニチンの基本的な役割は,脂肪酸をミトコンドリアマトリックスに輸送し,β酸化とクレブスサイクルによるエネルギー生成に利用できるようにすることである[21]。また、強力な抗酸化物質であり、抗炎症メディエーターでもある[22,23]。組織レベルでは、L-カルニチンは主に筋肉、心臓、肺の組織に蓄積される[24]。高齢者や慢性疾患(肥満、糖尿病、高血圧、心血管疾患など)を持つ人は、健康な人に比べて組織内のL-カルニチン濃度が著しく低いことがわかっている[25]。このような健康状態の悪い集団は、慢性的な炎症を起こしやすく、L-カルニチンを補給することでその症状が緩和されることが示されている[23]。さらに、L-カルニチンは、高血圧のネズミモデルにおいてACE1レベルを低下させることが示されており[26]、ウイルス感染に関しては、抗脂漏性効果によってC型肝炎感染を減少させることがわかっている。L-カルニチン酒石酸塩は,35年以上の安全性が確認されており,乳児用粉ミルクにも配合されている[24]。
本研究では,げっ歯類およびヒトの組織における主要な宿主依存因子(HDF)の発現に対するL-カルニチンの効果を評価し,SARS-CoV-2感染に対する影響を検討した。その結果、L-カルニチンは、運動誘発性の炎症を起こした後にのみ、ネズミの組織およびヒトの血清中のACE2,TMPRSS2,フーリンのレベルを低下させることがわかった。肺上皮細胞では、L-カルニチンはACE2レベルを低下させ、SARS-CoV-2感染を有意に抑制した。これらの結果は、L-カルニチンがヒトのSARS-CoV-2感染を緩和する有益な効果を持つ可能性を示唆しており、特に炎症を起こしやすい脆弱な人々にとって、L-カルニチンの補給はさらなる検討に値すると考えられる。
2. 材料と方法
2.1. 材料
L-カルニチン酒石酸塩(CarnipureTM酒石酸塩)は,米国ニュージャージー州モリスタウンのLonza社から提供された。
2.2. 細胞
培養ヒト気道上皮細胞(Calu-3)は、American Type culture Collection(ATCC)から入手し、10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシンを添加した50%ダルベッコ変法イーグル培地(DMEM)+50%ハムズF12培地で維持した。Vero E6細胞は,10% FBSおよび1%ペニシリン/ストレプトマイシンを添加したDMEM培地で維持した[27]。
2.3. 動物組織
異なる用量のL-カルニチン酒石酸塩を補充し,以前に記述したように運動療法を行ったラットから,肺,肝臓,筋肉,および血漿の組織を採取した[28]。すべての動物実験は,Firat University(Elazig, Turkey)の動物実験倫理委員会(2019/140-207)に準拠して実施した。
2.4. ヒトサンプル
21歳から65歳までの健康な男女で、活動的(すなわち、週3日、30分間の中程度の活動を行う)な被験者計80名を、2つのグループに無作為に割り付けた(IntegReview, Austin, TX, USA, Protocol #0220)。治療群には、3gのCarnipure酒石酸塩(L-カルニチン68%、酒石酸38%)から供給される2gのL-カルニチンを毎日補給し、プラセボ群には微結晶セルロースaを5週間投与した。7名の被験者が時間的制約により脱落した後、73名が試験を完了した。そのため,記述統計および統計解析には73名のデータを用いた(NCT04136821)。ヒト血清は、前頸部の静脈穿刺により静脈血から採取し、10 mLのEDTAバキュテイナーチューブ(BD Vacutainer®, Becton, Dickinson and Company, Franklin Lakes, NJ, USA)に集めた。血液サンプルは770×gで10分間、4℃で遠心分離した。その後,得られた血清サンプルを分注し,さらに分析するまで-80℃で保存した。これらの被験者の血清を用いて,C-reactive protein(CRP),ACE 1,ACE 2,TMPRSS 2,Tumor necrosis factor-α(TNF-α),およびfurinの分析を,試験開始時のベースライン,5週目,および運動負荷の48時間後に行った(Clinicaltrials.gov NCT04420377,2020年6月9日)。後者は、炎症刺激の代理として機能する。
2.5. 遺伝子発現
げっ歯類遺伝子の発現をqPCRで測定した。RNeasy 96 Universal kit (Qiagen, Tokyo, Japan)を用いて、凍結した組織サンプルから製造元の指示に従ってトータルRNAを抽出した。ランダムプライマーを含むhigh-capacity reverse transcription cDNA kit (Qiagen, Valencia, CA, USA)を用いて、500 ngのトータルRNAからcDNAを合成した。リアルタイム定量RT-PCRは、YBR(Qiagen, Hilden, Germany Catalog No.330620)と遺伝子特異的プライマーを用いて行った。内部コントロールとして,グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)を用いた。齧歯類遺伝子の増幅に用いたプライマーは,ACE1:5′-AGCATCACCAAGGAGAACTA-3′(順方向),5′-ACTGGAACTGGATGATGAAG-3′(逆方向),ACE2:5′-GCTCCTGCTGGCTCCTTCTCA-3′(順方向),5′-GCCGCAGCCTCGTTCATCTT-3′(逆方向),TMPRSS2.5′-CACCTGCCATCCATACAG-3′(フォワード),5′-CCAGAACTTCCAAAGCAAGC-3′(リバース),フーリン: 5′-ACTAA CACTG TGCCC TGGTG GAG-3′(フォワード)5′-ACCCT GGACA GGTAG GTTGG GTA-3′(リバース)GAPDH:5′-TGGTGAAGCAGGCATCTG-3′(フォワード)5′-TGGTGAAGCAGGCATCTG-3′(リバース)。ヒトCalu-3の遺伝子発現を定量化するために,12ウェルプレートに細胞を播種し(22万個),50,100,500,750,1000μMのL-カルニチンで24時間処理した。RNAは標準プロトコルに従ってTRIzol(Qiagen社)を用いて抽出し,SuperScript II RT(Invitrogen社)を用いて全RNAを逆転写した。ACE1,ACE2,TMPRSS2の発現量は,遺伝子特異的プライマーを用いたSYBRリアルタイムPCR法で評価した(ACE1のプライマーは[29],ACE2とTMPRSS2のプライマーは[11]による。内部コントロールとして,ヒトGAPDHを用いた。GAPDHのプライマーは以下の通りであった。5′-GCCATCAATGACCCCTTCATT-3′(フォワード)および5′-TGACGGTGCCATGGAATTT-3′(リバース)であった。未処理の細胞に対する発現のフォールドチェンジを、標準的なddCt法を用いて求めた。
2.6. げっ歯類の組織サンプルを用いたウェスタンブロット
同一実験群のげっ歯類組織サンプルをプールして,タンパク質分析を行った。全タンパク質(20μg)をMini-Protean TGXゲル電気泳動で分離し,Trans-Blot turbo transfer system(Bio-Rad, Life Sciences Research, Hercules, CA, USA)を用いてニトロセルロース膜に転写し,特異的一次抗体(Santa Cruz Biotechnology, Inc. 免疫反応シグナルは、西洋ワサビペルオキシダーゼで標識したヤギ抗ウサギ(Santa Cruz Biotechnology, Inc. 血清中のC反応性タンパク質(CRP)およびインターロイキン6(IL-6)のレベルは、市販の酵素結合免疫吸着アッセイ(ELISA)キット(Abcam,Cambridge,MA,USA)を用いて、製造者の説明書およびマイクロプレートリーダー(Bio-Tek Elx800 Universal,Bio-Tek Instruments,Inc.,Winooski,VT,USA)に従って測定した。
2.7. ヒト血清のELISAとL-カルニチンの分析
ヒト血清中のACE1,ACE2,TMPRSS2,フーリンタンパク質レベルは,市販のELISAキットを用いて,製造者の推奨に従って評価した。ACE1 (R&D Systems Inc., Minneapolis, MN, USA)、ACE2 (RayBiotech Inc., Peachtree Corners, GA, USA)、TMPRSS2 (Novus Biologicals, Littleton, CO, USA)、CRP (R&D Systems Inc., Minneapolis, MN, USA)、TNF-α (Novus Biologicals)、フーリン (Sigma Aldrich, St. Louis, MO, USA)。血清サンプルからの総カルニチン、遊離カルニチン、およびアセチルカルニチンは、製造者の推奨に従ってUV検出器付きHPLCで分析した(Sigma Aldrich, St.Louis, MO, USA)。
2.8. 細胞の生存率に対するL-カルニチンの影響
96ウェルプレートに播種したCalu-3細胞(30,000個)を、CarnipureTM酒石酸塩として提供される50,100,250,500,1000μM、および10mMのL-カルニチンで処理した。処理後24時間、48時間、または72時間後に培地を除去し、製造者の推奨に従って標準的なMTTアッセイを行った(Invitrogen社、Cat # M6494)。ビヒクルのみで処理した細胞をネガティブコントロールとして使用した。吸光度は、マイクロプレート分光光度計を用いて595nmで読み取った。CC50は、GraphPad Prism V5.0ソフトウェア(GraphPad Software, Inc., San Diego, CA, USA)を用いた非線形回帰により算出した。
2.9. SARS-CoV-2
SARS-CoV-2ウイルスは、もともとカナダのケベック州のCOVID-19患者から分離されたもので、LSPQ1亜種と呼ばれている。この患者のウイルスを増幅し、プラークアッセイを用いてVero E6で力価を測定した。感染性SARS-CoV-2ウイルスを含むすべての実験は、SARS-CoV-2作業用に事前に承認されたバイオセーフティレベル3の実験室の指定されたエリアで行った。
2.10. Vero E6を用いたプラークアッセイ
Vero E6細胞(1.2×105細胞/ウェル)を、感染の36時間前に10%FBSを添加したダルベッコ変法イーグル培地(DMEM)を用いて24ウェル組織培養プレートに4倍に播種した。SARS-CoV-2を含むウイルス上清の10倍連続希釈液(10-2-10-6)を最大6回、37℃で1時間かけて細胞に感染させた(感染量200μL)。1時間の間、プレートは15分ごとに手動で揺らした。その後、ウイルスを除去し、細胞を洗浄し、重ね合わせた培地(DMEMに10%FBSを加えた0.6%低融点アガロースを含む)を加え、37℃で60〜65時間、乱さずに培養した。インキュベーション後、細胞を4%ホルムアルデヒドで固定し,0.25%クリスタルバイオレット(30%メタノールで調製)で染色した。高解像度のDLSRカメラ(Nikon model: D80, objective: AF Micro-Nikkor 60 mm f/2.8D)を用いて,高品質のプラーク写真を撮影した。プラークのカウントは手作業で行い,並行して,画像化したプラークプレートを処理し,自動アルゴリズムベースのMatlabソフトウェア(IRCMのMicroscopy platformが開発)を用いてプラークを計数した。ウイルス力価は,1mlあたりのプラーク形成単位(PFU/mL,プラーク数×ウイルスの希釈倍率×1000/感染に用いたウイルス希釈液の容量(単位:µL))で表した。感染の多重度(MOI)は次のように表される。MOI = 感染に使用したウイルスのPFU/細胞数。
2.11. SARS-CoV-2による細胞感染に対するL-カルニチンの効果
Calu-3細胞を12ウェルプレートに重複して播種し(2.3×105細胞/ウェル)一晩培養した。その後、350μLの無血清DMEMを用いて、37℃で3時間、MOI 0.01および0.1のSARS-CoV-2ウイルスに感染させたが、時折プレートを手動で揺らした。コントロールとして、細胞+培地のみを使用した。培養後、ウイルスを除去し、細胞の単層をPBSおよび無血清DMEMで2回連続して洗浄した。続いて、前述の濃度のL-カルニチンを含む新鮮な培地(合計1mL)を細胞に加えた。感染後12時間、24時間、および48時間に、細胞を含まない上清(250μL)を除去した。感染後24時間目にL-カルニチンとIFN-2aを補充した。ウイルス上清は、今後使用するまで-80℃で保存した。上澄み液中のウイルス産生量は、上述のようにVero E6細胞のプラークアッセイを用いて定量した。3連で行ったプラークアッセイで定量したウイルス力価(PFU/mL)は,平均±標準偏差で表した。
L-カルニチン存在下でのプラークの割合は、ウイルス単独群を100%とした場合の相対値で表した。データは非線形回帰モデルを用いてフィットさせ,方程式log inhibitor vs. variable slope(4つのパラメータ)を用いて,GraphPad Prism V5.0ソフトウェア(GraphPad Software, Inc., San Diego, CA, USA)で半減期最大阻害濃度(IC50)値を求めた。
2.12. 統計解析
血清マーカーを分析するために、条件をグループ間因子(L-カルニチン対プラセボ)時間をグループ内因子(ベースライン、5週目の運動負荷前および48時間後)被験者を無作為因子とした二元混合分散分析(ANOVA)を用いて従属変数を精査した。有意なF値が得られた場合には,多重比較のためのボンフェローニ補正を用いて,ポストホック検定を行った。ANOVAでは,分散と共分散の均一性をそれぞれLeveneの検定とBoxのM検定で確認した。さらに,Mauchlyの球形性の検定を用いて,二元交互作用の球形性の仮定を検定した。すべての解析において,αレベルは事前にp < 0.05と設定した。データは、特に記載のない限り、平均値±標準誤差で示した。げっ歯類の組織検査におけるマーカーの変化を比較するために、ANOVAおよびTurkey’s post-hoc testを用いた。必要に応じて、ノンパラメトリックMann-Whitney’s U-test(両側検定)を用いて、2つの治療グループ間のランクを比較した。ヒトとCalu-3の実験はGraphPad Prism(Prism, San Diego, CA, USA, Calu-3はVersion 5,ヒトのバイオマーカーはVersion 8)を、ネズミのデータはSPSS統計プログラム(IBM, SPPS Version 21, Armonk, New York: IBM Corp, Armonk, NY, USA)を用いて分析した。
3. 結果
3.1. げっ歯類組織におけるACE1, ACE2, TMPRSS2, フーリンの発現量
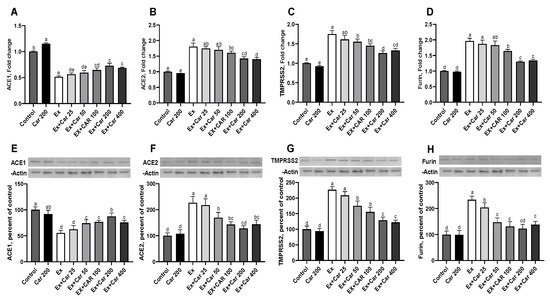
炎症刺激となる高度なトレーニングを行ったげっ歯類に,異なる用量のL-カルニチンを6週間にわたって経口投与した[28]。使用したL-カルニチンの用量25, 50, 100, 200, 400 mg/kgは,それぞれヒトの1日あたりの投与量250, 500, 1000, 2000, 4000 mgに相当する。ACE1, ACE2, TMPRSS2, フーリンのmRNAレベルを,肺,筋肉,肝臓の組織で評価した(図1A-D,補足図S1)。運動なしのコントロールと比較して、運動コントロール群では、すべての組織でACE2,TMPRSS2,フーリンのmRNAレベルが統計的に有意に増加した(図1A-D、補足図S1,組織によってACE2とTMPRSS2は約2〜3倍、フーリンは約1.5〜2倍)。L-カルニチンを投与すると、ACE2,TMPRSS2,フーリンの濃度が用量依存的に低下し、運動していないときと比較して200mg/kgの用量で最大の効果を示した。ACE1は、運動により有意に減少し、L-カルニチンの補給により、対照レベルには達しないものの、運動との併用でわずかに増加した(図1A、補足図S1)。タンパク質レベルの評価では、mRNAの効果を真似て、ACE2,TMPRSS2,フーリンが運動により増加し、L-カルニチンの補給によりベースラインのコントロールに近い状態に戻り、200mg/kgで最大の効果が得られた(図1F-H、補足図S2)。ACE1タンパク質レベルは、mRNAと同様のパターンを示し、肺だけでなく、肝臓や筋肉組織でも、運動により減少し、L-カルニチンにより増加した(図1E、補足図S2)。さらに、ヒトのバイオマーカーのデータと比較するために、血清中のこれらのマーカーも評価した。図2に示すように、L-カルニチンを補給すると、運動療法に加えてACE1,ACE2,TMPRSS2タンパク質が40%から50%減少した(図2)。血清中のACE1/ACE2比は運動により有意に低下し、L-カルニチンの補給によりこの比は一部回復した(図2)。運動により、ACE2,TMPRSS2,フーリンが増加し、ACE1が減少した。これらの変化は、図2E,Fに示すように、運動中のELISAによるCRPおよびIL-6炎症マーカー測定で判定される炎症の増加と一致した。L-カルニチンを補給すると、CRPとIL-6の減少で示されるように、運動による炎症が減少した。また、L-カルニチンによる炎症の減少は、運動をしていなくても認められた(図2E,F)。
図1 ネズミの肺におけるアンジオテンシン変換酵素1(ACE1)アンジオテンシン変換酵素2(ACE2)膜貫通型プロテアーゼセリン2(TMPRSS2)およびフーリンの発現に対するL-カルニチンの効果
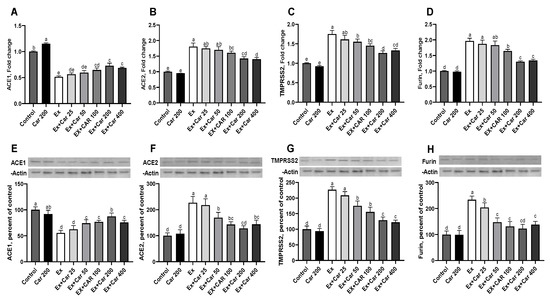
コントロール群に対するmRNAおよびタンパク質レベルのフォールドチェンジ。ACE1(A)ACE2(B)TMPRSS2(C)フーリン(D)のmRNAレベルとそれぞれのタンパク質(E-H)。タンパク質の発現はβ-actinで正規化した。統計的比較は、異なる上付き文字で示した(a-d);プロット内(p < 0.05, ANOVA, Tukey’s post-hoc test)。異なる文字は統計的な違いを示す。独立した3回の分析の平均±SDを示す。対照群。Car: L-カルニチン;Ex:運動。
図2 げっ歯類におけるACE1(A)ACE2(B)ACE1/ACE2比
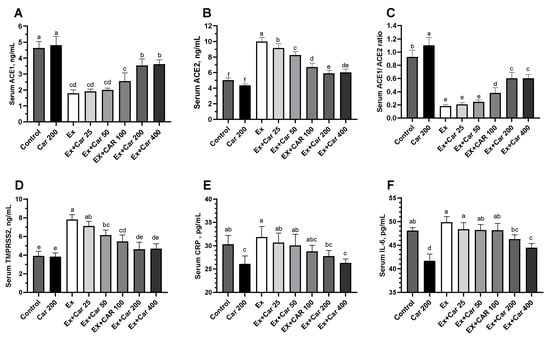
(C)TMPRSS2(D)C-reactive protein(CRP)(E)interleukin 6(IL-6)(F)の血清タンパク質濃度。統計的比較は異なる上付き文字で示した(a-f);プロットでは(p < 0.05, ANOVA, Tukey’s post-hoc test)。異なる文字は統計的な違いを示す。独立した3回の解析の平均±SDを示す。対照群。Car: L-カルニチン、Ex:運動。
3.2. 血清中のACE1, ACE2, TMPRSS2, フーリン, CRP, TNF-αの変化
様々なバイオマーカーに対するL-カルニチンの効果を評価するために、ヒト試験の参加者73名の血清をベースライン時、5週間のサプリメント摂取後、および運動チャレンジの48時間後に採取した。図3Aは、運動もL-カルニチン単独も、ACE1の血清レベルに影響を与えなかったことを示している。逆に、プラセボ投与群では、運動によってACE2,フーリン、TMPRSS2のレベルが有意に上昇したが、L-カルニチン投与群では、タンパク質レベルは運動前のベースラインレベルと同程度であった(図3B-D)。ポストホック解析の結果、プラセボ投与群では運動負荷後48時間目にACE2,TMPRSS2,フーリンがベースラインおよび5週目に比べて上昇したが、L-カルニチン投与群では上昇しなかった。両群間の差は有意であった(図2B-D)。L-カルニチンを投与しない運動時にはACE2が有意に増加し、ACE1レベルには変化がなかったにもかかわらず、全体のACE1/ACE2比の変化はいずれの群でも統計的有意性に達しなかった(図3E)。事後解析の結果、運動後5週間の時点で、プラセボ投与群または運動前のベースラインと比較して、L-カルニチン投与群ではCRPレベルが有意に低下していた(図3F)。運動もL-カルニチン補給も、TNF-αレベルには影響を与えなかった。観察されたすべての効果は、L-カルニチンの補給と相関していた。アセチルフリーおよび総血清カルニチン濃度は、補給により有意に増加した(補足図S3)。
図3 ヒトにおけるACE1,ACE2,TMPRSS2,フーリン,CRPおよびTNF-αの血清濃度に対するL-カルニチンの影響
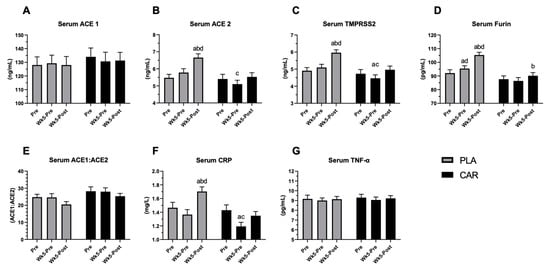
L-カルニチン補充群(CAR、黒棒)およびプラセボ群(PLA、灰色棒)におけるベースライン時(30)補充5週間後(Wk5-pre)および運動負荷後48時間後(Wk5-Post)のACE1(A)ACE2(B)TMPRSS2(C)フーリン(D)ACE1/ACE2比(E)CRP(F)およびTNF-α(G)の血清濃度。有意差(p<0.05)を示し、a:ベースラインとの差、b:運動前との差、c:運動後との差、d:グループ間の差。
3.3. ヒトCalu-3細胞におけるAce1,Ace2およびTmprss2の発現に対するL-カルニチンの効果
L-カルニチンがヒト肺由来上皮細胞であるCalu-3細胞のACE2およびTMPRSS2の発現レベルを調節できるかどうかを評価するために、まず生存率測定を行ったところ、L-カルニチンはこのモデル細胞株において、様々な濃度(最大10mM)で72時間処理しても検出可能な毒性を示さなかった(補足図S4)。Calu-3細胞をL-カルニチンに24時間曝露すると、50μMから始まるすべての濃度でACE2 mRNAのレベルが一貫して減少し(図4A)1000μMでは4.5倍に減少した(未処理細胞の1に対する相対値0.22±0.18)。ACE1(補足図S5A)およびTMPRSS2(補足図S5B)に対するL-カルニチンの効果は、試験した異なる用量ではあまり決定的ではなかった。ACE1では、100 μMのL-カルニチンでのみ、mRNAの発現が統計的に有意に増加したが、1000 μMのL-カルニチンでは発現が減少した。TMPRSS2については,低濃度のL-カルニチンでmRNAレベルの増加が認められたが(50μMで平均1.5±0.3倍,100μMで平均5±3.1倍),その後500μMで2倍以上の有意な減少が見られ,未処理のCalu-3のレベルに戻った(補足図S5B)。L-カルニチンはフーリン mRNAの発現レベルに影響を与えなかった(データは示さず)。
図4.ACE2 mRNAおよび重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)によるCalu-3感染に対するL-カルニチンの用量依存性効果
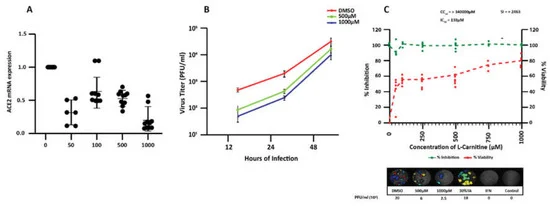
(A)RT qPCRにより測定したCalu-3におけるACE2のmRNA発現レベル。Calu-3細胞を無処理、または指示濃度のL-カルニチンで24時間処理した。表示されているのは、独立した3つの分析の平均±SDで、重複して行われた。統計解析。統計解析:Mann-Whitney’s test. B)感染後12時間、24時間、48時間後の複製動態をプラークアッセイで調べ、L-カルニチンを投与した場合としなかった場合の感染細胞からの感染性ウイルスの放出を調べた。折れ線グラフは、2つの生物学的複製で行った4重のプラークアッセイの結果を示す(平均±SD)。C)各濃度のL-カルニチンで処理した感染細胞におけるSARS-CoV-2の力価(感染後24時間)の阻害率を、4重に行ったプラークアッセイで測定した(各点は複製を表す)(上段)。左のY軸は、未処理のDMSO処理群に対するウイルス力価の抑制率(%)を示す[21]。右のY軸は,DMSO処理群(緑色)に対する細胞生存率(パーセント)を示す.L-カルニチンのCC50(50%細胞毒性濃度),IC50(半最大抑制濃度),SI(選択性指数,CC50/IC50で決定)の値は,図の通り。下段には,L-カルニチンの濃度を変化させて感染させたCalu-3細胞の代表的なプラーク画像を示した。内部コントロールとして酒石酸(TA)30%およびIFN-2aを用いた。*, **, *** 統計学的に有意である。
3.4. Calu-3におけるSARS-CoV-2感染に対するL-カルニチンの効果
L-カルニチンがCalu-3細胞のACE2発現を低下させたことを考慮し、この受容体レベルの低下がCalu-3細胞のSARS-CoV-2感染に対する感受性を変化させるかどうかを評価した。この目的のために、Calu-3細胞をさまざまな濃度のL-カルニチン(50〜1000μM)で24時間前処理した後、SARS-CoV-2ウイルスをMOI 0.01で感染させた。感染後12時間および24時間の時点で、500μMおよび1000μMのL-カルニチンで前処理した場合、未処理の細胞に比べてウイルスの力価が有意に低下した(約1log)(図3B)。感染後24時間後のプラークアッセイ分析では,L-カルニチンが子孫ウイルスの力価を50μMで少なくとも40%,1000μMで最大約80%低下させる効果があり(図4C),IC50は138μM,選択性指数(SI)は2463を超えた[31](図4C)。
この結果から、L-カルニチンを投与すると、Calu-3細胞のSARS-CoV-2感染に対する感受性が著しく低下することが明らかになった。これは、細胞表面上のウイルス受容体ACE2の発現を低下させることによるものと考えられる。
4. 考察
本研究の目的は、Calu-3細胞モデルにおいて、L-カルニチンの補給がウイルスの侵入と病原性に重要な宿主因子(ACE2,TMPRSS2,フーリン、ACE1/ACE2比)のレベルに与える影響と、SARS-CoV-2感染に対する影響を調べることである。まず、血清および組織中のACE2,TMPRSS2,フーリンの濃度は、L-カルニチンによって有意に低下したが、運動誘発性の炎症の後にのみ低下することがわかった。この減少は、げっ歯類およびヒトの血清中のCRPレベルの低下に見られるように、炎症の抑制と一致していた。次に、ヒト肺由来上皮細胞株であるCalu-3におけるSARS-CoV-2感染に対するL-カルニチンの前処理の効果を評価した。その結果、L-カルニチンの前処理により、Calu-3のSARS-CoV-2感染感受性が低下した。これは、ウイルス受容体ACE2の発現が低下し、ウイルスの付着が減少したことによると考えられた。しかし、Calu-3では、L-カルニチンを前処理してもTMPRSS2とフーリンのレベルは低下しなかった。齧歯類およびヒトのバイオマーカーと、Calu-3の細胞ベースのアッセイとの間に観察されたこれらの違いは、Calu-3に炎症刺激が含まれていないことで説明できる可能性がある[32]。また,炎症以外の別の作用機序が,生体内で観察された結果をもたらした可能性もある。L-カルニチンの生理的な役割は,脂肪酸を細胞膜およびミトコンドリア膜を通して輸送し,ミトコンドリアのクレブスサイクルでエネルギー源として利用することである[21]。このミトコンドリア活性の向上は,ネズミの血清中の乳酸濃度の低下によって示された[28]。最近,L-カルニチンが核内受容体であるHNF4-αと物理的に結合し,そのレベルを上昇させることが報告されている[33]。HNF4-αは、ACE2レベルを低下させることが示されており[32,34]、L-カルニチンによるACE-2のダウンレギュレーションのメカニズムの可能性を提供している。
ACE2レベルは、特に肺胞細胞で上昇することが示されており、これが肺感染症のウイルス特異性を説明している可能性がある[34]。さらに、II型糖尿病[17]、高血圧[2]、肥満[35]、一般的な老化や虚弱[36,37]などの炎症性疾患状態は、SARS-CoV-2による死亡率の主要な危険因子であることが知られており、炎症の増加を介している可能性が高い。炎症状態では肺や血漿中のACE2濃度が高くなることが知られており[34]、上記のような状態にある人々の細胞がSARS-CoV-2に感染しやすくなると考えられる。L-カルニチンは、炎症プロセスにおいて調節的な役割を果たすことが報告されており[22,23,38]、L-カルニチンの補給は、高齢者や様々な炎症性疾患の状態で発生するような、L-カルニチン濃度が比較的低い集団において有益な効果をもたらす[25]。
過酷な有酸素運動とレジスタンス運動は、どちらも一過性(96時間未満)に筋肉の酸化ストレスと機械的損傷を増加させ[39]、それによって炎症を促進することが示されている[40]。運動によって誘発された炎症は、ACE2レベルを増大させ[41]、抗炎症作用のあるアンジオテンシン-(1-7)を生成することで、炎症の抑制につながる[14]。実際、CRP濃度は、運動の結果、ベースラインの168%まで上昇し[42]、2日後には253%とピークに達する[42]。我々の研究では、運動による炎症によって、ACE2とCRPの血清レベルも上昇したが、L-カルニチンの補給によって緩和された。興味深いことに、スポーツ選手は、SARS-CoV-2感染による合併症のリスクが高く、最終的には肺や心臓の損傷につながることが報告されている[43]。このSARS-CoV-2感染症に対するアスリートの感受性の高まりは、運動によって肺や筋肉細胞のACE2受容体のレベルが上昇することと関連していると考えられる。今後の研究では、L-カルニチンの補給が、このような人々のSARS-CoV-2感染症に対する感受性を低下させる可能性があるかどうかを検討することができる。
ACE2の生理的役割は、炎症を引き起こすアンジオテンシンIIを抗炎症作用のあるアンジオテンシン(1-7)に変換することで、血圧を下げ、炎症に対抗することである[5]。アンジオテンシンIからアンジオテンシンIIへの変換は、ACE1によって行われる。ACE1の増加またはACE2の減少は、有害なサイトカインストームを経験した進行した疾患のCOVID-19患者に特徴的な炎症状態の増加を反映している可能性がある[36]。実際、高血圧患者が、レニン・アンジオテンシン系(RAS)を標的としたACE1やアンジオテンシン受容体拮抗薬(ARB)で治療を受けると、ACE1/ACE2比が上昇し、SARS-CoV-2感染症の悪化につながる可能性があることが報告されている[44]。したがって、ACE2を低下させる治療法は、ACE1/ACE2比を低下させるか、上昇させない方法で行う必要がある[36]。私たちは、L-カルニチンが肺や筋肉組織のACE1/ACE2比をより抗炎症的な状態にシフトさせる一方で、ヒトでは同じ比を維持することを発見した。これらのデータは、L-カルニチンが、ヒトで見られる炎症による筋力低下や肺の損傷を軽減する可能性を示唆している。最後に、我々のデータは、L-カルニチンの前処理がACE2の発現を減少させ、Calu-3肺上皮細胞における感染性ウイルス粒子の産生を抑制することを示している。
5. 結論
本研究では、L-カルニチンの補給が、げっ歯類およびヒトにおいて、運動誘発性炎症後のSARS-CoV-2受容体ACE2およびウイルス侵入に必要なプロテアーゼ(TMPRSS2およびフーリン)の発現を低下させるという証拠を示した。また、L-カルニチンの補給は、SARS-CoV-2の感染に対するヒト肺上皮細胞の感受性を有意に低下させた。L-カルニチンが35年以上にわたって使用されてきた優れた安全性を考慮すると[24]、ヒトにおけるSARS-CoV-2感染および合併症の予防におけるL-カルニチンの潜在的な有益性について、今後の調査が望まれる。しかし、今回の研究の限界として、ヒトおよびげっ歯類の組織ではTMPRSS2およびフーリンの減少が観察されたにもかかわらず、Calu-3細胞ではTMPRSS2およびフーリンへの影響が見られなかったことが挙げられる。これは、細胞ベースのアッセイをげっ歯類やヒトの知見に翻訳することの限界を示している。L-カルニチンの投与は、試験管内試験でヒト肺上皮細胞のSARS-CoV-2感染に対する感受性を低下させたが、この効果がACE2のダウンレギュレーションのみによるものなのか、それともウイルスの侵入を阻害するものなのかは、まだ明らかになっていない。
www.mdpi.com/article/10.3390/nu13041297/s1, Figure S1: Effect of L-carnitine on mRNA of ACE1, ACE2, TMPRSS2 and フーリン in rodent muscle and liver tissues. 図S2:ネズミの筋肉および肝臓におけるACE1,ACE2,TMPRSS2およびフーリンのmRNAに対するL-カルニチンの影響。図S3: ヒト血清中のアセチルカルニチン、遊離カルニチン、総カルニチン濃度に対するL-カルニチン補給の効果。図S4: Calu-3細胞の生存率に対するL-カルニチンの効果。図S5:Calu-3細胞におけるACE1およびTMPRSS2の発現に対するL-カルニチンの用量依存性の効果。