Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7655491/
ウイルス感染症に対するケフィアサプリメントの作用機序
要旨
コロナウイルス病2019(COVID-19)は、「重症急性呼吸器症候群コロナウイルス2′(SARS-CoV-2)」と呼ばれる最近発見されたコロナウイルスによって引き起こされる感染症である。何人かの学者がCOVID-19を克服するために抗ウイルス剤や化合物をテストしていた。
‘ケフィア’は、ケフィアの粒から作られた薄いヨーグルトに似た発酵乳飲料である。ケフィアおよびそのプロバイオティクスの内容物は、ウイルス(例えば、ジカ、C型肝炎、インフルエンザ、ロタウイルス)からの感染を抑制するために、免疫系を変調させることができる。
ケフィアの抗ウイルス機構は、マクロファージ産生の増強、貪食細胞の増加、クラスター分化陽性(CD4+)CD8+、免疫グロブリン(Ig)G+およびIgA+のB細胞、T細胞、好中球、ならびにサイトカイン(例えば、インターロイキン(IL)-2,IL-12,インターフェロンγ-γ)の産生を促進することを含む。
ケフィアは、IL-6,IL-1,TNF-α、およびインターフェロン-γの発現を減少させることにより、抗炎症剤として作用し得る。したがって、ケフィアは、COVID-19に寄与する「サイトカインストーム」の有意な阻害剤である可能性がある。
ここでは、ケフィアの摂取とその微生物組成のウイルス感染に対する効果に特に重点を置いたいくつかの研究をレビューするとともに、免疫応答の調節を介したSARS-CoV-2感染に対する保護補助食としてのケフィアのさらなる発展について議論する。
1. はじめに
ウイルス感染は人の生命を脅かす可能性がある[1]。呼吸器の急性感染は、ウイルス、真菌、細菌と関連しており、成人、小児、免疫不全者に罹患率と死亡率を引き起こす[2]。
パラミクソビル科、オルソミクソビル科、アデノビル科、ピコルナビル科、コロナビル科のウイルスは、呼吸器感染症を引き起こす可能性がある。コロナウイルス科に属するウイルスは、エンベロープと一本鎖RNAを有する。コロナウイルス(CoV)は最大のRNAゲノム(30kB)を持ち、ヒトや動物に感染する[3,4]。CoVは小児だけでなく、高齢者や慢性疾患を持つ人の下気道にも感染する可能性がある[5]。また、CoV感染は、消化器系、呼吸器系、肝系、中枢神経系の障害を引き起こす可能性がある[6,7]。
CoVは 2012年にサウジアラビアで発生した中東呼吸器症候群(MERS)や 2002~2004年に中国で発生した重症急性呼吸器症候群(SARS)の主な原因であった[[8], [9], [10]。SARSに関連する異なるCoVは、リザーバー宿主としてコウモリで研究されてきた[7,11,12]。
2019年12月12日、武漢(中国湖北省)で肺炎をもたらす新しいCoVによる感染が認められた[13]。この新しいCoVは、全ゲノムのシークエンスを行ったところ、コウモリ由来のCoVと96%の類似性を有することが判明した[14]。世界保健機関(WHO)は 2020年2月11日にこの新しいCoVを「重症急性呼吸器症候群コロナウイルス2′(SARS-CoV-2)」と命名した。SARS-CoV-2は最初に中国でパンデミックし、世界中に広がった。WHOは、SARS-CoV-2の感染によって生じる病気を「コロナウイルス病2019′(COVID-19)」と命名した。2020年10月25日現在、COVID-19は世界で42,624,910人の確定症例と1,149,928人の死亡をもたらしている[15]。
ウイルス感染症と戦うために使用される戦略は、感染した患者を治療するための適切なワクチンまたは有効な抗ウイルス薬の開発である[16]。ほとんどのワクチンの作用機序は、インターフェロン(IFN)-γ、インターロイキン(IL)-2,IL-12などの異なるサイトカインを産生するTヘルパー1型(Th1またはクラスター分化(CD)4+)細胞の促進である。後者は、キラーT細胞の成熟を刺激し、ナチュラルキラー(NK)細胞の細胞毒性を高め、ウイルス感染細胞を特定して破壊する [17]。Buismanら[18]は、ワクチンが免疫グロブリン(Ig)Aの産生を誘導して体を保護することを報告している。抗ウイルス薬の作用機序は、主に免疫系の増強、標的細胞へのウイルス付着の抑制、または複製ステップの停止に基づいている[16]。
COVID-19に対する有効な薬剤またはワクチンは利用できない。しかし、細心の衛生管理と免疫系のサポートは予防戦略として可能である。したがって、現在利用可能な抗ウイルス薬(例えば、インフルエンザウイルス)はSARS-CoV-2に対して有効ではないため、免疫系を強化し、SARS-CoV-2の活性を抑制するための適切な化合物を発見するための研究が緊急に必要とされている[19,20]。
天然物は、免疫系を強化し、ウイルス感染を抑制する可能性がある。「ケフィア」は、ケフィアの粒から作られた薄いヨーグルトに似た発酵乳飲料である。ケフィアは、健康的なプロバイオティクス(すなわち、腸内細菌叢を改善/回復することによって摂取された場合に健康上の利点を提供することができる生きた微生物)として世界的に受け入れられており、商業規模で製造されている[21]。人間の健康に関しては、ケフィアは抗ウイルス性、抗菌性、および抗炎症性の可能性を持っている。ケフィアは、アンジオテンシン変換酵素(ACE)レベル、コレステロール代謝を阻害し、創傷治癒を促進し、腫瘍成長を抑制し、免疫系に変化をもたらし、喘息症状やアレルギーを改善することが示されている[22], [23], [24], [25]。ケフィアおよびケフィア誘導体(例えば、多糖類、タンパク質、ペプチド)は、免疫系応答を調節することにより、および/またはウイルス接着の破壊を引き起こすことにより、ウイルス活性を抑制することができる[26,27]。それらはまた、IL-1β、腫瘍壊死因子(TNF)-αおよびIL-6などの炎症性サイトカインの活性を阻害することにより、抗炎症剤としても作用する[27]。したがって、ケフィアとその副産物は、ウイルス感染症に対する保護剤として採用される可能性がある。
本レビューでは、ケフィアとその副産物の抗ウイルス機序に焦点を当てている。SARS-CoV-2などのウイルスに対するケフィアの可能性についていくつかの提案がなされており、研究者がこの天然物に基づいて抗ウイルス活性をスクリーニングするのに役立つ。
2. CoVID-19の病原性
COVID-19の発症機序については,まだ十分な理解が得られていない.しかし、SARS-CoVやMERS-CoVの感染様式と比較することで、SARS-CoV-2による感染を理解するためのヒントが得られるかもしれない。
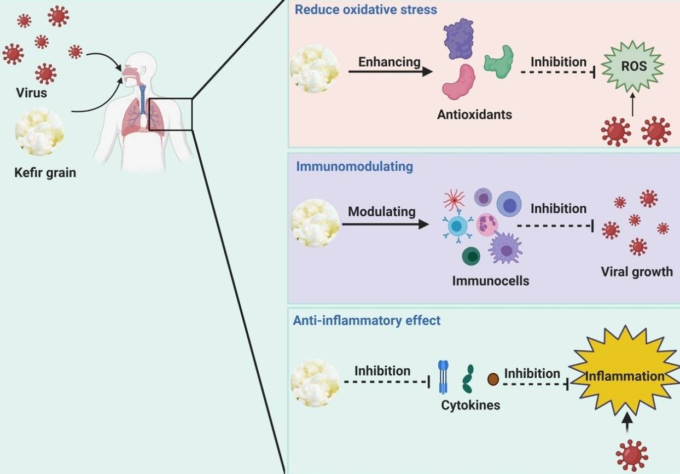
CoVの組み立てと感染には、4つの構造タンパク質が用いられている。ウイルスと宿主の接着に関与するタンパク質は、「スパイク」(S)糖タンパク質である[28]。膜(M)タンパク質は、ウイルスの形状、湾曲した膜、およびヌクレオカプシドの結合を担当している[29]。ウイルスの放出と病原性はエンベロープ(E)タンパク質の役割である[30,31]。ウイルスのRNAゲノムの結合はヌクレオカプシド(N)タンパク質の役割であるが、ウイルスの複製にも重要な役割を果たしている(図1 )[32]。
図1 SARS-CoV-2の構造
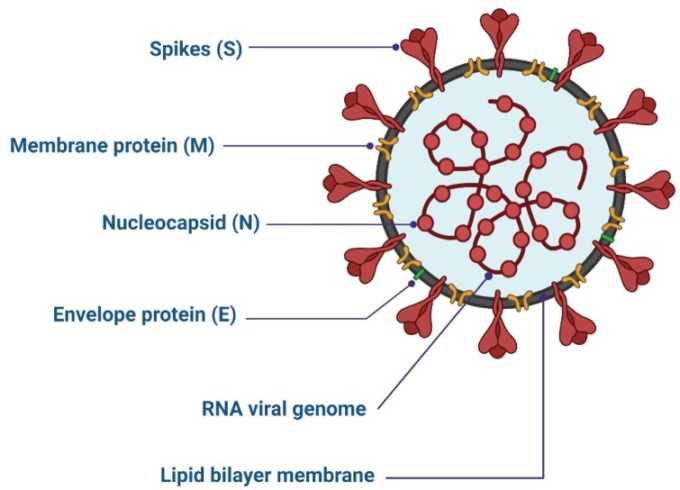
CoVは複製するためには細胞質に到達しなければならないため[33]、細胞内の受容体と相互作用する必要がある[34,35]。SARS-CoV-2由来のS糖タンパク質は、肺細胞の膜上のACE2受容体と相互作用する(SARS-CoVで見られるのと同様)[14]。受容体とウイルスの結合に続いて、ウイルスと細胞膜は、タンパク質分解酵素によるS糖タンパク質の分解後に融合し、それによってウイルスゲノムの細胞質への侵入を導く[36]。II型膜貫通型セリンプロテアーゼはACE2関連タンパク質であり、ウイルスの融合を促進することができる[37,38]。その後、ウイルスのゲノムRNAの複製とmRNAの転写が起こり、負鎖RNAからゲノムRNAが合成される(図2)[39]。
図2 コロナウイルスのライフサイクル
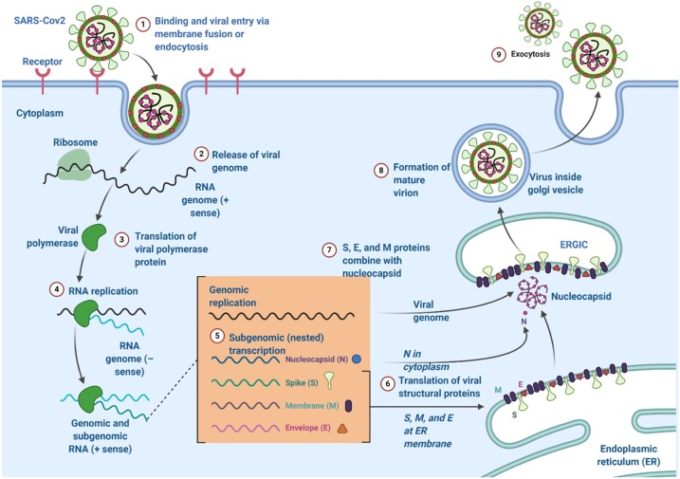
その結果、S、E、Mタンパク質が新たに形成され、小胞体やゴルジ体に取り込まれる。そして、ヌクレオカプシドタンパクとゲノムRNAが結合してヌクレオカプシドが形成される。その後、ウイルス粒子は小胞体-ゴルジ体中間コンパートメントに発達する[19]。その後、Nタンパク質がウイルスゲノムをカプシド化して成熟ウイルスを形成する [40]。その後、ウイルス粒子は形質膜と結合してウイルスを放出する[41]。
SARS-CoV-2に感染した人の症状は、乾いた咳、発熱、呼吸困難、頭痛、肺炎などであり、呼吸不全を引き起こし、死に至ることもある[14]。しかし、これらの症状はSARSやMERSが誘発する症状と比較すると軽度の反応であると考えられている[4]。SARS-CoV-2の潜伏期間は2~10日で、汚染された手や咳やくしゃみで拡散する飛沫を介した人から人への感染により、急速なパンデミックを確実なものにしている[42]。ウイルスは遺伝子構造を変化させる能力があるため、抗ウイルス薬では十分ではない[43]。
3. ケフィアの特性と潜在的使用
ケフィアは東欧、バルカン半島、コーカサスで最初に特許を取得した。それはクリーミーなテクスチャーの酸アルコール発酵乳である[44,45]。ケフィア粒の直径範囲は0.3~3.5cmである[46,47]。ケフィアの粒は、タンパク質と多糖類の複雑なマトリックスの中に存在するプロバイオティクス微生物で構成されている[48,49]。ケフィアは、乳酸菌(LAB)と酵母の異なる集団からなるケフィア粒と新鮮な牛乳を室温で混合することによって形成される。培養期間は、ケフィア粒の微生物群集が発達して広がる絶好の機会を提供し、これにより、細菌、酵母、およびそれらの遺伝子の追加または喪失につながる[22,24,25]。ケフィアは、伝統的な方法および商業的なアプローチを含む様々な方法で容易に形成することができる[50]。ケフィアは、その微生物群集および有機酸などの代謝収量に関連したいくつかの健康上の利点[[51], [52], [53]]を有している[54,55]。さらに、商業的な関心は、健康を促進する細菌の成長を促進するための栄養培地としてのケフィアの使用を増加させている[56], [57], [58]]。ケフィア粒の主要な多糖類は、ヘテロ多糖類であるケフィランであり、これはほとんどがラクトバチルス・ケフィラノファシエンス(Lactobacillus kefiranofaciens)によって形成されるガラクトースとグルコースの等価量から構成される[59]。ケフィランは酸性乳の粘度を高める[60]。ケフィランは、低温で良好な粘度を有するゲル状物質を生成することができ、発酵製品の改良に利用することができる[61]。さらに、ケフィランは、重要な抗腫瘍性、抗真菌性、抗菌性[62,63]のほか、免疫調節性または上皮保護性[45]、抗炎症性[64]、治癒性[53]、および抗酸化活性[47]を有する。
ケフィアの穀物および牛乳に含まれる最も一般的な細菌属は、ラクトコッカス、ストレプトコッカス、ラクトコッカス・ラクティス亜種、ラクトバチルス・デルブルエッキイ亜種ブルガリクス、L. helveticus、L. casei subspecies pseudoplantarum、L. skefiri、L. kefir、L. brevisおよびストレプトコッカス・サーモフィルス(Streptococcus thermophiles)は、微生物集団の約37〜90%を占める(表1)[[22], [23], [24], [25]。何世紀にもわたって、これらの細菌は重要な健康上の利点を持つことが知られてきた[65]。また、Leuconostoc mesenteroidesや酵母種のような他の細菌種が、一部のケフィア粒に優占している可能性がある[25]。ケフィアを他の発酵乳製品と区別する特徴は、ケフィア粒に多くの酵母の集団が存在することである[66,67]。
ケフィアの組成は、発酵に使用される乳(成長培地)の種類に依存する。ケフィアの栄養的重要性は、様々な生体分子(例えば、ミネラル、糖質、炭水化物、タンパク質、ペプチド、ビタミン、脂肪)および二次代謝物(例えば、カテキン、バニリン、フェルラ酸、およびサリチル酸)の濃縮度に基づいている[68]。ビタミンB1,B2,B5およびC、高濃度の元素(例えば、カルシウム、マグネシウム、カリウム、ナトリウム)および低濃度の元素(例えば、亜鉛、銅、鉄)ならびに必須アミノ酸(例えば、セリン、スレオニン、アラニン、リジン、バリン、イソロイシン、メチオニン、フェニルアラニン、トリプトファン)は、ケフィア中に存在する[[69], [70], [71]]。これらの成分は、免疫調節、消化、代謝、エネルギーバランス、治癒、中枢神経系、ホメオスタシスの改善に重要な役割を持っている[[70], [71], [72]]。Nisoliらは、ケフィラン含有アミノ酸が高齢者の健康寿命を延ばし、重度外傷性脳損傷患者の精神状態を改善することを報告している[73]。
3.1. ケフィア補給に対する免疫系の反応
腸内マイクロバイオーム(GM)とは、消化管(GIT)に存在する微生物、細菌、ウイルス、原虫、真菌、およびそれらの集合的遺伝物質の総体である。GMは、適切な量を適用すれば免疫応答を調節できるため、病気の治療/予防に応用できる可能性がある[65,74]。GMは、動物モデルにおいてインフルエンザウイルスおよび肺炎球菌に対する有効性を示している[75]。
様々なプロバイオティクスは、自然免疫系と適応免疫系をサポートし、調整する上で様々な能力を示している[76]。プロバイオティクスには、リポテチン酸、ペプチドグリカン、核酸などの免疫賦活物質が含まれている[77]。プロバイオティクスはまた、腸管[76]および上気道[78,79]におけるさまざまなタイプの感染症の重症度を低下させることができる。プロバイオティクス微生物は、ウイルスと結合することで、ウイルス活性およびウイルスの宿主細胞への侵入を抑制することができる[80]。
いくつかのプロバイオティクスの潜在的な抗ウイルス作用機序は、抗ウイルス剤としてのバクテリオシン、乳酸、過酸化水素の開発と同様に、直接的な捕捉、免疫化合物の増強である可能性がある[81]。プロバイオティクス微生物の有益な活動は、生きている微生物細胞に対する直接的な効果、または代謝物(生体分子)の微生物分泌を介した間接的な効果を通して作動することができる[82]。Möller らは、発酵乳に含まれる生体分子がリンパ球と Ig 分子の産生を促進することを実証した [83]。
何人かの学者がケフィアの免疫系への影響について議論している。マウスモデルでは、安井らはインフルエンザウイルスに対するビフィドバクテリウム・ブレベの経口投与による抗ウイルス活性を調査した[84]。彼らは、B. breveがウイルス感染から下気道を保護することを示した。他の研究では、発酵乳を摂取すると鼻腔内病原体の集団が減少することが示されている[85,86]。
Vinderolaらは、ケフィア(および他のプロバイオティクス)の免疫システム増強剤としての有効性を示した。彼らは、ケフィアをマウスに適用すると、腸管や気管支のIgA+細胞数を増加させるだけでなく、腹膜や肺のマクロファージの貪食能も増加させることで、免疫応答を調節できることを示した[87]。また、ケフィアを投与したマウスの小腸前膜でサイトカイン IL-4,IL-6,IL-10 の発現が増加したことも報告されている。Perdigonらは、発酵乳を与えたマウスは、IgA+細胞数の増加、マクロファージ活性、特異的抗体反応などの免疫応答を示すことを報告している[[88], [89], [90]]。Canらは、チョルハマス(Salmo coruhensis)にケフィアを与えた後、IgMレベルが増加したことを実証した[91]。Thoreux と Schmucker は、コレラ毒素(CT)を十二指腸内で免疫した若齢ラットを対象に、ケフィアの免疫調節活性を研究した [92]。彼らは、ケフィアを給与したラットの血清、パイエルパッチ、腸間膜リンパ節、脾臓、腸扁平上皮において、抗CT IgAのレベルがCT群のラットと比較して増加していることを発見した。また、ケフィアは若年成人ラットではCTに対する腸管粘膜免疫応答を誘導するが、発病期のラットでは誘導しないことが示唆された。さらなる調査では、ケフィラン(ケフィア微生物叢 L. kefiranofaciens によって産生される)を異なるマウス群に投与すると、サイトカイン IL-1α、IFN-γ、TNF-α、IL-6,および IL-10 の発現が増強されることが示された [26]。同様に、天然痘ワクチン接種に応答して、IFN-γの血清濃度の増加が観察されており、ケフィアの作用モードが上述したものと類似していることを示唆している[93]。IFNをベースとした治療法がC型肝炎ウイルス感染患者の治療に有効であったことから、ケフィアの作用機序とワクチンのウイルス感染症治療能力の類似性を示唆している[94,95]。
ケフィアの免疫調節効果は、その誘導体にも及んでいる。いくつかの研究は、特異的および非特異的な免疫応答を調節する上でケフィア(例えば、LAB)のプロバイオティクス集団の効力を実証している[96]。ケフィア粒に存在する新規プロバイオティクス株L. kefiranofaciens M1は、免疫調節、抗アレルギー、抗喘息、および抗大腸炎活性を試験管内試験および生体内試験で細菌を含まないマウスで示している[97]。L. reuteriおよびL. plantarumは、肺炎ウイルス感染マウスに対してポジティブな効果を示している[98]。L. plantarum HEAL 9およびL. paracasei 8700を2~12週間摂取した場合、CD4+およびCD8+細胞の誘導を介してヒトライノウイルスによる感冒感染症を発症するリスクの低下が示された[99]。Cavicchioliらは、L. lactis亜種ラクティスの精製バクテリオシンがヘルペス・ポリオウイルス-1に対して顕著な阻害活性を有することを実証した[100]。さらに、Nanisらは、Lactobacillus acidophilusやBifidobacteria種のようなプロバイオティクスの投与が、IFN-αやリバビリンの調節により、C型肝炎ウイルス(HCV)感染症の治療に対する治癒反応を高めることを示した[95]。Weissらは、L. acidophilus NCFMの投与により、トール様受容体-2-IFN-β依存性の方法でウイルス防御遺伝子の発現を活性化することにより、マウス骨髄由来樹状細胞に関連する遺伝子のアップレギュレーションをもたらしたことを報告している[101]。
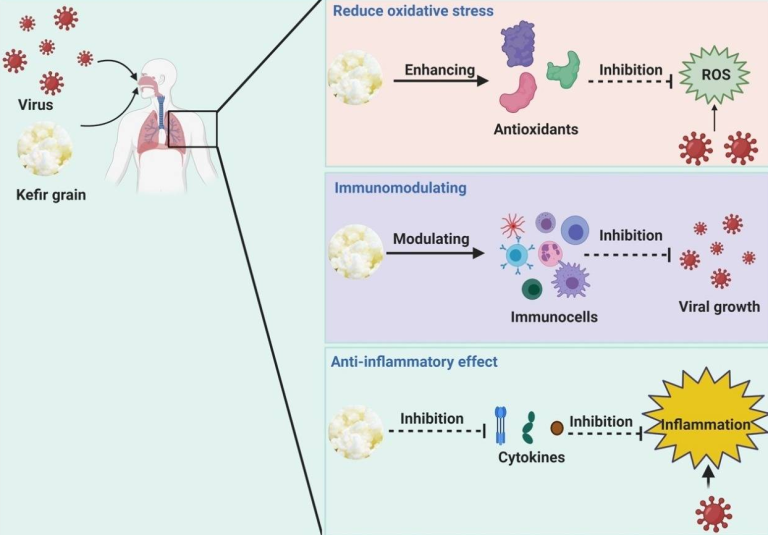
Adiloğluらは、ケフィアの経口投与がヒトの自然免疫系に及ぼす影響を研究した[102]。健康な18人の参加者にケフィアを6週間投与し、TNF-α、IL-1,IL-5,IL-8,形質転換成長因子-β、ヘモグロビン、クレアチニン、アラニンアミノトランスフェラーゼの血清レベルを測定した。その結果、Th1型の免疫反応分極が増加し、Th2型の反応が低下し、結果的にアレルギー反応を示すことが示された。また、ケフィア補給後のIL-8発現の低下は、好中球の走化性を阻害することで炎症反応を抑制する可能性がある。一方、IL-5 の発現量が増加すると、消化管粘膜での IgA の分泌が促進され、腸管内腔での免疫応答がより効率的になる可能性がある(図 3)。
図3 ケフィアのウイルス感染に対する作用機序の可能性
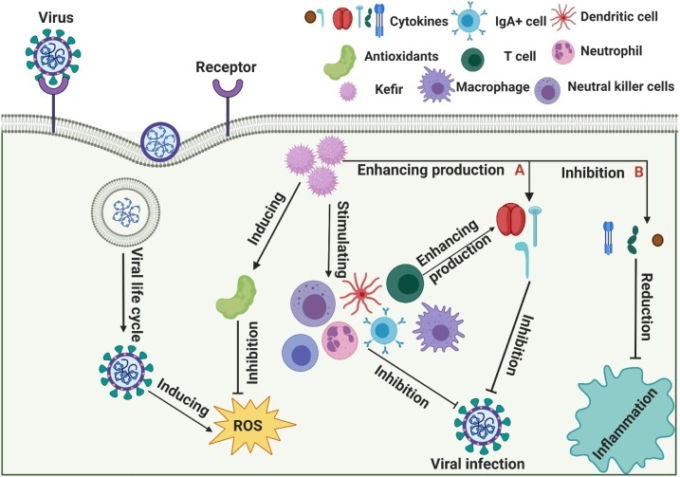
(A) ケフィアは、インターフェロンγ(IFN-γ)インターロイキン(IL)-2,IL-12などのサイトカイン産生を刺激することで免疫応答を増強する。(B) ケフィアは、IL-6,IL-1,腫瘍壊死因子(TNF)-αなどのサイトカイン産生を抑制することで炎症反応を抑制する。
3.2. ケフィアの抗炎症活性
ウイルス感染は、細胞サイトカインの過剰発現と関連している。例えば、COVID-19は、エフェクターT細胞の過剰活性化および炎症性サイトカイン(特にIL-6)の追加合成と関連している。このような作用は、「サイトカインストーム」と呼ばれ、抗体ベースの免疫療法で治療された患者における生命を脅かす合併症として割り当てられている。そのほか、IL-1,TNF-α、およびIFN-gなどの他のサイトカインも形成される。これらのサイトカインはすべて、血漿漏出、血管透過性、および血管内凝固をもたらす病理学的事象に関与している[103,104]。Giavanniらは、サイトカインストームとSARS-CoV-2誘発性肺炎症状との関係を示唆した[104]。免疫障害を有し、サイトカインブロッカーを服用している患者では、SARS-CoV-2誘発性肺炎の増加は報告されていない。免疫介在性疾患を有する患者がIL-6阻害薬(またはIL-6産生またはIL-6シグナル伝達の媒介に終止符を打つ免疫経路を阻害する化合物)を服用していると、SARS-CoV-2誘発性肺炎から保護されるのではないかとの推測がなされている。
ケフィア中に存在する微生物群集とともに、他の発酵産物および代謝物も重要な活性を有する。これらの副産物の多くは、微生物群集が存在しなくても宿主において広範な結果をもたらす可能性がある [48]。Chen らは、トランスジェニックホモ接合型核内因子κB (NF-κB)-ルシフェラーゼ+/+マウスにおける 4 μm より小さい粒子状物質 (PM4.0)誘発肺炎に対するケフィアペプチドの抗炎症活性および抗酸化活性を研究した [27]。ケフィアペプチドは、NF-κB シグナルを阻害することで、肺組織内の炎症性サイトカイン IL-lβ、IL-4,IL-6,TNF-αの発現を低下させ、強力な抗炎症作用を示すことが示された。また、本ペプチドは抗酸化剤としても作用し、肺の全スーパーオキシドジスムターゼ活性を刺激することで活性酸素のレベルを低下させた。Rosaらは、ケフィアを10週間摂取することで、高血圧ラットの脂肪組織における炎症性サイトカイン(IL-1β)酸化ストレスマーカー(マロンジアルデヒド、ヒドロペルオキシド)の発現を減少させることを報告している[105]。Andradeらは、ケフィアの投与により、TNF-α/IL-10発現が42%減少し、(抗炎症性)IL-6発現が50%減少し、同時に(抗炎症性)IL-10発現が増強されたことを示した[106]。チベットケフィアの凍結乾燥多糖類抽出物は、2.08 mg/mLの最小活性で強力なヒアルロニダーゼ阻害作用を示している[105]。Seoらは、ケフィアから生成した細胞外小胞が、炎症性サイトカインの合成を抑制することで腸内細胞の炎症を抑制することを報告している[107]。また、炎症性腸疾患誘発マウスにケフィア由来の乳酸菌細胞外小胞を投与したところ、体重減少や直腸出血が有意に減少したことも報告している。
Morsyらによる重要な研究では、ケフィアの飲用が慢性HCV感染症患者に有益である可能性があることが実証された[108]。また、患者がケフィアを摂取するとHCV感染がかなり改善することが示されており、抗炎症作用および抗酸化作用に加えて免疫系を刺激する能力があることが示唆されている。Carasi らは L. kefiri CIDCA 8348 の抗炎症活性を研究しており、パイエルパッチと腸間膜リンパ節におけるプロ炎症性メディエーターの発現を減少させたが、IL-10 産生を増加させた[109]。また、回腸ではIL-10,ケモカイン(C-X-Cモチーフ)リガンド-1,ムチン6遺伝子の発現が誘導され、大腸ではムチン-4の発現が増加し、IFN-g、顆粒球-マクロファージコロニー刺激因子、IL-1b遺伝子の発現が低下した。
3.3. ケフィアの抗ウイルス活性
ウイルス性疾患、特に新興ウイルス(チクングニヤ、デング熱、エボラ、ジカ、SARS-CoV-2)によるウイルス性疾患の数の大幅な増加は、世界中の公衆衛生に大惨事をもたらしている[106,110]。また、抗ウイルス薬に対する耐性の開発を食い止めるのに十分な薬剤が開発されていない。
ヒトの栄養、免疫系、および感染症の発生、発生、抑制におけるそれらの役割との間に強い関係があることは、免疫系を強化する製品を求める上で有益な概念であるかもしれない[111]。あるメタアナリシスでは、プロバイオティクスとプレバイオティクスが成人のインフルエンザワクチンの免疫原性を高めることが示唆されている[112]。
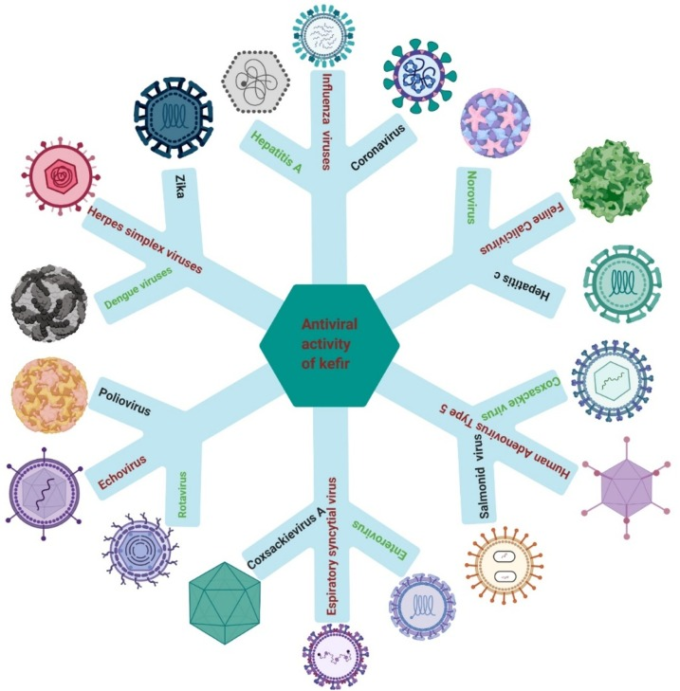
副作用の少ない抗ウイルス剤に関しては、いくつかの学者がプロバイオティクス製品を抗ウイルス剤と一緒に治療薬として使用できるかどうかを研究してきた[113], [114], [115]. de Andradeらは、ジカウイルスに対するケフィア(37.5μg/mL)の能力は、上皮細胞への影響の抑制、またはTリンパ球の増殖に対するウイルスの影響の拮抗によって起こることを実証した[106]。L. kefiri(100 μg/mL)を用いると、抗ウイルスサイトカインやヒト単球由来樹状細胞の発達が促進され、抗ウイルス剤や抗がん剤として応用できることが示されている[116]。酵母は、ケフィアの成分の一つとして、HCVやSARSなどのRNAウイルスの複製部位であることが示されている;この特徴は、ウイルス複製減少のメカニズムの理解に役立つかもしれない。約100の非必須酵母遺伝子が、いくつかの植物のRNAウイルスの複製に影響を与えている(例えば、トマト萎縮性スタントウイルス、ブロメモザイクウイルス)ので、酵母は他のヒトRNAウイルスにも影響を与えているかもしれない[117,118]。Parsonsらは、酵母からアマンタジン塩酸塩を単離し、抗ウイルス能を持つことを示した(図4)[119]。
図4 ケフィアの抗ウイルス活性
3.3.1. ウイルス性肺炎
インフルエンザウイルスはヒトにおいて季節的なパンデミックを定期的に発生させるが、抗ウイルス療法やワクチンで対抗することができる。しかし,これらの治療法は,免疫抑制症や高齢者では効果が限定的であることが多い.さらに、ウイルスの高い遺伝的柔軟性は、活性型ワクチンおよび抗ウイルス剤の有効性を妨げている[120]。このような状況では、プロバイオティクス微生物の概日投与がインフルエンザウイルスに対して有用であるかもしれない[121]。
乳酸菌株Enterococcus faecium NCIMB 10,415は、直接の接触および相互作用を介してインフルエンザウイルスの影響を鈍らせることができる[20]。Choi らは、L. acidophilus、L. rhamnosus、L. plantarum、Streptococcus thermophilus、および Bifidobacterium bifidum で嫌気培養下で発酵させた 5 種類のヨーグルトの無細胞上清(CFS)の抗ウイルス効果を、7 種類の RNA ウイルス(インフルエンザウイルスを含む)の抗ウイルス効果と比較して研究した(122)。彼らは、プロバイオティクス菌で発酵させたヨーグルトの代謝物が、医薬品や発酵乳をベースとした食品の改良に利用できることを示した。丸尾らは、マウスを用いて、エキソ多糖類を産生する Lactococcus lactis 亜種 cremoris で発酵させた牛乳の抗ウイルス性を研究した [123]。彼らは、L. lactis亜種クレモリス発酵乳を投与した群のマウスの肺は、対照群に比べてウイルス力価が有意に低下したことを示した。Gotoらは、インフルエンザウイルス(H1N1)に感染したマウスを対象に、非生菌と生菌のL.アシドフィルスの抗ウイルス効果を調べた。彼らは、L.アシドフィルスの経口投与後、いくつかの抗ウイルスサイトカインやケモカインによって肺のNK細胞活性が改善されることが、インフルエンザウイルス感染から保護される可能性を示唆している[124]。市販のインフルエンザウイルス(H1N1)に対する薬剤とL. plantarum分離株との比較研究では、L. plantarum分離株の方が高い効果があることが示された[125]。L. rhamnosusの経口摂取は、体液性および細胞性免疫応答を刺激することでマウスの生存率を改善し、インフルエンザウイルス感染に対する宿主の抵抗性の改善を示した[120]。さらに、Baeらは、L. plantarumとLeuconostoc mesenteroidesプロバイオティクスのヒト季節性インフルエンザウイルスおよび鳥インフルエンザウイルスに対する抗ウイルス特性をスクリーニングした[121]。彼らは、マウスの肺におけるウイルス複製がこれらのプロバイオティクスによって有意に制御されたことを報告した。Lactobacillus gasseriはいくつかの重要な作用を持ち[121]、小児の肺炎や気管支炎の主な原因病原体である呼吸器同期ウイルス(RSV)に対して有意な活性を示している[126]。マウスの肺における RSV 力価は L. gasseri 処理後に大幅に低下し、RSV 感染に起因する炎症性サイトカインの発現についても同様のパターンが観察された。
細胞プロテオミクス研究では、SNF2関連のCBPアクチベータータンパク質が、L. gasseri対RSVの活性において生理活性分子であることが示された[126]。また、Saccharomyces cerevisiaeのb-グルカンは、IFN-gや一酸化窒素の産生を増加させることで、豚インフルエンザウイルスに対して効果があることが示されている[127]。Friemanらは、非構造タンパク質3(nsp3)またはパパイン様プロテアーゼ(PLP)の抑制に基づいて、SARS-CoVの複製をブロックする役割を果たす低分子を検出するための特異的なアッセイを設計した。このスクリーニングの根拠は、S. cerevisiaeにおけるNSP3の発現を高めると、表現型の成長が著しく遅くなることであった [128]。PLPはウイルスの複製に極めて重要である。どの分子がSARS-CoV複製の抑制に関与しているかを発見するために、酵母ベースのPLP活性アッセイを設計した。一連の分子をスクリーニングして、PLPの阻害効果を試験し、増殖を維持した。NSC158362はSARS-CoV複製を排他的に阻害したが、nsp3のプロテアーゼ活性、脱ユビキチナーゼ活性、抗IFN活性には効果が認められなかった。このことから、SARS-CoV複製の阻害機構はPLP活性が明らかではなく、PLP機能の修飾による直接的な阻害が期待された。さらに,サプレッサーである NSC158011 で処理した場合には,PLP プロテアーゼの活性が阻害された(表1
).
表1 ケフィア中のプロバイオティクス微生物とその抗ウイルス活性
| 微生物種 | 抗ウイルス活性 | 参考文献 |
|---|---|---|
| ラクトバチルスカゼイ | ロタウイルス | [ 24、142、143、144 ] |
| ラクトバチルスブレビス | 単純ヘルペスウイルス2型(HSV-2) | [ 24、25、142、143、145 ] |
| ラクトバチルスプランタルム | エコーウイルスE7およびE19、インフルエンザウイルスH1N1、コクサッキーウイルス、インフルエンザウイルス、季節性および鳥インフルエンザウイルス | [ 23、54、142、145 ] |
| ラクトバチルスアシドフィルス | C型肝炎、インフルエンザウイルス、ロタウイルス、コクサッキー | [ 142、143、145、146 ] |
| ラクトバチルスガセリ | インフルエンザAウイルス、呼吸器合胞体ウイルス(RSV) | [ 142、143 ] |
| ラクトバチルスクリスパタス | HSV-2 | [ 142、147 ] |
| ラクトバチルスアミロボルス | エコーウイルスE7およびE19 | [ 142 ] |
| L.ラムノサス | インフルエンザウイルス、単純ヘルペスウイルス1型、コクサッキー | [ 142 ] |
| L.サケイ | サケ科のウイルス | [ 142 ] |
| L.ロイテリ | コクサッキーウイルスAおよびエンテロウイルス71 | [ 142 ] |
| ラクトコッカスラクチス亜種。ラクトコッカスラクチス | ネコカリシウイルス、ノロウイルス(NV)、単純ヘルペスウイルス1(HSV-1)およびポリオウイルス(PV-1) | [ 22、24、25、54、143、144、147、148、149、150 ] |
| ラクトコッカスラクチス亜種。クレモリス | インフルエンザウイルス | [ 149、150、151 ] |
| Streptococcusthermophilus | コクサッキー、インフルエンザウイルス | [ 122 ] |
| リューコノストック属 | ヒトアデノウイルス5型 | [[ 143 ]] |
| Leuconostoc mesenteroides | サケ科のウイルス、季節性および鳥インフルエンザウイルス | [ 22、24、142、144、151 ] |
| ビフィズス菌属 | ロタウイルス | [ 151 ] |
| B.ロンガム | ロタウイルス | [[ 146 ]] |
| Saccharomyces cerevisiae | 豚インフルエンザウイルス、コロナウイルス | [ 24、25、128、143、147、152、153、154、155、156 ] |
| 霊芝ガノデルマルシダム | エンテロウイルス71 | [ 152 ] |
| ペニシリウム属 ベガ347 | デング熱ウイルス | [ 152 ] |
3.3.2. ロタウイルス
ロタウイルスは乳幼児の下痢性疾患の原因となっている。いくつかの研究で、ラクトバチルス種(例えば、L. caseiおよびL. acidophilus)およびビフィズス菌種(例えば、B. longum)がロタウイルスに対して活性を有することが実証されている[114,129,130]。ロタウイルス感染症に対するL. caseiおよびビフィドバクテリウム種の活性は、NSP4タンパク質の構築およびCa2+放出によって観察されている。細胞の破壊を抑制することでロタウイルス感染の影響が減少することが示された( 表1 ) [114]。
3.3.3. 単純ヘルペスウイルス(HSV)
HSVはヘルペス感染症の主要な原因であり、体の多くの部位で発症するが、最も頻繁に性器(HSV-2)または口内(HSV-1)に発症する [100,[131], [132], [133] [133]。L. lactis亜種のL. lactis、L. rhamnosusおよびL. brevis、L. crispatusはそれぞれHSV-1およびHSV-2に対して活性を有する[100]。最近の研究では、L. lactis subspecies lactisの精製バクテリオシンがHSV-1に対して顕著な阻害活性を有し、新しい抗ウイルス剤として使用できることが明らかになった[100]。さらに、Khaniらは、L. rhamnosusがマクロファージの生存率を改善してHSV-1を除去したと述べている[131]。L. brevisは、耐熱性の非タンパク質細胞表面細菌成分のために可能な分子量10 kDa以上の複合体に関連して、HSV-2の生殖を抑制する効果があるとされている[132]。Mousaviらは、哺乳類のVero細胞株およびHeLa細胞株において、L. crispatusのHSV-2に対する阻害活性をスクリーニングした。133] L. crispatusはHSV-2粒子を「キャッチ」するようであった。さらに、L. crispatus のミクロコロニーを細胞表面に発現させることで、HSV-2 の受容体を遮断し、感染初期の細胞へのウイルスの侵入を回避することが示唆された ( 表1
)。
3.3.4. エンテロウイルス
エンテロウイルスは、一般的には軽度である多くの感染症の原因となる。それにもかかわらず、中枢神経系のエンテロウイルス感染は重篤な健康障害を引き起こす可能性がある[134]。ほとんどのエンテロウイルスはGITで繁殖するので、LABはGITでそれらに対して防御することができる[134]。数多くの研究が、選択されたエンテロウイルスに対する抗ウイルス剤としての市販のプロバイオティクスの活性を示している[134,135]。2016年には、2つの市販プロバイオティクスが抗ウイルス活性について調査された。Lactobacillus reuteri ProtectisおよびLactobacillus casei Shirotaは、ヒトの大腸および骨格筋細胞株において、エンテロウイルス71(EV71)コックスサッキーウイルスA型(CA)6株(CA6)およびCA16(手足口病の原因となる主な病原体)に対して試験された。L. reuteri ProtectisはEV71に対して実質的な活性を示した[135]。著者らは、抗ウイルス効果は、ウイルス粒子と細菌の間の物理的相互作用によって達成され、哺乳類宿主細胞へのウイルスの侵入を阻止したと主張している。抗ウイルス効果は、L. casei Shirotaについては文書化されていない。Sunmolaらは、エンテロウイルスに対するLAB L. plantarumとL. amylovorusの抗ウイルス活性を調べた[134]。L. plantarum と L. amylovorus の抗ウイルス活性は、細菌細胞ペレット、CFS、ブロス培養において、処理前と処理後のエ コウイルス 7 (E7) と E19 に対する抗ウイルス活性を示した。また,L. plantarum,L. acidophilus,L. rhamnosus株及びそれらの誘導体により,コックスサッキーウイルスに対する阻害活性が示された(表1)[122,136]。
3.3.5. その他のウイルス
ノロウイルス(NVs)やA型肝炎ウイルスなどの食中毒ウイルスは、食中毒ウイルス感染を停止するために新しい、効果的な方法の開発を必要とする主要な公衆衛生上の懸念である[137]。Aboubakrらは、ネコカリシウイルス(ヒトNVsへの代替)に対するプロバイオティクスLABの抗ウイルス活性を決定した[137]。彼らは、L. lactis subspecies lactisの使用がウイルスの力価の減少をもたらしたことを示した。L. reuteriは、細菌とウイルスの直接的な相互作用によりCAの宿主細胞への侵入を阻害し、CAに対して有意な活性を示した[135]。さらに,L. acidophilusやBifidobacteria種のようなプロバイオティクスを投与した場合,IFN-αやリバビリンの調節により,抗HCV治療に対する治癒反応が増強されることが明らかになった(表1)[95].
4. 結論と今後の展望
COVID-19パンデミックは世界的に大パンデミックしており、すべての科学界にとって大きな懸念材料となっている。SARS-CoV-2に対する特異的なワクチンは利用できないが、抗ウイルス剤(リバビリン、アシクロビル、ガンシクロビル、ノイラミニダーゼ阻害剤)は研究中である[19]。しかしながら、COVID-19と戦うための適切な治療法を見出すためのあらゆる試みは、免疫系を関与させなければならない。
ケフィアおよびその成分は、免疫応答において重要な制御的役割を持っている。この点で、ジカウイルス、HCV、B型肝炎ウイルス、インフルエンザウイルス(H1N1)HSV、ライノウイルスおよびレトロウイルスに対する活性が報告されている。
COVID-19患者の中には、1 L-6,IL-1,TNF-α、およびIFN-γを含むサイトカインストームの結果として生じる大規模な炎症反応の後に死亡する患者がいると推測されている。サイトカインストームから患者を保護するために提案されている初期の解決策は、IL-6の機能を遮断するか、または炎症を抑制する化合物を投与することである。ケフィアは、プロ炎症性サイトカインの活性を阻害することができる。ケフィア(およびその副産物)を、COVID-19患者におけるプロ炎症性サイトカインの発現阻害剤として使用することは、実行可能な政策であり得る。
SARSのCoV-2複製はpHに依存しているため、ケフィアの消費とpHを変化させる能力との関連を解明することは価値のあることであろう[44,45]。研究では、ケフィアのpHは酸性(pH 4.6)であることが報告されている[21,138]。この酸性度は、酸性細菌の異なる集団に関連している[139,140]。Reaらは、ケフィア粒の酸性pHが病原性活性を阻害する可能性があると報告している[139]。酸性の二次代謝物を産生し、それらが分解されないようにする能力のために、ケフィアは、それが消費されるときに特定の領域のpHを変更する可能性がある。CoVsの融合は弱アルカリ性のpHで起こる[141]ので、ケフィアの消費と特定の身体部位のpH変化とウイルス感染との関連を調べることは価値があるだろう。
ケフィアとそのプロバイオティクス微生物に関するすべての研究に基づいて、ケフィアはウイルス感染に対する保護剤として作用する可能性がある。