Hydroelectrolytic Disorder in COVID-19 patients: Evidence Supporting the Involvement of Subfornical Organ and Paraventricular Nucleus of the Hypothalamus
www.ncbi.nlm.nih.gov/pmc/articles/PMC7872848/
オンラインで公開2021年2月10日
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、嗅覚神経を介して、あるいは嗅覚神経に沿ってくも膜下腔を経由して脳の脳脊髄液、さらには脳の間質空間にまで拡散する可能性が高いため、コロナウイルス感染症2019(COVID-19)患者では複数の神経学的問題が報告されている。SARS-CoV-2は、SFO(脳弓下器官)のような円周性器官(CVO)には血液脳関門がなく、SFOに感染すると視床下部傍室核(PVN)や視床上核(SON)が機能不全を起こし、水電解障害を引き起こすことから、上記のルートと循環血液を介してSFOに侵入するのではないかと考えられている。SARS-CoV-2はSFO-PVN-SONニューロンに容易に侵入し、これらのニューロンはアンジオテンシン変換酵素2受容体やタンパク質分解性ウイルス活性化因子を発現しているため、これらのニューロンでは神経変性や神経炎症を引き起こす可能性がある。水電解質バランスの調節におけるSFO-PVN-SON回路の重要な役割を考えると、これらの領域におけるSARS-CoV-2感染は、神経内分泌系による水電解質ホメオスタシスの制御を混乱させる可能性がある。本稿では、SARS-CoV-2のSFO-PVN-SON経路感染がCOVID-19患者の水電解質障害を引き起こすメカニズムを提案する。
キーワード
SARS-CoV-2, COVID-19, 脳, 神経浸潤, 水電解質バランス, 低カリウム血症
1. はじめに
2019年末、中国・武漢で原因不明の重症肺炎症例を伴う呼吸器疾患が発生し、急速に世界に広がった(Huang er al)。 その後まもなく、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と名付けられた新型コロナウイルスがこの病気の原因であることが判明した(Gorbalenya et al 2020)。現在、コロナウイルス感染症2019(COVID-19)は、世界のほぼすべての国で感染しており、1億人以上の確定症例と220万人以上の確定死亡者が確認されており(worldometers.infoおよび世界保健機関 2020年)このパンデミックは、公衆衛生および人々の生活に世界的に大きな影響を与えている(KupferschmidtおよびCohen 2020)。
COVID-19患者は無症状であることがあるが、SARS-CoV-2感染は軽度から重度までの臨床症状を促進することもある。頻繁に報告される症状は、発熱(∼70%)乾いた咳(59〜76%)および筋肉痛(38〜69%)または疲労(14〜70%)で構成され、喀痰分泌(28〜33.7%)喀血(0.9〜5%)頭痛(6〜13%)下痢(3〜10%)および嘔吐(3〜5%)などのあまり一般的でない症状とは対照的である(Guan et al 2020;Huang et al 2020;Huang et al 2020;Huang et al 2020)。2020; Huang et al 2020; Wang et al 2020; Yang et al 2020)。) 加えて、COVID-19のいくつかの症例は、髄膜炎または脳炎(6.1%)およびギラン・バレー症候群(1.4%)を呈している(Correia et al 2020;Moriguchi et al 2020)。発症から 1週間後、患者は呼吸困難および急性呼吸窮迫症候群(ARDS)を発症し、集中治療室(ICU)入院に至る可能性がある。ARDSに起因する重篤な呼吸器および血液学的問題のため、ICU入院患者のかなりの割合で死亡が発生する(Huang et al 2020)。
SARS-CoV-2感染は、頭痛、めまい、痙攣、熱性発作、および脳炎を含む複数の中枢神経系(CNS)関連症状を引き起こし得る(Asadi-PooyaおよびSimani 2020)。さらに、COVID-19患者は、味覚および嗅覚の機能障害を経験している(Pallanti 2020;Spinato et al 2020;Xydakis et al 2020)。さらに、いくつかの研究は、SARS-CoV-2感染が低カリウム血症の高い有病率と関連していることを示した(Barkas et al 2020;Chen et al 2020;Mabillard et al 2020;Moreno-P et al 2020)。重度(18%、<3 mmol/L)および軽度(37%、3〜3.5 mmol/L)の低血漿カリウム(K+)レベルは、COVID-19患者の55%において報告された(Chen et al 2020)。特筆すべきことに、低カリウム血症の程度は、COVID-19の重症度および高い死亡率と強く関連している。さらに、COVID-19患者は、電解質不均衡に関連したプロ不整脈イベントを起こしやすい(Wu et al 2020)。
SARS-CoV-2は、嗅覚神経を介して嗅球へ、または嗅覚神経に沿ってくも膜下腔を通って脳の脳脊髄液コンパートメントへ、そして脳の間質空間へと、おそらく中枢神経系に到達する。SARS-CoV-2は、SFOのような円周性器官(CVO)には血液脳関門がないため、SFOに感染すると視床下部傍室核(PVN)や視床上核(SON)が機能不全を起こし、低カリウム血症などの水電解障害を引き起こすことから、上記の経路や循環血液を経由して肛門下器官(SFO)にも侵入すると考えられる。水電解質バランスの調節におけるSFO、PVN、SON回路の重要な役割を考えると、SARS-CoV-2のSFO-PVN-SON感染は、COVID-19患者における水電解質ホメオスタシスの神経内分泌制御を混乱させることを提案する。本レビューでは、水電解バランスの神経内分泌制御、SARS-CoV-2が中枢神経系に侵入するさまざまな経路の現在のエビデンス、SARS-CoV-2感染後のSFO-PVN-SON経路の機能不全がCOVID-19患者の水電解障害をもたらすメカニズムを示唆している。
2. 水電解バランスの神経内分泌制御
十分に血管化されたSFOは、アンジオテンシンやバソプレシンなどの特定のホルモンの放出に影響を与えることにより、心血管プロセスや体液・血圧バランスの調節に関与する末梢循環シグナルを検出する役割を担う感覚CVOである(Black et al 2018; Coble et al 2015, 2014; Ferguson and Bains, 1996; Ishibashi and Nicolaidis, 1981)。さらに、SFOは、水電解バランスの維持に役割を有するPVNのような、視床下部の自律神経および神経内分泌制御中枢の血液脳関門(BBB)によって保護された領域、例えば(Anderson et al 2001; Gutman et al 1986; Tanaka et al 1985; Wright et al 1993)への送液性突起を送る。したがって、SARS-CoV-2感染に関連したSFO-PVN経路の機能不全は、COVID-19患者において低カリウム血症をもたらす可能性がある。
古典的には、真核細胞では、細胞内のK+濃度は細胞外の[K+]よりも高い。このような調節は、タンパク質合成およびNa-K-ATPase活性によって維持される細胞容積の維持に必須である(Stone et al 2016)。Na-K-ATPaseポンプは、膜電位を決定し、活動電位、筋収縮力、およびイオンチャネル活性のためのエネルギーを提供する電気化学的K+勾配を作成するために責任がある(McDonough and Youn, 2017; Youn, 2013)。さらに、[K+]恒常性は、食事によるK+摂取およびK+排泄とも相互に関連している(Giebisch, 1998; Xu et al 2017)。K+濃度を生理的パターン(3.8〜5mM)内に保つために、K+排泄は生理的にきつく調節されている(Giebisch et al 2007)。細胞外液中のK+濃度の低下は、細胞膜の分極を変化させ、その結果、細胞の電気的興奮性の機能不全を引き起こす(McDonough and Youn, 2017)。したがって、[K+]恒常性の調節は、統合的な生理学的特性に基づいて、体内のいくつかの重要な機能にとって極めて重要である。腎K+排泄は、主に遠位ネフロンに沿った分泌、特に初期収集管および皮質収集管を介した分泌によって維持される(Giebisch et al 2007)。腎臓のK+排泄は、生理学的条件下で細胞外K+レベルによって調節される。頻繁に、食事によるK+摂取は細胞外K+レベルを増加させ、これは、集束管におけるK+分泌を直接活性化することにより、腎K+排泄を刺激する(Gennari and Segal, 2002; Youn, 2013)。この分泌は、酸塩基バランス、K+代謝、ナトリウムバランス、およびバソプレシンおよびアルドステロンを含むいくつかのホルモンの作用などの一連の因子によって決定される(Amorim et al 2004)。これらの関連メカニズムにおけるSARS-CoV-2の効果は不明のままである。
COVID-19患者における低カリウム血症の原因として考えられるのは、胃腸障害の上昇および尿量減少である。COVID-19に起因する胃腸症状は、嘔吐および下痢を含む一部の患者において報告されている(Gu et al 2020;Huang et al 2020;Wang et al 2020;Yang et al 2020)。しかし、重度の低カリウム血症と下痢との関連は、患者の29%にしか観察されず、低カリウム血症が下痢だけの結果ではないことを示唆している(Chen et al 2020)。このように、K+消化管欠損が低カリウム血症の主な原因である可能性は低いと考えられる。一方、Chenらはまた、低カリウム血症患者は、正常カリウム血症の対照患者と比較して、尿中K+排泄量の増加を示したことを報告しており(Chen et al 2020)増加した尿中K+喪失がCOVID-19患者における低カリウム血症の主要な原因であることを示唆している。
アルドステロンは、K+レベルの主要な調節因子である。ほとんどのK+排泄(90%以上)は腎臓のアルドステロン感受性遠位ネフロンによって行われ、一方、K+排泄の10%未満はアルドステロン感受性遠位結腸によって保証されている(Giebisch, 1998; Giebisch et al 2007)。アルドステロン感受性遠位ネフロンがK+摂取量に合わせてK+排泄を調節していることは注目すべきことである。摂取量の増加による血漿K+レベルの増加は、副腎を刺激してアルドステロンを分泌させ、腎K+の分泌および排泄を誘導して正常な血漿K+レベルを回復させる(Todkar et al 2015)。したがって、レニン-アンジオテンシン-アルドステロン系(RAAS)の変化が低カリウム血症に関連している可能性がある。アンジオテンシン変換酵素2(ACE2)がRAASの主要なカウンターレギュレーターであり、血圧、血液量、および電解質バランスを調節する役割を担っていることが報告されている(Santos et al 2008)。当然のことながら、RAASは、ACE1およびACE2によって調節され、それぞれRAAS活性を増加(「アクチベーター」系)および減少(「インヒビター」系)させる(Alexandre et al 2020;Vaduganathan et al 2020)。SARS-CoV-2の腎臓への浸潤は、ACE2の分解およびACE1機能の増加をもたらし得、それにより、RAAS活性の増大をもたらし得る(Santos et al 2008)。激化したRAAS活性は、アルドステロンの二次的な増加およびその結果としての腎K+排泄をもたらし得る(Chen et al 2020; Rocha et al 1999)。
さらに、バソプレシン(ADH)もまた、K+ホメオスタシスに寄与し得る。ADHは、視床下部のPVNおよび視床上核(SON)によって産生され、視床下部-神経葉系を介して後脳下垂体に輸送され、その後、全身循環に放出され、ヒドロミネラルのホメオスタシスを調節する(Cocco et al 2017)。遠位ネフロンK+分泌のために、ADHは、V1(先端膜)およびV2(基底膜)受容体を刺激し、ホスホリパーゼC(PLC)/Ca2+/PKCおよびアデニル酸シクラーゼ/cAMP/PKAシグナル伝達経路をそれぞれ活性化し、したがって、先端膜上の低コンダクタンスおよび高コンダクタンスK+チャネルに作用する(AmorimおよびMalnic 2000; Amorim et al 2017; Amorim et al 2017)。2004; Barreto-Chaves and De Mello-Aires, 1997; Cassola et al 1993; Musa-Aziz et al 2002; Nonoguchi et al 1995; Wheatley et al 1998; Yoshitomi et al 1996)。) これまでの報告では、いくつかのCOVID-19患者が、不適切な抗利尿ホルモン分泌(SiADH)の症候群を示すことが示されている(Habib et al 2020;MabillardおよびSayer 2020;Yousaf et al 2020)。SiADHの最も一般的な結果は、低ナトリウム血症(Dhawan et al 1992)であり、これはCOVID-19患者に見られる(Habib et al 2020;Yousaf et al 2020)。しかしながら、SiADHはまた、K+排泄を増加させ得る(Gowrishankar et al 1996;MuschおよびDecaux 2019)。
我々は、SFO、PVN、およびSONのニューロンにおけるSARS-CoV-2感染が、ウイルス媒介の神経変性または神経炎症のいずれかに起因するこれらの領域の機能不全をもたらすことを提案する。SFOニューロンにおけるSARS-CoV-2感染は、おそらく、SFOからPVNおよびSONへのADHを産生するための刺激を中断し、一方、PVNおよびSONにおけるSARS-CoV-2感染は、おそらく、下垂体後面へのADHの放出を妨害する。これらの変化は、最終的にCOVID-19患者の低カリウム血症および水電解質アンバランスにつながる可能性がある。
その上、交感神経自律神経系およびコルチゾールの放出は、低カリウム血症に影響を与え得る。SARS-CoV-2感染は、血液ガスおよび免疫炎症性因子の変化を介して交感神経活動を増加させることができる(Porzionato et al 2020)。自律神経の活性化は、アルドステロン分泌を増加させ、K+の損失に寄与するRAASに直接的なアドレナリン作用を有する(Darbar et al 1996; Goldstein 2020; Gordon et al 1967; Nayyar et al 2017)。ある研究はまた、血漿コルチゾールレベルの上昇とCOVID-19患者の死亡率との関係を示した(Tan et al 2020)。コルチゾールは、腎ミネラルコルチコイド受容体を活性化し、K+排泄を増加させる(クッシング症候群症状)(Funder 2005;Gomez-Sanchez 2014)。別のもっともらしい代替案は、COVID-19によって誘導される末梢感染が、IL-6などのプロ炎症性サイトカインの産生を増加させることである(Han et al 2020)。サイトカインIL-6は、視床下部-下垂体-副腎皮質(HPA)軸を活性化し、アルドステロン、ADH、およびコルチゾールの合成および分泌を誘導し、これは低カリウム血症に寄与し得る(González-Hernández et al 2006; Päth et al 1997)。したがって、COVID-19を有する患者における低カリウム血症は、中枢因子と末梢因子の相乗効果の結果である可能性が高い。
3. SARS-CoV-2が中枢神経系に入る経路
いくつかのウイルスは、嗅神経を介した嗅球への前向性輸送や血液循環など、さまざまな経路を用いて中枢神経系に到達することが示されている(Desforges et al 2014; Durrant et al 2016)。ウイルスはまた、嗅・呼吸器上皮下粘膜に位置する鼻リンパコンパートメントと、嗅・呼吸器上皮下粘膜およびエトモイドリンパ管と、脳の脳脊髄液(脳脊髄液)コンパートメントとの間のコミュニケーションのために、篩板(しばん)を通過する嗅神経に沿ってくも膜下腔に侵入する可能性が高い(Johnston et al 2004;Zakharov et al 2004)。ウイルスがくも膜下腔に入ると、くも膜下脳脊髄液が血管周囲空間と並んで脳の深部領域に急速に通過するため、脳脊髄液の流れは、間質空間を介して脳全体への拡散を促進することができる(Shetty and Zanirati, 2020)(Iliff er al)。 間質空間に入ると、ウイルスは神経細胞またはACE2を発現する任意の神経細胞に侵入する可能性が高い。
SARS-CoVは、SARS-CoV-2と79%の相同性を持つβ-コロナウイルスであり、重症急性呼吸器症候群(SARS)患者の75%の脳内で検出された。SARS-CoVの存在は、特に視床下部および大脳皮質で認められた(Gu et al 2005)。いくつかの研究は、SARS-CoV-2がヒトおよび動物の脳に侵入し得ることを示している(Conde Cardona et al 2020;Mesci et al 2020;Song et al 2020b 2020a)。ある研究はまた、ヒト脳オルガノイドおよびヒトACE2を過剰発現させたマウス、ならびに死後のCOVID-19患者の脳サンプルにおいて、SARS-CoV-2の神経細胞への浸潤の証拠を提供している(Song et al 2021)。これらの研究において、著者らは、SARS-CoV-2感染ニューロンにおける特異的な代謝亢進状態および局所的な血管変化を観察した。SARS-CoV-2は、試験管内試験曝露の2日後に3次元ヒト脳オルガノイドのニューロンに優先的に感染し、神経変性だけでなく、タウタンパク質の調節障害および高リン酸化を誘発する(Ramani et al 2020)。さらに、SARS-CoV-2は、iPSC由来のヒト脳オルガノイドのニューロンに侵入し、皮質ニューロンを死滅させ、シナプス形成障害を促進した(Mesci et al 2020)。さらに、SARS-CoV-2は、脳脈絡叢上皮に感染し、ヒト脳オルガノイドにおける血液-脳脊髄液(脳脊髄液)バリアを損傷した(Pellegrini et al 2020)。免疫学的変化は、神経学的損傷を有するCOVID-19患者の脳脊髄液において同定されており、SARS-CoV-2の神経侵入を示唆している(Alexopoulos et al 2020;Song et al 2020a)。
図1は、SARS-CoV-2が中枢神経系にアクセスすることができる2つの経路を示す。嗅神経を介した抗重力輸送は、嗅球に到達し、次いで中枢神経系の残りの部分に到達するための示唆された経路の1つである(Durrant et al 2016; ButowtおよびBilinska 2020; Conde Cardona et al 2020)。嗅球がPVNへの送液性突起を有することは注目に値する(Guevara-Aguilar et al 1988)。そのような神経伝達は、逆行性および前行性方向にダイニンおよびキネシンなどのタンパク質を用いてウイルスを輸送する神経細胞の能力に起因して起こり得る(Bohmwald et al 2018)。ゴールデンシリアハムスターにSARS-CoV-2を2日間経鼻接種した後、嗅上皮に急性炎症が観察された(Zhang et al 2020)。さらに、これらの著者らは、SARS-CoV-2が、鼻咽頭偽柱状繊毛呼吸上皮細胞、成熟および未熟な嗅神経細胞、およびその細胞のustentacularに侵入し、COVID-19の嗅機能障害に寄与し得ることを示した。嗅覚系におけるSARS-CoV-2の存在については十分な証拠があるが、嗅球においては、ウイルス抗原はこれまでのところ検出されていない(Bryche et al 2020;Zhang et al 2020)。したがって、前節で述べたように、ウイルスはほとんどが嗅神経に沿ってくも膜下腔を通って脳の脳脊髄液(脳脊髄液)コンパートメントに侵入していることを示唆している。
図1 SARS-CoV-2の脳内侵入経路の模式図。
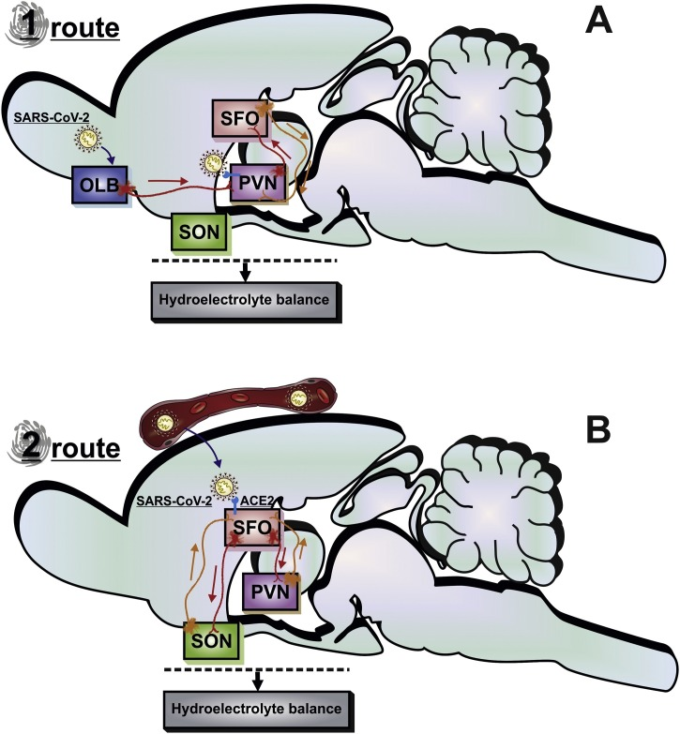
SARS-CoV-2は、嗅神経や血液循環を介して脳に侵入する。A)経路1では、ウイルスは嗅覚ニューロンの軸索によってOLBに運ばれ、PVNに向かって運ばれる。SARS-CoV-2は、PVNでACE2とプロテアーゼを介して細胞質に運ばれる。その後、ウイルスRNAは細胞内でウイルスタンパク質によって複製、転写、翻訳される。このウイルスタンパク質とRNAが組み合わされて新しいウイルスを構成し、神経細胞膜に放出される。B)経路2では、SARS-CoV-2は、血液から円周臓器の細胞外液このウイルスはACE2を介してSFOニューロンに侵入することができる。SFOからの軸索突起はPVNおよびSONニューロン上でシナプスを形成し、水電解バランスを調節する。SARS-CoV-2に感染すると、SFOとPVNの機能が障害され、水電解バランスが崩れる。ACE2,アンジオテンシン変換酵素2,OLB、嗅球、PVN、傍室視床下核、SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2,SFO、角膜下器官、SON、視床上核。
SARS-CoV-2は血液循環を介して脳に到達する可能性も示唆されている。しかし、その正確な経路はまだ解明されていない。BBBは脳の大部分を保護しており、この拡散障壁は、ほとんどの血液を媒介する成分の脳間質液への流入を遮断することができる(Ballabh et al 2004)。しかし、CVOは、BBBを横断することなく血液からの成分の流入を可能にする特定の脳領域である(Ballabh et al 2004)。CVOの典型的な特徴は、神経深部、SFO、正中上峰、薄板末期の血管器官、小脳下器官、松果体、脈絡叢、および後脳領域を含む脳領域における高透水性および柵状毛細血管の存在である(Bodiga et al 2013;DuvernoyおよびRisold 2007;Ganong 2000;JohnonsonおよびGross、1993;Simpsonon、1981)。ある研究では、血漿中のSARS-CoV-2に対するリアルタイムRT-PCRの予想される陽性結果は約15%であることが示唆されている(Huang er al)。 しかしながら、ほとんどのCOVID-19患者の血漿中のSARS-CoV-2の欠如は、循環血液中のウイルス存在の短いスパンに起因する可能性がある。実際、フェレット動物モデルにおける最近の研究では、症状発症後7日目から 20日目までの血漿SARS-CoV-2結合IgM抗体およびIgG抗体による血清化の前に、SARS-CoV-2がCOVID-19の急性期にのみ血中循環およびCVO中に存在することが報告されている(Kim et al 2020)(Thevarajan et al 2020)。これらを総合すると、SARS-CoV-2はいくつかの経路で脳に入り込むことができるようである。SARS-CoV-2は血液、脳脊髄液、または嗅球からの滲出液を介してCVOに侵入する可能性があるため、CVOはSARS-CoV-2に感染する最初の脳領域の一つである可能性が高い。COVID-19患者の死後の脳組織におけるCVOを調べることで、さらなる知見が得られる可能性が高い。
4. SARS-CoV-2感染を促進する特徴
SARS-CoV-2がCVOの細胞外液に到達する可能性が高いことを考えると、このウイルスによる古典的な宿主細胞感染とSFO領域の細胞特性、および視床下部のPVNとの間に平行線を引くことが重要である。SARS-CoV-2は、表面の王冠のようなスパイクによって識別される不規則な楕円形をしており、直径は約130nmである(Fathi, 2020)。ウイルス粒子は、ポジセンス一本鎖RNAゲノムと、スパイク(S)エンベロープ(E)膜(M)ヌクレオカプシド(N)などのタンパク質を特徴とする。S、MおよびEタンパク質は、ウイルスエンベロープ(宿主細胞膜に由来するリン脂質二重層)に固定されている。あるいは、Nタンパク質は、ウイルスRNAと相互作用してウイルスのコアに入る(FehrおよびPerlman 2015)。S糖タンパク質のタンパク質分解活性化は、ウイルス侵入の初歩的な条件である。一般に、S糖タンパク質は、S1サブユニットとS2サブユニットの間の領域でタンパク質分解タンパク質によって切断され、プレフュージョンコンフォメーションで非共有結合的に拘束されたままである。SARS-CoV-2の侵入は、宿主細胞におけるACE2受容体との結合によって、膜貫通型S糖タンパク質のウイルスS1サブユニットによって機能的に媒介される。ACE2は、SARS-CoV-2の機能的受容体として知られている(Du et al 2009;Kong et al 1997;Lu et al 2020;Wrapp et al 2020)。この膜貫通タンパク質は、3つのドメインによって形成される。i)細胞外ドメインは、細胞外液中のSARS-CoV-2としていくつかのリガンドと相互作用することができ、(iii)中間ドメインは、細胞外と細胞内のミリーウスを連結し、(iiii)細胞内細胞質ドメイン(Jaia et al 2009;Peng et al 2011)である。多くのヒト組織に分布するACE2は、気道上皮、血管内皮、肺、腎臓、腸、精巣、心臓、および脳に深く発現している(Donoghue et al 2000; Hamming et al 2004; Harmer et al 2002)。実際に、ACE2はPVNだけでなく、SFO、lamina terminalis、下垂体、正中天、後膜領域の血管器官でも発現していることが既に報告されている(Doobay et al 2007)。その後、S2ドメインは、ウイルス融合機構の活性化を促進して宿主細胞内に侵入する(Kong et al 1997)。神経細胞および細胞外液に発現するいくつかのプロテアーゼは、SARS-CoV-2の活性化を媒介することができる。膜貫通型プロテアーゼ/セリン型2(TMPRSS-2)は、細胞内へのSARS-CoV-2の侵入を促進する重要なプロテアーゼとして記載されている細胞表面に付着したトリプシン様セリンプロテアーゼである(Hoffman et al 2020;Qian et al 2013)。また、TMPRSS-2は視床下部神経細胞においても発現している(Ubuka et al 2018)。したがって、PVNおよびSFOは、SARS-CoV-2がニューロンにアクセスしやすい領域であると考えられる。
SARS-CoV-2の内部化後、ウイルスゲノムは細胞質中に放出される(Lai and Stohlman, 1981)。ゲノムRNAの一部は非構造タンパク質(nsp)に翻訳され、これがRNA合成、複製、およびサブゲノムRNAの転写を担当する複製転写酵素複合体の引き金となる(Sethna et al 1991)。その後、SARS-CoV-2のゲノムRNAは、ネガティブ鎖RNAに転写され、このネガティブ鎖RNAは、ポジティブセンスのゲノムRNAおよびサブゲノムRNAの合成のための鋳型として使用され(FehrおよびPerlman 2015)レプリカーゼポリプロテインの下流で使用される(Sethna et al 1991;Siu et al 2008)。サブゲノムRNAから翻訳された構造タンパク質S、E、およびMは、次いで、小胞体(ER)およびゴルジ装置に挿入され、ウイルスゲノムを成熟したビリオンにカプセル化する(KuoおよびMasters 2013;Sethna et al 1991)。その後、ウイルスは小胞の形で細胞表面に運ばれ、エキソサイトーシスによって放出される(図2)。SARS-CoV-2に感染した宿主細胞は、時折、細胞溶解を活性化し(Jia er al 2005; Sethna er al)。 1991; Ye and Hogue, 2007; Zhou er al 2020)ビリオンのオーバーフローおよび隣接するニューロンに影響を与える細胞質イオン量の放出につながる。要約すると、我々は、先に述べた経路を介して、SARS-CoV-2がSFO-PVN-SONニューロンに感染し、それにより、ウイルスの複製、神経変性、または神経炎症によって促進されるニューロン機能の変化により、その生理的役割が変化することを提案する。SFOは、心血管系の調節とハイドロミネラルのホメオスタシスを調節する古典的な核である(Ch’ng and Lawrence, 2019)。加えて、SFOは、自律神経および神経内分泌調節のための確立された経路であるPVNおよびSONニューロン上でシナプスを形成する。これらのニューロン接続はまた、形質水バランスおよびナトリウムおよびK+のような形質イオンを維持するADHの負のフィードバック作用に寄与する([hydromineral homeostasis](Washburn et al 1999))。このように、SFO-PVN-SON活性の破綻は、水電解障害を引き起こす可能性がある。
図2 SFOおよびPVNニューロンにおけるSARS-CoV-2の感染経路の模式図
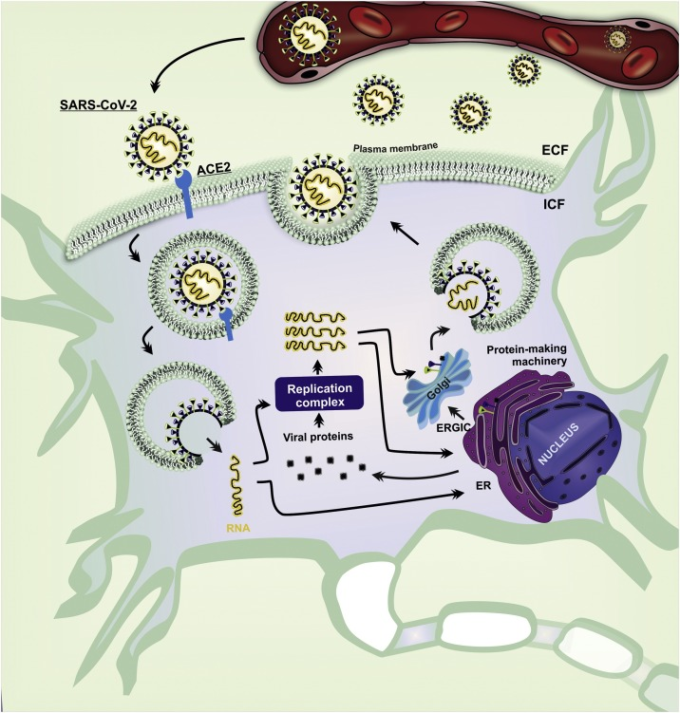
細胞外液中のSARS-CoV-2は、ウイルス感染の必須の決定因子である。SARS-CoV-2のプロテアーゼによるタンパク質分解活性化(TMPRSS)の後、S糖タンパク質はSFOおよびPVNニューロンにおいてACE2と結合する。ACE2は融合膜によるウイルスの侵入を媒介している。細胞質では、SARS-CoV-2は、ウイルスタンパク質に翻訳されたり、複製されたりする一本鎖RNAを送達する。ゴルジ体複合体は、ウイルスタンパク質とRNAを組み立て、ゴルジ体で新しいビリオンを構成し、ニューロンの形質膜で放出される。ACE2,アンジオテンシン変換酵素2,ECF、細胞外液、ER、小胞体、ERGIC、ER-ゴルジ中間コンパートメント、ICF、細胞内液、PVN、視床下部核、SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2,SFO、角膜下器官、TMPRSS、膜貫通型プロテアーゼ/セリン。
5. 結論と今後の展望
COVID-19患者の水電解質障害には、SFO-PVN-SONネットワークに基づくメカニズムが関与していることを提案している。SARS-CoV-2感染はまた、HPA軸の活性化を悪化させ、ADHとアルドステロンの分泌を増加させ、交感神経の過活動を誘発する可能性がある。これらの因子は、直接的または間接的にK+の損失に寄与し、結果として低カリウム血症を引き起こす。しかし、SARS-CoV-2が感染後の様々な時点でCVOやその他の中枢神経系領域にどのような経路でアクセスしているのかを十分に理解するためには、COVID-19を用いた動物モデルでのさらなる研究が必要である。さらに,COVID-19患者の死後の脳組織におけるCVOを注意深く観察し,SFO,PVN,SONの神経変性や神経炎症の程度を他の脳領域と比較して評価することが必要である.
