Fasting as a Therapy in Neurological Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6836141/
要旨
断食は進化の中で深く根付いているが、今日の最も一般的な、無効にする神経疾患へのその潜在的なアプリケーションは、まだ比較的未踏のままである。絶食は、神経疾患の幅広い配列を打ち消すかもしれない方法で、ニューロンの生体エネルギー、可塑性、および回復力を最適化する変更された代謝状態を誘導する。
動物とヒトの両方において、断食は多くの神経疾患の主要な危険因子であるメタボリックシンドロームを予防し、治療する。動物では、絶食はおそらく腫瘍の形成を防ぎ、確立した腫瘍を治療し、化学療法に対する腫瘍の反応を改善する。脳に関与するがんを含むヒトのがんでは、絶食は化学療法に関連した副作用を改善し、化学療法から正常細胞を保護する可能性がある。
絶食は認知力を改善し、加齢に伴う認知機能の低下を食い止め、通常は神経変性を遅らせ、脳損傷を軽減し、脳卒中後の機能回復を促進し、動物モデルにおけるてんかんおよび多発性硬化症の病理学的および臨床的特徴を緩和する。
主に研究が不足しているため、神経変性、脳卒中、てんかん、多発性硬化症を含むヒトの神経疾患の治療法としての断食を支持する証拠は間接的か、存在しない。動物実験でのエビデンスの強さを考えると、神経疾患の治療法としての断食の有効性についての今後の研究が待たれるところである。
キーワード
絶食、治療、神経疾患、メタボリックシンドローム、がん、神経変性、脳卒中、てんかん、多発性硬化症
1. はじめに
ファスティングは、新しい千年紀の間に人気が急上昇している。断食が人間の健康の多くの面で有益であるとの認識が広まってきたことが、この新たな熱狂に拍車をかけている。ファスティングの健康上の利点が謳われているにもかかわらず、従来の医療現場ではいささか異質な存在であることに変わりはないが、この状況は今に始まったことではない。マーク・トウェインが言ったように、「歴史は繰り返すものではないが、それは韻を踏んでいる 」のである。
なぜ、どのように断食が神経疾患の配列に治療法として適用できるかもしれない理解するためには、進化的および機械論的な文脈の両方で断食を検討するのに役立つ。そうすることで、断食と薬物療法は相互に排他的である必要はなく、組み合わせることができ、そのようなアプローチが実際には理想的であるかもしれないことが徐々に明らかになってくるはずである。医療費が高騰し、障害を持つ神経疾患が増加している時代には、従来の医学的アプローチと並んで、自己啓発的で、費用のかからない、効果的な治療法の影響は、実質的でポジティブなものになるだろう。
このような背景から、断食の定義、起源、メカニズム、およびさまざまなレジメンについて議論し、続いて、さまざまな神経疾患の予防と治療における断食を支持するエビデンスの要約を行い、最後に、断食に関連する最も一般的な副作用と誤解についての考察を行う。
2. ファスティングとは何か?
「断食」とは、特定の反復的な期間、飲食物を自発的に断つことであり、断食期間は通常、ヒトでは12時間から3週間と定義されている[1,2,3,4]。断食は、現代社会では1日3食以上の食事を摂ることが特徴であり、座り仕事の多いライフスタイルと組み合わせることで、慢性的な神経疾患を発症するリスクを高める可能性があるため、自由食(「好きなように」)と対比されることが多い [5]。絶食は、自発的でも制御されていない慢性的な栄養不足の状態であり、臓器不全および死に至る可能性がある飢餓と混同されるべきではない。
2.1. 断食 起源
進化の中では、長時間の栄養素のない環境に耐えることができる生物は、そうすることができないものよりも重要な生存上の優位性を持っていた。低エネルギー環境に関連するストレスを生き残るための進化的な選択圧力は、ヒトにおいて数十億年ではないにしても、数百万年の間に保存されてきた絶食誘発性代謝メカニズムを生成した。[6]。
2.1.1. 断食のヒト以前の進化の起源
多くの単細胞生物や単純な多細胞生物は、栄養不足の時期に代謝を変化させ、資源を節約し、ダメージを最小限に抑え、寿命を延ばすことを目的としている。例えば、突然変異大腸菌は、栄養価の高いブロスからカロリーのない培地に移行すると、一連の代謝変化を経て野生型菌の4倍以上の生存期間を持つようになり[7]、酵母のサッカロマイセス・セレビシエは、成長培地から水に移行すると、ストレス耐性を高めて寿命を2倍にする定常期に入る[8,9]。同様の反応は、線虫のCaenorhabditis elegansのように、栄養分を失った単純な多細胞生物でも観察されており、この場合は代謝的な「ダウアー状態」に移行し、寿命が大幅に増加することになる [10]。
これらのより単純な生命体の他にも、肺魚、ウナギ、カエル、ヘビ、節足動物などの多くの複雑な多細胞生物もまた、安静時の代謝率と活動レベルの低下に起因することもあり、栄養不足に対する並外れた抵抗力を進化させている[11]。しかし、いくつかの複雑な生物は休眠段階に入るのではなく、実際に絶食時に認知レベルと身体活動レベルを上げ、食物を探して獲得する能力を向上させている。例えば、絶食レジメンのげっ歯類では、脳(および生殖腺)以外のほとんどの器官のサイズが減少していることが示されている[12]が、その結果、認知および身体能力が維持または改善されている[13,14]。別の例では、従来の毎日の給餌スケジュールから、週に3回の食事のみで構成される「峡谷と高速」スケジュールに切り替えた飼育下のライオンは、ペーシングなどの不適応なステレオタイプの行動の減少、および嗅ぎやストーキングなどの適応的な狩猟関連の行動の増加を示している[15]。
2.1.2. 人類史における断食
進化前の生物の多くがそうであったように、農耕前のヒトは定期的な食糧不足に耐えていた [16]。人類は200万年前から狩猟採集を行ってきたが、農業への移行が起こったのは1万2000年前の比較的短い期間であった [17]。したがって、農耕後の人類には、農耕によって提供される継続的な食糧供給に完全に適応するのに十分な時間がなかったのかもしれない。例えば、古代ローマ人は、1日に1回以上の大食いは不健康であると考えていた[19]。キリスト教やイスラム教を含むほとんどの世界の宗教もまた、定期的な断食を宗教的実践に取り入れていた[20]。
現代では、断食の潜在的な健康上の利点は断続的に認識されているが、忘れ去られている。アメリカの医師エドワード・デューイは1800年代に断食についてやや過激な見解を採用し、事実上すべての病気は食べ過ぎが原因であると信じていた[21]。1900年代には、ドイツの医師オットー・ブヒンガーは、多くの人間の病気における断食の有益な効果を厳密に文書化した最初の人物であり、「断食は、疑いなく、治療の最も効果的な生物学的方法である」[22]と書いている。2000年代にイタリア生まれの生物地球学者であり、断食の研究者でもあるヴァルター・ロンゴは最近、断食が複数の「長寿プログラム」を選択的に活性化し、それが寿命の延長だけでなく、健康寿命の延長にもつながる可能性があることを示唆している[23]。不思議なことに、これらおよび他の断食擁護者にもかかわらず、ほとんどの現代社会で確立された食事パターンは、肥満、2型糖尿病、および障害のある神経疾患の様々な世界的に増加している有病率に関連付けられているパターンは、1日3回以上の食事のままである[24,25]。
2.2. 断食 メカニズム
絶食は、ニューロンに影響を及ぼす可能性のある多くの代謝および転写機構の協調的な変化を誘導する(図1)。これらの変化は、ニューロンの生体エネルギー、可塑性、ストレスに対する回復力を最適化し、認知能力の維持または向上につながる全身的な代謝状態の変化をもたらする[5]。
図1 空腹時に誘発される代謝および転写機構と神経細胞への影響
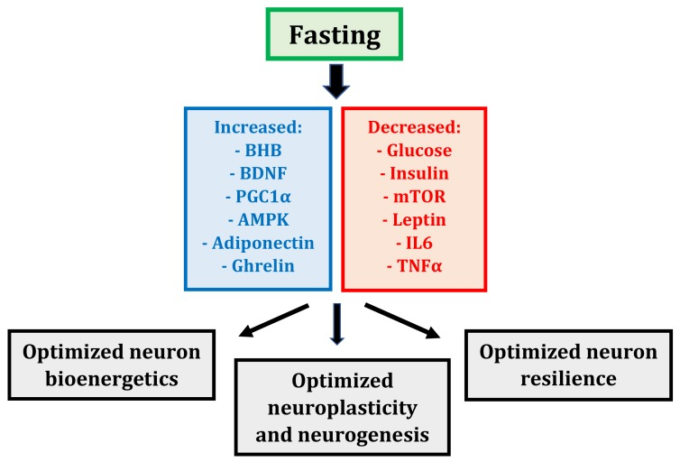
(BHB-β-ヒドロキシ酪酸;BDNF-脳由来神経栄養因子;PGC1α-ペルオキシソーム増殖因子活性化受容体γ共活性化因子1α;AMPK-AMP活性化プロテインキナーゼ;mTOR-ラパマイシンの哺乳類標的;IL-6-インターロイキン6;TNF-α-腫瘍壊死因子α)。
2.2.1. 断食。全身の変化した代謝状態
12-36時間の絶食後、ヒトの体は、低血糖レベル、肝臓グリコーゲン貯蔵量の枯渇、および脳の主要なエネルギー源として機能する脂肪由来のケトン体、またはケトンの肝生産によって特徴づけられるケトーシスの生理学的状態に入る[26]。肝臓はケト生成の主要部位であるが、脳のアストロサイトもケトン体を生成する [27,28]。断食を開始してから数日以内に、ケトン体は脳の好ましい燃料源となり、脳のエネルギー必要量の最大70%を供給するようになる [29]。ケトン体は、筋肉[30,31]や脳[32]において単位酸素あたりのエネルギーのより効率的な供給源となり、ニューロンの生体エネルギーと認知能力を向上させている。
しかし、ケトンはニューロンにとって単なるエネルギー源ではなく、血液中の主要なケトンであるβ-ヒドロキシ酪酸(BHB)もまた、重要なシグナル伝達機能を果たしている[5,26]。海馬および皮質ニューロンでは、BHBは、BDNFの発現を抑制する酵素であるヒストン脱アセチル化酵素を阻害することで、脳由来神経栄養因子(BDNF)の転写を誘導することで、重要なシグナル伝達の役割を果たしている[34]。BDNFは、ミトコンドリアの生合成を刺激し、シナプス構造を維持し、新しい海馬ニューロンの産生と生存を促進し、ニューロンの傷害や疾患に対する抵抗力を高めるなど、ニューロンの機能を制御する重要な役割を担っている[35]。
BHBとBDNFに加えて、絶食はミトコンドリアのマスターレギュレーターである転写因子ペルオキシソーム増殖因子活性化受容体γ共活性化因子1α(PGC1α)の発現を誘導する [5,36]。PGC1αはミトコンドリア生合成の中心的な誘導因子であり、ミトコンドリアのバイオマスを増加させ、その結果、ニューロンの生体エネルギーを高め、シナプス可塑性を可能にする。PGC1αはまた、ミトコンドリアの組成と機能を調節する。例えば、PGC1αを異所的に発現させたトランスジェニックマウスから分離された筋ミトコンドリアは、野生型のコントロールと比較して、呼吸能力の増加を示した[37]。このように、PGC1αはミトコンドリアの生合成を刺激するだけでなく、内在性の特性を変化させたミトコンドリアの形成をも刺激し、どちらもニューロンの生体エネルギーにプラスの影響を与えている。
絶食はグルコース代謝およびインスリンシグナル伝達に強力な効果を示す [1,6]。ヒトでは、3~5日間の絶食は血糖値を30~40%低下させ、解糖を阻害する [38,39,40]。交互に3週間の断食を行うと、断食した日のインスリン値が50~60%低下する[41]。一般的に、ヒトでも3~5日間の断食は、哺乳類の主な成長因子であるインスリン様成長因子(IGF-1)が60%低下し、その主な結合タンパク質の1つであるIGF-1結合タンパク質(IGFBP1)が5~10倍に上昇し、筋肉量を維持するために上昇する成長ホルモン(GH)が2~3倍に上昇する結果となる[39,42,43]。したがって、絶食は、インスリン感受性と成長因子シグナル伝達を維持しながら、慢性的で過剰な、潜在的なグルコース代謝異常の発症を防ぐことができ、これらはすべてニューロンの生体エネルギーに利益をもたらす可能性がある。
絶食はまた、細胞の合成および分解プロセスに強力な影響を及ぼす [44,45]。細胞合成と分解のバランスは、代謝の2つのマスターレギュレーター、哺乳類ラパマイシン標的(mTOR)とAMP活性化プロテインキナーゼ(AMPK)のそれぞれの活性によって調節される[44]。対照的に、細胞のエネルギー備蓄量が少ない場合、AMPKはmTORをダウンレギュレートしてエネルギー消費を最小限に抑え、オートファジー(誤って折り畳まれたタンパク質や損傷したオルガネラを除去し、栄養素をリサイクルし、エネルギー生産を促進する細胞内分解経路)を刺激する。絶食はmTORを抑制し、AMPKを上昇させ、それによって栄養消費と成長を制限し、オートファジーと生存に有利な状態にする;mTORとAMPKは主に筋細胞で研究されてきたが、最近の証拠は、これら2つの拮抗的なマスター代謝調節因子がニューロンの絶食反応をも媒介する可能性があることを示唆している[5]。
絶食は、レプチン、アディポネクチン、グレリンのホルモン活性を変化させることで脂肪代謝に影響を与える [1,5,46]。レプチンは炎症促進状態と関連しているのに対し、アディポネクチンはインスリン感受性の亢進および炎症の抑制と関連している[47]。グレリンもまた、インスリン感受性の亢進と関連している[48];さらにグレリンは海馬のシナプス可塑性と神経新生を刺激する可能性がある[49]。絶食はレプチンを減少させるが、アディポネクチンとグレリンを増加させるが、これらの変化はおそらくニューロンの生体エネルギーと神経経路の維持に有益である。
最後に、絶食は炎症を抑制し、インターロイキン6(IL-6)や腫瘍壊死因子α(TNF-α)などの炎症性サイトカインの発現を減少させる [50,51]。炎症過程は多くの異なる神経障害の根底にあるため[52]、神経および全身の炎症を抑制する絶食の能力は、これらの障害における神経細胞の生存を改善する可能性がある。
2.2.2. 断食 カロリー制限の効果だけではない
カロリー制限とは、食事の頻度を維持したまま、カロリー摂取量を慢性的に20~40%減少させることである [1]。1世紀以上にわたる研究により、カロリー制限が慢性疾患を軽減し、さまざまな種の寿命を延ばすことが示されている [53]。カロリー制限と断食は多くの類似したメカニズムを共有しており、断食はしばしば時間の経過とともにカロリー摂取量の減少をもたらすので、断食の潜在的な利益が、断食の特定の効果とは対照的に、単にカロリー摂取量の減少によるものであるかどうかという疑問がしばしば提起されている。
動物やヒトを対象としたいくつかの研究では、断食はカロリー制限以上に細胞(ニューロンを含む)の代謝に利益をもたらす可能性があることが示されている。全般的なカロリー制限がないにもかかわらず、前者は後者に比べてグルコースレベルとインスリン活性の改善、神経毒であるカイニン酸に対するニューロン抵抗性の向上など、有益な代謝効果を示していることが示されている[54]。過体重および肥満の非糖尿病患者を対象とした研究では、絶食者のインスリン感受性の改善が、非絶食でカロリーを調整した場合と比較して大きいことが示されている [55,56]。最近、糖尿病前の男性を対象とした5週間のランダム化クロスオーバー試験では、体重減少を防ぐために十分な全体的なカロリー摂取量を含む絶食レジメンを、規則的な食事スケジュールの対照群と比較した;両群ともカロリー摂取量は一致していたが、絶食群はインスリン感受性および代謝健康の他の測定値においてより大きな改善を示した [57]。
メタボリックヘルスに対する空腹時特異的な効果の最も明白な説明は、空腹時とカロリー制限のタイミングの基本的な区別にあるかもしれない。具体的には、断食は断続的に行われるのに対し、カロリー制限は継続的に行われる。12-36時間の絶食後には、炭水化物およびグルコースから脂肪酸およびケトンへの代謝移行または「スイッチ」が主要な細胞燃料源として存在する[5]。絶食状態では、スイッチは「オン」であり、理論的にはニューロンのオートファジーと生存経路をアップレギュレートするのに対し、給餌状態ではスイッチは「オフ」であり、リモデリングと成長経路が強調される。このように、カロリー制限とは異なり、断食は、比較的ストレスのない細胞の回復期に向けて「舞台を整える」ことで、連続的な生体エネルギーの課題を利用している。例えば、急性のmTOR活性化は筋肥大を促進するが、慢性的な活性化は萎縮を引き起こす [58,59,60]。
2.3. 断食。レジメン
断食レジメンを特徴づける3つのパラメータ-飲食物制限の強度、断食期間の頻度、および断食期間の持続時間-がある(表1)。理想的な」断食レジメンは、個人のライフスタイルと耐性に依存する。
表1 ヒトの断食レジメン(強度、頻度、期間別)
| 飲食制限の強度 | 絶食期間の頻度と期間 | 人間の研究で使用される一般的な組み合わせ |
|---|---|---|
| 「純粋な」断食(食べ物や飲み物はない。多くの場合、宗教的慣習の文脈で) | 時間制限のある給餌(毎日4〜12時間の食事時間枠) | 水/液体のみの時間制限給餌 |
| 水のみの断食(水のみ、および塩と微量栄養素が許可される) | 隔日断食(1日おきの断食) | 水/液体のみ交互-毎日の断食 |
| 水分のみの断食(水のみの断食と、お茶やブラックコーヒーなどのカロリーのない水分) | 週2日断食(週2日連続断食) | 制限されたカロリー摂取量週2日絶食 |
| 限られたカロリー摂取の絶食(野菜または骨のブロスを介して、1日あたり最大250〜500 kcal) | 定期的な断食(断食期間は2日から3週間) | 限られたカロリー摂取量の定期的な断食 |
2.3.1. 飲食制限の強度
断食の「強度」とは、断食期間中に許可される飲食物の量と種類を指する。断食期間の強度は、すべての飲食物を完全に排除するもの(「純粋な」断食)から、断食した代謝状態を維持することを目的とした特定の食事の摂取を最小限に抑えるものまで様々である。
飲食物を一切摂らない断食は概念的には単純であるが、現実的には水分摂取量が不足しているため、24時間という現実的な上限が課せられている。このタイプの断食の例としては、イスラム教のラマダン月に行われる断食があり、日の出から日没までの約30日間、個人はすべての飲食物を断つ [2,62]。
水のみの断食では、カロリー摂取はすべて省略されるが、十分な水分補給が可能であるため、十分な塩分とその他の微量栄養素が維持されていれば、数日、数週間、あるいは数ヵ月に及ぶ断食が可能である [63,64]。体液のみの断食では、紅茶やブラックコーヒーなどのカロリーのない水分を摂取することも可能であり、エネルギーを維持し、人によっては一過性の空腹感の波を抑えるのに役立つ。どちらのタイプの断食でも、1日に最低2~2.5Lの水または水分の摂取を目指すべきであり [65]、微量栄養素を補給するためにマルチビタミンを追加してもよい [66]。
水分のみの絶食に耐えられない患者では、絶食中の代謝状態を崩さないような特定の食事を選択することで、ある程度の絶食強度を確保して耐性を向上させることができる。これらの食事のカロリー摂取量は、1日あたり250~500kcalを超えてはならない [65]。一般的な選択肢の1つは、毎日の野菜や骨のスープを断食に取り入れることであるが、これもまた水分と微量栄養素を供給する [65,66]。
2.3.2. 断食期間の頻度と期間
ほとんどのマウスの系統では、食物なしで3日以上生存することはできないが、ほとんどのヒトでは30日以上の絶食期間を生き延びることができる [1]。このように長時間の断食が可能であることを考えると、ヒトで利用可能な断食レジメンの頻度と期間にはかなりのばらつきがある [2,3,4,67]。
すべての絶食レジメンの中で最も忍容性が高いのは食事時間制限(TRF)であり、12~20時間の毎日の絶食期間と、毎日4~12時間の「食事の窓」を交互に設けている [2,3,4,67,68]。摂食時間を午前中または午前中に制限すると、午後遅くまたは夕方の摂食時間に比べて体脂肪およびインスリン抵抗性に優れた効果が得られるという証拠がいくつかある [68]。
1日よりも長く続く断食期間は、しばしば広く使われている用語「断続的断食」の下にグループ化されることが多いが、その定義は情報源によって異なることが多い [2,3,4,67]。実用的な意味では、この用語の使用は、24-48時間持続する反復的な断食期間を含む断食レジメンには控えた方がよいであろう。ヒトでの研究では、最も一般的な間欠的な断食レジメンは、一日おき断食(ADF)および週に2日間連続して行う断食(週2日断食)である。
定期的な断食は、典型的には2日~3週間の長期の断食期間を指す [3]。定期的な断食は、食事時間制限(TRF)一日おき断食(ADF)または週に2日の断食に比べて、より顕著な代謝変化をもたらす可能性がある;しかしながら、多くの人にとって定期的な断食は耐えがたいものであり、個人の目標によっては必要ない場合もある。数ヵ月から1年以上にわたる断食期間がヒトで記録されているが [64,69,70]、これらは例外的なケースである。
3. 神経疾患における断食を支持する証拠
断食は神経疾患の主要な危険因子である老化を遅らせる可能性がある [1,3,4]。老化以外にも、動物とヒトでは、断食がメタボリックシンドローム(様々な神経疾患の主要な危険因子)を予防したり治療したりできるという説得力のある証拠が示されている[71]。絶食は動物においても多くの神経学的障害を予防および治療することができるが、研究が不足しているため、ヒトでは証拠がはるかに少ない(表2)。より多くのヒトでの研究が必要である。
表2 一般的な神経疾患(動物とヒトの両方)の予防と治療における治療法としての断食のエビデンスまとめ
| 障害 | 動物における証拠 | 人間の証拠 |
|---|---|---|
| メタボリックシンドローム (神経疾患の主要な危険因子) |
肥満 を緩和するインスリン感受性を改善する 高血圧を緩和する |
肥満 を緩和するインスリン感受性を改善する 高血圧を緩和する |
| がん (脳に関わるがんを含む) |
おそらく腫瘍の形成を防ぎ、確立された腫瘍 を治療する可能性がある化学療法に対する腫瘍の反応を改善する |
化学療法関連の副作用を改善する化学療法 から正常細胞を保護する可能性がある |
| 神経変性 | 認知を改善し、加齢に伴う認知機能の低下を遅らせる。通常、神経変性を遅らせる | 直接的な証拠はない(ケトン食療法からの利益の間接的な証拠のみ) |
| 脳卒中 | 脳の損傷を軽減し、 機能回復を促進する |
直接的な証拠はない |
| てんかん | おそらく発作の重症度と頻度を軽減する | 発作の重症度と頻度を軽減する |
| 多発性硬化症 | 実験的自己免疫性脳脊髄炎の病状と症状を緩和する | 直接的な証拠はない(空腹時を模倣した食事からの利益の間接的な予備的証拠のみ) |
3.1. メタボリックシンドローム
メタボリックシンドロームは、腹部肥満、インスリン抵抗性、高血圧、および脂質異常症の組み合わせで構成されている [72]。絶食は、動物およびヒトにおけるメタボリックシンドロームの主要な異常を緩和し、その結果、カロリー制限で観察されたものと同様の、そして時にはそれ以上の有益な効果をもたらす。
3.1.1. メタボリックシンドロームの治療法としての断食。動物実験
絶食は動物モデルにおいて一貫して肥満を緩和する [1,73]。絶食レジメンで維持されたげっ歯類は、自由食を与えられたげっ歯類と比較して低体重を示し、長期(20週間以上)の絶食レジメンは一般的に有意な体重減少をもたらす [54,74,75,76]。さらに、低体重は主に除脂肪量ではなく脂肪量の減少に起因する;後者は免れている [77,78]。
動物では、絶食レジメンもまた内臓脂肪を根絶し、インスリン感受性を改善する [3,4]。絶食はげっ歯類モデルにおいて2型糖尿病を治癒させるが、この効果はカロリー制限によるものではない。これは、食事時間制限(TRF)動物が自由食動物と同じ総カロリーを消費していることを考えると、前者は抗糖尿病効果を示すのに対し、後者はそうではないことを示している[79,80]。いくつかの研究では、絶食レジメンはインスリン抵抗性に有益な効果を誘導しており、それは厳しいカロリー制限によっても誘導される効果よりも優れている。例えば、一日おき断食(ADF)を投与したげっ歯類は、自由摂取のげっ歯類と比較して同等の体重を維持することができるが、それでも前者は40%のカロリー制限を行ったげっ歯類が示したものと同等かそれ以上のグルコースレベルおよびインスリン活性の改善を示している[54]。
一日おき断食(ADF)は数日以内にげっ歯類の心拍数と血圧を低下させ、両方とも1ヵ月後までに低レベルで安定化するまで低下し続け、その後は空腹時と給餌日の両方で低レベルのままである[75]。一日おき断食(ADF)レジメンを投与したげっ歯類は、心拍変動性の増加も示す[81]だけでなく、固定化ストレスに対する優れた心血管系の適応も示す[75]。心拍数、血圧、心拍変動、および心血管系のストレス適応に対する絶食を介した効果は、BDNFの増加に起因していると考えられており、これは脳幹の心血管系ニューロンのコリン作動性活性を増強する [3]。全体的に10%~20%のカロリー制限を行った一日おき断食(ADF)のげっ歯類は、慢性的に40%のカロリー制限を行ったげっ歯類よりも安静時心拍数の低下が大きいことを考えると、これらはカロリー制限によって媒介されているようには見えない[81]。
3.1.2. メタボリックシンドロームの治療法としての絶食:ヒト研究
ヒトにおける断食誘発体重減少の証拠は、動物におけるものほど一貫していない [73];しかしながら、短期(6ヵ月未満)の断食レジメンは、一般的に過体重および肥満者の体重減少をもたらす [2,3,82]。宗教的断食を受けている多くの人が体重減少を経験するが、体重減少はその後に回復することが多い [83,84]。逆に、2~6ヵ月間の断食レジメンを受けた過体重および肥満者のレビューでは、一般的に対照群と比較して3~16%の体重減少が示されており、3ヵ月以上のレジメンでは5kg以上の臨床的に意味のある体重減少が示される可能性が高い [2,4,85]。絶食レジメンとカロリー制限レジメンはどちらも同程度の体重減少をもたらすが、いくつかの研究では、絶食レジメンの方が20%~25%のカロリー制限よりも優れている可能性があることが示唆されている [56,86]。さらに、体重の減少は同様であるにもかかわらず、除脂肪体重を維持するには、カロリー制限よりも断食の方が効果的である可能性がある [85]。
断食は1世紀以上も前からヒトの2型糖尿病を逆転させることが知られており、しばしば糖尿病薬の必要性を排除している[66,87,88,89]。さらに、絶食レジメンは体重減少とは無関係にインスリン感受性増強効果を発揮するようであり[90,91]、絶食レジメンを受けた非糖尿病患者および糖尿病予備群は、カロリー摂取量をマッチさせた非絶食群と比較してインスリン感受性のより大きな改善を示す[55,56,57]。これらの知見をまとめると、絶食のインスリン感受性増強効果は、少なくともある程度は体重減少およびカロリー制限とは無関係であることが示唆される。
ヒトでは、6~24週間の一日おき断食(ADF)または週に2日の断食を行うと、一般的に体重減少の文脈で血圧が有意に低下する(収縮期3~8%、拡張期6~10%)[55,92,93]。定期的な絶食は高血圧患者の血圧低下に特に効果的である;収縮期血圧は1~2週間以内に20~60mmHg低下する [94,95]。断食とカロリー制限は血圧低下に同様の効果を示す [55,56]。
3.2. 癌
がん細胞は多くの代謝変化を示すが、最も顕著なのは、正常な酸素濃度が存在するにもかかわらず解糖速度が大幅に上昇することであり、これは「Warburg効果」として知られている[96,97]。ワールブルグ効果はエネルギー産生において非効率的である;したがって、悪性がんの90%以上に共通する特徴である、がん細胞によるグルコース取り込み速度の劇的な増加に依存している[98]。グルコースに加えて、一部のがん細胞は、成長および増殖のためにアミノ酸グルタミンに強く依存している [99,100]。がん細胞のグルコースおよびグルタミンへの過度の依存は、ほとんどのがんに特徴的なミトコンドリアの数、構造、および機能の欠乏に起因すると考えられている[101] [97]。これらの代謝の特徴に加えて、がん細胞は、規制緩和された過敏なインスリン、IGF-1,およびmTORシグナル伝達 [58,102,103]、ならびに機能不全のオートファジー[45]を示す。
3.2.1. がんにおける治療法としての絶食。動物実験
1914年にRousは、食物摂取量の減少がげっ歯類におけるがんの発生率を減少させることを報告した [104]。それ以来、多くの研究がカロリー制限レジメンがげっ歯類ではおそらく75%、アカゲザルでは50%の腫瘍発生率を減少させることをまとめて示している [105] 。これらの知見の説明は、カロリー制限が血中グルコースおよび成長因子の利用可能性を減少させ、がん細胞の増殖を抑制するという事実に部分的に関係していると考えられる [107]。絶食レジメンもまた、ほとんどのげっ歯類のがんモデルにおいて腫瘍を予防する;しかしながら、その結果はカロリー制限と比較してより可変的である[105]。これらの所見は、使用される特定の絶食レジメンおよび再給餌期間に採用される多量栄養素の比率に関する研究間のばらつきによって説明できるかもしれない;両方とも腫瘍予防の程度に強く影響する可能性があり、多くの場合、カロリー制限の腫瘍予防効果を上回る [108,109,110,111]。カロリー制限と比較して、絶食は大量のケトン体の産生をもたらすが、これはがん細胞によって有効に利用されず、がん細胞の増殖を阻害する可能性がある [112,113,114]。絶食はまた、グルコース、グルタミン、および成長因子の利用可能性をカロリー制限よりも断続的に低下させ、理論的にはがん細胞から主要な燃料を奪い、増殖する能力を阻害する。
予防以外にも、動物において絶食が確立した腫瘍を治療することができるという証拠がいくつかある。例えば、腫瘍細胞を腹腔内接種したげっ歯類は、10日間の一日おき断食(ADF)後の生存率が50%であったのに対し、自由給餌では12.5%しか生存しなかった[115]。さらに、実質的な証拠は、絶食が化学療法と協働して「差動ストレス抵抗性」の細胞状態を作り出すことで化学療法に作用することを示している。これにより、エネルギー不足の正常細胞はストレス抵抗性経路を活性化させることでエネルギー保存および生存を優先し、限られた栄養の利用可能性および化学療法によって生じる極限状態に対してより抵抗力を持つようになる [45,107]。対照的に、エネルギーを失った癌細胞は、成長と増殖を優先し続け、ストレス抵抗性経路を活性化しないため、限られた栄養素の利用可能性と化学療法によって課せられるストレスに対して脆弱になる。差動的ストレス抵抗性の概念を支持するために、絶食はグリオーマを含む様々なげっ歯類がんモデルの化学療法に対する治療反応を改善することが示されている [45,116]。
3.2.2. がんの治療法としての断食。ヒトの研究
ヒトのがん予防における絶食の効果に関するデータはほとんどない。動物と同様に、絶食は栄養不足の環境を助長し、がん細胞に敵対的である可能性がある [107]。しかし、具体的な証拠という点では、観察研究しかなく、示唆に富むものしかない;例えば、2337人の乳がん生存者の集団において、毎晩の短い断食はがんの再発の増加と関連していた [117]。
いくつかの小規模研究では、原発性脳腫瘍および脳に転移する可能性のあるがんを含む、ヒトの確立したがんの治療に断食が有望である可能性があることが示されている。成人における最も一般的な原発性悪性脳腫瘍である膠芽腫は、生存期間の中央値が1~2年である [118]。他の形態のがん治療と併用して水のみの絶食レジメンを使用した膠芽腫患者の症例報告では、腫瘍の増殖に関して良好な転帰が報告されている [119,120]。化学療法と併用した断食の潜在的有用性は、肺がんや乳がんなど、脳に転移することが多いがんを含む他のがんでも評価されている。肺がん1人と乳がん4人を含む10人の患者が参加した症例シリーズ
では、化学療法の前後の絶食により、脱力感、疲労、胃腸の不調などの化学療法に関連した有害作用が減少した [121]。さらに、乳がんの女性13人を対象としたランダム化試験では、化学療法の前後に24時間の絶食を行うか、または自由食に割り付けられ、絶食は忍容性が高く、化学療法による赤血球および血小板数の減少を予防し、正常細胞をDNA損傷から保護する可能性があることが示された [122]。さらに、肺がん患者1人と乳がん患者5人を含む20人の患者が参加した症例シリーズでは、化学療法前および化学療法中の48時間以上の絶食は、DNA損傷から正常細胞を適度に保護した [123]。
3.3. 神経変性
ハンチントン病(HD)パーキンソン病(PD)アルツハイマー病などの神経変性疾患は、異なるニューロン(HDでは線条体棘突起ニューロン、パーキンソン病では広範囲のドーパミン作動性ニューロンおよびコリン作動性ニューロン、アルツハイマー病では皮質コリン作動性ニューロン)を苦しめている;しかしながら、3つの疾患はいずれもニューロンの生体エネルギー、グルコース代謝、および神経栄養因子シグナル伝達の障害を示している[3,124]。3つの障害すべてにおいて、マスターミトコンドリア調節因子PGC1αの発現低下があり、ミトコンドリアの生合成と機能の低下が関連している[36,124]。さらに、呼吸鎖はパーキンソン病とアルツハイマー病で障害されており、特にパーキンソン病は複合体Iで著しい欠損を示す[125]。さらに、PDおよびアルツハイマー病の両方は、ニューロンのグルコース代謝およびインスリンシグナル伝達の障害を示し[126,127]、特にアルツハイマー病は、抵抗性だけでなく脳のインスリン欠乏によって特徴づけられるため、脳特異的な「3型」糖尿病の一形態として記述されているアルツハイマー病につながる[128]。
3.3.1. 神経変性における治療法としての断食。動物実験
絶食は非神経変性動物モデルにおいて認知を改善し、認知機能の低下を防ぐ。絶食レジメンを受けたげっ歯類は、自由食を与えられたげっ歯類と比較して認知能力が向上していることが示された [14,129]。食事時間制限(TRF)は、自由摂取させたげっ歯類で観察された脳白質の完全性、エネルギー産生、認知の加齢に伴う低下を停止させる [130,131]。食事時間制限(TRF)で維持されたマウスはまた、海馬のBDNFレベル、シナプスの強さ、および神経新生の増加を示している[132,133]、認知の改善は、ある程度、BDNFによって媒介されていることを示唆している。
絶食は通常、HD、PD、およびアルツハイマー病の動物モデルにおいて神経変性を遅らせる [1]。ハンチントン変異マウスでは、線条体および皮質のBDNFレベルとグルコース代謝が欠損し、神経変性と運動機能障害が起こる。しかし、一日おき断食(ADF)を十分に早期に開始すると、BDNFレベルが上昇し、グルコース代謝が正常化し、神経変性と運動機能障害が遅延する [134]。PDマウスモデルでは、一日おき断食(ADF)はミトコンドリア毒素である1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)によって誘導されるドーパミン作動性ニューロンの変性と喪失に対する保護を与え、その結果、アドリバイタル摂取マウスと比較して機能的転帰が改善された [135]。MPTPはミトコンドリア呼吸鎖の複合体Iを干渉するので、この有益な効果は部分的にミトコンドリアのバイオエネルギー[136]を強化し、理論的に複合体II依存性のメカニズムを介してパーキンソン病の複合体Iの欠陥を回避する空腹時に生成されるケトンに起因する可能性がある。ADマウスモデルでは、一日おき断食(ADF)は海馬ニューロンがカイニン酸の神経毒性効果に対する抵抗力を高めることが示されており、その結果、改善された認知パフォーマンスが得られている[54,137]、一日おき断食(ADF)はβアミロイド前駆体タンパク質、プレセニリン1,およびタウの変異を発現するトランスジェニックマウスで発生する加齢に伴う認知障害を改善している[138]。
3.3.2. 神経変性の治療法としての断食 ヒトを対象とした研究
これまでのところ、HD、PD、およびアルツハイマー病の人々の治療法としての絶食は探索されていない。しかしながら、これらの疾患におけるケト原性食の研究によって間接的な証拠が提供されている [139]。ケト原性食は、このようにケトン体を生成し、絶食によって誘導される代謝機構の多くを誘導することにより、絶食代謝状態を模倣し、主なエネルギー源として炭水化物よりもむしろ脂肪を燃やすために体を強制的に高脂肪、適切なタンパク質、低炭水化物の食事である。パーキンソン病では、小さなケースシリーズは、ケトジェニックダイエット[140]の4週間後に改善された運動症状を示し、軽度から重度のパーキンソン病を持つ47人を含むその後の無作為化比較試験では、ケトジェニックダイエット[141]の8週間後に最も無効な、少なくともレボドパに反応するパーキンソン病の非運動症状の多くの改善を示した。アルツハイマー病におけるケトジェニックダイエットの効果については、軽度から中等度のアルツハイマー病と15人を含む単一のケースシリーズは、そのような食事[142]の12週間後に認知の軽度の改善を報告した;これらの知見は、部分的に脳のグルコース取り込みは、アルツハイマー病で著しく損なわれているが、ケトンの利用はない[143]という事実によって説明される可能性がある。
3.4. 脳卒中
脳卒中は、血液供給の途絶により突然発症する神経学的欠損であり、脳梗塞、脊髄梗塞、または網膜梗塞を引き起こす [144]。世界中のほとんどの脳卒中は虚血性であり、ニューロンの喪失、神経炎症、神経ネットワークの再構築、およびニューロン機能の再編成を伴う。
3.4.1. 脳卒中における治療法としての絶食。動物実験
動物では、虚血性脳卒中の前に絶食すると脳損傷が緩和され、機能回復が促進される。中大脳動脈閉塞前に一日おき断食(ADF)で維持されたげっ歯類は、自由食を与えられたものと比較して、脳損傷が少なく、機能的転帰が改善されていることが示された[50,145]。さらに、中大脳動脈閉塞前に3ヶ月間食事時間制限(TRF)で維持されたマウスは、海馬と脳室下帯の神経新生の増加、およびアドリビトゥムを与えられたマウスに見られるものの半分以下のサイズの梗塞を示している[146]。さらに、全脳虚血の3ヵ月前と70日後に食事時間制限(TRF)を投与したラットでは、非空腹時の対照群と比較して空間記憶の持続的な改善が見られた[147]。虚血性脳梗塞が既に発生した後の絶食の効果は知られていないが、外傷性脳損傷後の絶食レジメンの実施が神経保護を与え、機能回復を改善することを示す外傷性脳および脊髄の研究から間接的な証拠が得られている[148,149]。これまでに、損傷を受けたラットの大脳皮質では、偽動物と比較してBHBの取り込みが8.5倍に増加していることが示されている[150]。しかし、BDNFのアップレギュレーション、ミトコンドリア機能の強化、ストレス応答シグナル伝達経路の活性化、神経炎症の抑制も重要な役割を果たしている可能性がある[5]。
3.4.2. 脳卒中における治療法としての断食。ヒトを対象とした研究
虚血性脳卒中における絶食の直接的な効果に関するヒト研究は不足している。しかし、絶食はC反応性蛋白質、IL-6,ホモシステインなどのプロ炎症性因子のレベルを低下させ[51]、ヒトにおける脳卒中の一般的な原因であるアテローム性動脈硬化性プラークの形成を抑制する可能性がある。
3.5. てんかん
てんかんはニューロンの過興奮性が特徴であり、発作を起こしやすい永続的な素因となっている [151]。さまざまな抗てんかん薬や手術が可能になったにもかかわらず、てんかん患者の3分の1は薬剤耐性発作を経験し続けている。
3.5.1. てんかんにおける治療法としての絶食。動物実験
てんかんの動物モデルにおける発作制御のための絶食を支持するささやかな証拠がある。食事時間制限(TRF)を投与されたマウスは、自由食を与えられたマウスと比較して、発作発生までの潜伏期間が延長され、発作の重症度と頻度が減少していることが示されている[152]。このような抗痙攣効果は、少なくとも一部はBHBの直接的な抗痙攣効果によるものである[153,154]。しかし、絶食は、IGF-1,mTOR、AMPKなどの代謝因子の活性を変化させることで、さらに発作の予防効果をもたらす可能性がある。
3.5.2. てんかんにおける治療法としての絶食。ヒトを対象とした研究
断食はヒポクラテスの時代からてんかんの治療に用いられてきたが[155]、GuelpaとMarieが20人のてんかん患者の治療における断食の有効性を正式に文書化したのは1911年になってからである[156]。ワイルダーのケトジェニック・ダイエットが導入され、抗てんかん薬が次々と発売されたため、てんかんにおける断食に関する研究はほぼ1世紀にわたって発表されていなかった。最近、小規模な研究では、ケト原性食への不完全な反応を持つ6人のてんかん児における2ヵ月間の修正食事時間制限(TRF)レジメンの効果を調査し、6人のうち4人が発作制御において中程度の改善を経験したことを報告している[157]。絶食とケト原性食は多くの類似のメカニズムを共有しているので、これらの結果は驚くべきことではない;例えば、両方とも、いくつかの研究で改善された発作制御[158,159]と相関しているBHBを増加させ、両方が総称してシナプス機能を安定化させる追加のメカニズムを誘導する。しかしながら、絶食した子供たちの中には、ケト原性食のそれ以上の発作制御のわずかな改善を経験した者もいるので、絶食とケト原性食の基礎となる抗発作メカニズムには重要な違いがあるかもしれない。
3.6. 多発性硬化症
多発性硬化症(MS)は、中枢神経系のニューロンとその軸索に損傷を与える炎症性の自己免疫疾患である[160]。最近では、両方がT細胞の分化と腸管免疫応答の重要なレギュレータであることを考えると、MSにおける腸内細菌とその代謝物の役割にますます注目が集まっている。このことは、腸内細菌叢の組成や代謝物の産生に強い影響を及ぼす食事因子が、MSの発症に寄与している可能性を示唆している[161]。
3.6.1. 多発性硬化症における治療法としての断食。動物実験
絶食は、実験的自己免疫性脳脊髄炎(EAE)炎症を媒介とする脱髄とオリゴデンドロサイトの死を伴うMSの動物モデルにおいて有益である[162]。マウスでは、一日おき断食(ADF)はEAEの病理学的および臨床的特徴を改善し、腸内細菌の多様性を高め、調節性T細胞数を増加させる [163]。さらに、一日おき断食(ADF)マウスから自由摂取マウスへの糞便微生物叢の移行は、後者ではEAEの重症度を低下させ、絶食の利点の一部が腸内細菌によって媒介されている可能性があることを示唆している[163]。カロリー密度を著しく低下させた標準的な量の食物を提供することで断食を模倣する断食模倣食(FMD)の交互サイクルもまた、マウスにおけるEAEの臨床的重症度を低下させ、20%のマウスで症状が完全に逆転するなどの結果が得られている[164]。EAEにおけるFMDの基礎となる可能性のあるメカニズムには、オリゴデンドロサイト前駆細胞の再生と軸索再髄化の亢進、自己免疫細胞と炎症性マーカーの調節の改善が含まれる。
3.6.2. 多発性硬化症における治療法としての断食:ヒト研究
断食はヒトの炎症性介在性疾患の治療法として期待されているが、MSの治療法としては直接的な証拠はない。断食は、関節リウマチや喘息[165,166]などの非神経学的、炎症性介在性疾患の病理学的、臨床的改善をもたらする。MSについては、再発寛解MSと17人を含むパイロット試験では、変更された絶食レジメンは、腸内細菌叢[163]への同様の、おそらく有益な変化を含む、齧歯類のEAEモデルで見られるものを連想させる変化を誘導したことがわかった。FMDはまた、再発性のMS [164]を持つ人々の臨床と生活の質のスコアを改善する可能性がある。
4. 神経疾患における断食実施の課題
神経疾患の治療としてファスティングを適切に適用するためには、ファスティングが適応となる場合とそうでない場合を認識し、起こりうる一般的な副作用を管理する方法を知り、いくつかの一般的な誤解に注意することが不可欠である。
4.1. 断食の潜在的な禁忌と副作用
すべての人がファスティングに適しているわけではなく、最も適している人でもファスティングに関連した副作用を発症することがある(表3)。ほとんどの副作用は、十分な水分と塩分の摂取を確保し、運動と休息のバランスをとることで回避できる [65]。
表3 ファスティングの潜在的な禁忌と一般的な副作用
| 潜在的な禁忌 | 一般的な副作用 |
|---|---|
| 体重の少ない人 | 倦怠感 |
| 母乳育児または妊娠中の女性 | 不眠症 |
| 極端な年齢(子供、非常に古い) | 吐き気 |
| 栄養失調のリスクが高い人 | Headache |
| ウイルス感染症 | 前失神 |
| 1型糖尿病 | 消化不良 |
| 腎臓結石 | 背中の痛み |
| 痛風 | 四肢の痛み |
4.1.1. 潜在的な禁忌
正常体重以下の人、授乳中または妊娠中の女性、小児、および高齢者を対象とした断食レジメンに関する研究は比較的少ない;これらの人々の場合、断食は慎重に開始すべきであるか、または全く開始すべきではない。
栄養不良に非常に敏感な患者は、神経疾患を持つ患者を含め、断食レジメンには適さない;例えば、栄養不良の可能性のあるパーキンソン病またはアルツハイマー病を持つ特定の患者では、断食は禁忌である [139]。
急性感染症における断食の役割は、ヒトでは完全には解明されていないが、ウイルス感染症では断食は有害であるかもしれない(逆に、細菌感染症では保護されるかもしれない)[167]。
1型または2型糖尿病、胃食道逆流症、腎結石、痛風などの患者では、断食を考慮することができる;しかしながら、最初に断食の経験のある医師に相談するのが賢明であろう。絶食がインスリン抵抗性を改善または逆転させることができるという証拠 [66,87,88,89] を考えると、2型糖尿病の人は通常理想的な候補者である。さらに、2型糖尿病における絶食誘発性低血糖のリスクは低い;2型糖尿病患者が週2日/週の絶食レジメンを12週間にわたって遵守した場合の効果を検討した最近の研究では、ほとんどの参加者が低血糖(血糖値<4.0mmol/Lと定義)を経験せず、重度の低血糖(その是正のために他人の援助を必要とする事象と定義)を経験した参加者はいなかったことが実証された[168]。
4.1.2. 一般的な副作用
最近行われた、医学的に管理された水のみの断食を2日以上維持した患者768人の訪問を包括的に分析したところ、ほとんどの副作用は軽度から中等度で、疲労、不眠、吐き気、頭痛、高血圧(「副作用」として高血圧を認めた人の97%が主な内科的愁訴として高血圧も認めていたことから、付随的なものと考えられる)副交感神経症、呼吸困難、腰痛、および四肢の疼痛が含まれていた [169]。
期間絶食の最初の数日間は自然利尿または「絶食の自然利尿」と関連しており、大量の水分およびナトリウムが尿中に失われることが長い間知られてきた [20,170]。24~48時間またはそれ以上続く絶食期間では、自然帰化は個人を脱水および低ナトリウムレベルにさらすが、これを放置しておくと、疲労、頭痛、および痙攣などの症状を引き起こす可能性がある;ほとんどの場合、自然帰化に関連する症状は、十分な水分および塩分の摂取を確保することによって回避できる。
4.1.3. まれな副作用
浮腫、重度の低カリウム血症、腸閉塞、尿酸ネフローリチア症、心室性動悸、さらには死亡を含む、極めてまれな有害事象が、長期の断食を受けている人に記録されている [20,63,171,172];
しかしながら、これらの有害事象はすべて、その多くが数週間または数ヵ月に及ぶ極めて長期の断食期間を受けている人に発生しているということを認識することが不可欠である。対照的に、2日以上の水のみの断食を受けている人が関与した768件の訪問のうち、これらのまれな有害事象はいずれも発生していない [169]。
4.2. 断食に関する誤解
時には、人間における断食の潜在的な効果について混乱が生じることがある。通常、生理学的な背景を理解することで、誤解を解くことができる。
4.2.1. 激しいカロリー制限と比較した場合の断食の症状と代謝への影響
カロリーを仮想的に排除する(断食)ことによる症状および代謝効果と、40%~50%のカロリー制限を行うことによる症状および代謝効果を区別することが重要である。短期の断食を受けた患者は空腹感の欠如を頻繁に報告するが、これは達成されたケトーシスのレベルに比例していると考えられ、エネルギー、気分、自信、および生活の質の改善がみられる [55,56,88,93,166,173]。対照的に、激しいカロリー制限は、持続的な空腹感、疲労、過敏性、無気力、および性欲減退と関連している [174]。これらの対照的な症状効果は、安静時代謝率への影響に関して、重度のカロリー制限と絶食の間に文書化された違いがあることに起因していると考えられる。ヒトの体は、カロリー摂取量を慢性的に20~40%減少させても、安静時代謝率をほぼ同程度に低下させることで適応する [174,175]。対照的に、絶食は安静時代謝率の5~15%の上昇を刺激するが、これは一般的に絶食期間の開始から2~3日後にピークを迎え [176,177,178,179]、その後、代謝率は多かれ少なかれ元の速度にまで低下する [180,181,182]。これらの対照的な代謝反応の基礎となるメカニズムは、カロリー制限が全体的な交感神経活動を減少させるのに対し、絶食はGH、コルチゾール、カテコールアミンなどの「対抗」ホルモンの活性化を介して交感神経活動を増加させるという事実によって大きく説明される[39,178,183,184]。
4.2.2. 筋量と運動耐性
筋肉量と運動耐性に対する断食の効果については、頻繁に議論されている。どのような個人においても、筋肉の減少を含む体重減少の程度は、初期体脂肪、カロリーとタンパク質の摂取量、および運動レベルに依存する [185]。過体重および肥満の個人では、1日あたり体重1kgあたり0.8~1.2gのタンパク質摂取量は除脂肪量に惜しみない効果がある[186]。しかし、低体重者および正常体重者は、肥満者と比較してエネルギー消費に対するタンパク質の酸化率が高いことを示しており[179]、除脂肪体重の多い人は筋肉量を維持するために体重1kgあたりより多くのタンパク質を必要とする可能性があることを示唆している。十分なタンパク質摂取に加えて、定期的な運動は、絶食レジメンを受けている肥満者および正常体重者の筋肉減少を防ぐことも示されている。肥満者を対象とした12週間の研究では、一日おき断食(ADF)と週3回の持久運動を組み合わせると、一日おき断食(ADF)または運動単独よりも優れた方法で脂肪量を減少させ、除脂肪量を保持することが示された[187]。さらに、健康な若年男性を対象とした最近の2件の研究では、食事時間制限(TRF)と抵抗運動を週3回組み合わせると、脂肪量とエネルギー摂取量が減少し、除脂肪量と筋力が維持されることが示された [188,189]。これらの知見は、運動は絶食によって大きく制限されるものではないことを示唆している。
4.2.3. 空腹時に誘発されるインスリン抵抗性
ヒトにおける48時間を超える絶食期間は、しばしば骨格筋のインスリン感受性の低下を伴うことが長い間認識されてきた [38,190]。「飢餓糖尿病」としても知られるこの空腹時誘発性インスリン抵抗性は、低血糖および低インスリン血症の設定で発現し、おそらく骨格筋によるグルコース取り込みを制限して、安定したグルコース供給が常に脳の義務的要求に利用可能な状態を維持する役割を果たしている[190]。したがって、絶食誘発性インスリン抵抗性は、脳機能を維持することを目的とした正常な生理学的適応である。空腹時誘発性インスリン抵抗性と高血糖および高インスリン血症の状況下で発症するインスリン抵抗性を区別することが重要である。
4.2.4. 代償的な過食
最後の懸念は、各断食期間の終了時に、個人が代償的な過食を起こしやすくなる可能性があるということである。1世紀以上にわたり、厳しいカロリー制限レジメンを受けた人では、「制限後過食症」につながる空腹感の増加が記録されてきた [174,175,191,192]。対照的に、絶食レジメンを受けている人の最近の研究では、給餌日に代償的な過食は示されていない [55,56]。さらに、摂食日のカロリー摂取量の増加を報告した研究では、絶食期間によって誘発される全体的なカロリー不足を余分な摂取量で補うことはまだできていない[193]。
5. 結論
医療費の上昇と神経疾患の有病率が増加している時代には、神経疾患の範囲のための自己啓発、コストフリー、効果的な治療法の選択肢の導入は、医師の武器庫に歓迎すべき追加となる。今日の最も一般的な神経疾患は、基本的に多くのレベルで、欠陥代謝によって特徴付けられている。断食は、動物の神経疾患の様々な治療のための健康的な実績を持つ、シンプルでマルチターゲット、および本質的に「代謝」治療であることを考えると、それはヒトの類似の疾患の治療法としての可能性を秘めている。このように期待されているにもかかわらず、ヒトでのエビデンスは極めて限られており、ヒトの神経疾患における治療法としての絶食の実際の臨床効果を確認するには、さらに多くの研究が必要である。しかし、これらの研究を優先させることができれば、おそらく、断食レジメンが投薬ベースのアプローチと並行して処方され、症状だけでなく、現存する最も一般的な、障害を持つ神経疾患の自然な経過も修正することができる統一された代謝アプローチの概念を確立する日が来るだろう。
