Contents
- Emerging Neurological and Psychobiological Aspects of COVID-19 Infection
- 要旨
- 1. 序論
- 2. COVID-19に関連する多臓器障害
- 3. 神経-CoVIDの病態
- 4. SARS-CoV-2の中枢神経系への直接的および間接的な侵入のメカニズム
- 5. SARS-CoV-2の神経毒性の直接的および間接的機序
- 6. 神経炎症と血液脳関門の障害
- 7. COVID-19に関連する神経学的合併症
- 8. 神経症状の臨床症状のスペクトルは初期症状と後期症状に分けられる
- 9. COVID-19後の神経学的回復
- 10. COVID-19パンデミック時の新生児の神経心理学的福祉のためのCAVEAT
- 11. COVID-19後のリハビリテーション
- 12. 急性・慢性「神経性COVID」発症リスクのあるCOVID-19患者の早期診断・治療のための正確な「セラノスティックス」の開発の必要性
- 13. 結論
Emerging Neurological and Psychobiological Aspects of COVID-19 Infection
www.mdpi.com/2076-3425/10/11/852/htm
要旨
2019年12月に中国で初めて報告されたSARS-CoV-2ウイルスは、執筆時点(2020年11月1日)で約4,300万人に感染し、100万人以上の死者を出している現在のCOVID-19パンデミックの原因物質である。COVID-19感染時に観察される臨床症状のスペクトルは、無症状から生命を脅かす重篤な臨床状態まで様々である。
新たな証拠は、COVID-19が呼吸器系だけでなく、心臓、腎臓、血管、肝臓、中枢神経系(中CNS)および末梢神経系を含むはるかに多くの臓器に影響を及ぼすことを示している。また、感染症の急性期に起こる神経学的・心理学的障害は、回復期を超えて持続する可能性があることも明らかになってきている。
本レビューの目的は、COVID-19感染症(Neuro-COVID)の神経学的症状の病態生理に関連するこの新興の関連分野の研究をさらに推進することである。COVID-19感染者が感染時および回復期の両方で経験する末梢神経系および中枢神経系症状についてまとめていく。
COVID-19の神経学的・心理学的症状に対処するためには、この分野の診断学的・薬理学的知見が強く求められている。
キーワード
COVID-19; サイトカイン; 中枢神経系; 神経-COVID; パーキンソン病; 末梢神経系; SARS-CoV-2
1. 序論
過去20年の間に、呼吸器系を中心に新型のウイルス感染症が発生している。これらの中で 2002年から 2003年までのコロナウイルスSARS-CoVによって引き起こされた重症急性呼吸器症候群(SARS)2009年のH1N1インフルエンザウイルスによって引き起こされた豚インフルエンザ、および2012年の中東呼吸器症候群ウイルス(MERS)-CoVによって引き起こされた中東呼吸器症候群を挙げることができる。さらに最近では 2019年12月に中国で初めて報告されたSARS-CoV-2ウイルスは、執筆時点(2020年11月1日)で約4,300万人に感染し、100万人以上の死亡を誘発したCOVID-19感染の現在のパンデミックを引き起こした[1]。
新型コロナウイルスSARS-CoV-2は、世界中の政府と医療システムの双方に、前例のない社会的・経済的苦境を挑んでいる。この病気の世界的な負担は、効率的な予防法や治療法の発見が急務であることから、世界中の科学者や医学者の間で、病原体のメカニズムや病気の経過の研究に力を入れるようになっていた。
COVID-19感染時に観察される臨床症状のスペクトルは、無症状のものから生命を脅かす重篤なものまで様々である[1]。COVID-19感染は、症状に応じて軽症、中等症、重症、重症に分類される。無症状または軽症の場合は約80%の患者に見られ、さらに15%の患者は入院を必要とする重症、5%の患者は重症となる [2,3]。後半の5%の患者は、敗血症性ショック、心不全、呼吸不全、多臓器不全などの生命を脅かす状態に陥る可能性がある[1]。ジョンズ・ホプキンス大学の統計によると、世界の死亡率は4.5%(ジョンズ・ホプキンス・ダッシュボード 2020年7月11日。
2. COVID-19に関連する多臓器障害
最新の研究および新たな臨床データは、COVID-19が呼吸器系だけでなく、はるかに多くの臓器に影響を及ぼすことを示している[4,5,6,7,8]。これは、血管内皮細胞、腎尿細管上皮、精巣のライディッヒ細胞を含むいくつかの細胞型に発現するヒトアンジオテンシン変換酵素2(ACE2)受容体[9]に対するSARS-CoV-2の強い親和性によるものである[10]。ACE2受容体は、血圧、体液・電解質バランス、全身の血管抵抗を調節するレニン-アンジオテンシン系において重要な役割を果たしている[11]。ウイルスはACE2受容体と結合して宿主細胞に侵入する。前身のSARS-CoVがACE2を受容体として認識するのとは対照的に[12]、SARS-CoV-2の宿主細胞への侵入は、フーリンと呼ばれる別のタンパク質によってさらに促進され、このタンパク質がウイルスを割って宿主細胞への遺伝物質の流入を可能にする。その代わり、元のSARSウイルスであるパンゴリンが必要とする追加のタンパク質は肺組織にしか存在しないため、呼吸器系には限定されている[13]。
フーリンはすべてのヒト細胞、特に内皮細胞に存在している[14]。ヒトの体内へのウイルスの侵入に続いて、ACE2受容体の膨大な発現を特徴とする臓器やシステムへの直接的な攻撃が開始される。これらの臓器には、心臓、腎臓、血管、肝臓、および中枢神経系が含まれる。その結果、感染に反応していくつかの炎症性サイトカインが増加し[15]、他の臓器への拡散が起こり、多臓器障害を引き起こす可能性がある。COVID-19患者の肺、心臓、腎臓、肝臓、および腸における内皮細胞損傷の臨床的証拠は、この疾患が多臓器疾患であることをさらに証明し、インフルエンザ様H1N1,肺をほぼ独占的に標的とするSARSウイルスのような他の既知のウイルス感染症とは区別する。エボラやデングのような他のウイルスもまた、内皮細胞を損傷することがあるが、それらは典型的に肺を感染させるウイルスとは大きく異なる[16]。このシナリオは、SARS-CoV-2ウイルス粒子が鼻腔や喉だけでなく、腎臓、肝臓、膵臓、心臓組織にも存在し、涙、便、尿中に排泄されることを報告している剖検や生検と一致している[6,17,18,19,20,21,22,23,24,25,26,27,28,29,30]。したがって、この病原性メカニズムを介して、SARS-CoV-2は、呼吸器の損傷を単独で引き起こすというよりも、全身に影響を及ぼす多臓器疾患のように作用する(図1および図2)[8]。
図1. COVID-19感染による損傷の影響を受けている主要臓器。
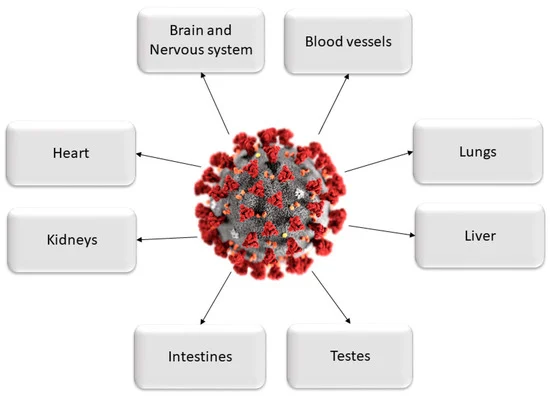
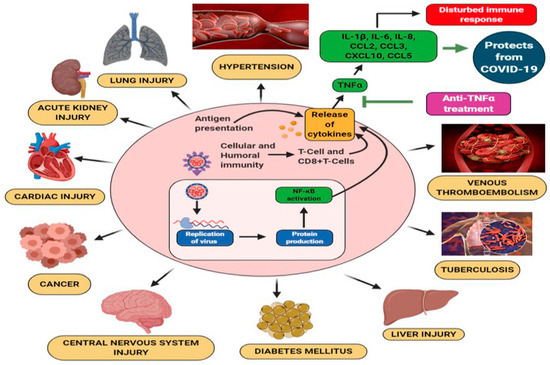
図2. コロナウイルスの病因、併存疾患、多臓器障害[31]。
最近の証拠は、中枢神経系と末梢神経系の両方がウイルスによって標的にされうることを示しており、これが臨床症状とそれに伴うさまざまな重症度の疾患につながる可能性があることを示している[32,33]。“Neuro-COVID “は、COVID-19に関連する神経学的、精神医学的、心理学的な臨床症状を表す用語として新たに確立された。
さらに、感染の急性期にウイルスによって引き起こされる神経学的および心理生物学的障害は、回復後も十分に持続する可能性があるという認識も高まっている。COVID-19は広範囲の障害を引き起こす可能性があり、病態のメカニズムを解明し、患者の完全な機能回復を促進する治療法を特定するための強力な努力を必要としている。
疫学的、社会経済的、臨床的関連性の高まりに対処するために、欧州神経学会(EAN)は、神経臨 床ケア学会(NCS)とともに、COVID-19における神経学的機能障害のグローバル・コンソーシアム研究(GCS-Neuro-COVID)を承認した。
The Lancet Neurology誌の最近の社説によると、この共同研究の優先事項の1つは、統一された定義によるコンセンサスとデータの調和を開発することであるとされている[35]。
今回のレビューの目的は、Neuro-COVIDの病態生理学に関連したこの新興分野の研究をさらに推進し、感染中および回復期に観察される中枢神経系および末梢神経系の症状や臨床症状の一部を統一的に把握することである。
COVID-19の病原性機序および疾患の臨床経過は、本レビューの焦点の外であるが、我々自身および他の者による最近のレビュー[36,37]で記述されている。それにもかかわらず、COVID-19の多元的な、そしてまだ相互に関連したメカニズムを示す知見が収束していることを強調することは有用であろう。
また、肥満、2型糖尿病および加齢などの併存疾患によってもたらされる重度のCOVID-19のリスクの増大も知られているが、それでもなお、想起することは有用である。高齢者では、これらの条件は、SARS-CoV-2感染に対する制御不能な免疫-炎症反応を起こしやすくする「炎症」と呼ばれる慢性炎症のプロセスによって関連している可能性がある[38,39,40,41,42,43]。
3. 神経-CoVIDの病態
3.1. COVID-19の神経トロピズム
SARS-CoV-2 [44] は、内皮細胞の ACE2 受容体への親和性を介して神経委縮性を示す [45]。ACE2は脳にも存在し[45]、神経組織(グリア細胞およびニューロン)にも発現しており、これらはウイルスの潜在的な標的となっている[46]。COVID-19の神経毒性は、感染の過程で神経系全体に影響を及ぼす神経学的、精神医学的、心理学的症状や症候群の幅広いスペクトルと一致している(図3)。
図3。SARS-CoV-2の人体内分布
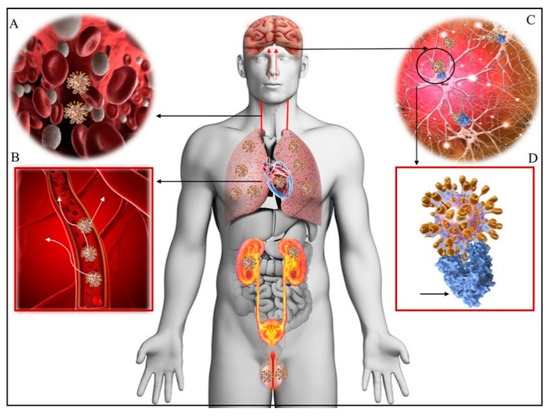
A-ウイルス感染。血流を介したSARS-CoV-2ウイルスの全身への伝播。B-循環および/または上鼻転写経路を介した神経毒性:COVID-19が血液脳関門の機能を修飾するか、または直接脳に到達することを可能にする。C-ウイルスが結合し、ACE2受容体と係合する。D-SARS-CoV-2はスパイク蛋白質(青色)を介してACE2にドッキングする;主要臓器である肺、心臓、腎臓、腸、脳、睾丸はACE2受容体を発現しており、COVID-19の標的となりうる(D、金色のスパイク)[45]。
しかし、ウイルスが直接中枢神経系に感染するかどうかはまだ議論されていない。この分野のある研究では、COVID-19感染患者の剖検時に、肺、肝臓、心臓などの様々な臓器にウイルスが侵入しているにもかかわらず、脳内にSARS-CoV-2またはその粒子が存在するという証拠は報告されなかったが、最初の研究では、COVID-19感染患者の剖検時に、肺、肝臓、心臓などの様々な臓器にウイルスが侵入しているにもかかわらず、脳内にSARS-CoV-2またはその粒子が存在するという証拠は報告されていない[47]。一方、Moriguchiら[48]は無菌性脳炎患者の脳脊髄液中にウイルスRNAを観察し、Paniz-Mandolfiら[49]は死後の研究で前頭葉組織の神経細胞や毛細血管内皮細胞にSARS-CoV-2ウイルス粒子が存在することを報告している。したがって、SARS-CoV-2の神経侵入、神経炎症、血液脳関門(BBB)の障害が神経症状の原因であることが示唆されている[50]。
3.2. コロナウイルスの神経侵襲性と神経毒性
コロナウイルスファミリーの他のメンバーは、精神状態の変化、髄膜脳炎および発作、さらには頭痛や記憶喪失などの回復後の合併症を含む広範なスペクトルの症状によって臨床的に特徴づけられる神経浸潤性および神経毒性を示すことが報告されている[51]。また、脳炎[52]や視神経炎[53]、多発性硬化症[54]、パーキンソン病(PD)[55]など、様々な神経疾患をコロナウイルス感染に伴うことが知られている。
特に 2003年からのSARS-CoVのパンデミックは、多神経症、脳炎、虚血性脳卒中と関連していた[56]。また、脳浮腫や髄膜血管拡張、血管壁への免疫細胞の浸潤、神経線維の脱髄や虚血性神経細胞障害を伴う症例も報告されている[57]。
2012年のMERS-CoV感染はまた、神経学的および神経心理学的障害(患者の25%)および発作(8.6%)を含む症状を伴う神経毒性を示した[58]。その他の神経学的合併症は、意識障害、虚血性脳卒中、ギラン・バレー症候群(GBS)およびその他の神経障害として現れた[59]。
4. SARS-CoV-2の中枢神経系への直接的および間接的な侵入のメカニズム
一般に、コロナウイルスは、血行性経路および/または神経細胞の逆行性播種を介して中枢神経系にアクセスすることが認められている。
血行性経路は、感染した白血球がウイルスを運ぶBBBを通過して中枢神経系に到達するか、ACE2を発現する脳微小血管内皮細胞に直接感染することで起こる。それにもかかわらず、血行性ルートはSARS-CoV-2による中枢神経系への侵入には関与していないように思われる。なぜなら、議論されているように、感染の初期段階では感染した脳領域の非神経細胞ではウイルス粒子が実質的に検出されなかったからである[60]。
神経経路は、嗅神経を介しておよび/または腸神経系を介して起こり得る(図4)。しかし、嗅覚系の神経細胞ではACE2が発現していないことから、SARS-CoV-2の中枢神経系への侵入経路は疑問視されている。したがって、SARS-CoV-2の宿主細胞への侵入は、少なくとも嗅覚経路を介して説明するために、ACE2に依存しないメカニズムが提案されている。対照的に、ACE2の発現は、腸神経系のニューロンと接続する小腸内皮細胞で発生している。このことは、COVID-19患者のサブセットにおける消化器症状の頻繁な発生、およびこれらの患者の口腔および肛門スワブからのSARS-CoV-2の分離と一致している。このようにして、SARS-CoV-2は迷走神経を介して、中枢神経系への可能性のある経路として、腸管神経系にアクセスする可能性があることが示唆された[60]。さらに、最近の研究では、膜貫通型受容体ニューロピリン-1もまた、COVID-19のニューロトロピズムに関与している可能性が示唆されている。実際,NRPIは呼吸器上皮や嗅覚上皮に高発現しており,この経路を介してSARS-CoV-2の脳内への侵入を促進する可能性がある.最近では、NRP1は中枢神経系(嗅尿細管や腸管などの嗅覚関連領域を含む)でも発現していることが明らかになっており、脳内へのSARS-CoV-2の侵入経路としての役割を強化していると考えられている[61]。以下に、SARS-CoV-2の脳内感染経路として提案されているACE2受容体依存性およびACE2受容体非依存性の経路を簡単に説明する。
図4. SARSARS-CoV-2が脳の呼吸中枢に感染する可能性があることを示す模式図
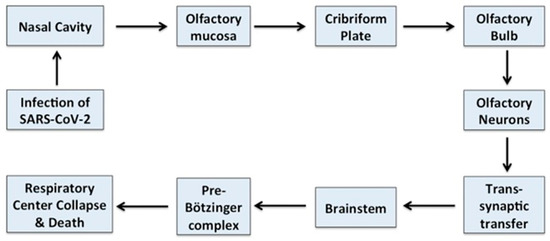
SARSARS-CoV-2は、上鼻腔に存在する嗅粘膜を介して脳に侵入する可能性がある。そこから、嗅軸索を介して篩状板にアクセスし、嗅上皮および嗅球に到達することがある。
SARS-CoV-2はさらにシナプスを介した移動によって視床や脳幹などの脳の深部に移動し、プレ・ベッツィンガー複合体を標的とするため、脳の呼吸中枢の崩壊を引き起こす可能性がある[62]。
4.1. ACE2受容体依存性中枢神経系の侵襲経路
SARS-CoV-2の特異的な宿主受容体ACE2との結合を介した細胞侵入のメカニズムについては、すでに議論されている[12]。ACE2受容体は、脳幹および心血管機能の調節に関与する領域に広く発現しており、その中には、腹膜下器官、傍室核、索条体核、吻側髄核などが含まれる。ACE2はグリア細胞やニューロンでも検出されている。
関連する知見は、ニコチンによるnACh受容体の刺激が神経細胞におけるACE2発現を増加させ、喫煙者はSARS-CoV-2による神経学的合併症のリスクが高くなるということでもある[63]。
前頭葉組織の死後検査における神経細胞および毛細血管内皮細胞におけるSARS-CoV-2の存在は、脳内へのウイルス侵入の血行経路を支持する[49,64]。
一般循環に入った後、ウイルスは脳に移動して複製を開始し、強力な免疫反応を誘発するが、これが制御されない場合には、脳浮腫を引き起こす可能性がある [45]。感染と免疫応答の組み合わせが、ウイルス性髄膜炎/脳炎の典型的な臨床症状を形成している。
4.2. ACE2受容体に依存しない中枢神経系への侵襲
重症急性呼吸器症候群ウイルス(SARS)と中東呼吸器症候群ウイルス(MERS)の両方に似た方法で、SARS-CoV-2もまた、ACE2受容体を使用せずに、吸入時に嗅球を介して直接経シナプス経路を取る可能性がある。動物実験では、嗅上皮を介して脳にアクセスして神経細胞死を引き起こすSARS-CoVの可能性が実証されている[65]。ウイルスの侵入は反応性アストログリア症を引き起こし、中枢神経系において大規模な神経炎症性カスケードを引き起こす。
最近、Takeshiらは、SARS-CoV-2に関連した髄膜炎・脳炎の最初の症例を報告した。彼らは脳脊髄液(脳脊髄液)標本からSARS-CoV-2のRNAを検出した[19]が、ウイルスの神経浸潤性の直接的な証拠となった。この知見は、SARS-CoV-2が神経系に直接侵入する可能性があり、SARS-CoV-2が誘発する臨床症状はウイルスによって直接引き起こされる可能性があり、ウイルスに対する免疫応答の二次的効果である必要はないという仮説と一致している[48,66]。
COVID-19患者のかなりの割合(33.9%)で観察された味覚または嗅覚障害は、ウイルスが直接シナプスを介して嗅球のニューロンを介して脳に到達するという仮説と一致している[65]。
5. SARS-CoV-2の神経毒性の直接的および間接的機序
臨床検査では、炎症性マーカー(白血球(WBC)好中球、C反応性蛋白(CRP)d-ダイマー)の増加、および肝酵素の上昇や腎機能検査の異常などの多臓器関与の証拠が明らかにされている[67,68]。
神経症状はCOVID-19による多臓器障害の結果ではないかと考える著者もいるが [68]、SARS-CoV-2は神経細胞に感染する可能性があることも示唆されている。これは、神経細胞に分化するように操作されたヒト多能性幹細胞からなる脳組織の小さな構造物、いわゆるオルガノイドに関する研究からも裏付けとなる証拠が得られている。研究者らは、SARS-CoV-2がオルガノイドに感染すると、シナプス形成が低下するだけでなく、神経の部分的な死に至ることを実証している[69,70]。直接的な損傷は、ウイルスがニューロン逆行性(嗅球および/または三叉神経)血液(BBBを克服)免疫介在性経路(病原体を伝達する免疫細胞を介して)を介して神経系に侵入した場合に発生する可能性がある 図5.
図5. 脳のコロナウイルス感染のメカニズム
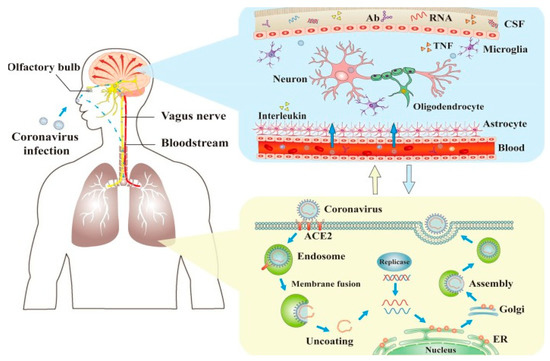
SARS-CoV-2は、嗅神経を介して直接神経系に侵入するほか、血液循環や神経経路を介して神経系にも侵入し、神経障害を引き起こす。Ab:抗体;ACE2:アンジオテンシン変換酵素2;脳脊髄液:脳脊髄液;ER:小胞体;TNF:腫瘍壊死因子。[72].
一方、新たな証拠は、中枢神経系への直接的なウイルスの侵入に加えて、ウイルス媒介免疫応答を介した間接的な中枢神経系の関与も可能であることを示している[71]。
中枢循環に侵入した後、ウイルス粒子はBBB内皮細胞とACE2受容体を発現する脳・脳脊髄液関門上皮細胞に結合する [72]。
神経毒性の間接的なメカニズムは、中枢神経系のプロ炎症状態を悪化させる免疫細胞および炎症性細胞によって媒介される可能性がある [73]。免疫細胞、サイトカイン、ラジカル、その他の物質の活性と発現の増加は、神経学的合併症の併発を伴う最も重篤な臨床例と関連している。COVID-19感染中に観察される頻繁なうつ病の症例はまた、この疾患の病態に関与しているプロ炎症性サイトカインの大量放出によるものであるかもしれない[74,75,76]。
これらの病因性機序を支持するために、COVID-19感染後には、IL-6,IL-12,IL-15,TNF-α [77]およびインターフェロンγ誘導性プロテイン10(IP-10,T細胞化学吸引性ケモカイン)[78]を含むプロ炎症性サイトカインのレベルが上昇していることが報告されている。IP-10のレベルの上昇もまた、ウイルス誘発性脱髄と関連している [79]。
ウイルス誘発性低酸素症は、神経系を含む複数の臓器およびシステムを標的とする別の非特異的な損傷メカニズムである。この間接的な病原性メカニズムは、肺合併症およびガス交換の損傷をもたらし[72]、それに続く低酸素および代謝性アシドーシスを伴い、脳の血管拡張および浮腫を引き起こす。この状態は、頭蓋内圧の上昇および急性脳血管事故のリスクが高いことと関連している。
COVID-19の直接的および間接的な中枢神経系損傷メカニズムは、異なるシーケンスで発現するか、または同時に発生する可能性がある。しかしながら、神経学的症状が呼吸器症状に先行する可能性があることが提案されている[80]。
神経炎症は、低酸素のBBB損傷誘導と恒常性調節障害を伴う少なくとも2つのメカニズムによって、重要な病原性メディエーターである可能性がある。
6. 神経炎症と血液脳関門の障害
全身性のSARS-CoV-2関連の神経炎症はBBBに障害を与え、結果的に脳の恒常性の障害と神経細胞死を誘発する可能性がある [67,81,82]。脳の毛細血管を覆ってBBBの第1層を構成する内皮細胞 [83] は、体の他の部位の内皮細胞とはいくつかの点で異なるが、SARS-CoV-2の標的でもあり、ウイルス感染の際に感染する。サイトカインを含むこの免疫反応は、バリアの機能を低下させる [81]。神経損傷は合併症、全身の恒常性調節障害、多臓器不全、急性呼吸不全を引き起こす可能性があり、これらはCOVID-19の死亡率に最も密接に関連した原因である[84]。
Neuro-COVIDの根底にある可能性のある病原性機序についての重要な洞察を加えたのが、Buzhdyganらによる最近の観察である[82]。これらの著者らは、死後脳組織を用いて、ACE2が前頭皮質の様々な血管のカリバー全体に遍在的に発現していることを初めて確認した。さらに、高血圧や認知症の症例では、ACE2の発現が上昇していることも観察された。ACE2は、ヒト脳毛細血管内皮細胞(hBMVEC)でも試験管内試験で検出された。彼らは、S1,S2,または受容体結合ドメインのみを含むS1の切り詰められた形態のいずれも、hBMVECの生存能力を損なうことを実証した。試験管内試験モデルのBBBにスパイクタンパク質を導入すると、バリア特性に大きな変化が見られた。特に、S1はヒトBBBの先進的な3Dマイクロ流体モデルにおいて、バリアの完全性の喪失を誘発した。これらの知見は、SARS-CoV-2スパイクタンパク質が脳内皮細胞の炎症反応を誘発し、BBBの機能不全に寄与する可能性があることと一致している。このシナリオは、SARS-CoV-2がCOVID-19患者で観察された神経学的結果の原因となりうる追加の病原性メカニズムを提供している[82]。
神経炎症、低酸素および恒常性調節障害
脳内では、ACE2受容体は脳幹と心血管系機能の調節を司る領域に優勢に存在している[85]。このため、一部の著者は、COVID-19で観察された呼吸不全の根本原因は中枢神経系の呼吸機能障害にあるのではないかと仮説を立てているが、これは併存疾患や他の危険因子を持たない患者では特に有効である[86]。
正常な恒常性は、自律神経系の求心性および放出性セクションの適切な機能に依存している。この機能が損なわれると、呼吸機能の障害だけでなく、呼吸不全が悪化して重篤な低酸素状態に陥る可能性がある。低酸素と既存の神経炎症の組み合わせは、海馬および皮質領域の損傷をもたらし、ウイルスの神経精神医学的効果として顕在化する[44,87]。
これと一致して、大規模な脳への関与は、恒常性調節障害が完全に活性化される前に致死的な脳浮腫を引き起こす可能性があることが示唆されている[45]。
7. COVID-19に関連する神経学的合併症
COVID-19中の神経症状
SARS-CoV-2が中枢神経系に侵入する正確なメカニズム、およびどのように正確に病原性効果を発揮するかにかかわらず、COVID-19患者では、中枢神経系および神経系の両方に影響を及ぼす多種多様な神経精神症状が報告されている[77]。
これと一致して、大規模な脳への関与は、恒常性調節障害が完全に活性化される前に致死的な脳浮腫を引き起こす可能性があることが示唆されている [68]。
Patersonと共同研究者[88]は、COVID-19が重度の神経学的合併症につながる可能性があることを示唆する新たな証拠として、COVID-19に関連した脳損傷の潜在的な波を警告している。
神経学的症状の幅広いスペクトルは、重症度および症状の現れ方が時間の経過とともに変化し、また、年齢、併存疾患、性別、および地理的な場所などの変数にも依存する。
COVID-19に関連する一般的な神経学的合併症は、以下の図6に示されている。
図6 COVID-19で報告された主な神経学的異常[87]
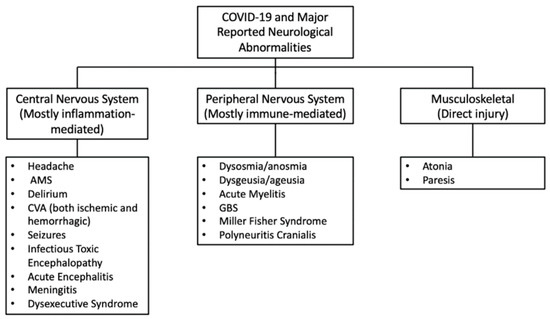
AMS-嗜癖性精神状態;CVA-脳血管事故;GBS-ギラン・バレー症候群。
COVID-19感染における神経学的合併症のデータのほとんどは、中国、フランス、英国、イタリアのいくつかの観察研究から得られたものである。要約したデータを表1に示す。
表1. 各国におけるCOVID-19の臨床経験
原文参照
8. 神経症状の臨床症状のスペクトルは初期症状と後期症状に分けられる
初期の神経学的症状には、嗅覚や味覚の喪失、体の痛み、頭痛、筋肉痛などがある。
嗜眠症、頭痛、発熱、および筋肉痛は、SARS-CoV-2 検査で陽性となる最も強力な独立した予測因子と考えられている。急速に進行する神経学的合併症は、通常、感染の初期にめまい、頭痛、運動失調、痙攣などの症状を呈する。最近の3つの症例報告は、コロナウイルス疾患2019(COVID-19)に続く急性パーキンソニズムの発症を記述しており、これはSARS-CoV-2によるPDの誘発の可能性について懸念を生じさせている[105]。この症例およびコロナウイルスとPDとの間の可能性のある関連性の以前の証拠は、SARS-CoV-2パンデミックの結果の第三波としてのパーキンソニズムの出現におけるCOVID-19の潜在的な役割の科学的コミュニティを警鐘している[106,107]。
COVID-19に関連した神経学的損傷は、疾患の経過の後期に認められることが多く、その予測的意義は不明のままである。呼吸困難は、中等症と重症の両方の疾患を強く予測する唯一の症状であり、疾患経過の早期に臨床管理の決定を導くのに有用である [108]。
後期の神経学的症状は、精神状態の障害、虚血性脳卒中や出血性脳卒中などの急性脳血管事故、および神経脱髄に関連する状態である。SARS-CoV-2に関連するその他の合併症としては、髄膜炎、脳脊髄炎、脳炎、急性壊死性出血性脳症、ギラン・バレー症候群(GBS)がある[109](表1)。
神経性COVIDの臨床症状に関するいくつかの論争
現在進行中のCOVID-19パンデミックでは、発熱(98.6%)疲労(69.6%)乾性咳(59.4%)食欲不振(39.9%)筋痛(34.4%)などの特徴的な症状に加え、頭痛(6.5%)めまい(9.4%)吐き気(10.1%)嘔吐(3.6%)腹痛(2.2%)ショック(8. 7%)発熱(98.6%)倦怠感(69.6%)乾性咳嗽(59.4%)食欲不振(39.9%)筋肉痛(34.8%)呼吸困難(31.2%)不整脈(16.7%)急性心不全(7.2%)などの特徴的な症状のほかにも、発熱(98.6%)倦怠感(69.6%)乾性咳嗽(59.4%)食欲不振(39.9%)筋肉痛(34.8%)呼吸困難(31.2%)不整脈(16.7%)急性心不全(7.2%)などが報告されている[90]。一部の患者はまた、呼吸困難および歩行変化を報告している [68,110] (表1)。
中枢神経系と末梢神経系の両方の関与は、現在では十分に文書化されているが、これらの合併症に苦しむ患者の割合は、異なる研究、評価時期、および地理的な場所によって大きく異なる [86]。例えば、フランスの患者における神経症状の発生率は、入院時には14%、治療コースの中止/終了後には69%であった[93]。中国武漢では36.4%の患者で様々な神経症状[68]が報告されている。中枢神経系の合併症としては,めまい(16.8%),頭痛(13.1%),意識障害(7.5%),脳卒中(2.8%),運動失調,痙攣(0.5%)などが報告されており,自律神経系の合併症としては,嗅覚障害(5.6%),味覚障害(5.1%),視覚障害(1.4%)などが報告されている。神経学的合併症は筋骨格系の合併症が10.7%を占め、神経痛は2.3%の患者が報告した(表1)。
英国で得られたデータによると、COVID-19を有する患者の中にはせん妄/精神病を伴う脳症に苦しむ患者もいれば、脳炎、急性播種性脳脊髄炎、GBSのような末梢神経障害を含む炎症性中枢神経系症候群を発症する患者もいる一方で、少数の患者は生命を脅かす虚血性脳卒中を発症することが示されている[88]。
Varatharajら[96]は、125人の患者にCOVID-19を3週間投与した際の神経学的/精神医学的疾患を報告している。患者の3分の1(31%)に精神状態の変化がみられ、その中には脳症が13%、精神病(8%)神経認知症候群(5%)情動障害(3%)を含む神経精神医学的診断が18%含まれていた。著者らは、観察された患者の62%に脳血管障害が認められ、そのうち74%が虚血性脳卒中、12%が脳内出血、1%が中枢神経系血管炎であったと述べている。
確立された神経学的合併症は、ウイルス感染の重篤な臨床像や糖尿病や高血圧の併発と関連していることが最も多いと考える著者もいるが[68,80](表1)この点では矛盾したデータが得られている。ウイルス感染の中等度の症状を持つ患者、あるいは回復期であってもCOVID-19は、脳および脊髄の神経細胞のミエリン鞘の破壊的変化を引き起こし、麻痺につながる免疫炎症性の致命的な脳および神経学的損傷を引き起こす可能性がある[84]。
また、肺の症状がない場合の中枢神経系の損傷は、他の症状を伴わずに片麻痺や意識障害を発症した50歳以下の若い患者でも報告されており[81]、脳MRIでは脳動脈閉塞の証拠が示されている。
また、最近のメタ解析では、COVID-19関連脳症患者の脳波異常所見として、精神状態の変化、発作様イベント、心停止などが報告されていることも興味深い。脳波異常所見は543例中88.0%に認められ、背景異常、周期的・リズミカルな脳波パターン、てんかん様変化の3つのグループに分類された。また、全所見の約3分の1は前頭部の脳波パターンであることが示された。継続的な脳波を用いた研究では、251人の患者の96.8%に異常が認められたのに対し、継続的な脳波を受けていない患者では85.0%であったことが報告されている。したがって、Neuro-COVIDでは前頭部所見が頻繁に認められ、Neuro-COVID発症のマーカーとして提案することができる[111]。これらのデータは、中枢神経系の病変の徴候を示すCOVID-19感染症患者に脳波を使用することの有用性を強調している。
多くの著者は、生命を脅かす神経学的状態に至るコロナウイルスの神経毒性効果は、必ずしも重度の呼吸器症状の発現と関連しているわけではないことを示唆している[65,66,69]。
末梢神経学的症状に関しては、最近の研究では、中国におけるCOVID-19感染に関連した最も一般的な末梢症状として、味覚および嗅覚の喪失(5%)視覚障害(1.4%)および神経痛(2.3%)が挙げられている[68](表1)。
イタリア[97]では、程度の異なるageusiaとanosmiaがそれぞれ10.2%と5%の患者で報告されており、18.6%の患者が両方を訴えていた。これらの症状は若い患者や女性に多くみられた。
ヨーロッパの12の診療所で行われた他の研究では、軽度から中等度の疾患の症例では、嗅覚(85.6%)と味覚(88%)の変化を伴っており、それらの間に高い相関関係があり、また女性に多いことが示されている[101]。ほとんどの患者では、感度の回復に数週間かかり、44%の患者では早期に回復した(表1)。
Maoら[68]によると、筋骨格系の損傷は10.7%が有病率で、主に肝臓や腎臓に問題のある患者に見られる。中国の550の病院から1099人の患者が参加した別の研究では、筋肉痛の発生(14.9%)が報告されている。観察された症状の重症度は疾患の重症度と相関していた[112]。横紋筋融解症は0.2%の症例で認められた(表1)。
利用可能な情報に基づき、Sheraton et al 2020)[87]は、中枢神経系症状は主にウイルス誘発性炎症に関連して起こることを示唆した。末梢神経系の合併症は免疫介在性の二次的なプロセスであるのに対し、筋骨格系の不随意はウイルスの直接的な損傷効果の結果である[87]。
脳血管事故は通常、この疾患の重症例で発生し、心血管系および脳血管系の併存疾患および糖尿病を有する高齢者患者が主に影響を受けている。
しかし、新しいデータは、コロナウイルス関連の虚血性脳卒中が必ずしも加齢に関連しているとは限らないことを示している。ニューヨークでは、30~40歳代のコロナウイルス患者5人が命に関わる虚血性脳卒中を経験したが、そのほとんどは過去の病歴がなかった。これらの症例は多因子性の可能性があり、一方ではSARS-CoV-2の内皮細胞への親和性が、凝固障害の既往歴やリスクのない人でも内皮の損傷や血栓の形成を引き起こすことに関連している[103]が、他方では抗リン脂質(抗PL)自己抗体の形成に関連している[36]。
我々は、脳血管イベントが抗リン脂質(抗PL)自己抗体の存在に起因する可能性があり、これらの自己抗体の存在は、Bリンパ球のアップレギュレーションされた活性化に二次的に起因する可能性があるD-ダイマーおよびループス様抗凝固剤の上昇[36]を有する凝固障害患者において検査されるべきであることを既に論じた[113]。
9. COVID-19後の神経学的回復
現在進行中のパンデミックの最近の発症により、回復した患者の短期または長期の合併症のリスクを評価することはまだ困難である。現在、SARS-CoV-2に感染した人は4,300万人を超えており、回復した人の多くは認知および神経学的後遺症の重荷を背負っている[112,113]。これらはすべて、彼らの生活の質、仕事や日常活動の能力に影響を与えると予想されている。これまでのところ、COVID-19の回復後に観察された合併症には、脊髄に影響を及ぼす脱髄および急性骨髄炎 [114] またはせん妄を伴う脳浮腫が含まれる。29人の患者を対象とした研究では、COVID-19後の神経学的合併症を5つの主要なグループに分類した [88]。ウイルス性疾患に関連したいくつかの心理学的パラメータの変化も、ストレス、抑うつ、不安、心理学的異常として報告されている[115,116]。
この設定では、1918年のスペイン風邪の大パンデミックと、1917年から 1930年の間に100万人以上の人がリーサルギカ脳炎または「眠気病」と診断されたという事実を思い出す価値がある。ダメージは、脳の腫れの結果として、多くの患者が絶え間ない眠気と重度の神経変性を引き起こして障害を負った[117]。
COVID-19感染の回復期、特にNeuro-COVIDに罹患した患者には複数の精神神経症状が予想されることは、SARS-CoVパンデミック時のデータと一致している。SARS生存者の最大42.5%が、4年間の追跡調査で持続する長期にわたる精神疾患を発症したことが報告されている[118]。その内訳は、主に心的外傷後ストレス障害(54.5%)うつ病(39%)身体性疼痛障害(36.4%)パニック障害(32.5%)強迫性障害(15.6%)であった [118]。
COVID-19のパンデミックが終われば、脳への遅れてくる影響を考慮して、神経学的合併症の長期的なリスクの完全な評価が非常に必要になるだろう。コロナウイルスは「パンデミックに関連した脳損傷」のパンデミックをもたらす可能性があるという懸念がある。なぜなら、脳損傷の問題の中には、患者が退院してからしばらくの間は顕在化しないものもあるからだ。[119]。
特に、Beauchamらは、SARS-CoV2誘発性パーキンソニズムの発症を恐れており、神経変性障害を含む可能性のある長期的な影響のために、回復した患者をモニタリングすることを提案している。[107].
我々はまた、COVID-19を持つ人々が最終的に二次性抗リン脂質抗体症候群(APS)を発症する際に、抗PL自己抗体が長期にわたって持続することによってもたらされるリスクについても以前に議論した[36]。抗PL自己抗体陽性の患者では脳血管イベントの症例が報告されており、これらの自己抗体の消失の動態はまだ研究されていない。抗PL自己抗体陽性の患者は、自己抗体が持続的に消失するまで、慎重な検査室でのモニタリングと最終的な抗凝固剤治療を必要とするであろう。
COVID-19の後遺症のもう一つの側面として、これまでおそらく過小評価されてきたのは慢性疲労の発生である。パンデミックが始まって以来、感染症の管理に関する国際的なガイドラインでは、急性期と比較的重篤な合併症や後遺症に焦点が当てられていた。しかし、COVID-19感染から回復したいくつかの患者が、疾患の経過中に神経学的合併症があったかどうかにかかわらず、慢性疲労を報告するケースが増えている[120]。Carfiらは、退院後約60日後に評価を受けた患者の87.4%が、少なくとも1つの持続する症状、特に疲労と呼吸困難を報告していると報告している [120]。
SARS-CoVに感染した患者を対象としたいくつかの追跡研究でも、コロナウイルスが長期的な疲労を引き起こす可能性があることが示唆されている。22人のSARS生存者を対象に実施された研究では、感染がないと宣言されてから13~36ヵ月の間に、全員が仕事やSARS以前の日常生活に戻ることができない状態が続いていることが明らかになった [121]。中国のSARS生存者233人を対象とした別の研究では、40%が回復後4年後に慢性疲労に苦しんでいたと報告されている [115]。
慢性疲労の重症度を評価する上での制限要因は、コロナウイルス感染前の疲労度に関するデータがないことであり、特に、疲労を客観的に評価するためのバイオマーカーやその他のアプローチがないことである。評価は患者から提供された情報のみに基づいており、この症状の効率的な管理を複雑にしている。
SARS-CoV-2の神経行動学的後遺症には、プライマリーケア、救急医療、入院治療、心理学的・精神医学的介入が必要である。また、機能改善に関連した測定可能な神経画像の変化をもたらす可能性が示唆されていることから、心理療法の使用も期待されている。免疫系の機能に対する心理社会的介入の有益な効果は、治療後少なくとも6ヵ月間は変化が持続することも実証されている [122]。このことは、COVID-19の重症症例の免疫系の病因を考えると、免疫系の恒常性に微妙ではあるが長期的な異常を引き起こす可能性があることを考えると、特に関連性が高いと思われる。
この推論に沿って、Pallantiら[123]は、COVID-19から回復した患者を炎症性パネルに基づいて層別化することの有用性を示唆しており、これは精神衛生上の後遺症に関連するスティグマの軽減を伴う適切な治療およびリハビリテーションプログラムの設計に役立つかもしれない。
10. COVID-19パンデミック時の新生児の神経心理学的福祉のためのCAVEAT
最近のレビューで予想されており、過小評価される危険性があるため、さらなる注意が必要である点は、症候性または無症候性の母体感染の両方が子孫に与える可能性がある潜在的な影響である[123]。COVID-19感染中の生理的妊娠の成功を危うくするいくつかの要因がある。妊娠中の炎症への母親の暴露は、ヒトの子孫における神経精神疾患の後の開発に関連しているため、これは、子供の神経発達の初期段階でリスクをもたらす可能性がある[124]。これは、おそらく神経発達に影響を与える特定のサイトカイン[75,126,127,128]などの炎症性メディエーターの放出を介して、気分障害[125]の病因における炎症性イベントが果たす既知の役割と一致している。
我々は、SARS-CoVまたはSARS-CoV-2に感染した母親の子供は、病態生理をよりよく理解し、早期介入を可能にするために、縦断的研究において神経精神医学的、神経免疫学的、炎症学的状態を継続的にモニタリングする必要があると予想している。
11. COVID-19後のリハビリテーション
イタリアは、感染率が非常に高く、重症症例数も非常に多い、最も重症な影響を受けた国の一つであった。イタリアで収集されたデータの分析によると、COVID-19の管理は、治療計画と陰性アッセイの完了で終了すべきではなく、回復期の患者のためのリハビリテーション計画を意味するべきであることが示されている[80]。
ウイルス感染症患者における神経学的合併症は、より重篤な経過をたどるリスクも高めるが、急性呼吸窮迫症候群で使用されている人工呼吸器の中止後の回復がより難しく、より遅くなることが前提条件である。また、より長く、より重症化した回 復期の期間が長くなることは、より良いリハビリテーションの必要性にも関係している。
COVID-19の生存者の中には、運動などの身体的リハビリテーションと精神・認知的リハビリテーションの両方の長いリハビリテーション期間を必要とする者もいる。
12. 急性・慢性「神経性COVID」発症リスクのあるCOVID-19患者の早期診断・治療のための正確な「セラノスティックス」の開発の必要性
COVID-19感染時の神経学的合併症の関与と関連性が確立されれば、Neuro-COVIDのリスクを持つ患者を早期に同定し、その予防のための個別の治療法を設計することができる可能性のあるバイオマーカーを評価することが重要になる。このような研究に関連して、例えば、我々などは、細胞増殖および代謝の複数のプロセスを制御するmTOR(哺乳類ラパマイシン標的)経路が、ウイルス感染への応答にも関与しており、SARS-Cov-2感染に応答して過剰に活性化されることを示してきた [15,129,130]。
過剰に活性化されたmTOR経路は、COVID-19の管理のための潜在的な薬理学的標的となる可能性がある[15,129,130]。[15,129,130].
COVID-19投与中の中枢神経系におけるmTORの過剰活性化はまだ実証されていないが、mTOR経路は、多発性硬化症[131]、アルツハイマー病[132]、HIV関連の神経認知機能低下[133]など、炎症や変性の程度が異なる神経疾患に関与していることは興味深いことである。
Neuro-COVIDとその重症度、mTORとその上流経路であるPI3KとAktの活性化との関連を末梢神経系と中枢神経系の両方で評価することは、重要な病原性情報を提供し、mTORや上流経路の阻害剤を用いた治療アプローチへの道しるべとなると考えられる。
示されているように、Neuro-COVIDの病因における他の潜在的なプレーヤーは、SARS-CoV2感染によって誘発されるプロ炎症性サイトカインおよびケモカインである。プロ炎症性サイトカインが、多発性硬化症(MS)アルツハイマー病、および大うつ病性障害を含むいくつかの神経学的および精神医学的障害の病因に寄与することが知られている[75,127,134,135]。SARS-CoV-2の神経学的症状を誘発する1つ以上の主要なサイトカインを特定することは、神経病理の発症および進行を抑制するためにそれらの薬理学的標的化を可能にするであろう。
このような観点から、我々は、神経疾患の病態生理における関連する役割は、神経成長因子(NGF)ニューロトロフィン-3(NT-3)NT-4/5を含む神経成長因子ファミリーの一員である脳由来ニューロトフィック因子(BDNF)が担っているのではないかと仮説を立てた。BDNFは、神経細胞の維持、神経細胞の生存、可塑性、神経伝達物質の調節を制御している。精神疾患や神経変性疾患の患者では、BDNFがACE2-Mas軸の下流に存在することから、特定の疾患における脳の慢性的な炎症状態に二次的に起因すると考えられる血中および脳内のBDNF濃度の低下がしばしば見られる[136]。
したがって、SARS-CoV-2とACE-2の相互作用は、下流のMas/BDNF軸の障害とBDNFの減少を引き起こし、これがNeuro-COVIDの病因に中心的に関与しているのではないかという仮説が立てられている。
COVID-19,特にNeuro-COVIDにおけるBDNFの修飾については、まだ研究されていない。現在までに、16人の患者を対象に実施された1つの予備研究では、重症または中等症の患者では、軽症の患者と比較して、血清BDNFのレベルが有意に低いことが示されている。COVID-19感染症、特にNeuro-COVIDの病態におけるBDNFの役割に関するこの知見の意義は、もしあるとすれば、明らかに興味深い研究分野である[138]。
13. 結論
COVID-19が純粋な呼吸器感染症ではなく、むしろ多臓器感染症であることは、臨床的・病理学的証拠に基づいて現在しっかりと確立されている。これは主に、ほぼすべてのヒト組織に存在する開裂プロテアーゼ(furin)を利用して、広く発現しているACE2受容体に結合するウイルスの能力に関連している。さらに、SARS-CoV-2は内皮細胞に強い親和性を持ち、内皮細胞の損傷、凝固の増加、および播種性微小血栓症を引き起こす。
また、いくつかの研究では、COVID-19の経過中に中枢神経系と中枢神経系が頻繁に侵されることが示されており、これが神経-COVIDと呼ばれる疾患の特異的な症状につながっている。神経系の病変は、直接的または間接的な機序で起こり、呼吸機能の調節障害を含む広範な臨床症状を引き起こす。我々は、神経症状に関連する最も一般的な症状を説明し、ウイルス障害の直接的および間接的な病原性機序を提案した。中枢神経系および中枢神経系の損傷機構の解明は、Neuro-COVID発症リスクのある患者の早期診断や新規治療法の開発に不可欠であることを強調している。我々は、COVID-19で報告されているmTOR経路の活性化と炎症性サイトカインの産生亢進が、Neuro-COVIDの予防と治療のための新たな価値ある治療薬になると仮説を立てた。特に、新たなエビデンスは、全身および中枢神経系の両方のBDNFレベルの変化がCOVID-19で起こり、それが中枢神経系の症状とBDNFに関連している可能性を示唆している。我々はまた、妊娠中の免疫炎症の既知の影響のためにCOVID-19感染の母親から生まれた新生児の初期の神経学的および精神医学的発達に特別な注意を払うべきであることを示唆している。最後に、長期的な認知・神経学的影響を防ぐために、回復期にあるNeuro-COVID患者の正確なフォローアップが必要であることを警告する。現在の知識とSARS-CoVの報告された経験に基づいて、SARS-CoV-2の神経行動学的後遺症は、プライマリーケア、救急医療、入院治療、精神保健医療の間の緊密な相互作用が必要であり、特定の段階と段階での調整された介入が必要であることを強調している。
