Contents
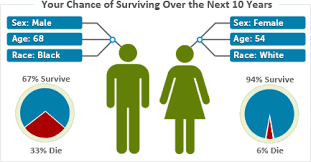
男女の性別によるリスク・重症化の違い
関連記事



性差における遺伝学の役割
immunityageing.biomedcentral.com/articles/10.1186/s12979-020-00183-z
COVID-19の性差の理由はおそらく多因子性であり、遺伝、生活習慣の違い、併存疾患、およびホルモン [28、29]を含む。例えば、中国では、男性の喫煙率は女性よりもはるかに高い。喫煙率は、ACE2 [31]の活性の増加と関連している – ヒト細胞の表面に発現し、SARS-CoV-2ウイルスの「ドア」として使用される受容体タンパク質。興味深いことに、この遺伝子はX染色体上に位置している。
しかし、ACE2活性の性および年齢に関連した変化が生物学的なものであるのか[32]、あるいは交絡因子(例えば、タバコの喫煙[31])に起因するものであるのかは不明である。さらに、それは中国における性差が男女間のたばこ喫煙率の違いに起因する可能性があると推測されているが、この上のデータはこれまでのところ決定的ではない[33]。また、男性は虚血性心疾患などの慢性疾患の罹患率が高く、これはCOVID-19感染症との戦いや生き残りの能力に影響を与える可能性がある。
性差における遺伝学の役割
X染色体は、全ゲノム中で最も多くの免疫関連遺伝子を含んでいる[34]。その中には、自然免疫応答(例えば、単球で高発現するパターン認識受容体TLR7およびTLR8)および適応免疫応答(例えば、エフェクターT細胞で高発現するケモカイン受容体CXCR3)に関与する遺伝子も含まれている。X染色体は、自己寛容性(すなわち、自己からの細胞/分子を許容する免疫系)の破壊に寄与することにより、女性の免疫系の過剰反応性、すなわち女性における自己免疫疾患の発生率の増加に部分的に関与していることが示唆されている[35]。
女性(XX遺伝子型)は、男性(XY遺伝子型)に比べて2倍の数のX-linked遺伝子(1000遺伝子以上)を持っている。X-linked遺伝子の発現レベルは、X染色体不活性化(XCI)と呼ばれるプロセスを経て、X染色体の1つのコピーを転写的に不活性化することで、男女間でバランスが保たれている。XCIは胚発生時に確立され、ほとんどの場合、生涯を通じて維持される [36]。
XCI は一般的に組織間で一様であるが、29 の組織の 449 人を対象に行われた最近の研究では、 XCI パターンには組織および個人特有の不均一性があることが示されている [32]。ヒトの健康におけるこの不均一性が、特にCOVID-19における役割を果たすかどうかはまだ分かっていない。
さらに、いくつかの遺伝子-特にY染色体相同体を有する遺伝子-は、脱出者として知られるXCIから脱出することができる。したがって、これらの遺伝子は、母方および父方の2つのコピーから発現することができる。エスケープ遺伝子もまた、疾患に寄与している可能性がある。
例えば、女性の血液由来免疫細胞の単細胞解析により、TLR7遺伝子は、初代B細胞、単球、形質細胞様樹状細胞において、母方と父方の両方のコピーから発現していることが明らかになった[37]。さらに、このバイアレル発現は、女性におけるこの分子の遺伝子およびタンパク質発現の増加と相関しており、末梢血単核細胞(PBMCs)からも検出することができる。
全身性エリテマトーデス(SLE)では、TLRの投与量が重要な病原因子と考えられている[38]。したがって、XCIのエスケープによるTLR7の発現増加は、他の自己免疫疾患で観察される同様のスキューと同様に、女性におけるSLEの高い罹患率(SLE患者の90%は女性)に寄与している可能性がある。
この分野の報告は限られているが、加齢は XCI パターンにも影響を与え、加齢に伴う特定の遺伝子発現プロ グラムの増加や特定の疾患への感受性の増加に寄与している可能性がある[39]。今後の研究課題は、COVID-19感染症におけるX-linked遺伝子の役割を解剖し、その役割が加齢によって影響を受けるのか、あるいは交絡疾患や状態(例えば、肥満)の存在によって影響を受けるのかを理解することである。
COVID-19 免疫系における老化性の二型
前述のライフスタイル、併存疾患、および遺伝的な違いに加えて、男女の免疫系は、特に加齢に伴って顕著な違いを示しており、これがCOVID-19症例の性差にも寄与している可能性がある。我々の最近の研究では、加齢が女性と男性の免疫系にどのように異なる影響を与えるかを、加齢に関連した変化の程度と時期の両方の観点から明らかにした[40]。
我々は、交絡疾患、投薬、虚弱体質を除外するために慎重にスクリーニングを行い、22歳から93歳までの健康な男女172人の血液由来免疫細胞を調査した。ゲノムアッセイおよび機能的アッセイを用いて、免疫細胞のトランスクリプトームおよびエピゲノムマップを解析することにより、免疫細胞数の加齢に関連した変化、および免疫細胞の機能的な違いを明らかにした。
高齢男性で高い自然免疫
男女に共通する加齢に伴う変化としては、適応免疫(特にT細胞)の低下と自然免疫の活性化が観察された。これらの変化は男女ともに見られたが、特に自然免疫の活性化と炎症に関しては、年齢、BMI、民族的には臨床的に同程度の健康な被験者であっても、男性の方が有意に大きな変化を示した[40]。
IL-6・IL-1RA
これらのゲノム上の所見と一致するように、別の研究から得られた血清タンパク質レベルのデータは、高齢の女性に比べて高齢の男性(65歳以上)では、プロ炎症性のIL6とIL1RAのレベルが高いことを示した(再解析に使用されたn = 267、500FGプロジェクト)[41]。
さらに、これら2つのタンパク質の血清レベルは、女性と比較して男性では年齢とともにより有意に増加した[40]。これらのデータは、男性が女性よりも強い「炎症老化」症候群を経験していることを示唆している。高齢男性における全身性炎症の増加が、女性よりも男性に多く見られる現象である SARS-CoV-2 ウイルスに対する重度の過剰反応を特徴づける炎症性の「サイトカインの嵐」の基礎となるかどうかを理解するためには、さらなる研究が必要である[21]。
妊婦女性の抗炎症メカニズム
中国武漢からの最近の報告によると、COVID-19に感染した妊婦はほとんどが無症状であった(92%、118人中109人)[3]。興味深いことに、妊婦の重症症例の大部分(9人中6人)は出産後に発症したが、これはおそらく妊娠中に妊婦が赤ちゃんに耐性をつけるための耐性/抗炎症メカニズムが発達しているためであると考えられる[42]。
炎症レベルの重要性
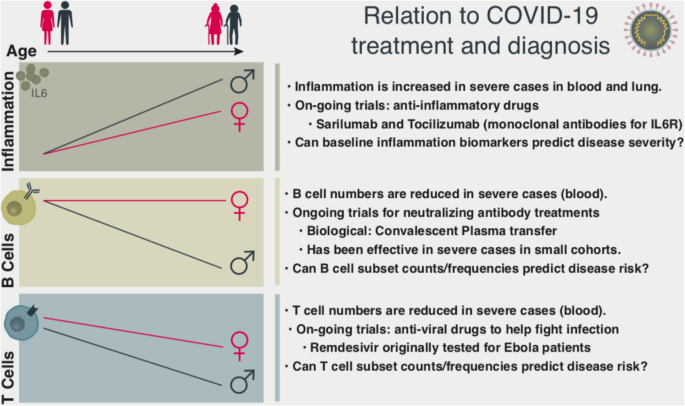
これらの観察結果を合わせると、全身の炎症レベルがCOVID-19の重症度の予測因子となりうることが示唆される。抗炎症薬治療(抗IL-6モノクローナル抗体など)はすでに臨床試験が行われており[24]、高齢者、特に高齢男性や肥満の人など、全身の炎症レベルが高い人に効果があるかもしれない(図1)。
他の抗炎症治療、特に高齢者を保護するために開発されたもの(老年保護)[43]の有効性は、重度のCOVID-19感染症から個人を保護するために将来的に検討されるかもしれない。
B細胞
我々はまた、B細胞のコンパートメントの老化の仕方に顕著な性差があることも明らかにした [40]。B細胞は適応免疫細胞であり、活性化されると形質細胞に分化して抗体を産生する。これらの抗体は血流中や粘膜表面に存在し、感染因子に対する初期のバリアとして機能している。
血中B細胞(数および割合)は、コネチカット州で募集した我々のコホート(細胞割合、n = 130)と、フランス(細胞割合および数、n = 892)[44]および日本(細胞数、n = 356)[45]の別のコホートの両方において、高齢男性(65歳以上)では低かったが、これらの性差の一部は集団間で保存されていることを示唆している。
高齢男性の低いB細胞
高齢男性におけるB細胞数の減少は、抗体産生の減少をもたらし、ウイルスや他の病原体と戦う個人の能力を損なう可能性がある。これに関連して、重度の症状を有するCOVID-19患者の血中B細胞数は無症状患者の3倍(血液1マイクロリットル当たり109対373)[46]であったが、統計的有意水準には達していないものの、より小規模なコホート(n = 44)[21]でも同様の減少傾向が観察された。
血漿投与
5人の重症COVID-19患者を対象としたパイロット研究では、抗体を含む回収患者の血漿を投与することで、SARS-CoV-2ウイルスを有意に中和し、患者の臨床状態を改善することができた[47]。
抗体ベースの治療によるB細胞欠損の可能性
より大規模な抗体ベースの治療研究が現在進行中である(図1)。抗体をベースとした治療戦略は、高齢男性のB細胞欠損を補う可能性がある。しかし、安全性の面で懸念されるのは、非中和性抗ウイルス抗体が宿主細胞への侵入を促進し、それによってウイルスの感染力を高める抗体依存性亢進と呼ばれる現象である。
この現象はin vitroで観察され、デングウイルスに感染したヒト、または初期の呼吸器同期ウイルス(RSV)ワクチンを接種したヒトで発生することが確認されている[48]。これは、急性SARS-CoV感染時に急性肺障害を引き起こす抗スパイク抗体でも観察されている[49]。
高齢男性のT細胞機能の低下
また、女性に比べて男性では加齢に伴うT細胞機能の低下が加速することも観察された[40]が、これは日本人コホート(n = 356)でも報告されている[45]。例えば、ナイーブT細胞頻度は加齢とともに減少し、特にCD8+ T細胞では男女ともに減少したが、若年者および高齢者の両方の被験者において、女性は男性に比べてナイーブT細胞が多かったが、これは他の研究でも観察された[50]。女性はすべての年齢で男性に比べて胸腺機能が高いことが示されている[51]が、これはナイーブT細胞の性差を説明する可能性がある。
リンパ球減少
リンパ球減少症(血液中のリンパ球数が減少する)は、複数の研究[21、23、52、53]でCOVID-19の重症例で報告されており、CD4+およびCD8+ T細胞だけでなくNKおよびB細胞の劇的な減少も含まれている。これらのデータを合わせると、SARS-CoV-2は抗ウイルス免疫を著しく損なう可能性があり、この障害は高齢者にとってより深刻な結果をもたらす可能性があることを示唆している。
COVID-19に対するいくつかの抗ウイルス薬が臨床試験中であり、その中にはエボラ患者のために開発されたレムデシビルも含まれている;米国食品医薬品局(FDA)は最近、重度のCOVID-19症例に対するレムデシビルの緊急使用承認を発行した。
中国本土におけるCOVID-19の年齢と性差の比較研究
academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa683/5849103
COVID-19の年齢に依存する二型性があることが明らかとなった。女性のCOVID-19感染の感受性は高いが、重症度と死亡率は低くなる。
COVID-19感染と循環ACE2レベル
www.frontiersin.org/articles/10.3389/fped.2020.00206/full
女性と子供における保護の役割
COVID-19の新規感染におけるACE2の役割はどうなのだろうか?
この明らかなACE2パラドックスは、タンパク質のレベルを調節する翻訳後のイベントと、膜結合型と可溶性型の間のバランスによって説明されるかもしれない。
実際、ACE2は内皮細胞からADAM17(ジスインテグリンおよびメタロプロテアーゼ17)が介在する「脱落」を受け、その結果、触媒作用と生理活性を持つエクトドメインが循環に放出されることになる(9)。
したがって、2014年に、研究者たちは、循環するACE2酵素がインフルエンザA(H7N9)ウイルス誘発性急性肺損傷に対する保護を提供することを発見した(10)。
一方、ACE2の遺伝子をオフにすると、H5N1に感染したマウスでは重度の肺障害が生じたが、ヒトACE2を投与したマウスでは肺障害が緩和された(10)。
さらに、組換えヒトACE2の単回投与(GSK2586881;0.2mg-kg-1または0.4mg-kg-1 i.v.、NCT01884051)は、前臨床試験および臨床試験の両方で肺動脈性高血圧症の血行力学的効果を示すことが示されている(11)。
ACE2遺伝子変異
いくつかの先行研究では、ACE2遺伝子の遺伝子変異がヒトの体内のACE2レベルに影響を与える可能性があることが示唆されている。
Leeds Family Studyでは、534人の被験者の血漿中のACE、ACE2、中性エンドペプチダーゼ(NEP)活性が測定され、循環ACE2の表現型の変化の67%までが遺伝的要因によって占められることが示された(12)。
さまざまな多型の中で、ACE2 rs2106809がACE2レベルに一次的な影響を及ぼすのではないかと推測されている。
ACE2の循環レベルは、CCまたはCT遺伝子型ではTT遺伝子型に比べて高くなる傾向がある。
これは、内皮機能を調節するマイクロRNAが、翻訳抑制や転写後分解を介して内皮機能を調節している可能性があることを示唆している。
民族間、人種間のACE2分布
さらに、異なる人種および民族間でのACE2変異体の分布頻度のいくつかの有意差が記載されている。
最近の単細胞RNA-sequencing(RNA-seq)解析では、アジア人男性は組織ACE2の発現が高い可能性があることが示された(13)。
中国東北部の漢民族集団で実施された別の症例対照研究では、血清ACE2活性は、女性のEH(本態性高血圧)患者の体格指数(BMI)、脈圧、およびエストロゲンレベルと負の相関を示した (14)。
これらの観察は、ACE2循環レベルの心血管保護効果を示唆しており、同時にエストロゲンがACE2発現と活性レベルのアップレギュレーションに関与していることを証明している。
これはCOVID-19感染における女性と男性の相対的な保護を説明するものであろう。これらの証拠を総合すると、COVID-19に対する性の素因は、男性の方が感受性が高く、特異的なACE血漿プロファイルを反映している可能性があることを示唆しているように思われる。
子供のACE2
このような関連性のある傾向は、子供にも見られた。一般に小児は成人よりもACE2のレベルが高い(16)。例えば、FAPGGベースの酵素活性アッセイを用いた場合、小児(生後6ヶ月から17歳まで)のACEレベルは13-100 U/lであるのに対し、成人のACEレベルは9-67 U/lである。
注目すべきは、COVID-19が確認された小児は一般的に軽度の症状を呈しているという事実である。新しい研究によると、中国の子どもたちの間のコロナウイルス疾患2019(COVID-19)の症例は、成人の症例よりも重症度が低いことが明らかになっている。
中国の患者1,099人を対象とした研究では、確認された症例のわずか0.9%が9歳未満であったのに対し、10~19歳ではわずか1.2%であった(17)。
ノースカロライナ州で行われたマウスの研究でも同様の現象がBaricらによって報告されている。SARS-CoVはかなりよく複製することができるが、若い動物は病気の点では感染に対して本当に抵抗力がある。高齢の動物を試験したところ、SARSの病気の重症度が上昇した(18)。
母体への影響
我々の意見では、年齢とCOVID-19疾患重症度との間の相関関係の説明は、高齢化した免疫系の免疫低下(immunesenescenceと呼ばれる)だけでなく、出生時からの子供を特徴付ける可能性のある特異なACE血漿プロファイルにも関連しているかもしれない。
実際に女性の妊娠中期から後期には、ACE2 の尿と血漿レベルの増加だけでなく、局所的な胎盤/子宮の生産と ACE2 の活性の増加が発見された。
これは、ACE2の胎盤-胎児血流と急速な胎児の成長の強化における全身的な血行力学的役割を示唆している。 (19)。
ACEは胎盤を通過することができ、母体の免疫や他の種類の保護可溶性因子を赤ちゃんに伝達することができる。
中国におけるCOVID-19の小児患者の疫学的特徴と感染パターンから、成人とは対照的に、若年患者では有意な性差がないことが明らかになった(20);これはおそらく小児と青年の性成熟度の影響によるものである。
男性の精巣
実際、エストラジオールはERを介してACE/ACE2およびAT1/AT2受容体のモジュレーターとして知られているだけでなく、ACEは男性の生殖にも関係している。精巣ACEの触媒活性はACEのカルボキシ末端ドメインのみを含み、アンジオテンシンI以外の基質に対して未知の作用を示している(21)。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされるコロナウイルス疾患2019(COVID-19)は、複数の臓器が関与している。精巣への関与はほとんど不明である。
COVID-19患者の精巣における病理学的所見:臨床的意義
pubmed.ncbi.nlm.nih.gov/32563676/
デザイン、設定、参加者。
死亡したCOVID-19患者12人の精巣の死後検査を、光顕微鏡と電子顕微鏡を用いて、リンパ球マーカーと組織球マーカーの免疫組織化学的検査を行った。精巣組織中のウイルスの検出には、逆転写ポリメラーゼ連鎖反応(RT-PCR)を用いた。
結果と限界
顕微鏡的には、セルトーリ細胞は腫脹、空胞化と細胞質の希薄化、管状基底膜からの剥離、管内細胞塊の内腔への損失とスロー化を示した。11例中2例、5例、4例はそれぞれ軽度、中等度、重度の損傷を示した。
COVID-19精巣のライディッヒ細胞の平均数は対照群に比べて有意に少なかった(2.2 vs 7.8、p < 0.001)。精巣間質には浮腫とTリンパ球と組織球からなる軽度の炎症性浸潤が認められた。透過型EMでは3例でウイルス粒子は検出されなかった.RT-PCRでは12例中1例でウイルスが検出された。
結論
COVID-19患者の精巣には、有意な精管損傷、ライディッヒ細胞の減少、軽度のリンパ球性炎症が認められた。RT-PCR検査では、大多数(90%)の症例で精巣内にSARS-CoV-2ウイルスの証拠は認められず、電子顕微鏡検査では1例も認められなかった。
これらの知見は、精子提供のためのエビデンスに基づいたガイダンスを提供し、COVID-19病期の精巣損傷のリスクを軽減するための管理戦略を提供する可能性がある。
免疫反応の性差
男性のCOVID-19患者は報告された症例の3分の2以上を占めている。(73%対27%)
また、男性患者では2019-nCoVで死亡する可能性が1.5倍以上高くなっている。(死亡率:2.8%対1.7%)。
男性は一般に、I型IFNと炎症性サイトカインの産生量が少なく、循環T細胞の数が少ないと考えられている。
エストロゲン、プロゲステロン、アンドロゲンなどの性染色体遺伝子と性ホルモンは、性別間の免疫反応の異なる調節に寄与する。
栄養状態や腸内微生物叢の組成などの環境要因も、男性と女性で異なった免疫系の発達と機能を示す。
www.nature.com/articles/nri.2016.90
ウイルス、細菌、寄生虫、真菌によって引き起こされる感染症の重症度、有病率、病因は性差によって異なり、一般に男性が女性よりもこれらの感染症にかかりやすい。
pubmed.ncbi.nlm.nih.gov/26891052/
自己免疫性脳脊髄炎(EAE)マウスと多発性硬化症患者の末梢単核細胞では、メスはTH1細胞の活性化とIFNγ産生レベルの増加を示すが、オスはT細胞でのPPARα発現のアンドロゲン受容体調節により、TH17細胞応答が大きくなる。
自己免疫性脳脊髄炎(EAE)雌マウスと多発性硬化症の重症型のメスマウスでは、高用量のエストロゲンを投与すると、細胞性免疫反応が抑制され、疾患の症状が緩和される。
pubmed.ncbi.nlm.nih.gov/26621682/
多くの場合、細菌ワクチンやウイルスワクチンに対する抗体反応は、男性よりも女性の方が高い。これは、効果的なワクチンの投与量は男性よりも女性の方が低くても良いことを意味するかもしれない。
不活化インフルエンザワクチンを用いた用量反応研究では、半量インフルエンザワクチンを半量接種したヒトの女性は、全用量ワクチンを接種した男性と同等の抗体価を達成した。
pubmed.ncbi.nlm.nih.gov/19064822/
TMPRSS2は、SARS-Cov2の宿主への侵入に必要とされる重要な因子。 前立腺癌の主要な調節因子でもあり、アンドロゲンに応答して発現を強くアップレギュレートする。
より高いTMPRSS2発現に関連する一塩基多型の保有患者は、二つのコホート研究でインフルエンザ感染の影響を受けやすかった。 このことは、COVID-19における男性の死亡率の高さを部分的に説明するかもしれない。
TMPRSS2は、エストロゲンのシグナル伝達に反応する可能性がある。 アンドロゲン受容体阻害療法がCOVID-19の肺症状に対する感受性と死亡率を低下させるかもしれないという仮説。
cancerdiscovery.aacrjournals.org/content/early/2020/04/10/2159-8290.CD-20-0451
理論的には、高アンドロゲンの表現型は、COVID19のウイルス量の増加、ウイルスの播種の増加、および肺病変の重症度と相関している可能性がある。 頭髪が少ない、胸毛が濃い、にきび、脂性肌、での高リスク?
www.jaad.org/article/S0190-9622(20)30608-3/pdf
COVID-19:免疫反応と病因に関する未回答の質問。
www.jacionline.org/article/S0091-6749(20)30631-X/pdf
ほとんどの場合、小児は軽度の疾患を発症している。これには異なる説明が提案されている。この良好な状況には、頻繁な感染や幼少期に投与されたワクチンやアジュバントによって挑戦され、訓練された自然免疫が寄与している可能性がある。さらに、小児の SARS-CoV2 に対する感受性が低いのは、成人に比べて ACE-2 受容体の密度が低いためである可能性がある。
女性の感染頻度と死亡率が低いのは、ホルモンや遺伝的な違い、肺に影響を及ぼす併存疾患(COPD、喫煙など)の発生率が低いこと、あるいは何らかの調節機序が低下した結果、自己免疫疾患やアレルギー性疾患の有病率が高いことと関連している可能性がある。
男性と比較して、女性は通常、以下のことを示す
i. ウイルス負荷レベルが低く、より高い CD4 T 細胞と Abs 応答を伴う炎症が少ない
ii 組織におけるセリンプロテアーゼ TMPRSS2(S タンパク質プライミング)の発現が低い、肺における ACE2 の発現が低い、
iii. iv. 過剰発現したTLR7(SARS-CoV2としてのRNAウイルスにとって重要なセンサー)は、ウイルスによってトリガーされると、より高いIFNとより低いIL-6産生につながる。
男性と女性のCOVID-19死亡率の年齢関連の違い
pubmed.ncbi.nlm.nih.gov/32460973/
男性と女性とでは死亡率は常に男性が高いものの、その比率は年齢によって異なる。
イタリア国立衛生研究所の調査では、男性100に対して20歳から59歳の女性平均の27.8%に対して、50~59歳ではその比率が突然大きく43%にまで変化することがわかった。
X染色体の不活性化からの脱出
X染色体不活性化からの15%のランダムな脱出により、肝臓と肺、胃腸組織などのACE2発現レベルは男性と女性との間で異なる。
胃腸組織のACE2発現の男女での違いは、糞便感染を含むさまざまな感染パターンを作り出す可能性がある。
重度の肥満患者での重症度の違いも説明できるかもしれない。
pubmed.ncbi.nlm.nih.gov/32348773/
IgG抗体産生の不一致
女性患者におけるIgG抗体の生成は、疾患初期段階の男性患者よりも強かった。
pubmed.ncbi.nlm.nih.gov/32383183/
COVID-19の臨床試験は変数として性別を含める必要がある。
COVID-19感染に対する遺伝的性別とミトコンドリアの役割
www.karger.com/Article/FullText/508560
要約
COVID-19感染症、および一般的な感染症に対する女性と男性の免疫応答の違いは、多因子性である。免疫応答のよく知られた決定因子であるX染色体とY染色体、性ホルモン、微生物相などは、機能的に相互に関連しており、生物の免疫を形成する上で相互に影響し合っている。
ここでは、遺伝的性別とミトコンドリアとの相互作用と、それがCOVID-19感染における性別依存性免疫応答にどのように影響を与えるかに焦点を当てて解説する。
これらの相互作用の存在を認識することは、COVID-19や他の感染症と戦うための新しい方法を設計したり、既存の治療法や日常的な治療法を微調整するのに役立つかもしれない。
序論
研究や臨床研究では、患者の遺伝的性別が免疫反応や、多くの一般的な非感染症や感染症の経過、予後に影響を与えることが示されている。COVID-19感染者においても同様の相関関係が最近観察されており、COVID-19感染者の世界的な統計解析によると、感染率と転帰の不潔さは男性の方が女性よりもはるかに高く、重篤であることが示されている。
この現象の最も一般的な説明は、男性では免疫反応を犠牲にしてテストステロンに依存した二次性徴が発達するという「免疫能力ハンディキャップモデル」である。性ホルモンは自然免疫応答と適応免疫応答に影響を与えることが知られており、アンドロゲンは抗炎症性であり、エストロゲンはプロ炎症性と抗炎症性の両方を持つ[1, 2]。
しかし、これらの性差のメカニズムは多因子性であり、性染色体にコードされた因子と調節因子、ホルモン、および人体に生息する微生物相の間の非常に複雑な相互作用に依存している。過去10年間で、ヒトの消化管に生息する微生物は、その種類や種類の豊富さにおいて、男女間で異なることが明らかになってきた。
マイクロジェンダーロームと呼ばれるこの性に依存した微生物群は、性ホルモンの分泌が始まる思春期以降に発生し、局所的・全身的な炎症や感染症への反応を調節している(図1)[1-3]。
また、最近の研究では、免疫応答の性差がミトコンドリアの性二型集団に依存している可能性も示唆されている。
以下に、これらの異なる要素がどのようにCOVID-19や他の疾患に対する免疫応答を形成しているかを簡単にまとめてみた。
図1.
免疫系に対するマイクロジェンダーゲノムの影響
出生時に獲得した微生物や、環境(空気や食べ物)から得た微生物は、人体、特に消化器系をコロニー化する。
思春期以降は、性ホルモンの影響で、男性と女性の体内に生息する種の豊富さと多様性が変化し、男性の方が女性よりも多様性が少ない。
マイクロジェンドロームによって産生される化合物は、自然免疫や適応免疫、脳の機能に相互に影響を与える(Vemuriら[2]より引用)。
免疫のX・Y染色体制御
女性と男性の免疫応答の違いは、X染色体の数(女性の場合は2本のX、男性の場合は1本のX)や、免疫細胞の機能に対する性ホルモンの影響に直接関係しているが、ここ10年の研究では、Y染色体とX染色体の両方が免疫細胞の転写と翻訳(転写体とプロテオーム)のプロファイルを制御していることが示されている。
X染色体
mar2017.archive.ensembl.org/Homo_sapiens/Location/Chromosome?r=X [4]によると、ヒト染色体Xは1億5000万以上のDNA塩基対からなり、全ヒトゲノムの中で最も多い数の自然免疫・適応免疫関連遺伝子と数百のノンコーディング遺伝子を含む800以上のタンパク質をコードする遺伝子を含んでいる。
免疫応答遺伝子には、マクロファージを含む免疫細胞、炎症を起こした組織や臓器への移動を指示するフラクタリン受容体CXCR3(C-X-Cモチーフケモカイン受容体3)が含まれている。
抗原提示細胞、B細胞、単球/マクロファージ、樹状細胞上のCD40受容体に結合し、CD154との相互作用によりT依存性B細胞活性化のシグナルを誘導するCD80リガンド遺伝子、インターロイキン-1受容体関連キナーゼ1(IRAK1)遺伝子。
また、X染色体には、常染色体遺伝子産物の発現および分解を調節する全ゲノムマイクロRNA(miRNA)遺伝子の10%が含まれている[5, 6]。
研究では、X染色体のいずれかに欠失、または広範な欠失があると、さまざまな自己免疫疾患につながることが示されている(図2)[5,6]。
図2.

性染色体が免疫関連機能に及ぼす影響
X染色体には、多くの免疫応答関連遺伝子や、多くの遺伝子の転写、スプライシング、分解を制御するゲノムmiRNAが全ゲノムの10%を占めている。また、メスのアイデンティティの指定を通じて、母体のパージとミトコンドリアの伝達を指示する。
雌細胞では、X染色体の1つの不活性化はランダムであるため、雌体は、同じ遺伝子の異なる対立遺伝子を含むことがある。例えば、ウイルス受容体ACE2の異なる対立遺伝子は、ウイルスに対する親和性が異なる可能性があり、これは抗ウイルス免疫応答に影響を与える。
Y染色体は、X染色体とオートソームの転写的に不活性な状態(ヘテロクロマチン)と活性な状態(ユークロマチン)の調節を通じて、多くの異なる免疫応答機能、免疫細胞数、免疫細胞の表現型を調節している。
男性のCOVID-19感染率が高いのは、確率的なX染色体の不活性化による女性細胞のX染色体モザイク化の影響もあるかもしれない[7]。例えば、β型コロナウイルスSARS-CoV-1およびSARS-CoV-2の受容体であるアンジオテンシン変換酵素2(ACE2)は、X染色体上に位置するACE2遺伝子によってコードされている。
この遺伝子のいくつかの対立遺伝子が、ウイルスを認識して結合する効率の異なる受容体をコードしている可能性がある。すべての細胞には同一のX染色体が存在するため、雄の細胞は常に単一のACE2対立遺伝子を発現している。
対照的に、雌の場合は、細胞間にストキャスティックス的に分布しているX染色体がモザイク状になっているため、異種性ACE2対立遺伝子を発現する。したがって、メスでは、ACE2受容体の潜在的により効率的な形態が、全細胞の半分しか存在しないであろう。
これは、SARS-CoV-1およびSARS-CoV-2ウイルスへの感染性を制限し、ある程度、メスに感染に対する相対的な抵抗性を与える可能性がある(図2)。また、このようなACE2多型が高血圧やその他の疾患に影響を与えるかどうかについても議論されている[8, 9]。
Y染色体
ヒトのY染色体はX染色体よりもはるかに小さく、約6,000万塩基対のDNAで構成されており、大多数の動物ではその大部分が転写的に無色である(異色性)。
Y染色体は、主にトランスポーズ可能な要素、リピート配列(内容の50%以上を占める)、リボソーム遺伝子の多型変異体などのマルチコピー遺伝子、およびタンパク質をコードする遺伝子の数が少ないが、これらは主に男性に特異的で、性発生、精子形成、性比、生殖能力を調節しており、多くの場合、オートソームからのトランスポーズ/トランスロケーションによって進化したものである。
Y染色体のこの男性特異的な領域(MSY)は再結合しないため、連続した男性の世代間では変化しない[10-13]。
Y染色体は、常染色体とX染色体のヘテロクロマチン/エクロマチン状態を制御し、免疫応答遺伝子を含む様々な遺伝子のサイレンシング/発現に影響を与え、組織/細胞特異的な代替遺伝子スプライシングを制御することが研究で明らかになっている[10, 14-18]。
Y染色体がヘテロクロマチン/エウクロマチン含量に影響を与え、他の遺伝子の転写に影響を与えるメカニズムはほとんどわかっていないが、Y染色体がヘテロクロマチン化因子を隔離しているという仮説と、細胞核の構造に影響を与え、特定の遺伝子を転写因子にアクセスできなくしているという仮説がある[19-22]。
系統研究では、ヨーロッパで最もポピュラーなY染色体の系統であるハプログループIを持つオスは、炎症反応がアップレギュレーションされ、適応免疫がダウンレギュレーションされ、冠動脈疾患のリスクが高いことが示された[23-25]。
マウスモデルでは、Y染色体はナチュラルキラーT細胞の数、CD4+ T細胞の遺伝子発現パターン、マクロファージの免疫応答、およびコックスサッキーウイルス感染後の死亡率に影響を与えており[26-28]、Y染色体が多種多様な免疫細胞および免疫プロセスに強い影響を与えていることを論証している。
Caseらの研究[10]では、Y染色体遺伝子SlyとRNA結合モチーフ遺伝子Rbmyのコピー数が自己免疫疾患の発症率を逆に制御することが示されている。
マウスインフルエンザモデル[29]では、Y染色体の遺伝子変異が、インフルエンザA感染症の発症率を高め、T細胞の炎症性サイトカイン発現を活性化し、肺での病原性免疫応答を増加させることが示されている(図2)。
ミトコンドリア
過去数十年の研究[30, 31]では、ミトコンドリアは生体エネルギー(ATPを生成する)と生合成(様々な高分子の合成のための成分を生成する)のハブであるだけでなく、自然免疫応答と適応免疫応答、発生、免疫細胞の特定の表現型の維持/生存と活性化のために不可欠な調節因子であることが示された。
ミトコンドリアはまた、ATPレベルを変化させ、その代謝経路を交互に変化させ、活性酸素種やミトコンドリアDNAシグナルを放出することで、免疫細胞の様々なシグナル伝達経路や転写に影響を与えることができる。
ミトコンドリアは、呼吸の種類を破たんしたTCAサイクルからβ酸化に変えることで、マクロファージの表現型をプロ炎症性(M1)から抗炎症性(M2)に切り替えることができる。また、免疫細胞の小胞体膜に近接した位置にミトコンドリアが局在することは、免疫細胞の代謝や免疫関連機能に直接影響を与える[30, 31]。
また、ミトコンドリアの外膜には、ウイルスRNAの存在を感知するレチノイン酸誘導遺伝子I(RIG-I)というウイルスRNAセンサーによって活性化されるミトコンドリア抗ウイルスシグナル伝達(MAVS)タンパク質が含まれている。
MAVSは、抗ウイルス防御機構としても作用し得る。RNAウイルスに感染したマクロファージでは、MAVSは抗ウイルスタンパク質viperinと相互作用し、抗ウイルス化合物インターフェロンのレベルに影響を与える(図3)[30, 32]。
ミトコンドリアMAVS応答の適切な機能は、SARS-CoV-2ウイルスが肺胞マクロファージに直接感染し、肺のサイトカインストームのスイッチを入れるように誘導するCOVID-19感染に特に関連しており、重要であり得る[33]。
さらに、ウイルスの生存と複製は、宿主のミトコンドリアが産生するエネルギーに依存しているため(図3)、ミトコンドリアの生体エネルギー機能を調節する化合物を含む新規抗ウイルス戦略が考えられる(34)。
図3.

抗ウイルス免疫応答に対するミトコンドリアの影響。
ウイルスの存在は、ウイルスRNAの主要なセンサーであるRIG-Iによって感知される。
これにより、ミトコンドリア膜に存在する抗ウイルスMAVSタンパク質が活性化される。活性化されたMAVSは、ウイルス抑制タンパク質であるビペリンとの相互作用を介して、インターフェロンのレベルに影響を与え、その結果、ウイルスの複製を調節する。
さらに、ウイルスは、好気性呼吸や嫌気性呼吸などのミトコンドリア機能に直接影響を与え、免疫細胞の表現型や応答に影響を与える。これらのデータはすべて、健康で適切に機能するミトコンドリアが免疫応答の適切性に不可欠であることを示している。
したがって、COVID-19のような男性における感染率および重症度の高い感染症を説明する理論の一つが、ミトコンドリアの母性伝達、および男性におけるミトコンドリアの標準以下の品質に関連していることは、驚くべきことではない。
ヒトを含む哺乳類では、ミトコンドリアは卵の細胞質で母性的に伝達される。受精後、初期胚発生の間に、母体のミトコンドリアは複製し、体細胞および生殖細胞に入る[20]。ヒトにおけるミトコンドリアの父性伝達のいくつかの、非常にまれな例があるが[35]、ヒトにおけるミトコンドリアDNAの母性継承の概念は依然として有効である。
哺乳類の卵の形成と成熟の間に、ミトコンドリアは品質管理を受け[36]、欠陥のあるもの、または雌にとって有害な変異を含むものは排除される。
このミトコンドリアの淘汰はメスに偏っているため、卵の細胞質に残ったミトコンドリアにはオスにとって有害な突然変異が含まれている可能性がある。このいわゆる「母の呪い」[20]は、男性の免疫応答の質と能力にも影響を及ぼす可能性がある。
最近、メラトニンがCOVID-19治療の潜在的なアジュバントとして示唆された[37]。メラトニンは、有毒な酸素種や窒素ベースの反応物を消去し、抗酸化酵素を増強し、電子輸送鎖を促進し、電子漏出を制限し、フリーラジカルの発生を抑制し、ATP合成を刺激することで、ミトコンドリアの恒常性にプラスの効果を持つ[38]。
ミトコンドリアの質がCOVID-19感染症に影響を与える可能性があるという我々の仮説に照らすと、COVID-19患者のメラトニン治療は女性よりも男性の方が有益である可能性がある。
現在のところ、COVID-19および他の微生物感染症の性差に起因する結果に対する有効な治療法は証明されていないが、女性と男性の免疫応答の違いの根底にあるすべてのメカニズムについての詳細な知識は、新しい治療法および治療アプローチの開発を促進するはずである。