Contents
コロナウイルス 高フェリチン血症症候群
高フェリチン血症症候群
悪化したCOVID-19は、高フェリチン血症症候群スペクトルの新しい仲間?
www.sciencedirect.com/science/article/pii/S156899722030135X
COVID-19感染症は「高フェリチン血症症候群」と臨床的/研究的特徴を共有している。
COVID-19は高フェリチン血症症候群のメンバーと少なくともいくつかの段階で類似している
リンパ球減少症、NK数と活性の低下、肝機能検査の異常、凝固障害、そしてもちろん高フェリチン血症である。
COVID-19の重症型は、マクロファージ活性化症候群(MAS)、成人発症スティル病(AOSD)、破局性抗リン脂質症候群(CAPS)および敗血症性ショックを含む、「高フェリチン血症症候群」という用語の下に収集された4つの実体と、いくつかの臨床的および検査学的特徴を共有している。
COVID-19全身性炎症反応および「高フェリチン血症症候群」は、いずれも高血清フェリチンと、最終的に多臓器不全に至るサイトカインの嵐によって持続する生命を脅かす高炎症を特徴としている。
高フェリチン血症
高フェリチン血症は「高フェリチン血症症候群」の特徴であり、過去10年の間に、高循環フェリチンは急性期の反応を反映しているだけでなく、炎症においても重要な役割を果たしている可能性があるという考えを支持する証拠が増加している。
フェリチンは主要な細胞内鉄貯蔵タンパク質であり、その2つのサブユニットであるHとLの比率は、細胞の組織タイプや生理的状態によって異なる場合がある[13]。H-フェリチンは免疫調節機能だけでなく、IL-1βを含む様々な炎症性メディエーターの発現を誘導することで頂点に達する炎症促進活性を示すようである。
高鉄血症はいくつかの自己免疫疾患を特徴づけるが、その免疫調節特性に基づいて病原性の役割を果たしている可能性がある。炎症状態での循環血清フェリチンの起源については、いまだに議論されていない。
マクロファージの活性
In vitro実験では、フェリチンは非古典的な経路を介してマクロファージと同様に肝細胞[18]によって活発に分泌される可能性があることが実証されている[19]。
したがって、「高フェリチン血症症候群」では、マクロファージの活性化がフェリチン産生に積極的に寄与している可能性が高い。この仮説に沿って、以前の研究では、AOSDにおけるフェリチンの血清レベルは、疾患活動性と相関があるだけでなく、マクロファージの活性化とも相関があることを示した。
フェリチンの重症度との相関
興味深いことに、COVID-19を有する入院患者39人のコホートを記述した非常に最近の研究では、フェリチンの血清レベルが疾患の重症度と有意に相関していることが判明した。
活性な分泌のほかに、炎症反応の間、血清フェリチンの主な成分は、細胞死、特に肝細胞死によって得られる。一旦放出されると、フェリチンは内部の鉄分の一部を失い、「遊離鉄」 の血清レベルが非常に高くなる。
遊離鉄
重度の炎症状態の間に検出可能な循環中の「遊離鉄」の過剰は、顕著な凝固促進状態を誘導する特別な能力を持つ炎症反応を悪化させることができるようである。
この能力は、赤血球とフィブリンの形態の変化に関連している “遊離鉄 “は、それ自体がヒドロキシルラジカルの産生を支持することができる。赤血球とフィブリンに対する酸化ストレスは、脳卒中発症の原因となる緻密な血栓の産生を誘発する可能性がある。
鉄キレート
鉄キレーションは、活性酸素産生を減少させることで炎症反応を抑制し、抗ウイルス活性を促進する能力があるため、SARS-CoV-2感染症患者におけるこの治療法の有用性が最近注目されている。
軽度から重度のCOVID-19感染症患者を対象としたデスフェラル(デフェロキサミン、「鉄の過剰摂取」の場合に鉄を結合させることができる薬物)の使用に関する臨床試験がイランで現在進行中である。
血管凝固
COVID-19患者で発生する血管凝固の増加は、古典的なDICというよりもむしろ肺中心性肺血管内凝固症(PIC)に近いものである。この特異な症状はMAS様の肺内炎症に関係していると思われる。実際、重度のCOVID-19はMASに似たいくつかの異常な臨床検査パラメータを持っていますが、古典的な臓器肥大症のような他の特徴の欠如は、主に肺実質に限定された免疫系の過剰活性化を仮定することにつながる、驚くべきことだ。
単球とマクロファージ
高フェリチン血症症候群」とSARS-CoV-2重症感染症との類似性は、これまでに報告された数少ないCOVID-19患者の剖検からも明らかになっている。剖検における巨視的所見には、胸膜炎、心膜炎、肺の圧迫、肺水腫が含まれる [34];顕微鏡的所見には、単球とマクロファージを主成分とする炎症性浸潤を伴うびまん性肺胞損傷、リンパ球の浸潤は最小限であるが、多核化した巨大細胞と巨大な非定型肺炎球が含まれる 。
心筋炎の形での心臓病変も記載されている。同様に、胸膜炎、心膜炎、心筋炎は、主にAOSDとMASを持つ患者で記載されている。COVID-19患者において安全に剖検を行うためのいくつかの推奨事項やガイドラインが発表されているが、この感染症に関連する損傷の程度や種類、およびその可能性のある病態をよりよく理解するためには、病理学的側面が最も重要であるにもかかわらず、この側面に関する文献はまだ乏しい。
COVID-19による全身炎症に関与する分子・エピジェネティック因子の研究
SARS-CoV-2感染者の中には、治療に反応する患者がいる一方で、なぜこのような劇的な経過をたどる高炎症状態に移行するのかはまだ不明である。SARS-CoV-2感染の重症化は、ウイルス因子だけに起因するものではなく、異なる疫学的・分子的因子を含む宿主の特徴に起因していると考えられる(図1)。

COVID-19に関する具体的なデータがないにもかかわらず、民族性もまたウイルス感染の結果に何らかの影響を与えている可能性がある。出生時に、白人とアジア人の間で自然免疫応答の違いが確認されている。
健康なフィリピン人由来のマクロファージをM. Tuberculosisに感染させた場合、中国人や非ヒスパニック系白人と比較して、IL-1とIL-6の産生量が低く、IL-8の産生量が高いことが示されている。さらに、麻疹ワクチンを接種した子供のPBMCを対象とした研究では、刺激後のサイトカイン産生量に人種に関連した変動が見られた。
抗体依存性
COVID-19感染の転帰の違いを支持するもう一つの興味深い仮説は、他のコロナウイルスへの過去の暴露によるSARS-CoV2の抗体依存性の亢進である。実際、COVID-19感染前に他のコロナウイルスに以前に接触していたことが、COVID-19感染前に免疫反応を高める原因となっていたことが、人によって観察された重症度の違いを説明できる可能性がある。
今のところ確実なのは、まだ明らかにする必要がある理由から、COVID-19患者の中には過剰な炎症反応が見られることであり、これは他の炎症性疾患、例えばAOSDのような特発性自己炎症性疾患の原型であり、感染によって頻繁に引き金を引かれることがある。
IL-1β
この状態との類似性から、遺伝的素因も排除できない。AOSDでは、IL-1関連経路におけるまれなコーディングバリアントの存在およびIL-18に関連する遺伝子多型が同定されている。同じ程度で、PRF1とUNC13D遺伝子に関連するヘテロ接合変異は、MAS患者の特定のサブセットにリンクされている。
遺伝的要因に加えて、両方の肺上皮細胞によって、自然免疫細胞と適応免疫細胞によって異なるサイトカインの発現の変調を考慮する必要がある。
IL-1βに関しては、SARS-CoVを対象とした先行研究で、ウイルスが炎症細胞の活性をアップレギュレートし、その結果、IL-1βの産生を積極的に増加させる能力があることが実証されていることを覚えておくことが重要である。
SARS-CoVとSARS-CoV-2の間の類似性(82%のヌクレオチド配列相同性)から、SARS-CoV-2は過剰なIL-1β媒介応答を誘導する能力を示している可能性が高い。
したがって、COVID-19誘導炎症反応とAOSDやMASなどの高フェリチン血症症候群との間のリンクは、両方とも大規模なIL-1βの全身放出に関連していることはすぐに明らかである。
インターフェロン
MASの間に、それはまた、炎症反応の重要なメディエーターであり、その中和が有望に見える II型インターフェロン(IFN)の役割を思い出させることが重要である。
この点で、I型IFNが主な抗ウイルス経路を代表することは知られているが、SARS-CoVに関する研究では、I型およびII型IFN(α-βおよびγ)の両方が相乗効果を発揮してウイルスの複製を阻害し、同時に活性ウイルスがそのようなIFN産生を減少させようとしていることが明らかになった。
COVID-19患者からの予備的データは、CD4+ T細胞によるIFNγ産生の抑制が、より重篤な疾患とどのように関連しているかを示唆している。
結論
結論として、COVID-19の全身性炎症はハイエルフェリチン血症症候群のスペクトルの一部であると考えられる。これらの疾患の背景には共通の病因があると考えられ、重要な炎症性メディエーターを標的とした治療法の使用を支持する。
現在までに、TocilizumabまたはSarilumabによるIL-6阻害、およびAnakinraまたはCanakinmabによるIL-1阻害の有効性を評価するいくつかの臨床試験が進行中である。特にAOSD およびMAS において有意な有益性を示すことが知られているこれらの治療法への反応は、「高フェリチン血症症候群」と重度のCOVID-19との間に厳密な病原性の関連性があるという仮説をさらに支持するものであろう。
フェリチン濃度とCOVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7286435/
フェリチンは、特に極度の高フェリチン血症下では、直接的な免疫抑制作用と炎症促進作用を介して免疫調節障害の重要なメディエーターとなり、サイトカインストームに寄与している1。COVID-19による致死的転帰はサイトカインストーム症候群を伴うことが報告されており、疾患の重症度はサイトカインストーム症候群に依存することが示唆されている2。
糖尿病患者の多くは血清フェリチン値が上昇しており3-5、COVID-196による重篤な合併症を経験する可能性が高いことが知られている。これに基づいて、我々は、フェリチンレベルがCOVID-19の重症度に影響を与える重要な因子であるかもしれないという仮説を支持する証拠を簡単にレビューする。
20人のCOVID-19患者を対象としたある研究では、重症および非常に重症のCOVID-19患者は血清フェリチン値の上昇を示し、非常に重症のCOVID-19群の血清フェリチン値は重症のCOVID-19群よりも有意に高いことが明らかになった(1006.
これと同様に、別の研究では、COVID-19で死亡した患者では、入院時および入院期間中、フェリチン値が高いことが明らかになっている。これらの患者では、入院16日目以降の血清フェリチン値の中央値が検出限界値を超えており、フェリチン値がノンストップで上昇していることが示唆された8。また、Chenらは99人の患者の臨床的特徴を分析しており、そのうち63人の患者の血清フェリチン値は正常範囲を大きく上回っていた9。
死因がSARS-CoV-2感染であった12人の患者の剖検でもフェリチン値の上昇が認められた10。重症COVID-19患者69人の末梢血を分析したところ、非重症患者と比較してフェリチン値が上昇していることが明らかになった。
したがって、血清フェリチン値はCOVID-1911の重症度と密接に関連していると結論づけられた。最後に、重症COVID-19患者の臨床検査所見は、重症で命に関わる疾患と関連しているフェリチンを含む炎症性マーカーの上昇を伴うサイトカインストームと一致するデータを示した12。
フェリチンレベルを減少させる可能性のある戦略は、鉄キレート剤による治療かもしれない。デフェロキサミンは、臨床的にFDAによって承認された非毒性の鉄キレート剤であり、ベータ-サラセミアや鉄過負荷13を含む他の疾患の長期的な鉄キレーション療法に有効であるので、良い候補かもしれない。
彼らは血清フェリチンレベル14,15を変更することが示されているように食事の鉄を減少させる操作も考慮する必要がある。したがって、我々は、これは特に糖尿病3-5などの上昇したフェリチンレベルと呪う病的疾患を持つ個人で、COVID-19の増悪を減らすことができるかもしれないという仮説を立てた。
高フェリチン血症症候群の一部としてのCOVID-19:鉄欠乏療法の役割
COVID-19 as part of the hyperferritinemic syndromes: the role of iron depletion therapy
link.springer.com/article/10.1007%2Fs12026-020-09145-5
要旨
SARS-CoV-2感染症は、無症状の患者から生命を脅かすような状態に至るまでのプロテスタン性の臨床像を特徴とする。重症のCOVID-19患者は、しばしば重篤な肺病変を呈し、好中球減少症、リンパ球減少症、およびIL-6の顕著な上昇レベルを発現する。COVID-19が高フェリチン血症のスペクトラムの一部であるという考えにつながる高フェリチン血症に伴う過剰なサイトカイン放出がある。実際、フェリチンの非常に高いレベルは、血食細胞性リンパ組織球症、マクロファージ活性化症候群、成人発症スティル病、破局的抗リン脂質症候群および敗血症性ショックを含む他の疾患で発生する可能性がある。数多くの研究で、フェリチンの免疫調節効果と死亡率および持続的な炎症過程との関連が実証されている。遊離鉄の高レベルは組織に有害であり、特に線維化につながる酸化還元損傷を介して有害である。鉄キレーションは、鉄過多の治療の柱を表している。さらに、鉄キレーションは、抗ウイルスおよび抗線維化活性を有することが証明された。ここでは、SARS-CoV-2感染時のフェリチンと鉄の病原性の役割を分析し、COVID-19パンデミックにおける新たな治療法として鉄欠乏症治療を提案する。
背景
2020年初頭にパンデミックリスクとして浮上したSARS-CoV-2ウイルスの発生。本疾患(COVID-19)は、主に発熱、乾いた咳、倦怠感、肺炎に至る肺病変を特徴とする[1]。ほとんどの症例では軽度の行動をとるが、最大14%の症例では呼吸困難、呼吸回数30回/分以上の頻呼吸、SpO2≦93%の低酸素血症、動脈酸素分圧対吸気酸素分画比<300、および/または24~48時間以内に肺実質の50%以上を含む肺浸潤を伴う重症化の可能性がある。
これまでのところ、特定の治療法は承認されておらず、特に急性呼吸窮迫症候群(ARDS)が発生した場合に、患者の臨界期への移行率を低下させ、救命につながる薬剤が緊急に必要とされている。現在の治療戦略には、いくつかの抗ウイルス薬やクロロキンやヒドロキシクロロキンのような免疫モジュラント作用を有し、直接的な抗ウイルス作用を有する可能性のある抗リウマチ薬が含まれている。それにもかかわらず、この疾患の典型的な特徴は、初期段階ではインターロイキン(IL)-1B、IL-1RA、腫瘍壊死因子(TNF)αのレベルが著しく高く、集中治療室の患者ではIL-2、IL-10、TNF-αのレベルが高くなる、炎症性の状態であるように思われる。重症患者は通常、好中球増加、リンパ球減少、およびIL-6の著しく高いレベルを示す [3]。
実際、このような過剰なサイトカイン放出(別名「サイトカインストーム」)[4、5]は、SARS-CoVおよびMERS-CoV肺炎ですでに報告されており、ウイルス負荷がIL-6濃度のピークおよびその後の放射線学的重症度に先行していることが示唆されている[6]。SARS-CoV-2はアンジオテンシン変換酵素II(ACE2)を介して肺や腸の細胞に入り込み感染する [7、8]。この過剰なサイトカイン放出の結果、活性化された好中球が肺胞腔内に浸潤し、間質性線維症につながる線維増殖期を迎える [9, 10]。コロナウイルス感染症におけるサイトカイン放出症候群(CRS)には、2つの主要なメカニズムによって例証されている異なる原因がある。最初のものは、IFNに拮抗するSARS-CoVおよびMERS-CoVの両方が保有する複数の構造的および非構造的タンパク質によって媒介される遅延型インターフェロン(IFN)応答である。遅延IFNシグナルは、免疫応答をさらにオーケストレーションし、アポトーシスにT細胞を感作する。もう一つは、ヒトおよび動物実験の両方で実証されているように、ヒトコロナウイルス感染後の肺における炎症性単球-マクロファージおよび好中球の蓄積である。これらの細胞は、致死的な転帰に関連するサイトカインやケモカインの主要な供給源である[11]。このような背景から、標的型抗サイトカイン治療が提案され、いくつかのケースでは成功している。トシリズマブは、IL-6受容体に対するモノクローナル抗体である。トシリズマブは、キメラ抗原受容体設計T細胞(CAR-T)免疫療法の結果として、関節リウマチ(RA)患者およびCRSを治療するために開発された [12, 13]。重症COVID-19患者に対するトシリズマブの有効性を検証する試験が中国とイタリアで実施されている[14] (www.aifa.gov.it/sperimentazioni-cliniche-COVID-19)。
それにもかかわらず、炎症亢進の同定と治療は必須である。Mehtaら[15]は最近、COVID-19は、二次性食血細胞性リンパ組織球症(sHLH)[16]のようなCRSによって特徴づけられるより広範な高炎症性症候群の一部であり得ることを提案している。注目すべきことに、これらの症候群の基本的な特徴の1つは、高フェリチン血症である。フェリチン値が有意に高い場合、COVID-19の重症度と予後の悪化を特徴づけ、死亡率がウイルス性の高炎症によるものである可能性を示唆している。循環フェリチンレベルは急性期の反応を反映しているだけでなく、むしろ炎症において重要な役割を果たしている可能性がある [18]。高フェリチン血症の中等度レベルが、全身性エリテマトーデス、RA、多発性硬化症および抗リン脂質症候群(APS)[19,20,21,22]を含む自己免疫疾患と関連している場合、典型的には、マクロファージ活性化症候群(MAS)、成人発症スティル病(AOSD)、破局的APS(cAPS)および敗血症性ショックを含む他の状態では、高レベルが記載されている。重症患者では、高フェリチン血症は基礎疾患の重症度と関連している [23,24,25];さらに、非常に高いフェリチンレベル(> 3000 ng/ml)は、用量反応的に死亡率の増加と関連しているようである [26]。フェリチンのこのような高レベルのフェリチンは、集中治療室(ICU)での敗血症、敗血症性ショックおよびその他の状態の患者と血球貪食性リンパ組織球症の患者を区別するようであり、フェリチンのカットオフ値である9083μg/Lは高い感度と特異性を示し、ICUの設定での血球貪食性リンパ組織球症の診断の改善に寄与する可能性がある[27]。ウイルス感染症、特にチクングンヤがAOSDとcAPSの基礎となる高フェリチン血症症候群を誘発することができたことは非常に興味をそそられる[28]。
高フェリチン血症症候群
高フェリチン血症症候群の病態は非常に複雑で可変的である。遺伝的変異、感染症、基礎疾患および免疫抑制は、これらの状態において明確な役割を果たし得、高フェリチン血症(>500μg/L)および高炎症という特異的なエピローグにつながる[29]。Schulertら[30]によると、高フェリチン血症症候群の発症に役割を果たしうる多数の主役にもかかわらず、それらは高フェリチン血症を誘発する少なくとも2つのメカニズムに収束する可能性がある:Tリンパ球の過剰活性化およびIFN-γの過剰活性化[30]。それにもかかわらず、マクロファージを活性化して炎症性サイトカインの分泌を増加させるフェリチンのH鎖の直接的な役割については、最近のエビデンスが記述している[31]。
高炎症と高フェリチン血症の両方を呈するいくつかの疾患は、高フェリチン血症症候群という共通の傘の下にグループ化されている(表1)。これらには、MAS、HLHの二次的な形態、AOSD、cAPSおよび敗血症性ショックが含まれる[32、33]。これらの病態は、異なる病因と臨床症状によって特徴づけられるが、フェリチンの病的に上昇したレベルが炎症過程を維持している可能性が高い[32]。フェリチンの高レベルは、上述の高フェリチン血症症候群に特異的なものではない。実際、フェリチンのレベルが2000μg/Lまで上昇することは、肝障害や感染症などの他の状態で見られることがあり、第一はHLHの可能性のある臨床症状の一つであるが、第二は二次的なHLHの最も一般的な引き金となる[34]。それにもかかわらず、上述したように、非常に高いレベルであれば、ICUではHLHの患者を識別することができる[26, 35]。
表1 高フェリチン血症症候群のスペクトル:疑われる病因、臨床的特徴、治療戦略 原文参照
血球貪食性リンパ組織球症
HLH(血球貪食症候群とも呼ばれる-この用語は現在では時代遅れであるにもかかわらず[36])は、まれではあるが生命を脅かす可能性のある異常な高フェリチン血症である[29]。レトロスペクティブな分析では、臨床発症から30日間の死亡率は、若年患者では35%(45/129)、60歳以上の患者では58%(44/76)であった[37]。成人では、HLHの臨床的特徴には、発熱、発疹、肝脾腫、リンパ節腫大、潜在的な出血性疾患、神経症状の程度の変化を伴うか否かにかかわらず敗血症様症候群、および予期せぬ急速な多臓器不全への進行が含まれている[38]。高フェリチン血症、肝機能障害、細胞減少、高トリグリセリド血症、低フィブリノゲン血症、Dダイマーおよび乳酸脱水素酵素の上昇が頻繁に観察される[29]。興味深いことに、単一施設の大規模な症例シリーズでは、フェリチンの非常に高いレベル(>50,000μg/L)が30日死亡率と相関しており[39]、治療によるフェリチンレベルの低下は重要な予後予測値を持つ可能性がある[16]。
2019年のHLH勧告で報告されているように、MAS-HLHを含む一次性および二次性HLHは、共通の終末経路を持つが、異なる病原性の根を持つ[36]。原発型または家族性型(FHLH)は、より早い年齢で発症し、より侵攻的になる傾向がある。これは、様々な遺伝子変異(PRF1、UNC13-4、STX11、STXBP2など)に起因しており、それによって炎症性リンパ球の調節障害が起こり[40、41]、および/またはT細胞傷害性リンパ球(CTL)およびナチュラルキラー細胞(NK)の細胞傷害性活性が低下する;脱顆粒およびマクロファージの制御、または細胞のアポトーシスが障害される可能性がある[42、43]。細胞毒性の欠乏は、リンパ球の持続的な抗原曝露につながり、様々な炎症性サイトカイン、特にIFN-γの過剰産生を誘発し、その結果、CRSおよびマクロファージの制御不能な活性化を引き起こす可能性がある[44]。
二次型(sHLH)は様々な条件で起こりうるが、中でもウイルス感染が最も頻度が高い。その他の感染症としては、細菌性感染症 [45]、寄生虫性感染症および真菌性感染症 [46, 47] がある。他の原因として考えられるのは、全身性の自己炎症および自己免疫疾患が続く固形または血液の悪性腫瘍であり(成人のHLH症例の40~70%)、その場合、sHLHは通常MAS-HLHと命名される[48]。いくつかのリウマチ性疾患は、そのような全身性エリテマトーデス、RA、シェーグレン症候群、血管炎、最も頻繁に、全身性若年性特発性関節炎(sJIA)、AOSDとcAPSとして、MAS-HLHを開発することができる。最後に、例えば臓器移植後などに起こる後天性免疫不全の状態は、sHLHの引き金となることはまれである [36]。
ウイルス感染はsHLHの主な原因であり、特にエプスタインバーウイルス(EBV)[49]、単純ヘルペスウイルス(HSV)およびサイトメガロウイルス(CMV)である。これらのウイルス剤がどのようにしてHLHを誘発するのかは完全には解明されていない。これらのウイルスはCTLおよびNK細胞の細胞毒性を抑制し、HLHの発症を促進すると考えられている。EBV潜伏膜タンパク質-1(LMP1)は、リンパ球活性化分子(SLAM)-関連タンパク質(SAP)を転写的に阻害することができ、あからさまなT細胞活性化とサイトカイン産生、特にIFN-γの産生をもたらする[50]。鳥インフルエンザの原因菌であるH5N1由来の組換えヘマグルチニン(H5)は、ペルフォリンの発現を抑制し、試験管内試験(in vitro)でヒトCTLの細胞毒性を低下させる可能性がある。同時に、IFN-γの過剰産生を促進し、マクロファージの過剰活性化、サイトカインストーム、血球貪食に重要な役割を果たす可能性がある。さらに、H1N1インフルエンザはNK細胞に直接感染し、NK細胞の数と活性を低下させた [52]。
それにもかかわらず、これらの機序でHLHの発症を常に説明することはできない。感染の引き金は必ずしも特定されず、細胞傷害性CTLの欠陥が存在しない場合もある[44]。他のHLHモデルでは、CTLやNK活性ではなく、自然免疫経路が直接、IL-1ファミリーのサイトカイン、特にIL-18とIL-33の産生に重要な役割を果たしているようである[44]。HLH-94プロトコルに基づくHLHの主な治療法であるコルチコステロイド、シクロスポリンA、髄腔内療法、エトポシド [36, 54] の他に、成人患者のHLHの病因は非常に異質であるため、特定の引き金の治療が不可欠である。場合によっては、SLEを含む自己免疫疾患の場合のように、引き金となる薬剤を特異的に治療することで、HLH-94プロトコルを必要とせずにHLH症候群をコントロールできることもある。ルキソリチニブ(JAK1/2阻害薬;ClinicalTrials.gov識別子NCT02400463、NCT03795909、NCT03533790)、アナキンラ(IL-1遮断薬;NCT02780583)、アレムツズマブ(NCT02472054)およびエマパルマブ(抗IFN-gモノクローナル抗体;NCT01818492)を組み込んだ代替治療アプローチを試験する興味深い試験が推進されてきた。
破局性抗リン脂質症候群
cAPSは、1週間以内に少なくとも3つの臓器が関与する微小血栓症を特徴とし、APSの稀ではあるが重篤な合併症である。APS患者の約1%に発症し、死亡率は36%に達する。Agmon-Levinらは、原発性APS患者に高フェリチン血症が認められ、cAPSと相関があることを示した(cAPS患者の71%に高フェリチン血症が認められた)[56]。同様に、SLE患者では、高フェリチン血症は血小板減少、ループス抗凝固薬および抗カルジオリピン抗体の存在と相関しており、二次性APSの初期マーカーである可能性が示唆されている[57]。COVID-19で発生する新たな合併症は、凝固障害と血栓性微小血管症の可能性である[58]。最近、COVID-19と抗リン脂質抗体が複数の梗塞を合併した症例が報告されている。興味深いことに、この患者でもフェリチンの著明な上昇が認められ、感染症、凝固症、高フェリチン血症の関連性が強調されている[59]。
敗血症性ショック
敗血症と敗血症性ショックのための最後の国際的なコンセンサス定義によると、敗血症は、感染に対する宿主の反応が異常になることによって引き起こされる、Sequential Sepsis-related Organ Failure Assessmentのスコアが2点以上増加することによって表される、生命を脅かす臓器機能不全と定義されている[60]。敗血症は生命を脅かす病態であり、時に高フェリチン血症などのHLHと共通する特徴を持つことがある。2019年のHLHガイドラインで報告されているように、HLHの適切な形態よりも少ないが著しい炎症を特徴とする敗血症の形態は、HLHの診断基準を満たさない可能性があり、「MAS様」と記載されている。このため、敗血症の確定例または推定例のある重症患者では、HLHの診断を除外することが重要である[61]。HSV 1 型、ヒトヘルペスウイルス 6、EBV、CMV、アデノウイルスによる DNA 貧血では、小児の重症敗血症において高フェリチン血症と有害な転帰との関連が証明されていることを強調しておくことが重要である [62]。SARS-CoV-2の複製とフェリチン血症との間に相関関係があるかどうかは、非常に興味深いところである。
炎症とウイルス性疾患におけるフェリチン
フェリチンは、この金属元素の潜在的な毒性からタンパク質、脂質、DNAを保護しながら、鉄分子を結合し、重要な細胞プロセスのために生物学的に利用可能な形で鉄を貯蔵する役割を果たしている。フェリチンは2つのアイソフォームで構成されていることが示されている。フェリチンは、H型とL型の2つのアイソフォームで構成されており、異なる濃縮度を持つフェリチンは、いくつかの組織で発現しており[63]、炎症時には異なる意味合いを持っている[31]。フェリチンとそのサブユニットである軽鎖フェリチン(LHC)と重鎖フェリチン(HFC)は、生体内試験(in vivo)および試験管内試験(in vitro)で免疫調節効果を示した[64]。例えば、HFCは試験管内試験(in vitro)でケモカイン受容体4(CXCR4)と直接結合し、CXCR2を介したERK1/2活性化に影響を与える[65]。炎症に対する正常な全身反応の一部としてフェリチンの血中値が急性に上昇するにもかかわらず、高フェリチン血症反応は敗血症患者の死亡率の有意な増加と関連している[24, 27]。フェリチンレベルの主な調節因子は鉄の利用可能性であるが、 フェリチンの合成は、IL-1βやIL-6などの異なる炎症性 サイトカインによっても調節される可能性がある[66, 67]。実際、血清フェリチンは、ヘプシジンの産生がプロ炎症性サイトカイン、 特にIL-6によって刺激されるヘプシジンのアップレギュレーションの影響を受けている[68]。Ten Kateらは、AOSD患者では、フェリチンに結合した鉄の量が、健常対照およびヘモクロマトーシス患者のサンプルと比較して有意に少ないことを発見した;しかしながら、循環鉄の総量は対照よりもはるかに多いことを示した。このことは、活動性AOSDでは、フェリチンの迅速な合成がフェリチンへの鉄の取り込み速度を上回っていることを示唆している[69]。
フェリチンとは別に、ウイルス感染症で考慮すべきもう一つの側面は、鉄過負荷の影響である。鉄は、ウイルスの複製およびミトコンドリア機能、ATP生成、DNA/RNA合成および修復、ならびに細胞生存/フェロプトーシスを含む他のプロセスに必要である[70]。例えば、ウイルス複製のためのSARS-CoVのヘリカーゼの活性は、ATP加水分解を必要とし、それは順番に鉄の存在を必要とする[71]。鉄分過多はHBVおよびHCVウイルス感染症の予後を悪化させ、鉄分補給は貧血状態とは無関係にHIV患者の死亡率を増加させる[72,73,74,75]。SARS-CoV-2はウイルスの複製とその機能に鉄を必要としている可能性が高く、これがCOVID-19での鉄キレーション療法の根拠の一つである[76]。
さらに、鉄は、IFN-γ/STAT1シグナル伝達経路に対するTリンパ球感受性の調節に影響を及ぼす。実際、IFN-γ/STAT1経路に対するT細胞の難治性は、主にIFN-γR鎖、特にIFN-γR2のダウンレギュレーションに起因していることが知られている。ヒトTリンパ球では、IFN-γR2の内部化は、IFN-γとは独立して、主にクラスリン被覆ピットで起こる[77]。鉄は細胞質の鉄調節タンパク質1(IRP1)およびIRP2に結合し、これによりフェリチンなどのタンパク質の発現が調節される。さらに、一酸化窒素(NO)と鉄をつなぐ制御ループが存在し、一方でNOはIRP活性を調節し[78, 79]、他方で鉄は誘導性NO合成酵素の転写を阻害する。鉄はIFN-γR2の内部化を決定するのに重要であり、したがってヒトT細胞におけるIFN-γ/STAT1経路の活性化を防ぐことが示された。一般的な鉄キレート剤であるデフェロキサミン(DFO)は、細胞周期に入った活性化されたT細胞においてのみ、細胞表面上のIFN-γR2発現のアップレギュレーションを誘導することができる[80]。これは、2つの方法でSARS-CoV-2感染に対するT細胞応答を回復させることができる。(a) Tリンパ球のIFN-γに対する感受性を回復させること、(b) クラスリンを介したSARS-CoV-2細胞の侵入を阻害する可能性があること、である[81]。
それにもかかわらず、MeradとMartin [82]は最近、SARS-CoV-2感染時の単球とマクロファージの潜在的な病理学的役割を取り上げている。マクロファージの侵入は急性炎症を促進し、機械換気下の患者で観察される線維性合併症に関与しているようである。NLRP3 inflammasomeの活性化は感染中に起こる可能性が高く、ウイルスアクセサリータンパク質はpro-IL-1β遺伝子の転写とタンパク質の成熟の強力な活性化因子である。微小血管血栓症の関与は、組織因子の産生と外因性凝固経路の活性化を介して活性化単球によって媒介されるようである。活性化された内皮細胞による好中球のリクルートおよび好中球細胞外トラップ(NET)の放出は、順番に、凝固過程をさらに増幅させる。MAS-HLHのそれに似たこのような大規模な炎症過程を早期に認識することは診断上の課題であり、フェリチン以外の特定のバイオマーカーの潜在的な診断アプリケーションに焦点を当てた研究が行われている[83]。可溶性(s)CD163は、M2マクロファージ細胞膜上に位置するヘモグロビン-ハプトグロビン複合体のCD163受容体の可溶性対応体であり、M2マクロファージの活性化と分化のマーカーを表している。CD163の脱落および迅速な放出は、TNF-α、酸化ストレスおよびリポ多糖などのいくつかの炎症性刺激によって誘導され、いくつかの研究では、敗血症または機械的換気を必要とする急性呼吸窮迫症候群のような、全身的な炎症性負荷が高いことを特徴とする状態でのsCD163の予後的役割が実証されている[84, 85]。さらに、説得力のある証拠は、MAS-HLHのバイオマーカーとしてのsCD163の潜在的な役割を支持している[86、87]。この設定では、骨髄吸引液中の活性化または貪食細胞性CD163+マクロファージは、sJIAを持つ被験者のMAS-HLH発症に先行していることが示された。注意すべきことは、血清sCD163レベルは、特に疾患発症時に、MAS-HLHなしで活動的な疾患を持つ患者と比較して、MAS-HLHに関連するsJIAを持つ患者で有意に増加している、治療に応答して臨床経過をたどると、注意すべきことは、sCD125とフェリチン[89]のような全身の炎症性負荷の他のサロゲートバイオマーカーと相関している。sCD163の増加はAOSD患者、特に活動性疾患群でも同様であり、敗血症患者でも同様であった[90]。興味深いことに、sCD163レベルはAOSD患者においてのみ、フェリチンの血清レベルと正の相関を示しており、これらの条件下でのフェリチン産生にマクロファージが直接関与していることを示唆している[91]。さらに、最近の研究では、MAS-HLHを有する全身性エリテマトーデス患者は、ループス腎炎、自己免疫性溶血性貧血または免疫性血小板減少症のような他の重篤な疾患症状を有する患者と比較して有意に高いsCD163レベルを示し、sCD163レベルは疾患活動性と相関していることが実証された[91]。sCD163のレベルは、原発性HLHとMAS-HLHを鑑別するためのマーカーとしても機能する。最近の研究では、sCD163の血清レベルは、pHLHの患者と比較して、MAS-HLHの患者で顕著に増加したので、MAS-HLHのマクロファージ活性化はpHLHよりも高いという仮説を立てている[92]。したがって、MAS-HLHでは、大規模なIL-1βの放出は、劇的なIL-6、IL-18およびフェリチン産生と、その結果、マクロファージから広がるsCD163を伴うサイトカインストームにつながる緊密な自己分泌ループを引き金としている。確かに、大量のサイトカイン放出に関連するこの複雑な病因パターンをより深く理解することは、標的を絞った治療や患者の予後の改善につながるかもしれない[16]。
鉄欠乏症治療
上記のような鉄、炎症および感染症をリンクさせた病原性シナリオの結果として、特にCOVID-19を有する患者においてCRSおよび線維化の発症を予防するための可能な治療戦略を見出す必要性がある。MAS-HLHやAOSDなどの他の高フェリチン血症症候群の病態におけるプロ炎症性サイトカインの重要な役割の理解が進んだことにより、抗サイトカイン薬の試験的使用が行われるようになり、その結果、従来の治療に無反応であった患者において成功した症例報告が増加している[93]。IL-1の阻害(アナキンラとカナキヌマブの使用)とIL-6の阻害(主にトシリズマブによる)は、MAS-HLHとAOSDを対象としたいくつかのコホートおよび無作為化比較試験において、プラセボと比較して強い有効性が示された。RAを対象としたトシリズマブの無作為化、多施設、二重盲検、24週間、第3B相試験であるMEASUREのデータの事後分析では、トシリズマブ投与後にフェリチン、ヘプチジン、ハプトグロビンが急速に減少したことが示されている。これは、IL-6シグナル伝達がこれらの分子の産生を促す共通の刺激であるという考えと一致している[94, 95]。フェリチンに対する抗IL-6効果は、SARS-CoV-2感染症におけるトシリズマブ治療の成功報告の一部を説明することができる。
それにもかかわらず、SARS-CoV-2感染症の急性期における炎症の発症の速さは、鉄の十分な貯蔵を可能にし、病原体から鉄を奪うためにフェリチン産生の増加を誘発する可能性がある。血液中のトランスフェリンの結合能を超えると、鉄は非トランスフェリン結合鉄として血漿中に存在し、血漿中の鉄はその酸化還元活性型に変化してラボイル血漿鉄(LPI)と呼ばれるようになる [96]。LPIはフェリチンレベルと相関しており、活性酸素種(ROS)の形成に寄与し、組織の損傷とそれに続く線維化を引き起こす[97](図1)。したがって、COVID-19治療への新しいアプローチは、これらのステップを中断させることができる鉄キレーション療法に代表される。鉄キレーションは、幅広いスペクトルの疾患による鉄過負荷の治療の柱となり、現在、複数のキレート剤が登録されており、臨床現場で日常的に使用されている。実際、デフェロキサミン(DFO)は、オートファジーを誘導してリソソームでのフェリチン分解を促進するため、フェリチンに直接的な効果がある。さらに、鉄キレート療法の潜在的な抗ウイルス効果については、いくつかの研究が行われてきた。実際、鉄過負荷は、逆転写酵素活性を増加させ、感染したT細胞の生存率を低下させることで、試験管内試験(in vitro)でのHIV複製に寄与する可能性がある。DFOによる鉄キレートは、(1)酵素活性を発揮するために鉄を必要とするリボヌクレオチド還元酵素の阻害によるDNA合成の制限、(2)HIVの複製に不可欠なT細胞の増殖の阻害、(3)酸化ストレスを介したウイルスDNAおよびRNAへの直接的な毒性効果、(4)NF-kB経路の阻害などの複数のメカニズムを介して、おそらくHIV感染に有益な効果を示している[99]。これらの効果は、すべての鉄キレート剤に普遍的なものではないかもしれない。実際、DFOとデフェリプロン(DFP)はどちらもT細胞の増殖とDNA合成を阻害し、一方、ブレオマイシンはウイルスDNAに直接結合して宿主T細胞には影響を与えない[100, 101]。
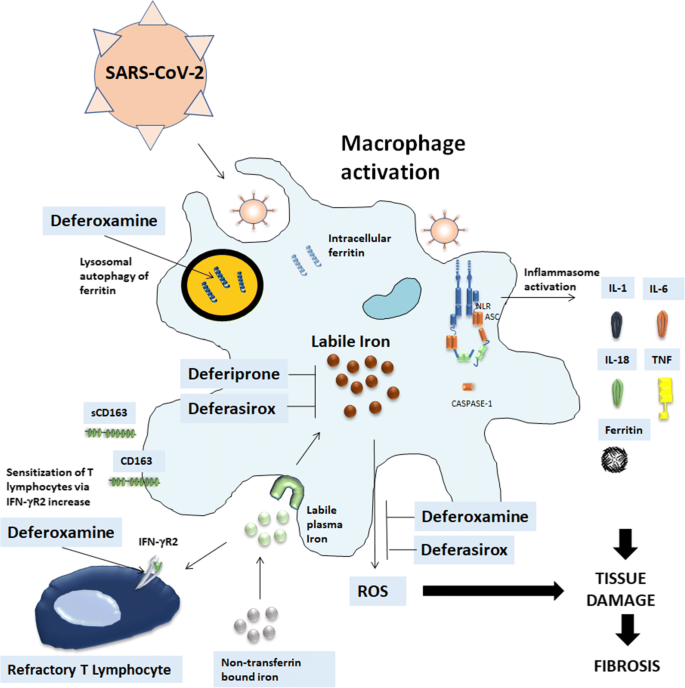
図1
SARS-CoV-2 感染症における鉄キレーション療法。SARS-CoV-2は、おそらくインフラマソームの活性化を介して、IL-6、TNF-α、IL-1β、フェリチン、およびそれに続く可能性のある肺線維性合併症のレベルの上昇によって特徴づけられるハイパー炎症を促進することができる浸潤マクロファージの刺激を導く。フェリチン産生の増加は、鉄の十分な貯蔵を可能にし、病原体から鉄を奪う。細胞内の遊離性鉄は、組織損傷および線維化をさらに促進する活性酸素種の形成に寄与する。鉄は網状内皮マクロファージに蓄積し、CD163の脱落はマクロファージ活性化のマーカーとなる。鉄キレート療法は、これらのステップを中断させることができる。(a) デフェロキサミン(DFO)は、オートファジーを誘導してリソソームでのフェリチン分解を促進するため、フェリチンに直接作用する。デフェリプロンもデフェラシロックスも、プロテアソームによるフェリチン分解の前にフェリチンから抽出される細胞質の鉄と鉄をキレートしている可能性が高い。(b) DFOは、活性化されたT細胞の細胞表面におけるIFN-γR2発現のアップレギュレーションを誘導し、SARS-CoV-2感染に対するT細胞の応答を回復させることができる。(c) DeferasiroxとDFOは、フリーラジカルの産生、マクロファージ組織浸潤を抑制し、IL-6レベルの顕著な低下を引き起こす線維化を減少させる。
潜在的な抗ウイルス効果は、HSV-1 [102]やCMVなどの他の病原体についても実証されている。より具体的には、CMVは感染細胞のサイズの増加を誘導するために鉄を必要とするため、この現象が発生する前に遊離鉄の試験管内試験(in vitro)レベルが増加することが実証されており、これは鉄キレート療法によって効果的に制限することができる[103]。また、DFOはB型肝炎ウイルス(HBV)感染に対するIFNの治療効果をさらに高めることが可能である[104]。Mateosら[105]は、ニューモシスティス・ジロベシ肺炎を発症したHIV患者の気管支肺胞液(BAL)中の遊離鉄のレベルが対照群と比較して増加したことを報告しており、鉄の潜在的な病原性の役割を示唆しているが、他の感染因子に対する鉄キレーションの効果に関するデータは少ない。同様に、トリパノソーマ・クルジ感染のマウスモデルでは、宿主細胞の鉄代謝とは無関係に、DFO治療の有益な効果が実証されている[106]。しかし、鉄キレート剤は実際に病原体から鉄の供給源として利用される可能性があることを慎重に考慮すべきである[107]。
鉄が炎症を促進する主なメカニズムの一つは、ハーバー・ワイス反応を介した遊離酸素ラジカルの産生の増加によって媒介される。例として、鉄は、クラミジア肺炎およびインフルエンザAウイルス感染後の内皮細胞による試験管内試験(in vitro)でのIL-6産生を増加させることができ、これはDFOによって効果的に制御することができる[108]。興味深いことに、IL-6および遊離酸素ラジカル産生を含む同様のプロセスが敗血症性ショックの間に起こる。したがって、鉄キレーションがNO消去[109]およびMAPキナーゼとNF-kB経路の阻害を介して敗血症性ショックのマウスモデルにおける死亡率の低下に効果的であり、最終的にはプロ炎症性サイトカインの産生の減少につながることは驚くに値しない[110]。
鉄過負荷につながる疾患の最も重篤な合併症の一つは、進行性の線維化と最終的には不可逆的な肝硬変を特徴とする肝障害である。実際、肝障害の予防は、これらの状態における鉄キレーションの主な適応である。遊離鉄レベルの低下、その結果、酸素ラジカルの低下が進行性の損傷を防ぐ主なメカニズムであるが、一部の著者は、鉄キレート剤が独立した抗線維化効果を発揮する可能性を示唆している。この証拠は、肝臓の鉄含有量が有意に低下していない場合に肝線維化の減少を示した研究から得られている[111]。Deferasirox(DFX)およびDFOは、コンカバリンAおよびCCl4誘発性肝障害の複数のラットモデルにおいて、フリーラジカルの産生を阻害することにより、損傷および線維化を減少させることができるようである[112,113,114]が、他の研究ではこの証拠は確認されていない[115]。腎疾患における抗線維化作用は、ラットおよびマウスの腎障害モデルにおいても実証されており、酸化ストレス、マクロファージ組織浸潤、TGF-βなどの線維化促進サイトカインの産生の減少を介している[116, 117]。他の著者は、DFOがIL-6レベルの顕著な低下を誘発し、HCV感染において強力な抗線維化作用を有することを示している[114]。
結論
これらの現象がCOVID-19と共通しているかどうかは現在のところ不明である。しかしながら、鉄キレーションがフリーラジカルおよびCOVID-19の後期に強く関与する炎症性サイトカイン産生に影響を与え、最終的には急性肺障害およびARDSにつながると推測するのが妥当である。COVID-19患者でしばしば必要とされる機械的換気は、炎症性因子の放出、アポトーシス、内皮機能障害および凝固系の活性化と関連していることが知られている肺損傷を誘発する可能性があることが示されている[118, 119]。興味深いことに、DFOを用いたプレコンディショニングは、マウスモデルにおいてマクロファージとミトコンドリアにおける活性酸素の形成を効果的に減少させることにより、機械的換気に対する肺保護効果を示した[120]。
さらに、予備的なデータでは、重症COVID-19患者の一部には、急性期以降も肺障害が残存している可能性があることが示唆されているようである [121]。これらのデータが確認された場合、鉄キレート剤の抗線維化作用は、慎重に検討するに値する追加の作用機序である可能性がある。COVID-19患者を対象としたデフェロキサミンの有効性と安全性を評価した試験はこれまでに2件(NCT04333550、NCT04361032)あり、標準治療との比較、またはトシリズマブとの比較が行われており、結果が待ち望まれている。
結論として、上述の考察は、COVID-19が高フェリチン血症症候群のスペクトルの一部である可能性があるという考えにつながる[122]。フェリチンの急速な合成が鉄の取り込み率を超えることで引き起こされる鉄の急性過負荷の可能性と、鉄キレーション療法が炎症状態および肺で発生する線維形成に有益な効果をもたらすことは、COVID-19を有する重篤な患者の適切な設定では、鉄キレーション療法が生存率および全体的な長期転帰を改善するために考慮されうることを示唆している。

