link.springer.com/article/10.1007%2Fs00011-020-01389-z
要旨
背景
ミトコンドリア機能の低下は加齢とともに起こり、死亡率を増加させる可能性がある。本研究では、COVID-19敗血症に対するミトコンドリアの寄与、特に自然免疫機能、ウイルス複製、高炎症状態、HIF-α/サーチュイン経路の複雑な相互作用について検討した。
方法
PubMed/Medline検索の論文は、「SARS-CoV-2、COVID-19、敗血症、ミトコンドリア、加齢、免疫代謝」という用語の組み合わせでレビューされた。
検索結果
老化細胞のミトコンドリアが機能不全に陥り、COVID-19敗血症に関連した高代謝要求に追いつけなくなっている可能性があることを示す証拠がある。ミトコンドリアのタンパク質は、自然免疫を活性化するダメージ関連分子パターン(DAMP)として機能している可能性がある。正常な酸化的リン酸化経路の破綻は、HIF-α/サーチュイン経路を介して敗血症カスケードを活性化する活性酸素の増加に寄与している。ウイルスとミトコンドリアの相互作用は、複製とウイルス負荷の増加に必要である。低酸素と高炎症状態はCOVID-19敗血症に関連した死亡率の増加に寄与している。
結論
老化は敗血症の予後の悪化と関連している。敗血症の治療薬としてサーチュイン活性を調節することが浮上している。HIF-α、ミトコンドリアDNAレベル、および他のミトコンドリアDAMP分子も有用なバイオマーカーとして機能する可能性があり、調査が必要である。これらのメカニズムは、COVID-19関連敗血症に特化して研究されるべきである。新たに発見された制御機構を理解することは、新たな診断・治療ターゲットの開発につながる可能性がある。
序論
敗血症は、感染に対する宿主の反応の異常によって引き起こされる生命を脅かす臓器機能不全と定義されている [1]。抗生物質治療や敗血症のクリティカルケア管理が進歩しているにもかかわらず、罹患率と死亡率を伴う多臓器不全は依然として高い状態が続いている。このことは、現在のCOVID-19パンデミックで明らかになっている。SARS-CoV-2、コロナウイルス関連敗血症の感染は、すべての国、民族、性別、年齢層の人々に影響を与える罹患率と死亡率の壊滅的な増加をもたらしている[2]。特に影響を受けているのは、人口密度の高い地域社会や老人ホーム施設での虚弱な高齢者である。最も一般的な危険因子は、心肺疾患、糖尿病、肥満、高血圧などの複数の合併症を持つ高齢者である。今回のCOVID-19パンデミックの危機は、敗血症の病態生理に関する我々の理解がまだ不完全であることを立証しており、これらのギャップを埋めるためにさらなる研究が必要である。
COVID-19に関連する敗血症に特有の生化学的特徴は、深遠な持続性低酸素症、アシドーシス、高凝固性、および変質した好気性解糖代謝(LDHおよび乳酸アシドーシスの上昇)として顕在化した破壊的な下流効果に関連するサイトカインストームを伴う急性炎症の状態を確立している。一般的に影響を受ける臓器は、肺、腎臓、肝臓、心臓、脳、および消化管である。これは、呼吸不全を伴う低酸素症、血液透析を必要とする腎不全、トランスアミナーゼ上昇を伴う肝不全、関連する心筋症および不整脈を伴う心不全、脳症、および下痢および腸間膜虚血を伴う腸症状として発現する [3]。
この簡単なレビューでは、COVID-19病因の現在の進展と、敗血症の動態におけるミトコンドリアの可能性のある役割について論じている。過度のCOVID-19ウイルス関連敗血症と死亡は、加齢に伴うミトコンドリアの効率性と呼吸鎖機能の低下に起因する可能性がある[4, 5]。さらに、最近の証拠は、ウイルスがそのライフサイクルを維持するためにミトコンドリアを操作する可能性があることも示している。炎症、ウイルス負荷、およびその他のベースラインの危険因子の増加とともに、その結果として生じる組織の低酸素化は、重症敗血症のリスクの増加に寄与している。この関連性は、急速に発症し、重症化し、抵抗性のある高齢者のバイタルオルガン不全に伴う死亡率の高さを説明していると考えられる。剖検では、特に肺炎球、心筋細胞、内皮細胞、肝細胞、腎細胞、神経細胞などの代謝量やミトコンドリア量の多い細胞において、臓器線維化を伴う高炎症状態が確認されている。
健康におけるミトコンドリア機能
ミトコンドリアは、成熟赤血球を除くすべての細胞に存在する重要な小器官であり、酸化的リン酸化、ATP合成、細胞内カルシウム調節、体温調節、活性酸素の調節、脂質代謝、鉄代謝、オートファジー、アポトーシス、およびコルチゾール、エストロゲン、トリヨードサイロニンなどの特定のホルモンの調節を含む主要な細胞機能を有する [5,6,7]。ミトコンドリアが最適化されていない老化組織や免疫細胞の割合が高い高齢者は特に感受性が高く、敗血症に伴う突然の代謝亢進に追いつくことができない可能性がある [8]。さらにミトコンドリアにも役割があり、細胞の老化、慢性炎症(flammaging)、自然免疫の低下、年齢に依存した幹細胞活性の低下と関連している[9](図1)。
図1
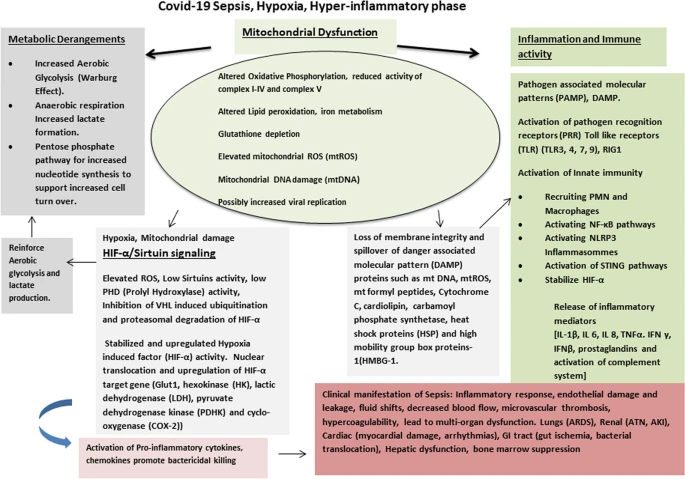
図1
COVID-19ウイルスと可能性のあるミトコンドリア動態、免疫代謝における複雑な相互作用 ミトコンドリアの酸化的リン酸化は活性酸素種(ROS)の蓄積をもたらす。好気性解糖、ペントースリン酸経路、乳酸形成の活性化があり、活性酸素はさらに増加する。これにより、ミトコンドリアの膜損傷とDAMP因子の放出が起こる。また、ミトコンドリアは、コロナウイルスのライフサイクルにおいて重要な二重膜小胞の形成に寄与する可能性がある。自然免疫は、下流の高炎症性カスケードとともに活性化される。HIF-α/サーチュイン経路もまた、細胞低酸素および活性酸素によって活性化され、好気性解糖および自然免疫系を活性化する。これらの因子はすべて多臓器不全を引き起こし、敗血症関連死亡率を増加させる。TLR Toll様受容体はPRR、RIG 1レチノイン酸誘導性は細胞質PRR、ILインターロイキン、TNF腫瘍壊死因子、IFNインターフェロン、NLRP3 NOD様受容体はPRR
人は加齢とともに細胞に複製エラーやミトコンドリアDNA(mtDNA)の突然変異が蓄積する[8]。過酸化水素(H2O2)、スーパーオキシド、ヒドロキシルラジカルなどの活性酸素種(ROS)による細胞への酸化的損傷も加齢とともに蓄積する。ミトコンドリアの呼吸鎖はこれらの活性酸素の発生源であり、これらの活性酸素は、例えばスーパーオキシドジスムターゼなどのスカベンジャー機能を持つ酵素で消去する仕組みも持っている。ミトコンドリア機能不全は、毒性暴露や慢性的な無酸素状態にも関連している[7]。高齢者では老年期細胞の割合が高いため、呼吸鎖機能の欠乏は最終的に発症し、ミトコンドリア呼吸効率の低下と関連している可能性がある[9]。
敗血症におけるミトコンドリア機能不全(図1)
敗血症は異常な病理学的状態であり、感染症と戦うための初期の急性炎症性亢進期と、回復を助けるための免疫寛容、冬眠期から構成されている。各相に特有の異なる代謝過程やリプログラミングが記述されており、2つの相の異なる多様な臨床症状に役割を果たしていると考えられている。高炎症性期は、好気性解糖(Warburg効果)の亢進によって特徴づけられる。この段階は、宿主組織がエネルギー産生を急増させ、自然免疫細胞を活性化させて病原体の殺傷能力を高め、感染の拡大を制御し、侵入してきた微生物から身を守ることを目的とした反応を起こすために起こる[5, 10, 11, 12]。後期の低炎症性の免疫寛容期は、免疫細胞における脂肪酸酸化の増加によって特徴づけられる[10,11]。SARS-CoV-2感染肺細胞株における差動遺伝子発現の最近の解析では、ミトコンドリアのサイトカイン/炎症性シグナル伝達に関与する遺伝子のアップレギュレーションと、ミトコンドリア組織、呼吸、オートファジー遺伝子のダウンレギュレーションが示されている[13]。これらの知見は、ミトコンドリアの障害が有効な免疫応答を妨げ、炎症を増加させ、COVID-19関連敗血症の重症度を高めるという証拠を提供している。
代謝および免疫上の影響、およびDAMPの放出(図1)
初期敗血症の主な特徴は低酸素症である。細胞レベルでは、低酸素は電子輸送鎖の複合体I-IVおよび複合体Vの活性低下による正常な酸化性リン酸化とミトコンドリア機能の変化を伴う好気性(解糖性)呼吸への転換と相関している。酸素消費量の増加、ATP産生量の増加、高血糖がある。さらに、細胞のターンオーバーの増加により、ヌクレオチドへの要求が増加し、ペントースリン酸経路の増加がある[4, 5, 10, 12]。
これらの変化した代謝経路は、過剰な細胞質およびミトコンドリアの活性酸素の産生につながる。老化したミトコンドリアによる活性酸素の除去に失敗すると、ミトコンドリアの構造、脂質膜、生合成ユニットが障害され、損傷し、無傷のミトコンドリアDNAが変化する可能性がある[5, 14]。
活性酸素を悪化させ、上昇を引き起こす他のミトコンドリア因子には、脂質過酸化の変化、グルタチオン(GSH)の枯渇、および鉄代謝の変化が含まれる[15]。ミトコンドリア膜の完全性の喪失は、全身循環でmtDNAを放出する可能性がある。これらの循環するmtDNA断片は、危険関連分子パターン(DAMP)としても知られており、微生物によって放出され、免疫細胞上の病原体認識受容体(PRR)によって同定される病原体関連分子パターン(PAMP)と類似している。
中平らは、200人の患者を対象としたプロスペクティブ研究で、無細胞、血漿中mtDNAレベルの上昇とICU関連死亡率の増加との関連を初めて示した。彼らは、敗血症やその他の炎症状態で見られる炎症反応を伝播させるDAMPであり、ICU関連死亡率の予測バイオマーカーであることを示唆している[16]。
ミトコンドリアの異常に関連する他のDAMPタンパク質には、mtROS、mtホルミルペプチド、シトクロムC、カルジオリピン、カルバモイルリン酸合成酵素、ヒートショックプロテイン(HSP)、および高可動性群ボックスタンパク質-1(HMBG-1)が含まれる(図1)[5, 6, 17, 18](図1)。
これらの内因性のDAMP分子は、老化老化して破壊されたミトコンドリアから得られる内因性のDAMP分子であり、ウイルス粒子から得られるPAMP分子と同様に自然免疫系を活性化させることができる。PRR(Toll様受容体ファミリー)の活性化は、好中球、マクロファージ、樹状細胞、およびナチュラルキラー細胞からなる免疫細胞の活性化をもたらす。
活性化された自然免疫は、プロスタグランジン、炎症性サイトカイン、ケモカイン、インターロイキンなどのシグナル分子の産生につながる遺伝子の転写を開始し、さらに補体系を活性化して炎症性カスケードを誘発する [16, 19]。
DAMPはまた、(B細胞の核因子カッパ-軽鎖エンハンサー)NF-Kβ経路、炎症ソムスの活性化、および(インターフェロン遺伝子の刺激因子)STING経路を活性化することも示されている。これらのメカニズムは、心血管系、免疫系、代謝系、内分泌系、凝固系、体温調節系の各経路を含む組織機能障害を悪化させ、複合的に悪化させ、全身的な影響や多臓器不全の原因となっている[5,16,19,20,21]。
敗血症患者および敗血症動物モデルからのこれまでの報告では、無傷のmtDNAの減少および循環遊離mtDNAフラグメントの増加が示されている[16, 18]。
敗血症におけるHIF-α/サーチュインの役割(図1)
最近の研究では、HIF-α(hypoxia-inducible factor-Iα)-Sirtuins(silent mating type information regulator)シグナル伝達経路による急性炎症と敗血症カスケードのメカニズムが強調されている[10, 11, 22]。組織の低酸素は敗血症の中心的な特徴である。組織低酸素状態では、HIF-αシグナル伝達のアップレギュレーションが存在する。これらのシグナル伝達分子および転写因子は、敗血症の炎症亢進期(HIF-α上昇/低サーチュイン)および第二の免疫寛容性回復期(サーチュイン上昇/低HIF-α)の両方に関与している。
サーチュイン(1~7型)は、抗炎症性および抗酸化性で知られる高度に保存されたタンパク質ファミリーである。これらのタンパク質は、(ニコチンアミド・アデニン・ジヌクレオチド)NAD+依存性クラスIIIヒストン脱アセチラーゼ(HDAC)酵素ファミリーに属し、細胞質、ミトコンドリア、核などの細胞のさまざまなコンパートメントに異なるタイプが存在している。サーチュインは細胞の(NAD+)エネルギーセンサーであり、恒常性の守護者と考えられている。サーチュイン3,4,5型はミトコンドリアに局在している[10,11,22](図1)。NAD+レベルは加齢とともに低下し、糖尿病、高血圧、喫煙者、肥満の患者など、慢性的にストレスを受けている細胞ではさらに低下し、サーチュインの活性が低下する。これらの患者群は、現在COVID-19パンデミックで観察されているように、重度の敗血症と死亡のリスクが最も高い。SARS-CoV-2感染マウス、ヒト肺細胞株、および剖検標本を用いた最近の実験では、NAD+の消費に関与するポリ(ADP)リボースポリメラーゼ(PARP)遺伝子ファミリーのアップレギュレーションが示唆されている。これらのPARP遺伝子の過剰発現は、NAD+を消費し、NAD+のレベルを低下させ、これらの細胞で過剰発現している[24]。NAD+の活性低下と枯渇は、サーチュインの保護機能をさらに減衰させる[23、24]。
低酸素細胞は転写因子HIFαをアップレギュレートする [12, 20]。一般的に、HIFαの安定化およびその高炎症活性の増加は、細胞内サーチュインの保護作用の喪失または機能不全に伴って起こる。これは、敗血症の動物モデルの超炎症段階で実証されている[10,11,12,22]。
関連する組織低酸素を伴うこの初期の超炎症段階では、PRR(Toll様受容体)は、サイトカインストームを引き起こすNF-ĸB、NLRP3 inflammasommesの過剰活性化、マイトジェン活性化プロテインキナーゼ(MAPK)、およびラパマイシンの哺乳類標的(mTOR)などの多くの増殖経路をアップレギュレートする[23,24,25]。
増殖活性の増加および細胞のターンオーバーの増加とともに、それに伴う好気性解糖経路および機能不全の酸化的リン酸化は、サーチュインのダウンレギュレーションをもたらす活性酸素を放出する。サーチュインの活性が低いこと自体が、非効率的なクリアランスによる活性酸素の上昇を促進する。活性酸素の上昇はまた、プロリルヒドロキシラーゼ(PHD)をダウンレギュレートする。これらの酵素はHIF-αを不活性化する。これらの因子はHIF-αを安定化し、プロテアソーム分解のためのE3リガーゼ(フォン・ヒッペルリンダウ因子、VHL)によるユビキチン化を防ぐ。安定化されたHIF-αは核に転座し、解糖と炎症性サイトカインの産生をアップレギュレートする主要遺伝子を活性化し、高炎症状態の悪循環を維持する [10,11,12,22]。主なHIF-αターゲットには、グルコーストランスポーター1(Glut1)、ヘキソキナーゼ(HK)、乳酸脱水素酵素(LDH)、ピルビン酸脱水素酵素キナーゼ(PDHK)、およびシクロオキシゲナーゼ(COX-2)が含まれる。これらの酵素は、酸化的なリン酸化から代謝をシフトさせ、解糖シグネチャを促進し、代謝経路をさらに促進する[10,11,12,22](図1)。
敗血症の第二段階では、酸素消費量の減少、ミトコンドリア呼吸の再開、ATP産生の再開など、低代謝状態が続く。敗血症に関連した死亡率の大部分はこの段階で起こる。この低代謝状態は、細胞機能のゆっくりとした回復を可能にする抗炎症性の冬眠状態に細胞が入ることを可能にする。しかし、このような細胞保護的で免疫抑制的な状態は、感染症の治癒にも有害である可能性がある[10]。さらに、二次的な院内感染がこの段階で発生する可能性がある。例えば、クロストリジウム・ディフィシル感染症、および二次的な細菌感染症やカンジダ感染症などである。多くの場合、これらの感染は多剤耐性であり、低炎症相の設定では敗血症に関連したモラルを高める[10]。生化学的には、この段階はHIF-αの活性低下とサーチュイン活性の上昇と関連している。脱アセチラーゼ機能を持つサーチュインは、NF-ĸB、HIF-α、高可動性群ボックス蛋白質-1(HMBG-1)、およびその他のDAMP分子を不活性化し、全体的なサイトカイン負荷を減少させる[23,24,25]。サーチュインはまた、この段階でグルコースから脂肪酸酸化への切り替えを調整する。このための分子メカニズムは不明のままである [10, 11, 14, 22, 25]。細胞の回復に伴い、ミトコンドリアの生合成が開始され、PARγ coactivator-1α(PGC-1α)、転写因子A for mitochondria(TFAM)、核呼吸因子(NRF-1)などのミトコンドリア生合成のマーカーのアップレギュレーションが見られる [9, 15, 23]。
ミトコンドリア局在化は、SARS-CoV-2複製に必要とされる可能性がある。
SARS-COV-2ウイルスは、細胞侵入にACE2受容体を使用し、スパイク蛋白質(S蛋白質)のプライミングにTMPRSS2を使用する[26]。異なる民族集団におけるACE 2受容体の変異が、このウイルスの病原性と感染性に役割を果たしている可能性がある [27]。
SARS-CoV-2のタンパク質とヒトタンパク質の相互作用は、複製、タンパク質輸送、ユビキチン化などの複数の複雑な生物学的プロセスをつなぐことが観察されている。SARS-CoVウイルスは、ミトコンドリア外膜受容体と相互作用するオープンリーディングフレーム(ORF)と呼ばれる付属タンパク質を産生する。一つの特定の相互作用は、ORF-9とミトコンドリア抗ウイルスシグナル伝達系(MAVS、TOMM.70)との相互作用に関係している[28]。MAVSはミトコンドリア輸入受容体であり、細胞質ウイルス認識受容体としても機能する。ORFは、MAVS活性を抑制することが示されており、したがって、初期の宿主細胞、自然免疫、インターフェロン、および抗ウイルス応答を制限する[28,29,30]。同様の他のSARS-CoV-2ウイルス非構造タンパク質(NSP4、NSP5、NSP7、およびNSP8)とヒトのミトコンドリア膜およびマトリックス機能との相互作用が実証されている。これらのウイルスタンパク質は、RNA処理、電子輸送およびミトコンドリアシグナル伝達、およびトラフィッキングタンパク質と関連していることが実証されている。このように、ウイルスとミトコンドリアの相互作用は、ミトコンドリアの膜の完全性と機能的側面の両方を破壊する可能性がある[28]。
細胞質内に入ると、SARS-CoV-2ウイルスは一本鎖RNA(ss RNA)から中間の二本鎖RNA(ds RNA)を経て複製しなければならない。これは、Toll様受容体、RIG-1受容体、およびミトコンドリア抗ウイルスシグナル伝達系(MAVS)によるそれらの認識を介してウイルスを拮抗させることを素因としており、したがって、先に述べたように、自然免疫の活性化をもたらす。SARS-CoV-2ウイルスは、dsRNAの周りに二重膜小胞(DMV)を形成することで、この検出を回避している。ウイルスはその複製と伝播にミトコンドリアや小胞体などの細胞内小器官を必要とする[31, 32]。
計算機械学習モデルに基づいて、SARS-CoV-2 RNAゲノムとすべてのサブゲノムRNAが宿主のミトコンドリアマトリックスとヌクレオラスに濃縮されていることが最近Wuらによって実証された[33]。また、コロナウイルスゲノムからのオープンリーディングフレーム(ORF)がミトコンドリアに存在することが確認されている。これらのモデルに基づいて、コロナウイルスが細胞防御を回避して衰えずに複製するためには、二重膜小胞の形成にミトコンドリアの滞留が必要であると予測された。言い換えれば、ウイルスは単にミトコンドリアを乗っ取り、その機械を自分自身の複製と生存のために使用することができる[33]。そうすることで、ウイルスはミトコンドリアのDNAを損傷し、ミトコンドリアのDNAが細胞質に漏出し、自然免疫の活性化の引き金となる可能性がある[34]。これまでに、高ミトコンドリアウイルスRNAとミトコンドリア機能の完全性の低下との関連がHIV RNAウイルスで実証されている[35]。この仮説は、SARS-CoV-2を用いてさらに検証する必要がある。これらの知見は、SARS-CoV-2 RNAウイルスによるミトコンドリアの関与が、実際にはウイルス性と感染性を助けている可能性を示唆している。ウイルスがミトコンドリアに侵入して機能障害を引き起こすメカニズムは、まだ研究されていない。
COVID-19と高齢者の高死亡率に関連するバイオマーカー、図2
いくつかのウイルスおよび宿主関連バイオマーカーが、COVID-19敗血症における感染の重症度を決定する上で重要であると考えられるようになってきている。主な問題は、これらのバイオマーカーが一貫した性能を発揮するかどうか、試験や複製が一様に行えるかどうか、そして現在利用可能なデータをプールすることで検証できるかどうかである。
図2
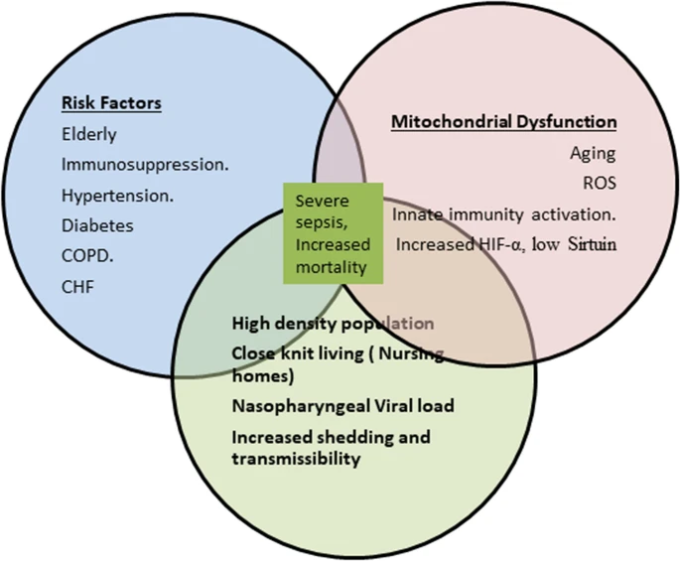
図2
ベン図:COVID-19パンデミックにおける重症敗血症と死亡率上昇のリスクを描いたもの。の組み合わせ。(a)緊密なコミュニティや人口密度の高い地域に住む合併症を持つ高齢者、(b)関連するミトコンドリア機能不全や糖尿病、高血圧、肺疾患、自然免疫の活性化などの危険因子、(c)ウイルス負荷の増加、これらすべてが相まって、重度の敗血症と高死亡率のリスクを伴うウイルスの脱落と感染性の増加のためのパーフェクト・ストームを作り出した。
現在のSARS-CoV-2ウイルスが米国および世界的にパンデミックし続けているため、高い定量的ウイルス負荷が疫学上の重要な因子として浮上しており、またCOVID-19感染症の臨床経過を予測するためにも重要である[36,37,38,39,40]。現在のCOVID-19パンデミックでの重要な観察は、敗血症を伴う高齢者患者の高い死亡率を示している。
量的ウイルス負荷の増加は、高いレベルのウイルス複製を表し、感染性のサロゲートマーカーである。この関連は、高齢者におけるその相互作用とミトコンドリア機能不全に関連している可能性がある。これまでの研究では、インフルエンザ、サイ、およびその他の呼吸器ウイルスに感染した患者のウイルス負荷と入院の長期化に伴う重症度の増加との関連を確認することが試みられている[36、37、40]。
第 2 群コロナウイルス(HCoV-OC43 および HCoV-HKU1)などの呼吸器ウイルスおよび SARS 関連コロナウイルスを検出するためのリアルタイム PCR アッセイ(rRT-PCR)は、入院時に鼻咽頭サンプルで測定された高ウイルス負荷が成人患者の入院期間の長期化と関連していることを実証している [36, 40]。
SARS-COV-2ウイルスに関する最近の文献と同様に、COVID-19パンデミックでは、鼻咽頭スワブからの高ウイルス負荷値が依然として重要な因子であり、ウイルス脱落期間の延長および重篤な臨床転帰と関連していることが示唆されている[38, 39]。
ウイルス負荷の上昇は、無症候性の患者と症候性の患者の両方で認められる可能性がある。無症状の保菌者は集団の中でサイレント・スプレッダーである可能性があるため、これは依然として懸念材料となっている。ウイルス負荷は、スーパースプレッダーを検出するための有用なマーカーであり、また、症状のある患者の重症度や予後を判定するためにも有用であると考えられる[38, 39]。
定量的なウイルス負荷を早期に決定することは、回復期血漿、抗ウイルス剤、コルチコステロイドの早期導入など、他の治療上の利点もある。COVID-19感染から回復したドナーからの回復期血漿は、COVID-19症例の重症度を低下させ、臨床転帰を改善する可能性がある[41、42]。
したがって、ウイルス負荷の持続的な上昇は、先に述べたような高炎症期の長期化を伴う代謝およびミトコンドリア機能障害の悪化と関連している可能性がある。この仮説は、世界中のCOVID-19患者で観察される臨床的なばらつき、すなわち、高齢者の死亡率の高さ、特に老人ホームのような緊密な集団では、高ウイルス負荷に伴うミトコンドリア機能障害が示唆されていることを説明することができるかもしれない(図2)。この仮説を確認するためには、COVID-19ウイルス負荷に関する更なる疫学的研究とアッセイが必要である。
その他の宿主関連バイオマーカーとしては、D-ダイマー、IL-6濃度、リンパ球減少症などがあり、現在のパンデミックから世界中の様々な集団で一貫して観察され、相関している。これらは炎症の重症化を示唆しており、予後不良や死亡率の増加と相関している[41, 43, 44]。
今後の方向性:ミトコンドリア関連の診断バイオマーカーと治療ターゲットの可能性
敗血症の重症度に対するバイオマーカーとしてのHIF-αの役割は不明であり、研究が続けられている [10,11,12,25]。敗血症はダイナミックなプロセスであり、HIF-αのレベルは疾患の段階や異なる病原体によって変化する可能性がある[12]。以前の研究では、敗血症患者ではHIF-1 RNA発現が上昇していることが示されたが、生存者と非生存者では差は認められなかった[45]。潜在的なバイオマーカーとしてHIF-αを調査する臨床試験(NCT02163473)が完了しており、結果が待たれている。
mt DNAおよび他のmt DAMP分子のレベルも有用なバイオマーカーとして機能する可能性があり、SARS-CoV-2感染の文脈で調査する必要がある [6, 9, 16, 17, 19]。前述したように、mtDNAは敗血症で見られる炎症反応を伝播させるDAMPであり、ICU関連死亡率の予測バイオマーカーとして機能する可能性がある[16]。げっ歯類モデルにおける最近のエビデンスでは、mtDNAを臭化ヘキサジメトリン(HDMBr)などの核酸捕捉剤で中和すると、多臓器機能障害の重症度が低下し、生存率が向上する可能性があることが実証されている [46]。これらのメカニズムは、COVID-19関連敗血症に特化して研究されるべきである。
活性化剤および阻害剤を用いてサーチュイン活性レベルを調節し、ミトコンドリアのバイオエネルギーを調整することは、敗血症の実験モデルにおいて治療薬として浮上している[10, 11]。しかし、有益な効果を得るためには、敗血症の特定の段階で正確にタイミングを合わせなければならない。敗血症の炎症亢進期にNAD+レベルを上昇させ、その結果サーチュインのレベルを上昇させることができる薬剤は、サイトカインストームを減衰させ、生存率を向上させるために使用される可能性がある。以前、げっ歯類を用いた実験では、NAD+ブースターがNF-ĸB活性を減衰させ、内皮機能を改善し、微小血管の炎症を減少させることが実証されている[47]。レスベラトロール(天然に存在するスチルベノイド)、ニコチンアミドリボシド(NR)やニコチンアミドモノヌクレオチド(NMN)などのNAD+前駆体、CD38、CD157、NAMPTなどのNAD+レベルを調節する酵素などのサーチュイン活性化剤はすべて実験で研究され、サーチュイン活性を増加させることが実証されている[11、47、48]。
同様に、第二次低炎症期にインヒビター(EX-527)でサーチュイン活性を低下させると、冬眠している内皮および血管系を反転させ、好中球機能を改善し、破片を除去し、効果的な酸化性リン酸化およびミトコンドリア生合成を補助し、治癒を促進し、生存率を改善する可能性がある[11、49]。
老化、肥満、および炎症と呼ばれるメタボリックシンドロームに関連した慢性炎症を標的とすることができる分子には、最近の開発および関心がある。これらの分子は、ジロプロテクターとしてもラベル付けされている[23]。これらの分子のいくつかは、敗血症の予防および補助療法に好ましい効果をもたらす可能性があり、簡単に言及する価値がある。これらは経験的な治療法であり、COVID-19敗血症に対するヒト試験では確認されていないことを強調すべきである。哺乳類のtarget of rapamycin(mTOR)シグナル伝達経路は、抗原提示、活性化、サイトカイン産生などの免疫機能を制御することが実証されている。阻害剤であるラパマイシンでmTOR活性を調節すると、高齢者の免疫機能が改善することが示されている[23]。同様に、メトホルミンは、抗血糖作用やメタボリックシンドロームにおける良好な効果に加えて、AMPK活性を低下させ、mTOR経路を阻害する。メトホルミンは、代謝異常を改善し、ミトコンドリア機能を改善し、サイトカイン産生を減少させる可能性がある[23、48]。赤ブドウやブルーベリーに含まれる天然由来のポリフェノールであるレスベラトロールなどのNAD+ブースターは、サーチュイン活性を活性化してNF-ĸB活性を減衰させ、内皮機能を改善し、微小血管の炎症を減少させる[47]。
サーカディアンリズムの乱れ、および関連する腸管の不衛生を伴う腸管透過性の亢進は敗血症で発生する。抗炎症活性と抗酸化活性を持つ分子であるメラトニンとプロバイオティクスは、敗血症におけるミトコンドリアのバイオエネルギーと生存率を改善する可能性がある[50]。
結論
COVID-19は、パンデミックに対する高齢化人口の脆弱性と、新たな疾患の世界的な課題に光を当てている。治療法やワクチンの開発には、これらの新興ウイルスの病態や分子機構を包括的かつ深く理解する必要がある。ミトコンドリア機能不全は、このウイルスに関連した過剰な死亡率の原因として探求され続けている。我々は、ウイルスとミトコンドリアの相互作用が、ウイルスの複製、自然免疫の調節、炎症亢進状態、および末端臓器の損傷に役割を果たしている可能性のあるいくつかのメカニズムを強調してきた。
新たなエビデンスに基づいて、ミトコンドリアの機能不全が一次事象である可能性が示唆されている。ORFやNSPタンパク質などのSARS-CoV-2ウイルスタンパク質と宿主細胞のミトコンドリアタンパク質との相互作用は、膜の完全性の喪失につながり、また、ミトコンドリアの生体エネルギーの機能障害を引き起こす。その後に続くものは、mt DNAの放出、上昇した活性酸素;MAVS関連保護、抗ウイルス性インターフェロン産生、NF-Kβ経路の活性化、flammasommes、およびハイパー炎症状態とサイトカインストームを伴う自然免疫の損失との二次的な損傷イベントである。
ミトコンドリアのメカニズムが説明できるかもしれないし、併存疾患を持つ高齢者の特定の感受性に反映されている。これらの患者は機能不全、老化細胞、およびミトコンドリアを有している。ウイルスの関与は、結果として過剰な死亡率を伴う克服が困難なアンバランスを引き起こす可能性がある。生理的に健康な若年者の感染者は、健康な組織と適切なミトコンドリアの動態により、この破壊を免れることができるかもしれない。さらに、ミトコンドリアがウイルスの複製(二重膜小胞の形成)や増殖に必要であることも明らかになっていた。
結論として、COVID-19敗血症に伴う多臓器不全の病因におけるミトコンドリア機能不全の関連性については、引き続き活発な調査が行われている。多くの疑問が未解明のままである。現在のCOVID-19パンデミックは、敗血症に関する知識のギャップを明らかにし、科学界の活性化につながることを期待している。COVID-19敗血症のメカニズムを解明するためには、さらなる研究が緊急に必要である。これらの制御機構を理解することは、将来のパンデミックの危機に対処するための新しい診断法や治療法の開発につながるかもしれない。
