Circulating SARS-CoV-2 Vaccine Antigen Detected in the Plasma of mRNA-1273
academic.oup.com/cid/advance-article/doi/10.1093/cid/ciab465/6279075
Alana F. 緒方 †1,2,3 Chi-An Cheng†1,2,3 Michaël Desjardins†3,4,5 Yasmeen Senussi1, Amy
C. Sherman3,4, Megan Powell4, Lewis Novack4, Salena Von4, Xiaofang Li6, Lindsey R. Baden*3,4,6, David R. Walt*1,2,3
1Department of Pathology, Brigham and Women’s Hospital, Boston, MA, USA
2米国マサチューセッツ州ボストン、ハーバード大学、ワイス生物学的誘導工学研究所
3ハーバード大学医学部(米国マサチューセッツ州ボストン
4米国マサチューセッツ州ボストン、ブリガム・アンド・ウィメンズ病院、感染症部門
5モントリオール大学病院感染症科 カナダ、QC
6 米国マサチューセッツ州ボストン、ブリガム&ウィメンズ病院、臨床研究センター
共著者
David R. Walt
概要
mRNA-1273ワクチンを2回接種した13人の参加者から採取した経時的な血漿サンプルで,SARS-CoV-2タンパク質を測定した。参加者13名のうち11名は,最初のワクチン接種後1日目にして,検出可能なレベルのSARS-CoV-2タンパク質を示した。検出可能な SARS-CoV-2 タンパク質のクリアランスは,IgG および IgA の産生と相関していた。
キーワード
COVID-19,mRNAワクチン,SARS-CoV-2抗原,免疫反応.スパイク
序論
コロナウイルス感染症2019(COVID-19)のメッセンジャーRNA(mRNA)ワクチンは、米国で広く展開されており、感染や重症化に対する防御を誘導する効果が高い1。2020年12月、米国食品医薬品局は、mRNA-1273ワクチン(ModernaTX社)に、100μgを28日間隔で2回投与するという緊急使用許可(EUA)を与えた。 mRNA-1273は、重症急性呼吸器症候群コロナウイルス(SARS-CoV-2)のスパイク抗原をコードしており、膜貫通型のアンカーとS1-S2切断部位を持つ2。mRNA-1273ワクチンを接種したヒトでは、スパイクタンパク質に対する結合抗体および中和抗体が誘発されたというデータがあり、スパイクタンパク質が産生され、免疫反応が誘発されたと推測されている2-5。しかし、これらの研究では、mRNA-1273ワクチンから翻訳によってスパイクタンパク質が直接産生されたことを示す重要なデータが得られておらず、ワクチンのメカニズムを完全に理解することができなかった。
今回、我々は、mRNA-1273ワクチンを接種した参加者の血漿中に、循環するSARS-CoV-2タンパク質が存在することを示す証拠を得た。Brigham and Women’s Hospitalの医療従事者13名を対象としたmRNA-1273ワクチンの抗原および血清学的データを報告する。SARS-CoV-2抗原スパイク(S1-S2ユニット),S1,ヌクレオカプシド,およびSARS-CoV-2スパイク,S1,受容体結合ドメイン(RBD),ヌクレオカプシドに対する抗体IgG,IgA,IgMの検出には,既述6,7のように超高感度単一分子アレイ(Simoa)アッセイを用いた。Simoaアッセイは検出限界が非常に低いため,ワクチン接種後の初期段階で抗原および抗体の産生を検出し,両ワクチンの注射期間中のレベルの変化を定量化することができる。
材料と方法
2020年12月から 2021年3月にかけて、SARS-CoV-2感染の既往歴がない18歳以上の医療従事者13名を対象に、Brigham and Women’s Hospitalで前向きパイロット試験を実施した。試験デザインの詳細はSupplementary Materialsで報告されている。SARS-CoV-2抗原と抗体は、(Methods, Figure S1, Table S2-S4)に記載されているように、単一分子アレイアッセイを用いて測定した。
結果
1回目の注射から 1~29日後、2回目の注射から 1~28日後の10~13の時点で、13名の参加者から血漿を採取した。性別のバランスは均等で,年齢の中央値は24歳,さまざまな人種や民族の参加者が含まれていた(補足表S1)。COVID-19の既往感染を報告した参加者はいなかった。
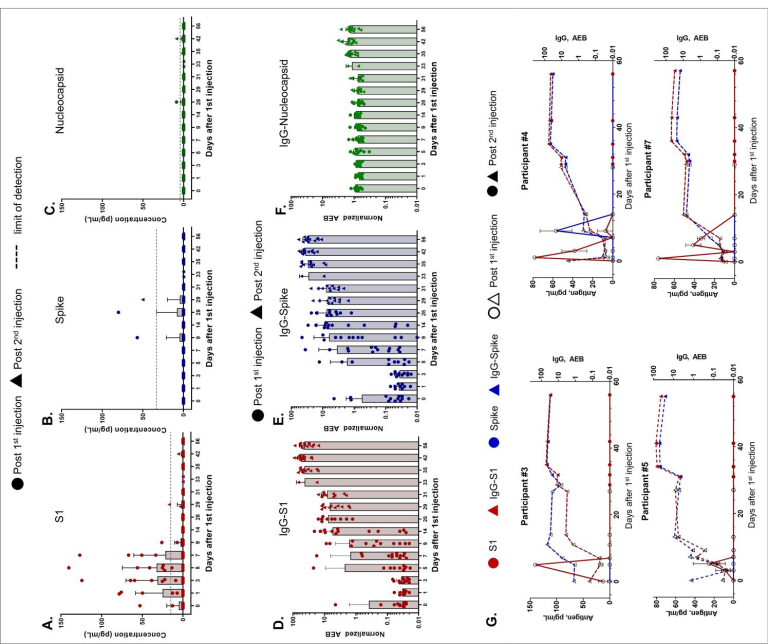
SARS-CoV-2抗原および抗体の時間的プロファイリングは、以前に説明したようにSimoaアッセイを用いて行い6,7,各参加者の抗原産生と免疫反応をモニターするために15のマーカーのデータを提供した(補足図S2~S14)。スパイク、S1,ヌクレオカプシドのSimoa抗原測定法は、パンデミック前の健常者、パンデミック前の呼吸器感染症患者、COVID-19陰性患者、COVID-19陽性患者の血漿で検証されている7。ここでは、mRNAの翻訳を調べるために抗原S1とスパイクを測定し、ヌクレオカプシド抗原は陰性コントロールとして使用した(図1A、B、C、補足表S5)。mRNA-1273 ワクチンは,初回 100 μg 投与後,11 名の被験者の血漿中に検出可能なレベルの S1 抗原を生成し,13 名中 3 名の被験者の血漿中にスパイク抗原が検出された。ヌクレオカプシド抗原は、予想通り、2回の接種後、すべての参加者で検出されないか、バックグラウンドレベルであった。
S1抗原は、ワクチン接種後1日目という早い段階で検出され、1回目の注射から平均5日後にピークレベルが検出された(図1A)。S1の平均ピーク値は68 pg/mL ±21 pg/mLであった。すべての被験者のS1は減少し、14日目には検出されなくなった。13人中12人は、予想通り,0日目には抗原が検出されなかった。しかし,1名は0日目にS1が検出されたが,これは他のヒトコロナウイルスとの交差反応によるものか,ワクチン接種時に無症状で感染していたためと考えられる。スパイクタンパク質は、13人中3人が初回注射から平均15日後に検出された。スパイクのピークレベルの平均は 62 pg/mL ± 13 pg/mL であった。2回目のワクチン接種後、S1やスパイクは検出されず、両抗原とも56日目まで検出されない状態が続いた。1名(参加者#8)については、2回目の注射から 1日後の29日目にスパイクが検出され、2日後には検出されなくなった。
血漿中の抗体IgG、IgA、IgMは、スパイク、S1,RBD、ヌクレオカプシドに対して測定された。0日目に測定した抗体レベルは、各参加者のベースラインレベルを表しており、全員がCOVID-19感染の報告がなかった。13名の参加者全員において、予想通り、スパイクとS1,RBDに対するIgGレベルは初回注射後に上昇したが、ヌクレオカプシドに対するIgGは経時的に変化しなかった(図1D、E、F;各参加者のデータは補足図S2-S14に示す)。IgAは初期の中和活性に関与しており、したがって、潜在的に短命なIgA反応を標的とすることは極めて重要である8。我々のSimoaアッセイでは、初回注射後にスパイク、S1,RBDに対するIgAの増加が検出された(補足図S2-S15)。9人の参加者(参加者#3,#4,#5,#7など。
9人の参加者(#3,#4,#5,#7,図1G)は、初回ワクチン接種後14日目までに、S1とスパイクに対するIgGレベルが測定可能であった。4人の参加者(参加者#1,#6,#10,#13,補足図S2,S7,S11,S14)は、IgG-S1およびIgG-スパイク反応の遅れを示し、最初の注射から 28日目まで増加しなかった。それにもかかわらず、すべての参加者は、2回目の注射の後、IgG-S1のさらなる上昇を示した。
考察
本研究では、11名の参加者が1回目の注射後に血漿中にS1抗原を検出したが、すべての参加者においてヌクレオカプシド濃度は有意ではなく、検出されたS1は自然感染ではなくワクチン接種に由来するものであることが確認された。S1の存在は、コード化されたmRNA-1273スパイクタンパク質の性質によるものと考えられる。このスパイクタンパク質には、切断可能なS1-S2部位があり、スパイク三量体からS1を放出することができる2。我々は、S1タンパク質の放出は、ほ乳類細胞のプロテアーゼや循環するプロテアーゼを介した切断に起因すると仮定した。S1は1日から5日の間に増加していることから、ワクチン接種後すぐにmRNAの翻訳が始まっていると考えられる。興味深いことに、S1が産生されてから平均8日後にスパイクタンパクが13人中3人に出現している。完全なスパイクタンパクのSimoa抗原測定法は、検出のためにS1とS2の両方のサブユニットに抗体が結合する必要があるように設計されており、その結果、切断されたスパイクタンパクは検出されない。さらに、ワクチン接種を受けた被験者の血漿中のスパイクタンパク濃度は、我々のアッセイの検出限界以下である可能性もある。我々は、ワクチン接種の数日後に起こるであろうT細胞の活性化によって引き起こされる細胞性免疫反応が、スパイクタンパクを提示している細胞を直接殺すことにつながり、血流中にスパイクがさらに放出されるという仮説を立てた9。遊離したS1が放出され、その後、無傷のスパイクタンパク質が検出されるメカニズムはまだ不明であり、さらなる研究が必要である。
さらに、抗原の結果を裏付けるために、大規模な試験2-5,10-12で行われた血清学的研究と一致する対応する抗体データを提示する。Simoa社の血清学的検査法は、ワクチン接種後の早い段階で抗体の産生を確認するのに十分な感度を持ち、各参加者の抗体動態を高解像度でプロファイリングすることができる。S1,スパイク、RBDに対するIgGおよびIgAは、すべての参加者においてS1生成後に増加した。ヌクレオカプシドに対するIgGおよびIgAの有意な増加は見られず、ヌクレオカプシドのmRNAを含まないワクチンに特異的な免疫反応であることが確認された。すべての参加者において、S1およびスパイクに対するIgGの増加は、2回目の注射によるS1またはスパイクタンパク質の減少に直接対応していた。抗体レベルと抗原レベルの間に見られた逆相関は、SARS-CoV-2自然感染を調査した過去の研究と一致しており、血漿中の抗原レベルが高い重症のCOVID-19患者は、抗体の産生時に抗原クリアランスを示した7。当グループのSimoa抗原測定法では、抗原-抗体の免疫複合体は検出できない。S1タンパク質はほとんどの参加者に存在するが、血清学的データによると、一部の参加者は14日目までに抗体レベルの初期増強を示し、28日目まで増強を示さない人もいる。このような抗体の動態の違いは、以前の無症候性感染により早期に抗体が産生されたことで説明できるが、これは最近、血清反応陽性の参加者で実証されている10。本研究では、ベースラインのIgGスパイクレベルが高い2名の参加者(参加者番号3,4)が、14日目までにIgGスパイクレベルの上昇を示す他のすべての参加者と比較して観察された。
今回の研究の限界は、サンプルサイズが小さいことと、健康な若年成人を登録したことによる潜在的なバイアスであり、これは一般集団を代表するものではない可能性がある。また、今後の研究では、中和抗体による抗原産生の動態を調べる必要がある。とはいえ、mRNA-1273ワクチンによるスパイクおよびS1タンパク質の産生が全身で検出されたという証拠は重要であり、これまでのワクチン研究では報告されていない。この発見の臨床的な関連性は不明であり、さらに検討されるべきである。これらのデータは、初回ワクチン接種後のS1抗原の産生は1日目までに検出され、注射部位と関連する局所リンパ節を超えて存在することを示している。また、ワクチン接種後5日目にはIgGとIgAの免疫反応が検出され、スパイクとS1抗原の全身循環でのクリアランスと関連している。
著者の貢献
概念構築。DRW, AFO, LRB, MD
調査 調査: AFO, CC, MD
サンプル/データ取得 AFO、CC、MD、YS、ACS、MP、LN、XL、SV
資金獲得 DRW, LRB
監修:DRW、LRB DRW, LRB
執筆-原案 AFO, CC, DRW
執筆-レビューと編集 MD, ACS, LRB
謝辞
技術面でサポートしてくださったJonathan Krauss氏、John Alexander Kupelian氏、サンプル採取や研究管理で協力してくださったJulia Klopfer氏に感謝する。
資金調達
本研究の資金は,Barbara and Amos HostetterおよびChleck Foundationからの寛大な寄付によるものである。本研究の一部は,ビル・アンド・メリンダ・ゲイツ財団(no.INV-017380)の支援を受けている。ワクチン開発に関する以下の研究助成金からの支援に感謝する。NIH/NIAID,Welcome Trust,IAVI.
利害の衝突
デイビッド・R・ウォルトは、超高感度デジタル免疫測定プラットフォームを開発している会社であるクアンテリックス社の取締役であり、株式を保有している。ウォルト博士は、Simoa技術のインベントリーであり、同社の創設者であり、同社の取締役を務めている。Walt博士の利害関係は、Brigham and Women’s HospitalおよびPartners HealthCareの利益相反ポリシーに基づいて審査され、管理されている。本書に掲載されている抗SARS-CoV-2 Simoaアッセイは,Brigham and Women’s HospitalがQuanterix Corporationにライセンス供与したものである。A.F.O.は、NIH Post Doctoral Training Grantからの資金提供と、投稿作品以外では、Quanterix社にライセンスされたSARS-CoV-2抗体アッセイの知的財産について、Brigham and Women’s Hospitalからのロイヤリティ支払いを報告している。L.R.B.は、NIH/NIAID、Welcome Trust、IAVIからの研究助成金を報告しており、NIAIDのワクチン開発を含む様々なプログラムのSMCに参加しているが、提出した研究内容とは異なる。M.D.は、モントリオール大学病院センター(CHUM)およびCHUM財団からの助成金を報告しているが、提出した研究とは異なる。
図1 mRNA-1273ワクチン接種後のSARS-CoV-2抗原および抗体レベルの時間経過
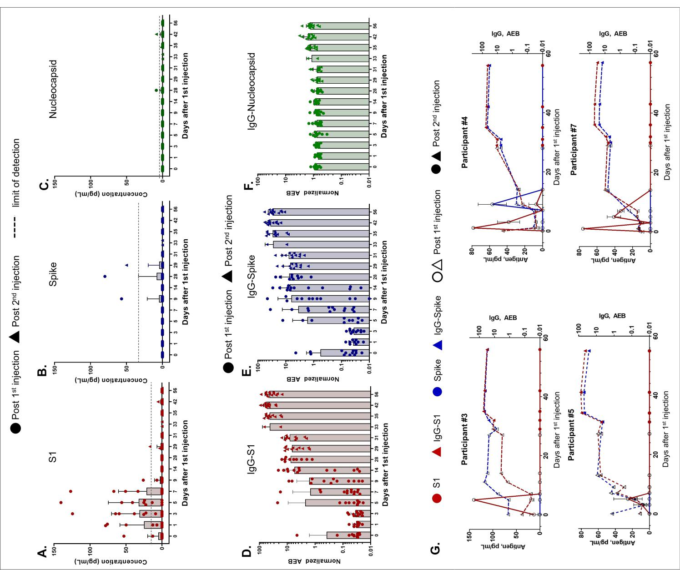
参加者13名のデータ。参加者全員が1日目と28日目にmRNA-1273の注射を受けており、丸と三角のデータポイントはそれぞれ1回目と2回目の注射後の抗原レベルを示す。(A)S1,(C)スパイク、(C)ヌクレオカプシドのレベルはSimoa社のアッセイを用いて測定した。点線はサンプルの検出限界を示し、方法に記載されている通りに算出した。D)S1,(E)スパイク、(F)ヌクレオカプシドに対するIgGレベルはSimoa社のアッセイを用いて測定し、正規化したAEB(Average Enzymes per Bead)の単位で報告した。AEB単位の検出限界は、IgG-S1では0.006,IgG-スパイクでは0.0044,IgG-ヌクレオカプシドでは0.0129であった。(A-F) 棒グラフはその日の参加者の平均濃度、エラーバーは標準偏差を表し、個々のデータポイントを重ねて表示している。各データポイントは重複した測定の平均値。(G) 個々の参加者#3,#4,#5,#7のS1,スパイク、IgG-S1,およびIgG-スパイクのデータ。中空のデータポイントと実線のデータポイントは、それぞれ1回目と2回目の注入後のレベルを示す。各データポイントは2回の測定の平均値を示し、エラーバーは標準偏差を示す。