CHAPTER 14 Niacin and hyperlipidemia
Maria C. Naranjo1,Maria C. Millan-Linares2,Sergio Montserrat-de la Paz3
キーファクト
- 本章では、高脂血症に関連する疾患におけるナイアシン(ビタミンB3)の効果に焦点を当てる。
- 食後高脂血症は一過性の正常な生理現象であり、脂肪分の多い食事を摂取したときの反応として現れる。
- 1979年にZilversmitが初めて食後高脂血症を動脈硬化現象として定義した。
- ナイアシンは、空腹時の血漿高密度リポタンパク質コレステロール値を上昇させ、空腹時の血漿トリグリセリド値、低密度リポタンパク質コレステロール値、リポタンパク質[a]値を低下させる広範囲の脂質調整薬と定義されている。
- ナイアシンが空腹時の血漿脂質およびリポタンパク質のレベルにポジティブな変化をもたらすことを支持するエビデンスが増えている
14.1 はじめに
心血管疾患(心血管疾患)は、医療水準が大幅に向上しているにもかかわらず、欧州における死亡原因の約50%を占めている(Chapman et al 2011)。主に空腹時の血漿低密度リポ蛋白コレステロール(LDL-C)の上昇によって引き起こされる高リポ蛋白血症の治療と、動脈性高血圧症の治療は、心血管疾患の主要な治療目標の一つである(Zeman er al 2015)。LDL-Cの目標は達成されているが、心血管イベントを起こすリスク(残留心血管リスク)は65%から70%の範囲で上昇したままである(Kearny et al 2008)。空腹時の血漿トリグリセリド(TG)(超低比重リポ蛋白(VLDL))アポB(100)小比重低比重リポ蛋白(LDL)粒子、リポ蛋白(a)(Lp[a])の値が高く、空腹時の血漿高密度リポ蛋白コレステロール(HDL-C)の値が低い患者では、残存心血管系リスクが特に重要となる(Chapman er al)。
ナイアシンは、長年にわたり心血管疾患の予防と治療に応用されていた(Song and FitzGerald, 2013)。よく知られている抗動脈硬化作用は、その抗脂血症作用に起因すると考えられているが、この作用は、例えばフラッシュ(特に顔や首などの皮膚の温かさ、赤み、かゆみ、ヒリヒリ感などを特徴とする)などの望ましくない副作用を伴って起こる。免疫細胞、脂肪細胞、表皮ランゲルハンス細胞、網膜色素上皮に発現しているナイアシン受容体が検出されたことにより(Martin et al 2009年)ナイアシンの副作用を最小限に抑えつつ、長所のメカニズムを明らかにすることができた。そこで本章では、ナイアシンの薬理効果に関する最新のデータを提供するとともに、食後(非絶食時)の高脂血症に関連する疾患におけるナイアシンの機能について説明する。
14.2 食後高脂血症
食後高脂血症は一過性の正常な生理現象であり、脂肪分の多い食事を摂取した後の反応として現れる。食物脂肪は、脂肪酸(FA)を輸送するCD36(cluster of differentiation 36)などの特定の輸送体を介して、あるいは受動的な拡散によって腸細胞に吸収される。TGやその他の脂質は、アポリポプロテインIVやアポリポプロテインAIとともにアポB48の助けを借りて、食後のTGリッチリポタンパク質(TRL)を腸細胞内で形成するが、その過程にはミクロソームのTGトランスファータンパク質やFAsトランスポートタンパク質が関与している。腸内分泌型TRLは、吸収された食事性脂質を水性血漿中に輸送するためのバランスをとる機能と、アポB48受容体、LDL受容体、LDL受容体関連タンパク質などの受容体や、エネルギーやいくつかの代謝経路のための非受容体依存的なメカニズムによって細胞に外因性のFAを供給する機能を持っている(Varela et al 2013; Bermudez et al 2011)。血漿中のTG濃度は、脂肪分の多い食事の3〜4時間後にピークに達し、6〜8時間後にはベースラインに戻る傾向がある。それにもかかわらず、食後の高脂血症は、TRLの反応の次元と長さが悪化し、食後のTRLとその残骸が循環中に蓄積されると、病的になる可能性がある(Chan er al)。 この意味で、食後の高脂血症のピークは2~3倍になり、食餌性脂肪の摂取から 10~12時間後までも延長される可能性がある(Cohn, 2006)。
Zilversmitは1979年に初めて食後高脂血症の概念を動脈硬化現象として定義した(Zilversmit, 1979)。この考え方は、食後のTRLがコレステロールに依存しない動脈硬化性粒子であること(Sniderman, 2000)や、食後のTG代謝異常が冠動脈疾患患者の特徴であること(Patsch et al 1992)が明らかになってから、より注目されるようになった。食後のTRLがアポB48を介してヒトのアテロームで検出されたことは、動脈形成におけるTRLの直接的な役割を示す新たな証拠となった(Proctor et al 2002)。食後のTRLの反応の大きさと長さが大きければ大きいほど、動脈壁は食後のTRLとその残骸にさらされることになる。そのため、LDL-CやHDL-C粒子のコレステロールエステルに代わってTGが存在する確率が高くなる。食後のTRLは動脈壁を伝染して内皮下に到達し、内皮脂質(特にTG)の沈着、単球の誘引、炎症マーカーの産生、酸化ストレスなどを引き起こす(Pirillo er al)。 動脈硬化を媒介とする炎症におけるTGの役割は、その直接的な血管への影響に依存するが、HDL-Cの機能性の変化とも関連している。これらの変化には、血管の炎症や免疫反応の障害に対する保護が含まれる(Patel er al)。 通常の食物摂取に対する血漿TGの非空腹時レベルに関する前向きな疫学調査には、Copenhagen City Heart study(Lindman et al 2010年)Women’s Health study(Boren et al 2014年)およびNorwegian counties study(Miller et al 2008)の3つの大規模な研究があり、いずれも以下のような情報を明らかにしている。(1)心血管疾患が確立されている集団や心血管疾患につながる複数の危険因子を持つ集団では、非空腹時の血漿中TG濃度が上昇していること、(2)前向きな集団ベースの研究で対象者を長期的に追跡調査すると、非空腹時および(あまり確実ではないが)空腹時のTGが心血管疾患イベントや死亡の発生率に関係していること(Nordestgaard et al 2007)。心血管疾患患者の多くは、脂質低下療法によってLDL-Cが目標値に達したとしても、心血管疾患イベントのリスクが高いままである(Bansal et al 2007)。このことは、非空腹時の血漿中TG濃度は、従来のLDL-Cに関連する心血管疾患リスクとは独立した予測因子であることを示唆している。
食後のTG代謝の生理学的および遺伝的制御についての理解が深まれば、新たな治療標的につながる可能性がある(Varbo er al)。 それにもかかわらず、無作為化臨床試験から得られたTG低下の効果に関する事実は、スタチンによるLDL-C低下の効果に比べてはるかに少ない(Miller et al 2011; Catapano et al 2011)。このような状況は、非空腹時および空腹時の血漿中TG濃度に特定の目標値が設定されていないため、TG低下薬の有用性に関する質の高いエビデンスがないことに起因すると考えられる。高濃度の非空腹時(Lopez et al 2008,2011,Pacheco et al 2006)および空腹時(Chan et al 2013,Berglund et al 2012,Watts et al 2013)の血漿TGを管理するためには、脂肪分の制限、カロリー制限、アルコール摂取量の制限、運動量の増加など、適切な食生活の改善が不可欠であると考えられる。現行のガイドラインでは、食後の動脈硬化性脂質プロファイルを治療のターゲットとして明記しておらず、食後高脂血症のパラメータの目標値も示していない。グローバルリスク評価に基づいて心血管疾患リスクが高い、または非常に高い人の顕著な血漿TGレベルを低下させるために、最初に推奨される薬理学的ステップは、特にメタボリックシンドロームと2型糖尿病を有する被験者におけるスタチン治療である(Ryden er al)。 スタチンはまた、入手可能なデータによると、非空腹時の血漿TGレベルを低下させる(Kolovou er al 2011)。エゼチミブは、ヒト腸管におけるアポB48の分泌を減少させることが報告されており、腸管における食後のTRLの組み立てに対するこの薬剤の直接的な効果が示唆されている(Tremblay er al)。 フィブラートに関する研究では、標準化された脂肪チャレンジに反応して、血漿TGの非絶食レベルを有意に低下させることが報告されている(Chan et al 2013,Kolovou et al 2011)。さらに、フェノフィブラートは、血漿中のアポB48と食後のTRL残基のバイオマーカーのレベルも低下させる(Chan er al)。
ペルオキシソーム増殖因子活性化受容体(PPAR)α/PPARδのデュアルアゴニスト、ジアシルグリセロールを豊富に含む食用油、ジアシルグリセロール-O-アシルトランスフェラーゼ-1,ミクロソームTGトランスファープロテインの阻害剤、アポB100,アポB48,アポリポタンパク質CIII(アポCIII)のアンチセンスオリゴヌクレオチド。とインクレチンを用いた治療法は、新しい薬理学的および非薬理学的アプローチであり、空腹時および非空腹時の血漿中TG濃度が高いことを原因とする脂質異常症の治療を最大化するために、単独または従来の治療法と組み合わせて適用することができる(Chan er al)。 , 2013). しかしながら、これらの新規薬剤は、臨床効果、作用機序、安全性、忍容性を詳細に検討するために、臨床試験を行う必要がある。
14.3 ナイアシンの効果と作用機序
ナイアシンは、一般的にニコチン酸またはビタミンB3として知られており、ビタミンB群に属する水溶性ビタミンである。このビタミンは、生体内で脂質異化作用に関与する補酵素であるニコチンアミドアデニンジヌクレオチド(NAD 1 )に変換される(Liu er al 2015)。米国の成人の推奨一日摂取量は、米国国立衛生研究所に従って16〜18mg/日の範囲であり、薬理学的に活性な高脂血症の投与量である1~3 g/日とはかけ離れている(Zeman er al 2015)。
Altschulら(1955)は、ナイアシンのコレステロール低下作用を最初に報告した。それ以来、ナイアシンは、空腹時の血漿HDL-Cレベルを上昇させ、空腹時の血漿TG、LDL-C、Lp[a]レベルを低下させる広範囲の脂質調整薬として定義されている(Vosper, 2009)。実際、ナイアシンは、心血管イベント、心血管死亡率、全死亡率を低下させることが示された最初のコレステロール低下薬であった(Canner et al 1986)。
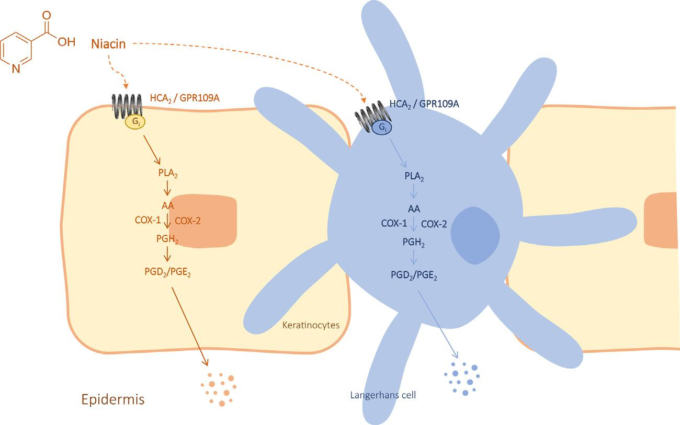
しかし、このような脂質調整作用は、おそらくプロスタグランジンD2(PGD2)やプロスタグランジンE2を介したセファレア、胃腸の不快感、そう痒、顔面紅潮などの副作用を伴っており、ナイアシン投与の主な不便さの一つとして治療のコンプライアンスを低下させている(Rhodes er al)。 フラッシングは、耐性に依存しており、TRPV1およびTRPV3と呼ばれるTRPイオンチャネルの一過性受容体電位バニロイド(TRPV)サブファミリーの様々なメンバーの活性化を構成している。これらの新しい知見は、ナイアシン療法の維持において、フラッシングをどのように緩和するかという以前の問題を再検討するものである(Cooper et al 2015a,b)。
表14.1は、無作為化対照試験から得られた血漿脂質の空腹時レベルおよび心血管イベントに対するナイアシンの主な効果の詳細を表示している(Canner et al 1986;Anonymous、1975: 36, 37,Creider et al 2012;Carlson et al 1977;Blankenhorm et al 1987;Brown et al 2001;Taylor et al 2004, 2009;Whitney et al 2005;Boden et al 2011;Landray et al 2014)。小規模な研究では、血中リポタンパク質に対するナイアシン単剤療法の複数の有益な効果、特に空腹時の血漿HDL-Cレベルの上昇が検証された(Blankenhorm et al 1987年、Brown et al 2001,Taylor et al 2004,2009,Whitney et al 2005)。また、2つの大規模な臨床試験では、血漿LDL-Cを低値に保つための集中的なスタチン療法において、高用量(最大2g)のナイアシンの単独投与(AIM-HIGH試験)(Boden et al 2011年)またはPGD2受容体-1アンタゴニストのラロピプラントとの併用投与(HPS2-THRIVE試験)(Landray et al 2014)の臨床効果と安全性が検討された。スタチン治療にナイアシンまたはナイアシン/ラロピプラントを追加しても、空腹時の血漿HDL-Cレベルの上昇など、血漿脂質プロファイルの改善にもかかわらず、追加の臨床的ベネフィットはなかった。しかし、多くの副作用が報告された(Anderson et al 2014)。このようなナイアシンとスタチンの不一致は、未解決の問題であると思われる。
ナイアシン受容体GPR109Aの発見、最近ではヒドロキシカルボン酸受容体2(HCA2)と呼ばれるようになった(Offermanns et al 2011)ことで、ナイアシンが薬理作用を発揮するメカニズムに新たな研究ラインが開かれた(Yasuda et al 2015)。空腹時と非空腹時の両方でHCA2を介したシグナル伝達ネットワークに対するスタチンの役割は、今後の研究で上述の負の相互作用を研究する上で興味深い問題となるだろう。HPS2-THRIVE試験では、少なくともHCA2とカプサイシン受容体のTRPV1イオンチャネルが介在するフラッシングを遅延させるために、ラロピプラントが採用された。ナイアシンによるHCA2の刺激は、細胞膜から内因性アラキドン酸を遊離させる細胞質ホスホリパーゼA2を含む遠位酵素のカスケードを誘発する。構成型シクロオキシゲナーゼアイソフォーム1および誘導型シクロオキシゲナーゼアイソフォーム2は、アラキドン酸を非安定な環状エンドペルオキシドであるプロスタグランジンH2(PGH2)に変換する律速段階であり、プロスタグランジンシンターゼはPGH2を異性化してPGD2に変換する(図 14.1; Montserrat-de la Paz et al, 2016).
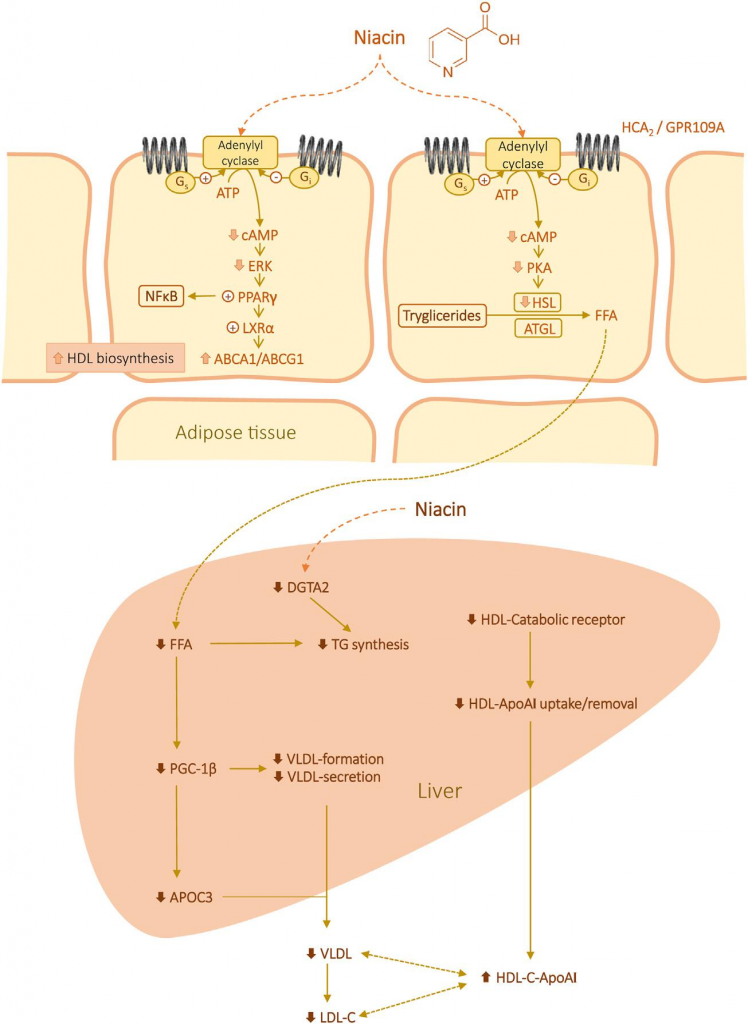
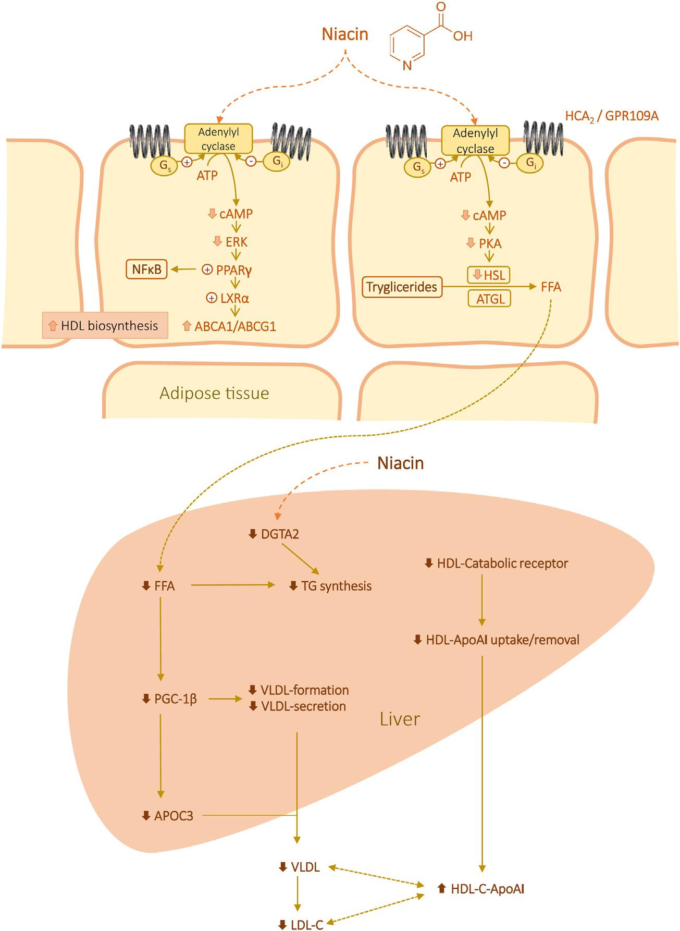
ナイアシンは、主に脂肪組織からの脂肪分解を部分的に阻害することにより、血漿TGおよびアポB100含有リポタンパク質(VLDLおよびLDL-C)のレベルを低下させ、肝臓への遊離FAのフラックスを低下させる(図14.2;Montserrat-de la Paz er al 2016)。これが達成される正確なメカニズムはまだ解明されていないが、ナイアシンに結合すると、HCA2はヘテロ三量体GプロテインのGiファミリーメンバーを介して活性化される。このステップは、アデニル酸シクラーゼに対する阻害作用と、細胞内の環状アデノシン一リン酸(cAMP)レベルの低下を引き起こす。cAMP依存性プロテインキナーゼAの活性が低下し、その標的であるホルモン感受性リパーゼ(TGの加水分解を担うプライマリリパーゼ)のリン酸化が損なわれる(Linke er al)。 肝臓への遊離FAの減少は、PPARγ coactivator-1b (PGC-1b)とapoCIIIの肝臓での発現を抑制する。PGC-1bの発現が低下すると、VLDLの形成と分泌が減少する(Barroso er al)。 アポCIIIの発現低下は、血漿中のVLDLとLDL-Cのレベルを迅速なターンオーバーによって低下させると考えられる。さらに、ナイアシンは、TG合成の最後の反応を触媒する重要な酵素であるミクロソームのジアシルグリセロールO-アシルトランスフェラーゼ2を阻害することで、肝臓の脂肪量とVLDL合成量を減少させる(Kamanna et al 2013; Le Bloc’h et al 2010)。ナイアシンは、ヒト腸細胞様Caco-2細胞において、CD36,FATP2,FATP4遺伝子の発現を腸管レベルで一過性に増加させることが報告されており、ナイアシンがFAsの取り込みを促進する可能性を支持している(Riedel et al 2014)。
HDL-Cはコレステロールの逆輸送に不可欠な役割を担っているが、その抗炎症、抗酸化、抗血栓、抗アポトーシスの機能にも注目しなければならない(Navab et al 2007)。ナイアシンは、低濃度の血漿HDL-Cを増加させる最も効果的な分子の一つである(Vosper, 2009; Vega and Grundy, 1994)。血漿VLDLレベルに対する効果とは別に、ナイアシンはHDLサブポレーション粒子を大きくする方向に変化させ、HDL-TG代謝の変調を示す(Lamon-Fava et al 2008)。この効果は、部分的にはHDLのapoAI産生の増加によるもので、作用のメカニズムはまだ議論されているが、肝臓と脂肪組織が重要な役割を果たしているようである。ナイアシンによる肝内のapoAI分泌は、マイトジェン活性化プロテインキナーゼとPPARファミリーの転写因子の活性化を介して行われることが提唱されている(van der Hoorn er al)。 さらに、ナイアシンは、表面に発現したATPシンターゼβ鎖を阻害することにより、HDL粒子の肝再吸収を減少させることが示されている(Zhang er al)。 これは、ナイアシンがapoAI分画異化率を阻害し、HDL-Cの異化を阻害する能力と一致する(Pang et al 2014)。ナイアシン(最大1 mmol/L、24時間)が、脂肪細胞におけるPPARγ、肝X受容体α、およびATP結合カセット輸送A1の発現を誘発し、細胞からのアポAIへのコレステロール流出を引き起こすことは指摘しておくべきである(Wu and Zhao, 2009)。
図14.1 上皮性ランゲルハンス細胞およびケラチノサイトにおけるHCA2の活性化によるナイアシン誘発性フラッシングのメカニズム
Montserrat-de la Paz, S., Bermudez, B., Naranjo, M.C., Lopez, S., Abia, R., Muriana, F.J.G., 2016から引用している。急性高脂血症に対するナイアシンの薬理効果。Curr. Med. Chem. 23, 2826 2835.
図14.2 ナイアシンの抗脂血症効果の潜在的メカニズム
Montserrat-de la Paz, S., Bermudez, B., Naranjo, M.C., Lopez, S., Abia, R., Muriana, F.J.G., 2016から引用している。急性高脂血症に対するナイアシンの薬理効果。Curr. Med. Chem. 23, 2826 2835.
以前の研究では、ナイアシンの即時放出型(Kingら、1994年)または長時間放出型(O’Keefeら、1995年)の応用が、空腹時の血漿TGレベルが正常または高い被験者の食後脂肪の代謝に関係することが実証された。ナイアシン(3g/日)を12週間投与し、その後、食後試験を行った。いずれの治療法も、非空腹時の血漿中TG濃度を有意に低下させた。食後の高脂血症は投与開始後すぐに増強されたのに対し、血漿総コレステロールの空腹時レベルへの影響は、様々な日数を経て明らかになったことは指摘に値する。ナイアシンと高脂血症の治療(Carlson et al、1968)。さらに、高脂肪食の1時間前に2gの徐放性ナイアシンを単回投与すると、健康な被験者の非空腹時の血漿TGレベルも低下することが最近判明した(Usman et al., 2012)。
糖尿病性脂質異常症の特徴として、血漿TGのピーク値の上昇やクリアランスの遅延により、非空腹時の血漿TG濃度が高いことが挙げられ、この状態は空腹時の血漿TG濃度が正常な糖尿病患者にも定期的に現れる(Tentolouris et al 2007)。最近の研究では、脂質異常症の糖尿病患者における残存リスクを推定するために、2型糖尿病で空腹時の血漿TG濃度が高い男性を対象に、食後の高脂血症に対するナイアシンの効果を評価した(Ooi er al 2015)。被験者は、ナイアシン徐放製剤(1~2 g/日)による12週間の治療-ment後、食後状態の血漿TGレベルが低下した。食後のTGの減少は、血漿HDL-Cの増加を反映していた。食後のTGとインスリンに対するナイアシンと有酸素運動の効果は、肥満、インスリン抵抗性、高血圧、脂質異常症など、3つ以上の心血管危険因子を持つメタボリックシンドロームの男性を対象に調査されている(Lusis er al)。 メタボリックシンドロームの人は、空腹時の血漿中TG濃度が上昇するのが普通である。驚くべきことに、6週間のナイアシン徐放製剤の投与は、TGのピーク値を18%減少させ、TGの曲線下面積を23%減少させたが、高脂肪食摂取の1時間前に実施した中強度の有酸素運動による食後のTG低下効果を軽減した。有酸素運動による非食後血漿中TG濃度の低下に対するナイアシンの緩衝作用は、脂質代謝の恒常性維持機構が破綻した場合の高脂血症の制御における薬理学的および非薬理学的アプローチの限界を強調するものである。
ナイアシンの非空腹時血漿TG濃度に対する作用を明らかにするために、複合型高脂血症患者の異なるリポタンパク質画分におけるアポB100とアポB48の動態を調べた(Lamon-Fava et al., 2008)。徐放性ナイアシン(2g/日)を12週間投与したところ、血漿TGが減少しただけでなく、空腹時と非空腹時の両方において、TRLのアポB100とアポB48の分画異化値が増加した。ApoB100とapoB48の生成率はナイアシンの影響を受けなかったことから、ナイアシンによる急性高脂血症の抑制には、食後のTRLの肝での異化が重要なメカニズムであることが示された。また、HepG2細胞を用いたin vitroの研究では、ナイアシン(以下、ナイアシンと略す)がTRLの異化を促進することが示されている。3 mmol/L、2時間)が肝細胞におけるアポBの翻訳後分解を促進することを示している(Jin et al.、1999)。とはいえ、ナイアシンが食後の脂肪代謝を調節する正確なメカニズムを理解するには、さらなる研究が必要である。
14.4 結論
食事脂肪の代謝障害の特徴である血漿TGの過大な非空腹時レベルと心血管疾患との間には進行性の関係があるため、高脂血症の制御は緊急の必要性がある。食後の高脂血症に関連する有害作用には明確な限界がない。したがって、特に脂質代謝異常を伴う疾患においては、TGの過剰な増加やTGクリアランスの遅延に対する早期の治療が何よりも重要である。このデータによると、ナイアシンが空腹時の血漿脂質とリポタンパク質のレベルにプラスの変化をもたらすことを裏付ける証拠が増えている。さらに、ナイアシンは食後の血漿TGレベルを改善することが示されている。食後の脂質プロファイルに対するナイアシンの効果を示す臨床的証拠と、正しく健康を維持するために関与するメカニズムとの関係を明確にするためには、分子レベルでのさらなる研究が必要である。