Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7657010/
要旨
神経系上のSARS-COV-2によって引き起こされるコロナウイルス2019(COVID-19)感染症の予測不可能な欠点の深刻さは、膨大な数の感染者の間で広く注目されている。このタイプの新たに回転するパンデミック感染症は、主にヒトの呼吸器系に感染して軽度から中等度の症状を引き起こすことがわかったが、COVID-19の隠されたドアから脳への侵入を介しており、特にその重篤な副作用や死に至る可能性の高い高齢者にとっては大きな脅威となっていることが明らかになった。COVID-19患者のほぼ80%は、めまい、頭痛、意識不明、過敏性、嗅覚・味覚障害などの重篤な神経症状を呈し、筋肉疲労を伴う。
ここでは、COVID-19のヒト脳細胞への直接的な神経侵襲経路(主に嗅覚経路)に着目し、長期的な神経学的合併症を引き起こす可能性があることを明らかにしている。さらに、COVID-19感染が既存のアルツハイマー病をより顕著な重度のステージに激化させる能力を強調している。
もう一つ強調すべきことは、局所免疫応答の非常に顕著な活性化を持つアルツハイマー病患者がCOVID-19に感染することに多かれ少なかれさらされているかどうかである。これはCOVID-19感染への感受性が、将来的にアルツハイマー病を含む神経変性疾患のリスクにつながるのではないかという仮説が根底にある。
キーワード
アノスミア(嗅覚脱失)、アルツハイマー病、COVID-19,嗅球
1. はじめに
コロナウイルス(COVID-19)は、嗅覚を含む一般的ではない経路を介して中枢神経系(中枢神経系)に侵入し、神経学的合併症を含む様々な症状を引き起こす新型のパンデミックベータコロナウイルスである[1,2]。COVID-19の患者には症状が見られるが、5日間の潜伏期間後に現れる初期の一般的な症状としては、咳、発熱、倦怠感、息切れなどが挙げられる。COVID-19の人々の間での感染の主な方法は、くしゃみ-咳飛沫を介した感染である[[3], [4], [5]]。COVID-19感染後の匂いと味覚の部分的または完全な喪失は、感染者の間で頻繁に見られる診断症状であり、数週間続くこともある [6]。数多くの証拠が、神経疾患とCOVID-19パンデミック感染との直接的な関連性を示しており、神経疾患の症状を悪化させる可能性がある。コロナウイルスは,アルツハイマー病や多発性硬化症(MS)の中枢神経系(中枢神経系)で検出されており,ヒトや動物モデルでは,脳への感染が陽性であることを示す神経病変を伴うことが明らかにされている[7].
本視点レビューでは、COVID-19感染がアルツハイマー病の発症率を増加させる脆弱性と、既往のアルツハイマー病の修正に向けた可能性を取り上げている。
2. 中枢神経系細胞免疫モニタリング
中枢神経系(中枢神経系)は、恒常性維持を目的とした細胞と分子の相互作用を幅広く制御している。中枢神経系は、マイナー組織適合性複合体(MHC)分子を持つリンパ系攻撃システムを欠いているが、通常、脳内に常駐するマクロファージ型および免疫調節システムを介して、継続的に制御された免疫モニタリングシステムの下で、血液脳関門(BBB)および血液脳脊髄液(脳脊髄液)によって侵入から保護されている[8,9]。これらの脳内マクロファージは、炎症性カスケード経路がトリガーされた場合や、感染症の引き金となってBBBを介して、あるいは嗅覚系を介して脳を通過した場合に刺激される必要がある[[8], [9], [10]]。アルツハイマー病は、主に海馬と大脳皮質で特にアミロイドβとタウタンパク質の存在によって特徴付けられる古い人口のための神経変性疾患の最も一般的なタイプである。アルツハイマー病は、一般的な全身の傷害や感染症によって引き起こされる可能性のある重度の神経炎症を伴う中枢神経系を直接標的としている[11,12]。老人性プラークや神経炎症性のもつれが異なる脳組織に沈着し、神経免疫系の亢進によって引き起こされると、通常、中枢神経系のホメオスタシスや腸型免疫のホメオスタシスの乱れが頻繁に観察されるようになる。M1-M2ホメオスタシスの障害は、核内因子κB(NF-κB)腫瘍壊死因子α(TNF-α)マイトジェン活性化プロテインキナーゼ(MAPK)インターフェロンⅡ型(IFN-γ)およびケモカインリガンド-2(CCL2)を含む、脳を媒介する環境に依存した多くのプロ炎症性および抗炎症性カスケード経路に関与している[[13], [14], [15]]。
体の自然免疫系は、炎症や病原体への応答を作るために、さまざまな防御細胞を真剣に募集している。このような細胞には、多くの循環リンパ球(B細胞、T細胞、NK細胞)と樹状細胞とマクロファージの両方に発展することができる単球細胞が含まれる。これらの細胞には、組織関連の骨髄由来のマスト細胞も含まれる。全身的には、これらの作用は、血液中を循環するマクロファージとして発生した骨髄由来の白血球リザーバーから、炎症部位に至るまで開始され、その結果、侵入した病原性感染症の破壊、巻き込み、およびクリアランスをもたらす[16,17]。中枢神経系では,ミクログリア細胞は,脳組織の発達,神経の健康環境の維持,炎症性リモデリングシステムの維持に不可欠なさまざまなシステム化された制御プロセスに関与する脳型マクロファージとして機能し,周囲の脳組織の局所環境に依存している.したがって、これらのミクログリア細胞は、通常、M1(プロ炎症性)とM2(抗炎症性)の両方のレベルが主に周囲の脳組織の状態に基づいて表現されるミクログリアの恒常性バランスシステムM1-M2に見出される。ミクログリア脳型恒常性の乱れが生じると、脳は感染症にかかりやすくなり、不可逆的な自己損傷を受けやすくなることが以前に観察されている[17]。
3. COVID-19に関連する症状
一方、呼吸器系ウイルス感染症は人間にとって大きな問題となっており、その結果、健康面や経済面で大きな影響を与えている。これらの呼吸器ウイルス感染症は、特に乳幼児、高齢者、免疫不全者において世界的に高い罹患率と死亡率を引き起こす最も一般的な原因となっている[18]。COVID-19は、重度の呼吸器感染症(RTI)を引き起こすエンベロープドRNAベータ型の大規模なファミリーであり、哺乳類の中間宿主が存在するかどうかは不明であるが、コウモリからヒトへの感染が示唆されている。COVID-19の知られている重篤な症状は、肺炎、急性レパートリー、重篤な苦痛症候群、高凝固、およびおそらく死を含む[[19], [20], [21], [22]。一方、感染した患者は咳や発熱を伴わない無症状の場合もある。この種の非定型ウイルス感染症は、ウイルスの構成要素に必要なすべての情報を含む大きなゲノム(25〜30kb)一本鎖RNAと記述することができる。このRNAは、構造タンパク質でコードされ、埋め込まれたタンパク質でコードされた脂質膜エンベロープに包まれたヌクレオカプシドと呼ばれるカプシドを形成している。エンベロープからは、ウイルスの構造的完全性を維持するために責任があるスパイク状の糖タンパク質の冠の形で投影されたプローブ[[19], [20], [21], [22]]。
COVID-19が宿主に感染するためには、ウイルスのスパイクは宿主特異的細胞表面上の受容体に結合しなければならない。結合受容体と一緒にスパイクタンパク質の変異は、新たに感染した宿主細胞で終わる。新規COVID-19は、重症急性呼吸器症候群(SARS)と同じ受容体を使用して、呼吸器粘膜に位置する細胞への感染から始まり、アンジオテンシン変換酵素2(ACE2)を介してヒトの細胞に侵入し、次に肺の肺胞の上皮細胞に感染し、ウイルスと宿主膜との融合に続いて宿主細胞の侵入で終わるように見える[[23], [24], [25]]。その後、ウイルスは宿主の機械を利用して複製され、ウイルスRNAとタンパク質を産生し、その後、ウイルスと呼ばれる新しいウイルス粒子に組み立てられ、細胞死をもたらす。制御されていないウイルスの拡散は、通常、感染した臓器や組織を破壊し、体の防御機構反応として同定された攻撃的な炎症性カスケードを誘発する[[23], [24], [25]]。
4. COVID-19と嗅球
嗅覚の完全な喪失である無感覚症は、嗅神経の損傷と関連している可能性がある味覚異常と大きく関連している。科学者たちは、最初の主要な感染部位として気道を標的としているが、最近では脳を含む他の臓器にも感染し、無感覚症、脳損傷、神経障害、髄膜炎、麻痺などの重度の神経学的症状を引き起こしている。ウイルスが中枢神経系にアクセスするためには、嗅球を含む特定の神経経路を悪用し、中枢神経系を神経学的損傷の大きなリスクにさらす[[26], [27], [28]]。
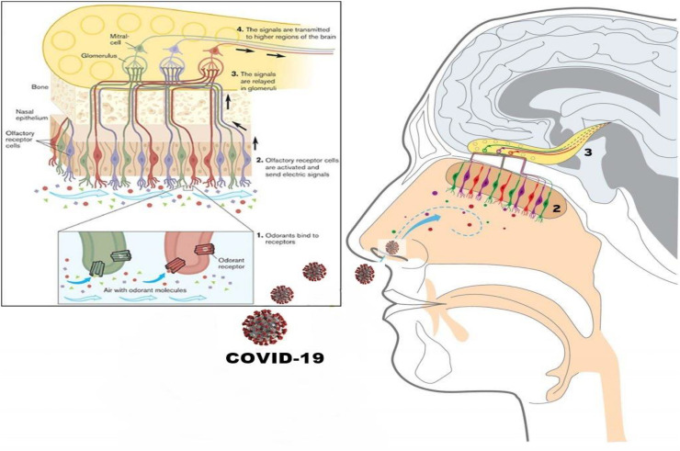
嗅神経は、脳への嗅覚や嗅覚に関する情報の伝達を担当する最初の頭蓋神経である。嗅覚神経は、人間の鼻腔内にある細胞の特殊な集合体である特定の嗅覚上皮から始まる。嗅覚上皮には何百万もの嗅覚受容体細胞がある。嗅覚受容体細胞の軸索はフィラと呼ばれる束のグループを形成しており、この束は篩状板と呼ばれる構造物を通って移動する。篩状板は、鼻腔と脳を隔てて嗅神経を形成しているエスモイド骨と呼ばれる骨の一部である[28,29]。COVID-19病原体は、嗅球ニューロンに続いて嗅球板を通過し、大規模な嗅覚機能障害を引き起こす可能性がある。嗅覚ニューロンは主に鼻腔を経由して外部環境に大きく曝露されているため、COVID-19は嗅覚経路を経由して脳に侵入し(図1)その結果、脳に急速に侵入し、広範囲の組織損傷と、様々な神経学的合併症を伴う重篤な炎症性カスケードを引き起こすことが示唆されている[26], [27], [28], [29]。
図1 嗅覚系とCOVID-19が嗅球を介して脳に浸透する能力を表す全身図
5. COVID-19と神経学的発現
COVID-19と神経学的症状との間の最近の関連性はよく知られている。この非日常的な関連は、COVID-19の感染が神経学的な欠点をもたらすのか、あるいはそれを誇張しているのか、あるいは一方の状態が他方の状態を強める正の相関関係にすぎないのか、多くの疑問を投げかけている[30,31]。ある種の動物や最近ではヒトでも神経侵襲性があることから、ユビキタスヒトコロナウイルス感染がヒトの神経変性疾患の引き金となることとの間に正の相関関係があることが最近明らかになってきている[[30], [31], [32]]。嗅球領域の神経保護能力が高いにもかかわらず,COVID-19は脳脊髄液(脳脊髄液)への侵襲性が高いため,鼻咽頭スワブの結果が誤って偽陰性となり,脳脊髄液では検出されない真陽性となる可能性があることを説明している(表1).COVID-19は常に上気道に限ったものではなく、中枢神経系に侵入し、老化、認知機能の低下、神経障害、麻痺、発作、髄膜炎などの神経細胞の合併症を引き起こし、長期的な合併症としてパーキンソン病やアルツハイマー病のリスクを伴うことが認められている[[32], [33], [34], [35]]。
表1 COVID-19の研究で見つかった神経学的症状。
| 研究タイプ | 研究の起源 | その他の症状 | 神経学的欠点 | 参考文献 |
|---|---|---|---|---|
| 投書 | スイス | -SARS-CoV-2感染後、味覚および/または嗅覚の喪失が観察される場合があります。 -観察によれば、一過性の無嗅覚症は、障害が不可逆的なままである可能性とともに、数週間後に回復することができます。 |
-嗅上皮球根は、COVID-19が鼻を介して脳に侵入するための直接的な経路として機能することができます。 | [ 36 ] |
| レビュー | 英国リバプール | -感染の最初の14日間に、発熱と呼吸窮迫症候群が観察されました。 | -観察された神経学的症状は、CSFで検出されたCOVID-19の後に検出され、続いて項部硬直、頭痛、発作、神経筋疾患、運動神経障害、ミオパチー、脳内出血、および認知症神経認知症候群が検出されました。 | [ 37 ] |
| 症例報告 | 日本 | -発熱、倦怠感、頭痛、発熱、喉の痛み。 | -Covid-19は、鼻咽頭スワブでは陰性であり、CSFでは陽性であることが判明しました。 -発作と意識喪失が臨床的に観察されました。 |
[ 38 ] |
| 症例報告 | 中国 | -倦怠感および反射低下を伴う神経症状後の最初の数日間に、発熱および乾性咳嗽が観察された。 | -中咽頭スワブの陽性COVID-19。 -炎症性脱髄性多発神経障害を含むいくつかの神経学的合併症が臨床的に観察されました。 |
[ 39 ] |
| 症例報告 | 米国 | -精神的およびCRPの上昇を伴う呼吸窮迫症候群 | -誇張されたサイトカイン放出を伴う発作 | [ 40 ] |
| 展望 | 中国 | -身体活動を除いて息切れのない発熱や咳熱などの臨床症状は観察されませんでした。 | -頭痛、めまい、軽度認知障害、かすみ目、筋骨格系障害など、いくつかの神経学的症状が観察されました。 | [ 41 ] |
| 投書 | 米国 | -発熱、咳、息切れ | -めまい、頭痛、精神状態の変化、神経痛、急性脳血管障害が、認知症とともに臨床的に観察された場合もありました。 | [ 42 ] |
6. 神経変性疾患とCOVID-19
COVID-19の嗅球感染で最も頻繁に見られる症状は、アノスミア(嗅覚脱失)と見当識障害の2つである。両方の徴候は、神経細胞がCOVID-19によって侵入され、重篤な毒性のある神経変性作用をもたらす結果として長期間内部に留まっている場合に、神経変性疾患の主要な輪郭として考えられる。これらの影響のいくつかは、感染回復後数ヶ月後の患者でさえ気づくことができる[[43], [44], [45], [46]]。嗅球を介したCOVID-19ウイルス感染に伴うサイトカインの過剰な放出は、自然免疫反応の変化の結果として神経細胞やシナプスの死に大きく関与しており、血液凝固活性化経路の引き金となって突然の脳閉塞を引き起こす可能性がある。COVID-19患者における重度の炎症と高レベルのサイトカインへの長期的な持続的曝露は、長期的には異なる神経精神医学的および神経認知症状に寄与する可能性がある。サイトカインレベル上昇ストームは、腫瘍壊死因子α(TNF-α)インターフェロン-γ(IFN-γ)インターロイキン-1β(IL-1B)およびインターロイキン-6(IL-6)を含み、これらはミクログリアM1表現型を活性化することにより血液脳関門(BBB)を損傷し得る。これは、これらの神経病理学的変化がCOVID嗅球浸透後の嗅覚脳の変化に関連することができる異なる脳領域での不溶性毒性凝集体の急速な蓄積につながる可能性がある[[46], [47], [48], [49]]。
これまでに、ウイルス感染による嗅球ニューロンの損傷を受けた症例では、嗅球、嗅道、嗅核、扁桃体、内嗅野皮質領域に神経原線維のもつれ(NFT)が主に確認されていることが明らかにされている。このような領域内のNFTの数は、認知症の重症度と相関している。最近の神経病理学的研究では、アルツハイマー病関連の脳組織の損傷は、長期的にはアルツハイマー病の炎症型[44,50,51]で終わる炎症性サイトカインの放出とミクログリアM1脳型の上昇の結果として、別の脳領域への広がりに続く嗅覚皮質内のウイルス感染から始まる可能性があることを示唆している。COVID-19の神経侵襲性の長期的な欠点は、その重症度と感染度との間に正の相関関係があるアルツハイマー病のリスクを誇張する結果となる可能性があることを強調するポイントとなる(図2)。
図2
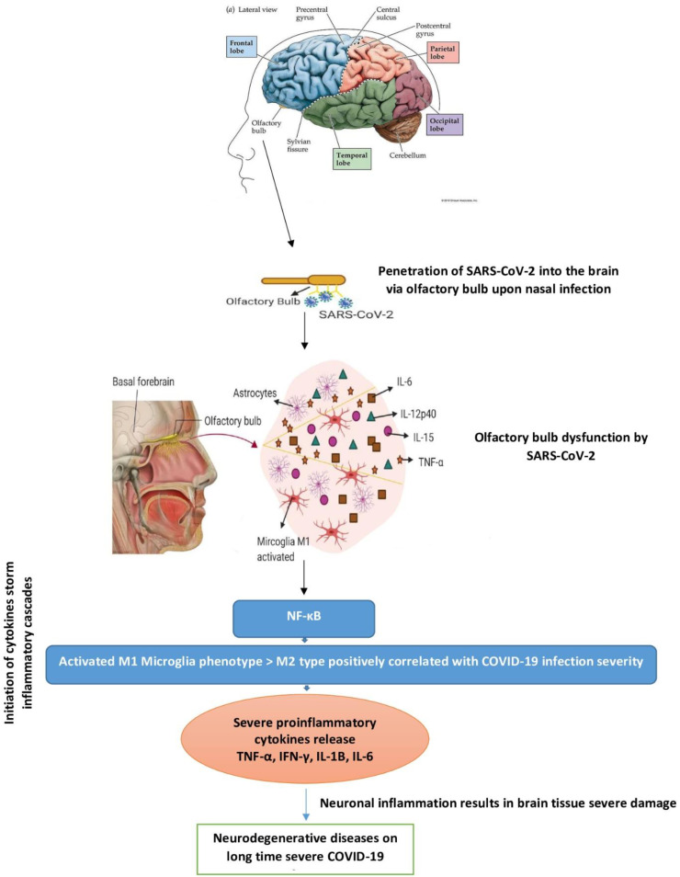
図2 COVID-19が鼻から感染することで中枢神経系に侵入し、神経変性疾患を引き起こす可能性があることを示している。
7. COVID-19の欠点に感染したアルツハイマー病患者
その予測不可能な合併症に加えて、それは、アルツハイマー病の神経病理学的ホールマークパターンに苦しんでいるCOVID-19患者は、神経細胞とシナプスの損傷を含む神経炎症性の欠点により敏感であることが示唆されている[[52], [53], [54]]。これにより、病原体関連分子パターン(PAMPs)を持つCOVID-19ウイルスは、インターロイキン6,IFNγ、NF-κB、および脳組織の不可逆的な損傷などの重度の神経学的症状につながる可能性があるTNF-αを含む嗅球の機能不全を介して自然なサイトカインの誇張された放出で結果が得られる。アルツハイマー病患者では、M1プロ炎症性サイトカインとケモカインの発現が多いプロ炎症性サイトカインと抗炎症性サイトカインの間のアンバランスがアルツハイマー病ステージの進行に寄与する可能性がある。これまでの研究では、IL-6,IFNγ、およびTNF-αレベルの過剰な発現がアルツハイマー病患者で観察され、その結果、シナプスおよびアルツハイマー病神経細胞の機能不全とともにアミロイド前駆体タンパク質(APP)の調節障害をもたらすことが示されている[12,51,55]。
その結果、本レビューでは、鼻や嗅球ルートを介してCOVID -19感染は、それが長期的に高齢者のアルツハイマー病患者ですでに失われていない場合は、ウイルス感染の初期の兆候として、最初の数日で失われた味と匂いの感覚を伴うトリガー炎症性サイトカインの放出と脳組織の酸化的損傷に起因するアルツハイマー病への素因因子として機能することができることを示唆している[27,28,[55], [56], [57], [58], [59]]]。本研究では、ウイルス性COVID-19感染は、主に高IL-6によって維持される老人性の誇張されたプラーク形成を増加させる可能性があることも明らかにしている。そのため、特にNF-κB、TNF-α、およびIL-6の誇張された放出によって媒介されるイニシアチブと適応免疫応答の両方の障害につながる深刻な炎症性サイトカインの産生の欠点として、COVID-19陽性患者では、非ウイルス感染アルツハイマー病患者よりも中枢神経系におけるアミロイド斑の沈着がより有意に高いことが示唆されている[[53], [54], [55], [56], [57], [58], [59]]。
8. 結論
最終的には、COVID-19患者の間で神経学的症状が頻繁に見られるようになり、サイトカインの過剰な放出と高度に誘発された神経炎症が重度の脳組織損傷をもたらすために、高リスク患者の入院を伴うことがある。パンデミックCOVID-19が脳に侵入する能力と、神経障害を長期化させる神経細胞損傷への関与のメカニズムを理解することは、神経病理学的な欠点の長期的なカスケードにつながるまれな合併症を回避するために非常に重要である。
COVID-19患者のセット管理に必要なのは、繰り返しの臨床検査、脳イメージング、および本質的な実験室関連の神経学的検査を含むことの必須の重要な要求である。また、回復後も長期間にわたる一般的な定期検診が重要であり、将来の突然の神経学的合併症の可能性を避けるためにも必要である。
以上のように,COVID-19の謎に包まれた神経学的症状と神経変性疾患への影響を明らかにするためには,慎重な臨床研究と疫学的研究が必要不可欠であると考えられる。
