コンテンツ
ブノワ・シオン(Benoit Sion)、メリーナ・ブグ(M´Elina B´egou)
Clermont Auvergne大学、INSERM U1107、NEURO-DOL、Clermont-Ferrand、フランス
キーワード概日リズム、クロノファーマコロジー、神経系疾患
2020年8月4日受領 2021年1月4日改訂 2021年2月1日受理
概要
神経疾患の病態生理における概日リズム異常の重要性が最近注目されている。クロノファーマコロジーの原則は、個々の患者の概日リズムに合わせて治療のタイミングを調整することで治療管理を最適化できることを示唆している。
クロノファーマコロジーでは、患者の体内時計の個人差、薬物の治療効果や副作用に対する生体の感受性のリズミカルな変化、疾患の予測可能な時間変動が考慮されている。
本総説では、神経疾患のクロノファーマコロジーに関する最新の文献を、てんかん、アルツハイマー病、パーキンソン病、神経因性疼痛に焦点を当て、他の神経疾患についても分析が可能であったかを検討した。
本総説で取り上げた研究の結果は、神経疾患におけるクロノファーマコロジーの治療効果の可能性を示唆しているが、この分野はまだ初期段階にある。1日24時間の投与時間や時計調整薬の有益な効果を評価するためには、十分な数の患者を含み、概日リズムのゴールドスタンダードマーカーを測定する研究がまだ必要であると思われる。
はじめに
神経疾患における薬理学的戦略は、(i)根治的治療法がない、(ii)慢性的に使用すると副作用がある、(iii)どの治療にも反応しない患者の割合が多い、などの理由からまだ限定的である。そのため、代替的な治療法が必要とされており、クロノセラピー*1の使用は、患者により個別化されたテーラーメードの戦略を提供することで、解決策の一部となる可能性がある。本総説では、クロノファーマコロジー*1が神経疾患患者の治療管理を改善する可能性を探る。概日リズムについて簡単に説明した後、主な神経疾患(てんかん、アルツハイマー病(AD)、パーキンソン病(PD)、神経因性疼痛)のクロノパソロジー*を説明し、薬理学に焦点を当てながら、クロノセラピー介入について利用できるデータを提供する。
表1 用語集
- 生物学的リズム:時間の関数として得られる生物学的変数の一連の測定値における規則的に繰り返される成分と定義されるChronergy:Chronesthesy および Chronokineticsに従った薬物に対する生体の反応(すなわち総合効果)の律動的変化を表す Chronesthesy: 薬物の作用機構に生じる時間変化および薬物の効果におけるリズム依存的な差異について扱う
- クロノバイオロジー:生命現象のタイミングを制御し、異なる生体機能の相互作用を有用に同期させる反復的な生体リズム*の研究である。ヒトで観察される生体リズムのうち、最もよく知られ、最も研究されているのは概日リズムである。クロノバイオティクス:生体リズムのパラメータ(すなわち位相設定)に影響を与えることができる物質である。
- クロノパソロジー:クロノバイオロジーの一分野であり、疾病の発現における生体リズムを探求し、これらのリズムの発現の基礎となる機構を研究する。
- クロノファーマコキネティクス(またはクロノキネティクス):体内における薬物の吸収、代謝、分布、排泄の変化の研究クロノファーマコロジー:時間生物学モデル(すなわち、時間依存性の変化の研究)を薬学(すなわち、薬の研究)に応用することである。具体的には、薬物の生体リズム依存性を研究する学問である。
- クロノセラピー:患者の概日リズムに基づいて開発された治療法である。クロノファーマコロジーや、体内時計や外的な合図(ツァイトゲーバー)の操作に関連することもある。
- クロノタイプ:個人が好む睡眠時間や活動時間を指し、遺伝的に決定される部分もあるが、生涯を通じて変化するものでもある。通常、3つのクロノタイプが区別される。朝型は、早い睡眠時間を好み、早く目が覚め、一日の早い時間に最も注意力が高まる。夕型は、遅い睡眠時間と遅い起床時間を好み、一日の遅い時間に最も気分が高まる。最も多いタイプ(60~70%)は、このクロノタイプの中間にあるニュートラルタイプである。
- 概日リズムシステム:複数の遺伝子産物からなる細胞自律的な機構で、SCNにあるマスター概日時計と末梢時計によって組織化された一部の分子成分の機能に、相互作用によってほぼ24時間のリズムを生じさせる。
- 概日リズム:SCNのマスター概日時計や末梢時計によって内因的に駆動される、生理、代謝、行動の振動のリズムで、約24時間で発生する。概日リズムは一定の条件下で持続する
- カップリング:2つ以上の発振器が安定した位相関係で相互作用するプロセスである。同期化はカップリング機構によって起こる。この意味で、SCNは結合した発振器のネットワークで構成されている。非結合は、2つ以上の振動子がこの位相安定性から外れたときに起こる(例:SCNから非結合になった末梢振動子)。
- エントレインメント:自立した振動子(SCNなど)が駆動振動子(明暗周期など)の周期を採用し、そのリズムに従うことをいう。
- メラノプシン:神経節細胞の一部に存在するオプシン(光応答分子)で、本質的に光に敏感な細胞である。これらの神経節細胞は、視覚に関係しない光情報をSCNに送る。
- 位相: 周期(基準点)内の振動の瞬間的な状態であり、一般にアクロフェーズ(リズムのピーク) 位相シフト: 時間軸に沿って振動が変位することである。位相の進みと遅れがある
- リセット: 時計遺伝子の発現が、周期を再始動させる同調物質によって位相がずれること。
- 視交叉上核(SCN):視床下部の基底部にある大脳構造で、内因性行動周期を決定することから哺乳類のマスターサーカディアン時計と考えられている。
- 24時間リズム:24時間以内に起こる生理、代謝、行動の振動のリズムで、概日時計によって駆動される可能性があるが、姿勢の変化、睡眠または睡眠不足、身体活動、食物摂取などの他のメカニズムによって誘発される可能性もある。
- ツァイトゲーバー(ドイツ語で時間を与える者):シンクロナイザーとも呼ばれ、概日時計への入力で、リズミカルな生体振動のタイミングを変化させる。その中でも、ヒトの場合、光は概日システムにとって最も強力なツァイトゲーバーであり続けている。
概日リズム
生物学的機能
生物は、日々変化する外的環境の中で、生理的・行動的な代謝機能を環境と同調させなければならない*。そのため、バクテリアからヒトに至るまで、ほとんどすべての生物は、以下に述べるようなマスター概日時計と周辺時計を含む概日リズム系*と呼ばれる生体タイマーを発達させてきた。これにより、体内生理と外界の手がかりとの同期が保たれ、恒常性が維持される。リズムが崩れた場合、概日リズムのズレが生じ、健康障害を引き起こす可能性がある[1,2]。この場合、循環器系、代謝系、免疫系、発がん系、神経系など、生物のすべての機能が変化する可能性がある。
一昔前、マスタークロックは、完全に隔離され、光刺激がない状態でも持続する概日範囲内(つまり、Duffyら, 2011によれば23.5-24.5時間)の内因性かつ自立的な活動を誘発するものとして同定された [3]。この構造は、環境とコミュニケーションをとる必要がある。環境からの入力を受け取るときは、それらの合図によって同期することができ、下流のターゲットに出力信号を送信するときは、概日リズムのメッセージを送信することができる。
中心時計-視交叉上核
ヒトの場合、概日時計とも呼ばれる概日リズム系のマスターペースメーカーは、視床下部前部の視交叉上核※(SCN)という左右対称の核である。ヒトでは約5万個の神経細胞で構成されている。1970年代に、SCNを切除すると、運動活動、すなわち摂食、飲水、睡眠の24時間リズムが消失することが証明された[4,5]。SCNはコアとシェルの2つの部分からなり、時計の活動には両者の関連性が必要である。この2つの部分は、神経伝達物質、神経求心性、および概日活動によって異なっている。コアの神経細胞は、血管作動性腸ペプチド(VIP)とガストリン放出ペプチド(GRP)を発現し、視覚求心性神経を受け、低い振幅で概日活動を示す。一方、シェルのものはアルギニン-バソプレシン(AVP)を発現し、視覚求心性神経をほとんど受けず、強い振幅の概日活動を示す。この構造は他の哺乳類でも同様であるが、ニューロテンシンやニューロペプチドY(NPY)を発現するニューロンの存在により、ヒトの特異性が観察される[6]。
視交叉上核の求心性神経
核となるSCNは網膜からの光入力を2つの異なる経路で受け取る。光入力は網膜-視床下部路を経て核に到達し、覚醒と日長に関する情報を伝達する視床下部-生殖器路を経て間接的に核に到達する。また、背側および正中側被蓋核のセロトニン作動性ニューロンからの非フォシス性入力も受け、活動や運動に関する情報を伝える。また、間葉核と背側被蓋核は運動に関する情報を伝達し、間葉核は代謝に関する情報を伝達することもある。貝シェル領域は視床下部と腹側小柱や大脳辺縁系皮質などの辺縁系領域から密な入力を受けている。最後に、正中視床の室傍核からの求心性神経がSCN全体に分布している(文献[7-9]に詳細が記載されている)。
SCNの神経細胞はホルモンの受容体を発現している。
(i) メラトニン受容体を発現するニューロンは、概日システムを調節することができるフィードバックメッセージを受け取ることができ [10,11]、(ii) レプチンおよびグレリン受容体を発現するニューロンは、代謝に関する情報を受け取ることができる。[12,13]。また、ホルモンのステロイドであるアンドロゲンやエストロゲンもSCNの概日活動を調節する可能性がある[8]。逆にSCNはグルココルチコイド受容体を発現していない。
これらの求心性のおかげで、SCN概日リズムはさまざまな外部からの合図(光、摂食、…)の情報を受け取る。これらのうち、ヒトでは光のみがSCN*を同期させる強い能力を示し、摂食は末梢時計のみを同期させることが示されている[14]。
視交叉上核のエフェレント
単シナプス性SCNの放出電流は主に視床下部近傍の標的に到達する。室下帯、視索前野、終末線条床核、外側中隔、視交叉後核、弧状核、および視床下部背内側への最も密な投射はシェルからで、室下帯外側(sPVZ)は中核からほとんどの入力を受け取る[15]。背内側視床下部は腹外側視索前核を介して睡眠の生成に、外側視床下部領域(LHA)は摂食に、背側sPVZは体温に、室傍核は運動活性とコルチコイド放出に影響を与える可能性がある。これらのSCN直接受信領域は、次に他の多くの脳領域に信号を送り、その結果、脳の大部分がリズミカルな入力を受け、活動の日リズムを持つようになる(詳しくは文献[7-9]を参照してほしい)。概日リズムはまた、事実上すべての末梢の身体組織で表現されている。SCNからの時間信号は、交感神経系と副交感神経系を通じて、また副腎グルココルチコイドの概日変動によって末梢器官に伝わる[16]。
また、SCNは(i)概日行動に必須のプロキネチン2(PK2)[17,18]、(ii)睡眠と運動活性に必須のトランスフォーミング増殖因子α(TGF-a)[19]、(iii)運動活性に必須のカルジオトロピン様サイトカイン[20]などの拡散性のシグナルを産生することが動物で証明されている。PK2もTGF-aも概日的に分泌される。これは、休息-活動サイクルをサポートするメカニズムであると考えられる。SCNで生成された拡散性のシグナルは、脳や腸に広く存在する遠位組織にまで伝わることが示唆されているが、[21]、そのようなシグナルが伝わる距離は実はわかっていない。
その結果、ほぼすべての末梢臓器に、多かれ少なかれ強固な時計が存在することがすぐに明らかになった。これらの時計はすべて互いに位相*が合っていなければならず、そのためにSCNは様々な手段で同期させることができるようになる。
末梢の時計
末梢時計の同調*はさまざまなメカニズムで行われ、その多くはSCNの活動によって制御されている。まず、SCNは下垂体-副腎皮質軸、特にグルココルチコイドを介して概日生理を同調させる。これらのホルモンは毎日分泌され、その受容体(GR)はほとんどの末梢細胞タイプで発現しているが、SCNニューロンでは発現していない [22]。SCNはまた、松果体によるメラトニン分泌の調節 [23]、自律神経系の調節 [24]、さらに拡散性シグナル(PK2またはTGF-a)の分泌を介して末梢時計を制御している。
末梢時計はSCN以外の因子によって制御されていた。温度と摂食は、シンクロナイザーとも呼ばれるツァイトゲーバー*であり、末梢時計の概日リズムを制御する。しかし、温度は背側SPZによって、摂食はLHAとPVNによって制御されているため、SCNはこれらの方法で間接的に末梢時計を制御していることになる[25]。
さらに、少なくとも試験管内試験では、サイクリック・アデノシン一リン酸(cAMP)、マイトジェン活性化タンパク質(MAP)キナーゼ、プロテインキナーゼC、カルシウムシグナルという3種類のシグナル伝達経路への入力によって、独立した位相シフト*を末梢の概日時計が行うことが確認されている[22]。
分子レベルにおける概日時計
真核生物では、細胞レベルでは、時計遺伝子とタンパク質(詳細は文献[26-29]に記載)のコアセットが関与する転写-翻訳フィードバックループによって概日リズムが生成されていた(図1)。日中は、脳と筋肉のアリール炭化水素受容体トランスロケーター様タンパク質1(BMAL1)と概日運動出力周期タンパク質(CLOCK)がヘテロ二量体を形成し(ニューロンではCLOCKのアナログであるニューロンPASドメインタンパク質2(NPAS2)も関与)、遺伝子プロモータ領域のエンハンシングボックス(E-box)配列に結合する。この複合体は、Per1,2、3やCryptochrome(Cry)1,2などの発現を活性化する。PER(s)とCRY(s)の細胞質での濃度は増加し、PER/CRY複合体の安定性はカゼインキナーゼ1 e/d (CK1e/d)によるリン酸化とホスファターゼIによる脱リン酸化によって調節される[30]。PER/CRYは転写後、BMAL1/CLOCKと相互作用し、自身のE-boxに作用することで自身の転写を抑制する。その後、PERとCRYは概日性の夜間に分解され、サイクルが再び開始されるようになる。BMAL1/CLOCKは、核内受容体サブファミリー1、グループD、メンバー1(REV-ERB)aおよびbの合成を活性化し、REV-ERB(s)はREV応答要素(RRE)に固定してBMAL1および核因子インターロイキン3-制御(NIFL3)の転写を抑制する[31]。REV-ERBはClockの転写を抑制している[32]。BMAL1/CLOCKは、アルブミンプロモーターのDサイト(D-box)結合タンパク質(DBP)の転写を活性化する。DBP は D-Boxに結合することにより、レチノイン酸受容体関連オーファン受容体 (ROR) abcを合成させる。ROR abcはROR response elementに結合し、BMAL1やNIFL3の転写を促進する。
この3つの要素、E-box、D-Box、RREは、時計制御遺伝子と呼ばれる多くの遺伝子にも存在し、そのため概日的に制御されることになる。これらの3つの転写フィードバックループは、大部分のサイクリング遺伝子の主要な転写調節因子である。これらの循環遺伝子は哺乳類の少なくとも1つの臓器で発現しており、概日時計の生理的重要性を裏付けるように、発現する遺伝子のサブセットには臓器機能に関連する様々な生理の制御遺伝子が含まれていることが多い [33,35]。
様々な遺伝子のリズミカルな発現は、アセチル化/脱アセチル化およびメチル化などのヒストン修飾によって制御されている可能性がある。CLOCKタンパク質はそれ自体がヒストンアセチルトランスフェラーゼ活性(HAT)を持ち、BMAL1はクロマチンを開くことができるパイオニア転写因子である。CLOCK/BMAL1の活性はHATと相互作用してヒストンやCRE-element binding protein(CREB)をアセチル化し、アクセス可能なクロマチン状態を提供する[35,36]。これらの転写-翻訳フィードバックループは、異なるメカニズムによって制御されている可能性がある。細胞内のATP枯渇によって活性化される燃料計であるAMP-activated protein kinaseは、CRY1のリン酸化とユビキチン化、ひいてはその安定性を負に制御することが示された[37]。細胞外シグナル制御(ERK)/MAPキナーゼカスケードは、SCNにおける概日時計の光誘起に関与していることが分かっている。MAPキナーゼシグナルはCREBのリン酸化と活性化を引き起こし、PER1とPER2を活性化する[38]。サーチュイン1は、ニコチンアミドアデニンジヌクレオチド(NAD+)依存性のヒストン脱アセチル化酵素(HDAC)で、ヒストンや非ヒストンタンパク質、特にBMAL1やPER2を脱アセチル化して概日リズムを調節している。NAD+はサーチュイン1の活性を駆動し、NAD+は代謝に関係し、NAD+の前駆体であるニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)の転写はCLOCK/BMAL1により制御されている。AMP活性化プロテインキナーゼとサーチュイン1の両フィードバックが代謝と概日時計を結びつけている[39,40]。哺乳類/mechanistic target of rapamycin(mTOR)シグナルは、概日時計のエフェクターであると同時にレギュレーターでもあるようだ。第一に、SCN時計への入力に対する光同調経路の一部として機能する。第二に、時計による制御により、mTORは時計からのリズミカルな出力を提供し、リボソーム生合成などの概日生理・生化学プロセスを制御している。さらに、mTORはCLOCKの発現を調節し、その周期を短くし、振幅を増大させる調節因子としても働く[41,42]。さらに、BMAL1の翻訳における機能は、mTORと関連している[43]。最後に、マイクロRNA(miRNA)も概日時計と相互作用し、時計駆動型遺伝子発現を組織特異的な要件に適合させるために働いている。miRNAを介した制御と対になる周期的転写は、リズミカルなトランスクリプトームの30%まで影響を与え、リズミカルなmRNAの蓄積の位相と振幅を転写後に調整する役割を果たした[44]。BMAL1遺伝子は、脳の細胞から分泌されるmiRNAであるmiR-494によって標的化されている[45]。
図1 哺乳類の細胞内概日時計機構の模式図
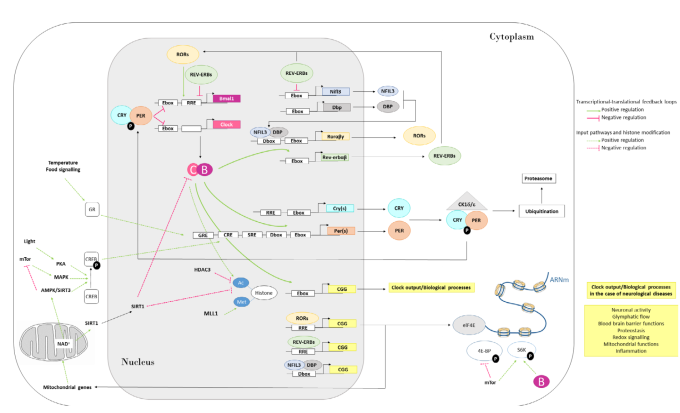
転写-翻訳フィードバックループが中核に関与している。日中、概日運動出力サイクルのカプートCLOCK(C)と脳と筋肉のアリール炭化水素受容体トランスロケーター様タンパク質1 BMAL1(B)のヘテロダイマー(BMAL1:CLOCK)はプロモーター領域のエンハンサーボックス(E-box)要素に結合し、そのタンパク質産物が相互に作用して自身のE-boxに作用して転写を抑制するPer(s)遺伝子とクリプトクロック(s)遺伝子を駆動している。PERとCRYの安定性は、ユビキチン化とカゼインキナーゼ1d/e(CK1d/e)によるリン酸化が並行して行われることにより制御されている。その後、概日性の夜間にPERとCRYが分解されることで、サイクルが再び開始される。CLOCKとBMAL1はまた、核内受容体サブファミリー1、グループD、メンバー1 aおよびb(Rev-ERBa/b)を制御し、Bmal1と核内因子インターロイキン3-regulated(Nfil3)の転写をリズムよく抑制し、活性化因子、レチノイン酸受容体に関連したオーファン受容体(ROR a/b)により駆動されている。NFIL3は、アルブミンプロモーターのDサイト(アルブミンDボックス)結合タンパク質(DBP)を抑制し、ROR核内受容体のリズムを制御している。ROR a/bとRev-ERBa/b はそれぞれの応答エレメントに、DBP/NFIL3 は D-box エレメントにヘテロダイマーで結合する。入力経路は異なる方法で概日振動子の位相に影響を与える。光パルスは、プロテインキナーゼA(PKA)を介したリン酸化によって、転写因子CRE-element binding protein(CREB)を活性化させる。この因子は、その後、Per遺伝子を活性化することができる。食物由来のシグナルはグルココルチコイド受容体(GR)を活性化し、グルココルチコイド応答要素(GRE)に結合して、Per遺伝子を活性化することができる。温度も同様の戦略をとるが、熱ショックタンパク質90(Hsp90)を介した調節活性があり、GRを抑制するようである。さらに、CREB転写因子はmTorとAMP活性化プロテインキナーゼ(AMPK)/サーチュイン3(SIRT3)経路によって制御される可能性がある。遺伝子へのアクセスは、ヒストン修飾と関連している。CLOCKはヒストンをアセチル化し、MLL1(ヒストンメチル化酵素)およびサーチュイン1(脱アセチル化酵素)との相互作用により、遺伝子発現を誘導することができる。ニコチンアミドアデニンジヌクレオチド(NAD+)はミトコンドリアの代謝を反映し、NAD +レベルの概日振動はSIRT1を駆動することが示された。SIRT1のNAD+依存性は、細胞のエネルギー代謝と脱アセチル化を直接的に結びつけている。また、REV-ERBはヒストン脱アセチル化酵素3(HDAC3)のリクルートを誘導し、次にヒストンを脱アセチル化することができる。最後に、タンパク質合成も概日的に制御され、mTORとBMAL1がARNmの翻訳と相互作用する。Ac, アセチル化; eIF4E, 真核生物開始因子4E; 4E-BP, 真核生物翻訳開始因子4E結合タンパク質; MAPK, マイトジェン活性化タンパク質キナーゼ; Met, メチル化; SRE, 血清反応性要素; S6, リボソームタンパク質S6キナーゼβ1.
概日リズムの生物学的基質について述べてきたが、神経疾患の時空間病理学的および時空間治療学的側面を紹介する前に、概日リズム*と24時間リズム*の間によく見られる混乱について、この分野の専門論文でさえ、発表文献で時々見られる注意喚起をしたいと思う。一方、24時間リズムは、概日時計によって駆動される日内リズムであるが、姿勢変化、睡眠または睡眠不足、身体活動、食物摂取など、他のメカニズムによって誘発される可能性もある[14,46]…。[14,46]. この2つの境界線は薄いが、概日時計が故障していると早急に結論づけるには重要である。この2つのリズムを明確に区別できるのは、概日リズムのゴールドスタンダードマーカーだけである。残念ながら、発表された研究、特にヒトで行われた研究では、このマーカーが欠けていることが多い [47]。
神経疾患のクロノパソロジー
クロノセラピーがすべての薬物や疾患に有効であるとは限らないとしても、半減期の短い薬物(12時間未満)や概日周期に沿って症状が変動する疾患に対しては、非常に興味深い選択肢となり得る。以下では、主な神経疾患であるアルツハイマー病、パーキンソン病、てんかん、神経因性疼痛における症状の概日リズム変動について述べる。このレビューは完全なものではなく、ハンチントン病、脊髄損傷など、他の神経疾患も紹介することができたと思われる。[48,49].
てんかん
てんかんにおける24時間のリズムの存在は何世紀も前から認識されており、特にGowersは1800年代後半にてんかんの睡眠/覚醒と日周パターンを関連付けた [50]。これらの歴史的な観察は、技術の進歩、特にニューロン活動の長期脳波記録によって確認されている[51]。非常に興味深いが、このレビューのテーマからは外れるが、カタメニア周期や季節変動など、他の周期もてんかんに関与している可能性がある。
てんかんの時間病理学は、1つのてんかんだけでなく、多くのてんかんが存在するため、複雑な特徴である。
しかし、発作のタイミングと発作の局在やセミオロジーとの関係が示唆されている[52,53]。発作の局在に関しては、全般発作は早朝に最も頻繁に起こるが、側頭葉発作は午後に起こりやすく、さらに午前中にピークを迎える可能性があるとされている。後頭葉および頭頂葉の発作については、あまりデータがないが、後頭葉の発作は午後に、頭頂葉の発作は午前に、より頻繁に発生する可能性がある。最後に、前頭葉発作は早朝に多く発生する[54-56]。生理学的な発現に基づく発作のパターンを調査した研究は少ないが、データは不一致である。強直発作、間代発作、強直間代発作、自動運動発作、運動過多発作、アトニック発作、ミオクロニー発作、運動低下発作、認知障害発作、てんかん性痙攣など、大多数の発作の半身像は日周パターンで記述されている。夜間パターンは、主に二次性全般化発作について記述されている[57-59]。時空間病理の明らかな証拠にもかかわらず、概日リズムとてんかん発作の発生を明確に関連付けるには、さらなる研究が必要である。
古典的な研究では、報告された発作の好発時間が、(i)それ自体の行動状態(すなわち、覚醒対睡眠、急速眼球運動(REM)睡眠対非REM睡眠)、(ii)環境条件(すなわち、明暗サイクル)、または(iii)生物学的機能の概日変調に関連するかどうかを解読することはできない。しかし、多くの証拠から、前者よりも後者の方が強く関与していることが示唆されている。てんかん発作と概日リズムの相互作用は、発作の発症と重症度に環境因子(食物および光)が影響すること、および体温、運動活性、睡眠構造、ホルモンの時間振動に発作が影響することから明らかなように、双方向的に起こる[55]。
てんかんが概日リズムに及ぼす影響については、対照群に比べ、てんかん患者ではメラトニンレベルが低いことが観察されている[60]。てんかん患者は、日中と夜間のホルモンのレベルの変動が強い可能性がある[61]。同様の方法で、記録は少ないが、コルチゾール濃度はいくつかのてんかんと正の相関がある。さらに、てんかん患者には、睡眠構造に様々な変化があることが知られている(詳細は文献[55]を参照)。てんかん患者の皮質興奮性は覚醒時間と共に増加し、てんかんと睡眠機能不全の間の悪循環を生み出すことが示されている[62]。概日リズムの乱れがてんかんに及ぼす影響については、中核的な時計遺伝子であるClock、Bmal1、Cry1、Cry2の発現低下や位相・振幅変化が、局所皮質異形成や結節性硬化複合体の患者のてんかん発生組織や、中側頭葉てんかんの動物モデルのてんかん発生海馬で観察されている[63]。このような時計遺伝子の制御異常は、電気的活動に直接的または間接的に関与する分子の概日発現を変化させ、発作の発生、頻度、持続時間に影響を及ぼす可能性がある。特に、メラトニン経路とmTOR経路の両方が関与していることが知られている。実際、夜間の辺縁系発作の頻度の減少は、メラトニンの高値とmTORの低活性に関連しており、これらの系が発作の時間的発生に関与していることを示唆している[65]。mTOR阻害遺伝子TSC1とTSC2の変異が結節性硬化症患者のてんかんを引き起こすという発見は、発作におけるmTORの関与の可能性を強化するものである[66]。
アルツハイマー病とパーキンソン病
概日リズム、老化、神経変性 ADとPDのクロノパロジーを詳述する前に、概日リズム、老化、神経変性との間にあるであろう、あるいは確実な関連性を把握することが必要である。
ヒトの老化は、代謝、生理、行動機能の漸進的な低下と、睡眠相の前進などの広範な概日リズムの変化によって特徴づけられる。時計が制御する生理的過程は、様々なレベルで変化している。まず、SCNの機能障害が報告されており、特にAVPを発現する細胞の数が減少し、おそらくSCNの出力が変化するとともに、ニューロンの発火率が低下し、一部の細胞が沈黙する(詳細については文献[67]を参照)。その結果、あるいは追加的に、メラトニンレベルの低下という報告により、概日リズムのホルモン分泌が変化するようであるが、このデータは必ずしも再現されていない[68,69]。体温の異常も報告されており、特に体温リズムの振幅が小さく、内因性位相が若い人に比べて39-45分近く早く発生する[70-72]。さらに、分子レベルでは、時計遺伝子の発現は広範な調節障害を示し、[73]、特に末梢時計において顕著である[74,75]。高齢者では、概日リズムの乱れ、活動の断片化、加齢に伴う睡眠障害が老化をさらに加速させ、認知症発症の危険因子となるという仮説がある[76-79]。概日リズムの変化とアルツハイマー病やパーキンソン病との間に強い関連性があることを考えると、この知見は驚くべきことではない。
重要な問題は、神経変性が概日リズムの乱れによって引き起こされるのか、あるいはその結果なのか、あるいはその両方なのかということである。概日リズムの乱れが神経変性疾患の臨床症状の発現に先行する可能性を示唆する証拠が増えつつあることから、概日リズムの乱れが原因であることが強く疑われている[79]。1つの可能性として、概日時計の神経変性への寄与は、睡眠覚醒サイクルと強く結びついていることと関係している可能性がある。実際、最近の研究では、一晩の睡眠不足でも、ヒトの脳の右海馬と視床にアミロイドb(Ab)が蓄積することがわかった[80]。睡眠遮断はまた、ヒトの血清中の炎症マーカーと神経細胞傷害マーカーを増加させることがある[81]。最後に、マウスで得られたデータは、睡眠遮断が、脳からのタンパク質クリアランス、抗酸化物質による過剰な活性酸素種(ROS)の除去、シナプスのホメオスタシスなど、神経変性に関与する他の側面を変化させ得ることを示している(より詳細については、文献 [82,83]を参照のこと)。しかし、FifelとVidenovicがよく述べているように、睡眠/覚醒調節を支配する神経生物学的メカニズムには、概日時計と覚醒および睡眠調節を行う脳中枢の複雑なネットワークが関わっており、睡眠/覚醒構造の変化は必ずしも概日システムの機能障害を意味しない[84]。さらに、マウスモデルにおいて、脳内の時計遺伝子の欠失は、睡眠を変化させることなく神経病理学的障害を引き起こすことを考えると、睡眠パターンの変化だけでは概日リズムの乱れによる脳への影響を完全に説明できないかもしれない [77]。
その場合、免疫反応の概日リズム調節など、他のプロセスが関与している可能性がある。脳では、自然免疫はミクログリアとアストロサイトに依存しており、少なくともげっ歯類では、どちらも炎症活性化を制御する機能的な概日時計を持っている[85-87]。マウスの脳でBmal1を欠損させると、すべての概日時計の機能が失われ、アストロサイトの活性化とシナプスの変性が広範囲に起こることから、脳における自然免疫の恒常性の維持にコアクロック機能が重要であることが強調された [77]。概日時計はまた、タンパク質のホモオスタシスと品質管理を直接制御し、それによって、プロテアソーム分解、オートファジー、タンパク質凝集体の血液脳関門クリアランスの関与が顕著なタンパク質凝集に影響を与える可能性がある[88-92]。最後に、マウスを用いたいくつかの研究により、概日時計と酸化ストレスの複雑で双方向的な関係が明らかにされた[93-97]。神経活動の増加や概日リズムの乱れによって副産物として脳内で生成される活性酸素種は、脳活動の変動に伴って酸化還元防御遺伝子の発現を非同期化し、脳を酸化的損傷に対してより脆弱にし、神経変性に二次的につながる可能性がある[83]。
アルツハイマー病
24時間リズムの機能障害は、TranahらによってADの異なるステージで報告されている。
[76] では、特に睡眠障害が初期の症状(前駆症状)として観察され、確立したADでは、夜間の覚醒の増加(睡眠潜時の増加および睡眠統合の減少により引き起こされる)、徐波睡眠の減少および不規則な睡眠覚醒リズムの特徴である日中の昼寝の増加へとつながる(より詳細については、文献 [79,98]を参照)とされている。さらに、中等度および進行したアルツハイマー病患者は、特に午後遅くまたは夕方において攻撃性、落ち着きのなさ、せん妄および激越の増加を特徴とする「夕暮れ症候群」を示すことがある[99,100]。さらに、身体活動や中核体温のレベルでは、健常対照者と比較して、振動の位相がシフトし、ピークが一日の後半になる[76,101]。また、CLOCKとBMAL1における一塩基多型(SNPs)がADのリスク上昇と関連していることから、遺伝的感受性が示唆されている[102,103]。最後に、Bmal1プロモーターのメチル化の変化が、線維芽細胞および18歳AD患者の死後脳サンプルにおけるBMAL1発現の変化と概日リズムの乱れにつながるという研究によって、概日リズム乱れのエピジェネティックなメカニズムが示唆されている[104]。
死後のAD脳組織では、メラトニンの分泌に関わる中枢時計入力を受け取る構造である松果体における時計遺伝子の発現が、SCN-松果体投射を実験的に病変させたラットと同様のパターンで乱れることが分かっており、松果体が正常な内包入力を奪われたことが示唆されている[105]。時計遺伝子の発現異常もCermakianらによって報告されている[106]。彼らは健常者とADの脳の両方でリズミカルな発現が見られるが、後者では顕著な位相のずれが見られると述べている[106]。最後に、神経病理学的なアミロイド斑ともつれの沈着と同様に重要な神経細胞の損失がSCNで観察されており、これは運動活性リズムの低下と相関している[27,107,108]。
ADの生理病理における概日リズムまたは24時間リズムの乱れの証拠は現在強固であり、このリズムの乱れがADの分子病態とどのように関連するかについての知識も増えてきている。まず、睡眠障害と脳内Abの蓄積が関連するデータが増えつつある。実際、ネズミでもヒトでも、脳脊髄液や間質液のAb濃度は神経活動が活発な時期に高く、睡眠中に最も低くなる[109-111]。これらの変動は、両液の体積の概日変化(休息時間帯に膨張する) [112,113]と同様に、タンパク質クリアランス、特にAbペプチドの変動によって維持されていると考えられる[112,114,115]。第二に、細胞レベルでは、ADと代謝性疾患、特に糖尿病との関連が指摘されている(AD発症の危険因子、e4 APOE対立遺伝子による遺伝的感受性、AD患者の脳で観察されるインスリン抵抗性、など)。概日リズムの乱れが代謝機能に悪影響を及ぼすことを考えると、ADの場合、神経機能障害を誘発する可能性がある(詳細は文献[98,116]を参照のこと)。
パーキンソン病
長い間、PDは運動症状(ブラディキネジア、安静時振戦、硬直、姿勢不安定)に限定されていた。しかし、現在では、非運動症状が共存し、その一部は疾患の前駆期に出現することが明らかになっている[117]。運動以外の症状には、気分障害やその他の精神神経障害、心血管障害、呼吸器障害、さらには概日リズムや睡眠・覚醒周期の変化など、幅広い機能障害が含まれる[118]。
最近、いくつかの研究により、PDにおける行動的、生理的、分子的レベルでの体内時計の変化が報告されている。運動症状および非運動症状の重症度により、パーキンソン病患者は時間の経過とともに座りがちなライフスタイルをとり、ほとんどの時間を室内で過ごし、その後、低い光強度にさらされるようになる。さらに、PDの変性過程は、ドパミン作動性アマクリン細胞および網膜神経節細胞の両方の網膜変性を含み [119]、少なくとも一部のパーキンソン病患者の網膜におけるa-シヌクレイン沈着と関連している[120,121]。
これらすべての側面は、光に敏感な網膜神経節細胞の変性と障害、光に対する感度の低下、そして結果として概日リズムの機能不全に寄与するメラノプシン*を介した応答の機能不全につながりうる[122]。PDにおける24時間リズムの最も明白な行動変化は、睡眠/覚醒および休息/活動サイクルの質の進行性悪化であり、これらの変化はしばしば運動または認知症状の発現に先行する[118,123]。睡眠覚醒障害は、全体としてパーキンソン病患者の80%以上に影響し、最も一般的な非運動症状である[124]。生理学的レベルでは、(i)24時間コルチゾールおよびメラトニン放出リズムの振幅減少(循環ホルモンレベルの変化なし)、(ii)メラトニンリズムの位相前進、(iii)血圧および心拍変動の日内リズムの逆転または完全喪失、(iv)尿排泄の日内リズムの減衰、(v)視覚コントラスト感度のリズム変調など多くの機能障害が報告されている(より詳細については文献[125]を参照のこと)。AD患者とは異なり、パーキンソン病患者の複数の生体リズム*を評価した結果、主に振幅の減少が見られたが、概日リズムの位相の変化はほとんど見られなかったため、概日リズムの真の障害とは結論づけられない。これまで、パーキンソン病患者における時計遺伝子の発現を調査した研究はほとんどない。血液単核細胞における時計遺伝子の発現から得られたデータは、BMAL1の24時間リズム発現の減衰 [126] または完全な消失 [127]を示している。リズミカルな発現の変化は、Per2とREV-ERBs遺伝子についても観察された[127,128]。さらに、以前の研究ではSCNにPDの神経病理学的マーカーを検出できなかったが、De Pablo-Fernandezらは、進行したパーキンソン病患者の13のSCNを調べたところ、軽度から中程度の重症度の9例で異常なレビー小体包有物を発見した [129]。最後に、BMAL1およびPER1のSNPsの発生がPDのリスク上昇と関連していることから、遺伝的感受性が記述されている[130]。
パーキンソン病患者における概日リズムの乱れを評価する強力なゴールドスタンダードがないため、PDにおける概日時計の関与の証拠は疑われているが、確実ではない。論争がまだ続いている。
(i) これらの概日リズムの変化は、ドパミン作動性治療によるものか、それともPDの生理病理そのものによるものか?[127,131]; (ii) 睡眠障害のみによる結果的な混乱があるのか?PD発症前または発症中の概日リズムの乱れの関与をより明確にするために、さらなる評価が必要である。
神経障害性疼痛がん、関節リウマチ、線維筋痛症、多発性硬化症、頭痛など、人間の痛みを伴ういくつかの病気や症状には、その病態や症状の強さに24時間のリズムが見られることが報告されている。このレビューでは、神経障害性疼痛に焦点を当てるが、他の疼痛状態に興味のある読者は、このトピックに関する優れたレビューを参照してほしい [132-136]。関節リウマチなど一部の疾患では、概日リズムを伴う疼痛症状がよく知られているが(午前中に症状が増加する)、神経障害性疼痛における概日リズムの寄与を調べた研究はほとんどない。長い間、示唆されていただけであったが、同じグループによって発表された2つの研究により、神経障害性疼痛患者の痛み(少なくとも糖尿病と帯状疱疹後の病因の場合)が一日中悪化し、夜間に最悪となることが確認された [137, 138]。興味深いことに、従来の鎮痛剤(モルヒネ、ガバペンチン、ノルトリプチリン)による治療では、痛みのスコアが低下したが、24時間のリズムが維持された [139,140]。神経障害性疼痛患者における行動、生理、分子レベルでの体内時計の変化を調べる場合、データはさらに制限され、前臨床研究を考慮する必要がある。特に、時計遺伝子の調節やPer1やPer2の欠失は、痛みの行動に変化を示すことが報告されている[141,142]。さらに、マウスの坐骨神経部分結紮によりPer遺伝子の概日振動が抑制され、siRNAの髄腔内注入による脊髄のPer1ノックダウンにより機械的過敏症が誘発されることがわかった[143]。最後に、最近の研究では、睡眠不足が機械的刺激や熱刺激に対する感受性を悪化させることが示された[144]。
神経障害性疼痛症状の24時間のリズムを説明する複数のメカニズムが存在する。(i) 内生オピオイド系の日内変動(ヒトでは、βエンドルフィンは朝が最も高く、夕方が最も低いことが報告されている) (ii) 免疫系と神経炎症の概日リズム、または発現の概日変動 (iii) 感覚ニューロンの疼痛反応に関係するイオンチャンネル(cGMP-gated cation channel, transient receptor potential channel, and voltage-gated ion channelsを含む) (より詳細については文献[135]を参照)の活性化)。[135]).
以上のように、神経障害性疼痛症状の24時間リズムに関する記述はまばらであり、一日を通しての症状悪化に明確な概日リズムがあることを裏付けるには至らない。したがって、神経障害性疼痛における明確な概日リズム障害を結論づけるには、補足的な証拠が必要である。
クロノセラピー戦略
クロノファーマコロジーについて
クロノセラピーは、概日リズムが治療法の効果に影響を与えるという原則に基づいている。Sullyらによってエレガントに説明されているように、クロノセラピー戦略は「3つの大きなカテゴリーに分類される:
- (i)摂食、睡眠覚醒、明暗周期における強固な概日リズムを維持するための介入「時計を鍛える」、
- (ii)効果を向上し副作用を減らすために薬のタイミングを最適化(「クロッキングザドラッグ」)、
- (iii)概日時計成分を直接標的とするか概日時計に深く関連する部分を標的とする低分子薬剤を使用「ドラッギングザクロック」」
である。[145]. 本総説はクロノファーマコロジー*に焦点をあてているため、クロッキング・ザ・ドラッグ(Clocking the Drugs)とドラッギング・ザ・クロック(Drugging the Clock)という2つのカテゴリーのみに関心を絞ることにする。実際、クロノファーマコロジーのトレーニングは、主に行動学的な非薬物学的アプローチによって管理されている。
簡単に説明すると、クロノファーマコロジーとは、薬の生体リズム依存性を研究する学問である。患者の時計の個人差(患者の朝型や夕方のクロノタイプ*による)、薬物の治療効果や副作用に対する生体の感受性のリズム変化(クロネスティシ*、クロノキネティクス*、クロナジー*)、病気の予測できる時間変動(薬物の標的の豊富さへの供給を理想的に同期化)を考慮に入れている[38,146,147]。
時間差投与のアプローチ-薬物の時計回り投与
最も単純なバージョンでは、薬物のクロッキングは、薬物の最適な投与タイミングを決定することからなる。最も進んだ方法では、疾患活動や患者のサーカディアンリズムのバイオマーカーに従って薬物放出の設定を可能にする薬物送達システムを使用する必要がある[148,149]。米国で承認されている薬剤の80%以上が、振動遺伝子にコードされたタンパク質を標的としており、そのほぼ半分が半減期が短い(6時間未満)という事実から、薬剤のクロックアップはすでに多くの疾患において成功を収めており、最近包括的なレビューがなされている[151, 152]。神経疾患に関しては、データが蓄積されつつあり、クロノファーマコロジーによる管理の優位性を示している。
概日リズムをリセットするためのアプローチ-ドラッギングザクロック
クロノバイオティクス*とは、生体内リズムのタイミングを調整し、概日リズムの再同期を可能にする物質である[147]。概日リズムの変化が多くの疾患を引き起こすという仮定に基づけば、時計が制御する出力プロセスを改善する時計調節分子は、疾患症状や生理的衰えを緩和する可能性がある[153,154]。これらの治療法は、位相、振幅、または周期を調節する性質があるため、多くの疾患における使用の可能性を示している。これまで、リセット*アプローチとしての薬物療法は、主に時差ぼけやシフトワーカー、その他の睡眠問題の治療のために概日性の分野で適用されてきたが、神経疾患分野での関与は有望な研究領域である[155,156]。
試験された最初の時計分子はメラトニンであり、生物学的な夜のマーカーとして、一日の終わりに上昇し、夜の終わり前に減少する(午前2時から午前4時の間にピーク値に達する)。メラトニンはSCNの制御下で主に松果体から産生・放出され、すべてではないにしてもほとんどの細胞型と相互作用し、SCNがすべての末梢時計を同期させるために用いる一つの方法である可能性がある[157]。メラトニンは概日時計の位相シフトを誘導するために使用される。午前中に投与すると位相の遅れ(遅い時間へのシフト)を引き起こし、午後/夕方に投与すると位相の進み(早い時間へのシフト)を引き起こす[158]。
最近では、時計の構成要素やその調節因子を標的とした、概日システムの低分子モジュレーターがいくつか開発されている。これらの分子は、その分子標的によって、異なる生理学的修飾を引き起こす。ある分子は概日周期を長くする。これはPER/CRYのレベルに影響を与えるCK1e/d阻害剤の場合である。その他の分子は、(i)上流キナーゼ(ERKおよびCa2+/カルモジュリン依存性プロテインキナーゼII(Cam-KII)、(ii)アデニルシクラーゼ、(iii)ホスホジエステラーゼを標的とし、概日リズムを急性的に進めたり遅らせたりする。最後に、いくつかの分子は時計の振幅を高めることができる(より詳細については、文献[156]を参照)。これらの化合物のうち、生体内試験動物実験が可能な良好なバイオアベイラビリティと薬力学的特性を有するものはわずかであるが、それらのいくつかは、癌、炎症性疾患、代謝性疾患、気分障害などの異なる疾患群に有益な効果を示している。例えば、食事誘発性肥満マウスを用いた前臨床研究では、RORのインバースアゴニストであるSR1555が体重を減少させ、活動を増加させることが明らかになった [159] 一方、CRY 安定剤であるKL001のバイオアベイラビリティ誘導体は耐糖能を改善し、[160] また、天然フラボノイドのノビレチン(nobiletin) は体重増加を抑制しエネルギー代謝を向上させる[161] ことが分かった。時計の低分子モジュレーターは、気分障害にも使用されている。REV-ERBのアゴニストは、抗不安作用を示した [162]。非常に印象的なことに、双極性障害の治療に用いられる気分安定薬のリチウムは、SCNと末梢の両方で概日リズムレポーターの振幅を増強するなど、概日リズム系に複雑な効果を示した [163]。現在までのところ、神経学的な用途での時計の低分子モジュレーターの使用はまだ限られている。
てんかんにおける時間治療戦略
このレビューで述べた神経疾患の中で、てんかんはおそらくクロノファーマコロジーのデータが最も豊富な疾患である。広く試されている治療戦略の1つは、発作が最も多く発生する時間帯に治療を行うことである。この戦略は、抗てんかん薬のクロノセラピーにおいて、カルバマゼピン、フェニトイン、クLOVAZA(オメガ3酸エチルエステル)ムの差分投与が副作用を増やすことなく発作のコントロールに有用であることが示されている[54,164-166]。抗てんかん薬のクロノファーマコキネティックな変動もまた、様々な研究によって裏付けられている。血漿タンパク質濃度の概日変化はバルプロ酸の分布に強く影響し、遊離濃度は午前2時から6時の間に最大となり、午後には最小となる[167]。カルバマゼピンでも同様の観察がなされている[168]。ジアゼパムの経口投与では、夜間投与に比べて朝方投与ではCmaxがより速く、Tmaxがより短くなるが、これはおそらく薬の吸収と分布の変化によるものである[169]。最後に、バルプロ酸の代謝物の排泄が午前2時から8時の間に減少するように、腎機能の概日振動が薬物または代謝物の排泄に影響を与える可能性がある[170]。抗てんかん薬におけるクロノファーマコロジーの特徴をよりよく理解することは、有効性の向上と副作用の低減の両方につながる。
これまで、時計の低分子モジュレーターはてんかん患者において評価されてこなかった。しかし、古い抗てんかん薬が時計遺伝子の発現を変化させることが示されている。これはジアゼパムやバルプロ酸の場合である[171,172]。バルプロ酸はショウジョウバエにおいて、概日リズムの周期を長くし、リズムを促進することが示され、[173]、マウスやヒト線維芽細胞において、投与時間によって概日遺伝子Per2のリズム発現を進めたり遅らせたりすることが示されている[174]。したがって、これらの薬物の抗てんかん作用は、概日リズム性そのものに深く作用することによって部分的に支持されうる。いくつかの前臨床および臨床研究は、いくつかのてんかんにおけるメラトニンの抗てんかんおよび神経保護効果を示唆している。しかし、データは限られており、時には矛盾しているため、[175]、さらなる評価の必要性が確認されている(詳細は文献[54]を参照)。
アルツハイマー病とパーキンソン病における時間療法戦略
概日リズムと睡眠リズムを安定化させるための様々な治療法が、ADとパーキンソン病患者で評価されている。メラトニンは、その強力な抗酸化作用 [176]と概日リズムと睡眠/覚醒リズムの内部同期*における役割から、ADおよびパーキンソン病患者において評価されている。パーキンソン病患者では、2つの研究のみが実施され、主観的な睡眠の質に対する有益な効果を示したが、睡眠の主観的尺度または運動症状の評価には全くまたはほとんど効果を示さなかった [177,178]。重要な限界の1つは、両方の研究プロトコルが、概日系の調節因子としての効果よりもむしろメラトニンの催眠作用に基づいていたことである。注目すべきは、これらの負の効果は、メラトニン摂取と明るい光治療の組み合わせによってわずかに打ち消されたことである[179]。AD患者においても、メラトニン治療の有効性を評価した研究はほとんどなく、投与時間の制限を指摘され、賛否両論の結果であった。実際、有益な効果を得るためには、メラトニンの投与は正常な内因性メラトニン合成のタイミングに注意深く合わせる必要があるようだ(詳しくは文献[67]を参照)。
ADとPDの治療に関しては、非薬理学的なクロノセラピー戦略に関するデータが文献に多数あるが、そのような治療の詳細な説明はこの記事の範囲を超えており、このテーマに関する優れたレビューが最近出版されている[67,84]。長い話を短くすると、朝の光療法がADおよびパーキンソン病患者の概日機能障害および症状を改善する可能性を示す研究もあるが、光刺激の時間、タイミング、周波数、スペクトルの特性および強度、ならびに患者の光歴に応じて注意を払う必要がある[180]。
神経障害性疼痛における時間療法
戦略鎮痛剤の疼痛感受性に対する効果もまた、24時間変動する。これは主に動物で観察されている。1967年に早くも、モルヒネによる鎮痛作用は、夜行性動物の活動期である午後9時に最大効果、午後3時に最小効果を示すことがホットプレートテストにより証明された。これらのデータは後に確認され、エンドルフィンおよびエンケファリン濃度の増加およびl-オピオイド受容体の24時間発現パターンと密接に関連していると思われ、これらの受容体の数は午後9時に最大となる[182]。現在までのところ、6人の健康なボランティアにおいて β-エンドルフィンのピーク値が午前8時(ヒトの活動時間帯)、トラフ値が午後8時であることを発見したとしても、ヒトにおけるエンドルフィンおよびエンケファリン濃度の概日変化についてはほとんど知られていない [183]。また、モルヒネの薬物動態に関与し、24時間変動を示すいくつかの過程が、モルヒネの効能の概日変動に関与している可能性が示唆されている[184]。外傷性神経障害性疼痛モデルを用いた別の鎮痛剤に関する最近の研究では、後根神経節におけるa2d1サブユニットタンパク質の発現が最大となる時間に注射した場合、ガバペンチンの効果は最小であることが示された [185]。
最後に、概日リズムをリセットするアプローチについては、メラトニンの抗侵害受容作用が広く評価されている。群発性頭痛に対する現在の薬物療法試験のメタアナリシスでは、メラトニンは急性治療と予防療法の両方に投与される可能性があることが示唆されている。
さらに、最近の臨床試験では、線維筋痛症候群による慢性筋骨格系疼痛とアロディニアまたは痛覚過敏を含む全身の圧痛がメラトニン治療により緩和されることが明らかになった。神経障害性疼痛に関しては、いくつかの研究があるが、結果は一致しておらず、さらなる評価が必要である。上に引用した研究では、メラトニンはその幅広い生理学的効果(特に抗酸化作用と抗炎症作用)のために使用されており、概日時計のリセット作用のためだけではないことに注意すべきである(より詳細については文献[186]を参照されたい)。
結論
経験上、神経疾患の治療は複雑であることが多く、また多くの場合不適切であることから、生理学的病理学および治療薬に対するサーカディアン効果の理解が深まれば、新しい治療領域が開かれることになる。しかし、有望ではあるが、神経疾患における概日リズムの介入の応用はまだ初期段階にあり、多くの疑問が残っている。まず、クロノセラピーの標的を定めるために、概日リズムの乱れが神経変性に関与している可能性のある分子機構をさらに研究する必要がある。特に、代謝、ミトコンドリア機能、レドックス状態、抗酸化反応、神経細胞やグリアの活性に関与している可能性に関心が持たれている。第二に、これらのうちいくつかは着手されているが、今後の研究では、最適な投与時期を決定するために、薬物標的の発現の概日リズムを明らかにする必要がある。さらに、神経疾患における概日リズムへの介入の効果を評価した既発表の研究は、すべてではないにせよ、そのほとんどが限られた期間に行われたものである。長いスパンでの評価と、十分に大規模な集団での評価が急務である。最後に、たとえ神経疾患の一部について病態の説明が可能になり始めたとしても、クロノタイプ(または個々の先端位相)の被験者間の差異を評価し、クロノセラピー戦略を決定する際に考慮に入れなければならない。概日時計の概念を精密医療にうまく応用できるかどうかは、これらの疑問に対する答えにかかっている。

