Can a metabolism-targeted therapeutic intervention successfully subjugate SARS-COV-2? A scientific rational
www.sciencedirect.com/science/article/pii/S0753332220308878
ハイライト
- SARS-CoV-2の複製は、ウイルスのパッケージングをサポートするために細胞のリポジェネシスのアップレギュレートを要求している。
- 肺胞におけるSARS-CoV-2誘発性ARDSはCOVID-19死亡の主な原因である。
- 酸化ストレスの増加は、ARDSの重要な特徴の一つとして、高用量ビタミンCによって克服される可能性がある。
- メトホルミンとアジルスロマイシン/ドキシクリンの組み合わせは、リポジェネシスをダウンレギュレートすることで、ウイルスの複製を標的とする可能性がある。
- 致死的なSARS-CoV-2発作に対するビタミンC+メトホルミンとアジスロマイシン/ドキシクリンの併用療法を提案している。
要旨
宿主細胞分子の高いターンオーバーを伴うプロセスとして、ウイルスの複製は、ウイルスの感染を成功させるために必要であり、その伝播に必要な高分子を獲得するためにウイルスの能力を要求する。この目的のために、ウイルスは、その特定の要求に応じて細胞代謝を利用するためにいくつかの戦略を採用してきた。ほとんどのウイルスは、特定の細胞代謝経路をアップレギュレートし、そのような変化に大きく依存している。例えば、RNAウイルスは、解糖とグリコーゲン分解の両方をアップレギュレートし、同化性脂肪形成に不可欠なTCAサイクルの中間体を提供している。また、これらの感染症は通常、PPPを誘導し、ウイルスの複製をサポートするヌクレオチドレベルの増加につながる。中国から世界に広がっているSARS-CoV-2(COVID-19の原因)もRNAウイルスである。感染していない細胞の方が代謝可塑性が高いことから、特異的な抗ウイルス治療のための有望なアプローチであり、近年注目を集めている。
このようなウイルスによる代謝変化を標的とした治療法の可能性があると考えられる。今回のレビューでは,まず,ウイルスによって誘発される代謝適応のいくつかをまとめ,次に,これらの情報と SARS-CoV-2 の病態に基づいて,この世界に蔓延する恐ろしいウイルスに対する治療法の可能性を提案し,近い将来の臨床応用を期待している.
キーワード
SARS-CoV-2細胞代謝グリコリシスPPPTCAサイクル
1. 序論
中国湖北省武漢市で最近,重篤な呼吸器疾患が報告された。気管支肺胞洗浄液のメタゲノムRNA配列解析により、コロナウイルス科に属する新規ウイルス株が同定され、SARS-CoV-2と命名され、その結果、コロナウイルス病2019(COVID-19)と命名された。ウイルス全ゲノムの系統解析を行うことで、このウイルス株は、中国のコウモリで以前に発見された重症急性呼吸器症候群(SARS)様コロナウイルス群(サルベコウイルス亜属、ベータコロナウイルス属属)に最も近い(75~80%のヌクレオチド類似度)ことが示された[1,2]。
世界保健機関(WHO)が発表したCOVID-19状況報告書-209によると、2020年8月16日までに世界で合計8人の21,294,845人の確定症例と761,779人の死亡が確認されている[3]。しかし、COVID-19の確定治療に有効であることが証明された抗ウイルス薬はまだ存在せず、有効かつ安全な治療法を見つけるためのさらなる研究が必要であることを裏付けている。
真核生物ウイルスは、宿主細胞の代謝に大規模な変化を引き起こすことが示されている。これまでに評価されたほとんどのウイルスは、好気性解糖を誘発し、これはワールブルグ効果としても知られている。数多くのウイルスがグルタミン分解および脂肪酸(FA)合成も誘発している。感染細胞による炭素源利用のこれらの変化は、ウイルス粒子に特異的な細胞基質を提供し、ウイルス複製およびウイルス産生のための利用可能なエネルギーを増加させ、それによってウイルス複製ニッチを形成し、感染細胞の生存を増大させることができる[4]。
各ウイルスの複製に必要な代謝変化をよりよく理解することは、特定の代謝経路を標的として阻害することを目的とした新規の治療戦略を開発するための基礎となるかもしれない。
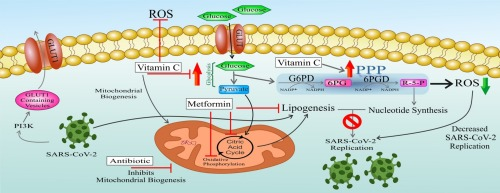
RNA ウイルス(RV)感染は、1) PI3K を介したグルコーストランスポーター 1(GLUT1)を含む小胞の宿主細胞膜への輸送を誘導し、それによりグルコースの取り込みを増加させることにより、宿主細胞の代謝のリプログラミングを誘導する。また、GLUT1の過剰発現によりPPP中間体が増加することがわかっている。) 同化性脂肪形成に必要なTCAサイクルの中間体を提供する解糖とグリコーゲノライシスの両方を調節する。3) ウイルスの複製をサポートするヌクレオチドのレベルを高めるPPPの活性化 [5]。
SARS-CoV-2はRVであるため、宿主細胞での複製のために他のRVと同様の代謝リプログラミングを誘導することが期待されている。したがって、これらの代謝経路を標的とすることで、本感染症の治療に応用できる可能性がある。コロナウイルス感染後には、解糖、PPP、TCAサイクルが亢進しているというエビデンスがある[7], [8], [9], [10], [11], [12], [13], [14], [15], [16]。そこで本稿では、まず、ウイルスに起因する代謝適応のいくつかをまとめ、これらの情報とSARS-CoV-2の病態に基づいて、この世界的に蔓延するウイルスの治療法を提案し、近い将来の臨床応用を期待している。
2. ウイルスは宿主細胞の代謝を利用する
ウイルスは、高分子の分散していない供給を確保し、その特定の要求に応じて宿主細胞の代謝に適合させるために、戦略の茄多が採用されていた。細胞防御機構の同時活性化と同様に、ウイルスの生産にリンクされている生体分子の高いターンオーバーは、しばしば細胞外炭素源(グルコースやグルタミンのような)のアップレギュレートされた取り込みと同様に、リポジェネシスやヌクレオチド合成を含むウイルスの複製に不可欠な代謝経路へのそれらのリダイレクションに関連付けられている高度に同化状態をもたらする[5]。
ウイルスは、PI3K[17]やCaMKK1/AMPK[18,19]などの細胞質シグナルの活性化や、Myc[20,21]、SREBP[16,[22], [23], [24], [25]やChREBP[26]の活性化などの転写制御など、多様な戦略を採用していることが実証されている。] 現在のデータは、宿主細胞操作のそれぞれの戦略を掘り下げていくと、RNA ウイルスと DNA ウイルスの間に二分法が存在することを示唆している。すなわち、DNA ウイルスが転写レベルで重要な代謝経路を制御しているのに対し、RNA ウイルスは、それぞれの複製サイクルのペースと一致した転写後の修飾 [17] を介して宿主細胞の代謝を形成しているように思われる(図 1)。
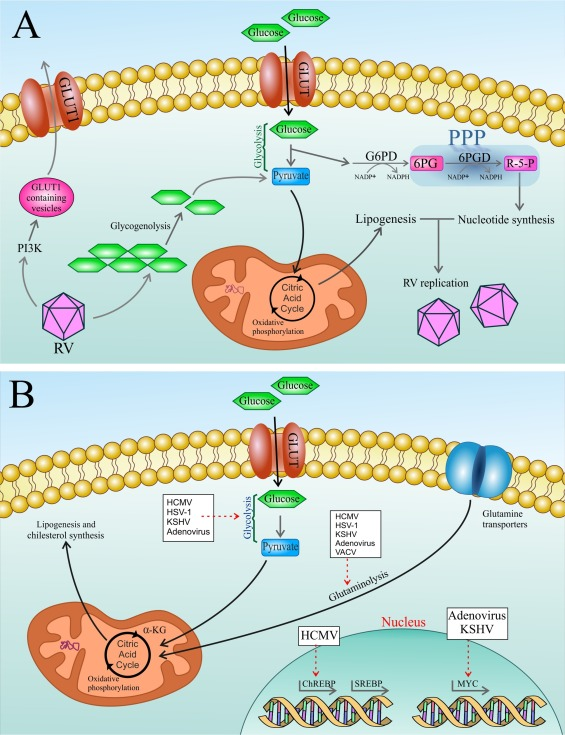
図1 a) RNAウイルス(RV)であるライノウイルスは、宿主細胞の代謝を転写後修飾する。このウイルスに感染すると、1)PI3Kを介したGLUT1含有小胞の宿主細胞膜への輸送を誘導し、グルコースの取り込みを増加させることにより、宿主細胞の代謝リプログラミングが誘導される。また、GLUT1の過剰発現はPPP中間体の増加につながることがわかっている。) 解糖と糖分解の両方を促進し、同化性脂肪生成に必要なTCAサイクルの中間体を提供する 3) ウイルスの複製をサポートするヌクレオチドのレベルを高めるPPPを活性化する。RV:ライノウイルス、PI3K:ホスファチジルイノシトール3-キナーゼ、GLUT:グルコーストランスポーター、TCA:トリカルボン酸サイクル。様々なDNAウイルスは、宿主細胞に感染した後、特定の代謝プログラムを活性化し、最終的にウイルスの複製とウイルスの成熟をサポートする。破線の矢印は、ウイルスが誘導する代謝経路の活性化または転写因子の活性化を示している。TCA: トリカルボン酸サイクル; α-KG: α-ケトグルタル酸; SREBP: ステロール調節エレメント結合タンパク質; ChREBP: 糖質応答エレメント結合タンパク質; GLUT: グルコーストランスポーター; HCMV: ヒトサイトメガロウイルス; HSV-1: 単純ヘルペスウイルス-1; KSHV: カポジ肉腫関連ヘルペスウイルス; VACV: ワクシニアウイルス。
宿主細胞のFA合成機構は、ウイルスのゲノム複製、ウイルスの生産、および形態形成のための実質的なものであることが証明されている。数多くのウイルスは、宿主小胞体(ER)の界面にウイルス複製複合体(VRC)を形成するために、ホスファチジルイノシトール4-リン酸塩/コレステロール富化膜の形成を刺激する。免疫モニタリング(例えば、細胞質パターン認識受容体)からウイルス核酸を保護し、ウイルス複製のための最適な環境を包含する隔離された膜の生成には、RNAウイルスのVRCにおけるステロールの蓄積が必要である[27,28]。VRCの形成は、ホスファチジルイノシトール-4キナーゼIIIβおよびオキステロール結合タンパク質(PI4KB-OSBP)軸のリクルートによる宿主細胞のステロール合成のリプログラミングに決定的に依存している。このように、細胞コレステロール恒常性の摂動は、ウイルスの複製を減衰させる[[29], [30], [31], [32], [33]]。
これらの情報は、ウイルスの持続的な増殖にはリポジェネシスが重要な役割を果たしていることを示しており、リポジェネシスを標的とすることで、ウイルスの複製を効果的に阻害する道が開かれる可能性があることを示している。
コロナウイルス感染後の解糖、PPP、TCAサイクルの上昇を反映したエビデンスがある。
HCoV-229Eは、コロナウイルス感染後の宿主細胞脂質応答の包括的な特性化のためのモデルコロナウイルスとみなされる可能性がある。HCoV-229E感染細胞のグリセロリン脂質とFAは有意に上昇し、リノール酸からアラキドン酸への代謝軸は顕著に摂動されている[34]。ミトコンドリアでは、FAは前駆体分子であるアセチル-CoA、マロニル-CoA、マロネートから合成され、FAへの伸長にはATPとNADPHが必要である[35,36]。感染性気管支炎ウイルス(IBV)コロナウイルス粒子上で行われたプロテオミクス解析は、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDHアルデヒドデヒドロゲナーゼ9ファミリー、メンバーA1(ALDH9A1)とα-エノラーゼを含む解糖経路に関与するいくつかのタンパク質を同定している。これまでに、HIV-1,ヒトサイトメガロウイルス(HCMVモロニーマウス白血病ウイルス(MMLVカポジ肉腫関連ヘルペスウイルス(KSHV鳥インフルエンザウイルス(AIV)などの他のウイルス粒子で同定されていた[[37], [38], [39], [40], [41], [42]]。リピドミクス解析はまた、HCoV [34] および MERS-CoV 感染後の代謝リプログラミングについての理解を広げてきた [16,34]。Yan at al.は、HCoV感染時にリン脂質とFA(飽和および不飽和)の蓄積によって示されるように、細胞脂質プロファイルのかなりの再配置を発見した。これらの研究者は、Coronaviridaeは、最適なウイルス複製を達成するために宿主の脂質プロファイルを特別に微調整していると主張している[34]。これらの知見は、MERS-CoV感染を抑制するための有望な戦略として、AM580(特異的阻害剤として)によるステロール調節エレメント結合タンパク質(SREBP)の薬理学的ターゲティングに関する最近の報告によって確認された[16]。AM580 を用いて SREBP のタンパク質分解処理を阻害すると、細胞内脂質液滴形成の減少、ウイルスタンパク質のパルミトイル化の減少、二重膜小胞(DMV)形成の減少など、複数のウイルス侵入後のステップを阻害する結果となった [16]。
PI3K/AKT/mTORおよびERK/MAPKシグナル伝達経路がMERS-CoV感染において重要な役割を果たしていることが実証されており、治療介入のための新たな薬物標的となる可能性がある[43]。PI3Kに依存したGLUT1含有小胞の細胞膜へのトラフィッキングは、グルコースの取り込みと代謝の増加をもたらする[5]。
3. COVID-19における代謝介入
コロナウイルスは、急性呼吸窮迫症候群(ARDS)による致死的な肺損傷および死亡を引き起こす可能性のあるパンデミックウイルスである[44]。重度の低酸素血症を特徴とするARDSは、一般的に酸化性傷害、制御不能な炎症、および肺胞-毛細血管バリアの損傷を伴う [45,46]。酸化ストレスの亢進は、急性呼吸不全の臨床症状の一つとして、ARDSを含む肺障害における重要な障害であり、かなり高い罹患率と死亡率を示している[47]。したがって、酸化ストレスはこの感染症の危険な側面である。サイトカインストーム」の結果としての細胞外酸化ストレスの増加は、このパンデミック感染症の高い死亡率の主な病理学的原因であるARDSをもたらする。
このような観点から、COVID-19に対する代謝介入は、以下の2つの主要な目標に沿ったものであると考えられる。1) ウイルス複製の阻害 2) 酸化ストレスの阻害。
第一の目標を達成するために考えられる戦略は以下の通りである。”ウイルスのパッケージングに必要な「リポジェネシスを標的とする」ことである。この目標は、3つの方法で達成することができる a) ピルビン酸産生を阻害するために解糖をダウンレギュレーションする(GLUT1のようなGLUT活性を阻害する以外の方法では、それらはPPPの活性を維持するために必要とされるのでTCAサイクルに入ることにより、リポジェネシスを減少させる。通常、解糖は、同化性脂肪形成のためのTCAサイクルの追加の中間体を提供するために必要である;b)TCAフラックスを減少させるためのミトコンドリアターゲティング;c)細胞性脂肪形成の直接的な阻害。
第2の目標を達成するための可能な戦略には、以下のものが含まれる:a)PPPPのアップレギュレーション、およびb)感染中に産生される細胞外ROSのスカベンジング(特に肺胞腔において
a) PPPのアップレギュレーションについて。
細胞内酸化ストレスは、コロナウイルス感染性に寄与し、肺上皮細胞におけるコロナウイルスの複製を増加させる。最近の研究で明らかになったように、グルコース-6-リン酸脱水素酵素(G6PD)欠損細胞やG6PDノックアウト細胞(NADPHの減少に伴う細胞内酸化還元力の低下を伴う)は、コロナウイルス感染に対してより高い感受性を示している。実際、細胞内酸化ストレスはコロナウイルスの複製に適切な環境を提供する[48]。また、これらの細胞は抗ウイルス反応を起こす能力が低いことを示している [49]。実際、酸化ストレスの標的化をコロナウイルス感染症の治療戦略として提案することを納得させるもう一つの理由は、G6PD欠損とコロナウイルス感染症(HCoV-229E)との関連性に関する以前に発表された報告に関連している。前に述べたように、RNAウイルスは、一般に、持続的なウイルス複製のための適切なヌクレオチドレベルおよび酸化還元力(NADPH)を提供するPPPをアップレギュレートする。いくつかの研究は、それにもかかわらず、私たちにこの経路(コロナウイルスの場合)を何か別の方法で見させ、コロナウイルスの複製のためのこの経路の全体的な有益な効果についての私たちの一般的な見解を取るようにした。よく知られているように、PPPの酸化相は、その鍵となる酵素がG6PDであり、NADPH産生を介して細胞に十分な酸化還元力を供給する上で重要な役割を果たしている。したがって、この重要なPPP酵素を欠いた細胞は、酸化ストレスに対抗する能力が低い。一方、G6PDを欠損した細胞は、HCoV-229E(SARSの原因となるコロナウイルス)に感染しやすいことが示されている。2008年にWuらによって行われた研究では、G6PD欠損細胞およびG6PDノックダウン細胞は、HCoV-229Eに感染すると、ウイルス遺伝子の発現およびウイルス粒子の産生が非常に高くなることが示された。これらの現象は酸化物質の産生量の増加と関連しており、コロナウイルス感染の重要な因子として宿主細胞の酸化ストレスを表していると考えられた。さらに、これらの研究者らは、抗酸化剤がG6PD欠損細胞のウイルス感染の増加を改善できることを実証した。この研究は、宿主細胞の酸化還元状態がウイルス感染性に重要な役割を果たしているという証拠を提供している[48]。この報告と一致するように、2015年にこれらの研究者は、この興味深い現象の根底にあるメカニズムを解明しようとした。彼らは、正常な細胞では、ウイルス感染はIκBの分解、したがってNF-κB転座を誘発し、抗ウイルス応答を促進し、ウイルスの複製を抑制することを示した。しかし、G6PD 欠損細胞では、NADPH/NADP+ 比が低下し、NADPH センサーとして HSCARG 蛋白質がアップレギュレーションされることを発見した。このタンパク質は、抗ウイルス遺伝子である腫瘍壊死因子α(TNF-α)やGTPase myxovirus resistance 1(MX1)の発現に関与するNF-κBシグナル伝達経路に悪影響を与える。したがって、G6PD欠損細胞でのPPPのアップレギュレーションは、抗ウイルス応答の障害をもたらし、その結果、HCoV-229Eの複製が増強された[49]。PPPは主要な細胞抗酸化防御システムである[50]。PPPは、グルコース代謝の最初のコミットされたステップでの解糖に由来し、リボヌクレオチド合成に不可欠であり、NADPHの主要な供給源でもある。NADPHは活性酸素の効率的な消去に必要である。実際、PPPの増加は、活性酸素レベルの上昇の結果として、細胞内酸化ストレスに対処するための細胞機構と考えることができる。したがって、この経路をアップレギュレートし、この感染症において活性を維持することは、活性酸素の有害な影響を減少させるために不可欠であるように思われる。
この感染症におけるPPP活性の増加の利点を示すもう一つの証拠は、オートファジープロセスに関連している。オートファジーはコロナウイルスの複製において重要な役割を果たすことが示唆されている[51]。宿主細胞の細胞質におけるコロナウイルスマウス肝炎ウイルス(MHV)のRNA複製は、DMVで行われる。Prentice Eらは、MHV感染細胞におけるDMV結合型複製複合体の形成にはオートファジーが必要であり、DMV形成により複製効率が著しく向上することを報告している[51]。また、オートファジーの増加は、細胞内の酸化還元力の低下に起因すると考えられている。G6PDの阻害は、オートファジーのフラックスの調節障害に関与するERストレスを誘導することが示されている。G6PD阻害は、mTORの状態とは無関係にオートファゴソーム形成の一定の増加をもたらすことが示されている[52]。同様に、PPP阻害はオートファジー誘導につながることが示唆されている。また、非重症のCOVID-19に対して有効性を示すクロロキンリン酸塩は、オートファジーを阻害することでウイルスの複製を抑制することが示唆されている[53]。クロロキンは宿主細胞のリソソームのpHを上昇させ、ウイルスがリソソームを酸性化しようとするのに対処する。リソソソームの酸性化は、細胞が自分自身を食べるために使用するオートファゴソームを形成するために必要である[54]。クロロキンはオートファジーを阻害することでウイルスの複製を抑制することができる[55]。
それにもかかわらず、PPPの増加に伴うNADPHの増加は、NADPHには二重の活性があるため、二刀流である可能性があることに留意すべきである。抗酸化系の燃料としての役割に加えて、NADPHは、NADPHオキシダーゼ(NOX)の基質として作用することでプロオキシダント効果を発揮し、それによって肺障害を引き起こし、SARS-CoV-2の感染性を促進する。一方、多形核白血球(PMN)およびマクロファージは、微小血管を介して炎症部位に浸潤すると、原炎症性サイトカインおよび活性酸素を含む細胞障害因子を分泌することができる。これらのメディエーターは、循環から間質空間および肺胞への体液の漏出につながる内皮および上皮の機能不全に寄与する[56]。研究では、グルコースの過剰な進入がPPPを介して流用され、NOXの基質を追加的に提供することで、炎症を悪化させるプロオキシダント環境をもたらすことが示されている[57]。このように、増加したPPPフラックスは、NOX酵素に追加の基質を提供することにより、炎症を悪化させるプロオキシダント環境をもたらすことができる。また、NOX1およびNOX2の欠失は、マクロファージによる活性酸素産生の劇的な減少をもたらす[56]。したがって、NOXの標的化は、宿主細胞の酸化ストレスを減少させるだけでなく、マクロファージや他の炎症性細胞の活性酸素産生能力を緩和するための適切な戦略を表している。このような観点から、PPPをアップレギュレートし、酸化ストレスに対抗するために高いNADPHレベルを提供するだけでなく、同時に、NOX阻害を介して前述のプロオキシダント経路へのNADPHの侵入を防止する薬剤を利用することが推奨される。
上述したように、PPPの阻害はオートファジー誘導をもたらす。したがって、本研究で示唆されたように、この経路を活性に保つか、またはアップレギュレーションすることは、ウイルスの複製を防ぐためにオートファジーを減少させる役割を果たす可能性がある。
3.1. COVID-19における解糖介入
記載されているように、解糖介入は、リポジェネシスのダウンレギュレーションを目的としている。リポジェネシスはウイルスのパッケージングに必要である。解糖介入は、ピルビン酸の産生およびTCAサイクルへの進入を阻害し、それによってリポジェネシスを減少させる。通常、解糖は、アナボリックリポジェネシスのためのTCAサイクルの追加の中間体を提供するために必要である。
他のウイルスと同様に、脂質はコロナウイルスのライフサイクルにおいて重要な役割を果たしている[34]。脂質は、ウイルスのライフサイクルの様々な段階で重要な役割を果たしている。第一に、脂質は、細胞表面またはエンドソームにおいて、非エンベロープ型およびエンベロープ型ウイルスの直接受容体または侵入補因子として作用することができる[58,59]。第二に、脂質および脂質合成は、VRCの形成および機能の両方において重要な役割を果たす [60,61]。第三に、脂質代謝は、効率的なウイルス複製に必要なエネルギーを生産することができる[62]。さらに、脂質は、ウイルスタンパク質の適切な細胞内分布、およびウイルス粒子の輸送、包装、および放出を決定することができる[63,64]。このように、宿主の脂質生合成代謝経路は、ウイルスの伝播を調節する上で重要な役割を果たしている。
3.1.1. 解糖阻害剤
表1[18][65][66][67][68][69][70][71][72][73][74][75][76][77][78][79][80][81][82][83][84][85][86][87][88][88][89][90]に概略的に記載されているとおりである。[91], [92], [93], [94], [95], [96], [97], [98], [99], [100], [101], [102], [103], [104], [105], [106], [107], [108], [109], [110], [111], [112], [113], [114], [115], [116], [117], [118], [119], [120], [121], [122], [123], [124], [125], [126], [127], [128], [129], [130], [131], [132], [133], [134], [135], [136], [137], [138], [139], [140], [141], [142], [143], 144]、[145]、[146]のように、与えられたウイルスによって誘導される特定の変化に関する我々の知識は、細胞培養および生体内試験モデルにおけるウイルス複製を標的とするための多くの戦略を導いてきた。したがって、その非常に確立された良好な副作用プロファイルを考えると、特にアスコルビン酸(ビタミンC)は有望な化合物であると思われる。
表1. 解糖阻害剤
阻害剤 ターゲットウイルス
2-DGホスホグルコース異性化酵素RV
エイズ
エイチシーエムブイ
STO-609
化合物C
AICAR CaMKK
AMPK
AMPK HCMV
オキサメート乳酸脱水素酵素 KSHV
VU0359595 PLD-1 HIV
フロレチンGLUT1 ジカウイルス(ZIKV
ケルセチンGLUT1 H5N1,C型肝炎ウイルス(HCVHBV、インフルエンザAウイルス(IAV)H1N1,DENV-2,HSV-1,ポリオウイルス1型、Pf-3,RSV、ZIKV、EV71,HIV
STF31 GLUT1
WZB117 GLUT1
ファセンチンGLUT1
アピゲニンGLUT1 ASFV、EV71,HSV-1・HSV-2,インフルエンザ、C型肝炎ウイルス、ウイルス、手足口病ウイルス
ゲニステインGLUT1 Bウイルス、HSV-1,アレナウイルス、H1N1,H9N2,ASFV、ヒト免疫不全1型ウイルス
オキシムベースのGLUT1阻害剤 GLUT1 ・・阻害剤を使用している。
ピロリジノン由来のGLUT1阻害剤 GLUT1 ・阻害剤
DNA損傷性抗がん剤GLUT3 ・抗がん剤
GSK-3阻害剤 GLUT3
リトナビルGLUT4 HIV/AIDS
シリビニン・GLUT4 C型肝炎ウイルス、HSV-2,HBV、デングウイルス、インフルエンザウイルス、トガウイルス(チクングニアウイルス、マヤロウイルス
3-(3-ピリジニル)-1-(4-ピリジニル)-2-プロペン-1-オン]3PO PFKFB3
N4A PFK2
YZ9 PFK2
PGMI-004A PGAM1
MJE3 PGAM1
TT-232 PKM2
シコニン/アルカニンPKM2 HIV 1型、AdV3,H1N1
FX11 LDHA ・FX11 LDHA
3-ブロモピルビン酸(3BP)ヘキソキナーゼII
ジクロロアセテート(DCA)PDHK1
ジアリールスルホンアミド(DASA-58)(DASA)PDHK1-.
オキサム酸 LDH
NHI-1 LDH A
PFK158 PFKFB3 ・・Μετετεώγραμμαμαώγραμαμα
2-デオキシグルコース(2-DG)HK HSV-1
フッ化ナトリウム(NaF)エノラーゼインフルエンザウイルスA/PR8/34(H0N1ポリ骨髄炎ウイルス
NaFとEDTAエノラーゼの添加と組み合わせた血液の酸性化-。
フッ化ナトリウム-シュウ酸カリウム(NaF-KOx)エノラーゼ
ヒ酸塩化合物グリセルアルデヒド-3-リン酸デヒドロゲナーゼ-ヒ酸塩脱水素酵素
ソルビニル アルドース還元酵素阻害剤
ガロフラビン乳酸脱水素酵素阻害剤 ・ガロフラビン乳酸脱水素酵素阻害剤
ロニダミンのミトコンドリアHK2
3-BrOPとラパマイシンヘキソキナーゼIIの組み合わせ-。
MGCD265とエルロチニブヘキソキナーゼIIの併用 エルロチニブ休薬後のB型肝炎ウイルスの再活性化
ジヒドロアルテミシニンピルビン酸キナーゼM2
AZD8055 mTOR
エタノールヘキソキナーゼとα-グリセロリン酸脱水素酵素 インフルエンザウイルス、感冒ウイルス、HIV
アレナマイシン(ペンタレノラクトン)グリセルアルデヒド3-リン酸デヒドロゲナーゼ
ソラフェニブマルチキナーゼリフトバレー熱ウイルス、HCVウイルス、シンドビスウイルス、チクングニアウイルス、EEEV、B型肝炎ウイルス
1-メチルトリプトファンインドールアミン2,3-ジオキシゲナーゼMHV-A59,HIV、HBV、HCV、ヘルペス、CMV
ヨード酢酸グリセルアルデヒド-3-リン酸脱水素酵素 センダイウイルス、子孫ウイルス、ジャガイモウイルスX
ヨードアセトアミドグリセルアルデヒド-3-リン酸脱水素酵素ウシ白血病ウイルス、タバコモザイクウイルス、ラウシャー白血病ウイルス、RSウイルス、ポリオウイルス、サイタコーシスウイルス、コオロギ麻痺ウイルス
アスコルビン酸がエネルギーの流れをブロックしてくれた。
LY294002 PI3K C型肝炎ウイルス
Pt3glcとLY294002 PI3K
マンノヘプツロースグルコキナーゼ阻害剤
ヨード酢酸グリセルアルデヒド-3-リン酸脱水素酵素VSV、仙台ウイルス、HSV-1
マロン酸コハク酸脱水素酵素 インフルエンザ・ヘルペスウイルス、麻疹ウイルス
FTS HIF1α発現 EMC-Dウイルス
乳酸PI3K ・乳酸PI3K
FK866 NAMPT ・Μετετεώγραμμαμαμαμα
6-AN G6PD ワクチニアウイルス
オキシチアミンTKTL1
ペンタレノラクトングリセルアルデヒド-3-リン酸脱水素酵素 HSV-1, HSV-2, Vac-IHD, Vac-DIE, NDV, VSV, WEE
化合物C AMP活性化プロテインキナーゼHCMV
FUT-175補体阻害剤
ルテオリンHEK2デングウイルス、インフルエンザAウイルス、HIV-1,B型肝炎ウイルス、シュードラビースウイルス、エプスタインバーウイルス、日本脳炎ウイルス、チクングニアウイルス
キノリン3-スルホンアミドLDHA ・・キノリン3-スルホンアミドLDHA ・キノリン3-スルホンアミドLDHA
3.1.1.1. ビタミンC(アスコルビン酸)
高用量のビタミンCまたはアスコルビン酸は、上流の解糖代謝物およびPPP代謝物の増加と下流の解糖代謝物の減少を含む代謝経路の変化を示している。したがって、このビタミンは解糖阻害剤として考えられる[147]。
ビタミンCは、ウイルス感染力を低下させることにより、DNAおよびRNAウイルスの不活化剤として使用することができる[148,149]。さらに、アスコルビン酸は、痛みや炎症の原因となるウイルス生成物を解毒することができる[150]。風邪(ライノウイルス)[151]、インフルエンザ[152,153]、ジカ[154]、およびチクングニア[155,156]を含むウイルス感染症に対して、ビタミンCの高用量静脈内注射が有効であることが示されている。ビタミンCの経口補給(3g以上の用量で)もまた、呼吸器感染症および全身感染症の予防および治療の両方に有効であるようである[157]。
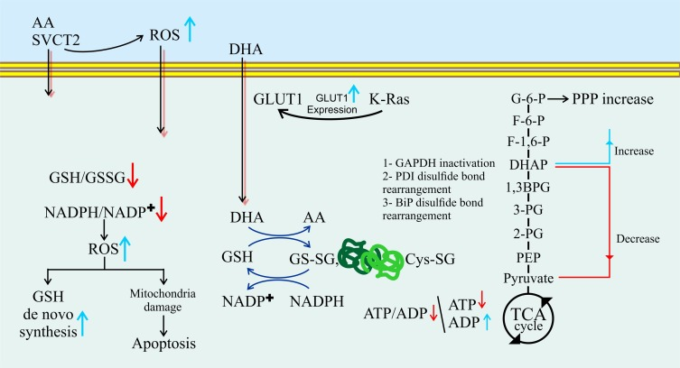
GLUTおよびナトリウム依存性ビタミンCトランスポーター(SVCT)1および2を含む2つの輸送タンパク質ファミリーがビタミンCの取り込みを媒介する。GLUTs、主にGLUT1とGLUT3はデヒドロアスコルビン酸(DHA)を細胞内に輸送し、SVCTは還元型ビタミンCを直接細胞内に輸送する(図2)[158,159]。
図2. ビタミンCの細胞内酸化還元代謝およびグルコース代謝への影響。
3.2. COVID-19におけるTCA介入
TCAサイクルは、ウイルスの持続的な増殖に不可欠なリポジェネシス[46]のプロセスにアセチル-CoAという燃料を供給する。したがって、リポジェネシスを標的とすることで、ウイルス複製の効果的な阻害への道が開かれる可能性がある。
3.2.1. TCA阻害剤
表2[21]、[160]、[161]、[162]、[163]、[164]、[165]、[166]、[167]、[168]、[169]、[170]、[171]に示すとおりである。[172], [173], [174], [175], [176], [177], [178], [179], [180], [181], [182], [183], [184], [185], [186], 187]、[188]、[189]、[190]、[191]、[192]、[193]、[194]、[195]、[196]、[197]、[198]、[199]、[200]、[201]、[202]、[203]、[204]、[205]、[206]、[207]のように、抗ウイルス活性を有するクレアサイクル阻害剤は数多く存在する。ここで、メトホルミンは、その確立された良好な副作用プロファイルおよび抗ウイルス活性によれば、[[208], [209], [210], [211], [212], [213], [214], [215]]、有望な化合物であると思われる。
表2. TCA阻害剤
阻害剤 酵素 VIROUS
H2O2 アコニターゼ、α-ケトグルタル酸脱水素酵素狂犬病ウイルス、植物ウイルス、インフルエンザA・B型、ライノウイルス1A・1B・7型、アデノウイルス3・6型、アデノウイルス4型、ミクソウイルス、呼吸器同期ウイルス株ロング、コロナウイルス株229E
AG-120(イボシデニブ)IDH1
AG-221 IDH2
ノバルティス-530 IDH1
FX 11 LDH-A
ジクロロアセテート(DCA)PDK
miR-26a PDHXインフルエンザAウイルス、ネコヘルペスウイルス1,呼吸器症候群ウイルス
miR-146b-5p PDHB ヒト乳頭腫ウイルス16,デングウイルス(DENV)
miR-370 PDHB B型肝炎ウイルス、日本脳炎ウイルス
miR-137 ASCT2
miR-183 IDH2 小水疱性口内炎ウイルス(VSV
miR-181a IDH1 LCMV
フマル酸塩PHD2
コハク酸PHD2
2-ヒドロキシグルタル酸α-KG依存性ジオキシゲナーゼ ・2-ヒドロキシグルタル酸α-KG依存性ジオキシゲナーゼ
アロキサンミトコンドリアアコニターゼ、コハク酸デヒドロゲナーゼ-。
チオレドキシンコハク酸脱水素酵素とフマラーゼ&ATP-クエン酸リアーゼH9N2鳥インフルエンザウイルス
6-ジアゾ-5-オキソ-L-ノルロイシングルタミン分解おたふくかぜ・小水疱性口内炎ウイルス、ヒトパラインフルエンザウイルス2型(HPIV-2NSV
CB-839 GLSアデノウイルス、HSV-1,インフルエンザA
CPI-613 PDHとKGDHC ・Μετετεώγραμμμαώγραμαμαμαμα
エナシデニブ(AG-221)IDH2
AG-881 IDH1とIDH2 ・IDH1とIDH2
AG-221 IDH2-R140およびIDH2-R172
オキサロマル酸オキソグルタル酸デヒドロゲナーゼ、アコニテートヒドラターゼ、イソクエン酸デヒドロゲナーゼ-。
γ-ヒドロキシ-α-オキソグルタル酸オキソグルタル酸デヒドロゲナーゼ、アコニテートヒドラターゼ、イソクエン酸デヒドロゲナーゼ-。
グリオキシル酸ピルビン酸オキシダーゼおよびα-オキソグルタルオキシダーゼおよびコハク酸オキシダーゼとして暫定的に使用されている。
フルオロ酢酸アコニターゼインフルエンザウイルス
3-BrPAイソクエン酸デヒドロゲナーゼ、α-ケトグルタル酸デヒドロゲナーゼ、コハク酸デヒドロゲナーゼ-。
マロン酸コハク酸ナトリウム脱水素酵素
ナトリウムヒ酸ピルビン酸デヒドロゲナーゼWTまたはNS1変異体ウイルス、PEDV
メトホルミンとフェノホルミンのミトコンドリア複合体1 *。
D-マレイン酸フマラーゼ
クエン酸フマラーゼ
D-酒石酸フマーラーゼC型肝炎ウイルスNS5A
L,a-ヒドロキシ-β-スルホプロピオン酸フマラーゼ
マレイン酸フマラーゼ インフルエンザウイルス、デングウイルス
メサコン酸フマラーゼ
トランスコニートフマラーゼ
コハク酸フマラーゼ
マロン酸フマラセ
アジピン酸フマラセ
グルタル酸フマラーゼ
グリシンフマラーゼ
ヒ素化合物 ピルビンオキシダーゼ、コリンデヒドロゲナーゼ、コハクデヒドロゲナーゼ ・ヒ素化合物
ヘマチンコハク酸脱水素酵素 ・ヘマチンコハク酸脱水素酵素
シアン化コハク酸脱水素酵素 ・シアン化コハク酸脱水素酵素
銅イオン コハク酸脱水素酵素インフルエンザAウイルス
マレイン酸コハク酸デヒドロゲナーゼ・アフス熱ウイルス
ジエチルジチオカルバミン酸ナトリウム(DDC) コハク酸脱水素酵素 HIV・エイズ
3.2.1.1. メトホルミン
メトホルミンは多元作用を有する薬物として、主に肝臓のグルコース産生を阻害することにより、グルコースの恒常性維持に関与している[216]。また,0件の研究では、メトホルミンはCOVID-19による死亡率の減少と有意に関連していることが明らかになった[217]。メトホルミンは、TCAサイクルへのグルコースおよびグルタミン由来の代謝中間体の流れを低下させることで、クエン酸産生およびde novo脂質生合成を減少させる。メトホルミンはミトコンドリアに直接作用してTCAサイクルの活性と酸化的リン酸化を抑制し、細胞が乳酸産生に有利なグルコース由来の炭素をより少ない量で受け入れるように導く[218]。メトホルミンは、ミトコンドリアの電子輸送鎖の複合体Iを阻害することで、細胞にエネルギーストレスをもたらす。これは、NADH酸化とTCAフラックスの減少を引き起こし、TCA代謝物の低レベルをもたらす。したがって、メトホルミンは間接的に細胞のリポジェネシスを阻害する(図3)[219]。
図3:メトホルミンによるTCAサイクル介入
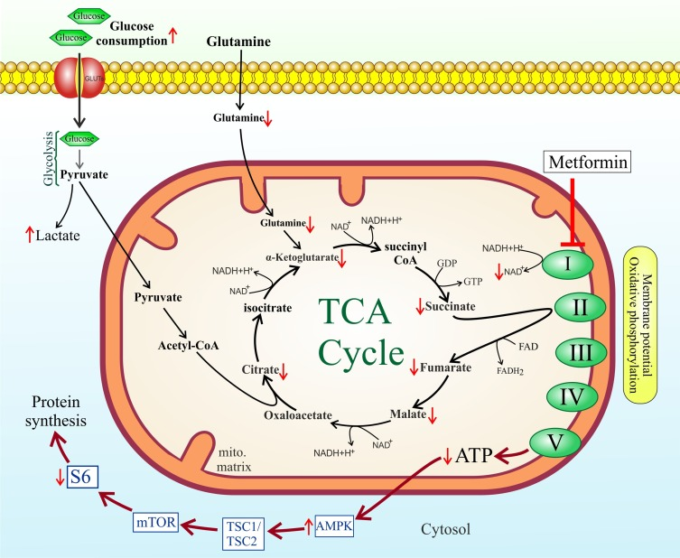
一方、メトホルミンはまた、直接的に脂肪形成を阻害する。メトホルミンの直接的な抗脂肪原性活性は、ATPクエン酸リアーゼ(ACLYアセチル-CoAカルボキシラーゼ(ACC脂肪酸合成酵素(FAS)複合体、3-ヒドロキシ-3-メチル-グルタリル-コエンザイムA還元酵素(HMG-CoA)を含む主要な代謝酵素の阻害を介して媒介される[220]。特筆すべきは、メトホルミンは、NOX活性を抑制することにより、活性酸素の産生を阻害することである[221]。これは、我々が提案しているCOVID-19の治療プロトコルに関する重要な特徴であり、NOX基質として作用することにより、細胞内の高いNADPHレベル(アップレギュレートされたPPPの結果として)は、酸化ストレスをもたらし、感染細胞内でのウイルスの複製を促進するだけでなく、ARDSの原因となる肺胞腔でリクルートされた炎症性細胞によるROS産生を増強することができる。
4. COVID-19関連の酸化ストレスの抑制
急性臓器不全、特に肺不全(ARDS)は、COVID-19に関連した死亡率の主要なメカニズムである[222,223]。サイトカインやフリーラジカルなどの急速な放出による酸化ストレスの大幅な増加は、細胞傷害、臓器不全、および死をもたらすARDSの特徴である[44]。したがって、高用量の抗酸化物質、特にビタミンCの早期摂取は、このような患者の管理において重要な役割を果たしている。したがって、コロナウイルスがパンデミックしている場合には、指導者と直接援助患者を提供するすべての人は、迅速かつ勇気を持って高用量のビタミンCの静脈内投与を行うことが推奨される。
サイトカインストーム」の結果としての酸化ストレスの増加は、このパンデミックウイルス感染症の高い死亡率の主な病理学的原因としてARDSをもたらする。サイトカインストーム誘発性ARDSは、これらの患者の死亡原因となる重要な病的イベントである[44]。ビタミンCは細胞応答における抗酸化システムの重要な構成要素である[225]。Fowlerらは、ライノウイルスとエンテロウイルスD68によるウイルス性ARDSを発症した26歳女性を報告している[226] Hemilaらは、ジャーナル「Nutrients」に掲載された18の臨床研究の2019年のメタアナリシスによると、ビタミンCはICU滞在を短くすると報告している[227]。彼らの報告では、1766人の患者のサブグループにおいて、ビタミンCはICU滞在期間を97.8%短縮した。Marikらは、敗血症のICU症例47例にビタミンCを静脈内投与したことを報告している。その結果、ビタミンCを静脈内投与された患者群では死亡率が大幅に減少していることが明らかになった[228]。
図4. ARDSにおける肺胞上皮と微小血管内皮の機能低下
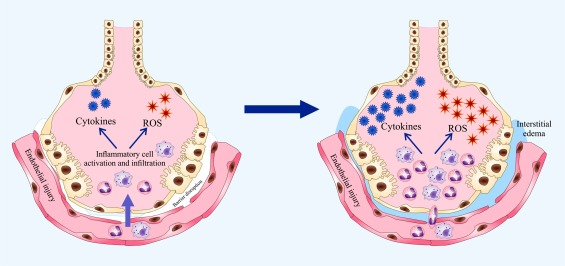
微小血管は、炎症部位への多形核白血球(PMN)やマクロファージの浸潤を亢進させ、炎症性サイトカインや活性酸素などの細胞障害因子の放出を増加させる。これらの放出されたメディエーターは、内皮および上皮の機能不全を引き起こし、循環から間質空間および肺胞への体液の漏出を引き起こす。これらのイベントが組み合わさると、肺水腫およびガス交換障害が生じる。
機械換気を受けている患者では、食事性抗酸化物質(ビタミンCおよびスルフォラファン)が酸化ストレス誘発性急性炎症性肺障害を減少させることが示されている[229]。その他の抗酸化物質(クルクミンなど)もまた、肺炎において有望な抗炎症作用を示すことが示されている[230]。
これらの報告に基づいて、高用量の抗酸化物質(ビタミンCのようなもの)を用いて、再燃性のCOVID-19関連の酸化ストレスを標的とすることは、病原体特異的な薬剤やワクチンを長く待つことなく、この壊滅的なパンデミックの即時管理における論理的なステップであるように思われる。また、メトホルミンは、活性酸素および一酸化窒素(NO)レベルを減少させ、スーパーオキシドディスムターゼ(SOD)などの抗酸化系を増加させることが示されている[231]。
ビタミンCは、フリーラジカルを産生することができるマイルドなプロオキシダントとして機能し、その結果、ミトコンドリアの生合成を誘導する。ミトコンドリアの生合成は、解糖と酸化的リン酸化に必要な代謝酵素を増強し、その結果、より大きなミトコンドリアの代謝能力を生み出す。アジスロマイシンとドキシサイクリンのミトコンドリア生合成への影響を調べた研究で示されたように、これらの抗生物質の低用量投与はミトコンドリア生合成を阻害することができた[232]。また、アジスロマイシンとドキシサイクリンは抗ウイルス活性を示す[[233]、[234]、[235]、[236]、[237]、[238]、[239]、[240]、[241]]。
5. 結論
2020年の新型コロナウイルスSARS-CoV-2のパンデミック大パンデミックは、有効な治療薬の発見が早急に必要とされている[242]。現在のところ、SARS-CoV-2感染症に対する明確で有効な治療法はない。急性臓器不全、特に肺不全(急性呼吸窮迫症候群またはARDS)は、SARS-CoV-2感染による致死率を支配する主要な病因メカニズムである。フリーラジカルやサイトカインなどの急激な放出による酸化ストレスの著しい増大はARDSの特徴であり、細胞傷害、臓器不全、そして最終的には死に至る[222,223]。また、G6PD欠損細胞のコロナウイルス(HCoV-229E)感染に対する感受性が高いことに関する最近の論文によると、宿主細胞の酸化ストレスはコロナウイルス複製のための適切な環境を提供している[48]。したがって、COVID-19患者における活性酸素レベルの低下は、この疾患に対する治療戦略であると思われる。もう一つの治療戦略は、ウイルスの複製を防ぐことである。これらの両方の側面を取り入れた治療的アプローチは、最適な治療法と考えられる。
抗酸化作用を持つビタミンCは、活性酸素を減少させることが知られている。しかし、ウイルスの複製を止めることはできるのであろうか?
我々は、酸化ストレスがコロナウイルスの感染を促進することが明らかになっているように、ビタミンCをCOVID-19治療に用いることで、細胞外空間(肺胞空間)におけるARDSの原因となる酸化ストレスの増大による危険な悪影響を直接的に打ち消すだけでなく、解糖を阻害し、PPPや細胞内NADPHをアップレギュレートして、より高い細胞内酸化還元状態を作り出すことで、SARS-CoV-2の感染性を低下させることを目的としている。また、最近、G6PD遮断によるオートファジー誘導効果がウイルス複製を増加させることが報告されていることから、PPPアップレギュレーションもこのオートファジーを介したメカニズムでSARS-CoV-2複製に対応している可能性が高いと考えられる。しかし、コロナウイルス感染症のこの側面については、今後のさらなる研究が必要である。したがって、高用量の抗酸化剤、特にビタミンCの早期使用は、これらの患者の管理において重要な役割を果たしている。ある研究では、少量のビタミンC(1日200mgのビタミンC)を補充することで、重症で入院している呼吸器疾患患者の死亡が80%減少したという結果が出ている[227]。ビタミンCを投与されたウイルス性肺炎の乳児の死亡率の減少が示されている [243]。1766人の患者のサブグループでは、中等度のビタミンC投与によりICU滞在期間が97%短縮された [227]。SARS-CoV-2感染の主な危険性は、SARSや肺炎への病勢進行である。1940年代以降、医師はウイルス性肺炎に対してビタミンCを使用することに成功している[244]。
複製するために、RNAウイルスは解糖と糖質分解の両方をアップレギュレートし、同化性脂肪形成に必要なTCA中間体を宿主細胞に提供する。これまでに中国から世界に広がり、致死的な結果をもたらしてきた新型コロナウイルスSARS-CoV-2もRNAウイルスである[6]。また、ライノウイルス感染と同様に、RNAウイルス感染後にはPPPフラックスが高くなることが示唆されている[245]。このように、これらの代謝経路を阻害・調節することで、ウイルス複製の抑制に寄与する可能性がある。しかし、コロナウイルスに関しては、感染細胞におけるこの代謝経路の正確な状態に関する直接的で明確なデータは少ない。むしろ、最近のデータでは、細胞内酸化ストレスがコロナウイルス感染に寄与していることが明らかになっており、コロナウイルス感染時のこの代謝経路の正確な役割と状態が疑問視されている。この観点から、PPPのアップレギュレーションは、NADPHレベルを高め、細胞内の酸化還元力を増強することで、コロナウイルスの複製を阻害することが示唆されている。しかし、SARS-CoV-2自体は、肺上皮細胞におけるこの経路をどのように操作しているのだろうか?この反応は、SARS-CoV-2感染後のPPPの綿密な評価の背後に隠れており、この点でのより詳細な調査を保証するものである。しかし、酸化ストレスがコロナウイルス感染を促進するという報告から、感染した宿主細胞におけるPPPのアップレギュレーションが治療メカニズムとして示唆されている。
ビタミンCは、細胞がグルコースをエネルギーに変換する代謝経路である解糖を阻害する。記載されているように、持続的複製のためのRNAウイルスは、解糖およびグリコーゲン分解を増加させ、それにより、同化リポジェネシスに必要なTCA中間体を提供する[245]。したがって、ビタミンCによる解糖経路の遮断にもかかわらず、TCAサイクルに連結された他の経路(一部のアミノ酸の異化作用のような)はまだ開いたままである。したがって、ビタミンC(間接的にTCAサイクルをダウンレギュレートする)に加えて、ウイルスの複製を阻害するには、TCAサイクルをブロックすることができる別の物質が必要である。
我々は、アップレギュレートされたPPPがSARS-CoV-2感染において抗ウイルス効果を発揮する可能性を提案する。SARS-CoV-2感染症では、活性酸素の増加が重要な役割を果たしているため、PPPの増加が治療戦略の一つと考えられている。RNAウイルスに感染した細胞は、直ちにPI3K依存性の方法でグルコース取り込みをアップレギュレートする。並行して、感染した細胞は、PI3K制御されたGLUT1の発現を増大させる[17]。解糖経路を遮断する際に考慮すべきポイントは、PPPを活性化し続けるためにはこのトランスポーターが必要なので、GLUT1を阻害しない阻害剤を使用することである。2-デオキシグルコース(2-DG)は、その確立された良好な副作用プロファイルおよび抗ウイルス特性を考慮すると、この点で有望な化合物であるように思われる。2-DGはビタミンCに比べて抗酸化作用はないが、むしろ酸化ストレスを誘発する[246]。したがって、抗酸化剤としてのビタミンCと解糖経路の阻害剤としてのビタミンCは、PPPのアップレギュレーションに同時に効果があり、このウイルス感染症の治療に良い選択肢となり得る。
PPPがアップレギュレーションされると、ウイルスの複製に必要なリボヌクレオチドの産生が増加する。ウイルスはその複製を宿主細胞のリポジェネシスに依存しているため、リポジェネシスを標的とすることで、大量のリボヌクレオチドの存在下でもウイルスの複製を阻害することが推測される。この意味では、クレブスサイクル遮断によるリポジェネシスの阻害が考えられる。上述したように、ウイルス複製の阻害にはTCAサイクル遮断が必要である。この目的のためにメトホルミンが導入されている。メトホルミンは、ミトコンドリアのTCAサイクル中間体を減少させるだけでなく、リポジェネシスを直接阻害する[219,220]。メトホルミンはNOX活性を抑制するので、その摂取は、より高い活性酸素の発生(炎症性細胞の有害な機能に寄与)や細胞内酸化ストレスの発生(宿主細胞におけるSARS-CoV-2感染性の増加に寄与)という点で、細胞内のNADPHレベルが高いことによる潜在的な危険な影響を(PPPのアップレギュレーションによる)回避することができるだろう。一方、ビタミンCはマイルドなプロオキシダントである。したがって、フリーラジカルを産生し、その結果、ミトコンドリアの生合成を誘導することができる。これは、細胞にTCAサイクルフラックスを担当するより多くの工場を提供することにより、SARS-CoV-2複製に有利に作用し、その結果、脂肪形成の増加につながる可能性がある。この影響を回避するために、ミトコンドリアの生合成を阻害し、ミトコンドリアのタンパク質翻訳を阻害する戦略を提案する。アジスロマイシンやドキシサイクリン(またはその両方)を低用量(抗生物質耐性を免れる)で使用することで、ミトコンドリアの生合成を阻害することが示されている。また、アジスロマイシンとドキシサイクリンは、標的外の副作用として、ミトコンドリアの大きなリボソームと小さなリボソームをそれぞれ阻害する可能性がある[232]。さらに、これらの抗生物質は抗ウイルス活性も有している[[233]、[234]、[235]、[236]、[237]、[238]、[239]、[240]、[241]]。
ビタミンC、メトホルミン、およびドキシサイクリン/アジスロマイシンの組み合わせは、この感染症の有効な治療法として役立つことが示唆されている。これらの化合物は無毒であるため、この治療戦略を最小限の副作用で適用できることを期待している。なお,世界的にパンデミックしているパンデミックウイルスの感染症治療への応用は,まだ仮説の段階であり,最終的には臨床的なエビデンスの裏付けが必要であると考えている。
