Contents
Calming the Storm: Natural Immunosuppressants as Adjuvants to Target the Cytokine Storm in COVID-19
オンラインで公開 20211月27日
Angela E. Peter, 1 ,* B. V. Sandeep, 1 B. Ganga Rao, 2 and V. Lakshmi Kalpana 3
要旨
COVID-19パンデミックは世界的な健康危機を引き起こしている。この感染症を治療するための特効薬となる抗ウイルス剤はなく、予防するための適切なワクチンも存在していない。SARS-CoV-2に感染した患者の中には、うまく調整された免疫反応を示して回復する人もいれば、ARDS、敗血症、MOFなどの重篤な合併症を引き起こし、罹患率や死亡率が高くなる人もいるという。免疫反応が機能しない患者では、「サイトカイン・ストーム」と呼ばれるサイトカインやケモカインの大量放出が起こることが研究で明らかになっている。その結果、TNF-α、INFγ、IL-1β、IL-2,IL-4,IL-6,IL-7,IL-9,IL-10,IL-12,IL-13,IL-17,G-脳脊髄液、GM-脳脊髄液、M脳脊髄液、HGF、ケモカインであるCXCL8,MCP1,IP10,MIP1α、MIP1βなどの炎症性/調節性サイトカインやケモカインが高濃度に放出される。このサイトカイン・ストームを標的とすることは、感染部位で観察されるこのサイトカインの過剰な流入と、その後の悲惨な結果を緩和するための、新規で有望な治療戦略である。
クルクミン、ルテオリン、ピペリン、レスベラトロールなどの植物由来の天然免疫抑制化合物は、炎症性サイトカインおよびケモカインの産生および放出を抑制することが知られている。この抑制効果は、サイトカインやケモカインの産生・放出に関与するNF-κB、JAK/STAT、MAPK/ERKなどのシグナル経路を変化させることによってもたらされる。これらの天然の免疫抑制剤をアジュバントとして使用してサイトカインストームを改善することは、現在使用されている抗ウイルス剤やその他の治療薬と組み合わせて、COVID-19の治療と効果的な治癒のための新しい相乗効果のあるアプローチを提示する。
この総説では、SARS-CoV-2感染症で観察されるサイトカイン・ストームの免疫病因を簡単に説明し、COVID-19疾患の治療にアジュバントとして使用できるいくつかの天然免疫抑制剤について詳しく述べる。
キーワード
COVID-19,サイトカイン・ストーム、免疫調整剤、植物由来の免疫抑制剤、アジュバント
はじめに
2019年12月に中国の武漢で、新規βコロナウイルスであるSARS-CoV-2によるコロナウイルス感染症2019(COVID-19)が初めて報告された(Wang er al)2020a)。世界中に急速に広がったこのアウトブレイクは 2020年1月30日に世界保健機関によって「国際的に懸念される公衆衛生上の緊急事態」として宣言された(世界保健機関 2020a)。現状の現実と課題は、この病気を治療・治癒するための特効薬がなく、また、この病気から予防するためのワクチンもないことである(本レビュー投稿時)(世界保健機関 2020b)。
COVID-19疾患の特徴の一つは、患者に見られる複雑な免疫機能障害である。この免疫機能障害は、有害な臨床症状を引き起こし、臓器傷害、その結果としての臓器不全、そして最終的には死亡率につながる(Giamarellos-Bourboulis et al 2020,Li et al 2020a)。COVID-19の患者さんでは、炎症や高サイトカイン血症(サイトカインストーム症候群/cytokine storm)として現れている。炎症亢進状態を引き起こす要因としては、サイトカインストームに加えて、持続的なリンパ球減少、好中球増加、補体成分C3,C3a、C5,C5a、マンノース結合レクチン関連セリンプロテアーゼ(MASP2)の過剰活性化が挙げられる(Girija er al)。 観察されるサイトカイン・ストームは、COVID-19感染症において最も危険で、生命を脅かす可能性のある事象である。これは、急性呼吸窮迫症候群(ARDS)や多臓器不全(MOF)を促進することで、疾患の悪化に重要な役割を果たすからである(Coperchini et al 2020,Ye et al 2020)。いくつかの研究は、COVID-19の治療に抗ウイルス剤を使用することに加えて、サイトカインストームのダウンレギュレーションが、この病気とうまく闘うための効率的な治療戦略であることを証明することを示唆している(Rahmati and Moosavi, 2020; Soy et al 2020; Zhao, 2020)。植物、植物抽出物およびその誘導体は、免疫調整作用を有することが知られている。さらに、植物由来の生理活性化合物の中には、炎症や疾患に伴うサイトカインストームを抑制する能力が評価されているものもある。この論文では、COVID-19患者に見られるサイトカイン・ストーム症候群について簡単に説明し、COVID-19に見られるサイトカイン・ストームを標的にして緩和するために重要な役割を果たすことができる、植物由来の天然の免疫抑制剤について強調している。
COVID-19とサイトカイン・ストーム
COVID-19の紹介
COVID-19は、エンベロープ型の非セグメントRNAウイルスであるβ型コロナウイルス、SARS-CoV-2によって引き起こされるウイルス性疾患です(Astuti and Ysrafil, 2020; Wang er al)。 世界保健機関(WHO)は現在進行中のパンデミックと宣言しているが、その影響は世界220の国・地域・領域に及び、確認された患者数は55,928,327人、確認された死亡者数は1,344,003人となっている(World Health Organization, 2020c)。SARS-CoV-2の感染は、主に呼吸器の飛沫や接触経路を介して起こる(世界保健機関 2020d)。SARS-CoV-2が宿主の細胞内に侵入するためには、スパイクタンパク質が重要な役割を果たしている。スパイクタンパク質のS1サブユニットの受容体結合ドメイン(RBD)は、hACE2受容体に高親和性で結合し、ウイルスの侵入と下気道細胞への感染を促進する(Hemmat et al 2020,Shang et al 2020)。SARS-CoV-2が宿主細胞に侵入すると、そのRNAが翻訳され、新たに合成された成熟したビロンを産生するためのウイルス複製が起こり、感染細胞の外に放出される(Shereen er al)2020)。SARS-CoV-2の平均潜伏期間は3~7日である(Li et al 2020b)。潜伏期間後に症状が発症する(Wujtewicz er al)2020)。感染者の中には、無症状の人もいれば、軽度の症状の人もいて、さらに重度の症状の人もいる(Tabata er al)。 症状としては、発熱、咳、倦怠感、頭痛、筋肉痛、喉の痛み、息切れ、痰の発生、下痢などがある。その他の症状としては、胸痛、悪寒、鼻づまり、鼻汁、吐き気などがある(Fu er al)2020a)。臨床症状としては、乳酸脱水素酵素、クレアチンキナーゼ、アラニントランスアミナーゼ、アスパラギン酸アミノトランスフェラーゼの値が上昇する(Wang er al)2020a)。リンパ球減少、高い疲弊レベル、および末梢血中のT細胞(CD4+およびCD8+ T細胞)の機能的多様性の低下も、COVID-19患者のもう一つの臨床的特徴です(Zheng et al 2020a;Zheng et al 2020b;Zhao et al 2020)。患者では、血清IgM、IgG、IgAの高レベルが検出されることがある。重症のSARS-CoV-2患者は、軽症の患者よりも有意に高い抗体レベルを示する(Ma er al)2020)。患者では血小板と好中球のレベルも上昇している(Zhou et al 2020)。Dダイマーレベルの上昇、プロトロンビン時間(PT)の延長、フィブリノゲンレベルの変化が観察され、患者に発症する肺血管内凝固障害の状態を指し示している(Zhang et al 2020a;Lancet Haematol 2020;Connors and Lavy 2020;Long et al 2020;McGonagle et al 2020)。重度のCOVID-19患者は、C3活性化、C3a生成、C3フラグメント沈着、および血清C5aレベルの増加を特徴とする広範囲の補体活性化を示す(Mastaglio et al 2020,Noris et al 2020,Risitano et al 2020)。赤血球沈降速度(ESR)IL-6,C反応性タンパク質(CRP)およびプロカルシトニン(PCT)などの炎症性マーカーも、特に重症の患者において上昇する(Zeng et al 2020)。これらの炎症マーカーの上昇は、疾患の重症度と関連しており、体内に存在する高免疫性の炎症状態を示し、この患者群では高い罹患率と死亡率をもたらす(Chen et al 2020a; Chen et al 2020b; Lippi and Plabani 2020; Sun et al 2020)。また、患者は、炎症性サイトカインTNF-α、IFNγ、IL-1β、IL-2,IL-4,IL-6,IL-7,IL-9,IL-12,IL-13,IL-17,G-脳脊髄液、GM-脳脊髄液、M脳脊髄液、およびケモカインCLCL8,MCP1,IP10,MIP1α、MIP1βの高いレベルを示した。炎症マーカーの場合と同様に、重症患者では血清サイトカインおよびケモカインのレベルが高い。重症患者では、IL-1,IL-6,IL-2,IL-7,IL-10,IL-17,G-脳脊髄液、IP10,MCP1,MIP1α、TNF-αの濃度が高く、両群で多様なサイトカインプロファイルが観察された。これらのサイトカインのうち、IL-6,IL-10,CXCL10は、病気が悪化するリスクの高い患者を予測する。サイトカインが急増した結果、肺の上皮が傷つき、肺胞の細胞バリアーが劣化する。また、内皮細胞の損傷により微小血管系の変化も見られる。これらの変化により、ARDSが発症する(Schett et al 2020a;Han et al 2020;Laing et al 2020;Lingeswaran et al 2020;Lingeswaran et al 2020)。免疫病理は徐々に呼吸不全、二次感染の確立、敗血症と敗血症性ショック、多臓器不全(腎臓、肝臓)へと進行し、全体的に予後が悪く、死亡に至ることもある(Gabriella et al 2020,Guo et al 2020,Hou et al 2020)。
サイトカインストーム/高サイトカイン血症/サイトカインストーム症候群
サイトカインストームと高サイトカイン血症は、感染症、自己免疫疾患、またはその他の疾患の結果として起こりうる、生命を脅かす重篤な状態を表すために使用される2つの用語である。米国国立がん研究所は、サイトカイン・ストームを、体内でサイトカインがあまりにも早く血液中に放出される重篤な免疫反応と定義している(米国国立がん研究所 2020)。この状態は、時にサイトカインストーム症候群とも呼ばれる(Shimabukuro-Vornhagen er al)。2018)。これらのサイトカインは、細胞から分泌・放出される小型で非構造的な低分子量タンパク質のシグナル伝達分子の多様なグループであり、免疫や炎症に複雑な調節的影響を与えている(Zhang and An, 2007; Ray et al, 2016)。健康や病気における免疫反応の調節に重要な役割を果たしている(Duque and Descoteaux, 2014)。エスカレートしたサイトカイン産生は、疾患状態と関連している(Orzechowski et al 2014)。サイトカインの臨床症状は疾患ごとに異なるが、広く類似したサイトカインプロファイルによって特徴づけられる。一般的にサイトカインストームに関連するサイトカインは、インターフェロン、インターロイキン、ケモカイン、コロニー刺激因子(脳脊髄液)腫瘍壊死因子(TNF)などです(Tisoncik er al)。2012)。
COVID-19におけるサイトカイン・ストームの免疫病因
SARS-CoV-2感染症の制御と解決には、免疫系が重要な役割を果たしている。病原体に対する免疫反応が制御不能になると、過剰な炎症を引き起こし、死に至ることもある免疫病原体を引き起こす可能性がある(Guo et al 2020; Qin et al 2020)。SARS-CoV-2に感染した人の多くは、免疫系が活性化し、細胞が集められて肺の感染が除去される。その後、免疫反応は徐々に後退し、患者は無事に回復する。しかし、一部の患者では、免疫反応が機能不全に陥り、サイトカインやケモカインが大量に放出される「サイトカイン・ストーム」が発生し、肺に広範囲の炎症が発生する(Catanzaro et al 2020,Tay et al 2020)。重症のSARS-CoV-2感染症で観察されるARDSおよびMOFの主要な原因の1つは、サイトカインストームである(Lingeswaran et al 2020;Ye et al 2020)。研究により、SARS-CoV-2感染の進行はサイトカインストームと関連しており、サイトカインストームのレベルが高いほど、より重篤な疾患の発症と関連していることが明らかになった(Tang et al 2020a;Han et al 2020)。サイトカインIL-1β、IL-1RA、IL-7,IL-9,IL-10,FGF、G-脳脊髄液、GM-脳脊髄液、PDGF、VEGF、IFNγ、TNFおよびケモカインCXCL8,IP10,MCP1,MIP1α、MIP1βの血漿レベルは、COVID-19患者では健常者と比較して有意に上昇している。さらに、炎症性サイトカインIL-2,IL-7,IL-10,G-脳脊髄液、TNFおよびケモカインIP10,MCP1,MIP1αは、軽度の感染者と比較して重度の患者で増加している(Tang et al 2020b)。
サイトカインやケモカインは必須の免疫系メディエーターであり、抗ウイルス免疫の維持に重要な役割を果たしている(Melchjorsen et al 2003; Sládková and Kostolansky 2006)。SARS-CoV-2は、自然免疫反応と適応免疫反応の両方を活性化する(Catanzaro er al)。 まず、ウイルスが宿主細胞に侵入すると、上皮細胞や肺胞マクロファージなどの抗原提示細胞に発現するTLR7,TLR8,RLR、NLRなどの病原体認識受容体(PRR)が、ウイルスの構造成分に含まれる核酸、糖鎖、糖タンパク質、リポタンパク質、dsRNAなどの中間生成物、小分子などのPAMPを認識して、ウイルスの認識を促進する。TLR3,TLR7,TLR8は、ウイルスを最初に認識し、これがインターフェロンの産生を高める原因となる。ウイルスを認識すると、自然免疫反応が刺激され、いくつかのシグナル伝達カスケードが活性化され、その結果、下流の転写因子が活性化され、炎症性サイトカインやケモカインをコードする遺伝子が発現する。ケモカインが産生されると、自然免疫応答細胞であるNK細胞、樹状細胞、多形核白血球、単球が引き寄せられ、これらの細胞はリンパ球をリクルートする能力のあるケモカイン、MIG、IP10,MCP-1を産生するようになる。集められたTリンパ球は、樹状細胞から提示された抗原を認識する。そして、プライミングされたCD4 T細胞は、B細胞にシグナルを与えて抗体を産生させ、細胞傷害性CD8 T細胞にシグナルを与えてSARS-CoV-2を標的にして排除することで、高度に特異的な適応免疫反応を実行する。産生された抗体(主にIgG、IgM、IgA)は特異性が高く、SARS-CoV-2の表面糖タンパク質(主にスパイク糖タンパク質とヌクレオカプシドタンパク質)に向けられる。これがSARS-CoV-2に対する体液性免疫反応であり、これらの抗体は、ACE2を発現しているヒトの細胞や組織へのウイルス感染を中和するために不可欠である。SARS-CoV-2に対する細胞性免疫反応は、T-ヘルパー細胞、B細胞が中和抗体を産生するのを助けるCD4 T細胞、細胞傷害性のCD8 T細胞、SARS-CoV-2に感染した細胞を直接殺すヘルパーT細胞、その他のT細胞が介在する。その後に観察される炎症反応を引き起こすTh17細胞と、免疫反応を抑制して過剰な反応を防ぐ役割を果たす制御性T細胞を含む(García, 2020; Herb er al)。 , 2020; Hotez et al 2020; Poland et al 2020; Ragab et al 2020; Shah et al 2020; Song et al 2020; Soy et al 2020; Tay et al 2020; Vabret et al 2020)。)
研究の結果、自然免疫反応から適応免疫反応への移行が、SARS-CoV-2感染症の臨床的な進行に重要であることが明らかになった。この移行期にどのような免疫制御事象が働いているのかは、現時点ではよくわかっていないが、一部の患者では防御的な免疫反応を、他の患者では機能不全の免疫反応をもたらすことは明らかである。もう1つの要因は、インターフェロン反応の調節不全である。SARS-CoV-2は、宿主細胞内での潜伏期間中に密かに増殖し、インターフェロンの産生を検出できないため、ウイルス量が多くなる。その結果、感染初期にはインターフェロンの反応が抑制されることになる。しかし、重症のCOVID-19患者では、強力なIFN-1反応が報告されている。このような免疫反応の障害は、病原体を効果的に排除することができず、ウイルスの複製が持続することで、炎症反応が悪化し、サイトカインの産生が増加する。COVID-19におけるサイトカインストームまたはサイトカインストーム症候群は、ウイルス除去機能の低下、感染初期のI型インターフェロンの低下、好中球の細胞外トラップの増加、NK細胞の活性化などが、積極的な炎症反応を引き起こす要因となっていると考えられる。サイトカインストーム症候群の他の要因としては、プログラムされた細胞死の炎症形態であるパイロプトーシスや、レニン-アンジオテンシン系の破綻に伴うアンジオテンシンIIの増加によって引き起こされるACE2受容体を介したサイトカインIL-6およびMCP1の増加が挙げられる(Acharya et al, 2020; Fu et al 2020b; Golonka et al 2020; Iwasaki et al 2020; Lee and Shin, 2020; Lee et al 2020; Mahmudpour et al 2020)。)
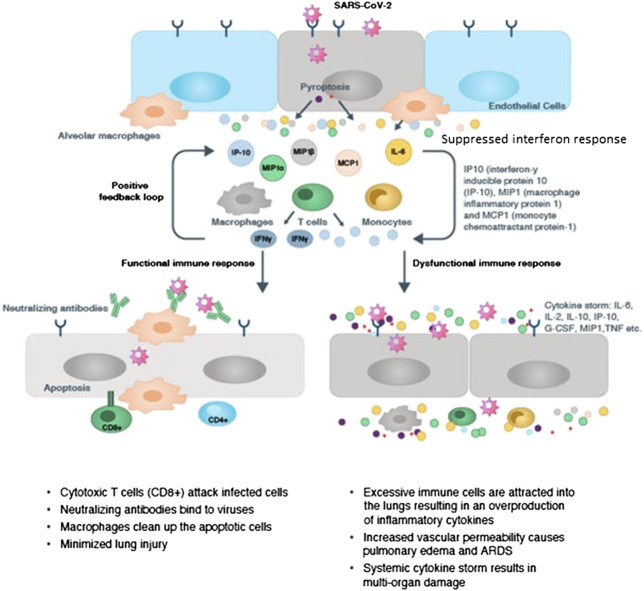
COVID-19感染症では当初、自然免疫細胞によるサイトカインやケモカインの産生に遅れが見られる。これに続いて、活性化したマクロファージ、単球、およびその他のリクルートされたリンパ球による炎症性サイトカインおよびケモカインの産生が突然急性的に増加する。炎症性サイトカインとケモカインの急増は、好中球、マクロファージ、単球、T細胞の感染部位への浸潤を増大させ、気管支と肺胞に激しく、激しい炎症反応をもたらす。その結果、気血関門の破壊、内皮・上皮細胞の損傷、肺胞・上皮関門の破壊、ARDSや肺線維症(PF)につながるびまん性肺胞の損傷を引き起こす。感染部位での局所的なダメージに加えて、サイトカインストームは全身に波及し、ウイルス性敗血症、MOF、そして最終的には重篤な患者の死につながる(Schett et al, 2020b; Li et al 2020c; Lingeswaran et al 2020; Matthay et al 2020; Nile et al 2020; Prompetchara et al 2020; Ragab et al 2020; Risitano et al 2020; Spagnolo et al 2020; Tay et al 2020; Vabret et al 2020)。COVID-19で観察されたサイトカインストームを図式化したものが図1にある(CAS,2020)。
図1 COVID-19におけるサイトカインストームの免疫病理(CAS, 2020)
免疫調整剤-COVID-19のサイトカインストームを標的とする
熱心な科学的研究や調査にもかかわらず、COVID-19の治療や予防に利用できる特効薬やワクチンはない。600件以上の臨床試験が行われているが、現在のところ有望な結果は出ていない(本レビュー投稿時)。現在行われているCOVID-19の標準的な治療は、対症療法、緩和療法、支持療法に過ぎない(Catanzaro er al)。2020; Risitano er al)。2020)。COVID-19感染症を治療し、効率的に管理するために、多様な薬剤が採用されている。抗ウイルス剤、その他の化学薬品、モノクローナル抗体、その他の薬剤が現在の治療体制の一部となっている。抗ウイルス剤としては、ロピナビル、リトナビル、レムデシビル、オセルタミビル、ファビピラビル、アルビドール、リバビリン、ガンシクロビル、アマンタジンなどが使用されている。その他の化学薬品としては、ヒドロキシクロロキン、クロロキン、アジスロマイシン、イベルメクチン、コルヒチン、サリドマイド、メチルプレドニゾロンやデキサメタゾンなどのグルココルチコイドが治療に使われている。また、モノクローナル抗体トシリズマブ、回復期血漿インターフェロン、免疫グロブリン静注療法などの治療法がパンデミックしている。さらに、セファロスポリン、キノロン、カルバペネム、リネゾリド、または抗真菌剤などの抗生物質が投与されることもある(Chakraborty et al 2020a;National Institutes of Health 2020a;Saha et al 2020a;Sethi et al 2020;Tobaiqy et al 2020)。
SARS-CoV-2を効果的に標的とし、感染を減少させることができる特定の抗ウイルス剤やその他の医薬品が果たす役割は大きく、軽視することはできないが、SARS-CoV-2が免疫機能障害を促進し、患者に高炎症とサイトカインストームを誘導することを考慮すると、免疫調節療法の使用が有効である可能性がある(Iannaccone et al 2020,Shi et al 2020,Tufan et al 2020,Zhong et al 2020)。治療戦略は、抗ウイルス療法のみを超えて、免疫調節剤をアジュバントとして使用することは、宿主の免疫反応を考慮したホリスティックな治療アプローチであり、それゆえに急性免疫/炎症反応をチェックし、ARDSおよびPFを予防することになる(Alijotas-Reig et al 2020;Liang et al 2020)。サイトカインストームは、COVID-19患者で観察される重度の免疫異常の顕著な特徴の1つである(Yazdanpanah er al)2020)。炎症亢進の状態を改善するためにサイトカインストームを標的にすることは、COVID-19患者の治療における新規の治療アプローチであると提案されている(Felsenstein et al 2020,Prompetchara et al 2020,Roshanravan et al 2020a、Vabret et al 2020)。COVID-19のサイトカインストームを治療し、その結果、炎症亢進状態を軽減するために、いくつかの合成薬、モノクローナル抗体、および幹細胞療法が提案され、検討されている(Alijotas-Reig et al 2020)。現在使用されている、また臨床試験中の治療アプローチのいくつかを以下に説明する。
Th17関連サイトカイン;IL-6,IL-17,IL-22,TNF-αおよびIL-1βを減少させることが知られている抗マラリア薬ヒドロキシクロロキンおよびクロロキンは、いくつかの臨床試験においてCOVID-19治療における有効性が評価されている(Felsenstein et al 2020,da Silva et al 2020,Karres et al 2020,Meo et al 2020)。IL-6受容体のアンタゴニストであるモノクローナル抗体トシリズマブおよびサリルマブによる選択的サイトカイン遮断は、特定の国の臨床試験で研究されている(AtalおよびFatima 2020;Chakraborty er al)2020b;Saha er al)2020b)。カルシニューリン阻害剤は、IL-2のカルシウム産生とIL-2受容体の発現の両方を減少させ、それによりT細胞の活性化を減少させる。このような2つの阻害剤;シクロスポリンおよびタクロリムスは、COVID-19で観察されたサイトカインストーム症候群を軽減するための潜在的な薬剤候補として検討されている(Mejia et al 2014;Cure et al 2020;Rudnicka et al 2020;National Institutes of Health 2020b)。IL-1受容体拮抗薬のアナキンラと抗IL-1βモノクローナル抗体のカナキヌマブは、スティル病のような他の炎症性疾患で観察されるサイトカインストーム症候群を効率的に治療する2つの薬剤候補であり、SARS-CoV-2で誘発されたサイトカインストームに対する有効性が評価されている(Huet et al 2020,Filocamo et al 2020,National Institutes of Health 2020c)。抗TNF抗体であるインフリキシマブおよびアダリムマブは、TNFを特異的に標的とすることにより、COVID-19で観察された炎症亢進を調節することが検討されている(Roshanravan er al)2020b)。凝固障害を有するCOVID-19患者における低分子未分画ヘパリンの有効性を評価するための個別研究および臨床試験が進行中である(Tang er al)2020b;National Institutes of Health 2020d)。評価されているもう一つの免疫調整治療分子は、静脈内免疫グロブリン(IVIG)の使用である。標準治療のみと比較した場合の免疫グロブリンの静脈内投与の有益性を研究する臨床試験が現在進行中である(米国国立衛生研究所 2020e)。悪化した患者の治療オプションとして、高用量のIVIGの有効性を評価する個々の研究が行われており、様々な結果が得られている(Xie et al 2020,Cao et al 2020)。COVID-19に対する高免疫性免疫グロブリン治療も検討されている(Alwis et al 2020)。入院患者における回復期血漿と抗COVID-19ヒト免疫グロブリンの有効性を比較する臨床試験が現在進行中である(National Institutes of Health, 2020f)。JAK/STAT経路は、サイトカイン産生の制御に関わる主要なシグナル伝達経路である(Bagca and Avci, 2020; Seif et al, 2020)。ルキソリチニブは、ヤヌスキナーゼ(JAK)1および2を選択的に阻害し、チロシンキナーゼ(TYK)2およびJAK3に対して中程度から顕著な選択性を有している。 COVID-19の高炎症およびARDS患者におけるサイトカインの過剰産生を標的としたルキソリチニブの有効性を評価する研究および臨床試験が行われている(La Rosée et al 2020,米国国立衛生研究所 2020g、米国国立衛生研究所 2020h)。バリシチニブは、JAK 1/2に結合し、その活性化とその結果としてのサイトカインの放出を阻害する別の阻害剤である(National Institutes of Health, 2020i)。COVID-19サイトカインストームを標的としたバリシチニブの使用は、パイロット研究および第2,3相臨床試験で検討されている(Cantini er al)2020;National Institutes of Health 2020j;National Institutes of Health 2020k)。炎症反応を調整する能力があることで知られ、他のウイルス感染症でも使用されているコルチコステロイドは、COVID-19治療のもう一つの選択肢です(Russell et al 2020)。COVID-19患者のサイトカインストームの軽減におけるデキサメタゾンおよびメチルプレドニゾロンの予防的作用、安全性および有効性を検証する臨床試験が進行中である(Horby et al 2020,National Institutes of Health 2020l、National Institutes of Health 2020m、Nature 2020)。スタチンは、免疫調整作用と抗炎症作用を有する薬剤の一種であり、COVID-19のサイトカインストームの治療に検討されている(Castiglione et al 2020,Lee et al 2020,National Institutes of Health 2020n)。SARS-CoV-2の宿主細胞への侵入はhACE2によって媒介されており、このhACE2はウイルスによる急性肺損傷にも関与している(Liu er al)2020)。SARS-CoV-2によって誘発される炎症やARDSにおいて、直接的(レニン-アンジオテンシン系の回復を介して)および間接的(キメラ受容体効果)な治療効果を媒介する組換えhACE2(rhACE2)の安全性と有効性を確認するための臨床試験が進行中である(Barone et al 2020,米国国立衛生研究所 2020o、米国国立衛生研究所 2020p)。また、COVID-19患者のサイトカインストームによる誇張された免疫反応を抑制するための多能性間葉系幹細胞(MSC)の使用も研究されている(Rajarshi et al 2020)。
これらの合成治療用免疫調節剤の利点は議論の余地がないが、その使用はしばしば有害な副作用を伴う。心筋症、神経系および胃腸系の副作用は、クロロキンおよびヒドロキシクロロキンの治療で報告されており、COVID-19患者は併存疾患のためにより脆弱であるため、安全性が懸念されている(Colafrancesco et al 2020,米国食品医薬品局 2020,Gevers et al 2020)。COVID-19患者へのトシリズマブおよびサリルマブを用いたIL-6拮抗薬による治療も、内分泌学的、血液学的、胃腸および心血管系の副作用を引き起こすことが知られているため、安全性が懸念される(Atal and Fatima, 2020)。IL-2ブロッカーのシクロスポリンとタクロリムスは、副作用を引き起こすことが知られており、非常に有害である(Cure et al 2020; Xia et al 2020)。IL-1ブロッカーのアナキンラとカナキヌマブは、安全性はそれなりに良好であるが、肝酵素値の上昇、ミオパシー、軽度の白血球減少を引き起こす可能性がある(Colafrancesco er al)2020)。抗TNF療法の副作用は頻度が低いと報告されている(Favalli er al)2020)。COVID-19の患者さんに投与されたJAK/STAT阻害剤であるルキソリチニブについては、重篤な薬物反応が報告されたため、実施された試験ではこの薬剤の投与を早期に中止した(Gaspari er al)。 また、別の経口JAK/STAT阻害剤であるバリシチニブの使用により、重篤な感染症を発症するリスクがある(Lilly, 2020)。以前に行われたARDSや敗血症患者を対象としたスタチン治療の臨床試験では、否定的な結果が出ており、COVID-19療法の補助薬としての検討には消極的であった(Lee er al)2020)。ARDS患者に対するrhACE2治療の研究では、高ナトリウム血症と嚥下障害が副作用として指摘された(Barone er al)2020)。MSCsを不適切に投与した場合、致命的な血栓性合併症や反応が起こる可能性があるため、この治療法の選択肢と適用ルートを十分に理解する必要がある(Moll er al)2020)。
天然の免疫抑制剤-COVID-19のサイトカインストームを標的とするアジュバント
バイオアベイラビリティが向上し、本質的に毒性の副作用がない植物由来の免疫調整剤の発見は希望の光であり、COVID-19で観察されたサイトカインストーム症候群を緩和するための新たなアプローチを開くものである(Grigore, 2017; Cena and Chieppa, 2020)。いくつかの植物および植物由来の生理活性化合物は、その免疫調節活性について研究されており、特にその免疫抑制活性について多くが同定されている(Sagrawat and Khan, 2007; Sahoo and Banik, 2018)。これらの天然の免疫抑制剤は、SARS-CoV-2に関連した病気、すなわちサイトカインストームとそれに伴う炎症亢進を効率的に管理するための代替治療戦略を提供する。植物由来の免疫抑制剤でサイトカインストームを標的にすることは、戦略的な治療法として非常に有望である。炎症カスケードの個々のメディエーターであるIL-1β、IL-6,TNF-αなどのサイトカイン、IP10,MCP1などのケモカインを中和・抑制することで、ウイルスの排除に悪影響を及ぼすような広範囲の免疫抑制ではなくなるからである。このようなサイトカインの特異的な標的化は、特定のシグナルカスケードに対する阻害作用によって達成される。植物由来の免疫抑制剤は、安全性が高く、SARS-CoV-2に対する免疫システムの応答能力を損なうことなく、炎症性サイトカインのレベルを抑制することができるため、今まさに必要とされている。COVID-19治療のアジュバントとして使用できる、炎症性サイトカインのレベルを低下させて炎症を抑えることが証明されている植物由来の免疫抑制剤を以下に紹介する。
アンドログラフォリド
アンドログラフォリドは、4-ヒドロキシ-3-[2-[6-ヒドロキシ-5-(ヒドロキシメチル)-5,8a-ジメチル-2-メチリデン-3,4,4a,6,7,8-ヘキサヒドロ-1H-ナフタレン-1-イル]エチリデン]オキソラン-2-オンのラブダン系ジテルペノイドである。薬用植物であるAndrographis paniculata (Brum.f.) Neesから単離されたもので、抗炎症作用、抗アレルギー作用、抗血小板凝集作用、抗腫瘍作用、抗HIV作用、肝保護作用などの幅広い治療効果があるとされている(Jayakumar et al 2013; National Center for Biotechnology Information, 2020a)。また、アンドログラフォリドは強力な免疫調整剤でもあり、免疫反応を著しく刺激し、NK細胞やサイトカインの産生を調節し、細胞障害性Tリンパ球の産生を刺激することが知られている(Varma er al)。 Andrographolideは、LPS/IL-4で活性化されたマウスのマクロファージにおいて、炎症性サイトカインTNF-α、IL-12,IL-1β、IL-6,IL-18のレベルを用量依存的に効率的に低下させた(Wang et al 2010)。アンドログラフォリド投与は、pMCAO刺激後の虚血脳組織において、炎症メディエーターであるIL-1β、TNF-α、プロスタグランジンE2(PGE2)NADPHオキシダーゼ2(NOX2)誘導性一酸化窒素合成酵素(iNOS)を抑制する(Lu et al 2019)。LPS刺激を受けたRAW264.7細胞では、アンドログラフォリド処理により、炎症性サイトカインTNF-α、IL-1β、IL-6のレベルおよびそれらに対応するmRNAの発現レベルが同様に用量依存的に低下した。この炎症性サイトカインの分泌の減少は、アンドログラフォリドがLPS誘導性のNF-κB経路およびMAPK経路を抑制するためであり、アンドログラフォリドは、NF-κB経路におけるp65およびIkBαのリン酸化のレベルと、MAPK経路におけるp-JNK、p-ERK1/2およびp-p38のレベルを減少させた(Li er al)。 アンドログラフォリド誘導体は、NF-κB p65サブユニットの核内移行を阻害し、p65およびIκBαのリン酸化を減衰させることにより、TNF-α/ NF-κBおよびTLR4/ NF-κのシグナル伝達経路を阻害し、血清中の炎症性サイトカインおよびケモカインのレベルを低下させることが明らかになった(Nie er al)。 ある研究では、アンドログラフォリドの経口投与により、C-C(CCL2,CCL5)およびC-X-C(CXCL1,CXCL2,CXCL10)サブファミリーのマウス大脳皮質ケモカインレベルが有意に減衰した。また、アンドログラフォリドは、アストロサイトにおけるLPS誘導ケモカイン(CCL2,CCL5,CXCL1,CXCL5,CX3CL1)およびTNF-αを無効化した(Wong et al 2016)。phorbol myristate acetateとionomycin(PMA/ionomycin)で刺激したJurkat細胞を用いて行われた研究では、アンドログラフォリドはIL-2の産生を抑え、NF-κBの活性を低下させることがわかった。また、抗CD3またはPMA/ionomycinによって誘導されるERK1およびERK5のリン酸化の減少をもたらした(Carretta et al 2009)。アンドログラフォリドは、コンカナバリンAで刺激したマウスT細胞におけるINFγの産生を有意に減少させ、IL-2の産生を部分的に抑制した。このINFγ産生の減少は、アンドログラフォリドで細胞を処理することでERK1/2リン酸化の有意な減少と関連していた。同じ研究で、アンドログラフォリドは、胸腺細胞のヒドロコルチゾン/PMA誘発アポトーシスを減少させることも判明した(Burgos et al 2005)。ドッキング研究の結果、アンドログラフォリドは、SARS-CoV-2の主要プロテアーゼ(Mpro)の強力な阻害剤でもあることが明らかになった。さらに、アンドログラホリドは安全であり、他の治療薬の代謝を妨げることはない(Enmozhi et al 2020)。アンドログラフォリドは、サイトカインやケモカインの異常な産生を緩和する強力な免疫抑制剤として、また主要なプロテアーゼを標的としたSARS-CoV-2の潜在的な阻害剤として、このような2つの有益な役割を果たしていることから、アンドログラフォリドはCOVID-19標的療法に考慮すべき有望な天然薬物であると言える(Banerjee et al 2020)。
アリシン
アリシンはチオ硫酸塩(3-prop-2-enylsulfinylsulfanylprop-1-ene)で、ガーリックオイルの成分であり、切りたてのニンニク(Allium sativum L.)の典型的な匂いと味の原因となっている。アリシンは、ガーデンオニオン(Allium cepa L.)やその他のアリ科の種にも含まれている(Borlinghaus et al 2014,National Center for Biotechnology Information 2020b)。アリシンは、抗酸化作用、抗菌作用、抗ウイルス作用、抗炎症作用、抗腫瘍作用、および抗糖尿病作用を有することが知られている(Batiha er al)2020)。アリシンは、2種類の腸管上皮細胞において、IL-1β、CXCL8,IP10の自発的な分泌およびTNF誘導による分泌を、用量依存的に抑制した。また、IL-1βサイトカインおよびCXCL8ケモカインのmRNAレベルも低下している。このサイトカイン産生の減少は、NF-κB経路に対するアリシンの効果によるもので、アリシンはIκBの分解を抑制する(Lang et al 2004)。BALB/cマウスにアリシンを投与したところ、IFNγの産生が増加し、CD4+T細胞が拡大したため、防御力と生存率が向上した。Ehrlich腹水癌(EAC)細胞にタモキシフェンと一緒にアリシンを投与すると、TNF-αレベルが著しく低下し、アジュバントとしての有益な役割を示した(Arreola er al)。 アリシン治療の安全性を評価する臨床試験では、副作用は報告されなかった(Sharifi-Rad et al 2019)。TNF-αで刺激したHT-29細胞およびCaco-2細胞において、アリシンはIL-1β、IP10,CXCL8およびMIGの分泌を用量依存的に顕著に抑制することをもたらした。RNAプロテクションアッセイでは、アリシンがIL-1βとCXCL8のmRNAレベルの発現を抑制することが明らかになった(Lang er al)。 また、アリシンはIkappaBの分解を抑制する役割も担っていた。LPS処理した血液サンプルでは、アリシンはIL-10の放出を劇的に減少させた(Keiss et al 2003)。培養したヒト臍帯静脈内皮細胞(HUVECs)を用いた研究では、アリシンはLPSによる炎症反応を抑制した。アリシンを投与したところ、TNF-α、CXCL8,NFκB活性の有意な低下が認められた。さらに、アリシンによる処理は、培養したHUVECにおけるLPS誘発性のアポトーシスも減少させた(Zhang er al)2017)。アリシンは、NF-κBシグナルを変化させてサイトカイン分泌を減少させ、サイトカインストームを標的とし、IFNγ産生を増加させて抗ウイルス防御を向上させ、CD4+T細胞の拡大を向上させてリンパ球減少を標的とする能力があるため、COVID-19患者の抗ウイルス療法と併用できる有望な自然免疫調整アジュバントである。しかし、COVID-19患者にアリシンを安全に使用するためには、これらの患者における安全性プロファイルと薬物動態(使用中の抗ウイルス剤との併用)を評価する臨床試験が必要である。
コルヒチン
コルヒチンは、Colchicum autumnale L.およびGloriosa superb L.から抽出された二次代謝産物(アルカロイド)です(Varsha er al)。 化学的には、コルヒチンはN-[(7S)-1,2,3,10-tetramethoxy-9-oxo-6,7-dihydro-5H-benzo[a]heptalen-7-yl]acetamideである(National Center for Biotechnology Information, 2020c)。抗炎症作用と免疫調節作用を有することが知られており、痛風、FMF、ベッチェット症候群の治療に用いられている。コルヒチンは、IL-1の産生を阻害することが知られている(Soy et al 2020)。微小管は細胞骨格の重要な部分を形成しており、サイトカインやケモカインの分泌、細胞移動などの細胞プロセスに関与している。コルヒチンは、β-チューブリンサブユニットに高親和性で結合することで微小管の重合を阻害し、微小管の集合を妨げ、サイトカインやケモカインの分泌過程や、単球や好中球などの炎症細胞の移動に影響を与える。また、コルヒチンは、inflammasomeの活性化を阻害し、caspase-1の活性化とそれに伴うIL-1β、IL-18の放出を抑制する(Montealegre-Gómez et al 2020)。急性冠症候群患者を対象とした実験では、コルヒチンが炎症性サイトカインであるIL-1β、IL-6,IL-18のレベルを有意に低下させることがわかった(Martínez et al 2015)。また、コルヒチンは、NLRP3インフラマソームの形成を阻害し、その結果、IL-1βを含む炎症性サイトカインの発現を抑制することがわかった。SARS-CoV-2患者において高サイトカイン血症の原因となるNLRP3インフラマソームの活性化が亢進していることから、コルヒチンはNLRP3インフラマソームを抑制し、高サイトカイン血症を改善する薬剤として注目されている(Papadopoulos et al 2020,Ribeiro et al 2020,Shah 2020,Vitiello et al 2020)。COVID-19に対するコルヒチン治療の有効性を評価するために、個々の研究が行われた。コルヒチンは、SARS-CoV-2患者において、サイトカインレベルの低下、好中球とマクロファージの活性化、およびインフラマソームの減少をもたらすことが観察された。患者の副作用は少なく、軽度の下痢が数人の患者で報告されただけでした(Della-Torre et al 2020; Montealegre-Gómez et al 2020)。COVID-19に対するコルヒチン補助療法の臨床的有用性、安全性、有効性を検討するための臨床試験が進行中である(Soy er al)2020)。
クルクミン
クルクミン(1E,6E)-1,7-ビス(4-ヒドロキシ-3-メトキシフェニル)ヘプタ-1,6-ジエン-3,5-ジオン)は、一般的にウコンの香辛料として知られている多年生植物Curcuma longa L.から得られるポリフェノール色素である。クルクミンは、天然の抗酸化物質であり、抗炎症作用、神経保護作用、肝保護作用を有し、腫瘍細胞の増殖を抑制する。クルクミンはまた、免疫調整剤でもある(Hewlings and Douglas, 2017; National Center for Biotechnology Information, 2020d)。クルクミンが、さまざまな炎症性サイトカインおよびケモカインIL-1β、IL-2,IL-6,IL-12,TNF-α、CXCL8,IP10,MCP1,MIP1α、IFNγの産生および放出を抑制する能力は、いくつかの研究で証明されている。このようなクルクミンの免疫抑制作用は、さまざまなシグナル伝達経路への影響を介している。クルクミンは、IKKβの活性化を阻害し、IκBαの分解を阻害することでサイトカインによるNF-κBの活性化を阻害し、AMPKを活性化することでNF-κBシグナルを阻害し、p65に作用することでNF-κB経路を撹乱し、その結果、サイトカイン遺伝子の転写をダウンレギュレートするなど、NF-κB経路を多段階で制御する。一方、クルクミンは抗炎症性サイトカイン、特にIL-10を積極的に制御する。IL-10は、TNF-αやICAM 1のレベルを低下させる。クルクミンは、IL-10の発現、産生、活性を高めることがわかった(Jain et al 2009,Sordillo and Helson. 2015,Shimizu et al 2019,Liu et al 2020)。LPS刺激マウスマクロファージ様細胞RAW264.7における炎症性サイトカインIL-18に対するクルクミンの効果についての研究では、クルクミンがIL-18の産生を有意に抑制することが明らかになった(Yadav et al 2015)。また、胎児期の血漿にさらされた単球培養を対象とした別の研究では、クルクミンは炎症性サイトカインであるIL-1α、IL-6,TNF-αのレベルを大幅に低下させ、核内NF-κB p50のレベル低下ももたらした(Rahardjo et al 2014)。イランでは、Tabriz University of Medical SciencesのImam Reza Hospitalを形成するCOVID-19患者を対象に、無作為化二重盲検プラセボ対照試験が実施された。本試験では、40名の患者を対象に、炎症性サイトカインであるIL-1β、IL-6,TNF-α、IL-18のレベルを調整するナノクルクミン(用量:160mgを1日40mgカプセル4個で14日間)の有効性を評価することを目的とした。COVID-19の患者では、IL-1βおよびIL-6の発現および分泌の減少が認められた。しかし、ナノクルクミンの投与によるIL-18 mRNAの発現およびTNF-α濃度へのプラスの効果は見られなかった(Babaei et al 2020; Valizadeh et al 2020; Zahedipour et al 2020)。天然香辛料の抽出物であるクルクミンは、安全で低毒性である。これらの特性は、SARS-CoV-2感染の結果として観察されるサイトカインストーム、高炎症およびARDSを軽減するための免疫調節アジュバントとしてクルクミンを使用するためのさらなる臨床研究を動機付ける(Sordillo and Helson., 2015; Liu and Ying, 2020; Liu et al 2020)。
オイゲノール
芳香族油であるオイゲノールは、2-メトキシ-4-プロップ-2-エニルフェノールである。オイゲノールは、クローブの芽(Syzygium aromaticum (L.) Merr. and L.M. Perry)の主成分であることからクローブ油とも呼ばれているが、シナモンの樹皮や葉、トゥルシーの葉、ターメリック、ペッパー、ジンジャー、オレガノ、タイム、バジル、ベイ、マジョラム、メイス、ナツメグなどのオーガニックハーブなど、他の植物にも多く含まれている(Khalil er al)。2017; National Center for Biotechnology Information, 2020e)。オイゲノールは、複数の有益な薬理学的特性を有することが知られている。強力な抗酸化剤、鎮痛剤、抗菌剤、抗けいれん剤、抗がん剤である。さらに、抗炎症、抗ウイルスの特性を持ち、免疫調節剤でもある(Pramod et al 2010; Dibazar et al 2015)。ある研究では、オイゲノールは試験管内試験でのIL-6およびIL-10の産生を抑制した(Bachiega er al)2012)。オイゲノールの投与は、IL-4およびIL-5の増加を防ぎ、NF-κBシグナル伝達経路を減少させ、最終的にOVA誘発好酸球増加から肺組織を保護した。別の研究では、ユージノールは炎症性サイトカインであるIL-6およびTNF-αの発現を低下させ、NF-κBシグナルの発現を低下させることで、肺組織における白血球の動員および炎症を抑制した。また、ユージノールは、LPS誘導マクロファージにおいて、TNF-αおよびIL-1β、ならびにNF-κB、ERK1/2,およびp38 MAPKシグナル経路を減少させた(Barboza er al)2018)。オイゲノールは、低用量で使用した場合、副作用はほとんどなく、局所的な刺激やまれなアレルギー反応がある。誤って過剰摂取した場合には、組織の損傷や肝臓・腎臓へのダメージが生じる可能性がある(National Institute of Diabetes and Digestive and Kidney Diseases, 2020)。オイゲノールの高分子ナノキャリアを用いた処理は、スイスのマウスにおいてTPA誘発性のIL-6レベルの有意な減少をもたらすことが判明した(de Araújo Lopes er al)2018)。豚の腸上皮細胞におけるLPS誘発炎症モデルでは、オイゲノールは、CXCL8およびTNF-αのmRNAレベルの両方を有意に減少させることで、炎症反応を抑制した(Hui er al)2020)。また、LPSを添加したマクロファージを用いた研究では、ユージノールがIL-6とIL-10の産生を抑制することが明らかになった。しかし、IL-1βの産生には効果が認められなかった(Bachiega et al 2012)。炎症メディエーター遺伝子であるNF-κB1およびTNF-αに対するオイゲノールの影響を評価するために,マウス腹膜マクロファージを細菌のLPSで活性化した。LPSではNF-κB1の発現が誘導されなかったため、ユージノールの効果は確認できなかった。TNF-αの場合、LPSで活性化した細胞にオイゲノールを処理すると発現低下が認められた(Porto Mde er al)。 成熟したWistar系雄ラットを用いて、2つの重要な炎症マーカーであるIL-6とTNF-αに対するオイゲノール処理の効果を調べた。IL-6とTNF-αの両方のレベルは、チオアセトアミド誘発肝損傷後に上昇していた。ユージノールを前処理すると、これらの炎症マーカーのレベルが有意に低下した(Yogalakshmi et al 2010)。オイゲノールは安全性が高く、IL-6やTNF-αなどの主要な炎症性サイトカインを抑制し、肺組織での白血球の動員を減少させることができるため、COVID-19で観察された高サイトカイン血症や高炎症を抑制するために、抗ウイルス剤と一緒にアジュバントとして使用するのに適した天然の免疫抑制剤であると考えられる。
胆汁酸
没食子酸は、植物の樹皮、木部、葉、果実、根、種子などに多く含まれるフェノール性二次代謝産物である。化学的には、3,4,5-トリヒドロキシベンゾン酸である(Fitzpatrick and Woldermariam, 2017)。天然の抗酸化物質で、抗がん剤、抗真菌剤、抗菌剤、抗炎症剤としての効果もある。研究の結果、TNBS誘発の潰瘍性大腸炎およびRA FLSにおいて、没食子酸が炎症性サイトカインIL-1,IL-6,IL-12,IL-17,IL-23,TGFβ、TNF-αおよびケモカインCCL2,CCL7のレベルを抑制することが明らかになった。この没食子酸の抗炎症活性は、NF-κB経路の阻害によって発揮される(Huang er al)。 別の研究では、抗CD3刺激脾臓細胞において、没食子酸はTh2サイトカインIL-4およびIL-5を選択的に抑制するが、Th1サイトカインIFNγは抑制しないことが明らかになった(Kato et al 2001)。没食子酸を処理すると、高グルコース誘導ヒト単球(THP-1細胞)において、NF-κBの活性が抑制され、炎症性サイトカインの放出が抑制されることがわかった(Lee er al)。2015)。ヒト肥満細胞(HMC-1)において、炎症性サイトカインTNF-αおよびIL-6の産生に対する没食子酸の抑制効果を評価した。HMC-1細胞をPMA+A23187で刺激したところ、TNF-αとIL-6の両方が分泌された。胆汁酸処理は、刺激したHMC-1細胞におけるこれら両サイトカインの分泌を有意に阻害した(Kim et al 2006)。また、没食子酸処理は、PMA+A23187によるIκBαの分解とp65 NF-κBの核内移行を見事に抑制することがわかった。LPS誘導子宮内膜症細胞において、没食子酸の炎症制御効果を評価した。没食子酸は、NF-κBの発現および炎症性サイトカインIL-6の分泌プロファイルの有意な減少に関与していた(Bustami er al)。2018)。PMAに曝したヒト単球において、没食子酸から酵素的に産生されるポリガリック酸が、炎症性サイトカインIL-6,TNF-α、IL-1βの分泌に及ぼす影響を評価した。調査対象となった3つのサイトカインの産生量は、没食子酸の処理により大幅に減少した(Zamudio-Cuevas er al)2020)。このことから、没食子酸は、免疫抑制アジュバントとして使用することができ、炎症性サイトカインを選択的に抑制するため、宿主のインターフェロン産生能力に悪影響を与えることなく、SARS-CoV-2患者に見られるサイトカイン放出症候群を標的とすることができる。
ジンゲロール
ショウガオールは、生のショウガ(Zingiber officinale Roscoe)に含まれる成分で、5-ヒドロキシデカン-3-オンの1位が4-ヒドロキシ-3-メトキシフェニルで置換されたβ-ヒドロキシケトンである(5S)-5-ヒドロキシ-1-(4-ヒドロキシ-3-メトキシフェニル)デカン-3-オン(National Center for Biotechnology Information, 2020f)。ジンゲロールは、Zingiber属のいくつかの種の根茎にも含まれている。ジンゲロールは、抗酸化作用、抗炎症作用、抗転移作用、抗血管形成作用、抗糖尿病作用、鎮痛作用、解熱作用を有している。さらに、ジンゲロールは、免疫調節作用や抗アレルギー活性を有することも知られている(Sharifi-Rad er al)。 6-ジンゲロールは、LPS刺激マクロファージにおける炎症性サイトカインIL-1β、IL-12,TNF-αの産生に対して、抗原提示能力を阻害することなく抑制効果を発揮することがわかった(Tripathi er al)。 別の研究では、50μMの6-ジンゲロールを効果的に投与したところ、V. cholera感染の引き金となるサイトカインIL-1α、IL-1β、IL-6,およびケモカインCXCL8のレベルが低下することがわかった。また、それぞれのmRNAレベルも低下した。このような炎症性サイトカインのレベルの低下は、リン酸化されたIKBαの増加とp65のダウンレギュレーションによるNF-κB経路のダウンレギュレーションによるものと考えられる(Saha er al)。 また、別の研究では、6-ジンゲロールがIL-6およびCXCL8のmRNA力価を低下させ、COX2の過剰発現およびNF-κB活性を低下させることで、IL-1βによる炎症を抑制することが報告されている(Li et al 2013)。また、DSS誘発マウス大腸炎モデルでは、6-ジンゲロールの投与により、DSSにより上昇した炎症性サイトカインIL-1β、IL-12,TNF-αの産生を抑制することが確認された。DSS処理したCaco-2細胞に6-ジンゲロールを投与した試験管内試験では、投与後にAMPKの活性化が認められたことから、6-ジンゲロールの抗炎症作用はAMPKの活性化を介して発揮される可能性が示唆された(Chang er al)。 LPS刺激マウス腹膜マクロファージにおける炎症性サイトカインTNF-α、IL-1βおよびIL-12の産生は、6-ジンゲロールで処理すると抑制された(Tripathi er al)。 また、LPSで処理したC6アストログリオーマ細胞を用いた別の研究では、6-ジンゲロールを処理することで、炎症性サイトカインの産生が用量依存的に抑制されることがわかった。さらに、生体内試験の研究では、6-ジンゲロールは、LPSによるラット脳内のTNF-αレベルの上昇も抑制した(Zhang er al)。2018)。6-ジンゲロールのサイトカイン産生に対する効果を、DSS誘発大腸炎マウスモデルで評価した。6-ジンゲロールは、DSS刺激によるサイトカインIL-6およびIL-17の血清レベルとそれぞれのmRNAレベルの上昇を抑制した。さらに、DSS誘発による抗炎症サイトカインの血清レベルおよびmRNAレベルの低下も抑制した。IL-10(Sheng et al 2020)。ジンゲロールは、標準的な抗ウイルス療法と併用することで、COVID-19で観察されたサイトカインストームの調節に有用であると考えられる天然の免疫調整剤である。
ルテオリン
天然のフラボノイドであるルテオリンは、2-(3,4-dihydroxyphenyl)-5,7-dihydroxychromen-4-oneである。ルテオリンは、野菜(セロリ、パセリ、ブロッコリー、ニンジン、ピーマン、キャベツ)果物(リンゴの皮)花(菊)薬草などに多く含まれている。強力な抗酸化作用があり、腫瘍細胞の増殖を抑制し、転移を抑制する効果がある。また、抗炎症作用や免疫系の調整作用もある(Lin et al 2008; National Center for Biotechnology Information, 2020g)。ルテオリンは、LPS/IFN誘導初代ミクログリアおよびBV-2ミクログリア細胞におけるTNF-αおよびIL-1βの産生を濃度依存的に阻害する。この抑制効果は、炎症性遺伝子の転写に必要なNF-κB、STAT1,IRF1を阻害することによるものである(Kao et al 2011)。別の研究では、PMAとA23187で誘導されたHMC-1細胞にルテオリンを投与すると、TNF-α、IL-6,CXCL8,GM-CSが有意に抑制され、NF-κBの活性化が抑制された(Kang et al 2010)。高血糖状態のヒト単球において、ルテオリンはNF-κB活性を抑制することにより、IL-6およびTNF-αの放出を大幅に減少させた(Kim er al)2014)。また、LPSとインキュベートしたヒト全血を用いた研究では、ルテオリンはIL-1β、IL-6,TNF-α、IFNγの産生を効果的に抑制した(Ribeiro er al)。 初代マウスミクログリアとBV-2ミクログリア細胞をLPSで刺激すると、炎症性サイトカインであるIL-6のレベルが著しく上昇した。ルテオリンを前処理すると、このIL-6の増加をmRNAとタンパク質の両方のレベルで抑制することがわかった。また、ルテオリンは、AP1転写因子の結合活性を著しく低下させ、JNKのリン酸化を抑制したが、LPSによるNF-κBのDNA結合活性の上昇や、LPSによるIκBαの分解には有意な影響を与えなかった。さらに、ルテオリンを投与したマウスを用いた生体内試験では、海馬においてIL-6の血漿レベルとIL-6のmRNAレベルを見事に低下させたが、大脳皮質や小脳では低下しなかった。このようなLPSによるIL-6産生に対するルテオリンの抑制作用は、ルテオリンがミクログリアにおけるJNKシグナル伝達経路とAP1の活性化をともに阻害することに起因すると考えられる(Jang er al)。 また、ルテオリンは、MSUによるラットの炎症において、炎症性サイトカインであるIL-1β、IL-6,TNF-αの血清レベルを有意に低下させることがわかった(Lodhi er al)。 ルテオリンは、LPS/INFγ刺激したRAW264.7細胞におけるTNF-αおよびIL-6の産生を効果的に抑制した。また、NF-κBの発現は、ルテオリン処理後、用量依存的に抑制された(Lee er al)。 ルテオリンの前処理は、TNF刺激に対するヒトHaCaTおよび初代ケラチノサイトのmRNA発現およびIL-6,IL-8,VEGFの放出に、用量依存的な顕著な減少をもたらすことがわかった。また,TNF刺激によるNF-κBのリン酸化,核内移行,DNA結合は,ルテオリン処理により有意に低下した。さらに、NF-κBの2つのサブユニット(NF-κB p50とNF-κB p65)をコードするNFKB1遺伝子とRELA遺伝子のTNF誘導性mRNA発現も、ルテオリン処理によって低下したことから、ルテオリンはNF-κBの誘導を低下させることで、炎症性サイトカインの産生を抑えていることが示唆された(Weng er al)。 また、ルテオリンは、幅広い抗ウイルス活性を有し、マスト細胞を抑制し、最近のドッキング研究で明らかになったように、SARS-CoV-2メインプロテアーゼ(3CLpro)を阻害する可能性もある(Theoharides, 2020)。ルテオリンは、その免疫調整作用を考慮すると、COVID-19で観察されたサイトカインストームを改善し、SARS-CoV-2感染を抑制する可能性のあるアジュバントとして評価できる、潜在的な治療薬として検討すべき重要な天然物である。ただし、COVID-19に対する安全性、有効性、投与量を確認するためには、さらなる臨床試験を実施する必要がある。
メラトニン
メラトニンは、多くの植物に含まれていることが報告されている生理活性物質である。化学的には、トリプトファン由来の置換インドラミン(N-アセチル-5-メトキシトリプタミン)である。普遍的な両親媒性の抗酸化物質であり、抗炎症分子でもある(Salehi er al)2019)。メラトニンは、Huang-qin(Scutellaria baicalensis Georgi.)curcuma(Curcuma aeruginosa Roxb.)の根、セントジョーンズワート(Hypericum perforatum L.)の葉と花、Tanacetum parthenium(L.)Sch.Bip.の葉に含まれている。黒胡椒(Piper nigrum L.);トウモロコシ(Zea mays L.)イネ(Oryza sativa L.)黒カラシ(Brassica nigra (L.) K. Koch)白カラシ(Brassica nigra (L.) K. Koch)の種子。 Koch)ホワイトマスタード(Brassica hirta Moench)クコの実(Lycium barbarum L.)フェンネル(Foeniculum vulgare Mill.)ヒマワリ(Helianthus annuus L.)フェヌグリーク(Trigonella foenum-graecum L. )、大麦(Hordeum vulgare L.)、アーモンド(Prunus amygdalus Batsch)、コリアンダー(Coriandrum sativum L.)、セロリ(Apium graveolens L.)、アニス(Pimpinella anisum L.) )、ケシ(Papaver somniferum L.)、亜麻(Linum usitatissimum L.)、コーヒー豆(Coffea canephora Pierre. Ex A.Froehner, Coffea arabica L.)などに含まれている。メラトニンの存在は、バラ科、ビタ科、イネ科、セリ科、アブラナ科に属する多くの植物種で報告されている(Nawaz er al)2016)。メラトニンは、その抗炎症活性により間接的な抗ウイルス活性を有することが報告されている。炎症性サイトカインの産生と放出、炎症、細胞の動員をダウンレギュレーションする。メラトニンは、炎症性サイトカインの産生に関与する重要な転写因子であるNF-κBの活性化を抑制するため、このようなダウンレギュレーションとその結果としての抗炎症活性を示する。さらに、メラトニンは、IL-6,TNF-α、IL-1βの血清レベルの有意な低下を引き起こすことができることが研究で明らかになっている(Tarocco et al 2019,Zhang et al 2020b)。メラトニンは、アクロレイン誘導ヒト肺線維芽細胞におけるIL-8の産生を効率的に抑制した(Kim er al)2012)。雄のC57BL/6マウスのカドミウム誘発肝損傷で実施された研究では、メラトニンを処理することで、炎症性サイトカインの産生が有意に抑制され、NLRP3インフラマソームの活性化が抑制されることがわかった(Cao er al)。 また、BV2マウスミクログリア細胞を対象に実施した別の研究では、LPSによるケモカインMCP1,CCL5,CCL9のmRNA発現の産生がメラトニン処理によって有意に抑制された。また、メラトニンは、LPS曝露によって誘導されるAkTリン酸化およびNF-κB活性化を抑制した。さらに、メラトニン処理の結果、LPSによるSTAT1/3リン酸化およびインターフェロンγ活性化配列(GAS)駆動転写活性も阻害された。このことから、メラトニンの抗炎症活性は、LPSで刺激されたマウスミクログリア細胞株BV2において、NF-κBおよびSTAT/GASの活性化を抑制することによって媒介されることが示唆された(Min er al)。 最近のメカニズム分析では、メラトニンを補充すると、免疫細胞の好気的な解糖を逆転させることにより、COVID-19のサイトカインストームを効率的にダウンレギュレートできることが示唆されている(Reiter er al)2020)。メラトニンの短期使用は安全である。メラトニンは高い安全性を持っている。報告されている頻度の低い副作用は、たまに起こるめまい、頭痛、吐き気、眠気程度である。これらの知見は、COVID-19で観察されたサイトカインストーム症候群を軽減するための免疫抑制アジュバントとしてのメラトニンの使用を支持している(Zhang er al)2020b)。
モルヒネおよびコデイン
モルヒネ(4R,4aR,7S,7aR,12bS)-3-メチル-2,4,4a,7,7a,13-ヘキサヒドロ-1H-4,12-メタノベンゾフロ[3,2-e]イソキノリン-7,9-ジオール)は、さまざまな脳機能の制御に関与するδ、μ、κオピエート受容体に結合して活性化する。モルヒネは、鎮痛作用、鎮静作用、呼吸抑制作用、消化器系平滑筋収縮作用などをもたらす(National Center for Biotechnology Information, 2020h)。モルヒネの免疫抑制作用は、100年以上前から臨床医学で知られてた(Dinda et al 2005)。モルヒネの免疫抑制作用は、サイトカインの産生に関するいくつかの研究で立証されている。In vivoの研究では、モルヒネがTNF-α、IFNγ、MCP 1,IL-12,IL-6の産生を抑制することが明らかになっている(Clark et al 2007,Fukada et al 2012,Cruz et al 2017)。モルヒネには、TNF-α、IL-1およびIL-6の産生を減少させる能力がある(Chang er al)2011)。別の研究では、Swiss-Webster、C57BL/6J、肥満細胞欠損Kit Wsh/Wsh(W-sh)および肥満細胞再構成(W-sh-rec)マウスのTNF-αおよびMCP1の腹腔内放出に対するモルヒネの効果を評価した。モルヒネは、LPSによるTNF-α放出を抑制する一方で、腹腔内のMCP1放出には大きな影響を与えなかった(Madera-Salcedo er al)。 モルヒネを投与すると、CB6F1雄マウスの気管支肺胞洗浄液および肺組織中のTNF-α、IL-1,IL-2およびMIP2のレベルが有意に低下した。また、モルヒネを投与すると、肺の常在細胞の転写因子NF-κBが阻害された(Wang et al 2005)。コデイン(4R,4aR,7S,7aR,12bS)-9-メトキシ-3-メチル-2,4,4a,7,7a,13-ヘキサヒドロ-1H-4,12-メタノベンゾフロ[3,2-e]イソキノリン-7-オール)は、天然に存在するフェナントレンアルカロイドであり、P. somniferum L. から得られるオピオイドアゴニストでもある。また、鎮痛、抗下痢、鎮咳作用があることでも知られている(National Center for Biotechnology Information, 2020i)。コデインで処理すると、雄のスイスマウスから抽出したConA刺激脾臓細胞におけるIL-2の産生が有意に抑制されることが判明した(Sacerdote er al)1997)。モルヒネとコデインは、ドッキング試験によって明らかにされたように、高い親和性でACE2に直接結合する。これにより、受容体を介したサイトカインの放出が抑制されると考えられる。このことから、モルヒネおよびコデインは、COVID-19で観察されたサイトカインストームを調節するための免疫抑制剤アジュバントの候補となる(Roshanravan er al)2020b)。しかし、モルヒネの投与時期がサイトカイン産生への影響を大きく左右し、遅く投与するとサイトカイン産生が増加することや、コデインが試験管内試験でマスト細胞によるサイトカインやケモカインの産生を誘導することが確認されていることを考えると、COVID-19に対するモルヒネやコデインの使用を検討するにはさらなる研究が必要である(Sheen et al 2007,Fukada et al 2016)。
ニコチン
ニコチンは、タバコ植物(Nicotiana tabacum L.)に含まれる植物性アルカロイドである。化学的には、3-(1-メチルピロリジン-2-イル)ピリジンである。ニコチンは、免疫調整剤、末梢神経系の薬、向精神薬として知られている(National Center for Biotechnology Information, 2020j)。ニコチンはAsklepiadaceae, Crassulaceae, Solanaceaeのいくつかの科にも含まれている(Dawson et al 1960)。臨床的には、炎症を抑える目的で潰瘍性大腸炎の治療に使用されている。ニコチンはコリン作動薬であるため、a7-ニコチン性アセチルコリン受容体(a7-nAChR)を介してコリン性抗炎症経路で作用し、炎症性サイトカインを抑制する。ニコチンは、TNF、IL-1,IL-6の産生を抑制する。その作用機序は、マクロファージや好中球などの炎症細胞上でa7-nAChRが活性化され、NF-κBの活性化が抑制されることで、炎症細胞からの炎症性サイトカインやケモカインの分泌が抑制されることにあると考えられる。HT-29大腸がん細胞をトリガーとしたPBMCを対象とした試験では、ニコチンはIFNγ、TNF-α、IL-1β、IL-2の分泌を抑制したが、IL-6の産生には影響を与えなかった。しかし、RKO大腸がん細胞をトリガーとしたPBMCでのニコチン処理では、サイトカイン産生を抑制する効果は認められなかった(Djaldetti and Bessler, 2017)。ニコチンは、ヒトのマクロファージおよび脾臓細胞におけるLPS誘導性のTNF-αおよびNF-κBの産生を抑制する。この抑制効果は、JAK2およびSTAT3を活性化するニコチンの能力に起因しており、マクロファージにおけるトリステトラポリン(TTP)の発現によって媒介される(Lakhan and Kirchgessner, 2011)。ニコチンには、IL-1,IL-6,IL-12,INFγ、MIP1,TNF-αの産生を抑制する作用があることが研究で示されている。ニコチンは、I-κBのリン酸化を抑制することで、NF-κBの転写活性を阻害する(Cloëz-Tayarani and Changeux, 2007; Piao et al 2009)。また、ニコチンは身近で承認された治療法でもある。したがって、ニコチンは、COVID-19におけるサイトカインストームを改善することができる適切なアジュバントであり、短期的に上昇する死亡率を低減できる可能性が高いという仮説が立てられている(Farsalinos et al 2020,Gonzalez-Rubio et al 2020)。
ピペリン
ピペリンは、シソ科の植物Piper nigrum L.などから得られるアルカロイドである。化学的には、ピペリジンが窒素原子で(1E,3E)-1-(1,3-ベンゾジオキソール-5-イル)-5-オキソペンタ-1,3-ジエン-5-イル基で置換されたN-アシルピペリジンである(2E,4E)-5-(1,3-ベンゾジオキソール-5-イル)-1-ピペリジン-1-イルペンタ-2,4-ジエン-1-オンである(National Center for Biotechnology Information,2020k)。ピペリンは、抗酸化作用、抗炎症作用、抗菌作用、抗転移作用、肝保護作用など、多くの治療効果を持つことが知られている。また、免疫調整剤でもあり、治療薬のバイオアベイラビリティーを高める性質があることも知られている(Gorgani er al)。 ピペリンは、オバルブミン誘発喘息モデルにおいて、Th2サイトカインIL-4およびIL-5の産生を抑制することが報告されている(Kim and Lee, 2009)。また、別の研究では、ピペリンがNF-κBの活性化を阻害することで、LPSによる炎症性サイトカインIL-1β、IL-6,IL-10,TNF-αの発現・産生を抑制することが報告されている(Dzoyem er al)。2017)。また、ピペリンは、ネズミのマクロファージにおいて、ATPによるAMPKの活性化を抑制することで、マクロファージをパイロプトーシスから保護し、IL-1βの放出を抑制する(Liang et al 2016)。また、ヒトPBMCを用いて行われた別の研究では、ピペリンは、ELISAアッセイおよびRT-PCRデータによって明らかにされたように、IL-2およびIFNγのmRNAの発現を抑制することにより、IL-2およびIFNγの産生を用量依存的に阻害することが判明した(Chuchawankul et al 2012)。ピペリンは、マウスを用いた実験で、NF-κB経路およびMAPK経路を阻害することにより、S. aureusに起因する炎症性サイトカインIL-1β、IL-6およびTNF-αの発現を選択的に抑制し、抗炎症性サイトカインIL-10の発現を増加させることが明らかになった(Zhai er al)2016)。また、関節リウマチ患者由来のIL-1β刺激線維芽細胞様滑膜細胞によるIL-6の発現を、ピペリン処理によって抑制することに成功した。さらに、ピペリンは、核内因子(NF)κBではなく、アクチベータープロテイン1(AP-1)の核内への移動を抑制することができた(Bang er al)。 ピペリンは、ヒト大腸上皮細胞を用いた研究で、LPSによる炎症性サイトカインIL-1β、IL-6,TNF-αの産生量の増加を逆転させることがわかった。このサイトカイン放出の減衰は、ピペリンがIκBαを活性化し、その結果、NF-κBの発現を抑制する能力に起因すると考えられた(Buagaew et al 2020)。B16F-10メラノーマ細胞におけるIL-1β、IL-6,TNF-αおよびGM-脳脊髄液のレベルは、ピペリンの処理によって有意に減少した。さらに、ピペリン処理により、NF-kappaBのp65,p50,c-Relサブユニットや、ATF-2,c-Fos、CREBなどの転写因子の核内移行も減少した。ピペリンは、IκBαの分解やp65の細胞質から核への転位を抑制することで、NF-κBの活性化を阻害する(Pradeep and Kuttan, 2004; Chung, 2019; Yang er al)。 さらに、最近のドッキング研究では、ピペリンがSARS-CoV-2のスパイク糖タンパク質およびACE2受容体に対して有意な結合親和性を示すことが明らかになった。したがって、ピペリンは、ウイルスの宿主細胞への付着を抑制するだけでなく、NF-κBおよびMAPK経路の活性を抑制し、その後の炎症性サイトカインの放出を抑制することで、サイトカインストームを標的とする有用な治療薬となる可能性がある(Maurya et al 2020)。
ケルセチン
ケルセチン(2-(3,4-dihydroxyphenyl)-3,5,7-trihydroxychromen-4-one)は、ブロッコリー、赤タマネギ、ナス、ジャガイモ、セロリ、レタスなどの緑葉野菜、リンゴ、柑橘類、赤ブドウ、トマトなどの果物、クランベリー、ラズベリーなどのベリー類など、多くの植物に豊富に含まれているポリフェノール性フラボノイドである。ケルセチンの抽出物は、リウマチ性疾患、心血管疾患、高コレステロール血症、感染症、および癌の予防および治療に使用されている(Li er al)2016;National Center for Biotechnology Information 2020l)。ケルセチンは、サイトカインの産生に影響を与えることが分かっており、ポリイノシン-ポリシチジル酸で誘導したマウスマクロファージにおいて、炎症性サイトカインTNF-α、IL-6,G-脳脊髄液、GM-脳脊髄液、VEGFおよびケモカインIP10,MCP1の産生を減少させ、インフルエンザAで処理したMDCK細胞において、抗炎症性サイトカインIL-27のレベルの増加をもたらすことが分かっている(Kim and Park, 2016; Mehrbod et al, 2018)。また、培養した血液末梢単核細胞において、T-ヘルパー細胞を刺激してIFNγを産生し、Th2由来のIL-4をダウンレギュレートすることがわかった(Biancatelli er al)。 カラギーニンによるIL-1βの産生は、ケルセチン処理により有意に減少した(Valério er al)。 ケルセチンは、正常なPBMCを用いた研究において、用量依存的にTNF-αの産生を顕著に減少させた。炎症性サイトカインTNF-αに対するケルセチンのこの抑制効果は、NF-κB1およびIκBの調節を介して媒介される(Nair et al 2006)。ケルセチンを投与すると、RAW 264.7細胞において、LPSによる炎症性因子IL-1β、IL-6およびTNF-αの増加レベルが減少することがわかった。炎症性サイトカインの産生を抑制するケルセチンの能力は、ERKおよびp38 MAPキナーゼとNF-κB/IκBのシグナル伝達経路の活性化を抑制することによって媒介される(Tang et al 2019)。LPSで刺激したRAW 264.7細胞を対象とした研究では、ケルセチンはリン酸化されたERKキナーゼとp38 MAPキナーゼの活性化を低下させた。JNK MAPキナーゼには有意な影響は見られなかった。さらに、ケルセチンは、NF-κB/IκB複合体の活性化およびIκBの分解も抑制した(Cho er al)。 ケルセチンは、IL-1βで刺激したヒト網膜色素上皮(ARPE-19)細胞において、IL-6,IL-8,MCP1およびICAM1のレベルを用量依存的に減少させた。ケルセチンは、炎症プロセスに関連するシグナル伝達経路を阻害することがわかった。ケルセチンは、マイトジェン活性化プロテインキナーゼ(MAPKs)のリン酸化阻害、核因子κ-Bキナーゼ(IKK)α/β、c-Jun、cAMP応答要素結合タンパク質(CREB)の阻害、転写因子2(ATF2)と核因子(NF)-κB p65の活性化、NF-κB p65の核内への移行の阻害など、炎症プロセスに関連するシグナル伝達経路を阻害することが明らかになった(Cheng er al)。 , 2019). また、冠動脈疾患患者を対象とした別の研究では、ケルセチンの投与により、IL-1β、TNF-αのレベルの低下がもたらされ、IL-10のレベルも低下する傾向が見られた。これは、NF-κBの転写活性の低下によるものと考えられる(Chekalina er al)。 ケルセチン治療による経口補給は比較的安全で、目立った副作用はなく、ある研究では30人中2人のメンバーに頭痛と一時的な末梢神経麻痺が観察されただけであった。ケルセチンをアジュバントとして使用することで、IFNsの産生を促進し、炎症性サイトカインおよび抗炎症性サイトカインのレベルを調節することで、免疫反応を同時に強化することができるため、COVID-19の治療において現在使用されている介入を補完できる可能性がある(Biancatelli et al 2020)。
レスベラトロール
レスベラトロール(5-[(E)-2-(4-hydroxyphenyl)ethenyl]benzene-1,3-diol)は、ポリフェノール性のフィトアレキシンであり、ブドウ、クランベリー、ブルーベリー、クワ、ピーナッツ、ジャックフルーツ、大豆、ワインなど70種以上の植物に含まれている。レスベラトロールには、抗酸化作用、抗がん作用、抗炎症作用、抗ウイルス作用、抗老化作用、延命作用など、多くの有益な健康効果があることが知られている(Bansal er al)。2018; National Center for Biotechnology Information, 2020m)。レスベラトロールは効率的な免疫調節剤であり、免疫細胞の調節、炎症性サイトカインの合成、遺伝子の発現を妨げ、免疫を調節する(Malaguarnera, 2019)。実施された研究では、レスベラトロールは脾臓リンパ球によるIFNγおよびIL-2の不可逆的な阻害、および腹膜マクロファージによるTNF-αおよびIL-12の産生を引き起こした。NF-κBの活性化は、基礎的なNF-κB活性に影響を与えることなく阻害された(Gao et al 2001)。別の研究では、COPD患者の刺激された肺胞マクロファージによる炎症性サイトカインおよびケモカインの放出(GM-脳脊髄液およびCXCL8)が、レスベラトロールによってブロックされた(Culpitt et al 2003)。レスベラトロールは、EV71に感染したRD細胞におけるIL-6およびTNF-αの分泌増加をブロックする(Zhang er al)2015)。さらに別の研究では、レスベラトロールによる処理は、試験管内試験でIL-1α、IL-6およびTNF-αの用量依存的な阻害を誘導し、HTLV-1感染細胞におけるIL-17の産生をダウンレギュレートした(Fuggetta er al)。 レスベラトロールの投与は、肺の炎症細胞におけるNF-κBのダウンレギュレーションと関連していることが分かった(Rieder er al)。 レスベラトロール処理を施したマクロファージでは、LPSによるIκBαのリン酸化と分解が阻害され、NF-κBのDNA結合活性が低下する。NF-κB経路に対するレスベラトロールの抑制効果は、IKK活性の低下をもたらす能力と相関している(Yamamoto and Gaynor, 2001)。豚におけるレスベラトロール乾燥懸濁液の有効性を評価した研究では、レスベラトロールがIFNγの放出をアップレギュレートし、TNF-αの放出をダウンレギュレートし、その結果、体液性免疫応答を調節することが判明した(Fu er al)2018)。炎症条件下の脂肪細胞において、レスベラトロール処理により、炎症性サイトカインIL-6,IL-8およびMCP1のレベルの用量依存的な減少が観察された(Zagotta et al 2015)。レスベラトロールのTNF-α、IL-6,MIP2レベルに対する抑制効果は、急性咽頭炎のウサギモデルを用いた研究で立証された。レスベラトロールは、IL-1βおよびIL-18のタンパク質発現を減少させた。さらに、レスベラトロールを投与すると、TLR4および骨髄分化一次応答タンパク質88のタンパク質発現が抑制され、p-NF-κBが減少し、p-IκBのタンパク質発現が増加した(Zhou er al)2018)。レスベラトロールによる治療では、サイトカインIL-1β、IL-6,IL-8,IL-12,TNF-αの産生低下が、用量および時間依存的に観察された(Rizzo er al)。 レスベラトロールは、補助的な用量で摂取しても安全であると考えられる。レスベラトロールは、サイトカインストームを緩和し、結果的に炎症を抑えるため、SARS-CoV-2感染症の補助剤として検討することができる(Marinella et al 2020)。
COVID-19療法のアジュバントとして使用できる可能性のある、さらにいくつかの植物由来の免疫抑制剤を表1に記載する。
表1 植物由来の免疫抑制剤とその炎症性サイトカインへの影響
| S.いいえ | 天然免疫調節剤 | 植物源 | 免疫作用 | サイトカインへの影響 | 考えられる作用機序 | 調査 | 参考文献 |
|---|---|---|---|---|---|---|---|
| 1 | シトラール | 柑橘系の果物、レモングラス | 免疫抑制剤 | IL-1βおよびIL-6の放出、IL-10の産生を阻害します | NF-κBの阻害 | LPSでチャレンジされたマクロファージ | バチエガ他 (2011) |
| IL-1β、IL-4、INFγ、TNFα産生の低下; NLRP3インフラマソーム活性化を阻害します | ATP誘導性のカスパーゼ-1活性を阻害します。NF-κB、p65の活性化を阻害します | LPS誘発マウスASLNモデル | Ka etal。(2015) | ||||
| 2 | ジンセノサイド | 人参人参CAMey。、P.三七(Burkill)FHChen。、P. quinquefolius L.、P.ミヤコグサVAR。メジャー(バーキル)CYWu。とfeng(およびpanax属の他のメンバー) | 免疫抑制剤 | TNFα、IL-6、IL-1β、IL-12p40、CXCL2mRNA発現の低下; 増強されたIL-10発現 | NF-κBおよびMAPK経路を阻害します | LPSでアクティブ化されたBMDM | Paik etal。(2019) |
| IL-6、TNFαおよびIL-10の発現をダウンレギュレートします | NF-κBの活性化を阻害します | II / Rはinvivoで肺損傷を誘発しました | 江ら。(2014) | ||||
| 3 | ケンペロール | デルフィニウム、マンサク、グレープフルーツ、その他の植物源 | 免疫抑制剤 | TNFα、IL-1β、IL-6、ICAM1、VCAM1の過剰産生の減少 | TLR4、NF-κBおよびSTATシグナル伝達における負の調節 | LPS誘発ラット腸微小血管内皮細胞(RIMVEC) | ビアンら (2019) |
| IL-6、IL-8およびTNFαの放出阻害 | PKCの活性化を抑制θ | C57BL / 6抗BDF1MLC | Kempuraj etal。(2005) | ||||
| 4 | ウィザフェリンA | Withania somnifera(L.)Dunalおよびナス科の他のメンバー | 免疫抑制剤 | IL-1α、IL-1β、IL-2、IL-3、IL-5、IL-10、IL-12p70、IL-13、IL-18、IP10、GM-CSF、CCL2 / MCP-1、CCL17を阻害します/ TA RC、SDF1α/ CXCL12およびCCL20 /MIP3α | NF-κBとインフラマソーム複合体を標的とします(NF-kBの核移行をブロックし、カスパーゼ-1の活性化を阻害します) | ATP刺激単球由来THP-1細胞 | Dubey etal。(2018) |
| IL-6、IL-8、IL-1α、MIP1α、MIP1β、G-CSFおよびIP10の用量依存的な減少 | NF-κb阻害 | マウスおよびヒトの膵島細胞; 試験管内で | SoRelle etal。(2016) |
結論
COVID-19のパンデミックは、世界中の何百万人もの人々に影響を与えている。SARS-CoV-2に感染した一部の患者では、免疫反応として、いくつかの炎症性サイトカインやケモカインが動員され、持続的に産生され、サイトカイン・ストームが生じている。このサイトカイン・ストームは、本疾患における一般的な死亡原因の1つであると考えられる。このため、この過剰な宿主の免疫反応を効率的に弱めることができる適切な治療戦略が必要とされている。COVID-19患者の治療には、コルチコステロイド、インターロイキン受容体拮抗剤、JAK/STAT阻害剤、トシリズマブ、サリルマブ、インフリキシマブ、アダリムマブなど、特定のサイトカインを標的とするモノクローナル抗体など、さまざまな合成免疫調節剤が評価されている。残念ながら、これらの免疫調整剤のほとんどは副作用を引き起こすことが知られており、その使用は制限されている。植物由来の免疫抑制剤は、COVID-19で観察されるサイトカインストーム症候群を管理するための貴重な選択肢となる。植物由来の免疫抑制剤は、安全性が高く、シグナルカスケードにおける決定的な反応を抑制することで、特定のサイトカインの産生および放出を特異的に制御する。さらに、これらの薬剤の中には、コロナウイルスに対する抗ウイルス作用を示すものや、SARS-CoV-2の主要プロテアーゼを阻害する可能性のあるものもある。この有望な治療法を活用するためには、COVID-19の投与量、投与時期、生物学的有効性、生物学的利用能、作用機序、安全性などを調査する臨床試験が必要である。SARS-CoV-2感染症に対しては、単一の薬剤を単独で使用するよりも、植物由来の免疫抑制剤と抗ウイルス剤などを含む併用療法が効果的である。このように、サイトカイン・ストームを改善するために天然の免疫抑制剤を含む相乗的な治療法は、大きな治療の可能性を秘めている。
