Contents
Aging and diabetes drive the COVID-19 forwards; unveiling nature and existing therapies for the treatment
2021 Jun 24
グラフィカルな要旨
ヒトSARSコロナウイルス-2(SARS-CoV-2)は、これまでに世界中で1億7,000万人以上が感染し、350万人以上が死亡している。この感染症は、あらゆる年齢層の人々にコロナウイルス症(COVID-19)を引き起こし、特に糖尿病患者や高齢者では感染性や致死性のリスクが高い。この病気で死亡した患者の約35%は糖尿病患者であった。この感染症は、免疫反応の弱まり、慢性炎症、そして潜在的な直接的な膵臓の障害と関連している。SARS-CoV-2感染症と糖尿病、加齢との間には、3つの関連性があるようだ。COVID-19感染症は代謝合併症を引き起こすため、健康な人でも糖尿病を誘発し、老化を促進する可能性がある。本研究では、COVID-19と糖尿病における老化促進のメカニズムと、これら3つの疾患の相関関係についてまとめた。COVID-19の治療薬開発には、前臨床試験や臨床試験の段階にある様々な薬剤候補が期待されているが、この疾患を治療するために承認された薬剤は今のところない。ここでは、COVID-19治療のための抗糖尿病および抗老化天然化合物の可能性について検討した。また、SARS-CoV-2に感染した患者や感染後の症候群を治すために、植物由来の天然物を用いたさまざまな治療戦略を検討した。
キーワード ヒトSARSコロナウイルス-2,糖尿病、老化、レスベラトロール、クルクミン、カテキン、メトホルミン、ポリフェノール、ACE-2
はじめに
コロナウイルスは、一本鎖のポジティブセンスRNAのゲノムを持ち、哺乳類や鳥類に病気を引き起こすウイルス群である。今回のCOVID-19パンデミックは、ヒトSARSコロナウイルス-2(SARS-CoV-2)によるもので、すでに世界的に知られているが、有効な治療薬がないために重篤な感染症と高い罹患率・死亡率を示している。今回のパンデミックの原因となったSARS-CoV-2は,ヌクレオカプシドタンパク質,スパイクタンパク質,エンベロープタンパク質,膜タンパク質の4つのタンパク質(図1)から構成されている[1]。ヌクレオカプシドタンパク質(図1A)は,RNAゲノムに結合している。スパイクタンパク質(図1B)は,コロナウイルスの感染サイクルにおいて多機能な役割を果たしており,ウイルスの宿主細胞への侵入も容易にする。膜タンパク質は、ウイルスのエンベロープの形状を決定する構造的な役割を果たし、ウイルスの組み立てにも関与している。エンベロープタンパク質は、膜タンパク質と相互作用してウイルスのエンベロープを形成する。ウイルスのスパイクタンパク質が宿主細胞の受容体であるアンジオテンシン変換酵素2(ACE-2)を認識して結合すると、感染が開始される[2]。このウイルスは、ACE-2を発現している細胞のみを標的とし、他のSARSコロナウイルスと比較して非常に高い結合親和性を持っている[3]。この結合に続いて、特定のプロテアーゼ(TMPRSS2およびfurin)によってスパイクタンパク質が切断され、宿主細胞への膜融合が起こる。これにより、ウイルスゲノムの宿主細胞への侵入が促進される[4, 5]。ウイルスは宿主の機械を引き継いでゲノムを複製し、複数のサブユニットからなる複製-転写酵素複合体(RTC)の形成を促し、転写を行って新しいウイルスRNAを生成する。細分化された転写により、入れ子状になったサブゲノムRNA群(sgRNA)が生成され、これが翻訳されて、ウイルスの構造タンパク質やアクセサリータンパク質が形成される。タンパク質の合成は、小胞体に取り付けられたリボソームで行われる。ウイルスの構造タンパク質(スパイクタンパク質、膜タンパク質、エンベロープタンパク質)は小胞体に挿入される。ヌクレオカプシドタンパク質は、ウイルスゲノムと結合して核タンパク複合体を形成する。小胞体-ゴルジ体中間コンパートメント(ERGIC)と呼ばれる別の複合体が、新しいビリオン粒子の放出を促進する[2]。成熟したビリオンはゴルジ装置で生成され,エキソサイトーシスによって細胞外空間に移動する[2, 6]。
図1
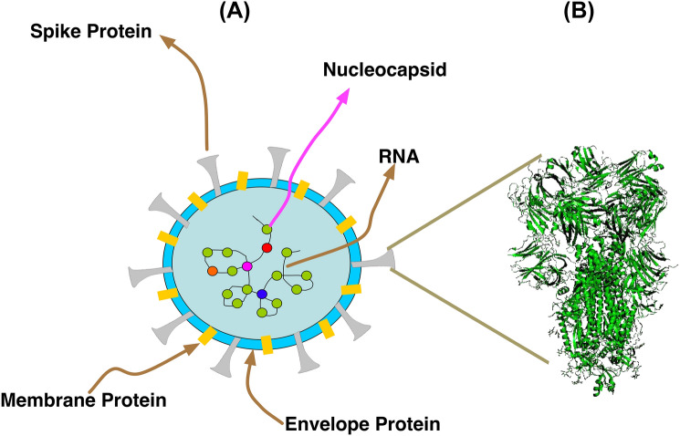
A コロナウイルスの構造概要
B スパイクタンパク質のX線結晶構造 (PDB id: 6ZDH)。スパイクタンパク質は、感染初期のウイルスと宿主の相互作用に重要な役割を果たしている
COVID-19パンデミックは、新たに認識されたヒトSARS-CoV-2株の感染によって引き起こされる。この病気は 2019年12月に中国の武漢で初めて報告され、現在では世界195カ国以上に広がり、1億7,000万人以上に影響を与え、350万人以上の死亡者を出している。原因となるウイルスは、呼吸器の飛沫やエアロゾルを介して人から人へ感染する。他の多くのコロナウイルスと同様に、呼吸器を介して広がる。症状は、無症状のものから、高熱、空咳、喉の痛み、息苦しさ、疲労感、味覚や嗅覚の喪失など様々である。SARS-CoV-2感染の診断に用いられる一般的な方法は、口腔咽頭または鼻咽頭サンプルのRT-PCR、または抗体検査である。抗体検査では、過去の感染に関する情報も得られる可能性があるが[7, 8]、非常に早い段階で感染を検出することができない。RNAベースの検査であるRT-PCRは、初期段階の感染も検出することから、COVID-19診断のゴールドスタンダードと考えられている。RT-PCRは、SARS-CoV-2のRNAを高度に標準化された方法で検出することができるが、サンプルに感染細胞が含まれていなかったり、RNAの抽出が不正確であったりすることで、偽陰性の診断となる可能性がある。そのため、最近では偽陰性の検出を最小限に抑えるための代替プロトコルも提案されている[8]。
SARS-CoV-2に対して今後開発されるであろう抗ウイルス剤は、特定のウイルス成分を標的としている可能性があるが、ウイルスRNAの複数の変異や新たなウイルスの変種により、これらの抗ウイルス剤に対する耐性が現れる可能性が高いと考えられる。したがって、ウイルスの複製、ビリオンの組み立て、およびその放出を制御する宿主細胞成分を標的とした治療薬は、今後の薬剤開発に付加価値をもたらす可能性がある。
COVID-19の際の免疫反応
コロナウイルスに対する免疫反応についての理解は、現時点では非常に限られている。しかし、ヒトSARS-CoV-2と他のコロナウイルスとの配列相同性や、免疫シグナルの保存性から、結果は他のコロナウイルス感染症と類似していると予想される。パターン認識受容体(PRR)は、ウイルス感染に反応して、病原体関連分子パターン(PAMP)を識別する。トール様受容体(TLR)やNOD様受容体(NLR)は、ウイルス感染に反応して活性化されるPRRの一例である。これらの受容体が活性化されると、サイトカインが産生される。インターフェロンI型とIII型は、COVID-19の感染を抑えることができる最も重要なサイトカインである。その他のサイトカインとしては、炎症性の腫瘍壊死因子α(TNF-α)や、インターロイキン-1(IL-1)IL-6,IL-18などがある[9, 10]。コロナウイルスに感染した患者では、炎症促進反応による「サイトカインストーム」も観察されており、この病気の病原性はインターフェロン反応の不均衡と相関している。宿主の抗ウイルス反応と炎症反応の相関関係を理解するには、さらなるデータと研究が必要である。
COVID-19感染症には、糖尿病、心血管疾患、高血圧など様々な併発疾患がある[10, 11]。いくつかの報告や臨床研究によると、糖尿病を持つCOVID-19患者はより集中的な治療を必要とし、回復の可能性が低いことが示唆されている[12-14]。また、ウイルス感染率の高さや重症化と関連するもう一つの要因として、高齢化が挙げられる。高齢者は免疫力が弱く、一般的にウイルス感染症が重症化しやすいのであるが、COVID-19感染症の場合、そのような患者の重症度と死亡率が高くなる。興味深いことに、糖尿病患者では老化が促進されるという研究結果もある。医薬品の開発は、前臨床および臨床開発のさまざまな段階を経て何年もかかる時間のかかるプロセスであるため、科学的根拠に基づいて既存の天然化合物を治療のために探索することができる。そこで、抗ウイルス、抗糖尿病、アンチエイジングなどの効果が期待できる植物由来の天然化合物についても検討した。最も重要なことは、これらの化合物は、生命を脅かす副産物や化学反応が一般的になく、安全に摂取できることである。
糖尿病、老化、そしてCOVID-19
注目すべきは、糖尿病を持つ老齢の患者は、SARS-CoV-2による感染症の重症化のリスクが非常に高いということである。また、COVID-19は、過去に糖尿病の病歴がない人でも、糖尿病にスイッチを入れることができると報告されている[8]。糖尿病とCOVID-19の間には双方向の関連性があり、COVID-19は糖尿病患者の高血糖病態に深刻な影響を与えるだけでなく、糖尿病患者は非糖尿病患者と比較して重篤な合併症や死亡のリスクを発症しやすくなると言われている。さらに、COVID-19後症候群(ウイルス検査で陰性となった後も、病気の症状が長期間持続する状態)では、糖尿病を発症する可能性が何倍にも高まる[15]。
糖尿病患者は、心血管疾患、創傷治癒の遅延、足の感染症、眼関連疾患など、その他の感染症や疾患のリスクが高くなる[16,17]。糖尿病患者では、免疫システムが弱まり、T細胞やマクロファージによるサイトカインの乱れた放出が起こり、その結果、複数のシステムの調節障害が生じる。CD8+T細胞からのインターフェロン(IFN-αおよびIFN-γ)の合成と分泌が減少し、新しい樹状細胞とナチュラルキラー(NK)細胞の数が減少して、免疫反応がさらに低下する。さらに、ウイルスはグルコース濃度が高くても生存する可能性があり、病気を排除することが難しくなる[18]。また、糖尿病患者ではIFN-I(抗ウイルス免疫反応に重要な因子)のレベルが低いことが、糖尿病の既往があるCOVID-19患者の死亡率が高い理由であると考えられる。インターフェロンは、ウイルス感染症の治療に使用できる可能性があり、IFN-αの点鼻薬を感染症の予防に使用したところ、有望な結果が得られた[10, 19]。COVID患者にインターフェロンを投与した場合、糖尿病患者と非糖尿病患者で反応が異なるかどうかを調べることは興味深いことである。
また、糖尿病は生物学的老化プロセスを促進し、高齢者の約30%が糖尿病を患っていることから、糖尿病の頻度は年齢とともに急増する[20]。高齢者に糖尿病が発症し、加齢と関連することを説明するために、さまざまなメカニズムが提案されている。老化の進行には、非酵素的な糖化のプロセスが重要な役割を果たしている。グルコースとタンパク質の化学的相互作用によって生成されるAGEs(advanced glycation end products)の生成は、糖尿病を促進する[21, 22]。AGEは体内に蓄積され、細胞内の他の分子と架橋を形成する。さらに、糖尿病患者では、酸化的損傷の増加、Na/K ATPase活性の上昇、毛細血管基底膜の肥厚、DNA巻き戻し速度の低下などの要因により、生物学的老化が促進されるという。さらに、糖尿病が心血管疾患や高血圧症と関連していることも、老化を加速させる要因となっている。
COVID-19患者における酸化ストレスの増加については、複数の報告がある[23-25]。ウイルスが宿主細胞に侵入した後、免疫系はマクロファージや樹状細胞を生成し、活性酸素(ROS)を発生させる。レドックスバランス(プロオキシダントとアンチオキシダントの比率)が低下している人では、ROSが赤血球の破壊や好中球の活性化を引き起こし、その結果、スーパーオキシドラジカルや過酸化水素を形成する呼吸バーストが発生する。これらのスーパーオキシドや過酸化物は酸化ストレスを引き起こし、これが「サイトカインストーム」を開始し、その結果、COVID-19の重症化を招く[23]。酸化ストレスは、糖尿病の発症と進展にも重要な役割を果たしている。細胞のインスリン抵抗性は、タンパク質の非酵素的な糖化、グルコースの酸化、脂質の過酸化の急増によるフリーラジカルの形成によって起こる[22]。酸化ストレスにより発生した活性酸素は、インスリンのシグナル伝達を抑制し、インスリン抵抗性を引き起こす。この活性酸素は、DNA、脂質、タンパク質、その他の細胞構成要素の破壊を引き起こし、細胞機構の損傷につながる。これらの損傷を受けた構成要素が積み重なることで、老化が加速する[26]。
加齢は、糖尿病の管理を困難にする。耐糖能は、ナイーブT細胞の数や新しい抗原を認識する能力の低下に加えて、加齢とともに劇的に低下する。IL-2のようなサイトカインの発現やシグナル伝達も影響を受ける。インターフェロン-1(IFN-1)の発現も高齢者では減少する。細胞を介した免疫反応の低下は、高齢者の合併症をさらに増加させる。COVID-19を発症した高齢者は、感染症の重症化や致死のリスクが高く、加齢症状が加速することは、今までによく知られている。生物学的老化や糖尿病のバイオマーカーがCOVID-19の強度を評価するのに使えるかどうか、さらに評価する必要がある。
老化は、糖尿病と相互に病態生理学的な関係を持つアルツハイマー病のようないくつかの他の疾患にもつながる可能性がある[27]。また、糖尿病、加齢、COVID-19に関連するもう一つの側面として、性別による統計がある。男性は糖尿病[28, 29]や加齢[30]の影響を受けやすく、COVID-19でも同様に男性の死亡率が高い傾向が見られる。老化、糖尿病、COVID-19には直接的な関係があるので、1つの治療法で3つの病気を同時にコントロールできる可能性がある。ここでは、これらの疾患の治療のために可能性のあるいくつかの治療薬と天然化合物について説明した。
COVID-19の治療のための潜在的な治療アプローチ
広く研究されていない最も重要な点の一つは、糖尿病患者や高齢者におけるSARS-CoV-2感染後の影響である。コロナウイルス感染後の症候群は、無症候性の患者(感染者の約70%)の生物学的老化を促進し、その結果、寿命を縮めるのか?これは、重要な問題である。COVID-19からの回復期に、あるいは回復後に、筋肉細胞の死が加速し、悪液質になったという報告がある[31]。悪液質は、がんを含む複数の疾患と関連しているが[32]、老化や糖尿病の特徴の1つとしても観察される[32, 33]。糖尿病は老化やウイルス感染の感受性を高めることが知られているため、COVID-19に対する治療に役立つ効果的な薬剤は、抗糖尿病かつ抗老化であり、SARS-CoV-2感染による重症化を回避するための予防的または長期的な解決策となり得ます。ここでは、安全性の高い天然化合物を用いた、COVID-19に対する様々な治療戦略について説明する。
ポリフェノール類
ポリフェノールは、構造単位としてフェノールの大きな倍数を持ち、植物などの天然資源に豊富に含まれているだけでなく、化学的に合成することも可能な化合物群である。植物由来のポリフェノール(フラボノイド、フェノール酸、スチルベン)は、高い抗酸化作用を持ち[34]、血糖値[35]の低下に役立つ。レスベラトロール、クルクミン、カテキン、プロシアニジンなどのポリフェノールには、抗糖尿病作用がある。ある種のポリフェノールには、ウイルス感染[36]を治療する可能性があるだけでなく、老化プロセスを遅らせる可能性もあるという証拠がある[37-39]。ポリフェノールがCOVID-19を治療する可能性を評価するには、さらに多くの研究が必要であるが、ポリフェノールは、ウイルス感染の予防と治療のために探究できる複数の潜在的な薬剤を提供する可能性がある。
レスベラトロール
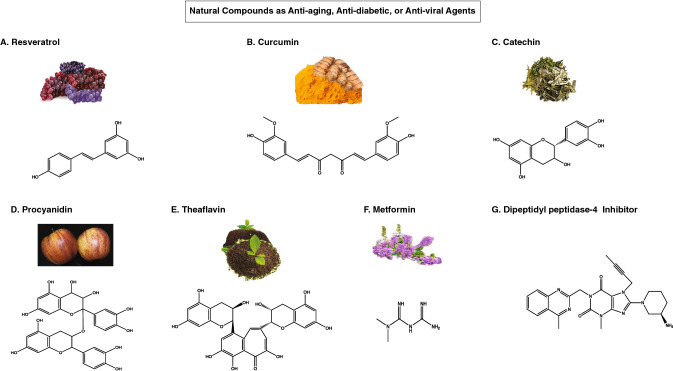
レスベラトロール(3,5,4′-トリヒドロキシ-トランス-スチルベン)(図2A)は、ブルーベリー、ブドウ、クランベリーなどの植物から天然に得られるポリフェノールであり、赤ワインにも含まれている。レスベラトロールは,新興の呼吸器系ウイルス,特にMERSウイルスの複製を阻害する可能性があることが,試験管内試験の研究で示されている[40, 41]。また、レスベラトロールは、TNF-α誘発効果やIL-6 mRNAの発現を阻害することで、炎症に対して有効であることが知られている[42]。さらに、レスベラトロールは魚類のTNF-αプレmRNAスプライシングをダウンレギュレートし、炎症を抑えることが示されている。さらに,サイクリックアデノシン一リン酸(cAMP)分子を分解するホスホジエステラーゼ(PDE)(主にPDE3B,PDE8A,PDE10A)の活性を停止させる作用もある。このcAMPは、グルコースやインスリンの分泌に重要な役割を果たしていることが知られている。細胞内のcAMPの増加は、インスリンを増加させ、β細胞の機能を高める細胞シグナル伝達経路を促進する。レスベラトロールは、ウイルスのヌクレオカプシドタンパク質を標的とした抗ウイルス活性を有することが示されている。
図2 A-G 糖尿病や老化とともにCOVID-19を治療する可能性のある植物由来の天然化合物の化学構造
レスベラトロールは、老化関連経路を制御するサーチュイン(SIRT1)の活性を調節する。シグナルカスケードを介して、ミトコンドリア活性の上昇をもたらし、体内の酸化ストレスの影響を減少させる。また、細胞接着分子やNF-κBなどの炎症マーカーを抑制する。また、NO(一酸化窒素)産生の増加にも関連しており、血管弛緩作用を高める。また、脂肪の動員、脂肪酸の酸化、脂肪分解、体重減少、全体的なアンチエイジング効果を向上させる[43]。
クルクミン
クルクミン(diferuloylmethane)(図2B)は,ウコンに含まれる天然のポリフェノール化合物である。抗酸化作用を示し,NF-κB活性を抑制し,p53活性を増加させることから,抗がん作用があるとされている[44, 45]。インスリン抵抗性を高め、高血糖を改善することが示されている。グルコースと脂肪酸の酸化を制御するアディポネクチンをアップレギュレートする。また、抗炎症作用と抗酸化作用があることから、アンチエイジングにも効果が期待されている。
クルクミンは、いくつかのin silico研究[46-48]で示されているように、SARS-CoV-2感染症を抑制する可能性がある。しかし、抗ウイルス剤としてのクルクミンの可能性を評価するには、さらなる研究が必要である。分子レベルでは、クルクミンは2つの異なるメカニズムで作用することが示唆されている。1つ目のメカニズムでは、ウイルスのスパイクタンパク質と宿主タンパク質の相互作用を阻害する。本剤は、ウイルスのS-protein(受容体結合ドメイン)と、ウイルスと宿主細胞の結合に必要な宿主タンパク質であるACE-2の両方に結合親和性を持つ。宿主とウイルスの相互作用を阻害することで、体内でのウイルスの増殖や拡散を防ぐことができる。クルクミンは、ACE-2タンパク質の発現を増加させ、膵臓におけるインスリンの分泌増加を促進することで、さらに糖尿病を調節することができる。
また、クルクミンは、アンジオテンシンII-AT1受容体-シグナル伝達経路の炎症促進作用を調節し、呼吸困難を減少させるため、ウイルス感染症の治療に利用できる可能性がある。さらに、IL-6,IL-8,IL-10などの炎症性サイトカインと抗炎症性サイトカインの活性を調節し、COVID-19の際に起こるサイトカインストームを緩和する[49]。サイトカインの機能のひとつに、白血球のNADPHオキシダーゼをアップレギュレートすることによる活性酸素種(ROS)の形成がある。また、IL-6などのサイトカインが異常に産生されると、インスリン抵抗性に関係することから、サイトカインの調節と糖尿病は互いに関連している[50]。このように、クルクミンは、重複するシグナル伝達経路と共通の中間体を介して、ウイルス感染、糖尿病、老化に対してどのように作用するかを紹介した。
カテキン類(フラバノール)
お茶、ココア、ベリー類などに含まれるフラボノイドのような抗酸化物質である。化学的には、2つのベンゼン環、複素環式のジヒドロピラン、3つの炭素部分に水酸基を持つ環を持っている(図2C)。お茶にはさまざまな種類のカテキンが含まれているが、緑茶に含まれるエピガロカテキン-3-ガレート(EGCG)は、COVID-19感染症の治療に最も有望なカテキンの1つである[51]。EGCGは、豚繁殖・呼吸器症候群ウイルス(PRRSV)感染症に対しても有効であることが証明されている[52]。研究によると、カテキンはグルコースのホメオスタシスを助けることがわかっている。さらに、カテキンは、インスリン依存性のGLUT4トランスポーターの転位を助ける。分子シミュレーション研究では、カテキンがウイルスのS-proteinとACE-2受容体に二重に結合する親和性を持つことが示されている。さらに、茶カテキンは、マロンジアルデヒド(MDA)レベルを低下させ、膜の-SH基を酸化から保護することで、赤血球の酸化ストレスを軽減することが示されている。
プロシアニジン
プロシアニジンは、フラボノイド(カテキン、エピガロカテキン、エピカテキン、ガロカテキン)がオリゴマー化またはポリマー化したものである(図2D)。IL-6やMCP-1の活性を低下させ、アディポカインやアディポネクチンの濃度を上昇させ、抗炎症作用を示す。また、AMPキナーゼ(AMPK)やインスリンシグナル伝達経路をアップレギュレートすることで、GLUT4のトランスロケーションを誘導することが知られている[53]。
プロシアニジンは,SARS-CoV-2感染に対する抗ウイルス作用を有することが示されている。計算機上の研究では,プロシアニジンB2がSARS-CoV-2のプロテアーゼに親和性を持つことが示されている[54]。プロテアーゼは、ポリタンパク質のタンパク質分解処理に関与し、宿主細胞内でのウイルスの複製に重要な役割を果たしていることから、プロシアニジンとの結合親和性は、SARS-CoV-2感染の制御に役立つと考えられる。プロシアニジンは、レスベラトロールとともに、代謝調節に関わるAMPKやサーチュイン-1の活性を調節することで、アンチエイジング効果を発揮する。
テアフラビン
テアフラビンは、ポリフェノールの一種で(図2E)高い抗酸化作用と抗高血糖作用を示する。テアフラビンは、グルコース代謝に関与するヘキソキナーゼ、ピルビン酸キナーゼ、グルコース-6-リン酸デヒドロゲナーゼの酵素活性を高める。グリコーゲン合成酵素を亢進させ、肝臓と筋肉のグリコーゲン量を改善する [55]。さらに、グルコーゲン生成およびグリコーゲン分解酵素の活性を低下させる。
これらのポリフェノールは,計算機上の研究で示されているように,ウイルスのスパイクタンパク質(受容体RBDタンパク質)と結合し,宿主とウイルスの結合を阻害する可能性があるが[56],これらの化合物のウイルスに対する有効性を評価するには,試験管内試験および臨床研究を行う必要がある。これらの化合物の抗酸化作用およびフリーラジカル消去作用[57]は、アンチエイジングに有効な化合物である。これらの化合物は、赤血球のマロンジアルデヒド(MDA)細胞内の還元型グルタチオン(GSH)および細胞膜レドックスシステム(PMRS)の酵素を調節する。
メトホルミン
メトホルミンは抗高血糖薬であり,大きな副作用もなく,ヒトにおいて多面的な機能を発揮する(図2F)。メトホルミンは,主に糖尿病の治療に用いられ,肝臓疾患,心血管疾患,肥満,癌の治療にも試験されている[58]。メトホルミンは肝細胞のAMPKを活性化し,筋肉へのグルコースの取り込みを促進する。また,メトホルミンは,TNF-αを阻害して抗炎症反応を引き起こし,COVID-19の重症化の鍵となる事象の1つである「サイトカイン・ストーム」を抑制する。メトホルミンがコロナウイルスの活動を阻害する方法は、いくつかある[59]。
メトホルミンは、メトホルミン-AMPK-ACE-2複合体を形成することで、ウイルス-宿主-細胞間の相互作用を阻害する可能性がある。ウイルスのスパイクタンパク質とACE-2の結合は、感染の最初のステップである。スパイクタンパク質の受容体結合ドメイン(RBD)とACE-2は、通常のウイルス感染時に相互に作用する。メトホルミンは、このウイルスと宿主細胞の結合を阻害すると同時に、ACE-2タンパク質の活性化を高める。メトホルミンは、AMPKを活性化することで、ACE-2タンパク質をリン酸化する。このリン酸化は,ウイルスタンパク質とACE-2受容体との結合を立体的に阻害し,両者の会合を中断させる[59, 60]。
さらに,メトホルミンは抗加齢作用を示すが,これもACE-2タンパク質の発現量の増加に起因すると考えられている[59]。ACE-2タンパク質は、アンジオテンシンIIからアンジオテンシンへの変換を触媒し、活性酸素の発生やアポトーシスを減少させることが知られている。したがって、全体的に見て、メトホルミンは、安全性が高く、抗糖尿病、抗ウイルス、抗老化の効果に利用できる可能性がある[60]。
また,メトホルミンは,他のいくつかのウイルスの病態に関与する重要な経路であるmTOR経路を阻害する可能性がある[61]。メトホルミンは、mTORシグナルカスケードを負に制御する肝キナーゼB1(LKB1)を調節することで、この経路を阻害する[62]。また,メトホルミンは,mTOR経路の活性化因子であるAKT(プロテインキナーゼB)の発現を抑制する。メトホルミンはアンチエイジングの可能性を示し,さらに虚弱体質をダウンレギュレートし,高齢者の長寿を実現する。
ラパマイシン
mTOR経路は,いくつかのウイルス感染症と関連しているため,mTOR阻害剤であるラパマイシンは,COVID-19感染症の治療に用いることが最近提案されている[63]。ラパマイシンは、タンパク質や脂質の合成を阻害する効果に加えて、老化防止や肥満防止の効果があることから、COVID-19の治療に効果的であると考えられている[63]。ラパマイシンは当初、抗真菌剤として記載されていたが、その後、免疫抑制剤としても作用することが発見された。腎癌やその他の固形癌の治療に使用されている。様々な研究において、ラパマイシンが腫瘍細胞や内皮細胞の生存率や増殖を抑制することが示されている。この10年間で、ラパマイシンによるmTORC1の薬理学的阻害を抑えることで、老化を遅らせることが明らかになっていた。ラパマイシンは、アルツハイマー病をはじめとする加齢性疾患のモデルマウスに対して有効であることが示されている。ラパマイシンによるマウスの寿命の延長は、顕著な副作用のない用量で観察されている。また、免疫抑制剤であることから、IL-6,IL-2,IL-10などのサイトカインの分泌を低下させ、COVID-19患者のサイトカインストームの強度を低下させる可能性がある。また、ネットワークベースの薬物再利用モデルを用いた他のヒトコロナウイルス感染症のデータに基づき、COVID-19の中心分子の一つとしてmTORを同定した複数のin silico研究がある。そのため、COVID-19の治療に低用量のラパマイシンを用いることも考えられるが、まずは前臨床試験でウイルス感染細胞を用いた試験を行い、その後、COVID-19患者を対象とした臨床試験を行う必要がある。
ジペプチジルペプチダーゼ-4(DPP4)阻害剤
ジペプチジルペプチダーゼ-4(CD26またはアデノシンデアミナーゼ複合体形成タンパク質2)は、通常、細胞表面に発現しているII型膜貫通糖タンパク質であり、免疫制御、シグナル伝達、アポトーシスに関与していることが知られている。ウイルスとの強い結合親和性を持ち、ACE-2タンパク質とともに感染を開始するための共同受容体として作用する可能性がある。DPP4のβプロペルドメインが、他のコロナウイルスとの類似性が高いMERS-CoVウイルスのスパイクタンパクに結合することはよく知られている。DPP4は、GLP-I(腸管由来インクレチン)やGIP(グルコース依存性インスリン分泌促進ポリペプチド)をダウンレギュレートし、インスリン分泌を調節する。したがって、DPP4を阻害すると、インスリン分泌量が増加する。さらに、T細胞の活性化を誘発し、CD86の発現、NF-kB経路、細胞接着、走化性の調節、アポトーシスの増加をもたらす。DPP4阻害剤であるリナグリプチン(図2G)は、その抗加齢効果が注目されている。初期の研究では、COVID-19の治療にはあまり期待できないことが強調されているが、結論を出すにはさらに多くのデータと分析が必要である。
シアノバクテリアと植物化学製品
シアノバクテリアに含まれるある種の代謝物(レクチン、硫酸化多糖、アルカロイド)は、抗ウイルス活性を有することが知られており、コロナウイルス感染症に対する有望な治療薬として使用することができる。さらに、スペルミジンやスペルミンなどの植物化学製品があるが、これらはmTORやオートファゴソームのシグナル伝達経路を標的とすることができ、コロナウイルス感染症の治療のために探索することができる[64]。ケルセチン誘導体やフラボノイドなどの植物性化合物の中には,ウイルスの拡散に必要なウイルスプロテアーゼを標的とするものがある[65]。また、これらの化合物は、抗糖尿病薬としても作用する可能性がある。これらを総合すると、これらの天然物は、糖尿病や老化も治すことができるCOVID-19治療のための合成薬の代替品として探索されなければならない。
天然化合物でウイルスと宿主の膜の相互作用を狙う
膜脂質の組成[66, 67],あるいは脂質ラフトのようなマイクロドメインは,糖尿病,老化,コロナウイルスの感染を制御する上で重要な役割を果たしている[68, 69]。注目すべきは,ヒトのACE-2タンパク質は,741〜761残基が膜貫通ドメインを形成する膜貫通タンパク質であることである。ウイルスの感染サイクルにおける膜貫通ドメインの役割については、詳しく調べられていない[70]。SARSコロナウイルスとその関連ウイルスに関する研究を振り返ると,ウイルスタンパク質が様々な宿主タンパク質の膜貫通領域と相互作用していることを示す証拠がある.SARSコロナウイルスのOrf3aタンパク質は、カベオリンと相互作用することが知られている[71]。HIV-1感染の場合,HIV-1のVpUタンパク質の膜貫通領域はオリゴマーを形成することが知られており,そのオリゴマー化はゴルジ領域または細胞内小胞のいずれかであるようである[72].また,HIV感染時に抗原提示細胞の細胞表面分子CD80およびCD86の消失を示す研究があり,膜の関与が示唆されている[73].さらに,HIV1-Vpuタンパク質はCD74と相互作用し,主要組織適合性複合体クラスIIの提示を調節するが,これには膜とER-ゴルジ複合体の関与が必要である[74].
in silico法を用いて,COVID-19ウイルス感染におけるACE-2の膜貫通ドメインの役割の可能性を探った。我々は,SARS-CoV-2の変異(D614G)がACE-2膜貫通ドメインとの結合に影響を与え,変異体の感染力が高まるのではないかと考えた。この仮説を検証するために、swissdockとI-TASSERサーバーを用いて、ACE-2(膜貫通ドメイン)とウイルススパイクタンパク質の予測モデルをそれぞれ感染した。さらに、HawkDockサーバーを用いて、タンパク質-タンパク質相互作用モデルと複合体の結合自由エネルギー(ACE-2とネイティブおよびD614G変異スパイクタンパク質との相互作用について)を得た。その結果、ヒトのACE-2とウイルスのスパイクタンパク質との結合の自由エネルギー変化は、野生型では-40.6kcal/mol、D614G変異型では-48.0kcal/molと決定された(図3)。このように、野生型と変異型の結合親和性に大きな差があることから、後者の方が伝染しやすいと考えられる。今回の計算機研究では、コロナウイルスの感染力に膜脂質が重要な役割を果たしていることも明らかになった。フラボノイドなどの天然化合物は、脂質ラフトの形成やウイルスの複製の制御に影響を与える可能性がある。したがって、これらの化合物は、膜脂質を標的にして、ウイルスの拡散を制御するために使用できる可能性がある。
図3 ACE-2と(A)野生型スパイク蛋白質および(B)変異型スパイク(D614G)-ACE-2蛋白質との結合に関する分子ドッキング研究
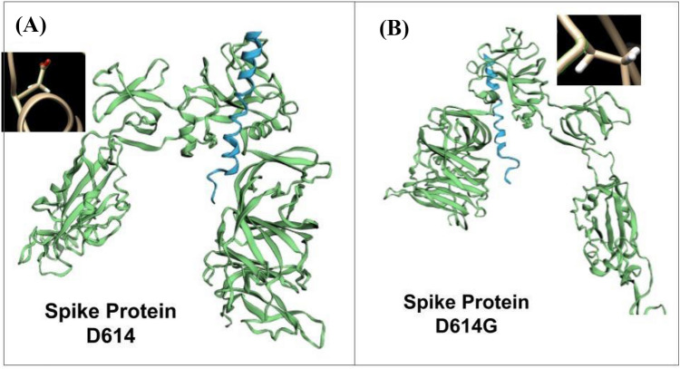
挿入図には、(A)D614残基と(B)D614G残基が示されている。自由エネルギー変化の違いが、変異型SARS-CoV-2の感染力が強い理由を説明している
結論
ヒトのSARS-CoV-2を原因とするパンデミック、COVID-19感染症は、196カ国以上で1億7000万人以上の患者と350万人以上の死亡者を出している。COVID-19の発生により、世界中の人々がウイルス感染症にさらされており、糖尿病患者や高齢者は若年層に比べて高い死亡率で深刻な状況に直面している。また、回復後の健康状態が長期的にどのような影響を受けるのかは不明である。無症状の患者や健康な人が、一度ウイルスに感染すると、長期的な影響を受ける可能性があるという証拠が増えている[15]。感染が老化の促進や糖尿病の発症にどのような影響を及ぼすのか、さらに研究する必要がある。
分子レベルでは、糖尿病、老化、COVID-19を制御する経路が交錯している。酸化ストレスと免疫反応の低下は、この3つの疾患によく関連している。これらの疾患の合併症は、他の多くの疾患の発症につながる。例えば、糖尿病は、心血管障害、眼疾患、神経障害、腎症などの長期的な合併症とも関連している[17]。同様に、加齢により、心血管障害、がん、関節炎などの可能性が高まる。また、コロナウイルスに感染すると、敗血症性ショック、急性呼吸窮迫症候群(ARDS)精神的苦痛、関節痛などを引き起こす可能性がある。したがって、これらの病気の交錯を研究し、適切な時期にこれらの病気を管理し、治療する方法を見つけることが極めて重要だ。理想的な治療法の候補は、共通の経路を標的とし、SARS-CoV-2の複製、組み立て、感染した細胞からの放出を阻害しながら、これらの疾患をまとめて制御できるものでなければならない。また、AKTやmTORなどの経路は、糖尿病や老化を制御していることが知られており、A型インフルエンザなどのウイルスが細胞からウイルスを放出する際にも調節されることがわかっている。ヒトヘルペスウイルス(HHV)をはじめとする多くのウイルスは、ウイルスに感染した細胞を増殖させるために、生存に必要なプロテインキナーゼであるAKTの活性化を必要とする。また、ウイルスに感染した細胞の増殖には、mTOR経路の活性化も必要である。いくつかの研究では、mTOR阻害剤であるラパマイシンがウイルスのタンパク質合成を阻害することも明らかになっており、新しいウイルス粒子の合成に必要な必須ステップを阻害する可能性がある。
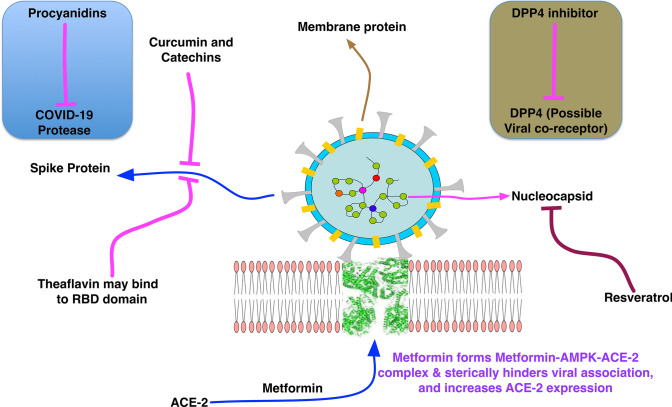
さらに、ウイルスと宿主の受容体との結合に影響を与え、ウイルスの複製と放出に必要な分子相互作用に影響を与える天然の化合物が存在する。これらの天然化合物は、ACE-2をはじめとする感染に必須のタンパク質とよく結合する。我々は、カテキン誘導体がSARS-CoV-2感染に対する潜在的な阻害剤として作用し、COVID-19の重症度をコントロールするのに役立つ可能性も示唆している。既存の化合物の中から効果的な治療法を選択するためには、この点を理解し、考慮する必要がある。レスベラトロール、クルクミン、カテキン、プロシアニジン、テアフラビンなどの植物由来の天然化合物や、メトホルミン、DPP4阻害剤などの既存の医薬品(図4)は、COVID-19の治療薬として試せる可能性のある候補であることが、様々なin silico、試験管内試験、生体内試験研究によって示されている。これらの既存の分子については、COVID-19やコロナウイルス感染後症候群の治療における可能性を検証するために、広範な実験を行う必要がある。
図4 COVID-19の治療に向けた既存の医薬品や天然化合物とその作用機序の概要
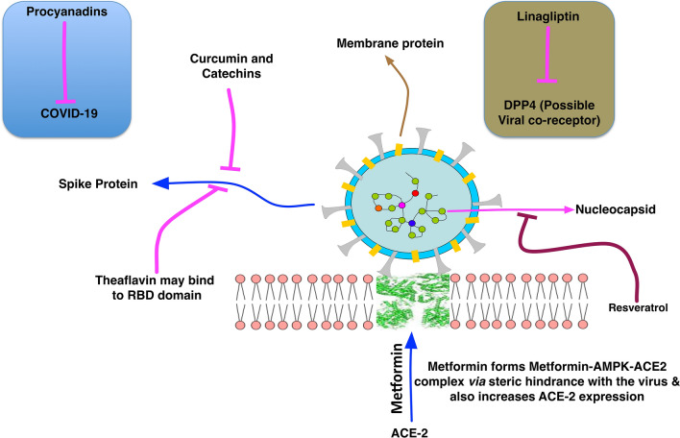
これらの化合物はまた、高い安全性プロファイルで抗糖尿病作用や抗老化作用を示す可能性がある
