Contents
Beneficial Effects of Walnuts on Cognition and Brain Health
www.ncbi.nlm.nih.gov/pmc/articles/PMC7071526/
要旨
酸化ストレスと神経炎症は、老化過程、軽度認知障害(MCI)アルツハイマー病(アルツハイマー病)その他の脳障害において重要な役割を担っている。アミロイドβタンパク質(アミロイドβ)は、アルツハイマー病患者の脳内アミロイド斑の主成分である。いくつかの研究では、アミロイドβが神経細胞のフリーラジカルの生成を増加させ、酸化的損傷や細胞死につながることが示唆されている。アミロイドβはまた、プロ炎症性サイトカインや酵素を増加させることにより、神経炎症を誘発することができる。
くるみには、抗酸化作用と抗炎症作用を持ついくつかの成分が含まれている。我々や他のグループからの動物およびヒトの研究では、食事中にクルミを補充することで認知を改善し、MCIおよびアルツハイマー病のリスクおよび/または進行を軽減する可能性があることを示唆している。トランスジェニックADマウスモデル(アルツハイマー病-TG)では、我々は、記憶、学習、運動調整、不安、および運動量の食事のクルミの有益な効果を報告している。
また、ヒト臨床試験では、成人のベースラインと比較して、くるみの摂取が認知能力の向上や記憶力の改善に関連していることが示唆されている。アルツハイマー病-tgマウスを対象とした最近の研究では、クルミを添加した食事は、クルミを添加しない対照食と比較して、抗酸化防御を有意に改善し、フリーラジカルのレベル、脂質過酸化、タンパク質の酸化を減少させることが示されている。
これらの知見は、クルミを含む食事は、フリーラジカルの発生を減少させ、抗酸化防御を高めることで酸化ストレスを軽減し、結果として脂質やタンパク質の酸化損傷を減少させることを示唆している。
合成アミロイドβを用いた試験管内試験試験では、クルミ抽出物がアミロイドβのフィブリル化を抑制し、あらかじめ形成されたアミロイドβフィブリルを可溶化することが示されており、クルミの抗アミロイド性が示唆されている。認知機能障害や認知症が発症するまでには何年もかかるため、クルミの早期および長期的な栄養補給は、認知機能の維持に役立ち、アミロイドβフィブリル化を減少させ、酸化的損傷を減少させ、抗酸化防御力を高め、神経炎症を減少させることで、MCIや認知症の発症リスクを低下させたり、発症を遅らせたり、認知症の進行を遅らせたりする可能性があることが示唆される。
さらに、いくつかの動物およびヒトの研究では、クルミがパーキンソン病、脳卒中、うつ病などの脳障害や、心血管疾患、2型糖尿病などのリスクや進行を減少させる可能性が示唆されている。これらの報告から、これらの疾患における酸化ストレスや炎症からの保護のためのクルミ成分の添加効果や相乗効果により、脳疾患やその他の慢性疾患におけるクルミ濃縮食の有用性が示唆されている。
キーワード
アルツハイマー病、アミロイドβ蛋白、認知症、うつ病、酸化ストレス、炎症、軽度認知障害、栄養、くるみ
1. はじめに
認知症とは、いくつかの領域(記憶、学習、判断、方向性、言語、理解)の認知機能が加齢に伴って進行し、高齢者の日常生活活動や社会機能に影響を及ぼすことで定義されている。認知症の有病率は、高齢化の進展により、年々増加している。2015年には世界で4,700万人が認知症に罹患しており、2050年には1億3,100万人が認知症になると推定されている[1]。認知症は主に65歳以上の高齢者に発症し、併存疾患も多い。一般に軽度認知障害(MCI)が先行する。現在の推定では、高齢者の33%が認知症で死亡している。世界的に認知症ケアにかかる年間コストは約8,180億ドルである。
アルツハイマー病は、5~20年の期間をかけて記憶力の低下や認知機能の低下が徐々に進行する壊滅的な神経変性疾患である。認知症には多くの種類があるが、高齢者の認知症原因の中ではアルツハイマー病が最も多く、認知症の6割以上を占めている。血管性認知症が2番目に多く、レビー小体型認知症がそれに続いている。アルツハイマー病は世界で約2,500万人が罹患しており、そのうち米国では550万人が罹患している。65歳以上の人口の10%、85歳以上の人口の50%近くがアルツハイマー病を患っている。アルツハイマー病の神経病理学的特徴は、神経細胞の喪失と、アミロイド斑としての線維性アミロイドβ蛋白(アミロイドβ)の進行性蓄積、および脳内の神経原線維性のもつれとしてのペアらせん状フィラメントの蓄積である[2]。アルツハイマー病では、主要なアミロイド蛋白質は40または42アミノ酸のアミロイドβ蛋白質(アミロイドβ)であり、可溶性または線維性のアミロイドβとして存在している。アルツハイマー病における神経病理学的変化は、認知症の臨床症状が診断される前に数十年かけてゆっくりと起こる。
MCIは健康な老化と初期の認知症の中間状態と考えられている[1]。MCIの有病率は65歳以上の人の10%~20%である。これらの人たちは日常生活動作はできるが、3~10年以内に認知症を発症するリスクが高いと考えられている。したがって、この期間は、認知機能障害や認知症の発症や進行のリスクを軽減し、予防したり、遅延させたりするための標的となる可能性のある介入の窓口となる。MCIは、無症候性MCI(記憶障害を伴う)と非無症候性MCI(記憶に影響を及ぼさない)に分類される。無脳性MCIの人の約50%が3年で認知症を発症する。
認知症の約35%は、血管性(心血管疾患、高血圧、脳卒中)代謝性(糖尿病、中年期肥満)頭部外傷、うつ病、生活習慣因子(食事の質、アルコール乱用、睡眠不足)などの修正可能な危険因子に起因するとされている。これらの危険因子、特に高血圧、うつ病、糖尿病、肥満の管理を改善し、標的を絞った介入を行うことで、認知症の33%の発症を遅らせたり、予防することができると推定されている[1]。食事と健康との関連性はますます明らかになりつつあり、フラボノイドやフェノール類を豊富に含む植物食品は防御的な抗酸化物質として効率的であり、その結果、神経疾患、心血管疾患(心血管疾患)高血圧、糖尿病を含む多くの疾患の病態生理に寄与することが知られている酸化ストレスを減少させるという広範な証拠がある。
以下のセクションでは、
(a)老化過程や認知症に関与する酸化ストレスや炎症の上昇、
(b)クルミに抗酸化成分や抗炎症成分が含まれることから、クルミを豊富に含む食事に早期に介入することで、認知機能の低下や認知症の発症リスクを低減および/または遅延させたり、進行を遅らせたりすることができる
という証拠をレビューする。
2. 老化、MCI、アルツハイマー病における酸化ストレス
酸化ストレスは、体内のフリーラジカルのレベルと抗酸化防御のバランスが崩れることによって引き起こされる[3]。フリーラジカルのレベルが上昇すると毒性があり、除去されないと細胞内の脂質、タンパク質、核酸と反応して細胞機能にダメージを与える。その結果、酸化ストレスは、流動性、酵素の活性、イオン輸送、タンパク質の架橋などの膜特性に影響を与える。酸化的ダメージの増大は、最終的には細胞死につながる。脳は、全身の酸素摂取量の20%を消費し(エネルギー要求量が高いため)抗酸化能力が限られており、不飽和脂質の量が多いため、酸化ストレスに対して特に脆弱である。
ヒトおよび実験モデルを用いたいくつかの研究では、酸化ストレス[4,5,6,7]および炎症[7,8,9,10]の増加が老化過程およびアルツハイマー病における重要な特徴であることが示唆されており、これは神経細胞の機能障害や死を引き起こす可能性がある。脂質過酸化、タンパク質酸化、DNA酸化の増加によって証明されるような酸化的損傷の亢進は、アルツハイマー病患者の脳、脳脊髄液(脳脊髄液)血液サンプルで実証されている。酸化損傷の増加は、MCI患者の脳や血液サンプル、認知症の初期徴候のある患者の脳脊髄液でも報告されている[11,12,13]。いくつかの報告では、アミロイドβが酸化ストレスを増加させることで神経細胞死を誘導することが示唆されている[14]。また、酸化ストレスのためにアミロイドβの生成が亢進し、その結果、より多くの酸化損傷を引き起こすことになる。
3. 老化、MCI、アルツハイマー病における炎症
いくつかの研究は、プロ炎症性サイトカインを放出する活性化ミクログリア細胞によって媒介される神経炎症カスケードが、アルツハイマー病において有害な役割を持つことを示唆している [7,8,9,10]。活性化ミクログリアおよびアストロサイトの数の増加、および炎症性サイトカイン、すなわちインターロイキン(IL)-6,IL-1β、および腫瘍壊死因子-α(TNF-α)のレベルの上昇が、加齢脳およびアルツハイマー病脳で報告されている。
アミロイドβはまた、ミクログリア細胞を活性化することが報告されており、これは、プロ炎症性サイトカイン(IL-1β、IL-6,およびTNF-α)の産生の増強とプロ炎症性酵素、例えば、誘導性一酸化窒素合成酵素(iNOS)の刺激につながり、その結果、NO(一酸化窒素)の産生が増強される[15,16]。アルツハイマー病では、シクロオキシゲナーゼ(COX-2,プロ炎症性メディエーターによって誘導される)の発現もアップレギュレートされており[17]、その結果、脳内の炎症性プロスタグランジン(PG)特にPGE2の産生が増加している[18]。
COX活性とPGE2の増加は、加齢脳でも報告されている。PG合成経路は脳内の活性酸素種(ROS)の主要な供給源であるため、炎症もまた、老化とアルツハイマー病における酸化ストレスの上昇の一端を担っている可能性がある。いくつかの研究では、慢性炎症と心血管疾患、糖尿病、うつ病、パーキンソン病(PD)高血圧などの他の疾患との関連性が示唆されている。
4. くるみの抗酸化成分と抗炎症成分。累積的な効果
いくつかの証拠から、クルミ(Juglans regia L.)は、抗酸化作用と抗炎症作用を持つ成分の付加的または相乗効果により、加齢に伴う疾患のリスクを低減する可能性があることが示唆されている。くるみは、フラボノイド、フェノール酸(エラグ酸)メラトニン、葉酸、γトコフェロール(ビタミンE)セレン、ジュグロン、プロアントシアニジンなどの抗酸化物質の含有量が高い(3.68mmol/oz)[19,20,21,22,23]。さらに、くるみには、非常に強力な抗炎症作用を持つ植物由来のオメガ3脂肪酸であるn-3 α-リノレン酸(ALA)が多量に含まれている[23,24,25,26]。くるみはまた、タンパク質(4g/オンス)食物繊維(2g/オンス)リン(1日の値10%)マグネシウム(1日の値11%)を提供する。
抗酸化物質の含有量について試験された1113種類の食品のうち、くるみは第2位にランクされた[21]。乾燥した果物の中では、クルミが最もフェノール含量が高いという事実が示すように、クルミが最も抗酸化効果が高く、次いでアーモンド、カシューナッツ、レーズンの順となっている[27]。別の報告では、くるみ50gのフェノール含有量は、コップ8オンスのリンゴジュース、コップ5オンスの赤ワイン、またはミルクチョコレートバーと比較して有意に多いことが示されている[19]。
ほとんどのナッツ類は一価不飽和脂肪を含むが、クルミだけは主に多価不飽和脂肪(1オンスのクルミあたり18gの総脂肪のうち13g)を含み、そのうちALA量は2.5gである。ALAは抗炎症作用を有することが知られているエイコサペンタエン酸(EPA)およびドコサヘキサエン酸(DHA)の前駆体である。ALAは、iNOS(したがってNO産生を抑制)COX-2,炎症性サイトカイン(IL-1β、IL-6,TNF-α)をダウンレギュレートすることで炎症を抑制することが研究で示されている[23,24,25,26]。
5. くるみを濃縮した食事の認知機能への有益な効果
私たちや他のグループからの最近の動物およびヒトの研究では、クルミの長期的な栄養補給は、MCIやアルツハイマー病の発症/進行のリスクを軽減したり、遅延させる可能性が示唆されている。
5.1. 動物実験
アミロイドβはアミロイド前駆体タンパク質(APP)のタンパク質分解によって産生される。APP遺伝子変異を持つAPPトランスジェニックマウス(アルツハイマー病-TG)は、脳内の記憶障害とアミロイドβ沈着を示し、アルツハイマー病の動物モデルと考えられている。くるみの推奨される1日のサービングは1-1.5オンス、すなわち28-42gであり、これはくるみの半分12-18個分に相当する。我々は、アルツハイマー病-tgマウスの記憶、学習能力、運動協調性、および不安に対するクルミ(ヒトで推奨されている1日あたり1オンスまたは1.5オンスのクルミ摂取量に相当する6%または9%)と長期(14ヶ月)の栄養補給の効果を調べた[28]。くるみを含まない対照食のアルツハイマー病-tgマウスは、同じ食餌の野生型マウスと比較して、記憶障害、不安に関連する行動、運動協調性、位置識別学習能力、空間学習能力の障害を示した。アルツハイマー病-tgマウスにクルミを補充した飼料(6%または9%)を与えた場合、クルミを含まない対照飼料と比較して、記憶、学習能力、運動発達、不安関連行動の改善が認められた[28]。対照マウスと実験マウスの食事は、総カロリー摂取量だけでなく、タンパク質、炭水化物、脂肪含量も同程度であった[28]。高齢ラット(19ヶ月齢)を対象とした別の研究では、6%のクルミを含む食事は認知能力と運動能力を改善することも報告されている[29]。
5.2. ヒトでの臨床試験
スペインで実施された2件のPREDIMED(Prevención con Dieta Mediterránea)臨床試験では、1日30gのミックスナッツ(クルミ15g、ヘーゼルナッツ7.5g、アーモンド7.5g)を補給した地中海式食事を摂取した健康な成人被験者は、低脂肪食の対照群と比較して認知機能の改善が認められ[30,31]、記憶力は対照群のベースラインスコアと比較して有意に改善した[31]。これらの研究の参加者は、心血管リスクが高いが心血管疾患または認知機能障害はない成人522人(平均年齢:74.6歳)[30]または成人447人(平均年齢:66.9歳)[31]であった。最初の研究[30]では、食事介入6.5年後の臨床試験終了時にMini-Mental State Examination(MMSE)とClock Drawing Test(CDT)でグローバルな認知能力を評価したが、ベースライン評価は行われなかった。2件目の研究では、ベースライン時と栄養介入4.1年後に実施された6種類の神経心理学的検査のスコアを比較することにより、時間経過に伴う認知変化の割合を検討した [31]。
高齢女性を対象とした別の臨床試験では、ナッツ類(特にクルミ)の長期的な摂取量が多いほど認知能力の向上と関連していることが報告されている[32]。この研究では、15,467人の女性(70歳以上;平均年齢74歳)が参加した。週に5食以上のナッツ類を摂取した女性と摂取しなかった女性の認知スコアの差は、2年間の認知老化に相当した。米国の成人集団を対象とした国民健康・栄養調査(NHANES)でも、クルミの摂取で認知スコアが向上することが示されている[33]。この研究では、2つの異なる年齢層(20~59歳;60歳以上)のデータを調査した。認知スコアはどちらの年齢層でもクルミの消費により良好であった。
若年成人64人を対象とした別の研究では、くるみを使った短期(8週間)の栄養補給が認知パフォーマンスに及ぼす影響を調べた[34]。記憶力、気分状態、言語的推論、非言語的推論がベースライン時と8週間の栄養介入期間終了時に評価された。クルミを濃縮した食事を摂取した被験者では、推論的言語推論の有意な増加が認められたが、気分状態、記憶、非言語推論については有意差は認められなかった。これは、この研究でクルミの栄養補給が8週間しか行われなかったためと考えられる。
6. くるみの認知と脳障害に対する有益な効果のメカニズム
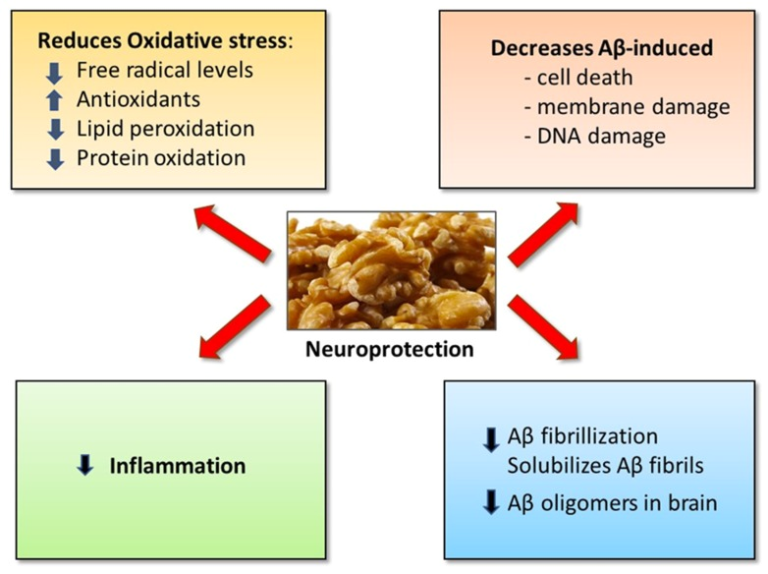
図1は、クルミの栄養補給が、加齢に伴う認知機能低下、MCI、アルツハイマー病のリスクを軽減し、発症を遅らせ、および/または進行を遅らせる可能性がある潜在的なメカニズムを解明したものである。
図1 軽度認知障害(MCI)や認知症リスクの低減におけるクルミの神経保護効果の潜在的なメカニズム
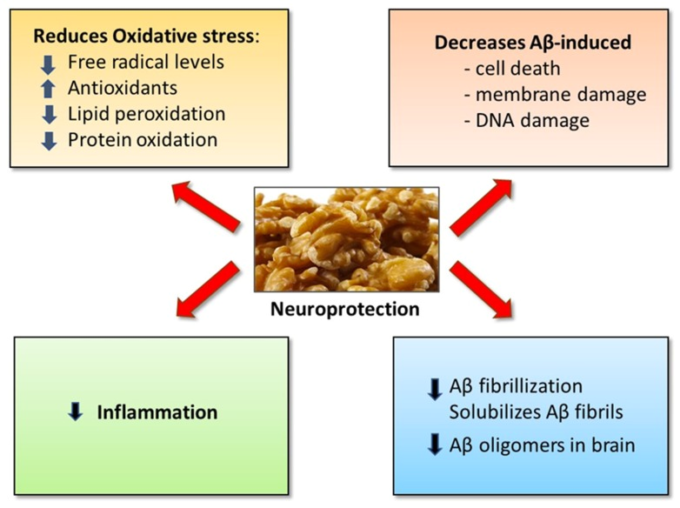
6.1. くるみの抗アミロイド性特性。くるみはアミロイドβ線溶化を抑制し、アミロイドβ線溶を可溶化する
可溶性アミロイドβからのアミロイドβフィブリルの形成は、アミロイドβのオリゴマー化・凝集に先行しており、アミロイドβの構造がα-ヘリカルからβ-プリーツシート構造へと変化することを伴う。合成アミロイドβを用いた研究では、クルミ抽出物がアミロイドβのフィブリル化を抑制し、あらかじめ形成されたアミロイドβフィブリルを可溶化した。ここでは、チオフラビンT蛍光分光法を用いてアミロイドβ凝集/線溶化の程度を評価し、電子顕微鏡でアミロイドβ構造の形態を調べた[35]。
6.2. くるみはアミロイドβ誘導酸化ストレスと細胞損傷を減少させる
多くの試験管内試験研究で、アミロイドβは活性酸素レベルを増加させ、酸化ストレスを誘導することで細胞毒性を示すことが報告されている[14]。我々は、クルミ抽出物がアミロイドβ誘導酸化ストレスや細胞死から保護することを報告している[36]。本研究では、PC12褐色細胞腫細胞を用いて、クルミ抽出物のアミロイドβ誘発細胞損傷、ROS産生、アポトーシスへの影響を調べた。細胞へのアミロイドβ処理による細胞内ROS蓄積は、クルミ抽出物の存在下では、クルミ抽出物を含まないアミロイドβ処理対照細胞と比較して有意に減少した。また、クルミ抽出物は、アミロイドβが媒介する細胞死(MTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイドの減少により評価)膜損傷(乳酸脱水素酵素遊離により測定)DNA損傷(アポトーシス)を用量依存的に減少させた[36]。これらの知見は、クルミ抽出物がアミロイドβ誘発性の酸化的損傷とそれに伴う細胞死から保護できることを示唆している。
アルツハイマー病におけるクルミの食事補充の有益な効果の根底にあるメカニズムをさらに理解するために、我々は最近、食事中のクルミの短期または長期の補充がアルツハイマー病-tgマウスにおける酸化的損傷を減少させ、および/または抗酸化防御を強化することができるかどうかを研究した[37]。くるみを含まない対照食を摂取したアルツハイマー病-tgマウス(T0)は、対照食を摂取した野生型マウスと比較して、活性酸素レベル、脂質過酸化、タンパク質酸化の年齢依存的な有意な増加を示し、抗酸化酵素(スーパーオキシドジスムターゼ、カタラーゼ)の活性の低下と相まっていた。酸化ストレスは、活性酸素のレベルの低下、脂質過酸化およびタンパク質酸化の減少、およびコントロールT0マウスと比較して、これらのマウスにおける抗酸化酵素の活性の有意な改善によって示されるように、6%(T6)または9%のクルミを含む飼料(T9)上のアルツハイマー病-tgマウスにおいて有意に減少することが観察された。くるみを10ヶ月または15ヶ月間食事に長期的に補給することは、アルツハイマー病-tgマウスの5ヶ月間の短期的なくるみ補給と比較して、活性酸素レベルと脂質やタンパク質の酸化損傷を減少させ、抗酸化状態を改善するのに有効であることが判明した[37]。
ヒトでは、クルミの急性摂取は、総抗酸化能を増加させ、血漿脂質過酸化を減少させることが報告されている[38]。くるみの成分であるフラボノイド、エラグ酸、γトコフェロール、メラトニンなどは、抗酸化作用やフリーラジカル消去作用を有することが知られている。クルミの成分には強い抗酸化作用があることから、クルミによるアミロイドβ誘発フリーラジカルレベルの抑制は、活性酸素の中和作用に起因している可能性がある。
7. その他の脳疾患や慢性疾患におけるクルミの有用性
酸化ストレスと炎症は、MCIとアルツハイマー病だけでなく、PD、うつ病、自閉症、統合失調症、双極性障害、およびいくつかの加齢に関連した慢性疾患などの他の脳疾患でも極めて重要な役割を果たしている。
7.1. くるみとパーキンソン病、うつ病、脳卒中、てんかん
パーキンソン病は、ドーパミン作動性ニューロンの漸進的な喪失と、運動障害、姿勢不均衡、振戦、硬直などの臨床症状によって特徴づけられる。パーキンソン病のマウスモデルでは、クルミ抽出物はパーキンソン病の症状(姿勢バランス、運動協調、運動)を改善し、酸化ストレスを減少させ、ニューロンを保護した[39]。
うつ病は認知症の人に多く見られ、認知症の危険因子と考えられている。認知症患者の20%以上がうつ病と診断され、他にも数人がうつ病の症状を呈している。コホート研究では、うつ病エピソードの数とMCIや認知症のリスクとの間に関連があることが示されている[40]。28年間の追跡調査では、認知症と診断される前の10年間に主にうつ病の症状が高くなっていた[40,41]。最近、Arabらは、米国の集団を対象としたNHANES研究から、うつ病とくるみの消費に関するデータを分析した[42]。彼らは、ナッツ類、特にクルミを食生活に取り入れている被験者では、ナッツ類を摂取していない対照群と比較して、抑うつ症状が有意に少なく、頻度も低いことを報告した。クルミを多く含む食事をしている被験者では、物事への関心が高く、集中力が高く、エネルギーレベルが高く、絶望感が少ないことが示された。Sanchez-Vilegasら[43]はまた、30g/日のミックスナッツ(クルミ15g、ヘーゼルナッツ7.5g、アーモンド7.5g)を豊富に含む地中海式食事を摂ったPREDIMED対象者と、対照の低脂肪食を摂った対照群のうつ病に関するデータを比較した。この研究集団には、心血管疾患のリスクが高いが、これまでに心血管疾患の既往歴がない男性(年齢:55~80歳)と女性(年齢:60~80歳)が含まれていた;これらの被験者の51%は2型糖尿病も持っていた。グループ全体を比較したところ、対照群と比較して、ナッツ類を豊富に含む地中海式食事を摂取した被験者では、うつ病のリスクが20%~30%減少した(統計学的に有意ではなかったが)[43]。しかし、この群の糖尿病患者では、対照群と比較して、ミックスナッツを補充した地中海式食事に割り付けられた被験者では、うつ病のリスクが40%有意に低かった[43]。また、脳卒中の発症率は、ミックスナッツを含む地中海食を摂取していた人では約50%減少したことが明らかになった[44]。
てんかんは世界中で5,000万人が罹患しており、発作を繰り返すことで定義されている。ラットで実験的に誘発されたてんかんでは、クルミを濃縮した食事は神経保護効果と抗痙攣効果を示し、死亡率も減少した[45]。
7.2. くるみと2型糖尿病
2型糖尿病の人は、糖尿病でない人に比べて認知症を発症する可能性が高いと推定されている。83,818人の女性(年齢:34~59歳)を対象とした大規模コホート研究では、くるみなどのナッツ類を1オンス(28g)(1週間に5回以上)摂取することで、2型糖尿病発症のリスクが低下することが示された[46]。
看護師の健康調査(NHS(英国保健医療局))(1998-2008)の58,063人の女性(年齢:52-77歳)と、NHS(英国保健医療局) II(1999-2009)の79,893人の女性(年齢:35-52歳)を対象とした他の2つの大規模コホート研究では、くるみの栄養補給は2型糖尿病のリスクを有意に低下させることと関連していた[47]。また、くるみの摂取は、成人の2型糖尿病患者の内皮機能を有意に改善した[48]。ナッツ類を豊富に含む地中海式食事を用いた長期介入のPREDIMED研究でも、ナッツ類と糖尿病の50%減少との関連が報告されている[44]。
7.3. くるみと心血管疾患
中年期に発症する心代謝危険因子(高血圧、肥満、高脂血症)は、認知機能の低下や認知症の潜在的な危険因子とも考えられている。いくつかの研究では、クルミを食事に取り入れることで、様々な心代謝危険因子を改善することで、心臓病のリスクを低減できることが示唆されている[44,49,50]。
くるみを多く含む食事は、総コレステロールおよび低密度リポタンパク質(LDL)コレステロールを減少させ、高密度リポタンパク質(HDL)コレステロールを増加させ、血圧、炎症、プラーク形成を減少させることができる[49,50,51,52,53,54,55]。心血管系の健康に関連するクルミの利点を裏付ける証拠があるため、米国食品医薬品局は 2004年にクルミに対する以下のような健康訴求を承認した。”支持的ではあるが、決定的な研究ではないが、低飽和脂肪および低コレステロールの食事の一部として1日1.5オンスのくるみを食べることで、カロリー摂取量を増加させずに、冠動脈性心疾患のリスクを減少させる可能性があることが示されている。”
7.4. くるみと体重
予想に反して、臨床試験、疫学研究、およびさまざまな研究の系統的レビューでは、対照食と比較して、クルミの食事への摂取が体重増加に寄与したり、減量目標を妨げたりしないことが示されている[49,53,56]。
8. 結論
酸化ストレスや炎症は、老化の過程やMCI、認知症、多くの加齢性疾患に重要な役割を果たしている。くるみには抗酸化作用と抗炎症作用を持つ複数の成分が含まれており、炎症や酸化ダメージを抑制する上で相加的または相乗的な効果があると考えられている。私たちの研究では、くるみがフリーラジカルレベルを低下させるだけでなく、抗酸化防御力を高めることで酸化ストレスを軽減し、脂質やタンパク質への酸化ダメージを軽減することが実証されている。
動物およびヒトの研究からの十分な証拠は、クルミの食事摂取(1日1-2オンス)が認知機能を改善し、認知症発症の危険因子である心血管疾患、うつ病、2型糖尿病などの他の疾患のリスクを減少させることを示唆している。アルツハイマー病-tgマウスを用いた我々の研究では、クルミを食事に長期補充することで、
(a)記憶力、学習能力、運動協調性、不安関連行動を有意に改善し、
(b)フリーラジカルと抗酸化物質と関連するアミロイドβ媒介細胞死のバランスを改善することで、アミロイドβ誘発性酸化ストレスを減衰させることができる
ことが明確に示されている。これらの報告を合わせると、クルミを用いた早期および長期的な栄養介入は、認知機能を維持し、加齢に伴う認知機能低下から保護し、MCIやアルツハイマー病における認知障害や認知症のリスクを軽減し、発症を遅らせ、または進行を遅らせるという有益な効果がある可能性が示唆されている。
クルミの抗アミロイド原性役割の根底にあるメカニズムを明確に理解するために、食用クルミが(a)APPのタンパク質分解切断に影響を与え、アミロイドβの産生を阻害するかどうか、および/または(b)プロテアーゼによるアミロイドβの分解を増加させ、このように脳内のアミロイドβのレベルを低下させ、そのクリアランスを増加させるかどうかを調査するための更なる研究が必要とされている。