Contents
pubmed.ncbi.nlm.nih.gov/31403031
2019年7月25日オンライン公開
要旨
シミアン・ウイルス40(SV40)は、サル由来の小型DNA腫瘍ウイルスである。このポリオウイルスは、主に汚染されたポリオワクチンによってヒト集団に投与されたが、このワクチンは自然に感染したSV40サル細胞で生産されたものだった。
これまでの分子生物学的手法と最近の免疫学的手法により、SV40が、以前のSV40汚染ワクチンとは無関係に、ヒト集団に拡散していることが示されている。
SV40のDNA配列は、脳腫瘍、骨腫瘍、悪性胸膜中皮腫、リンパ増殖性疾患などの特定のヒト癌検体において、対応する正常組織/検体と比較して高い頻度で検出されている。しかし、他の研究では否定的なデータもあり、SV40とヒト腫瘍の関連性は確認されていない。
このような分子生物学的研究から生じた論争を回避するために、新たに開発された間接的ELISA試験による免疫学的研究が、上記と同種の腫瘍に罹患した患者の血清試料を用いて行われた。これらの間接法ELISAは、合成ペプチドをSV40抗原のミモトープ/特異的抗原として用いるブレイクスルーものである。SV40ミモトープは、同種のヒトポリオマウイルス、BKPyV、JCPyVとは交差反応を示さない。腫瘍患者の血清サンプルを分析するために使用されたSV40ミモトープを用いた間接ELISAから得られた免疫学的データは、これらの血清が健康な被験者と比較してSV40に対する抗体の有病率が高いことを示唆している。
本総説では、(i)SV40の生物学および遺伝学、(ii)一般集団におけるSV40の疫学、(iii)SV40の変容メカニズム、(iv)特定のヒト腫瘍の発症/進行におけるSV40の推定役割、(v)他のヒト疾患との関連に関する主要データを報告する。
キーワード シミアンウイルス40、ポリオーマウイルス、がん、腫瘍、悪性胸膜中皮腫、骨肉腫、健常者、ELISA
はじめに
シミアンウイルス40(SV40)は、1955年から1963年にかけて、SV40に汚染されたワクチン(主にポリオワクチン)を通じて、偶然にヒト集団に投与されたサルウイルスである(1)。SV40は、ポリオーマウイルス科ベータポリオーマウイルス属に分類され、ヒトのJC(JCPyV)およびBK(BKPyV)ポリオーマウイルス(HPyV)と近縁である(2)。SV40の形質転換および腫瘍形成特性については多くの研究が報告されており、それぞれ細胞培養や動物モデルで実験的に証明されている(3–7)。これらのデータは、SV40と様々なヒトのがんとの関連性を検証することを目的として開発された、かなりの量の新しい研究を後押ししている。
本総説では、(i)SV40の生物学と遺伝学、(ii)一般集団におけるSV40の疫学、(iii)SV40の形質転換メカニズム、(iv)特定のヒト腫瘍の発症/進行におけるSV40の推定役割、(v)他のヒト疾患との関連について簡単に概説する。
SV40 ゲノム組織
SV40ビリオンは、直径45-50 nm、密度1.34-1.35 g/cm3の未発達な20面体のタンパク質構造で形成されている(8)。ウイルスゲノムは円形の二本鎖DNA分子で、SV40株によって異なるが、〜5.2kbである(9)。SV40は、JCPyV(10-12)やBKPyV(12,13)と約70-75%のゲノム相同性を持つが、HPyV 6および7(14)、マラウィポリオマウイルス (MXPyV またはHPyV 10)(15)、セントルイスポロマウイルス (STPyV またはHPyV 11)(16)、メルケル細胞ポリオマウイルス (MCPyV)(17-19)など他のHPyVとはほとんど相同性が無い。
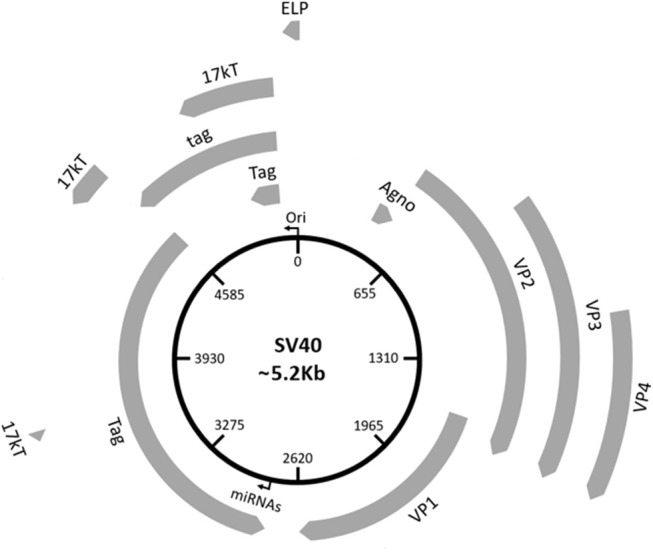
SV40ゲノムには、(i)非コード制御領域(NCCR)、(ii)初期コード領域、(iii)後期コード領域の3つの主要領域が確認されている(図1)。NCCRには、DNA複製起点(ori)と遺伝子プロモーターが含まれ、その塩基配列は、初期および後期遺伝子発現を制御する転写因子の結合部位となる。「初期」と「後期」という用語は、宿主細胞内でのウイルスのライフサイクルにおける遺伝子転写の時系列的順序を示す。初期および後期遺伝子は、いずれもNCCRに対して相反する方向、すなわち、それぞれ反時計回り、時計回りに転写される。初期領域には、大型腫瘍抗原(Tag)、小型腫瘍抗原(tag)、17 kTおよび初期リーダータンパク質のコード配列が含まれている(図1、表1)。Tagとtagは共に代替スプライシングで転写される。Tagとtagはウイルス性のオンコプロテインであり、SV40のDNA複製、遺伝子発現、さらに宿主細胞のS期突入とDNA合成を誘導し、サイクル進行を誘発する(図2)(9).また、これら2つのオンコプロテインは、試験管内試験で形質転換能を有し、生体内試験でがん化活性を発揮する(9)。17kTタンパク質は、TagのN末端ドメインとアミノ酸配列の大部分を共有し、tag存在下で細胞周期の進行を促進するとともに、腫瘍形成能を示す(20)。初期リーダータンパク質は、23aaの小さなタンパク質で、その機能は不明である(21)。後期領域には、2つのクラスの後期mRNAに転写される遺伝子が存在する:(i) 主要カプシドタンパク質VP 1をコードする16S、(ii) VP 2、VP 3、VP 4ポリペプチド、およびagnoproteinをコードする19S(図1、表1)。VP 1-2-3は、ウイルスDNAがSV40ビリオンにパッケージされることを可能にする構造タンパク質である。合計360個のVP 1分子は、72個の5量体をもってビリオンを形成する(22,23)。各五量体の内部には、VP 2またはVP 3が1コピーずつ結合している(22)。VP 4はSV40ビリオンの溶解放出を促進するようであるが(24)、最近の研究でVP4はこのプロセスに必要でないことが示された(25)。アグノプロテインは、ビリオン形成時にVP 1の核周辺への局在を制御し、それがビリオン集合の引き金となる(26)。SV40が翻訳するタンパク質は全部で9つである。最近、SV40がコードする2つのマイクロRNA(miRNA)が同定された(図1、表1)(27)。これについては、「SV40のマイクロRNAとウイルス感染」の項で詳しく報告する(後述)。

図1 SV40ゲノムの模式図
SV40のDNAは、制御領域と初期・後期領域の3つの領域から構成されている。制御領域は複製起点(ori)を含み、ウイルス遺伝子の発現を制御する。初期領域には、大腫瘍T抗原(Tag)、小腫瘍T抗原(Tag)、17kT、初期リーダータンパク質(ELP)を含む初期遺伝子のコード化配列が含まれる。後期領域には、主要カプシドタンパク質VP 1、VP 2、VP 3、VP 4、およびアグノプロテイン(Agno)を含む後期遺伝子のコード化配列が含まれる。2つのmiRNAはTag遺伝子配列内にマッピングされている。
表1 SV40遺伝子産物
| SV40発現製品 | 主な機能(複数可) | |
|---|---|---|
| アーリー | 大型腫瘍T抗原(Tag) | 細胞周期進行、ウイルスDNA複製 |
| 小型腫瘍t抗原(tag) | 細胞周期進行、ウイルスDNA複製 | |
| 17 KT | 細胞周期の進行 | |
| アーリーリーダープロテイン | 不明確な機能 | |
| 初期極性SVmiRNA | Tagレギュレーション | |
| 後期極性SVmiRNA Tag 制御 | ||
| レイト | ブイピーワン | カプシド構造(外形)、ウイルスの付着・侵入 |
| ブイピーツー | カプシド構造(内部) | |
| 仮想3 | カプシド構造(内部) | |
| ブイピーフォー | 細胞溶解、ウイルス粒子放出 | |
| アグノプロテイン | ビリオンの組み立て |
図2 SV40のライフサイクルの主なステップ
SV40のライフサイクルは、SV40ウイルスのカプシドが標的細胞表面に付着することから始まり、脂質ラフトを介したエンドサイトーシスによって進行する。その後、ビリオンは小胞体輸送によって小胞体へと移動し、細胞質で続く被覆解除のプロセスを開始する。被覆されていないSV40ゲノムは核内に移動し、そこで細胞内のRNAポリメラーゼIIがウイルスの初期転写を仲介する。初期転写は、大きなT(Tag)抗原と小さなT(tag)抗原をコードするmRNAに交互にスプライシングされる前駆体を生成する。これらのmRNAは、細胞質で対応するタンパク質に翻訳される。Tagとtagは核に移動し、そこで宿主の細胞経路を妨害するいくつかの機能を媒介し、それによって細胞をG1期からS期へと強制的に進行させる。同時に、Tag/tagはSV40ゲノムの複製を開始する。SV40感染時の初期から後期への移行は、ウイルスDNAの複製が終了した時点で始まる。合成後、後期ウイルスタンパク質は細胞質に蓄積され、核に移動し、複製されたウイルスDNAと会合してビリオンを形成する。最後に、細胞の溶解によって子孫ウイルスが放出される。
SV40のライフサイクル
SV40ウイルスカプシドの標的細胞表面への付着は、宿主細胞における感染過程で最初に起こるイベントである。結合は、VP 1、細胞表面受容体であるガングリオシドGM1(28)、共受容体として働く主要組織適合性複合体 (MHC) クラスIの相互作用によって媒介される(29).その後、SV40カプシドは、VP 1と細胞表面のガングリオシドGM1との相互作用によって引き起こされる脂質ラフトを介したエンドサイトーシス(30)を経て標的細胞に入る(31)(図2)。その後、SV40カプシドは小胞輸送により、エンドソーム区画で小胞体(ER)へ向かって移動する。非定型的な状況では、SV40はカベオレを介したエンドサイトーシス経路で細胞に入り、ウイルスがエンドソームコンパートメントを迂回してERに直接トランスロケーションされる(32、33)。小胞体で始まるアンコーティングプロセスは、小胞体がCa2+イオンを吸収することで進行し、カプシドに侵入したVP 1 C末端アームが提供する特定のペンタマー間の結合を喪失させることになる。この過程でSV40核局在化シグナルが露出し、インポーティンα2/βヘテロダイマーとVP 3を介したメカニズムでウイルスゲノムの核内移行を誘導する(8,34,35)(Figure 2)。初期のウイルス転写とDNA複製の両方が核の内部で起こる。転写はNCCRで制御され(36)、一方、DNA複製は同じNCCR領域に含まれるORI配列から始まる。SV40のDNA複製は初期領域の転写後すぐに起こり、後期領域の転写はウイルスDNAの複製後に開始される(37)。初期および後期プロモーターはいずれも、細胞のRNAポリメラーゼIIおよび宿主因子によって認識され、それによってウイルス遺伝子の転写が誘導される。初期転写は、Tagとtagをコードする2つのmRNAに交互にスプライシングされる前駆体の生成をもたらす(38)(図2)。この段階では、SV40後期遺伝子は転写抑制因子によってサイレンシングされた状態に維持される(39)。寛容な細胞では、Tagの役割はDNA複製に不可欠である。Tagは多機能リンタンパク質であり、SV40ウイルスの複製ORIに二重六量体として結合し、そこでウイルスDNAを巻き戻す。この分子プロセスは、DNAポリメラーゼ-αやレプリケーションプロテインAなど、ウイルスのDNA複製に必要な細胞内タンパク質のリクルートを誘導する(40,41)。また、TagはウイルスDNAの伸長に必要なATPase活性を担っている(42)。SV40がDNAを複製するためには、主にS期に発現する、さらなる細胞の補因子が必要である。このため、Tagは、肝細胞増殖因子受容体(HGFR/Met)(44)、インスリン様増殖因子1(IGF-1)(45)、ノッチ1(46)、cdc2(47)などの細胞周期進行やアポトーシス(43)を制御する重要なシグナル伝達経路に関わる細胞内タンパク質を調節するように進化していた。これらの分子は、SV40に感染した細胞をG1期からS期へと進行させる(48)。このメカニズムでは、SV40のDNA複製とS期の進行の両方において、Tagと協力的な役割を果たしているようである(図2)(7,49,50).SV40感染時の、前期から後期への移行は、ウイルスのDNA複製の終了時に始まる。この初期から後期への転写の切り替えは、Tag濃度の変化に依存していると思われる。当初、低濃度のTagは、高親和性NCCR Tag結合モチーフとTagの相互作用に十分であり、したがって初期転写は正に制御される。次に、高濃度のTagは、このタンパク質が低親和性のNCCR Tag結合モチーフと相互作用することを可能にする。この相互作用により、RNAポリメラーゼII複合体をブロックすることで、初期転写の抑制が誘導される。さらに、細胞性リプレッサーは後期プロモーターから滴下され、後期遺伝子の発現を可能にする。実際、SV40ゲノムの数はウイルスDNAの複製中に増加するため、後期プロモーターでは抑制因子の濃度が減少する。Tagは宿主の転写因子とともに後期プロモーターと相互作用し、それによって後期遺伝子の転写が誘導される(51)。後期遺伝子は、初期遺伝子をコードする鎖と反対方向に転写される。後期タンパク質は、2種類の後期mRNAから翻訳される:(i) 主要なカプシドタンパク質VP 1をコードする16S、(ii) VP 2、VP 3、VP 4ポリペプチドおよびagnoproteinをコードする19S(52)(図2)。合成後、後期ウイルスタンパク質は、細胞分裂を負に制御するSV40によるチェックポイントキナーゼChk1の活性化を経て、細胞内に蓄積される(53)。そして、構造タンパク質が複製されたウイルスDNAと集合して核内でビリオンを形成する(図2)(26)。この機構は、SV40ゲノム内にある6つのタンデムGC-boxがカプシド集合シグナルとして誘導される。ウイルスの組み立ては、GC-boxが細胞内転写因子SP1と相互作用してVP 2とVP 3をリクルートし、それがVP 1ペンタマーに結合することで始まる(54)。この過程で、ウイルスDNAを取り囲むカプソマーの数は、ビリオンの組み立てが終了するまで増加する(9)。同時に、アグノプロテインはVP 1の核周辺への局在を制御する(26)。そして、ウイルス粒子の放出(図2)により、細胞の溶解と壊死が起こる。しかし、ヒト中皮細胞、上皮細胞、線維芽細胞、胚性腎細胞(HEK)などの特定の細胞種では、細胞病理効果(CPE)を示さないSV40の放出が報告されている(44,55–57)。
SV40を介した細胞の不死化およびトランスフォーメーション
異なる組織型の哺乳類細胞は、このがん原性ポリオーマウイルス(PyV)がウイルスサイクルを完了し、成熟したウイルス子孫を生成する能力によって、SV40感染に対して異なる方法で振る舞うことができる。SV40に感染した細胞は、(i)寛容、(ii)非寛容、(iii)半寛容のいずれかになりうる(56,58–60)。主な判別は、寛容細胞および半寛容細胞で発現するウイルスDNA複製能に依存する。この場合、ウイルスの子孫が作られるのに対して、SV40感染細胞は溶解して死んでしまう。サルの腎臓組織由来のCV-1と線維芽細胞様COS細胞株は、パーミッシブ細胞の原型である(58、61)。非許容性細胞では、生産的なウイルスサイクルは確立されず、一方、感染は起こるが中止される。実際、これらの細胞はSV40によって形質転換/不死化される。非許容性細胞の典型的な例はネズミの細胞で、細胞が形質転換される一方で、ゲノムに組み込まれたSV40 DNAを保持している(62)。半伝染性細胞はSV40の増殖を許容するが、限られたウイルスの子孫を産生する(63)。しかし、SV40の感染に抵抗する一部の細胞は、低い力価でウイルスの子孫を作りながら、形質転換し不死化する。SV40で形質転換/不死化したヒト線維芽細胞がいくつか文献に記載されている(64,65)。細胞は、Tagが後期プロモーター転写を刺激する能力によって、SV40感染に対する応答が異なり、これは寛容/半寛容細胞においてのみ生じる。ヒトの細胞はサルの細胞よりもSV40の複製を効率よく支持しない。ヒト細胞におけるSV40の複製能を実証するために、さまざまな試験管内試験細胞モデルが確立されている(66)。初期の研究では、SV40がヒト胎児神経細胞株(4)、中皮細胞(56)、およびB-/T-リンパ球(64、65、67)において複製できることが示されている。効率は悪いが、このPyVはヒトHEKリンパ芽球系B細胞株や、WI-38細胞のような線維芽細胞でも複製できる(57,68-71)。さらに、まれに(<1/108細胞)、宿主細胞ゲノムへのウイルスDNAの組み込みにより、ヒト線維芽細胞が形質転換することがある(72)。初期の研究では、ヒトアストロサイトの7個中1個が形質転換する可能性があることが示され(73)、連続した細胞株が確立された(74)。さらに、いくつかのSV40感染ヒト細胞は、CPEを示すことなく、低い力価でウイルス子孫を生成する(44、56、57)。その例として、正常なヒト中皮細胞(HMC)が挙げられる。HMCは、SV40に長期間持続的に感染し、ウイルス子孫を放出するようである(44、56、57)。SV40が真の持続・潜伏状態に入る能力の分子機構は、まだ十分に解明されていない。SV40が長期不死化したヒト線維芽細胞で持続感染を確立し、その結果、感染性のウイルス子孫を産生し、サルとヒトの両方の細胞に感染できることが報告されている(64、65)。
他のDNA腫瘍ウイルスと同様に(75,76)、SV40の形質転換能を研究するために、いくつかの試験管内試験細胞モデルが開発されてきた。Tagとtagの発現は、いずれも高い細胞形質転換を効率よく引き起こす(3)。実際、Tagは、p130、p300、p400といった細胞増殖、分化、細胞周期に関わる多くの異なる細胞因子の活性を阻害する(図3)(9)。さらに、Tagとtagはともに、動物やヒトの細胞の重要な腫瘍抑制タンパク質であるp53とpRbの活性を阻害することができる(9)。これらの相互作用は、ヒト細胞の完全な形質転換を達成するために必須である(9)。同様に、別のPyVであるMCPyVに属するTagの形質転換能も実証されている。実際、MCPyVのTagまたはLTは、MCPyV陽性の腫瘍組織で過剰発現していることが検出されており(17)、いくつかの試験管内試験研究ではその形質転換活性が評価されている(77、78)。しかし、多くの研究が、ヒト腫瘍におけるSV40配列の存在を報告しながらも、Tagの発現を示さなかったことを指摘することは重要である。一方、ヒト腫瘍組織のIHC染色に基づく研究では、SV40陽性細胞でTagの発現が確認されている(79–85)。
図3 Tagとtagの発がん性活性
SV40感染時、TagはpRBとp53の両方の腫瘍抑制経路を阻害する。これらの相互作用の主な下流効果は、p53が介在するアポトーシスとpRbが介在する細胞周期停止の阻害である。さらに、TagとpRB、p53などの相互作用は、IGF-1やMetなどの遺伝子をトランスアクティブ化し、それによってG1期からS期への移行とSV40感染細胞の増殖を誘発する。tagはPP2Aを阻害することにより、細胞の増殖や形質転換を促進する経路を活性化する。
興味深いことに、p53は、免疫沈降実験中にSV40形質転換細胞でTagと結合して検出され、初めて発見された(86)。Tagもtagも、他の多くの宿主細胞経路に干渉することができる(38,87,88)。例えば、TagはHsc70、Cul7、Bub1、TEF-1、Nbs1、Fbw7などの多くの細胞内因子と関連していることが分かっている(59)。また、Tag-p53複合体がIGF-1プロモーターに結合して活性化し、細胞増殖を促すことも報告されている(45)。他の成長因子の発現もTagによって影響を受ける可能性がある(9)。SV40感染時にTagと相互作用するもう一つの細胞因子は、肝細胞成長因子受容体(HGFRまたはMet)である(44)。さらに、Tagは、CBP/p300および特定のヒストンアセチル化レベルを増加させることにより、細胞の不死化および形質転換を誘導することができる(89)。
SV40 Tagは、細胞ゲノムや細胞因子との相互作用により、宿主細胞において様々な分子変化を引き起こす。SV40 Tagは、宿主ゲノムの染色体異常や点突然変異の出現によって示される、クラスト形成および変異原性活性を有する(90–93)。これらの分子/染色体変化は、SV40に起因すると推定されるヒトの腫瘍では調査/報告されていない。特異的なゲノムの変化は、ギャップ、切断、二動的染色体や環状染色体、染色体変化、欠失、重複、転座などの数値的・構造的な染色体異常によって特徴づけられる(91–93)。SV40 Tagは点突然変異の蓄積を促進し、宿主のDNA修復経路を妨害する(90,94,95)。実際、SV40 Tagはp53タンパク質と結合し、p53が誘導するアポトーシスを阻害し、DNAが変異した細胞を生存させる(90,94,95)。異なる組織型のヒト腫瘍において、特定の染色体異常が検出されることはよく知られており、以下のように報告されている:(atlasgeneticsoncology.org/Deep/CancerCytogenet2005ID20050.html)。SV40駆動/陽性のヒト腫瘍では、同様の染色体異常のパネルが表示される可能性がある(90–93)。時折、SV40のDNAが宿主の細胞ゲノムに統合されることがある。この事象は、細胞DNAの中でランダムに起こり、一方、ウイルスDNAも同様にランダムに切断される(96)。SV40 DNAの統合が起こった場合、Tagとtagの発現を維持しながら、これら2つのウイルス性オンコプロテインが細胞形質転換の表現型をサポートする(9)。さらに、Liuと共同研究者は、クローン化Ori-SV40で不死化したヒト気管支上皮細胞株、CRL-2504細胞株において、SV40統合による1q21.1のヒト染色体間隔の破壊が、細胞不死化に必須のステップとなり、ウイルス統合部位に近接して存在する老化/アポトーシスに関わる遺伝子の発現を変化させることを示した(97)。骨肉腫では、SV40のDNAがヒトゲノムに組み込まれることが報告されており、ウイルスDNAの組み込みが腫瘍形成に関与していることが示唆されている(98)。これらのSV40による変化は、宿主細胞のSV40による形質転換を引き起こす表現型の変化を引き起こす遺伝的背景を表している。
小さなtagを持つウイルスのオンコプロテインは、プロテインホスファターゼ2A(PP2A)と相互作用し、それによって細胞の変化に関連するいくつかの経路を誘発する(図3)。tag-PP2A複合体は、CDK阻害剤p27の分解、サイクリンA/CDK2およびサイクリンE/CDK2の促進を通じて、細胞周期S期への移行を誘導する(99–101)。さらに、tag-PP2AはMAPKカスケードの活性化を誘導し、それによって試験管内試験での形質転換プロセスを誘発する(102)。第3のSV40初期タンパク質である17kTもまた、サイクリンA/CDK2をトランスアクティブ化する(100)。SV40の形質転換に関与する多くの因子が発見されているが、この活性に関与するタンパク質の総数はまだ決定されてはいない。
SV40感染と様々な細胞内遺伝子のDNAメチル化との関連が報告されている。実際、不適切なDNAメチル化は、癌を含む様々な疾患(103,104)に関与している(105,106)。DNAメチル化は、抗ウイルス免疫を回避するためにDNA腫瘍ウイルスによって誘導され、がん発症時の免疫抑制的な微小環境に寄与している(107)。このプロセスは、ウイルスの増殖/活性化を促進する(107)。
初期の研究では、SV40の形質転換能は、様々な試験管内試験細胞モデルの開発に大きく利用された。SV40不死化細胞は、細胞増殖と形質転換(108–110)、サイトカイン産生(111)、血管新生(112)、さらに間葉系幹細胞分化(113)、神経細胞分化と神経再生(114)など、多数の異なる分子機構の研究に確立し使用されてきた。さらに、自己免疫疾患(115)、男性不妊症(116)、線維肉腫(108)、角膜ジストロフィー(117)など、さまざまな疾患がSV40不死化細胞モデルを使って研究されている。SV40不死化細胞試験管内試験モデルのその他の応用例としては、細胞共培養(118)、自殺遺伝子治療(119)などが挙げられる。
SV40 マイクロRNAとウイルス感染症
マイクロRNA(miRNA)は、真核生物の遺伝子発現の転写後ネガティブ制御に関与する低分子ノンコーディングRNA[18-22 nucleotide(nt)]である(120)。これらの小分子とその制御効果は、真核生物の細胞とPyVsを含むウイルスの両方で報告されている(120)。SV40では、初期領域に2つのmiRNAをコードする遺伝子がマップされており(図1)、これらは反対方向に転写される。これら2つのウイルスmiRNAは、SV40のライフサイクルの後期において、RNA媒介干渉(RNAi)機構を介して、初期mRNAをネガティブに制御し、Tagの翻訳を阻害する。これら2つのmiRNAは、異なるヌクレオチド位置でのTag mRNA切断を積極的に指示する(27,121)。しかし、SV40のmiRNAによるヒト遺伝子のサイレンシングの可能性は否定できない(27,121)。これらの知見は、SV40がヒトのRNAi機構を利用することができることを示している。Tagは宿主の細胞傷害性Tリンパ球(CTL)の標的であるため、ウイルスmiRNAによるTagのダウンレギュレーションは、SV40感染細胞のCTLの活性に対する感受性を低下させる(27,121)。同様に、JCPyVとBKPyVは、ヒトのRNAi機構を利用して、自然免疫と適応免疫の検出を免れている。実際、これら2つのHPyVは、BKPyVとJCPyVの間で同一の配列を持つmiRNAをコードし、UL16結合タンパク質(ULBP)ファミリーのメンバー、ストレス誘導リガンドULBP3を標的としている(122)。最近の研究では、この遺伝子ファミリーの別のメンバーであるULBP1がSV40感染後にダウンレギュレートされることが示されているが、SV40 miRNAはこの分子効果を媒介しないことが実証されており、SV40免疫回避能力の背後に他のメカニズムの関与が示唆されている(123)。別の報告では、感染したBリンパ球とミエロイド細胞株を用いた実験においてSV40 miRNA-null変異体を用いて実証されたように、2つのSV40 miRNAがB細胞に対するウイルス影響の程度をネガティブに制御できることが示された(124)。
動物モデルにおけるSV40のがん原性
SV40は、発がん性の高い小型DNA腫瘍ウイルスである。しかし、このPyVは、自然宿主であるアカゲザル(Macaca mulatta)の腫瘍では報告されていない。実際、腎臓組織由来の寛容なサル細胞にSV40を感染させると、腫瘍化することなく、細胞溶解と死が起こる(58,61)。一方、ハムスターに実験的にSV40を接種すると、注射の経路によって異なる組織型の腫瘍が発生する。具体的には、SV40をハムスターの皮下に接種すると肉腫や骨肉腫が、脳内に接種すると上衣腫や脈絡叢乳頭腫が発生する(5、38)。リンパ性白血病、組織球性リンパ腫、B細胞性リンパ腫などの血液悪性腫瘍は、SV40を静脈内に接種すると誘発される(5,6)。ハムスターの胸腔内にSV40を注射すると、100%の動物に悪性胸膜中皮腫が誘導される(125)。
SV40の発癌活性は、Tag/tagの発現がそのプロモーター(126)または組織特異的プロモーター(127–145)の制御下にあるトランスジェニックマウスで示されている。生体内試験における膨大なSV40のがん原性を利用し、SV40トランスジェニック動物は、腫瘍の発生/進行や革新的な抗がん剤治療を研究するための優れたモデルとなった(146)。トランスジェニック動物は、上衣腫、脈絡叢乳頭腫(147)、肝細胞癌(139、144)、脳(148)、膀胱(140)、および腸腫瘍(149)、ならびに眼球および/またはレンズ腫瘍(150)を含む眼腫瘍を発症した。前立腺癌の多段階進行もまた、SV40トランスジェニックマウスを用いて大きく研究されてきた(128–130,132,134-136,151,152)。興味深いことに、褐色脂肪腫(151)、心臓横紋筋肉腫(142)、副腎皮質癌(151)などの稀な癌の研究にもSV40を用いたトランスジェニックマウスが使用されている。肺がんや悪性胸膜中皮腫もこれらの動物モデルで研究されている(127,137,141)。さらに最近では、慢性リンパ性白血病を研究するためにSV40トランスジェニックマウスが開発されている(143)。さらに、他のSV40トランスジェニックマウスモデルも、線維肉腫(108)および網膜芽細胞腫(153)、ならびに乳癌(154、155)卵巣癌(131、156、157)、膵臓癌(158)および肝癌(20、159)の研究のために開発されてきた。
ヒト集団におけるSV40感染症の疫学
ヒト集団におけるSV40感染は広く報告されている(160–164)。SV40はサルのウイルスであり、サルはその自然宿主であることから、このヒトへのウイルス感染は、サルと密接に接触する対象者に限定され、まれな出来事と考えられていた。実際、サルの自然環境であるジャングルに近いインドの村の住民や、動物園・動物施設でサルの世話をしている人は、SV40に感染しやすく、このPyVに対する抗体ができている(165、166)。
1955年から1963年にかけて、南北アメリカ、カナダ、ヨーロッパ、アジア、アフリカの数億人が、SV40に汚染されていることが判明した不活化ポリオワクチンや生ポリオワクチンを接種され、不注意にもヒトに投与された。この事故は、これらの初期のポリオワクチンが、自然にSV40に感染したサルの細胞培養でポリオウイルスを増殖させて製造されたために起こった(167-169)。旧ソ連では1978年までSV40に汚染されたポリオワクチンが使用されていたが(170)、イタリアでは1999年まで、イタリア保健公社が英国国立生物標準管理研究所からの指摘を受けて、世界保健機関(WHO)のガイドラインに示されているSV40を含まない抗ポリオワクチンに切り替えたという報告がある(9、74、171)。他国では、ポリオワクチンがSV40陽性のサル細胞を用いて製造されているため、ポリオワクチンによるSV40伝染のリスクが依然として問題視されている(170)。過去の文献から、異なる地域でのSV40感染は、SV40に汚染されたワクチンか非汚染ワクチンのどちらを使用したか、また、ワクチン投与年数によって影響を受けることがわかった。Sweetらは、ポリオワクチンの約10〜30%がSV40に汚染されていることを定量的に示した(1)。さらに、ポリオワクチン中のSV40の遺伝子型は、ヒトで検出されたものと重複していることから、この発がん性PyVが汚染されたポリオワクチンを通じてヒトに持ち込まれたことが示唆された(172)。また、SV40感染直後に、このPyVがSV40で汚染されたワクチンを接種した子供の便の中で数週間にわたって拡散したことが報告されている(173)。この証拠は、SV40が一部の消化管細胞で複製することを示し、したがって、このウイルスが糞便-経口経路などの水平感染によってヒトに広がる可能性を示唆している。アデノウイルス(174)やA型肝炎(175)に対する他のワクチンもSV40に汚染されていることが少なからずある。さらに、呼吸器シンシチアルウイルスワクチンでは、呼吸器経路で接種された感染ボランティアにSV40汚染が検出された(176)。ボランティアの3人に2人がSV40に対する中和抗体を獲得している(176)。これらのデータを総合すると、SV40がヒトに感染し増殖することがわかる。
長年にわたり、分子生物学的手法の発展(12,18,76,177,178)に伴い、SV40のDNA配列が調査され、SV40に汚染されたポリオワクチンを接種した人の正常組織と腫瘍組織の両方から検出されるようになった。このPyVからのDNA配列は、下垂体組織(179)および臓器(180)および血液(181)提供者からの白血球で検出されている。SV40のDNAの足跡は、リンパ芽球細胞(68)、正常人および腫瘍患者の血液検体(79,161,182–186)でも報告されている。さらに、アスベスト汚染にさらされた健康な人の血液検体からもSV40 DNAが検出されている(187)。これらのデータは、SV40がヒト集団の中で循環していることを累積的に示している。また、血液細胞がSV40のリザーバーであり、ヒトにウイルスを拡散させる手段である可能性もある。このPyVのゲノム配列は、子供や大人の便サンプルや尿からも見つかっており、SV40が、ヒトにおけるウイルスの水平感染の原因である性的経路や糞便-口腔経路など、異なる経路で感染する可能性があることを示唆している(164,183,188)。これらの追加的な曝露源は、健常者における不顕性SV40感染につながる可能性がある。しかし、サルにおけるSV40の感染は、動物間で直接起こるのではなく、むしろ環境中で起こるようだと報告されている(189)。ヒトでは、人から人への感染ではなく、汚染された環境や家庭環境がSV40の拡散の原因であることはもっともである(188)。ヒトにおけるSV40の潜伏感染部位は、まだ解明されていない。このPyVはヒトの腎臓や尿から検出されているので(183,184)、サルでは自然宿主であることから、腎臓がウイルスの潜伏場所である可能性が高いと考えられる(1,189)。
SV40の一次感染は生後早期に起こり、その血清有病率は年齢とともに増加する。免疫された人の血清中の抗SV40抗体とSV40抗原は健常者でも検出されている(190-199)。Lustingらは、1歳から13歳までのスウェーデンの小児の7.6-14%に血清中の抗SV40抗体の有病率を報告した(198)。初期の研究では、アフリカの健常者(200)と米国(201)で11%という低い有病率が検出された。同様に、より最近の研究では、健康な成人献血者の血清中に抗SV40抗体が検出され、その割合は2%程度と低いものであった(202)。これらの血清学的データを総合すると、SV40は免疫のある健康な集団に1.3-15.6%の範囲で存在し、このPyVはヒトに低い有病率で循環していることが示唆される(200,201,203-206)。興味深いことに、ある研究では、SV40に汚染されたポリオワクチンが導入される前に、ヒトの血清中にSV40抗体が検出されたと報告しており、SV40はSV40に汚染されたワクチンとは無関係にヒトに循環していた可能性が示唆されている(207)。しかし、この研究は、SV40と相同性の高いヒトPyVs、JCPyV、BKPyVが同定される前に行われたものである(2、13)。実際、BKPyV、JCPyV、SV40の3つのPyV間の高い相同性は、抗原性交差反応による血清学的データの妨げとなった。長年にわたり、PyVの交差反応性により、ヒトにおけるSV40の本当の普及率を検証することができなかった(208)。SV40抗原のようなビリオン、可溶性組換えVP 1タンパク質、ウイルス様粒子(VLP)の使用に基づく様々な免疫学的アッセイは、常にBKPyV/JCPyVとの交差反応性を示した(208)。
この技術的な問題を回避するために、近年、SV40 VPs/Tagを抗原とする特異的で感度の高い間接ELISA試験が、SV40 VPs/Tagに反応する血清IgG/IgM抗体の健常人における存在を調べるために設定された(191、192)。免疫学的データから、健康な献血者はSV40 VPsとTagに反応するIgG抗体をそれぞれ18%と20%の有病率で保有していることが示された(191、192)。さらに、小児の免疫学的データは、SV40感染/セロコンバージョンが生後6カ月の早い時期に起こることを示唆しているかもしれない(190、193)。
主要サラセミアに罹患した複数の輸血患者の血清中のSV40 VPに対する抗体は、同じ年齢の健常者(31歳、両コホート)より高い有病率であった。これらのデータは、このPyVが他の自然発生源とともに、輸血によって感染した可能性を示している(209)。さらに、SV40抗体の有病率の増加は、年齢をマッチさせた対照群よりも患者の高齢群(41-50歳)で有意に高かった(38 vs. 20%)。
最近の調査で、テキサス州ヒューストン在住の女性の血清から、プラークリダクションSV40中和アッセイ法を用いて、7〜18%の有病率でSV40中和抗体が検出されたことが明らかにされた。著者らは、ヒューストンの被験者を含むヒスパニックグループで報告された高い血清有病率のSV40中和抗体と関連する重要な要因として、民族性を挙げている(210)。SV40で汚染されたポリオ生ワクチンは、ナイーブワクチンになる可能性があるため、ラテンアメリカ諸国での大規模な野外試験で、候補ワクチンとしてテストされたことを思い出す価値がある。
免疫学的データは、SV40がヒトの体内を循環し、IgM抗体、IgG抗体、中和抗体を誘導することを示しており、これらの抗体は健康な人の血清中に平均20%程度の頻度で検出されることがある。最近の免疫学的データは、SV40を模倣したものであるにもかかわらず、SV40に近縁な別のポリオーマウイルスがヒトに蔓延しているという仮説を否定するものではない。
SV40とヒト腫瘍との関連性
SV40がヒトの悪性腫瘍に関連するかもしれないという仮説は、多くの分子生物学的、免疫学的、疫学的研究によって検討されてきた(表2)。この発癌性PyVは、これまでに悪性胸膜中皮腫(悪性胸膜中皮腫)(80,81,227-233,235,238,240-243,256–258)、骨(98、215、224)、脳(212–214、217、219–221、259、260)、肺(227、234)、甲状腺(82、244)、下垂体(179)、尿路上皮(245)腫瘍、耳下腺の多形腺腫(83)、脈絡叢腫瘍、小児の上衣腫(160)。さらに、乳癌(84)や結腸癌(222)の検体にもSV40 DNAの足跡が検出されている。興味深いことに、SV40のDNA配列は、大脳病変のあるエイズ患者からも見つかっている(216)。さらに最近では、RNAシーケンス(RNA-seq)という革新的な解析法を用いた研究により、低悪性度神経膠腫患者の腫瘍試料からSV40 mRNAが同定された(219)。非ホジキンリンパ腫(79、247-251、260)を含む様々なリンパ増殖性疾患(85、239、254、255)もSV40感染と関連している。また、SV40で形質転換した細胞をヒトに同種・自家移植すると結節ができることが報告されており、このPyVがヒトで発がん能を示すことが示唆されている(261)。これらの研究は、ヒトの癌とSV40との関連性を支持するものである。
主にPCR、サザンブロットハイブリダイゼーション、DNA配列決定、免疫組織化学(IHC)により得られたこれらの結果は、多施設共同研究(80)により確認されたが、別の研究者グループにより否定された(262)。SV40陽性腫瘍のうち、悪性胸膜中皮腫は多くの研究でSV40陽性と検出されており(80,81,227-233,235,238,240-243,256-258,263)、SV40発癌のメカニズムも研究されている(9,44,258,264,265)。興味深いことに、正常なHMCをSV40とアスベスト繊維の両方に暴露した場合、対照と比較して形質転換率が有意に増加した(9)。アスベスト繊維に単独で高曝露すると、進行性の線維化(すなわちアスベスト症)を引き起こし、さらに悪い場合には、肺がん(266)や悪性胸膜中皮腫(9)を引き起こす。多くの研究が、アスベストへの曝露が多く、SV40に汚染されたポリオワクチンを接種している地域において、悪性胸膜中皮腫の発症にSV40とアスベストの相乗効果があることを報告している(9,81,187,232,236,239).悪性胸膜中皮腫組織におけるSV40 DNA配列の高い有病率は、SV40に汚染されたポリオワクチンとの関係を反映している(9、81、187、232、236、239)。上記のヒトの癌の大部分は、SV40を接種したげっ歯類やSV40トランスジェニックマウスで発生する腫瘍に相当する。
表2 SV40陽性のヒト腫瘍
| 腫瘍の種類 | 陽性検体数/全検体数(%) | 技法 | 参考文献 | |||
|---|---|---|---|---|---|---|
| SV40 DNA | SV40 RNA | SV40タンパク質 | ヒト血清抗SV40抗体 | |||
| 固形がん | ||||||
| 乳がん | 24/109 (22) | – | 24/109 (22) | – | PCR、IHC | (84) |
| 乳がん | – | – | – | 12/78 (15) | ELISA | (211) |
| 脳腫瘍 | ||||||
| アストロサイトーマ | 8/35 (23) | – | – | – | RA | (212) |
| アストロサイトーマ | 8/17 (47) | – | – | – | PCR法 | (161) |
| Astrocytoma | – | – | 11/15 (73) | – | IP, SS, WB | (213) |
| Astrocytoma | 9/28 (32) | – | – | – | PCR, SB | (214) |
| Choroid plexus | 10/20 (50) | – | 4/5 (80) | – | PCR, SB, RA | (160) |
| Choroid plexus | 10/20 (50) | – | – | – | PCR | (215) |
| Choroid plexus | 5/6 (83) | – | – | – | PCR | (161) |
| Choroid plexus | 6/16 (38) | – | – | – | PCR, SB | (214) |
| Cerebral lesion | 1* | – | – | – | PCR, filter | (216) |
| Ependymoma | 10/11 (91) | – | – | – | PCR | (215) |
| Ependymoma | 4/13 (31) | – | – | PCR, SB, sequencing | (217) | |
| Ependymoma | 8/11 (73) | – | – | – | PCR | (161) |
| Ependymoma | – | – | 8/8 (100) | – | IP, SS, WB | (213) |
| Ependymoma | 10/11 (91) | 3/6 (50) | – | PCR, SB, RA | (160) | |
| Ependymoma | 9/16 (56) | – | – | – | PCR, SB | (214) |
| Glioma | 3/20 (15) | – | – | PCR, SB, sequencing | (217) | |
| Glioblastoma | 10/30 (33) | – | – | – | PCR | (161) |
| Glioblastoma | – | – | 4/8 (50) | – | IP, SS, WB | (213) |
| Glioblastoma | 9/46 (20) | – | – | – | PCR, SB | (214) |
| Glioblastoma | – | – | – | 15/44 (34) | ELISA | (218) |
| Gliosarcoma | 4/20 (20) | – | – | – | PCR, SB | (214) |
| 低悪性度アストロサイトーマ | 13/22 (58) | – | – | – | PCR、SB | (214) |
| 低悪性度グリオーマ | – | 40/172 (23) | – | – | RNA-seq | (219) |
| 髄膜腫 | 1/7 (14) | – | – | – | PCR法 | (161) |
| 髄膜腫 | 1* | – | – | – | PCR、シークエンス | (220) |
| 各種脳腫瘍Δ | – | 11/32 (34) | – | – | インサイチュハイブリダイゼーション | (221) |
| 結腸がん | 6/94 (6) | – | – | – | PCR、qPCR | (222) |
| 上咽頭がん(Nasopharyngeal carcinoma)。 | – | – | – | 16/64 (25) | ELISA | (223) |
| 骨肉腫(こつにくしゅ | 5/10 (50) | – | – | – | PCR、シークエンス | (224) |
| 骨肉腫(こつにくしゅ | 9/35 (26) | – | – | – | PCR、SB | (98) |
| 骨肉腫(こつにくしゅ | 54/160 (34) | – | – | – | PCR法 | (215) |
| 骨肉腫(こつにくしゅ | – | – | – | 24/55 (44) | ELISA | (225) |
| 骨肉腫(こつにくしゅ | – | – | – | 87/249 (35) | ELISA | (190, 280) |
| 骨肉腫(こつにくしゅ | 143/277 (52%) | – | – | – | PCR法 | (226) |
| 胸部腫瘍 | ||||||
| アデノカルシノーマ | 7/15 (47) | – | – | – | PCR、SB | (227) |
| 気管支肺がん(Bronchopulmonary carcinoma | 18/63 (29) | – | 0/16 (0) | – | PCR、SB、IHC | (227) |
| 悪性中皮腫(Malignant mesothelioma | 10/21 (48) | – | 0/15 (0) | – | PCR、SB、IHC | (227) |
| 悪性中皮腫(Malignant mesothelioma | 3/30 (10) | – | – | – | PCR、シークエンス | (228) |
| 悪性中皮腫(Malignant mesothelioma | 5/5 (100) | 5/6 (83) | – | – | PCR、qPCR | (229) |
| 悪性中皮腫(Malignant mesothelioma | 29/48 (60) | – | 13/16 (81) | – | PCR、IHC | (230) |
| 悪性中皮腫(Malignant mesothelioma | 12/10 (83) | – | 12/10 (83) | – | PCR、シークエンス、IHC | (80) |
| 悪性中皮腫(Malignant mesothelioma | 4-26/26 (15-100)# | – | – | – | PCR法 | (231) |
| 悪性中皮腫(Malignant mesothelioma | 3/19 (16) | – | – | – | QPCR | (232) |
| 悪性中皮腫(Malignant mesothelioma | 15/25 (60) | – | 15/25 (60) | – | PRINS、IHC | (233, 234) |
| 悪性中皮腫(Malignant mesothelioma | 4/11-0/9γ | – | – | – | PCR、SB | (235) |
| 悪性中皮腫(Malignant mesothelioma | 8/19 (42.1) | – | – | – | PCR法 | (236) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | – | – | – | 25/97 (26) | ELISA | (237) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | 20/40 (50) | – | – | – | PCR、シークエンス | (238, 239) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | 2/35 (6) | – | – | – | QPCR | (240) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | 8/18 (45) | – | 0/18 (0) | – | PCR、シークエンス、IHC | (241) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | 4/9 (45) | – | – | – | PCR法 | (242) |
| 悪性胸膜中皮腫(Malignant pleural mesothelioma | – | – | 9/45 (20) | – | アイエイチシー | (81) |
| 胸膜・腹膜中皮腫(Pleural/Pperitoneal mesotheliomas | 67/118 (57) | – | – | – | PCR、シークエンス | (243) |
| 各種肺がんΣ | 12/35 (34) | – | – | – | PCR、SB | (227) |
| 甲状腺腫瘍 | 3/69 (4) | – | – | – | PCR、SB、シークエンス | (244) |
| 甲状腺腫瘍 | 12-19/19-29 (66-100)# | 17/24 (71) | 11/17 | – | PCR、SB、IHC、シークエンス、qPCR | (82) |
| 多形腺腫(Pleomorphic Adenoma | 28/45 (62) | – | 26/28 (93%) | – | PCR、IHC | (83) |
| 下垂体腫瘍 | 26/30 (87)§ | – | 0/18 (0) | – | PCR、SB、IHC | (179) |
| 尿路上皮腫瘍 | – | – | 1* | アイエイチシー | (245) | |
| 尿路上皮腫瘍 | 6/18 (42.1) | – | – | – | PCR法 | (236) |
| ぶどう膜黒色腫 | – | – | – | 16/48 (33) | ELISA | (246) |
| 液状腫瘍(リキッドターム | ||||||
| ホジキンリンパ腫 | 7/43 (16) | – | 2/7 (28) | – | PCR、シークエンス、IHC | (79) |
| ホジキンリンパ腫 | 16/54 (30) | – | – | – | Multiplex Nested PCR | (238, 247) |
| ホジキンリンパ腫 | 2/19 (10) | – | 2/2 (100) | – | PCR、SB、IHC、シークエンス | (85) |
| 非ホジキンリンパ腫 | 8/58 (14) | – | – | – | PCR、SB | (182) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 3/29 (10) | – | – | – | PCR法 | (172, 248) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 17/42 (40) | – | – | – | PCR法 | (249) |
| 非ホジキンリンパ腫 | 6/36 (17) | – | – | – | PCR、シークエンス | (247, 250) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 12/55 (22) | – | 12/12 (100) | – | PCR、IHC | (251) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 11/79 (14) | – | 3/11 (27) | – | PCR、シークエンス、IHC | (79) |
| 非ホジキンリンパ腫 | – | – | – | 36/89-26/61 (40,41,42,43)γ | ELISA | (252) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | – | – | – | 55/150-37/104 (37-36)γ | ELISA | (18,195,197,253) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 85/158 (54) | – | – | – | Multiplex Nested PCR | (238, 239) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 28/106 (26) | – | 28/28 (100) | – | PCR、SB、IHC、シークエンス | (85) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 63/108 (56) | – | – | – | PCR法 | (254) |
| 非ホジキンリンパ腫(Non-Hodgkin’s lymphoma | 38/60 (63) | – | – | – | PCR、qPCR | (255) |
| 白血病 | 22/54 (41) | – | – | – | Multiplex Nested PCR | (238, 239) |
| 白血病 | 16/48 (30) | – | – | – | PCR法 | (249) |
| 各種白血病 | 16/19 (84) | – | – | – | PCR、qPCR | (255) |
*Case reports;
Δ血管線維腫、星細胞腫、転移性脳腫瘍、髄膜腫、神経鞘腫、オリゴデンドログリオーマ;
#プライマーセットが違う;
γ2種類のコホート;
Σ多形癌、神経内分泌癌、扁平上皮癌、その他特定せず
§SV40およびBKPyV内部プローブにハイブリダイズするポリオマウイルスプライマー;
B細胞性急性リンパ芽球性白血病、B細胞前駆体性急性リンパ芽球性白血病、T細胞性急性リンパ芽球性白血病。IP、免疫沈降;SS、銀染色;WB、ウェスタンブロット;PCR、ポリメラーゼ連鎖反応;PRINS、プライムドin situアッセイ(DNA検出);qPCR、リアルタイム定量PCR;IHC、免疫組織化学;RA、制限分析。
同じ種類の腫瘍でも、地域によってSV40の塩基配列の有病率は異なるようだ。例えば、欧米では悪性胸膜中皮腫の20〜83%がSV40陽性であると報告されているが(80,228,230,235,236,249)、トルコやオーストリアの悪性胸膜中皮腫ではこのPyVの配列は検出されていない(235,267)か、スウェーデンのように低頻度で検出されている(228)。同様に、骨腫瘍で検出されるSV40 DNAの陽性率は、例えばハンガリー(74%)とドイツ(24%)で異なっている(226)。さらに、SV40陽性の悪性胸膜中皮腫は、日本の2つの異なる研究で発見され、その有病率は6〜44%であった(241、268)。一方、ベトナムの悪性胸膜中皮腫患者のコホートで行われた別の調査では、20%のSV40陽性の腫瘍を検出した(81)。
SV40とヒト腫瘍との関連は、多くの研究者によって得られた結果に基づいている(80,98,213,218,220,225,227,230,234,255,256)。これらの研究のほとんどは、定性的PCR技術を使用して、腫瘍検体中のSV40 DNA配列を検出した。しかし、これらのアッセイは、コピー数としてのSV40 DNAの定量化を提供せず、また、ウイルスDNAの物理的状態、すなわち、統合および/またはエピソーム(96、98)を調査しない。他の研究では、SV40 mRNAおよび/またはTag/tagオンコプロテインが腫瘍で分析され(9、68、81、83、160、219)、あるいはqPCR法によりSV40 DNA配列の量が定量された(240、268、269)。これらの定性的/定量的アッセイ(表2)の大部分は、異なるSV40 Tag配列をターゲットとして実施された。これらの配列とともに、コントロール領域や後期遺伝子配列を含む他のSV40領域もPCR分析された(181,220)。これらのデータは、ヒト腫瘍で検出されたSV40 DNA領域が、SV40 Tag配列を有する組換えプラスミドによるPCR汚染に起因するものではないことを示している。さらに、IHC染色に基づく研究では、SV40感染細胞におけるSV40 Tagの局在が示されている(79–85)。SV40 Tag陽性細胞について行われた研究では、細胞の形質転換が特定のオートクリン/パラクリンループの活性化に関連していることが示された。この文脈で、HGFとその受容体(HGFRまたはMet)(44)、血管内皮増殖因子(VEGF)とその受容体(VEGFR)(270、271)、さらに(IGF-1)とその受容体のように、T-抗原媒介増殖における異なる成長因子とその受容体が分析された(272、273)。SV40 Tagが成長因子受容体/成長因子ループを誘導し、それがS期への細胞周期進行を刺激する能力について、一致したデータが報告された。これらの結果は、SV40陽性であることが判明した少数の細胞が、微小環境上のSV40陰性細胞を形質転換に向けて誘導していることを示唆している。SV40に感染した細胞は、いくつかの試験管内試験の研究によって決定されている(56,58–65)。ヒトにおけるSV40発癌のメカニズムについては、トランスジェニックマウスで研究された「ヒットアンドラン機構」を含む様々な仮説が立てられている(274)。しかし、この仮説はヒトで証明することはできない。上記の報告のほとんどは、ヒトの腫瘍を誘発するSV40の原因的な役割を証明できない関連研究に関連するものである。このPyVが、腫瘍形成の初期段階あるいは腫瘍の進行の後期段階のいずれにおいても、腫瘍形成の過程で共同因子として作用する可能性があることはもっともである。実際、他のウイルス(17)と同様に、通常の生理的条件下では、免疫系はSV40の発がん性を打ち消す(194)が、その感染は人生の初期に獲得することができる(190、193)。しかし、免疫不全者のような特定の宿主条件下では、SV40はその癌化活性を発揮する可能性がある。また、SV40が、細胞がすでに形質転換している後期段階で作用する可能性もある。このような前新生物細胞では、SV40のTag/tagの発現が完全な形質転換を促進する可能性がある。さらなる研究により、この重要な側面が明らかになるかもしれない。
いくつかの研究では、ヒト腫瘍とSV40との関連について否定的なデータが報告されている(235、263、274–277)。これらの調査では、他の研究でSV40陽性であることが判明した同じ種類の腫瘍において、ウイルスDNA(または低有病率のSV40 DNA)もウイルス性オンコプロテインやmiRNAも示されていない(240、248、275-278)。これは、ヒトおよびヒト腫瘍におけるSV40に関する論争を煽る重要な問題である(262)。しかし、SV40をヒトの癌の危険因子と考える上で統計的に有意でないと考えられるとしても、これらの研究で約5%のSV40有病率が示されたことを指摘することは重要である(9、240、262)。もう一つの関連する問題は、Lopez-Riosらによって強調され、SV40の配列を持つプラスミドが一般の研究室に出回ることによって、偽陽性のPCR結果が説明できるリスクを証明し、それによって過度に高い陽性率を作り出している(262)。Aaronsonと同僚による別の独立した報告書でも、同様の結論に達する否定的な結果が発表されている(279)。実際、この研究では、一連の悪性胸膜中皮腫 腫瘍および由来細胞株において、Tag 抗原が発現していることを示す証拠はない(279)。このような理由から、ヒトやヒトの癌におけるSV40感染の証拠を明らかにしつつ、偽陽性を防ぐために、分子技術やプロトコルがこれまで以上に慎重に使用されるようになった(270、276)。腫瘍組織からDNAを分離するために採用されたアッセイの違いが結果に影響を与えることも、この矛盾の説明として考えられている(79)。実際、いくつかの市販のキットでは、長さが5.2kb以下、つまり小さすぎるSV40 DNAは分離できない。さらに、SV40 DNAはある種のプライマーセットでは増幅できるが、他のものでは増幅できない(160、230)。まとめると、これらの相反する結果を明らかにし、ヒトの癌におけるSV40の役割に対処するためには、新しいアプローチによるさらなる研究が必要であるということである。
これらの論争をよりよく解明するために、合成ペプチドを模倣物/特異的SV40抗原として用いた新しい間接ELISA試験が設定された(191、192)。これらの免疫学的かつ特異的なアッセイにより、分子生物学的手法によりSV40陽性であることが判明した同種の異なる腫瘍(211,218,223,225,237,246,252,253,280,281)の影響を受けた患者からのヒト血清に抗SV40抗体が認められることが確認された。悪性胸膜中皮腫、多形性膠芽腫、骨肉腫、非ホジキンリンパ腫患者の血清では、年齢・性別をマッチさせた健常者と比較して、有意に高いSV40抗体価が検出された(218,225,237,252,253,280).
SV40とヒト非悪性腫瘍との関連性
動物の自然宿主であるサルで起こるように、ヒトでも腎臓がSV40潜伏の主要部位となる可能性を示唆する報告が多い(1、189)。このため、SV40感染と腎臓関連疾患との関連性が検討された。このPyVのDNA配列は、腎尿細管上皮細胞核、PBMC、巣状分節性糸球体硬化症患者由来の腎生検で検出され、腎臓病へのSV40の関与の可能性を示唆した(184)。この仮説は、腎症患者の尿沈渣細胞とサル由来のSV40寛容細胞であるCV-1細胞の共培養でSV40ビリオンが分離されたことにより、さらに強化された(183)。さらに、移植後間質性腎炎患者においてSV40/BKPyVの共感染が起こるという分子的証拠も報告されており、SV40がBKPyVと協力して腎移植後の本疾患に寄与している可能性が示唆されている(183)。他の研究では、SV40が多発性硬化症などの神経疾患と関連しているようであることが示されている(281–283)。SV40のDNA配列は、免疫不全の小児腎移植患者の同種移植片や、若年成人の肺移植患者の腎臓でも検出されている(162,284)。従って、他のPyVsと同様に、異所性免疫抑制を受けた移植患者に典型的な免疫系の弱さがSV40感染の危険因子となりうることを示唆するのは妥当である(17)。
結論
世界中の様々なヒト集団におけるSV40感染は、多くのグループによって報告されている(160–164)。実際、SV40のDNA配列は、PBMC(161、182、187)、臓器および血液提供者の白血球(180、181)および下垂体組織(179)などの正常組織で検出された。特異的な免疫学的アッセイにより、正常な小児、成人、高齢者の血清中にSV40のVPおよびTagに対するIgGおよびIgM抗体が確認された(190,191,193,194)。さらに、SV40中和抗体は、被験者/患者においてSV40感染が起こったことを示す特異性の高い試験であるプラークリダクションアッセイを用いて、異なる調査において検出された(203、210、285)。これらのデータは、SV40、または近縁のポリオーマウイルスがヒトに循環していることを累積的に示している。異なるヒトの腫瘍とSV40との関連については、相反する結果が発表されている。この発癌性PyVは以前、脳腫瘍(213、220、234)および骨腫瘍(98)、悪性胸膜中皮腫(80、81、227、230)および異なるリンパ増殖性疾患(85、239、249、254)などの幅広い腫瘍型と関連していたが、他の研究者は同じ腫瘍型を分析したときに否定的な結果を報告している(238、275–279)。さらに、これらの研究は、主にウイルスDNAの検出に基づくものである。腫瘍検体で行われた他の研究では、ウイルスDNAの状態(統合型またはエピソーム型)、mRNA、およびウイルスのオンコプロテインの発現について、より少ない程度ではあるが調査した(84,98,213,219)。免疫学的研究では、腫瘍に冒された患者の血清からSV40に対する特異的抗体が検出された(218,225,237,252,280).
まだ未知のSV40様ヒトポリオマウイルスの存在を否定することはできない。最近、ヒトで新しいリンパトロピックポリオマウイルス(HPyV9)が同定された(286)。HPyV9は、1960年代から知られていたサルのLPyVと大きな相同性を持つことが判明した(287)。
ヒトの腫瘍におけるSV40の役割は、もしあるとしても、まだ証明されていない。これは重要な問題であり、詳細かつ革新的な調査によってさらに注目されるべきものであることは確かである。
著者からの寄稿
JR:文献からのデータ収集、執筆、図面作成。EMとIB:文献からのデータ収集と図の作成。MTとFM:原稿の修正。
利益相反に関する声明
本研究は、潜在的な利益相反と解釈されうる商業的または金銭的関係がない状態で実施されたことを宣言するものである。
フットノーツ
資金提供本研究は、Associazione Italiana per la Ricerca sul Cancro (AIRC) からMT (ID:21617)とJR (ID:21956) への資金援助を受けている。JRはまた、イタリア、ミラノのウンベルト・ヴェロネージ財団からの博士研究員の支援を受けている(2019-2020)。