Contents
Amino Acid Catabolism in Alzheimer’s Disease Brain: Friend or Foe?
www.ncbi.nlm.nih.gov/pmc/articles/PMC5316456/
要旨
アルツハイマー病治療薬開発のための新たなターゲットの発見が切望されている。アルツハイマー病脳で起こる神経細胞のブドウ糖代謝の低下は、病気の進行に中心的な役割を果たす可能性がある。エネルギーの恒常性を維持しようとするために起こる代償的な神経細胞の変化については、ほとんど知られていない。
PubMed文献データベースを使用してこのレビューでは、我々はアミノ酸の酸化が一時的に減少したグルコース代謝を補うことができるが、最終的には変更されたアミノ酸とアミノ酸異化産物のレベルはおそらくアルツハイマー病の進行に寄与する毒性につながるという証拠を要約する。
アミノ酸は非常に多くの細胞の代謝とシグナル伝達経路に関与しているので、アルツハイマー病脳で変更されたアミノ酸代謝の影響は広範囲に及んでいる。いくつかの重要なアミノ酸のレベルの変化から考えられる病理学的な結果が議論されている。アルツハイマー病患者の脳の内皮細胞には尿素サイクル機能が誘導されている可能性があり、アミノ酸代謝の亢進から生成された過剰なアンモニアを除去することが考えられる。
代謝学の観点からアルツハイマー病を研究することは、アルツハイマー病の発症に新たな洞察をもたらし、酵素機能の変化を部分的に補ってアルツハイマー病を遅延させたり、病気によって引き起こされる苦痛の一部を軽減したりすることができる食事性代謝物サプリメントの発見につながるかもしれない。
1. 序論
現在、世界では約2,400万人のアルツハイマー病の症例があり、心臓病や癌などの他の疾患のより良い治療法が人間の平均寿命を延ばすのに伴い、その数は少なくとも今後数十年は増加し続けると予想されている[1]。人間の苦痛に加えて、アルツハイマー病やその他の認知症は 2010年には米国で約1720億ドルの費用がかかっている[2]。これまでの研究の大部分は、アルツハイマー病の発症におけるアミロイドβタンパク質凝集の役割を強調するアミロイドカスケード仮説に焦点を当ててきた。しかし、増大する証拠は、アミロイドカスケード仮説がアルツハイマー病の複雑な症状をカプセル化していないことを示唆している[3]。アミロイドカスケード仮説の20年間の研究では、1990年代初頭に予測された治療法は得られていない。アミロイド斑に加えて、アルツハイマー病脳の他の主要な組織学的特徴は、タウタンパク質の高リン酸化と凝集から生じる神経原線維のもつれの病理学である[3]。タウをベースとした治療法は、アミロイドをベースとした治療法よりも臨床試験でうまくいかない可能性がある。もう一つの有望な選択肢は、アルツハイマー病を代謝性疾患として捉え、その病因を明らかにすることである。この点では、アルツハイマー病の脳の神経細胞はグルコース代謝に大きな欠損を示すことが知られており、代替エネルギー源はアルツハイマー病に特徴的な神経細胞の死を防ぐのに役立つかもしれない。代謝障害としてのアルツハイマー病を治療することは、代謝産物や酵素補酵素の食事補充の研究をさらに進めることにつながる。そのような戦略の 1 つは、アルツハイマー病 脳で枯渇している要因を補充することであるが、別の戦略は、ニューロンのためのエネルギーを提供するために酸化することができる代謝物を補充することである。ニューロンは脂肪酸のβ酸化のための酵素を欠いているが、他の可能性のあるニューロンのエネルギー源は、アミノ酸、ケトン体、クエン酸サイクルの中間体、ピルビン酸、および乳酸を含む。最近のメタボロミクス調査の多くは、アルツハイマー病の脳と血漿中のいくつかのアミノ酸のレベルで大きな変化を示しているので、アミノ酸代謝の変化がアルツハイマー病の進行の原動力であるかどうかを検討することが重要である。
タンパク質の形をしたアミノ酸は、人間の食事の大部分を占めている。タンパク質の1日の推奨摂取量は、体重1キログラムあたり0.8グラム[4]であり、平均的な成人では1日あたり約71グラムのタンパク質に相当する。このようにタンパク質の消費量が多いため、アミノ酸はタンパク質合成のための構成要素としての必要量をはるかに超えるレベルで存在し、消費されたタンパク質の大部分はエネルギー生成のために分解されることになる。エネルギー生成のためにこれらのアミノ酸を処理するには、窒素廃棄物、尿素サイクルによって肝臓と小腸で主に行われるプロセスの処分を必要とする。アミノ酸と窒素の代謝の乱れは、神経学的欠陥と関連しており、いくつかのケースでは認知症[5-9]。アミノ酸使用のこれらの主要な経路に加えて、アミノ酸およびその代謝誘導体は、細胞のシグナル伝達および多くの多様な代謝経路に、より少ない範囲で関与している。
2. アルツハイマー病脳におけるアミノ酸代謝
多くの研究で、アルツハイマー病患者やADモデルマウスの血清や脳のアミノ酸レベルの変化が示されているが、これらの変化が疾患発症に寄与しているかどうかはまだわかっていない。グルタミン酸は興奮性の神経伝達物質であり、その代謝物の一つであるγ-アミノ酪酸(GABA)は抑制性の神経伝達物質であるため[9]、アルツハイマー病脳におけるグルタミン酸代謝の変化は神経機能に大きな影響を与える可能性がある。GABA はまた、アストロサイトのアルギニンから合成することができるし、この経路を介して合成された増加した GABA のレベルは、アルツハイマー病 マウス モデル [31] で認知機能障害の役割を果たすことが示されている。アミノ酸代謝に関与する酵素のレベルの変化はまた、アルツハイマー病脳で観察されている[32]、さらにアルツハイマー病発症における代謝異常のための役割を示唆している。例えば、グルタミン合成酵素と尿素サイクル酵素および中間体のレベルの変化がアルツハイマー病脳で観察されている。これは、適切に脳からクリアされていない場合、アミノ酸の異化からアンモニアの形で窒素廃棄物が神経細胞に悪影響を与えるため、懸念されている。
健康な個人は、消費された過剰なアミノ酸を他の有用な代謝物に処理したり、エネルギー生産のためにそれらを酸化することができる。それらを燃料として使用するために、炭素骨格はクエン酸サイクルで酸化されて二酸化炭素を生成し、余分な窒素は比較的毒性のない窒素廃棄物である尿素として廃棄される。しかし、ニューロンが効率的にグルコースを異化することができないとき、そのようなアルツハイマー病中のように、彼らはエネルギー生産のためのアミノ酸の酸化に依存するようになる可能性がある。神経細胞のアミノ酸が枯渇したり、アミノ酸を代謝する機械が異常をきたしたりすると、神経細胞が死滅し、病気の進行を促進することがある。しかし、たとえアミノ酸の酸化が神経細胞のエネルギーレベルを維持できたとしても、アンモニアの解毒に必要な尿素サイクルの酵素はすべて神経細胞やグリアには存在しないため、アミノ酸の異化の際に放出されるアンモニアの量が増加すると、神経細胞の死につながる可能性がある。その代わりに、アストロサイトは、アンモニアをグルタミンに分解するグルタミン合成酵素を高レベルで発現しており、これが脳から放出される。神経細胞ではグルタミン合成酵素の発現が40倍も低いため、過剰なアンモニアを無害化する機能がない。
3. コントロール、MCI、およびアルツハイマー病集団におけるアミノ酸レベルの変化
軽度認知障害(MCI)患者におけるアミノ酸の変化を同定することは、これらの変化が アルツハイマー病 の発症につながる上流の変化である可能性があり、アルツハイマー病 の間に起こる下流の変化は MCI の間に起こった傷害に体が適応した結果である可能性があるため、重要である。ある報告では、MCI、アルツハイマー病 患者、または健常者の年齢をマッチさせた対照者の脳脊髄液(脳脊髄液)を対象にメタボロミクス解析が行われた。その結果、代謝産物であるジメチルアルギニン、アルギニン、バリン、プロリン、セリン、ヒスチジン、コリン、クレアチン、カルニチン、およびサブエリルグリシンが疾患進行バイオマーカーの可能性があることが示された [33]。アルツハイマー病の潜在的な脳脊髄液バイオマーカーを研究している別のグループは、メチオニン、トリプトファン、チロシン、プリン代謝経路の変化がMCIとアルツハイマー病の両方の被験者で起こったと結論づけた。メチオニンのレベルはMCIで増加したが、トリプトファンのレベルは減少した [34]。トリペプチドであるグルタチオンのレベルもアルツハイマー病では低下した。ある研究では、アルツハイマー病 被験者からの 脳脊髄液 のシステイン レベルの増加を発見した [28]、別の 1 つは対照群と比較して MCI と アルツハイマー病 被験者の両方からの血漿中のトリプトファンとフェニルアラニン レベルの変更を識別しながら;トリプトファン レベルも MCI と アルツハイマー病 被験者を比較するときに区別された [35]。血漿のさらなるメタボロミクス研究は、MCIとアルツハイマー病被験者[36]で変更されたアルギニン代謝とポリアミン代謝を発見した。別の研究では、グリシンとバリンのレベルが アルツハイマー病 血漿 [37] で変化していることがわかったが、著者らは、血漿アミノ酸レベルが献血前に被験者が行った絶食の量に応じて大きな変動を示すこと [38] と、リン脂質がより信頼性の高い血漿バイオマーカーである可能性があることを警告している。
コントロール、MCI、および アルツハイマー病 被験者からの血漿と 脳脊髄液 の両方の包括的なメタボロミクス研究では、トリプトファンとアルギニン代謝が MCI 被験者からの 脳脊髄液 と血漿の両方で変化していることがわかった [39]。リジン代謝は、MCI 被験者の血漿では減少しなかったが、脳脊髄液では減少していた。この研究では、MCI被験者の脳脊髄液中のメチオニン濃度の上昇も認められた。メチオニン、ヒスチジン、リジンレベルはアルツハイマー病血漿中で増加した。アルツハイマー病の脳脊髄液と血漿の両方で影響を受ける経路は、β-アラニン、アスパラギン酸とアスパラギン、アラニン、システイン、メチオニン、メチオニン-システイン-グルタミン酸、アルギニンとリジンの代謝が含まれてた。フェニルアラニン、リジン、およびロイシンは、MCI 被験者と対照者を識別するために使用できる血漿中の 6 つの代謝物のうちの 3 つであった [39]。唾液メタボローム解析では、タウリンとSer-Ser、Phe-Pro、およびArg-Leuを含むいくつかのジペプチドがMCI患者ではその量が減少していることがわかった[40]。これらの結果をまとめると、MCIおよびアルツハイマー病患者のアミノ酸代謝には多くの変化があることがわかるが、使用された方法論や装置が異なるためか、結果は研究ごとに非常に一貫性がない。
4. クラス別の選択アミノ酸の概要
MCIとアルツハイマー病の被験者では、いくつかのアミノ酸は豊富に増加したが、ほとんどのアミノ酸は、特に脳では、神経細胞のエネルギー源としての酸化と一致して、豊富に減少した。この情報は、表1にまとめられている。特定のアミノ酸の代謝の変化が神経原性につながる可能性のあるいくつかの可能なメカニズムが以下に詳細に記載されている。
表1 アルツハイマー病における遊離アミノ酸量の変化
表1
アルツハイマー病における遊離アミノ酸の存在量の変化。
| アミノ酸 | 測定された組織または体液 | ADの増加または減少 | 興味がある点 | 追加の効果 | DataWarriorドラッグスコア∗ |
|---|---|---|---|---|---|
| ロイシン | 強力なmTORアクティベーター[ 10 ]; αケト酸代謝産物は、代謝機能不全につながった[ 10 – 12 ] | 代謝物はラットニューロンのミトコンドリア機能障害を引き起こしました[ 12 ]。BCAAはオスのマウスの平均寿命を延ばしました[ 13 ] | 0.592 | ||
| バリン | プラズマ[ 14 ] | 減少[ 14 ] | mTORアクティベーター[ 10 ]; α-ケト酸代謝物は酸化ストレスを引き起こしました[ 10 ] | BCAA強化食はオスのマウスの平均寿命を延ばしました[ 13 ] | 0.559 |
| イソロイシン | mTORアクティベーター[ 10 ]; α-ケト酸代謝物は酸化ストレスを引き起こしました[ 10 ] | BCAA強化食はオスのマウスの平均寿命を延ばしました[ 13 ] | 0.684 | ||
| フェニルアラニン | 血清[ 14 ]; 脳[ 15、16 ] |
減少[ 14 ]; 増加[ 15、16 ] |
チロシンの非存在下で代謝される[ 17 ] | 0.579 | |
| トリプトファン | 血清[ 14 ]; 脳[ 15 ] |
減少[ 14 ]; 増加[ 15 ] |
代謝物は代謝機能障害を引き起こします[ 18 ] | 代謝物は細胞培養で一酸化窒素シンテターゼを増加させます[ 19 ] | 0.661 |
| チロシン | 血清[ 14 ] | 減少[ 14 ] | レベルの低下はカテコールアミンの生産を混乱させる可能性があります | 人間の記憶力と認知機能の改善[ 20 ] | 0.584 |
| グルタミン | 血清[ 21 ]; 脳[ 22 ] |
減少[ 21 ]; 増加[ 22 ] |
0.573 | ||
| アスパラギン酸 | 脳[ 15、22 ]。 血清[ 14 ] |
低下[ 14、15、22 ] | 0.593 | ||
| グルタミン酸 | 血清[ 23 ]; 脳[ 15、22 ] |
増やす[ 15 ]; 低下[ 22、23 ] |
神経細胞死に興奮毒性リード[ 24、25 ] | 0.531 | |
| リジン | 脳[ 15 ] | 減少[ 15 ] | 0.499 | ||
| ヒスチジン | 血清[ 14 ] | 減少[ 14 ] | 0.835 | ||
| システイン | 血清[ 26、27 ]。 脳[ 15、26 ]。 CSF [ 28 ] |
減少[ 26 ]; 増加[ 15、27、28 ] |
グルタチオン合成に関与します。mTOR阻害剤 | ラットにおけるmTOR活性の低下[ 29 ] | 0.493 |
| メチオニン | 血清[ 27 ] | 減少[ 27 ] | mTORアクティベーター | マウスにおけるアミロイドベータおよびp-タウの増加[ 30 ] | 0.578 |
∗DataWarriorソフトウェアを用いて、pH7.4における最も一般的な電荷状態を用いて構造を描画した。ドラッグスコアの値が高いほど、優れた薬剤候補であることを示している。
4.1. 分岐鎖アミノ酸、mTOR、アルツハイマー病
分岐鎖アミノ酸(BCAA)にはロイシン、バリン、イソロイシンなどがある。BCAAは芳香族アミノ酸のフェニルアラニン、チロシン、トリプトファンと競合して脳内に侵入する。したがって、血漿中のBCAAレベルを変化させると、脳内の神経伝達物質であるセロトニン、ドーパミン、エピネフーリン、ノルエピネフーリンのレベルに影響を与える可能性がある[41]。ファーストパスの肝代謝で大きく代謝されるほとんどのアミノ酸とは異なり、BCAAはそこでは大きく代謝されないため、血中濃度はしばしば食事摂取量を直接反映している。タンパク質制限は、ADマウスモデルでタウの高リン酸化を減少させ、認知力を高めることが示されている[42]。BCAA制限食は、タンパク質制限食と同様の方法で末梢グルコースおよびインスリンレベルに保護的な代謝効果を誘導することが示されている[43]。しかし、タンパク質制限の神経保護効果がBCAAレベルの低下によって媒介されるかどうかは、メチオニンなどの他のアミノ酸の制限も代謝保護効果をもたらす可能性があるため、まだ明らかにされていない[44]。
一部の研究者は、BCAAレベルの上昇とアルツハイマー病発症との関連を疑っている[45]。ラットの栄養補助食品を介してBCAAのレベルを増加させると、海馬[46]、記憶形成に関与し、アルツハイマー病患者の広範な神経細胞の損失を受けることが知られている脳の一部である海馬の神経成長因子(NGF)の減少につながった。ロイシン代謝物であるα-ケトイソカプロン酸の投与もまた、NGFと脳由来神経栄養因子(BDNF)を減少させた[11]。しかし、アルツハイマー病におけるBCAAの役割は明確ではない。BCAAsの一つであるバリンのレベルは、アルツハイマー病患者の血漿中で低下していることが明らかになっている[14]。さらに、BCAAsのレベルの増加を、筋肉タンパク質合成の増加[47]、ミトコンドリアの生合成[13]、およびmTORシグナル伝達[48]などの健康増加の指標にリンクするいくつかの研究がある。アルツハイマー病におけるmTORシグナル伝達の有益な役割は、インスリンシグナル伝達が神経保護[49,50]であり、インスリンはPI3K[51,52]を介してmTORキナーゼを活性化することができるという事実に起因して仮説が立てられている。例えば、mTOR活性化の増加は、5x家族性ADマウスモデルの脳におけるアミロイドβ病理の減少と関連していた[53]。しかし、これらの効果は特定のモデルやmTOR活性化の時間の長さに関係している可能性がある。短期的には、mTORの活性化はインスリン分泌の改善につながる[54]が、慢性的なmTORC1の活性化は膵臓のβ細胞を枯渇させ[55]、神経保護インスリンのレベルを低下させる可能性がある。
神経保護的であるmTORの知見とはやや対照的に、増加したmTOR活性化が頻繁にADモデルマウス[56]とヒトアルツハイマー病患者[57]の脳で発見されているという知見である。アミロイドβレベルの増加はmTOR活性化の増加につながり、これはタンパク質の翻訳を増加させてタウタンパク質のレベルを増加させ、病理学的にアルツハイマー病ニューロンに見られる神経原線維のもつれの主成分である[58]。mTOR活性化によって誘導された翻訳速度の増加は、アルツハイマー病脳で測定されたアミノ酸レベルの低下に部分的に責任があるかもしれない。mTOR活性の増加はまた、ミトコンドリアの電子輸送鎖活性を刺激することができる[59]が、おそらくアミノ酸のミトコンドリアの異化を増加させることにつながる。mTOR活性の増加はまた、オートファジーの速度を低下させ、有毒なアミロイドβペプチドの蓄積につながる。これらの知見と一致するように、PDAPPまたは3xTg-ADマウスをmTOR阻害剤であるラパマイシンで治療すると、アミロイドベータおよびタウのレベルが低下し、認知機能が回復した[60, 61]。これらのデータは、強力なmTOR活性化因子であるロイシンとアルギニンの低タンパク質レベルまたは低レベルの食事がアルツハイマー病患者にとって有益であることを示唆している[62]が、3つのBCAAすべてのレベルを一緒に減少させることは、マウスの末梢代謝を向上させる上でロイシンレベルのみを減少させるよりもより強力であった[43]。
ADモデルシステムにおけるラパマイシン治療によるmTOR阻害の保護効果の一部は翻訳速度の低下に起因するので、脳内の翻訳速度を低下させる他の治療法も治療的であるかもしれない。このことを念頭に置いて、減少したまたは不均衡なアミノ酸レベルはまた、一般的な制御nonderepressible 2-(GCN2-) eIF2αキナーゼ経路を介して翻訳速度を減少させることが示されている。GCN2キナーゼは、未充電のtRNAを感知し、翻訳開始因子eIF2αをリン酸化して翻訳速度を低下させる。上述したように、多くのアミノ酸、例えばBCAAsおよび芳香族アミノ酸は、血液脳関門を横切る輸送のために同じアミノ酸トランスポーターを共有している。したがって、ある特定のアミノ酸の高レベルのサプリメントは、他のアミノ酸の脳内への輸送速度を低下させて、そのレベルを低下させる可能性がある。これは、GCN2を活性化し、mTORを阻害し、グローバルな翻訳速度を低下させ、アルツハイマー病脳を保護するためにオートファジーを増加させるために、脳内の不均衡なアミノ酸レベルを作成することができる。すべてのmRNA転写物がアミノ酸制限下で翻訳の低下を示すわけではない。ATF4のようないくつかの転写産物は、保護的代償応答を媒介するために翻訳の増加を示す。ATF4はERストレス応答に関与する転写因子であり、マウスの寿命を延長する5つの条件の間に肝臓でアップレギュレートされることが示されている[63]。
BCAAsと代謝性疾患との関連には、2つの有力な仮説がある[10]。第一に、BCAAs、特にロイシンのレベルの上昇は、mTORC1の持続的な活性化に直接つながる可能性がある。第二に、BCAAの異化の亢進は、代謝機能障害につながるBCAA代謝物の増加につながる可能性がある。例えば、ロイシンのα-ケト酸異化産物であるα-ケトイソカプロン酸をラットの神経細胞に添加すると、ミトコンドリアの機能不全を引き起こした[12]。BCAAレベルと疾患との間の相関関係を見出そうとした研究の相反する結果は、代謝におけるBCAAレベルの複雑な役割を示唆しており、モデル生物、疾患状態、およびBCAAおよびBCAA異化産物レベルが上昇した時間の長さに依存して変化する可能性がある。
いくつかの研究では、死後のアルツハイマー病脳で具体的にBCAAsのレベルを調べたが、それは特定のBCAAsを増加させることは、特定のモデルシステムで脳を老化させるために有益である可能性があることが表示される。BCAAsを多く含む食事は、オスマウスの平均寿命を増加させることも示されている[13]。アルツハイマー病におけるBCAAsの役割への研究は、完全には程遠い。例えば、アルツハイマー病患者や動物モデルでのイソロイシンやバリンの補充の効果の研究はほとんどなかった。イソロイシンとバリンはロイシン[64]として強力にmTOR活性を刺激しないので、神経毒性のあるα-ケトイソカプロン酸に分解されていないので、これらのアミノ酸のサプリメントは、潜在的に病原性のあるシグナル伝達経路を活性化することなく、脳のためのエネルギーを提供することができる。BCAAs、mTORシグナル伝達、老化、神経変性の間のリンクを考えると、さらなる研究は、おそらくこれらの複雑な相互作用を明らかにするだろう。さらに、インスリン抵抗性患者における BCAAs と同じ相関関係の多くが芳香族アミノ酸でも観察されており、代謝と疾患におけるアミノ酸のこれらのクラスの両方の相補的な役割が強調されている[65]。
4.2. 芳香族アミノ酸
いくつかの研究では、芳香族アミノ酸のレベルがアルツハイマー病の血清または脳で変化することがわかっている。ある研究グループは、アルツハイマー病患者の血清中の3つの芳香族アミノ酸のすべての減少を発見した[14]が、他の研究グループは、アルツハイマー病患者の脳内のフェニルアラニンとトリプトファンの両方の増加を報告している間[15]。ADモデルラットを用いた研究者は、脳の異なる領域でフェニルアラニンの増加を発見した[16]。
脳では、トリプトファンは2つの異なる代謝運命を持っている:それはセロトニンに代謝されるか、またはそれがα-アミノ-β-カルボキシムコン-ε-セミアルデヒド(ACMS)に分解されるキヌレニン経路(KP)に入ることができ、NAD合成のためのキノリン酸に、またはTCAサイクルへのエントリのための2-アミノムコン酸のいずれかに代謝されることができる。セロトニンは学習と認知に役割を果たしているが[66]、KPに関与する酵素はアルツハイマー病ではアップレギュレートされている[18]。キノリン酸(QUIN)やKP経路の他の代謝中間体が脳に酸化的損傷を引き起こすという証拠がある[18]。QUINの増加は、ラット脳のシナプトソームにおける活性酸素レベルの濃度依存的な増加と海馬における脂質過酸化をもたらした[67]。また、QUINは一酸化窒素合成酵素活性を3倍以上に増加させることも示されている[19]。この酵素は、血管弛緩作用のあるフリーラジカルである一酸化窒素を産生する。アミロイドβ産生はQUINの濃度を増加させ[68]、アルツハイマー病をアミノ酸代謝物からの酸化的損傷により直接的にリンクさせた。さらに、トリプトファン分解のKP経路へのシフトは、セロトニン合成経路からトリプトファンを発散させる。これはアルツハイマー病脳からセロトニンを奪い、アルツハイマー病の発症に寄与する可能性がある。しかし、アルツハイマー病脳における芳香族アミノ酸の代謝やシグナル伝達に関する知見はまだ完全ではない。食事によるトリプトファン制限はげっ歯類の寿命を延ばすことが示されているが[69]、そのメカニズムは研究されていない。急性のトリプトファン枯渇は、ヒトでは記憶障害をもたらす[70]。
アミノ酸チロシンはカテコールアミンを合成するために重要であるが、いくつかの研究ではチロシンの経口投与が記憶と認知機能を改善することが発見されているが、アルツハイマー病脳内のチロシンレベルを特異的に測定する研究はわずかである[20]。フェニルアラニンはチロシンと同じ代謝経路を介して代謝され得るが、チロシンレベルが低い場合にのみ [17]、チロシンレベルの変化が同様に測定されるまでは、アルツハイマー病脳におけるフェニルアラニンレベルの変化に関する確固たる結論を妨げている。クラスとして、芳香族アミノ酸代謝は神経機能にとって特に重要であり、アルツハイマー病で起こる変化の関連性を解明するためには、より多くの研究が必要である。
4.3. 荷電アミノ酸
荷電アミノ酸は、酸性(アスパラギン酸とグルタミン酸)と塩基性(アルギニン、リジン、ヒスチジン)アミノ酸が含まれている。これらのそれぞれは、変化の方向がアッセイした脳の領域に依存する可能性があるグルタミン酸の可能な例外を除いて、アルツハイマー病患者の脳または血漿中に減少しているように見える。グルタミン酸 [23]、ヒスチジン、およびアスパラギン酸レベルは、アルツハイマー病患者からの血清中に減少した [14]一方、アスパラギン酸およびグルタミン酸レベルは、アルツハイマー病患者の大脳皮質の側頭葉で減少した [22]。Xuらは、グルタミン酸レベルが増加している間、剖検したアルツハイマー病患者の脳内のリジンとアスパラギン酸の両方のレベルの減少を測定した[15]。NMDA受容体とグルタミン酸の相互作用は学習と記憶形成に重要である[9]が、グルタミン酸の興奮毒性はアルツハイマー病における神経細胞死につながる[24, 25]。後述するように、アスパラギン酸およびグルタミン酸もまた、尿素サイクルの上流で起こるようなトランスアミノ化反応において役割を果たす。しかし、アミノ酸レベルの変化の原因、これらの変化とグルコース代謝の低下との関係、およびこれらの変化が脳に及ぼす影響を決定するためには、より多くの研究が必要である。アミノ酸代謝に関与するより多くの酵素の活性を調べ、アミノ酸代謝のモデルを構築することは、アルツハイマー病脳におけるアミノ酸レベルの変化を説明するのに役立つ可能性がある。
4.4. グルタミン
グルタミンは血漿中に最も多く存在するアミノ酸であり、グルタミンとグルタミン酸はヒトの脳内で最も多く存在するアミノ酸である[71]。グルタミンの補充は、タウのリン酸化を減少させ、そのようなアルツハイマー病 [72]のマウスモデルで炎症を減少させるなど、他の保護効果を示している。いくつかの神経細胞集団におけるグルタミン合成酵素の代償的な増加発現を引き起こすアルツハイマー病患者の脳のグルタミンレベルの低下。それは、グルタミン、グルタミン酸、アスパラギン酸、アラニン、プリン体は、グルコース代謝が乱されたときにそのようなアルツハイマー病などの神経変性疾患のトップ代替エネルギー源として可能性が高い分解されていることが判明した[73]。アラニン、アスパラギン酸、およびグルタミン酸の異化の最初のステップのためのアミノトランスフェラーゼの高レベルが脳に存在するため、これらのアミノ酸は容易に分解される[71]。アルツハイマー病患者の1つの研究では、グルタミンのレベルは血清中で低下することが発見された[21]が、脳の側頭皮質で増加した[22]。グルタミンとアラニンのレベルはまた、一過性のグローバル健忘症を持つ患者の血中で減少することが発見されている[74]。
神経細胞のアミノ酸異化の時期に脳がどのようにしてアミノ酸と全窒素レベルのバランスを維持しているかについては、あまり多くのデータが得られていないが、BCAAが血液脳関門(BBB)を介して取り込まれ、グルタミン酸が放出されて窒素バランスを維持している可能性がある[75]。BCAA由来の炭素は、その後、クエン酸サイクルに送り込まれてα-ケトグルタル酸を形成し、その後、α-ケトグルタル酸はグルタミン酸にトランスアミノ化されてグルタミン酸レベルを維持することができる。脳内のアンモニアレベルがゆっくりと上昇する時期には、取り込まれたBCAA(または単一の窒素原子を含む別のアミノ酸)ごとに脳からグルタミン(2つの窒素原子を含む)を排出することで、脳内のアンモニアレベルを低下させるための窒素の純排出が可能になる[71]。しかし、窒素の除去のこのメカニズムは、脳症を引き起こすことが知られている脳アンモニアの大きな増加に対処するのに十分に堅牢ではない可能性が高い。
4.5. 硫黄含有アミノ酸
含硫アミノ酸はシステインとメチオニンである。システインのレベルが体内で最も重要な抗酸化物質の1つであるグルタチオンの合成を制限するため、多くの研究がシステインとより膜透過性の高い形態のN-アセチルシステイン(NAC)の補充で行われてきた。システインとNACは血液脳関門をゆっくりと通過するため、脳のグルタチオンレベルを高めるための他の治療法が開発中である [76]。アルツハイマー病患者へのNAC補充の3つの小規模臨床試験が行われているが、結果はまちまちである[77]。したがって、アルツハイマー病に対するNACの効果を明らかにするために、より多くの研究が必要である。アルツハイマー病患者では、血清および脳のホモシステインレベルが上昇すると、硫黄含有アミノ酸代謝に混乱があるようである[26]。システインレベルはまた、剖検されたアルツハイマー病患者の海馬で増加することが示された[15]。ホモシステイン-システインジスルフィドレベルは、メチオニンレベルが減少している間に、アルツハイマー病患者の血清中で増加することが判明した[27]。血漿中のホモシステイン濃度の上昇は、アルツハイマー病やその他の認知症の危険因子として知られている[78]。食事中のメチオニン補給は、野生型マウスの脳と認知機能障害におけるアミロイドベータとリン酸化タウレベルの増加を引き起こした[30]。食事メチオニン制限は、APP-PS1 ADマウス[79]とミトコンドリア複合体I介在性スーパーオキシド産生を減少させ、ラット[80]の寿命を増加させ、システイン補給はmTOR活性[29]のわずかな減少をもたらしたが、アミロイドベータレベルと神経保護を減少させた。しかし、システイン補給は、メチオニン制限動物における活性酸素産生の減少を阻止した。
5. アルツハイマー病ニューロンにおけるエネルギー源としてのアミノ酸
アルツハイマー病 の特徴の一つは、エネルギー代謝の機能不全である。アルツハイマー病脳で生成されるミトコンドリア由来の酸素フリーラジカルは、エノラーゼ[81]やグリセルアルデヒド-3-リン酸デヒドロゲナーゼ[82]などの解糖酵素を損傷し、解糖を遅らせることが知られている。この損傷は、アルツハイマー病脳におけるインスリンシグナル伝達の低下と組み合わされて[83]、結果として、フルオロデオキシグルコース(FDG)-PETスキャンの使用を通じてアルツハイマー病進行の初期イベントとして確認されているグルコースの取り込みと代謝の低下をもたらする[84]。ブドウ糖代謝の低下は、アミロイドβ媒介性ミトコンドリア複合体IV阻害[85]とタウ媒介性ミトコンドリア複合体I阻害[86]と組み合わされたピルビン酸産生の低下につながり、ミトコンドリアのエネルギー代謝とATPレベルの低下につながる。体内のほとんどの細胞は代謝の柔軟性を示し、解糖出力が低下したときに細胞のATPレベルを維持するためにミトコンドリア脂肪酸β酸化を増加させることができる。神経細胞は、脂肪酸β酸化酵素[87]の非常に低いレベルが含まれているので、彼らは代わりに細胞のATPレベルを維持するためにアストロサイト[88]から放出された乳酸のケトン体の異化、アミノ酸の異化、または異化に依存している。ケトン体のレベルは通常、よく食べたと運動していないヒトの体で非常に低いです[89]。したがって、アミノ酸の異化は、乳酸代謝と限られたグルコース代謝と一緒に、おそらくアルツハイマー病ニューロンの細胞ATPレベルを維持する上で不可欠な役割を果たしている。この仮説を支持するデータは、剖検された早期発症家族性アルツハイマー病の脳におけるグルコース利用の44%の減少を示す臨床研究から来ている。驚くべきことに、アルツハイマー病の脳は、遊離アミノ酸(およびおそらく乳酸)がグルコースの代わりにエネルギー生成のために酸化され、アミノ酸レベルの低下につながるため、酸素利用の不足を示さなかった[90]。脳のアミノ酸レベルが枯渇すると、脳のアンモニアレベルも同様に低下した。これらのデータは、アミノ酸の補充や高タンパク食がアルツハイマー病脳を元気にするのに役立つかもしれないことを示している。
次の最も豊富なアミノ酸は、アスパラギン酸とタウリンでありながら、潜在的なエネルギー源として人間の脳に存在する最も豊富なアミノ酸は、約7-8 mMで存在するグルタミン酸とグルタミンであり、約1.2 mMで存在し、その後セリン、GABA、および約0.5 mMで存在しているグリシン[71]。脳には、グルタミン酸がニューロンによってシナプスの裂け目に放出されるグルタミン酸-グルタミンサイクルがある;グルタミン酸はその後、一部がエネルギーのために分解されるアストロサイトによって取り込まれるが、大部分はグルタミンに変換され、アストロサイトから輸出され、ニューロンによって再び取り込まれ、グルタミン酸に変換される。このサイクルを促進するために、ニューロンは2つのグルタミナーゼ遺伝子、GLS1とGLS2(リン酸で活性化されたミトコンドリア・グルタミナーゼ)を高レベルで保有しており、グルタミンからグルタミン酸への分解、つまりアンモニアを放出するプロセスで機能しているが、少量のグルタミナーゼ(ほとんどがGLS1)もアストロサイトに局在している[91]。GLS2活性はADP[92]によって強くアップレギュレートされており、特にアルツハイマー病脳では加齢とともに低下することが示されている[93]。
グルタミン酸がグルタミン酸脱水素酵素によってα-ケトグルタル酸に異化される場合、脳内のアンモニアのさらなる放出が起こりうる。正常な哺乳類のグルタミン酸脱水素酵素遺伝子GLUD1に加えて、霊長類はアストロサイトで発現する第2のグルタミン酸脱水素酵素遺伝子GLUD2を持っており、高いグルタミン合成酵素活性の存在下でα-ケトグルタル酸レベルを維持するためにそれらの細胞で必要とされるかもしれない[95]。グルタミン合成酵素活性は、タンパク質レベルは前頭前野と脳脊髄液で増加することが示されているが、酸化的不活性化を介して可能性の高いアルツハイマー病脳で低下することが示されている[96]。GLUD2はグアニンヌクレオチドの影響を比較的受けないが、ADPと分岐鎖アミノ酸[97]によって正に制御されている間、ミトコンドリアGLUD1は、クエン酸サイクル機能から形成されたGTPによってネガティブに制御されている。エネルギーレベルが高いときのGLUD1の負の調節は、神経伝達に必要なグルタミン酸レベルの維持を可能にするだけでなく、アンモニアの有毒な蓄積を防ぐことができる。グルタミン酸はまた、対応するケト酸が適切な量で存在する場合には、アラニン、アスパラギン酸、分岐鎖アミノ基転移酵素[98]の機能を介して、遊離アンモニアを放出することなく、クエン酸サイクルの代謝を促進するためにα-ケトグルタル酸に代謝される。
通常、ニューロンとアストロサイトの両方は、ATP収量を最大化するために、解糖によってグルコースを酸化し、酸化的リン酸化によって結果として生じるピルビン酸を酸化する[99]。しかし、アストロサイトはニューロンよりもエネルギー需要がわずかに低いため、代謝的に柔軟であることを示す多くの証拠がある [100]。したがって、アストロサイトは、酸化的代謝をほとんど行わずに、主に解糖によって生き延びることができる。アルツハイマー病のような代謝的にストレスの多い時期には、アストロサイトは、細胞の酸化還元状態を維持するために解糖から生成されたピルビン酸を乳酸に変換し、その後、細胞から乳酸をエクスポートすることがある。乳酸は、その後、ニューロンによって取り込まれ、再びピルビン酸に変換され、酸化的エネルギー代謝に使用され、アストロサイト-ニューロン乳酸シャトル[101]と呼ばれるプロセス。アストロサイトはまた、神経細胞の解糖が障害されている病態下では、エネルギー源として利用するために、ニューロンに放出されるグルタミンの量を増加させることができるかもしれない。アストロサイトは脂肪酸β酸化の能力を持っている[87]が、これはおそらくこれらの病理学的条件の間により重要になる。
ADマウスを使用した研究では、高タンパク質/低炭水化物食は、記憶[102]のために重要である海馬のCA3領域のニューロン密度と体積の減少を含む、ADマウスの脳重量の5%の減少をもたらしたことを発見した。高タンパク質/低炭水化物食もまた、高齢化した脳における興奮毒性の増加と関連している[103]。これらのデータは、高レベルのアミノ酸またはその異化産物が神経変性に寄与している可能性を示唆している。この評価と一致するように、ミトコンドリア内の分岐鎖ケト酸脱水素酵素(BCKDH)による分岐鎖ケト酸の異化は、ダメージを与えるスーパーオキシドラジカルの実質的な産生をもたらす[104]。さらに、低タンパク質/高炭水化物食のマウスは、高タンパク質/低炭水化物食のマウスよりも長生きし、インスリンレベルが低下し、mTOR活性化が低下していた[105]。しかし、低タンパク質/高炭水化物食の健康効果は中年期までしか続かない可能性があり、高齢のマウスや高タンパク質食を摂取した高齢者の被験者は病気からの保護を示した[106]。したがって、アミノ酸サプリメント療法は、最高の晩期発症アルツハイマー病の治療法として探索されるかもしれない。マウスの3つの分岐鎖アミノ酸の血漿中濃度はすべて食事タンパク質摂取量と正の相関を示したが、他のほとんどのアミノ酸の血漿中濃度は食事タンパク質摂取量と負の相関を示した。したがって、若年者および中年者のマウスにおける低タンパク質食がもたらす健康効果の一部は、血漿中の分岐鎖アミノ酸レベルの低下によって媒介されている可能性があると考えられる。
6. 尿素サイクルとアルツハイマー病
6.1. アミノ酸代謝、アンモニア、尿素サイクル
タンパク質は、遊離アミノ酸とジペプチドにいくつかの異なるペプチダーゼによって胃と腸で消化され、ジペプチドは、さらにファーストパス肝代謝によってアミノ酸に異化されている。これらのアミノ酸は、その後、異化され、肝臓でのグルコジェネシスのための基質として使用されるか、またはアミノ酸がタンパク質合成のために使用されている他の組織への血液によって輸送されるか、またはレベルがその要件を超えるときにアンモニアを生成するプロセスで分解されている。これが起こるためには、アミノ酸のα-アミノ基がα-ケトグルタル酸に移行してグルタミン酸とα-ケト酸を形成し、エネルギー生成のために酸化されることが多い。グルタミン酸は酸化的脱アミノ化を受けてアンモニアとα-ケトグルタル酸を形成したり、アミノ基がオキサロ酢酸に移行してアスパラギン酸とα-ケトグルタル酸を形成したりする。アスパラギン酸は、肝臓では尿素サイクルの機能に必要である。脳と筋肉(通常、かなりの尿素サイクル機能を欠いている組織)ではアスパラギン酸は、フマル酸とアンモニアを放出するためにプリンヌクレオチドサイクルを入力することができる。ヒスチジン、セリン、スレオニン、およびカテコールアミン(チロシン由来)の異化反応は、別個の反応を通じてアンモニアを放出する。アンモニアは毒性があるため、速やかに除去するか、毒性の低い形態に変換する必要がある。末梢組織では、一度アンモニアとグルタミン酸が結合してグルタミン合成酵素の作用によりグルタミンを形成すると、グルタミンは組織から輸出され、血液を介して肝臓に運ばれ、そこでグルタミナーゼ酵素の作用により遊離アンモニアが放出される。尿素サイクルはその後、アンモニアを尿素に変換するために機能し、体内から排泄される。
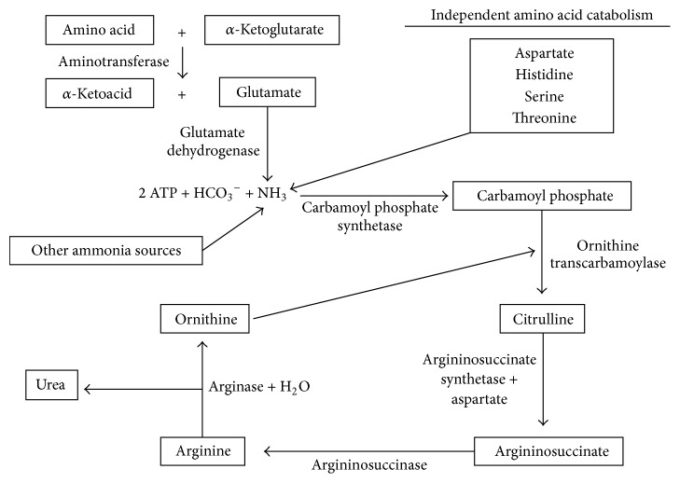
尿素サイクルの第一と第二のステップはミトコンドリアで発生し、他の3つのステップは細胞質で発生する。まず、アンモニアはATPおよびHCO3-と結合してリン酸カルバモイルを形成する。この反応を進行させるためには、N-アセチルグルタミン酸が補酵素として必要である。カルバモイルリン酸はオルニチンと反応してシトルリンを生成し、ミトコンドリアから輸送され、アスパラギン酸と反応してアルギニノスクシネートを形成する。アルギニノスクシネートは、アルギノスクシナーゼによってフマル酸とアルギニンに変換される。最終段階では、アルギナーゼがアルギニンをオルニチンと尿素に変換する。図1は、尿素サイクルに至るまでのアミノ酸の異化過程をまとめたものである。
図1

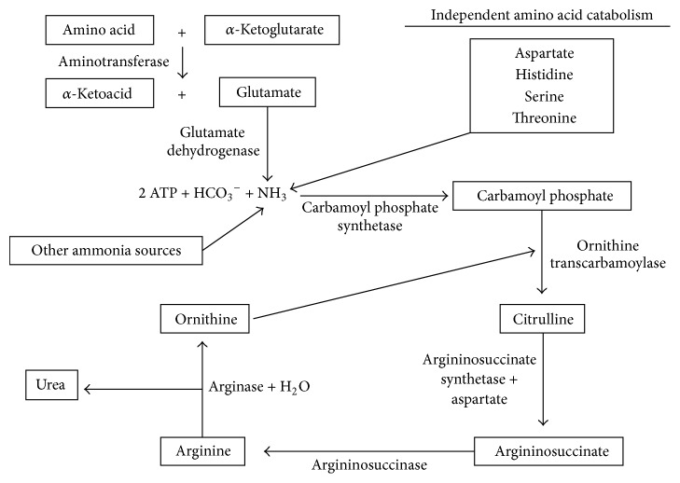
尿素サイクルの概要 アミノ酸の異化作用によって生成されたアンモニアは、尿素サイクルで尿素に変換されて排泄される。図中の代謝中間体は箱に入っており、矢印の横には酵素やその他の必要な基質が存在している。これらの代謝中間体のいくつかのレベルは、アルツハイマー病患者の脳や血漿中で変化している。
6.2. アルツハイマー病における尿素サイクルの構成要素の変化
尿素サイクルの酵素および代謝中間体のレベルはアルツハイマー病患者で変化する。尿素サイクルに必要なすべての酵素は肝臓で発現しており、低レベルの尿素サイクル活性は腎臓と腸でも発生している[107]。正常なヒトの脳は、オルニチントランスカルバモイルラーゼ(OTC)活性が非常に低いか、または全くないため、尿素サイクル活性が妨げられていることが示されている[108]。カルバモイルリン酸合成酵素活性も脳組織では低い。しかし、アルツハイマー病患者の剖検脳を用いた研究では、尿素サイクルのこの排他的な局在性に挑戦している。Hansmannelらは、健常成人とアルツハイマー病患者の両方の脳で尿素サイクルのすべての酵素のmRNA発現を同定した[109]。しかし、OTCのmRNAレベルはアルツハイマー病でない被験者では極めて低く、正常な細胞質の尿素サイクル酵素であるアルギナーゼ1(ARG1)は両集団で極めて低かった。アルギナーゼは、アルツハイマー病では発現が異常になると思われる尿素サイクル酵素の一つであり、よく研究されている。アルギナーゼは、アルギニンを尿素とオルニチンに変換する(図1を参照)。2つのグループ、Luiら[5]とHansmannelら[109]は、剖検したアルツハイマー病患者の脳におけるミトコンドリアアルギナーゼII(ARG2)レベルの増加の同じ傾向を発見した。HansmannelらはRT-PCRを使用して、コントロールと比較して、アルツハイマー病患者のARG2 mRNAレベルの55%の増加を発見した[109]一方で、Luiらはウェスタンブロットを使用して、2つの異なる脳領域におけるARG2タンパク質の総量の増加を示したが、3番目の領域では変化がなかった[5]。
アルツハイマー病脳におけるARG2発現の増加のいくつかの重要な結果がある。まず、増加したアルギナーゼ活性は、おそらくポリアミン合成の前駆体である後者は、尿素とオルニチンレベルを増加させるだろう。ポリアミンは、脳内で重要な神経保護の役割を果たすことができる。第二に、アルギナーゼ活性の増加は、おそらくmTOR活性の低下につながる可能性があるアルギニンレベルを低下させるだろう。アルギニンはまた、神経炎症を増加させる血管弛緩性フリーラジカル一酸化窒素を産生する一酸化窒素合成酵素の基質でもある。そのため、ARG1のトランスジェニックな過剰発現は、タウ過剰発現モデルのアルツハイマー病で神経保護を示した[110]。しかし、アルギナーゼ阻害剤はアミロイドβ産生マウスのADモデルで神経保護効果を示した[111]。したがって、アルギナーゼの発現はアミロイドとタウの病理学的に異なる効果を持つ可能性がある。ARG2はアルツハイマー病脳の主要なアイソフォームであり、内皮細胞で高発現している。したがって、ARG1活性が神経保護的であるのに対し、ARG2活性は異なる細胞タイプまたは異なる細胞下局在での発現により神経毒性を有することも考えられる。
Bensemainらは、RT-PCRを用いてオルニチントランスカルバミラーゼ(OTC)遺伝子の転写を検出し、アルツハイマー病脳内の尿素サイクルの他の酵素も検出した[108]。OTC活性は脳内皮細胞にのみ局在しており、脳脊髄液中の活性は対照群に比べてアルツハイマー病患者では9倍近く高かった[108]。OTC活性がアルツハイマー病患者の脳血管内皮細胞に集中していたことは興味深いことである[108];これらの領域はアミロイドプラークの影響を強く受けている[112]。これらの結果は、尿素サイクルがアルツハイマー病患者の内皮細胞で起こる可能性があることを示しているが、これはARG2によって代謝されるために細胞質からミトコンドリアへのアルギニンの輸送に依存している可能性がある。ミトコンドリアのオルニチンキャリアORC1,ORC2,およびSLC25A29もまた、アルギニンを輸送することができる[113]。ORC1およびORC2は、脳内で非常に低いレベルで発現しているが[114]、これは、アルツハイマー病患者からの内皮細胞における低レベルの尿素サイクル活性を可能にするのに十分であるかもしれない。
おそらく、アルツハイマー病脳における最も顕著な尿素サイクル代謝物の変化は、尿素自体のレベルにある。尿素のレベルの変化の方向は、臨床または病理学的サンプルまたはテストされたマウスモデルに依存する。ヒトアルツハイマー病患者からの血清は、GC/MSを使用してアッセイしたときに尿素レベルの44%の減少を示した[14]。同じグループは、APP/PS1 ADモデルマウスの血清中の尿素の減少を発見した[21]。また、SAMP8 マウスの海馬における尿素の減少も測定されている[115]。SAMP8マウスは、アルツハイマー病で観察されるのと同様の神経変性を示す。尿素レベルの低下は、APP/PS1マウスの脳で見られるアルギナーゼレベルの低下と一致している[30]。ヒトの脳の研究では、著しく異なる結果が示されている。GueliとTaibiによる側頭葉抽出物のGC/MSを用いた研究では、アルツハイマー病患者の脳組織で尿素が2倍以上に増加していることが実証された[22]。Xuらは脳の6つの異なる領域で尿素を測定し、尿素がアルツハイマー病患者の脳で平均5倍以上増加したことを発見した[15]。尿素レベルのこの増加は、ヒトのアルツハイマー病脳で増加したARG2レベルと一致している。興味深いことに、死後のハンチントン病脳の線条体では、尿素が最もダウンレギュレートされた(3.2倍)代謝物であることが判明した[116]が、別の研究では、死後のハンチントン病患者で調査されたすべての脳領域で尿素がアップレギュレートされたという反対の結果が得られた[117]。
オルニチンレベルは、アルツハイマー病の脳と血清で減少した[5,14,15]。オルニチンはアップレギュレートされている酵素(ARG2)の産物であるが、オルニチンはOTC、アルツハイマー病脳内の別のアップレギュレートされた酵素[108]の基質であり、オルニチンはポリアミンの生産のための前駆体であるため、減少は他の知見と一致している。この推論に一貫して、ポリアミンスペルミジンのレベルは、アルツハイマー病脳の側頭皮質で70%増加することが判明した。[118]. シトルリンのレベルは、しかし、アルツハイマー病脳では変化していない[5,119]。シトルリンは強力な抗酸化物質であり、シトルリンの補充は、マウスの海馬の脂質代謝における加齢に伴う変化を防止した[120]。アスパラギン酸はシトルリンと反応してアルギニノサクシネートを形成する。アスパラギン酸のレベルは、アルツハイマー病患者の血清中で減少している[14]と、アスパラギン酸とアルギニンの両方のレベルは、アルツハイマー病患者の脳内で減少している[15,22]。尿素サイクル中間体のレベルの低下は、それらの効率的な代謝を示している可能性がある。様々なグループが、解剖されたアルツハイマー病患者の脳の尿素レベルの増加、および1つ以上の尿素サイクル遺伝子の発現の増加を示していることを考慮すると、現在の証拠は、尿素サイクル活性がアルツハイマー病患者の脳の内皮細胞で誘導される可能性があることを示唆している。神経細胞やグリアで産生されるアルギニンなどの尿素サイクル代謝物が、ARG2レベルが高いアルツハイマー病内皮細胞に取り込まれ、OTCが独占的に存在してそこで尿素サイクルを終了させている可能性がある。内皮細胞のOTC活性から産生されるシトルリンもまた、尿素サイクルを終えるために神経細胞やグリアに輸出される可能性がある。しかし、それはまた、アルツハイマー病脳で見つかったより高い尿素レベルは厳密に完全な尿素サイクル機能とは独立したARG2レベルの増加に起因している可能性がある。
アルツハイマー病脳で増加した尿素レベルは、何がARG2(およびOTC)の発現の増加につながる可能性があるかとしての疑問を提起する。尿素サイクルの主な機能は、体内から除去する前に、アミノ酸異化および他のソースから生成された窒素性廃棄物をより毒性の低い形に処理することである。したがって、異常な窒素代謝がアルツハイマー病の病態に役割を果たす可能性があるという仮説が立てられている[121]。1993年にSeilerによって提案されたアルツハイマー病の病因に関する初期の仮説の1つはアンモニア仮説であった;これはアンモニアの増加したレベルがアルツハイマー病の脳に蓄積して毒性を持つという仮説である[122]。しかし、アミロイドカスケード仮説はその前年に提案されており[123]、アンモニア仮説は十分に調査されなかった[121]。アルツハイマー病のアンモニア仮説は、次のような観察のために生成された:アルツハイマー病患者からの血漿中に測定されたアンモニアレベルの増加[124,125]、アンモニアをスカベンジするアルツハイマー病アストロサイトにおけるグルタミン合成酵素活性の低下[96,126]、アルツハイマー病脳におけるアデノシンデアミナーゼ活性の増加[127]、およびアルツハイマー病脳におけるモノアミン酸化酵素活性の増加[128,129](後者の2つの酵素はアンモニアを産生する)。アンモニアはまた、SH-SY5Y細胞[130]およびアストロサイト[131]において活性酸素種レベルを増加させ、ラットにおけるRNA酸化につながることが判明したため、脳の酸化的損傷の原因としても暗示されている[132]。
さらに、ラットおよびマウスモデルでは、ミトコンドリア活性がアンモニアによって障害されている。げっ歯類の脳におけるアンモニア毒性は、状態IIIの呼吸 [133] とチトクロームc酸化酵素(複合体IV)活性の低下 [134] 、および単離されたシナプスのミトコンドリアにおける他のいくつかの酵素の活性低下をもたらした [135]。ミトコンドリア機能の障害はしばしば酸化的損傷の増加と関連している。これは、アンモニアの存在下での活性酸素種の増加を一部説明することができる。アンモニア産生の増加は、毒性のあるアンモニアを尿素に代謝するための尿素サイクル機能を必要とするか、あるいはグルタミン合成酵素によって触媒されるグルタミン酸とアンモニアの反応の増加と、その後の脳からのグルタミンの輸出を必要とするだろう。アルツハイマー病の被験者とマウスモデルにおける尿素サイクルとアミノ酸代謝の研究からの証拠は、アルツハイマー病の脳におけるアンモニアの生産と解毒の制御のさらなる調査を正当化する。
7. アルツハイマー病治療としての代謝物サプリメントの検討
食事中の特定のアミノ酸や他の代謝物のレベルを増減させることは、老化と長寿のマーカーを改善するためのいくつかの有望な方法であることが示されている[41];したがって、年齢がアルツハイマー病の主要な危険因子であるため、栄養補給や制限はアルツハイマー病患者の神経機能を改善する可能性がある。しかし、効果的な治療法が策定されるまでには、克服すべきいくつかのハードルがある。例えば、最適な処方を選択するためには、腸管輸送、バイオアベイラビリティ、肝代謝と排泄、血液脳関門輸送に関する研究が必要である。この情報の多くは、いくつかの一般的に研究されたアミノ酸のために存在しているが、それの多くは、アミノ酸の大部分のために欠落している。既知のものから、それは肝代謝が神経変性の治療に使用するためのアミノ酸の多くのサプリメントのために克服するために大きな課題を提示することが表示されるが、腸管輸送はまた、高齢者で制限になる可能性がある[106]。アミノ酸のいくつかはまた、限られた血液脳関門透過性を持っている。我々は、これらの多くの課題を考慮に入れて、以下に1つの有望な戦略を提示する。
前述のように、アミノ酸の腸内取り込みは65歳を過ぎると低下する。個々のアミノ酸およびジペプチドのバイオアベイラビリティは、個々のモノマーが腸内でさらに酵素による加水分解を必要とせずに迅速に吸収されるため、ポリペプチドとして消費されるアミノ酸のバイオアベイラビリティよりもわずかに優れていることが示されている。したがって、個々のアミノ酸または個々のアミノ酸の組み合わせによる栄養補給は、この年齢層の健康を促進する高タンパク食に加えて、高齢者にも恩恵をもたらす可能性が高いであろう[106]。個々のアミノ酸の使用はまた、特定のシグナル伝達経路を刺激することができるという付加的な利点を有する。高齢者ではアミノ酸の腸内吸収が低下しているため、アミノ酸エチルエステルやN-アセチルアミノ酸などの疎水性、より膜透過性の高いアミノ酸の形態を補うことで特に恩恵を受けることができる。これらのアミノ酸誘導体は、腸上皮や血液脳関門の毛細血管内皮など、特定の膜トランスポーターの活性が制限されている膜二重層を横切って拡散する確率が高くなる。これらのより疎水性のアミノ酸誘導体は、遊離アミノ酸を放出するために、細胞内または細胞外でエステラーゼおよび他の加水分解酵素によって切断される。この加水分解は、最初のパスの肝代謝中に大規模に発生する可能性があるので、この戦略は、多くのアミノ酸のための血液脳関門透過性を高めるための限界的な使用の可能性がある。
食事性アスパラギン酸、グルタミン酸、およびグルタミンは、腸細胞の燃料の主要な供給源として酸化される[136]。さらに、グルタミン酸およびアスパラギン酸は、脳内に高濃度で存在するにもかかわらず、血液脳関門を介した輸送が非常に悪い [137]。血液脳関門を介した輸送が悪い他のアミノ酸には、グリシン、アラニン、プロリン、およびGABAが含まれる。中鎖および大側鎖、非極性アミノ酸は、芳香族アミノ酸、BCAAs、メチオニン、ヒスチジン、およびスレオニンを含む脳内への血液脳関門によって比較的よく輸送される[138]。グルタミンおよびアスパラギンもまた、同じ経路で輸送される可能性が高い。これらのアミノ酸はすべて、L1輸送経路を介して輸送を競う。y+システムと呼ばれる別のアミノ酸トランスポーターは、血液脳関門を介してセリンなどのいくつかの中性アミノ酸と同様に、アルギニン、リジン、オルニチンなどの基本的なアミノ酸を輸送する[137]。
アルツハイマー病患者のための1つの潜在的な治療戦略は、BCAAs、芳香族アミノ酸(フェニルアラニン,チロシン,トリプトファン)、グルタミン、ヒスチジン、およびスレオニンの高レベルで低タンパク質の食事を補充することである。L1アミノ酸輸送系のための競争を介して、この治療法は、おそらくメチオニン制限の既知の代謝および神経保護の利点をもたらす、脳へのメチオニンの輸送を制限することができる[30, 44]。しかし、メチオニンはまた、この戦略の有効性を妨げる可能性があるy+系を介して限られた範囲で脳内に輸送される。第二の可能性のある治療法は、前述の補充戦略からメチオニンの代わりにロイシンおよび/またはイソロイシンを省略することである。これら2つのアミノ酸は、y+系によって輸送されない[137]。脳内のロイシンまたはイソロイシンの欠乏は、アミノ酸の不均衡、GCN2キナーゼの活性化、およびおそらくはタンパク質の翻訳速度を遅くするためのmTORキナーゼの阻害につながる可能性があり、それはタウタンパク質の高リン酸化凝集体から形成された神経原線維のもつれのレベルを減少させるのに有益であるかもしれない。これらのアミノ酸補充療法は、D-β-ヒドロキシ酪酸(ケトン体)クエン酸サイクル中間体、ピルビン酸、および/または乳酸などの他の代謝燃料との補充と組み合わせることができ、これは、燃料としてのアミノ酸の使用上のADニューロンの依存性を減少させるであろう。これらの代替代謝燃料の高レベルの消費は、ニューロンのアミノ酸レベルを部分的に回復させることができるかもしれない。
8. まとめと結論
食事中のアミノ酸は、生化学的経路の無数のによって代謝されることができる体に大量の炭素と窒素を提供する。アミノ酸は、神経細胞のシグナル伝達、エネルギー生産、および窒素廃棄物の生産と除去に役割を持っている。これらのプロセスは、正常な生理学にとって重要なので、疾患状態がその機能の主要な変化に起因することは驚くべきことではないが、この代謝の比較的マイナーな摂動が神経変性に寄与するかどうかについては、さらなる研究が必要である。アルツハイマー病患者からの脳と血清は、疾患の症状のいくつかの基礎を提供するアミノ酸レベルと代謝における多くの変化を示している。これらの個々の変化は、それぞれが病気の中で異なる役割を果たす可能性があり、アルツハイマー病の病理学の根底にある複雑さを強調している。尿素サイクル酵素の発現の変化と一緒にアルツハイマー病患者の脳内の尿素の増加は、尿素サイクル活性がアルツハイマー病脳内皮細胞で誘導される可能性があることを示唆している。アルツハイマー病を代謝に関わる大きな要素を持つ疾患として捉えることは、アルツハイマー病研究分野における創薬のための新たなターゲットの可能性についての貴重な知見を提供する。アルツハイマー病で起こるアミノ酸代謝の変化のいくつかの要約を図2に示する。
図2
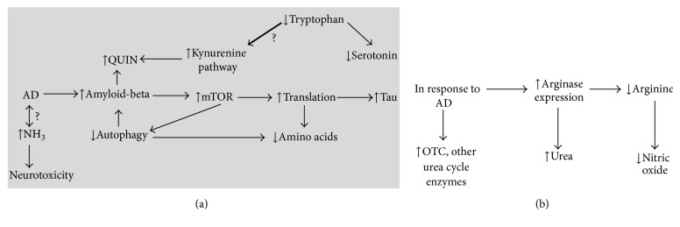
アルツハイマー病脳におけるアミノ酸代謝に影響を与える変化を選択してほしい。(a) アルツハイマー病脳で発生しているいくつかの病態プロセス。太い矢印は、キヌレニン経路におけるトリプトファン代謝が、アルツハイマー病におけるセロトニン経路に比べて相対的に増加し、観察されたより低いトリプトファンレベルに寄与している可能性があることを示している。(b) アルツハイマー病の脳が、グルコースの異化作用の低下とアミノ酸の異化作用およびアンモニアレベルの増加に直面したときに恒常性を維持しようとするメカニズムを選択する。
代謝物レベルの測定は、非常にダイナミックなプロセスのスナップショットを提供する。この情報は非常に有用であるが、それだけでは アルツハイマー病 に関連する病理学的変化を理解するには十分ではない。酵素活性を測定するさらなる研究は、アルツハイマー病におけるアミノ酸代謝の動態に関する補完的な情報を提供する可能性がある。さらに、OTC(オルニチントランスカルバモイルラーゼ)とARG2(トコンドリアアルギナーゼII)を過剰発現させてADマウスモデルの脳内皮細胞の尿素サイクルを活性化させる研究は、脳内皮の尿素サイクル活性が脳生理学や認知機能に及ぼす影響を明らかにするのに役立つであろう。代謝の観点からアルツハイマー病を研究することは、病気の進行を遅らせたり、病気によって引き起こされる苦痛の一部を軽減する栄養補助療法につながる可能性がある。