Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC5933890/
Effects and Mechanisms of Taurine as a Therapeutic Agent
2018年4月10日オンライン公開 doi:10.4062/biomolther.2017.251
pmcid: pmc5933890
PMID:29631391
概要
タウリンは豊富なβ-アミノ酸であり、多様な細胞保護活性を有する。ある種の生物ではタウリンは必須栄養素であるが、人間では準必須栄養素とされており、タウリンを欠いた細胞は大きな病理学的変化を示すことが知られている。
これらの知見から、タウリンの治療薬としての可能性に関心が集まっている。タウリンがうっ血性心不全の治療薬として有効であることを発見したことをきっかけに、他の疾患に対する治療薬としてのタウリンが研究されるようになった。
現在、タウリンは日本でうっ血性心不全の治療薬として承認されており、他のいくつかの疾患の治療薬としても期待されている。この総説は筋肉、中枢神経系および心血管系の病気の処置のタウリンの役割を支持する研究を要約する。
さらに、タウリンはミトコンドリア病、ミトコンドリア脳症、乳酸アシドーシス、脳卒中様エピソード(MELAS)の治療に極めて有効であり、糖尿病などの代謝性疾患や関節炎などの炎症性疾患の治療に新しいアプローチを提供する。
また、これらの治療作用の基盤となるタウリンの機能(抗酸化、エネルギー代謝、遺伝子発現、小胞体ストレス、神経調節、品質管理、カルシウム恒常性の調節)にも言及した総説である。
キーワード タウリン、細胞保護、神経変性疾患、抗酸化、小胞体ストレス、MELAS
序論
タウリンはβ-アミノ酸の一種で、ほとんどの細胞に高濃度に存在し、特に興奮性の組織ではその濃度が高い。タウリンは哺乳類において多くの機能を有しているが、その中でも細胞保護作用は、様々な生物種の健康状態や栄養状態を劇的に変化させることから、最も注目されている機能である。
タウリンは細胞内の基本的な事象を制御し、生と死のバランスを変化させるため、タウリンの生理機能に対する関心が高まっている。また、タウリンの生理機能に関する研究が盛んに行われ、乳児用ミルク、栄養補助食品、栄養ドリンクなどに使用されるようになった。
また、タウリンの治療薬としての研究にも拍車がかかっている。これらの研究のほとんどは動物の病理学のタウリンの仲介の逆転に焦点を合わせたが、臨床適用に基礎科学の調査結果を翻訳する試みがあった。多くの臨床研究の結果は有望であり、タウリン治療の有望な将来を示唆している(Ginguayet al.)同様に有望なのは、タウリンの栄養価を示す研究である(McCarty, 2013)。
ネコやキツネなど一部の種では、タウリンは必須栄養素である(Schmidtet al., 1976;Novotnyet al. 1991;Itoet al. 2008;Ripps and Shen 2012)。タウリンの欠乏はそれらの動物の病理を引き起こすだけでなく、寿命を縮める(Itoet al., 2014a;Parket al.)これに対し、タウリンは人間では条件付き必須栄養素あるいは機能性栄養素に分類される(Gaull, 1986,1989;Bouckenoogheet al, 2006)。
ヒトは大量のタウリンを合成することができないが、ヒトの組織によるタウリンの保持量はネコやキツネのそれよりも大きい。したがって、ネコとは異なり、ヒトは、非経口栄養がタウリン欠乏に関連することがあるが、タウリン欠乏の明白な兆候を容易に発症しない(Arrieta et al.2014)。
それにもかかわらず、ヒトの研究はタウリンの栄養価を明らかにしてきた。特に注目すべきは、世界25カ国の50の人口集団を含む世界保健協会の研究で、食事性タウリン消費の上昇は、高血圧および高コレステロール血症のリスク低下と関連していると報告している(Yamori et al 2004;Sagara et al.2015)。また、タウリンの補給は、肥満女性の肥満度指数の低下(Yamori et al.2010)および炎症マーカーのレベルの低下(Rosa et al.2014)と関連している。
したがって、タウリンの細胞保護作用は、ヒトの臨床的および栄養学的健康の改善に寄与する。本総説では、タウリンの細胞保護作用のメカニズム、幅広い疾患に対するタウリンの影響、タウリン補給の栄養的価値について考察している。
タウリンの細胞保護活性を支えるメカニズム
抗酸化作用
最近の研究により、タウリンによる細胞保護作用の新しいメカニズムが明らかにされている(表1)。タウリンの細胞保護作用の主要なメカニズムの1つは、3つの異なるイベントによって媒介されるその抗酸化活性に関係していると思われる。
まず、タウリンは好中球の酸化物質である次亜塩素酸を中和する抗炎症剤として証明されている。タウリンと次亜塩素酸の反応の産物であるタウリン・クロラミンはまた、炎症プロセスを妨害する(Kim and Cha, 2014;Marcinkiewicz and Kontny 2014)。
第二に、タウリンはミトコンドリアによるスーパーオキシドの生成を減少させる(Jong et al.2012;Schaffer et al.2014a)。正常なミトコンドリアでは、タウリンはtRNALeu(UUR)のウリジン残基と共役を形成している。修飾されたウリジン残基はアンチコドンのWobble位置にあるため、この共役反応によりtRNALeu(UUR)のAAUアンチコドンとミトコンドリアmRNAのUUGコドンとの相互作用を高めることが可能である。
しかし、ある種のミトコンドリア病では、タウリン抱合体の形成が低下し、その影響でNADH-ユビキノン酸化還元酵素鎖6(ND6)などの特定のミトコンドリアがコードするタンパク質の発現が抑制される(Schafferet al.、2014a)。
ND6は、複合体Iのサブユニットであり、複合体Iの最大活性と複合体の適切なアセンブリに必要である。したがって、ND6生合成の減少は、複合体I活性、呼吸鎖によるNADHの利用、およびミトコンドリアATP生成を減少させるが、呼吸鎖によるスーパーオキシドの生成を増加させる(Jong et al.2012;Schaffer et al.2016;Shetewy et al.2016)。
ミトコンドリア酸化ストレスがミトコンドリア内の高分子を損傷することは広く認められているが、より重要なのは、ミトコンドリア伝染性転移(ミトコンドリア内膜の伝染化)およびミトコンドリア依存性アポトーシスを誘発することができることである(Ricci et al 2008、Shetewy et al.2016)。
この一連の流れは、タウリン処理によって阻害される可能性がある。ミトコンドリア病、ミトコンドリア脳症、乳酸アシドーシス、および脳卒中様エピソード(MELAS)では、タウリン抱合体の形成が損なわれている。タウリン療法は、タウリン抱合反応の基質源を提供することで、ミトコンドリアタンパク質生合成を回復させ、ミトコンドリア機能を改善し、スーパーオキシドの発生を抑制する(Rikimaruet al, 2012;Schafferet al, 2014b)。
この理論を裏付けるように、オゾン、二酸化窒素、ブレオマイシン、アミオダロン、ヒ素、鉄、アドリアマイシン、カテコールアミンなどのミトコンドリア酸化ストレスのプロモーターは、タウリン療法に好意的に反応することが示されている(Schafferet al. 2009)。
第三に、ミトコンドリアから発生する活性酸素は、酸化ストレスを防止する機能を持つ抗酸化酵素を損傷させることがある。抗酸化酵素の中には、酸化的なダメージに対して活性が敏感なものがあるため、タウリンはそれらの敏感な酵素のダメージを防ぐことで酸化的ストレスを制限している可能性がある。
表1 タウリンの細胞保護作用に基づくヒトの臨床的・栄養的健康増進のメカニズムについて
| 細胞保護 | タウリンの機能 |
|---|---|
| 酸化防止 | 次亜塩素酸の中和によるタウリン・クロラミンの生成による抗炎症作用(Kim and Cha, 2014;Marcinkiewicz and Kontny, 2014) |
| ミトコンドリア内でtRNALeu(UUR)のウリジンと結合し、スーパーオキシドを減少させる(Jonget al., 2012;Schafferet al., 2014a) | |
| ミトコンドリアND6タンパク質をコードしてATPを生成(Jonget al., 2012、Schafferet al., 2016、Shetewyet al., 2016) ミトコンドリア膜伝染性とアポトーシスを防ぐ(Ricciet al., 2008、Shetewyet al., 2016) | |
| タウリン抱合の基質を提供することで、ミトコンドリア病、MELASに恩恵を与える(Rikimaruet al, 2012;Schafferet al, 2014b) | |
| エネルギー代謝 | 解糖時のNADH/NAD+比を低下させ、複合体IおよびNADH感受性酵素を活性化する(Schafferet al.) |
| PPARαレベルの増加により脂肪酸の酸化を回復させる(Schafferet al.) | |
| 胆汁酸を共役させ、腸での脂質吸収を促進する(Schafferet al.) | |
| 遺伝子発現 | 代謝関連遺伝子の転写プロファイルを変化させる(Parket al., 2006) |
| 長寿を誘導する遺伝子を調節する(Itoet al, 2014a) | |
| 転写因子を変化させる(Schafferet al, 2016) | |
| タンパク質のリン酸化と細胞シグナル伝達を調節する(Lombardini, 1996;Ramilaet al, 2015) | |
| ERストレス | タンパク質のフォールディングを改善することでERストレスを抑制する(Itoet al.、2015a) |
| ERストレス抑制による脳卒中脳損傷の改善(Gharibaniet al., 2015) | |
| 脳卒中やアルツハイマー病の神経細胞を保護する(Prenticeet al.) | |
| ニューロモジュレーション | GABAA、グリシン、NMDA受容体をアゴナイズすることにより、中枢神経系を保護する(El Idrissi and L’Amoreaux, 2008;Chanet al., 2013) |
| GABAA受容体との結合により発作を減少させる(L’Amoreauxet al., 2010) | |
| グルタミン酸デカルボキシラーゼを上昇させることにより、発作から保護する(El Idrissi and L’Amoreaux, 2008) | |
| 品質管理 | ユビキチン-プロテアソーム系とオートファジーを活性化することで心筋細胞を保護する(Jonget al.) |
| 毒素によるオートファジーを抑制する(Li et al.2012;Bai et al.2016) | |
| Ca2+ホメオスタシス | 心筋梗塞や脳梗塞の際に、Ca2+の過負荷を減少させ、心臓や脳を保護する(Liet al, 2012;Baiet al, 2016) |
| 虚血再灌流時のタウリン喪失は、低酸素誘導性のCa2+過剰負荷を軽減し、心臓を保護する(Schafferet al., 2002) | |
| タウリンの枯渇はSR Ca2+ ATPaseの活性低下による心筋症を引き起こす(Ramilaet al.2015) | |
| Ca2+結合タンパク質を誘導することにより、てんかん時の脳神経細胞を保護する(Junyentet al., 2010) | |
| グルタミン酸による興奮毒性に対して、グルタミン酸による[Ca2+]iの上昇を抑制し、神経細胞を保護する(Wuet al., 2005) | |
| オスモレギュレーション | 有機オスモライトとして機能する(Schafferet al., 2002) |
エネルギー代謝への影響
タウリン欠乏による複合体Iの活性低下は、主にNADH/NAD+比の上昇を通じてエネルギー代謝にも影響を与え、主要な脱水素酵素をフィードバック阻害することによってエネルギー代謝を調節している。クエン酸サイクルはNADH/NAD+比の上昇に非常に敏感であり、3つのNADH感受性酵素(α-ケトグルタル酸脱水素酵素、イソクエン酸脱水素酵素、クエン酸合成酵素)がNADH/NAD+比の上昇により阻害を受けるからだ。
例えば、タウリン欠乏心臓によるピルビン酸の酸化は、NADH/NAD+比の上昇によってピルビン酸デヒドロゲナーゼ活性が阻害され、ピルビン酸の乳酸への大量変換から生じるピルビン酸の欠乏を引き起こすため、低下する(Schaffer et al.2016)。
したがって、解糖の刺激にもかかわらず、タウリン欠損心臓ではグルコース酸化が著しく減少し、全体のATP生合成に対するグルコース代謝の寄与が劇的に減少する。肝臓でのタウリン生合成率は低いので、ヒトのタウリンの主な供給源は食事である。
長年、魚介類を多く含む食事はタウリンの優れた供給源と考えられており、肉類は魚介類に比べて多少なりともタウリンを含むが、その量は少ない。しかし、近年、Bacchus-DやRed Bullなどのタウリン含有サプリメントが登場し、タウリンの代替供給源として注目されている。
このサプリメントは、少なくとも心不全の場合には有効な治療薬であることが証明されている。Jeejeebhoy et al(2002)によると、心不全患者の心臓ではタウリンが欠乏している。
このような患者に対してタウリンを補充することによってタウリンレベルを回復させると、収縮機能が改善される。この研究は、タウリンサプリメントが重要な治療薬であるという見解を補強するものである。しかし、エネルギー代謝が最も低下するのは脂肪酸酸化であり、クエン酸サイクルのフラックスが低下することが一因である。
また、タウリン欠乏症で脂肪酸酸化を抑制するのは、転写因子であるPPARαのレベルが低いことである(Schafferet al.、2016)。PPARαは、脂肪酸代謝に関与するいくつかのタンパク質や酵素を調節し、最も重要なのは長鎖脂肪アシルカルニチントランスポーター複合体である(Schafferet al.、2016)。脂質代謝に影響を与えるもう一つの要因は、胆汁酸が腸による脂質の吸収を促進することから、タウリン欠乏による胆汁酸生合成の減少である(動脈硬化の項を参照)。
遺伝子発現の制御
Park et al(2006)は、タウリン治療が遺伝子変化を誘発することを認識した最初の研究者である。最近では、Ito et al(2014a)が、広範囲の細胞機能(細胞周期の進行、細胞シグナル伝達、死と生存、アミノ酸代謝、タンパク質生合成、タンパク質折り畳み、老化)に寄与するいくつかのタウリン感受性遺伝子を同定している。また、タウリンを介した転写因子含量の変化も報告されている(Schafferet al.、2016)。
タウリンはタンパク質のリン酸化および細胞シグナル伝達を調節することが知られているが(Lombardini, 1996;Ramilaet al., 2015)、タンパク質のリン酸化の変化がタウリンを介した遺伝的変化に関与しているかどうかはまだ解明されていない。
小胞体ストレスの調節
タウリンの細胞保護作用のもう一つの重要なメカニズムは、小胞体ストレスの減衰である。小胞体ストレスは、小胞体機能を回復し、タンパク質の分解とタンパク質の生合成/折り畳みの間のバランスを再確立するために設計された重要な制御機構である。
細胞が過度のERストレスを受けると、細胞を死に至らしめる経路が刺激される。ERストレスの一般的な原因は、欠陥タンパク質の蓄積であり、不適切なタンパク質フォールディング、不適切なタンパク質分解、ER機能不全の結果、そのレベルが上昇する。
ERの機能を回復し、タンパク質の分解と生合成/フォールディングのバランスをとるために、アンフォールドあるいはミスフォールドしたタンパク質は、3つのストレスセンサー(PERK、ATF6、IRE1)を活性化し、アンフォールドタンパク質応答(UPR)経路と呼ばれる異なる経路を開始させる。
UPR経路は、タンパク質の生合成を抑制し、タンパク質の分解を促進し、シャペロンを生成してタンパク質のフォールディングを改善し、オートファジーまたはアポトーシスを開始させる機能を有している。脳卒中では、タウリンはグルタミン酸の毒性を低下させ、酸化ストレスとカルシウム過負荷の両方を軽減する。
しかし、タウリンは3つのUPR経路のうち2つの経路も抑制する。ERストレスおよびUPR経路に対するタウリンの作用の基礎となるメカニズムはまだ解明されていないが、タウリンの欠乏がERストレスと関連していることは関連性がある(Ito et al.2015a)。
タウリンは、酸化ストレスを軽減するか、またはタンパク質の折り畳みのためにより良い浸透圧環境を提供することによって、タンパク質の折り畳みを変えるかもしれないことが提案されている(Itoet al.、2015a)。
ERストレスに対するタウリンの効果を説明する最初の研究は、脳卒中の細胞モデルおよび動物モデルを使用した(Gharibani et al.2013、2015)。
それらの研究の著者らによると、ERストレスは、酸化ストレスおよびミトコンドリア機能障害とともに、脳卒中およびアルツハイマー病、ハンチントン病およびパーキンソン病を含む神経変性疾患の特徴である(Prenticeet al.、2015)。
脳卒中では、大量の神経伝達物質であるグルタミン酸が放出され、これがシナプス後神経細胞を過剰に刺激し、酸化ストレス、カルシウム過負荷、ERストレス、場合によっては細胞死によって特徴づけられる神経興奮性反応につながる(Prenticeet al.、2015)。
抑制性神経調節因子としてのタウリン
中枢神経系におけるタウリンの細胞保護作用には小胞体ストレスが重要な役割を担っているが、もう一つの重要なメカニズムは、タウリンの神経調節作用である。CNSにおける毒性は、興奮性神経伝達物質と抑制性神経伝達物質の間で不均衡が生じたときによく起こる。
GABA は支配的な抑制性神経伝達物質の1 つである、従って GABAのCNSのレベルか GABAの受容体の活動の減少は神経細胞の過剰興奮性を促進できる。タウリンは、GABAA、グリシンおよびNMDA受容体の弱いアゴニストとして機能する(El Idrissi and L’Amoreaux, 2008;Chanet al.、2013)。
したがって、タウリンは、神経細胞の興奮性の抑制を引き起こすことによって、GABAの一部を代替することができる。しかし、タウリンによるGABAA受容体の制御は複雑である。急性期のタウリン投与はGABAA受容体を活性化するが、慢性期のタウリン摂取はGABAA受容体のダウンレギュレーションを促進し(L’Amoreauxet al.、2010)、GABA生合成の律速段階であるグルタミン酸デカルボキシラーゼのアップレギュレーションを促す(El Idrissi and L’Amoreaux, 2008)。したがって、GABA受容体、グリシン受容体、NMDA受容体における複雑な相互作用が、CNSにおけるタウリンの作用を大きく規定している。
品質管理プロセスの規制
また、タウリンはユビキチン-プロテアソーム系やオートファジーなどの品質管理プロセスも制御している。これらのプロセスは、損傷した細胞や細胞内小器官を若返らせるか、分解や細胞死によってそれらを排除する。タウリン欠損細胞では、プロテアソーム活性の低下がユビキチン化タンパク質の蓄積をもたらし、この効果はミトコンドリア特異的抗酸化物質であるmitoTEMPOによって消失する(Jong et al.2015)。
タウリンの欠乏は、損傷を受けた細胞や小器官が蓄積するオートファジーの減少とも関連している(Jonget al.)これらの品質管理プロセスの不活性化は、細胞や組織に極めて大きなダメージを与える。
しかし、過剰なオートファジーは、細胞死を上昇させるため、ダメージも大きい。オートファジーに対するタウリン処理の効果を検証した研究はまだ少ないが、タウリンは毒素を介したオートファジーを減衰させるため、タウリンの作用はその細胞保護活性と一致する(Liet al.、2012;Baiet al.、2016)。
Ca2+ホメオスタシスのモジュレーション
心筋梗塞や脳梗塞で心臓や脳に過剰に蓄積されたCa2+は、細胞毒性も持っている。高い[Ca2+]iはプロテアーゼやリパーゼを活性化するだけでなく、ミトコンドリア伝染性転移を開始し、ミトコンドリア内膜を伝染させてミトコンドリアからプロアポトーシス因子の放出を誘発し細胞を殺すイベントである(Rasola and Bernadi, 2011,Shetewyet al., 2016)。
タウリンは、3つのメカニズムを通じてCa2+の過負荷を減少させ、細胞を保護する(Schaffer et al.2014b;Prentice et al.2015)。
まず、虚血再灌流障害時の細胞からのタウリンの損失は、タウリンの損失が細胞からのNa+の損失も伴うことから、タウリントランスポーターによって媒介されているようである。その結果、タウリンが放出されると、Na+/Ca2+交換体を介したCa2+の侵入に利用できるNa+が少なくなり、Ca2+過剰負荷の程度を最小にする(Schaffer et al 2002)。
次に、タウリンは、細胞質からのCa2+の除去を通じて細胞質Ca2+恒常性の維持を担う筋小胞体Ca2+ ATPaseの活性を間接的に制御する(Ramilaet al.、2015)。このタウリンの作用は、タンパク質のリン酸化の変化を伴うが、タウリンがタンパク質のリン酸化を調節する機構は解明されておらず、さらなる研究が必要である。
第三に、タウリン処理はカルビンディンD28k、カルレチニン、パルバルブミンの存在の変化に関連している(Junyent et al.2010)。
第四に、タウリンは、L型、P/Q型、N型電圧ゲートCa2+チャネル、およびNMDA受容体チャネルを介してグルタミン酸誘導Ca2+流入を阻害する(Wu et al 2005)。
オスモレギュレーション
ほとんどの細胞内のタウリン濃度はかなり高いである。浸透圧負荷の上昇に反応して、細胞内のタウリンレベルは増加し、低浸透圧ストレスに反応して減少する。これは、浸透圧のアンバランスによる過度の伸展から細胞を守る重要なメカニズムである。
タウリンが有機性浸透圧として役立つので、それはまた Na+のような他の浸透圧のレベルを調節する、それは電荷を運ぶだけ(中立双対イオンであるタウリンとは違って)、また輸送および膜電位のような多くの重要な細胞機能で、かかわる(Schafferl et al 2002).腎臓では、タウリンは弱い利尿剤およびナトリウム利尿剤として機能し、正常な腎臓機能にとって重要な特性を持っている。
タウリンを介した病理学的および疾患に対する保護
タウリンの中枢神経系に及ぼす影響
脳卒中
脳卒中は、その発症率が増加傾向にあり、現在、死亡および身体障害の主要原因の一つとなっている。虚血性脳卒中や低浸透圧ストレスなどの病的状況下では、中枢神経系(CNS)の様々な細胞からタウリンが放出され、神経保護剤として機能する(Albrecht and Schousboe, 2005)。
多くの脳領域では、タウリンの濃度は1mM以下であり、グリシン受容体の活性化には十分であるが、ほとんどのGABA受容体は活性化さない。腹内側視床のGABA受容体は例外で、タウリンに対して特に高い親和性を示す。
タウリンは大脳皮質の神経細胞の発達に重要な役割を担っている(Furukawaet al.、2014)。
1mM以下のタウリン濃度はCNSの多くの領域でGABA受容体を活性化しないが、タウリン欠乏は線条体のGABA作動性抑制の障害をもたらし、肝性脳症に似た疾患の発症に関連する(Sergeeva et al 2007)。
*
脳卒中時の細胞損傷と死の主な原因は、大量のグルタミン酸の放出であり、グルタミン酸受容体を過剰に刺激し、過剰興奮をもたらす(Prenticeet al.、2015)。グルタミン酸毒性に関連する損傷事象の中には、カルシウム過剰、酸化ストレス、ATP枯渇、ミトコンドリア機能不全がある(Abramov and Duchan, 2008;Prenticeet al.、2015)。
カルシウム過剰と酸化ストレスの組み合わせは、ミトコンドリア伝染性遷移とミトコンドリアアポトーシスを開始するプロアポトーシス因子の放出をトリガーすることが可能である。アポトーシスは、ERストレスから生じるUnfolded protein response (UPR) 経路の最終産物であるカスパーゼ12、CHOP (C/EBP homologous protein) およびJNKによっても開始されうる。
興味深いことに、タウリンはグルタミン酸受容体刺激に応答して、脳切片からも放出される(Saransaari and Oja, 2010)。タウリンの放出は、[Ca2+]iの減少、Bcl-2/Bad比の増加、ERストレスの抑制によって、グルタミン酸毒性の悪影響を打ち消すのに役立つ(WuとPrentice, 2010)。
さらに、タウリンは、低酸素-再酸素刺激を受けたラット脳皮質スライスにおける細胞の膨張を減少させる(Ricciet al.)しかし、タウリンを介したATP生成の増加およびミトコンドリアROS生成の抑制が、脳卒中の重症度の減少に寄与しているかどうかについては、まだ解明されていない。
タウリンのミトコンドリア作用は、脳卒中による複合体I活性の抑制を逆転させるはずであると信じるに足る理由がある。タウリン処理は、基質であるNADPHのレベルを低下させ(Schaffer et al.2016)、Nox2/Nox4のダウンレギュレーションを媒介することが知られているので(Han et al.2016)、タウリンは、脳卒中のROSの別の源、すなわちNADPH酸化酵素からのものを減少させるかもしれない(Abrabonf et al 2007)。
Gharibani et al(2015)は、局所脳虚血の動物モデルを用いて、タウリンとNMDA部分拮抗薬(5-メチル-N,N-ジエチルチオールカルバミン酸スルホキシド)の組み合わせがアポトーシスとERストレスを低減する一方、部分拮抗薬単独では神経保護を示さないことを発見した。
*
タウリンが動物における脳卒中の治療に有効であるという証拠は豊富にあるが(Menzie et al.2013)、ヒトにおける脳卒中のリスクに対する効果について取り上げた研究はごくわずかである。
14,274人の女性を調べたNew York University Women’s Health Studyに基づく前向き症例研究では、血清タウリンレベルと脳卒中リスクとの関連は観察されなかった(Wuet al.、2016)。
しかし、非喫煙者においては、特に、タウリンを豊富に含む餌を与えた脳卒中の遺伝子モデル(脳卒中易発症性自然発症高血圧ラット)において、脳卒中の発症率が90%減少したというエビデンスに照らして、さらなる検討に値する関連性があるかもしれない(Yamoriet al. 2009)。
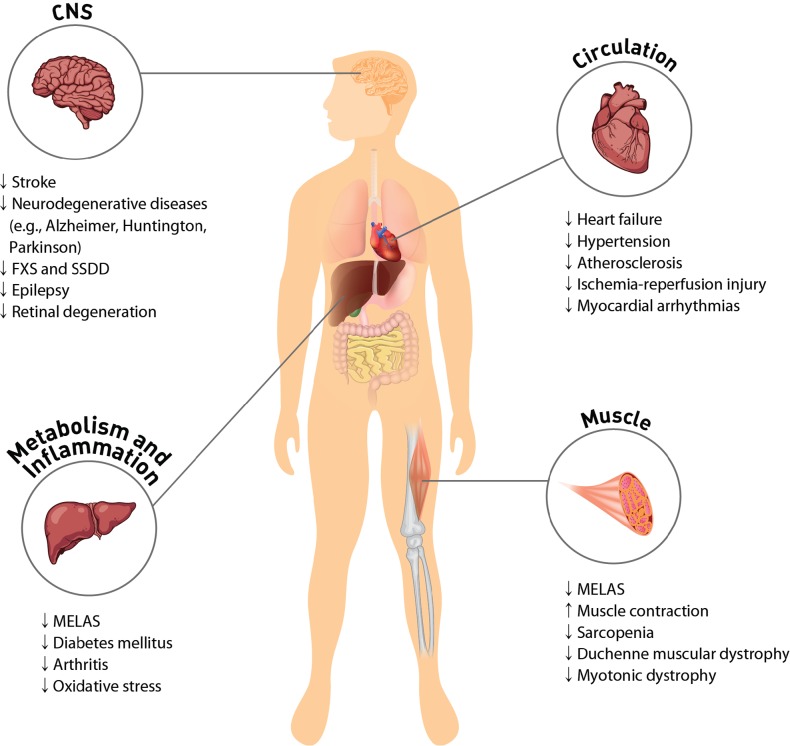
タウリンの脳卒中に対する有効性をヒトで検証する臨床研究が必要であることは明らかである(図1)。
図1 病理学および病気に対するタウリンの仲介の保護
ほとんどの細胞のタウリンの高い濃度は興奮するティッシュおよびミトコンドリアの生理学的な機能を調整する。タウリンは ERの圧力を減らし、GABAA、グリシンおよび NMDAの神経伝達物質の受容体に拮抗することによって、CNSを保護する。
タウリンによる心血管系の保護は Ca2+の輸送、ROSの生成および蛋白質のリン酸化のような細胞信号伝達の規則によって、起こる。タウリンの補足は MELAS および糖尿病の徴候を改善する。タウリンの抗炎症作用には、好中球におけるタウロクロラミンの生成、または関節リウマチや変形性関節症などの炎症性疾患における一酸化窒素やプロスタグランジンE2の減衰が関与している。
タウリンの枯渇やタウリントランスポーターのKOは、心臓や骨格筋の機能不全を引き起こす。タウリンは老化した人の筋肉の緩やかな損失を最小にすることによってsarcopeniaを防ぐ。
CNS: central nervous system; FXS: fragile X syndrome; SSDD: succinic semialdehyde dehydrogenase deficiency; MELAS: mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes.
アルツハイマー病、ハンチントン病、パーキンソン病などの神経変性疾患
神経変性疾患は、N-methyl-D-aspartate (NMDA) 受容体、α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA) inotropic glutamate receptor および metabotropic glutamate receptorのグルタミン酸による活性化により生じる脳卒中の病態特徴を多く共有している(Hara and Snyder, 2007)。
神経変性疾患におけるグルタミン酸を介した過剰興奮による細胞死の主な原因は、ミトコンドリア膜電位の崩壊にあるようだ(Abramov and Duchen, 2008)。
グルタミン酸受容体の活性化は、カルシウムの過負荷と活性酸素の産生の増加を引き起こす。ミトコンドリア機能は神経変性によって悪影響を受けるので、ミトコンドリアの活性酸素の発生が細胞障害の主要な原因であるはずだと予想される。
実際、変性疾患では呼吸鎖の欠損が検出されているが、欠損部位は疾患特異的であり、パーキンソン病は複合体I、ハンチントン病は複合体II、アルツハイマー病は複合体IVに影響を与える(Damiano et al.2010;Alleyne et al.2011)。
興味深いことに、パーキンソン病の動物モデルの1つは、複合体I阻害剤であるロテノンをネズミに投与することで生成される(Cannon et al 2009)。
タウリンの欠乏とロテノンの作用は類似しており、どちらも複合体Iの活性低下、NADHデヒドロゲナーゼ活性の阻害、呼吸活性の低下およびNADHの上昇をもたらす。タウリンの主要な生理的機能は複合体I活性の維持であるため、タウリン療法がパーキンソン病の重症度を下げるはずだと信じる理由がある(Alkholifi et al.2015)。
実際、最近、血漿タウリン量の減少がパーキンソン病の運動重症度と関連することが報告されている(Zhanget al.、2016)。さらに、47人のパーキンソン病患者を対象とした単盲検ランダム化比較試験で、タウリン類似物質であるホモタウリンによる治療時に過度の眠気を軽減する有効性が明らかになった(Ricciardiet al.、2015)。
*
フラジャイルX症候群とコハク酸セミルアルデヒド脱水素酵素欠損症
脆弱性X症候群は、行動障害と中等度から重度の知的障害を特徴とする遺伝病である。脆弱Xマウスの学習障害(記憶保持)は、タウリン(0.05% w/v)の4週間の慢性経口投与に良好に反応し、この効果はタウリンのGABA作動性活性に関連していると思われる(Neuwirth et al.2015)。
*
コハク酸セミルアルデヒド脱水素酵素(SSADH)欠損症は、GABA異化作用の重要な酵素が関与するまれな常染色体遺伝病である。SSADH欠損症の患者には、運動失調、筋緊張低下、言語障害、知的障害などの症状がみられる。SSADHの患者の半数近くは発作に苦しんでいる。
この疾患はGABAのホメオスタシスの崩壊と関連しているため、治療前後の症状に対するタウリン治療の効果が検討されている。2歳男児を対象とした1症例では、タウリン療法(200mg/kg/日)を12カ月間実施したところ、社会的行動、協調性、活動性が改善された(Saronwalaet al. 2008)。
しかし、その後の18人のSSADH欠損被験者のオープンラベル研究では、1年までの期間、タウリン(50〜200mg/kg/日)を投与しても、タウリンによる適応行動の大きな改善は見られなかった(Pearlet al.、2014)。明らかに、プラセボまたはタウリン療法のいずれかを受けるより多くの患者を対象とした対照的な無作為二重盲検試験が保証される。
*
てんかん
てんかんのメカニズムには、興奮性神経伝達物質と抑制性神経伝達物質の間の不均衡が背景にある。タウリンは脳内に豊富に存在するアミノ酸であり、抑制性神経調節因子として働いている(Oja and Saransaari, 2013)。
タウリンレベルは特定の種類の発作を抑制することができるが、タウリンの欠乏は発作の開始に必要ではない。動物実験では、タウリンの投与は、[D-Ala,Met]-エンファリンアミド、オピオイド、カイナイト、イソニアジド、ピクロトキシン、ペニシリンおよび低酸素を含む広範囲の刺激物によって誘発される発作を消失することが判明している。
それにもかかわらず、人間の癲癇に対するタウリンの処置の効果を検査する臨床試験は混合され、患者の約1/3だけがタウリンの療法に好意的に答えた(BarbeauおよびDonaldson、1974;Bergaminil et al、1974;Konigl et al、1977;Rumpll et al、1977;MantovaniおよびDevivo 1979;Airaksinenl et al、1980).
*
脳内の抑制性神経伝達物質は GABA であり、GABAによる神経興奮性の制御は、神経細胞の過興奮や発作の予防に大きな役割を担っている(L’Amoreauxet al., 2010)。
タウリンはGABAA受容体のアゴニストとして働き、シナプス後神経細胞への塩化物の流入を促進し、過分極を引き起こすことで興奮性を抑制する作用がある。カイニン酸、イソニアジド、ピクロトキシンを介した発作の抑制は、GABAeric系に対するタウリンの作用に起因している(El Idrissi et al 2003;El Idrissi and L’Amoreaux, 2008;Junyent et al 2009;L’Amoreauxet al, 2010)。
グリシンはGABAと同様に、塩化物コンダクタンスを活性化し、ニューロンを過分極させる主要な抑制性神経伝達物質である。また、タウリンがグリシン受容体に結合すると、塩化物電流が喚起され、神経細胞の発火が抑制されることから、タウリンの抑制性神経調節活性はグリシン受容体にも及んでいる(Wu et al 2008)。
*
網膜の変性
タウリンが猫にとって必須栄養素であることを示すブレイクスルー研究は、タウリン欠乏と視細胞損失および網膜変性の発症との関連性に焦点を当てたものだった(Schmidt et al.1976、Hayes et al.1975)。最近では、Hadj-Said et al(2016)が、タウリン欠乏が核神経節細胞の変性および喪失も引き起こすことを発見した。
さらに、抗てんかん薬であるビガバトリンは、タウリン欠乏に伴う視細胞および神経節細胞の両方の喪失を含む網膜変性を誘発することがある(Heim and Gidal, 2012;Frogeret al, 2014)。ベースラインおよび6カ月のビガバトリン治療後に異常なERGを示すコハクセミアルデヒド脱水素酵素欠損症の2人の患者において、タウリン療法はビガバトリン治療によって引き起こされる網膜障害を部分的に防ぐ(Horvathet al.、2016)。
タウリンは網膜神経節細胞の正常な生存に必要であるため(Froger et al.2012)、タウリン療法は網膜変性の予防に重要な役割を果たす可能性が提案されている(Froger et al.2014)。
タウリンの循環器系への影響
うっ血性心不全
タウリンは、日本ではうっ血性心不全の治療薬として承認されている(Azumaet al.、1992)。他の心不全薬のように、タウリンはうっ血性心不全の共通の徴候(労作時の息切れおよび浮腫)を減少させるだけでなく、ジゴキシンのような他の心不全薬の投与の必要性を除去または減少する(Azuma et al.1992)。
タウリンは低動脈圧心臓に対して軽度の正強心作用を発揮し、ナトリウム利尿と利尿を促進するが、タウリン慢性投与の主要な治療効果は、後負荷圧の上昇、心室リモデリングおよび体液リモデリングを通じて心筋パフォーマンスを低下させることが知られているノルピネフーリンおよびアンジオテンシンIIの作用の減少に関与すると考えられる(Itoet al.、2014b)。
タウリンは、カテコラミンオーバーフローの減少(Ca2+輸送の変化を通じて)と細胞シグナリングの減少(Ca2+輸送、活性酸素量およびタンパク質リン酸化の変化を通じて)の両方の能力を通じて、ノルエピネフリンの有害作用を低減するのに有効である。
最近の研究では、タウリン療法が心不全患者の運動能力を改善することが示されているが(Ahmadian et al.2017)、タウリンの補給が一般集団における顕性心不全の発症リスクも低減するかどうかは未解決である。
さらに、タウリンの補給が心不全患者の死亡率を低下させる可能性についても検討されていない。タウリンは、うっ血性心不全を患う患者の死亡率の重要な決定因子である心臓の高エネルギーリン酸量を上昇させるため、心不全患者の寿命を延ばすかもしれないと考える理由がある(Schaffer et al.2016)。
*
高血圧症
タウリンの補足はいくつかの動物モデルで高血圧の開発を防ぐ(FujitaおよびSato, 1986;Ideishil et al, 1994;Dawsonl et al, 2000;Haradal et al, 2004;Hagarl et al, 2006;Hul et al, 2009).これらのモデルにおいて、タウリンを介した血圧の低下は、腎機能の改善と同様に、[Ca2+]i、酸化ストレス、交感神経活性および炎症活性の減少の組み合わせによって媒介されるようである(Satoet al,1991;Dawson et al, 2000;Harada et al, 2004;Hagar et al, 2006;Mozaffari et al, 2006;Hu et al, 2009;Han and Chesney, 2012;Maia et al, 2014;Katakawa et al, 2016).
*
最近の2つの臨床研究は、タウリン療法が高血圧被験者の血圧を下げるという見解を支持している(Katakawa et al.2016;Sun et al.2016)。
Katakawaは、ヒトの高血圧に対するタウリン療法の有益な効果を、酸化ストレスの減少に伴う二次的な内皮機能の改善に起因するとしている。それに比べ、Sun et al(2016)は、高血圧予備軍患者がタウリン療法を受けた場合の血管拡張作用に着目した。
Sun et al (2016)が報告した研究の最大の特徴は、収縮期血圧が120~139mmHg、拡張期血圧が80~89mmHgと変動する18~75歳の高血圧予備軍120名を対象とした単施設二重盲検ランダム化プラセボ対照試験であり、その規模とデザインにある。
タウリン(1.6g/日)を12週間投与したところ、高血圧予備群の収縮期血圧は7.2mmHg低下し、拡張期血圧は4.7mmHg低下したが、プラセボを投与した高血圧予備群は同じ治療期間で血圧の有意な低下を示しなかった(Sunet al, 2016)。
タウリン効果は、初回タウリン投与時の血圧が低い被験者よりも、血圧が高い高血圧予備軍で大きく発現した。タウリンの投与により、血漿タウリン濃度が1.5倍に上昇し、この効果は血圧の改善と相関していた。この観察は、タウリンの摂取量が多い人は少ない人に比べて低い血圧値を示すというYamori et al(2010)による以前の疫学研究と一致した。
さらに、小川 et al(1985)は、本態性高血圧症では血漿タウリン含量が減少することを以前に観察していた。今回のヒトの研究は、腎臓を欠き、高塩分食を維持したラットにおいて、タウリンの欠乏が高血圧の発症を促進するという動物実験と一致している(Mozaffari et al 2006)。さらに、高血圧自然発症ラットでは、血漿タウリン量と血圧の間に負の相関が検出されている(Nara et al.1978)。
臨床研究において、Sun et al(2016)は、タウリンを介した血圧の低下を、血流およびニトログリセリンを介した拡張の改善によるものとし、この変化はプラセボ投与群では観察されなかったと述べている。
血漿タウリン含量の上昇に加えて、タウリン投与群はH2S含量の上昇を示し、後者は血管系における一過性受容体電位チャネル3(TRPC3)誘発シグナル伝達を阻害することによって低血圧を促進する。H2Sの血圧制御における重要性を、Ca2+、神経体液性因子、一酸化窒素など、血管機能の他の共通調節因子と比較するために、さらなる研究が必要である。
*
動脈硬化
動脈硬化は、脳卒中、心筋梗塞、末梢動脈疾患などの病態の主要な原因である。動脈硬化のプロセスは、複数の因子と段階が関与する複雑なものである(Moore and Tabas, 2011)。
動脈硬化の開始における重要なステップの一つは、動脈壁の内膜によるコレステロール富化リポタンパク質であるLDLの取り込みである。単球は、通常、内皮細胞とほとんど接着せず、平滑筋に蓄積されにくい。しかし、炎症因子や化学誘引物質(ケモカイン)にさらされると、単球は内皮細胞に接着し始め、そこで動脈壁の内膜に取り込まれる。
マクロファージコロニーファクターなどの因子にさらされると、初期粥腫の単球のほとんどはマクロファージに分化する。内膜では、LDLは酸化や糖化を受け、マクロファージによるLDLの取り込みが促進される。マクロファージによるLDLの取り込みと処理は、泡沫細胞の形成における初期のイベントと考えられているが、泡沫細胞の形成と動脈硬化には複数の経路が関与していることが明らかになっている(Moore and Tabas, 2011)。
*
タウリンの投与はいくつかの可能性のあるメカニズムによってアテローム性動脈硬化症を減少させる。
最初に、すべての研究ではないが、ほとんどの研究で、タウリンの補充はアテローム性動物の血清コレステロールレベルの後退を加速する(Petty et al.1990;Murakami et al.1996,2010).退行期間中、タウリン投与動物では肝コレステロール値がより急速に低下するが、これは主にコレステロールの分解を促進する7α-ヒドロキシラーゼ活性の増加のためである。
血清コレステロールの低下と治療時に使用するタウリンの用量に相関があることから、肝臓のCYP7A1遺伝子のアップレギュレーションが血清コレステロール値を調節すると考えられている(横越 et al.1999;Lam et al 2006;Murakami et al.2010)。
同時に、タウリン投与は、コレステロール生合成の律速段階である3-ヒドロキシ-3-メチルグルタリルCoA還元酵素の活性低下を伴う(Bellentaniet al, 1987)。
次に、タウリンを含む培地で肝細胞を24時間暴露すると、コレステロールエステルおよびトリグリセリドの生合成が低下する。肝臓のトリグリセリドとコレステロールエステルの含量は、肝臓の小胞体におけるリポ蛋白の集合の決定因子であるため、タウリンは構造蛋白であるアポリポ蛋白B100を含むリポ蛋白の集合と分泌を特異的に減少させる(Yanagitaet al, 2008;Murakamiet al, 2010)。アポリポタンパク質B100は、LDLとその前駆体であるVLDLの両方の主要な構造タンパク質である。
第三に、タウリンは、動脈硬化の発症の初期段階であるグルコース誘導性および酸化LDL誘導性の毒性から血管組織の内皮細胞を保護する(Ulrich-Merzenich et al 2007)。
また、タウリンは、高ホモシステイン血症を軽減することにより、ホモシステイン誘発性ERストレスおよびアポトーシスから内皮細胞を保護することが示唆されている(Zulli et al 2009)。
酸化ストレスは高血糖とホモシステイン血症に対する主要な有害反応であるが、酸化LDL誘発毒性は一酸化窒素合成酵素の阻害剤である非対称ジメチルアルギニンの蓄積に起因している(Tanet al. 2007)。
第四に、タウリンは動脈硬化に重要な役割を果たす血小板由来成長因子-BB(PDGF-BB)誘発血管平滑筋細胞増殖を抑制する(吉村 et al 2005)。タウリンは、血管平滑筋細胞の強力な化学誘引および増殖因子であるPDGF-β受容体を脱リン酸化するホスファターゼの活性を変化させるようである。しかし、タウリンはphorbol esterによる血管平滑筋増殖のRaf/MEK/ERK経路の活性化を抑制しないことから、タウリンの作用はPDGF-β経路に特異的であるとの指摘がなされている。
それにもかかわらず、この分野ではまだ論争が続いている。寺島 et al(2003)によれば、タウリンはERK活性およびimmediate early遺伝子発現を阻害することにより、間葉系細胞の増殖を抑制する。明らかに、平滑筋細胞の増殖に対するタウリンの効果を明らかにする研究は正当化される。
第5に、タウリンは、内皮細胞による酸化LDLの取り込みを仲介するLOX-1の発現を減少させ、腸骨動脈のバルーン損傷を受けた酸化ストレスを受けたウサギの狭窄率を減少させる(Gokce et al.2011)。
著者らは、この知見において、タウリンを介した酸化ストレスの減衰が重要な役割を担っていることも認識している。最後に、タウリンの動脈硬化抑制作用には、抗炎症作用が関与している可能性を検討する必要がある。
*
疫学的なWHO-CARDIAC研究では、食事性タウリン摂取が虚血性心疾患患者の死亡率低下と相関することが示された(Yamoriet al. 2001)。その研究を裏付けるように、Elvevoll et al(2008)は、タウリンが総コレステロール、LDLコレステロール、トリグリセリドに対するn-3脂肪酸補給の有益な効果を高めることを発見した。
最近、Katakawa et al(2016)は、タウリンとマグネシウムを補充した食事で維持されたヒトのアテローム形成リスクの減少を、酸化ストレスの低減と内皮機能の改善に起因するとしている。これらの研究により、ヒトの健康におけるタウリンの補給の重要性が明らかになった。
*
虚血再灌流障害タウリンの複数の行為(酸化防止剤、[Ca2+]iの調節、osmoregulation、蛋白質のリン酸化および高エネルギーリン酸の調節)は虚血再潅流の傷害の結果を変更する。
虚血再灌流傷害の様々なモデルにおけるこれらの因子の異なる効果、および虚血再灌流傷害の間のタウリン処理および喪失の重要性に関する議論は、最近のレビューに掲載されている(Schaffer et al.2014b)。
効果にばらつきがあるため、心筋梗塞の際に梗塞サイズを小さくし、傷害を最小限にするための急性心筋保護剤としてタウリンが採用されることはないだろう。むしろ、タウリンの使用は心臓移植やバイパス手術に限定されるかもしれない。
いくつかの研究者は、心筋梗塞治療液の成分としてタウリンの有用性を報告し(Oriyanhan et al 2005)、また、ドナー心臓として使用する前に心臓にタウリンを負荷することを報告している(Venturini et al 2009;Sahin et al.2011)。
酸化ストレスおよび腫脹の減少に加えて、虚血再灌流障害中のタウリンの損失は、浸透圧ストレスだけでなくCa2+過負荷も減少させる[Na+]iの減少をもたらす(Schaffer et al 2002;ModiおよびSuleiman. 2004)。さらに、バイパス手術の前にタウリンを急速に静脈内投与すると、酸化ストレスと細胞壊死から保護される(Milei et al.1992)。
*
心筋梗塞
タウリンの最も早く報告された心血管系の行為の1 つは広範囲のプロ不整脈の代理人(ジゴキシンまたは関連の心臓の配糖体、エピネフリン、ウアバイン、CsCl、低カリウム)に対するその抗不整脈作用である(Read および Welty、1963、Chazov等、1974年の)。
この作用は、[K+]i, [Na+]i, [Ca2+]iの調節に関連していると思われる。臨床報告では、タウリンとL-アルギニンの経口投与により、3名の被験者の不整脈が劇的に減少した。このように、タウリンは適切な条件下で非常に有効な抗不整脈薬である(EbyおよびHalcomb. 2006)。それにもかかわらず、タウリンは現在、心臓の不整脈の処置に使用されていない。
代謝性疾患におけるタウリンの役割
ミトコンドリア病、MELAS
タウリン欠乏症の症状とミトコンドリア病、MELASの症状には著しい類似性がある(Schaffer et al、2013)。
実際、MELASの特徴的な症状(ミオパシー、脳症、乳酸アシドーシス、脳卒中様エピソード)は、タウリン欠乏症でも認められる。このことは、両疾患の病態生理が類似していることから、驚くにはあたらない。MELASは、tRNALeu(UUR)をコードするDNAの領域における特定の点変異によって引き起こされる(Schafferet al.、2014a)。
この変異は、tRNAの構造を変化させ、tRNALeu(UUR)のウリジン塩基とタウリンの抱合を妨げるようだ(Kirinoet al. 2005)。ウリジン塩基の修飾は、UUGコドンとtRNALeu(UUR)のAAUアンチコドンとの相互作用を変化させ、それによってUUG解読が変化する(Kurataet al. 2003)。
タウリン欠乏は、タウリン共役体である5-タウリノメチルウリジン-tRNALeu(UUR)の形成も減少させるようであるが、その効果はミトコンドリアのタウリン量の減少に関連している(Schafferet al.、2014a)。
タウリンの欠乏は、UUG依存性タンパク質の発現を低下させ、最もUUG依存性のミトコンドリアがコードするタンパク質の1つは、複合体IのサブユニットであるND6である。ND6は複合体Iの組み立てに重要な役割を果たすため、タウリンによるND6レベルの減少は、MELASで見られるいくつかの特徴(乳酸症、複合体I活性低下および酸素消費量減少など)につながるのである。
呼吸鎖の機能低下は、スーパーオキシドの生成量の増加とATPの生成量の減少を引き起こすが、これらはMELASの筋障害と脳症の発症に中心的な役割を果たすと考えられる(図2)。MELASのもう一つの症状である痙攣発作は、タウリンのミトコンドリア活性も関係していると考えられるが、タウリンの神経調節抑制活性に依存している可能性がある。
*
図2 MELASとミトコンドリアにおけるタウリン欠乏症の比較
ミトコンドリア病であるMELASは、tRNALeu(UUR)をコードするミトコンドリアDNA(mtDNA)の特定の点変異によって引き起こされる。MELASの点突然変異の多くは、80%の頻度でA3243Gに、10%の頻度でT3271Cに変異が存在する。
mtDNAでは、ND遺伝子は赤色で、tRNA遺伝子は青丸で描かれている。MELASの原因であるtRNALeu(UUR)の遺伝子はND1に隣接している。MELASの変異はtRNALeu(UUR)の構造を変化させ、UAAアンチコドンのウリジン塩基とタウリンの結合による5-タウリノメチルウリジン(τm5U)の生成を阻害している。
MELAS患者はまた、アミノアシルtRNA合成酵素(AS)が触媒するロイシンによるタウリン欠損tRNALeu(UUR)のアミノアシル化も低下していることがわかる。ロイシンによるtRNALeu(UUR)のアミノアシル化の低下とτm5UAA-tRNALeu(UUR)のタウリン抱合体の形成はともにミトコンドリアのUUG依存性タンパク質、例えばミトコンドリア内膜にある電子輸送系複合体Iの44個のタンパク質サブユニットの一つND6のデコーディングを阻害している。
一方、タウリン欠乏症では、ロイシンによるtRNALeu(UUR)のアミノアシル化は正常だが、τm5UAA-tRNALeu(UUR)のタウリン抱合体の形成が低下し、ミトコンドリアのND6 mRNAのデコーディングもできなくなり、スーパーオキシドの生成量が増加してATP生成量が低下する。
MELAS: mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes; ND6: NADH-ubiquinone oxidoreductase chain 6; mt IS: motochodrial intermembrane space; mtIM: mitochondrial inner membrane; LS: light strand; HS: heavy strand.MELAS は、ミトコンドリア脳筋症、乳酸症、卒中症などの病態を示す。
*
タウリン含有量とMELASの発症には直接的な関連があるため、MELAS患者がタウリン療法に好意的に反応することは驚くべきことではない(Rikimaruet al.、2012)。
このような事例では、脳卒中様エピソードで来院した29歳女性が、左上腕筋生検でMELAS様A3243G点突然変異を有していることが検査で判明した。その後7カ月間、フェニトインとバルプロ酸の抗けいれん薬が投与されたが、てんかんと脳卒中様エピソードを止めることはできなかった。
タウリンの経口投与を開始し、血中タウリン濃度が約5倍になった直後から、てんかんと脳卒中様のエピソードは完全に停止した。また、タウリン治療により乳酸アシドーシスも改善された。関連する症例として、21歳の男性が右同名半盲症で入院した。
彼はA3243G連鎖型MELASと乳酸アシドーシスと診断された。その後数年にわたり抗けいれん療法が行われたが、それでも感覚性失語や視覚障害を含む脳卒中様のエピソードを数回経験した。タウリンの補給により血中濃度が約10倍に上昇した後、脳卒中様エピソードは停止した。
同じグループは、3243G-MELAS変異を持つ細胞質ハイブリッド(サイブリッド)に対するタウリン処理の効果を調べた。40mMのタウリンを含む培地でサイブリッドを4日間培養すると、A3243G含有サイブリッドで抑制されていた酸素消費とミトコンドリア膜電位を一部正常化させた。
また、タウリン処理は3243変異株を保有するサイブリッドの酸化ストレスの程度を減弱させた。このように、タウリン治療はMELAS患者の脳卒中様エピソードを消失させるだけでなく、正常なミトコンドリア呼吸機能を回復させることができる。これらのデータは、MELASに対する治療薬としてタウリンの使用が有望であることを明らかにした。
*
糖尿病(Diabetes mellitus)
糖尿病は、血糖値の上昇と血漿インスリンの減少(1型糖尿病)またはインスリンの作用に対する抵抗性(2型糖尿病)を特徴とする疾患である。1型糖尿病は、T細胞を介した膵臓β細胞の破壊により、インスリンの生合成が劇的に低下する自己免疫疾患である。
そのため、低インスリン血症や高血糖を特徴とする疾患である。一方、2型糖尿病は、初期にはインスリンの標的臓器への作用が低下するインスリン抵抗性を特徴とする進行性の疾患であるが、疾患の後期にはインスリン分泌も障害されるようになる。
糖尿病は、心血管疾患、神経障害、腎症、網膜症、足潰瘍、皮膚病変、聴覚障害など、複数の合併症を伴う。これらの合併症の制御には高血糖の程度の制限が中心であるが、いくつかの下流因子が合併症の重症化に寄与することがある。これらの要因の中で最も重要なものの1つが活性酸素である。
Brownlee(2005)による精力的な研究によると、ミトコンドリアによるピルビン酸代謝を伴うグルコースの酸化が活性酸素を生成し、それが糖尿病性合併症の発症に関与するいくつかの損傷経路(advanced glycosylation end product generation, protein kinase C activation, polyol formation and hexosamine pathway stimulation)のフラックスを促進すると提案されている。
*
Brownlee(2005)の研究から、2つの重要なコンセプトが生まれた。
まず、彼の統一的な仮説は、グルコースを介した酸化的障害と糖尿病性合併症に関係するいくつかの経路との間に論理的なつながりをもたらした。さらに、ミトコンドリア由来の活性酸素が、ある種の糖尿病性合併症の発症に重要な役割を果たすという洞察に満ちた考えを導入している。
しかしながら、糖尿病が介在する酸化ストレスがミトコンドリア機能自体に及ぼす影響については考慮されていなかった(Higgins and Coughlan, 2014;Maliket al., 2015;Coughlanet al., 2016;Czajka and Malik, 2016)。
*
ほとんどの糖尿病組織における活性酸素の主な発生源は、呼吸鎖の複合体IとIIIである。興味深いことに、複合体Iによって生成された活性酸素はミトコンドリアのマトリックス内に留まり、複合体III由来の活性酸素はマトリックスとミトコンドリア外部に分布している。
マトリックスにおいて、活性酸素は、酸化剤感受性酵素であるアコニターゼの活性低下、ミトコンドリアDNAの酸化の増加、そして十分に深刻な場合はアポトーシスによる死によって証明されるように、損傷を引き起こす(Ricci et al 2008;Lindblom et al.2015)。
複合体IIIを介した活性酸素の生成は、ミトコンドリア以外の標的にも影響を与えるが、ミトコンドリア内の作用は、糖尿病合併症の発症に最も重要であると思われる。レプチン欠損、肥満、2型糖尿病のdb/dbマウスでは、心臓のミトコンドリアROS生成の上昇は、呼吸機能とエネルギー代謝が損なわれるため、ATP生成の減少につながり、その結果、心筋のパフォーマンスが低下する(Boudini et al 2007)。
糖尿病性腎臓のメサンギウム細胞や尿細管細胞においても、呼吸とATPの産生が障害されている。ATPは近位尿細管での再吸収に必要である一方、エネルギー不足は腎不全につながるため、高血糖を介したミトコンドリア障害とATP不足は、糖尿病性腎症の発症に顕著な役割を果たすと考えられる(Higgins and Coughlan, 2014;Czajka and Malik, 2016;Hallan and Sharma, 2016)。
*
糖尿病を患うヒトで検出されたミトコンドリアDNA損傷は(Maliket al., 2015)、必ずミトコンドリアにコードされたタンパク質の発現を変化させ、呼吸鎖活性を低下させることにつながる。
その結果、より多くのROSが生成され、それがさらなるミトコンドリアDNA損傷を誘発し、最終的に損傷の悪循環を引き起こす。重度のミトコンドリア構造変化および機能不全(形態、生合成、呼吸鎖機能、脂肪酸およびクエン酸サイクル代謝、酸化ストレス、アポトーシスおよびアンカップリング活性)の証拠は、糖尿病合併症の発症におけるミトコンドリア損傷の役割を支持している(Sivitz and Yorek, 2010;Aonet al, 2015;Lindblomet al, 2015;Hallan and Sharma, 2016)。
*
血漿および血小板タウリンレベルは、1型糖尿病の被験者で減少している(Franconi et al.1995)。711人の過体重、糖尿病被験者に基づき、血漿タウリンレベルはインスリン感受性の低下と関連している(Zheng et al.2016)。実際、糖尿病の主要な標的(腎臓、網膜、神経細胞)のほとんどは、高血糖を介したタウリン含量の減少を受ける(Schaffer et al 2009)。
それにもかかわらず、幼少期には、糖尿病を有する被験者の代謝パターンは、タウリン欠損マウスの代謝パターンとは非常に異なっている(Ito et al.2015b;Schaffer et al.2016)。
1型糖尿病の初期欠陥はインスリン減少症であり、グルコース代謝が低下し、脂肪酸代謝が上昇するが、タウリン欠損マウスは呼吸鎖機能の低下、解糖の増加、グルコースおよび脂肪酸酸化の低下を示す(Schafferet al.、2016)。それにもかかわらず、タウリンは正常なβ細胞の生存に必要であり、したがって、12カ月齢のTauTKOマウスでは膵臓β細胞の数が減少する(Itoet al., 2015b)。
さらに、糖尿病動物の特性は、ミトコンドリアの酸化傷害により、疾患の後期には呼吸鎖機能が低下するため、年齢とともに変化する。また、ミトコンドリアの機能と生合成に影響を与えるのは、食事と身体活動である(Santos et al.2014)。
したがって、加齢と食事の修正に伴い、糖尿病とタウリンの表現型は類似の特徴を採用する。この点で、Han et al(2015)が、タウリン欠乏は糖尿病性腎症の適切なモデルを開発するための必要条件であると主張していることは興味深い。
*
タウリン療法が糖尿病、肥満、メタボリックシンドロームに関連する病態を軽減するという圧倒的な証拠がある(Schaffer et al 2009;伊藤 et al.2012;今井 et al.2014;村上ら、2015;Chen et al.2016)。
多くの動物研究、特にII型糖尿病の研究において、タウリン処理は低血糖の程度を減少させ、その効果はひいては糖尿病合併症を減衰させる(Nakaya et al 2000;Winiarska et al 2009;DasおよびSil. 2012;Kim et al.2012;Chiang et al.2014;Koh et al.2014)。タウリンで治療された糖尿病動物における高血糖の調節には、いくつかのメカニズムが寄与していると考えられる。
第1に、タウリンは、呼吸機能を改善し、ATP産生を増加させ、膵臓β細胞機能およびインスリン分泌を改善すべき効果をもたらす(Sivitz and Yorek, 2010;Schafferet al.、2016)。
次に、高血糖や脂質異常症は、ミトコンドリアROS生成の上昇と関連している。膵臓β細胞では、脂肪酸を介したROS生成はインスリン分泌を減少させるようであり、この効果はタウリン処理によって減弱する(Oprescu et al 2007)。
第三に、ミトコンドリア機能不全はインスリン抵抗性を誘発する可能性がある(Sivitz and Yorek, 2010)。Haber et al(2003)は、タウリン処理が高血糖によるインスリン抵抗性と酸化ストレスを防ぐことを見出した。
これらの知見は、タウリンが2型糖尿病を介した合併症から保護することを示しているが、タウリンのミトコンドリア作用とインスリン分泌および作用に対する効果を分離することが事実上不可能であるため、タウリンが2型糖尿病の合併症の発生を減少させるメカニズムは依然として不明である。
*
一方、ストレプトゾトシン誘発1型糖尿病モデルでは、血糖値はタウリン投与により変化せず、糖尿病性合併症の重症度は減少している。1つの糖尿病のstreptozotocinのモデルの糖尿病の状態がタウリンによって変化しないので、1つは糖尿病の複雑化の開発に対してタウリンの有効性の下にあるメカニズムを容易に確立できる。
複数の研究者によれば、2型糖尿病合併症の重症度におけるタウリン媒介の減少は、細胞ストレス(ER、酸化的および炎症性)およびミトコンドリア機能不全の改善とより密接に関連している(Schaffer et al 2009;Ito et al.2012;Imai et al.2014)。
Trachtman et al(1995)は、糖尿病合併症の発症に対するタウリン治療の有益性を認識した最初のグループであった。彼らは、ストレプトゾトシンを投与した雄ラットが、糸球体濾過量の上昇、糸球体肥大、タンパク尿およびアルブミン尿を特徴とする糖尿病性腎症を発症したことを報告した。タウリン(飲料水中1%)を投与すると、血糖値に影響を与えることなく、蛋白尿が50%減少し、糸球体肥大と尿細管間質線維化が劇的に抑制された。
また、酸化ストレスの指標である腎皮質のマロンジアルデヒドや、糖化最終産物の指標であるadvanced glycoloxidation productsの上昇を抑制したことから、タウリンの保護作用は酸化ストレスと糖化の抑制に起因することが明らかとなっている。
近年、糖尿病性腎症の発症に対するタウリン療法の有効性が確認されている(Pandya et al.2013、Koh et al.2014)。関連する研究として、Ikubo et al(2011)は、ストレプトゾトシンを投与した糖尿病ラットが、血糖値の変化なしに酸化ストレスに関連する血管の欠陥を発症することを発見した。
興味深いことに、タウリンはまた、グルコース毒性の細胞モデルにおいてアポトーシスから保護する(Ulrich-Merzenich et al 2007)。
*
肥満症は、インスリン抵抗性、高脂血症、高血糖、肥大した脂肪細胞に関連する炎症反応などを特徴とする疾患である。タウリンは、肥満動物の体重を減少させ、炎症反応を抑制する効果があるとされている。これらの効果やそのメカニズムについては、ここではレビューしないが、村上(2015)の総説で取り上げている。
*
炎症性疾患におけるタウリンの役割
関節炎は100以上の疾患を指す用語で、代表的なものに関節リウマチや変形性関節症がある。関節炎の主な症状は、関節、関節周辺組織、結合組織の炎症に伴う関節のこわばりや痛みである。関節リウマチは、滑膜の炎症と増殖、骨のびらん、関節軟骨の菲薄化が特徴である。
*
急性炎症期の特徴は、血管の拡張、微小血管の漏出、白血球の動員であり、後者は白血球と活性化内皮の相互作用を促進する接着因子が介在していることである。急性炎症は、損傷した組織や病気の組織、また刺激物や病原体によって引き起こされ、自然免疫系による損傷の修復や微生物や有害物質の除去の初期段階である。
急性炎症の際、白血球は内皮を越えて間質へ移行する前に内皮に付着する。好中球は、走化性因子やサイトカインによって炎症部位に誘導される。白血球、特に好中球と単核食細胞の活性化は、殺微生物ペプチド、陽イオン性微生物タンパク質、溶解酵素、活性酸素、リソソーム顆粒成分などの炎症性メディエーターの多くを分泌させる。
これらの炎症性メディエーターは、ファゴリソソームに放出されると、飲み込まれた微生物やその他の病原体を破壊する。しかし、それらが細胞外に放出されると、組織障害を引き起こす可能性がある。関節リウマチでは、炎症プロセスの活性化が自己免疫疾患の一部であり、関節の変形、骨の浸食、軟骨骨膜の破壊に寄与している。
*
好中球中のタウリン含量は高く、全遊離アミノ酸プールの約50%を占めている。好中球におけるタウリンの主要な機能は、抗炎症作用と抗酸化作用の2つである。好中球は病原体を殺すための武器として活性酸素を産生するが、その活性酸素のひとつが次亜塩素酸(HOCl)である。
ミエロペルオキシダーゼは、タウリンとHOClからタウリンクロラミン(TauCl)を生成する触媒である。TauCl は HOCl よりより少なく強力な酸化剤であるので、HOClの中和はタウリンの重要な酸化防止メカニズムの1 つを表す。
ミエルペルオキシダーゼ触媒反応はまた、TauClが炎症性サイトカインの生産を阻害するので、タウリンの抗炎症活性に責任がある(Marcinkiewicz et al.1995;Park et al.1997;Barua et al….。
2001)、一酸化窒素およびプロスタグランジンE2の上昇を減衰させ(Park et al 2000;Chorazy-Massalska et al 2004;Kim et al 2007)、マトリックスメタロプロテアーゼの活性を減少させ、白血球のアポトーシスを開始して急性炎症を終了させる(KlamtおよびShacter. 2005)。
タウリンの抗炎症および抗関節炎作用の詳細な議論については、MarcinkiewiczおよびKontny(2014)による広範な総説を参照してほしい。
タウリンの筋肉への影響
筋収縮の調節
タウリンの欠乏は、心筋と骨格筋の収縮機能の低下を招く(Cuisinier et al 2000)。Hamilton et al(2006)は、タウリン輸送阻害剤であるグアニジノエタンスルホン酸への曝露により、長趾伸筋のタウリン含量が60%減少し、それがピーク力収縮の減少と関連していることを見出した。
より重度の筋機能障害は、タウリントランスポーターノックアウトマウスで見られ、その筋タウリン含量は90%以上減少し、筋量の低下と筋機能障害を引き起こす(Warskulat et al 2004;Ito et al 2008;Ito et al. 2014b)。また、重度のタウリン欠乏症には、筋原線維の崩壊などの組織学的変化が伴う。
*
タウリン投与により、ヒト(石倉 et al.2011、Balshaw et al. 2013、Ra et al.2013、2016)、動物(Goodman et al.1985、Dawson et al 2002、谷田部 et al 2003、杉浦 et al.2013、da Silva et al.2014)ともに運動パフォーマンスが向上するという報告が豊富にある。
タウリン投与は、げっ歯類の収縮機能を改善するほか、疲労困憊するまでの時間を長くし、運動誘発性疲労を軽減し、激しい運動による損傷を減少させることが明らかにされている。激しい運動の前にタウリンを投与すると、炎症性因子のレベルが低下し、運動している筋肉が保護される(加藤 et al.2015)。
また、36人の男性被験者に、分岐鎖アミノ酸サプリメント、タウリンサプリメント、プラセボ、またはタウリンと分岐鎖アミノ酸サプリメントの組み合わせを投与した試験も注目される(Raet al.、2013)。
エキセントリック運動後の筋損傷が最も少なかったのは、運動2日後に筋肉痛が減少し、血中に放出される乳酸脱水素酵素とアルドラーゼが少なかった、併用群であった。興味深いことに、DNAの酸化的損傷の指標である8-ヒドロキシデオキシグアノシンの血清レベルも併用群で低下しており、タウリンの抗酸化活性が併用サプリメントの有益な効果に関与していることが示唆された。著者らは、タウリンが分岐鎖アミノ酸サプリメントの有益な効果を増強していることを示唆した。タウリンの保護作用の候補は、酸化ストレスと炎症の抑制であると考えられる。
同じ研究室による別の研究では、エキセントリック運動後の動脈硬化をエンドポイントとした(Ra et al.2016)。血清マロンジアルデヒドは、対照のプラセボ群では運動後4日間上昇したままだったが、タウリン投与群では酸化ストレスが低下していた。マロンジアルデヒドの上昇と動脈硬化は並行しており、タウリンを介した酸化ストレスの低減が動脈硬化の程度を減弱させるのに役立つことが示唆された。筋肉の機能および障害におけるタウリンの役割についてのより完全なレビューについては、DeLuca et al(2015)を参照してほしい。
*
サルコペニア
サルコペニアとは、タンパク質の生合成と分解の不均衡に関連して、骨格筋組織が徐々に減少することである。サルコペニアは加齢に伴い発生し、高齢者の身体障害につながるため、深刻な健康問題である。興味深いことに、タウリンの欠乏は細胞サイズの縮小と関連している(Schaffer et al.1998;Ito et al 2008)。
最近のレビューで、ScicchitanoとSica(2016)は、タウリンがサルコペニアの悪影響を打ち消すかもしれないという可能性を提起した。これは、タウリンの活用を別の用途に広げる可能性のある興味深い条件である。
*
デュシェンヌ型筋ジストロフィー症
酸化ストレスと炎症を特徴とする致死的な筋消耗性疾患であるデュシェンヌ型筋ジストロフィーのモデルであるmdxマウスの治療にタウリン療法を用いた有望な結果が報告されている(Terrillet al.、2016b)。
本疾患に罹患したヒトでは、出生時には症状がないが、若齢期からよちよち歩きや段差の登りにくさなどの症状が出現する。ヒトでは、細胞骨格と細胞外マトリックスをつなぐ細胞骨格タンパク質であるジストロフィンの変異が主な原因であり、デュシャンヌ型筋ジストロフィーのmdxマウスモデルでは、変異に代わってジストロフィンの発現が不十分であることが分かっている。
*
本疾患では、サルコレマ内の構造変化により細胞膜の伝染性が高まり、Ca2+が蓄積しやすくなるため、脱分極後の[Ca2+]i上昇速度が増大し、[Ca2+]iピーク値が上昇し、緩和期が延長するCa2+過剰負荷が発現する(Blake et al, 2002)。
プロテアーゼ阻害剤であるロイペプチンが[Ca2+]iの過度な上昇を消失させることから、プロテアーゼが本症の重症化に寄与していることが提唱されている。また、血管を十分に拡張させるために一酸化窒素を産生するnNOSの欠損も、本症の発症に寄与している要因の一つである。酸化ストレス環境では一酸化窒素レベルが低下するため、酸化ストレスや急性炎症も本疾患の病態に関与している可能性が指摘されている。
*
タウリンは、筋肉障害で減少するタウリンレベルを回復させることで、デュシェンヌ型筋ジストロフィーの発症のいくつかの段階を混乱させる可能性を持っている(Terrillet al,2015,2016b)。
実際、生後14日以降のmdxマウスのマウスチャウに4%のタウリンを添加すると、筋肉のタウリン含量が増加し、この効果は、炎症(好中球浸潤)の減少および運動後の筋細胞壊死の激しい発作の緩和と相関する(Terrill et al.2016a)。
DeLuca et al(2003)によると、タウリン処理はまた、運動するdmxマウスの前肢の強度を有意に増強する。
タウリンのこの効果は、タウリンの補給は主要なE-Cカップリングタンパク質の発現に影響を及ぼさないが、Ca2+ホメオスタシスの改善に大きく起因する(Horvath et al.2016)。
クレアチン投与はタウリンとほぼ同等の筋力増強効果があり、より多くのエネルギーを筋肉に供給することで筋機能の低下を防いでいることが示された。この点で、高エネルギーリン酸代謝および呼吸鎖機能の改善に対するタウリンの効果も、その有益な作用に寄与していると考えられる(Schaffer et al.2016)。
*
筋緊張性ジストロフィー筋緊張は、骨格筋の収縮に伴う弛緩の遅れを特徴とする疾患である。Conte-Camerino et al(1989)は、タウリンの急性投与が20,25ジアザコレステロール処理ラットによる筋緊張性放電の減衰に有効であるが、アントラセン9カルボン酸処理ラットでは有効でないことを見いだした。
20,25ジアザコレステロール投与による筋緊張モデルに対するタウリンの効果は、長趾伸筋の電位依存性クロライドチャネルのフラックスの改善によるものであった。アントラセン-9-カルボキシレートの作用がタウリンの効果を妨げていることが示唆されている。タウリンは機能的なクロライドチャネルを必要とするが、アントラセン-9-カルボン酸はそのチャネルを阻害するのである。
*
ミオトニアの重症度に対するタウリン慢性投与の効果を検証するいくつかの臨床試験が評価されている。筋萎縮症の9人の患者の二重盲検、単一のクロスオーバーの調査では、慢性タウリン療法はカリウムによって引き起こされる過興奮性を減少させている間、筋緊張症の重大さを減少させた(Durellil et al、1983)。
また、タウリンがNav1.4チャネルのナトリウムトランジェントを調節することから、タウリンがナトリウムチャネル性ミオトニアおよび先天性パラミオトニアに対しても有効である可能性が提案されている(DeLucaet al.、2015)。
*
タウリンはまた、筋原繊維のCa2+に対する感受性を増加させる(Dutka et al.1985)、この効果はTauTKO心臓でも見られ、トロポニンのリン酸化の促進に起因するとされている(Ramila et al.2015)。
また、タウリンが筋小胞体Ca2+ポンプの筋活動に影響を与える可能性もあり、心臓におけるこの効果は、調節因子タンパク質であるホスホランバンのリン酸化状態の変化によって引き起こされる(Ramila et al.2015)。
結論
タウリン(2-アミノエタンスルホン酸)は、様々な組織に高濃度で分布する内因性最終代謝物である。システインから合成される含硫アミノ酸であり、それ以上代謝されることなく排泄される。1827年に初めてタウリンが発見されて以来、骨格筋、網膜、中枢神経系、循環器系を中心とした実験により、多くの機能が解明されていた。
タウリンの細胞保護作用は、抗酸化、エネルギー産生、神経調節、Ca2+恒常性、浸透圧調節など様々なメカニズムを通じて、ヒトの臨床的・栄養学的健康の向上に寄与している。タウリンのこれらの細胞保護効果の1つ以上の組合せはCNSのものから、心血管系、骨格筋および不完全な新陳代謝に及ぶ多くの病気の病理そして徴候を減少させるために作用する。
打撃、神経退化、FXS、SSDD および癲癇を含む多くのCNS 関連病気はタウリンの療法に好意的に答える。タウリン治療はまた、心不全、高血圧、アテローム性動脈硬化症、虚血再灌流障害、心筋不整脈、糖尿病および関節炎などの炎症性疾患および循環器系の異常の重症度を低下させる。
タウリン枯渇の表現型は、ミトコンドリア病であるMELASと類似しており、両疾患とも呼吸鎖の活性に影響を及ぼすためである。また、タウリントランスポーターKOマウスの特徴として、骨格筋の収縮障害とサルコペニアが挙げられる。
したがって、タウリン療法は、MELAS、筋収縮力の低下、サルコペニア、デュシェンヌ型筋ジストロフィー、ミオトニックジストロフィーなどの疾患における心筋および骨格筋の機能障害を改善することが期待される。
タウリンは副作用の少ない天然物であり、ほとんどの哺乳類細胞の機能に基本的な役割を果たすことから、有効な治療薬および栄養補助食品としての未来は明るいと思われる。タウリンの臨床評価は一部の疾患に限られているが、すでにうっ血性心不全への使用が承認されている。したがって、タウリンは多様な細胞保護作用や治療作用を持つ必須中性脂肪物質であるといえる。
謝辞
2017年は、1827年にドイツの科学者、フリードリッヒ・ティーデマンとレオポルド・グメリンがタウリンを発見してから190年目にあたる。本記事は、タウリンの発見から190周年を記念して作成された。本稿の著者である国際タウリン学会会長Stephen Schafferと韓国タウリン学会会長Ha Won Kimは、韓国Dong-A Pharmaceutical Company, Ltd.の支援に対して感謝の意を表するものである。