Contents
- A mixed methods systematic review of multimodal non-pharmacological interventions to improve cognition for people with dementia
- 序論
- 方法
- 所見
- (1) 何が効いて何が効かないのか(有効性の予測因子)のエビデンスは?
- (2) マルチモーダルは重要か?
- (3)認知症の人のグループ(初期、中期、後期)ごとに異なるエビデンスは?
- (4) これらのアウトカムを検証するために用いられた異なる研究デザインの長所と限界は何か?
- (5) アウトカム指標の長所と短所は?
- (6) 各介入のモードに対する変化の可能性の高いプロセスに関する理論の証拠は何か?
- (7) MNPIの認知機能改善に対する有効性を評価するために用いられているさまざまな評価ツールの長所と限界は何か。
- (8)認知症と診断された人の認知機能改善のためのMNPIの有効性について、異なる提供方法の有効性はどのようなものであろうか?
- 考察と意味合い
- 限界
- 結論
A mixed methods systematic review of multimodal non-pharmacological interventions to improve cognition for people with dementia
www.ncbi.nlm.nih.gov/pmc/articles/PMC7180318/
ガルース・シャルフォン、クリスティン・ミリガン、ジェーン・シンプソン
目的
マルチモーダル非薬理学的介入は、認知症とともに生きる人々の生活の質を向上させるために、現在の薬理学的アプローチを補完する可能性があると主張されてきた。本レビューの目的は、特に認知機能を改善するためのマルチモーダル非薬理学的介入の有効性に関するエビデンスを特定し、総合的に評価することである。
方法
グレー文献を含む包括的な検索戦略の後、26の研究がレビューされた。認知症と診断された成人を対象とした。研究は2つ以上の異なる介入モードを用い、認知的アウトカムを測定している。「マルチモーダル」という言葉の概念の違いから、候補研究の分類を容易にするために、モードと方法の類型を作成した。
結果
21件のグループ研究と5件のケーススタディが見つかった。グループ研究では、2つまたは3つの介入方法とそれを実施するための複数の方法が用いられた。利用された介入は、認知的、身体的、心理的、心理社会的、栄養学的、断食、腸の健康、睡眠衛生、ストレス軽減、解毒、ホルモンの健康、酸素療法であった。
5つの個別のケーススタディは、2つの論文に掲載されている。それぞれの個別化された患者の治療では、綿密な評価が行われ、最大9つの異なるモードが処方されていた。21のグループ比較のうち19(90%)では、認知機能の改善、認知症の安定、または認知機能の低下の遅延が報告された。
これらの改善の程度は、臨床的に意味のある変化という意味では様々であった。
結論
マルチモーダルな非薬理学的介入は、認知機能の低下に寄与していると理解されている複数の修正可能な危険因子に対処することで、単一の治療アプローチを補完する可能性を秘めている。
キーワード
認知症、認知、非薬物療法、マルチモーダル、介入、治療、アルツハイマー病
序論
世界で認知症の影響を受ける人の最新の推計は5000万人(Pickett er al)。、 2018)であり、さらに年間900万人が認知症を発症しているとされている(WHO、 2017)。現在のナラティブは認知症の進行は避けられないことを示唆しているが、それは薬理学的試験の結果があまり奨励されていないことに裏付けられている(Cummings、 Morstorf、 & Zhong、 2014)。
しかし、薬効の改善が可能かどうかにかかわらず、認知症の人は他の長期的な疾患を抱えていることが多いため、追加の投薬は既存のレジームとの不愉快な相互作用を引き起こす可能性がある。一方、非薬理学的介入は補完的な治療を提供することができ、認知症患者の転帰を改善するための有用で汎用性の高いアプローチを提供することができる(Olazaran er al)。、 2010)。
認知症患者では多くの能力が影響を受けるが、その主な症状は認知能力の低下によるものである。グローバル認知とは、記憶、実行機能(時間管理、判断、計画)、注意力(目の前のタスクを実行するためにエネルギーを向ける能力、首尾一貫した論理的なパターンにタスクを整理する能力)、言語、コミュニケーションなど、様々な認知機能を包括する広義の用語である。
Clare and Woods (2004)は認知症患者の認知介入(CI)を、認知刺激(CS)、訓練(CT)、リハビリテーション(CR)の3つの基本的なタイプに分類している。Buschertら(2011)によると、特定の認知機能の訓練は、より障害のある参加者にとってはあまり有用ではないが、日常機能の刺激や活性化はより意味があり、成功する傾向があるという。
全体的な研究では、認知機能の改善における認知介入の効果は小さいが一貫しているという証拠が示されている(Alves er al)。、 2013)。さらに、2つ以上のCIの方法を利用することで、認知症の人の認知力を増分的に向上させることができるというエビデンスが示唆されている(Barban er al)。、 2016; Cotelli er al)。、 2014; Lee、 Choi、 Oh、 Sohn、 & Lee、 2016; Panerai、 2016)。
可能性のある別の介入は、日常的な身体運動である(Olazaran et al 2010)。運動は海馬の大きさを増加させ、高齢者の記憶力を改善する(Erickson et al 2011)。例えば、運動を病気を改善する治療法として運動を推奨したAhlskog、Geda、Graff-Radford、Petersen(2011)は、6ヶ月から12ヶ月間運動を続けた後、より良い認知スコアを発見した。特に、高強度の運動介入が有益な認知効果をもたらすというエビデンスがある(Livingston et al 2017)。
18の無作為化比較試験(RCT)に参加した802人の患者を対象としたメタアナリシスでは、有酸素運動と非有酸素運動の組み合わせ(高頻度と低頻度の両方で実施)が認知症患者の認知機能にポジティブな影響を与えた(Groot er al 2016)。
調査に値するもう一つのモードは栄養の変更であり、微量栄養素、ビタミン、抗酸化物質は、疾患の進行を減衰させ(Aliev et al 2013)、ミトコンドリアのエネルギー生産とタンパク質合成を通じて認知を改善するいくつかの証拠を示している(Troesch、 Weber、 & Mohajeri、 2016)。適切な栄養はまた、エピジェネティックな経路を介してADに関連しており、遅発性ADの予防と認知障害の減衰における潜在的な役割を示唆している(Athanasopoulos、 Karagiannis、 & Tsolaki、 2016)。
認知症のリスクを軽減したり、認知症の症状に対処するためには、認知介入、運動、栄養学だけでなく、他にも多くの方法がある。これらのいくつかは、含まれている研究で試みられている一方で、約600の要因がADの発症を増強することができるという新しい証拠から、より多くのものが出てきている(Kostoff、 Zhang、 Ma、 Porter、 & Buchtel、 2017)。
認知症は多因子性であり、生涯を通じて相互作用し、介入するメカニズムによって決定されるというこの理解は、予防へのマルチモーダルアプローチの出現をもたらした(Van der Linden & Juillerat Van der Linden、 2016)。
認知症予防の臨床試験では、マルチモーダルアプローチを用いると、グローバルな認知に臨床的に有意な効果をもたらすためには複数のメカニズムが必要である可能性があるため、リスク因子を低減できることが断言されている(Ngandu er al 2015)。実際、複数の要素を含む活動は、リスクの低減においてより有益であるように思われる(Karp et al 2006)。
これらは相乗効果を発揮する可能性があり、例えば、CT(訓練)を用いた身体トレーニングは、有益な認知効果を誘発する神経可塑性の可能性を促進し(Bamidis et al 2015)、認知機能の低下を抑制し、生活の質(QoL)を向上させる可能性がある(Aliev et al 2013)。
マルチモーダルアプローチのエビデンスには、脳の可塑性、海馬の神経新生、大脳皮質の神経保護効果のための複合トレーニングも含まれている(García-Mesa et al 2011)。例えば、CurlikとShors(2013)は、身体的なトレーニングに続いて精神的な学習を成功させる組み合わせは、どちらかの活動を単独で行うよりも、神経細胞のリクルートと全体的な精神的健康に有益であることを発見した。
さらに、Gomez-Pinilla(2011)によると、食事因子と組み合わせた運動は、エネルギー代謝の管理および認知のシナプス可塑性に関連する分子イベントに影響を与える可能性がある。Köbeら(2016)は、有酸素運動とCSを組み合わせたオメガ3脂肪酸の摂取が、軽度認知障害(MCI)患者のAD関連脳領域の萎縮を防ぐことを発見した。
マルチモーダルアプローチの出現を考えると、すでにいくつかのレビューが行われている。Rodakowski、 Saghafi、 Butters、 and Skidmore(2015)は、認知症の初期段階の認知症において、認知運動と身体運動の組み合わせによる選択された認知能力の小さな改善を発見した。Law、 Barnett、 Yau、 and Gray(2014)は、認知機能障害のある高齢者を対象に、認知機能と運動トレーニングを組み合わせた5つの研究のうち4つの研究で、有意な認知機能の改善が見られた。しかし、Rodakowskiら(2015)のスコピンピングレビューでは、さまざまな認知機能障害を持つ成人を対象としていた。Lawら(2014)は、認知障害のある成人とない成人の運動と認知刺激のみを調べた。したがって、現存するエビデンスをより包括的に理解する必要がある。
文献の中で3つのギャップが確認されているため、本レビューは時宜を得て関連性のあるものとなっている。第一に、認知症治療のための非薬理学的介入への関心が高まっている一方で、認知症患者における複雑な介入の効果についてはほとんど知られていない。
第二に、主観的認知機能障害(SCI)やMCIの患者に対するエビデンスは存在するが、認知症の患者を対象とした研究では、測定された認知アウトカムに関するエビデンスが不足している。第三に、上記2つのように特定のモダリティの組み合わせを対象としたレビューはあるが、可能性のあるすべてのモダリティの組み合わせを対象とした完全なシステマティックレビューは行われていない。その結果、本レビューでは、認知症患者の認知機能を改善するためのマルチモーダル非薬理学的介入(MNPI)のエビデンスを総合的に示している。
方法
検索戦略とスクリーニング
系統的な査読付き文献の検索は、PubMed、 PsycINFO、 Medline、 Scopus、 EMBASE、 Cochrane Database of Systematic Reviews、 CINAHL、 LILACS で行った。検索語は、認知症、アルツハイマー病、認知機能障害、マルチモーダル、治療、介入、活動、プログラムのバリエーションなどで、各データベースに合わせて検索した(オンライン付録1)。グレー文献は、論文、学位論文、政策文書、会議の議事録なども検索した。
タイポロジーの開発
エビデンスでは、「マルチモーダル」介入を説明するために複数の用語が使用されている。このレビューでは、研究がどのように多くのモードを利用しているか、したがって研究が含まれているかどうかを決定するために分類システムが必要とされた。Choi and Twamley (2013)とClare and Woods (2004)のカテゴリーに基づいて、3つの初期モードが導き出された。
- 認知機能強化療法(CS、CT、CR、非侵襲的脳刺激)
- 身体的介入(身体運動、身体的・作業的リハビリテーション)
- 心理学的・心理社会的療法(アート、音楽、ダンス、認知行動療法(CBT)、園芸療法(HT)、心理療法、レクリエーション活動、ボランティア活動など)
タイトルと要旨のスクリーニングから、さらに7つのモードが浮上した(表1参照)
表1. 認知症介入のためのモードと方法の類型-概要
モード /方法
- 1. 認知機能強化療法(Choi & Twamley、 2013; Clare & Woods、 2004
- a. 認知療法、刺激、リハビリテーション、トレーニング(CST、ROT、RT、CR、CSPR、CT、BT、DT、GRT、MT
- b. 非侵襲的な脳刺激
- 2. 物理的な
- a. 身体運動(HIIT、AE、ST、DT
- b. 身体・作業リハビリテーション(OT、PT、KT、IPP、PE
- 3. 心理学的・心理社会的療法
- a. アート、音楽、演劇、ダンス&ムーブメント、CBT、HT、STH、PMT、アーツ&クラフト、個別活動、レクリエーション活動、スピリチュアルな要素、コミュニティ活動、ボランティア活動
- 4. 栄養とダイエット
- 5. 睡眠衛生
- 6. ストレスの軽減 ・瞑想など
- 7. 解毒-サウナなど。
- 8. ホルモンの健康
- 9. 酸素療法-高気圧、間欠的な低酸素の訓練(IHT)、酸素の吸入
- 10. 伝統的な中国医学 ・鍼治療、ハーブ
含有基準
すべての研究は以下の包含基準を満たしていた。
- 認知症の一次診断を受けた高齢者が関与していること。
- 少なくとも2種類の非薬理学的介入が行われた。
- 認知機能の変化がアウトカム指標であった。
- どのような研究デザインまたは設定であってもよい。
- サブグループ分析(例:認知症の個人)が可能な場合は、参加者グループ(認知症、MCIなど)が混在している研究。
- 任意の日付の英語。
除外基準
- 認知症のせん妄、疼痛、失禁、行動・心理的症状(BPSD)を具体的に取り上げた。
- 2つのモードのみを取り上げ、そのうちの1つがケアスタッフや家族介護者への訓練、知識、支援を提供した場合。
- 1つのモードは薬理学的治療であった。1つのモードは薬物療法であった(研究前に参加者が安定した量の認知症治療薬を服用していた場合は除外されなかった)。
(頭字語と略語のリストはオンラインの付録4に掲載されている)
勉強の選択
タイトル・要旨の段階で、筆頭著者(GC)が97件の候補研究を選定した。他の著者(CM と JS)は 10%の研究をチェックし、意見の相違があれば議論して解決した。図 1 に検索、スクリーニング、選択のプロセスを示す。チームは介入のモードと方法について協議した。最初に24編の論文(27編のグループ研究またはケーススタディ)が掲載され、最終的に10のモード(表1)でタイポロジーを完成させた。モードと方法の詳細な説明については、オンラインの付録2を参照のこと。

図 1. 検索、スクリーニング、選択プロセスのフローチャート。
対象となった研究を、その介入様式とともに表2に示す。
表2. 対象となった研究とそのモード。
原文参照
グレー文献を検索したところ、マルチモーダルアプローチを含む認知症の非薬理学的治療に対する一般の人々や実務家の関心が高まっていることが明らかになった。しかし、グレー文献からの調査結果は、本研究に含まれる基準を満たしていなかった。
品質評価
質的研究と量的研究の両方がレビューに含める資格があることから、査読付き文献の質の評価には、質的研究、量的研究、混合法研究を 1 つの尺度で評価できるようにするための混合法評価ツール(Mixed Methods Appraisal Tool、MMAT)を利用した(Pluye er al)。、 2011; Souto er al)。
推奨されるカットオフスコアを 25%以下とすることで、質の低い論文をさらなる分析から除外した。この段階では、24 本の論文のうち 1 本(Jian、 1999)が除外され、全 23 本となった(オンライン付録 3:質の評価参照)。
データの合成と分析
対象となった研究は、1つの優勢な特徴を持っており、それらの研究をまとめて合成することができることがわかった。介入モードが主に認知的(治療、刺激、リハビリテーション、または訓練)であった10件の研究を表3に示す。さらに、介入が主に身体的なもの(運動、職業、リハビリテーション、または栄養)であった10件の研究を表4に示す。
最後に、介入モードが臨床または研究環境での個別化された治療であった2件のケーススタディ論文(合計5件の個別ケーススタディ)を表5に示す。研究の特徴は、著者と年、サンプル、研究デザイン、介入モードと方法、設定、研究の長さ、頻度、関与した時間である。
表3. 研究の特徴 ・認知。
原文参照
表 4. 研究の特徴-身体的。
原文参照
表 5. 研究の特徴 ・個人化された治療 ・1のN.
原文参照
参加者と設定
韓国(4)、米国(4)、イタリア(3)、スペイン(3)、ブラジル(3)、ドイツ(2)、中国(1)、ポルトガル(1)、シンガポール(1)の研究であった。グループ研究の参加者数は14人(Maci et al 2012)から 206人(Ibarria et al 2016)で、平均は58人、年齢は54~93歳であった。2件の症例研究では、54~78歳の認知症患者5人について報告された(Bredesen et al 2016a; Prokopov、2010)。
参加者は合計1、178人で、そのうち6件の研究では388人が長期療養(介護施設または精神科病院)で生活し、16件の研究では790人が自宅で生活し、デイサービスに通うか、数週間の入院をしていた。2件の研究(Onor et al 2007年;Viola et al 2011)では、介入期間中に介護者が参加者として参加した。
薬理学
一部の参加者グループは、研究の前および研究中にメマンチン、コリンエステラーゼ阻害薬および/または抗うつ薬を安定した用量で服用していたが、参加者が薬物を服用していないと宣言した研究はなかった。
認知症症状の根本原因に対処することを目的とした個別化された治療プログラム(Bredesen et al 2016;Prokopov、2010)では、特定の不均衡に対処するために、バイオアイデンティフィックホルモンなどの医薬品の補助薬が処方されていた。
研究デザイン
方法論は質的研究と混合法研究を包含するように設計されていたが、包含基準と質的基準を満たしたすべての研究は、デザインで定量的であったが、非常に異質であった。すべての研究が事後試験を実施していたが、RCTは11件(48%)のみであった(品質評価84%)。さらに5つは非ランダム化(QA 100%)、7つは定量的記述的(QA 100%)であった(オンライン付録3の品質評価を参照)。
Hanら(2017)は唯一の二重盲検またはクロスオーバー試験であった。3つは複数のセンターにまたがって実施された。ドイツの老人ホームを対象としたGraesselら(2011)とOswald、 Gunzelmann、 and Ackermann(2007)、スペインの日帰り病院を対象としたSerdà i Ferrer and del Valle(2014)である。すべての研究の特徴については、表3~55を参照のこと。
介入モードと方法
LiとLi(2017)は認知的モードを持たず、Prokopov(2010)とVicente de Sousaら(2017)は認知的モードも身体的モードも持たなかったが、他のすべての研究は両方を持っていた。心理学的モード、心理社会的モード、精神運動的モード、精神的モード、介護者モード、支援モードを欠いていたのは4名のみであった。
1件は酸素療法を用いた(Prokopov、 2010)、3件は食事と栄養および/または絶食に取り組んだ(Bredesen、 2016; Prokopov、 2010; Vicente de Sousaら、 2017)。4つの研究は、’マルチコンポーネント’または’デュアルタスク’と呼ばれるモードを同時に組み合わせたもので、2つの列にまたがる表4に示されている。
研究の中で利用された方法は、主要なモードの創造的な可変性を示している。認知モード(表3)には、セラピー、刺激、リハビリテーション、トレーニングなどの方法が含まれている。身体的モード(表4)には、運動、職業、リハビリテーション、栄養などの方法が含まれている。表5は、個別化された治療介入に見られる複数の方法を明らかにしている。
研究期間
グループ介入の長さは20分(Yoon et al 2013)から8時間(Ibarria et al 2016)までであった。最も短い期間は3週間であった(Vicente de Sousa et al 2017)が、Arkin(2007)はファシリテートされた介入を最大4年間継続した。パーソナライズされたN-of-1治療は24ヶ月間、診療所の受診を通じて追跡調査された(Bredesen et al 2016)。
認知症のステージとタイプ。軽度認知症の参加者が7件、軽度~中等度の参加者が11件、軽度、中等度または重度の参加者が3件、中等度~重度の参加者が1件含まれていた。12の研究ではADが含まれていたが、10の研究では特定されていない認知症や混合型の認知症が含まれていた。La Rue、 Felten、 and Turkstra(2015)による研究では、MCIの参加者の8%(N = 5)が含まれていた。参加者の90%以上が包含基準に適合しているため、この研究を含めることが決定された。
アウトカム尺度
認知評価については、複数のツールが利用された。主に、21の研究でMMSE(英語、韓国語、中国語版)、9つの研究でClinical Dementia Rating(CDR)、5つの研究でADAS-Cog(アルツハイマー病評価尺度の認知サブスケール)またはADAS-K(韓国語版)が使用された。他の14の尺度は1回または2回使用した(詳細は表6参照)。
21件のグループ研究のうち、17件(81%)では、Mini Mental State Examination(MMSE)、中国語MMSE、7MST(7 Minute Screening Test)を用いた試験後のスコアが報告されており、効果量(効果量)分析に含めることができた(図2)。Oswaldら(2007)は、入居者の認知変化に関するスタッフ調査を独自に取り入れている。
5件のケーススタディでは、試験前のMMSEまたはそれに類するものを提供したのは3件のみであり、臨床的重要性の比較の妨げとなった(図4)。Bredesenら(2016)の症例研究では、磁気共鳴画像法(MRI)およびフロロデオキシグルコース(FDG)陽電子放射断層撮影法(PET)スキャン、代謝検査、定量的神経心理学的検査、遺伝学的検査、認知検査を含む10以上の機器が報告されている。
これらの症例研究のうち3件は試験前のMMSEを報告していたが、1件(患者9)はモントリオール認知評価(MoCA)を報告しており、効果量分析ではMMSEの代わりとなっていた。興味深いことに、臨床的に重要な違いを示した4つのグループ研究はすべてMMSEのみを使用していた(図3)。
図2. グループ内効果量-介入群。

図3. MIDに関するNICEガイダンスに従ったグループ研究のMMSE変化の評価。
表6 認知アウトカム-有効性
原文参照
図4. MIDに関するNICEおよび非UKガイダンスに従ったケーススタディMMSE(またはMoCA)の変化を評価する。
所見
全26件(69%)のうち18件のグループ研究またはケーススタディでは、グループ内での認知の改善が統計的に有意または有意義であると報告されている(Baglio et al 2015; Bredesen et al 2016; Burgener、 Yang、 Gilbert、 & Marsh-Yant、 2008; Christofolettiら。2008; Coelho et al 2013; Han et al 2017; Kang et al 2010; Kim et al 2016; Li & Li、2017; Onor et al 2007; Oswald et al 2007; Prokopov、2010; Raggi et al 2007; Tay、 Lim、 Chan、 Ali、 & Chong、 2016; Yoon et al 2013)。
スコアの安定性または低下の減衰は、6つのグループ研究で報告されている(Arkin、 2007; Graesselら、 2011; Ibarriaら、 2016; La Rueら、 2015; Maciら、 2012; Violaら、 2011)。Serdà i Ferrer and del Valle(2014)とVicente de Sousaら(2017)の2つのグループ研究では、認知機能の改善は見られず、継続的な低下が報告されている。認知アウトカムを表6にまとめた。
(1) 何が効いて何が効かないのか(有効性の予測因子)のエビデンスは?
各介入群の効果量を評価した。ポスト前比較の計算にはCohenの効果量、dを用いた(Cohen、 1988)。認知症研究では、介入を行わない場合、対照群の認知が低下する傾向がある。そのため、評価期間の終了時に群間の効果量を報告している研究では、対照群が減少していることもあり、結果的に特定の治療や介入の効果を誤解を招くような過大評価をしてしまう可能性がある。
したがって、我々はまず、対照群で悪化する傾向によってインフレートされていない計算されたスコアで、どの介入が効いたかを識別するために、グループ内の効果量(図2)を調べることにした。
受け入れられた基準(0.2-小、≤0.5-中、≤0.8-大)(Cohen、 1988)を用いて、この分析では、効果量に適した17の研究のうち、2つの研究が大きな効果量を持っていたことが示された(Christofoletti er al)。 2008; Li and Li、 2017)、4つの研究は中程度の効果量を有しており(Onor et al 2007; Raggi et al 2007; Tay et al 2016; Yoon et al 2013)、5つの研究は小さい効果量を有していた(Burgener et al 2008; Graessel et al 2011; Han et al 2017; Ibarria et al 2016; La Rue et al 2015)。
さらに6つの研究では、疾患経過を反映した陰性の効果量が示された。興味深いことに、従来の推論的検定に基づいて、「グローバル認知は治療によって改善しなかった」と報告した1つの研究は、最大の効果量(d = 0.909)を有していた(Christofoletti et al 2008)。
pubmed.ncbi.nlm.nih.gov/18586813/
以下の4つのグループ研究は、以下の理由でこの分析から除外された。Coelhoら(2013)は、前頭葉機能を評価し、前頭葉認知症をADと区別するために設計された前頭葉アセスメント・バッテリー(FAB)を使用した(Slachevsky et al 2004)。Kimら(2016)は、正の平均スコアの変化を示すグラフを提供した。Kangら(2010)は変化スコアの中央値を提供し、Baglioら(2015)はグループ内分析のための指標を提供していない。
変化を解釈する上で同様に重要なのは、臨床的に重要な最小の差(MCID)(Burback、 Molnar、 St John、 & Man-Son-Hing、 1999)であり、臨床医が重要であると認識するアウトカムにおける最小の変化として定義されている。ADAS-Cogは70点満点のスケールで、スコアが低ければ改善を示す。ADAS-Cog尺度で4点以上の変化があれば、軽度から中等度の認知症のMCIDとなる(Huntley、 Gould、 Liu、 Smith、 & Howard、 2015)。繰り返しになるが、介入群のデータを具体的に見ると、2つの研究でADAS-Cogの改善が報告されているが(Graessel et al 2011年;Han et al 2017)、臨床的には重要ではない。
MMSEは30点満点の尺度で、スコアが高いほど改善を示し、少なくとも3点の変化は北米では臨床的に重要と考えられている(Burback et al 1999年;Qaseem et al 2008)。英国の英国国立医療技術評価機構(NICE)ガイダンス(NICE、 2018)に準拠した研究を評価するために、1.4のMinimal Important Difference(MID)も評価されている。
したがって、4つのグループ研究(Christofoletti et al 2008年;Li & Li、2017年;Raggi et al 2007年;Tay et al 2016年 (図3)では、平均MMSEの変化がNICEの閾値である最小の重要差を超えていることが報告された(図3)。しかし、グループ研究からの介入群のアウトカムでMMSEが3ポイントのMIDに達したものはなかった。
これらの4つの研究に加え、さらに2つのグループ研究が、効果規模分析(図2)において「良好」または「中程度の有効性」として同定された。表7は、これらの上位6件の研究と、それらの研究で使用されたモードおよび方法を示している。
表7. 最も効果的なグループ研究の上位6件
原文参照
2件の症例研究(Bredesen et al 2016)(P6およびP7)では、平均MMSEがNICEガイダンスのMIDを上回る変化が報告された。また、両症例研究とも非UKのMIDを3ポイント上回っていた。さらなる症例研究(Bredesen et al 2016)、患者9は、有意に正の相関を示すMoCA上のMIDを報告し(Stewart、 O’Riley、 Edelstein、 & Gould、 2012)、比較のためにMMSEに変換可能であった(Trzepacz、 Hochstetler、 Wang、 Walker、 & Saykin、 2015)。患者9は、NICEガイダンスによると臨床的に重要な改善を示した(図4)。
以下の図4のMMSEまたはMoCAを使用した3つの症例研究の他に、さらに2つの症例研究が含まれる論文で報告されている(Bredesen et al 2016;Prokopov、2010)。個別化されたN-of-1治療を提供する場合、マルチモーダル介入の有効性は、MRI、FDG PETスキャン、CVLT-IIB、および多数の代謝学的および神経心理学的検査を含む様々な評価指標を通じて臨床家によって決定された。これらは、これらの2人の患者の臨床的に重要な検査前の結果を報告している(表8)。
表8. ケーススタディ-臨床的に重要な違いを示す認知評価
スペイン MRI、詳細な生物医学的病歴、生活習慣調査、約1年間の精神衰弱、記憶力の低下、低エネルギー、低質の睡眠、興味・意欲の喪失、通常の活動や家事ができなくなった、補聴器なしでは聞こえなくなった、中等度の高血圧の過去の病歴がある。
KG氏は 2008年2月脳磁気共鳴画像検査(MRI)海馬と皮質の萎縮、心室容積の拡大 2009年4月MRIでは変性変化は認められなかった。 最初の5回の間欠的低酸素療法(IHT)セッションで、気分や活力の改善が顕著に見られた。徐々に精神状態と認知状態が回復した。
IHT療法 → https://www.hospitals-management.com/articles/intermittent-hypoxia-therapy
患者は、エネルギーと活動性の増加、記憶力と認知力の向上、わずかな体重減少、睡眠の改善、気分の改善を報告した。患者さんは徐々に健康な精神状態を取り戻し、買い物や料理を再開し、前年にはできなかったピアノを弾くようになった。数ヶ月前までは一日中補聴器を使用していたが、現在では一日に数時間しか補聴器を使用していない。
これらのケーススタディでは、以下のモードと方法を用いた(表9)。
表9. ケーススタディ ・方法と方法
研究 個人に合わせた治療介入 その他の方法 方法
Bredesenら(2016)米国MENDプロトコル ・栄養(食事、ビタミン、サプリメント、ハーブ、抗酸化物質)絶食代謝パラメータの最適化、反復治療、代謝特性の評価を継続的に最適化;睡眠ストレス 運動 脳刺激 ホルモン GI健康 解毒 睡眠衛生、ストレス軽減、エアロビクス、筋力トレーニング、脳トレーニング、ホルモン療法、経鼻的血管作動性腸管ペプチド(VIP)、重金属毒性への対応
Prokopov (2010) スペイン 間欠的低酸素トレーニング(IHT)の反復セッション 患者はリクライニングチェアでリラックスし、細胞とミトコンドリアはpO2の複数の振動を経験する。間欠的酸素制限(IOR)は、ゲノムの完全性をサポートする複数の代償戦略を迅速に誘発する普遍的な刺激である。 栄養調整個別化されたビタミン、アミノ酸、マイクロエレメンツ、サプリメント 絶食 低血糖指数、低炭水化物、動物性タンパク質&オメガ3脂肪酸で濃縮されたケトジェニックダイエットを食べることをお勧めする。断食プロトコルにアドバイス:18時間に生理的な夜の断食時間を延長するために6-7時間のウィンドウ内に食品の摂取量を制限する。
(2) マルチモーダルは重要か?
肯定的な認知効果量を示した11の研究(図2)のうち9つが2つではなく3つのモードを使用しており、より多くの方が良いかもしれないことを示している。しかし、モードの数だけでなく、モードを実施するために用いられた方法の数も複数あり、多様である。
例えば、Ibarriaら(2016)は、認知機能、運動、気分に関連したリハビリテーションと認知機能への刺激を統合したIntegral Psychostimulation Program(IPP)を開始した。彼らはまた、運動(能動的・受動的体操、個人&空間志向、運動協調、身体言語)、音楽療法、リラクゼーション、ADLを維持するための作業活動、表現力、創造性、ボードゲーム、介護者の関与などを用いた。
また、介入の焦点や全体的な特徴(主に認知的か身体的か)は、認知モードの有効性を決定するのに役立った。例えば、否定的な効果量を示した6件の研究のうち5件は、主に身体的なものであり、他のモードも加えられていた。逆に、肯定的な効果量を示した11件の研究のうち8件は、他のモードを加えた認知的なものが優勢であった。
(3)認知症の人のグループ(初期、中期、後期)ごとに異なるエビデンスは?
参加者群の認知機能障害のレベルを分析しても、介入が必ずしも認知機能障害の最も低い人や最も障害の高い人に効果があるということは示されていない。効果量が最も高かった6つの論文では、軽度から重度までの認知症の範囲があった。
実際、2番目に優れた効果量を達成したのはLiとLi(2017)で、参加者グループの82%が介護施設で中等度から重度の認知症であった。Arkin(2007)は、初期段階の参加者のほとんどがテストのスコアを改善または維持する傾向があったが、時折中等度段階の人も同様の傾向があったことを発見した。
Graesselら(2011)は、介護施設では、軽度から中等度の患者(n = 50)のサブグループでは、介入のための効果量が大きいことを示した。Raggiらの研究(2007)では、30%の軽度患者、40%の中等度患者、30%の重度患者を対象にして、すべての認知症の段階の被験者が治療プログラムに参加することで何らかの改善を示したと結論づけている。
Kimら(2016)の介護施設入所者を対象とした研究では、多成分認知プログラム(MCP)とともに身体運動(Kohzuki Exercise Program ・KEP)を実施することで、中等度から重度の認知症の改善が報告されている(KEP+MCP)。
予想通り、セルダーイ-フェレールとデーバジェの(2014)の研究では、プログラムの効果の大きさは、病気のステージに関連して徐々に減少したことを報告した。実際、軽度(29.69%)、中等度(31.25%)、重度(39.06%)の認知症の日帰り入院患者では、認知能力の低下が最も顕著であった。
したがって、参加者の認知症の病期が介入群の効果量に直接関係しているとは考えられないが、認知症の異なる病期の参加者に対する介入の最適化のレベルに関係していると考えられる。利用可能な研究データを考えると、異なるタイプの認知症の可能性については結論が出ていない。
(4) これらのアウトカムを検証するために用いられた異なる研究デザインの長所と限界は何か?
臨床的に最も重要な認知的差は、ケーススタディデザインで達成された。一方、効果量が陽性であった11のグループ研究のうち7つは無作為化デザインであり、これにより、モードは個人に特化して選択されるのではなく、コホート全体で選択されていた。
しかし、最も効果的なグループ介入では、個人に合わせたアプローチも明らかであったため、これがアウトカムに悪影響を及ぼすことはなかった。例えば、Christofolettiら(2008)、Li and Li(2017)、Raggiら(2007)、Tayら(2016)は認知症の人に合わせた介入や個人セッションを行っているが、Burgenerら(2008)、Ibarriaら(2016)、La Rueら(2015)、Onorら(2007)は介護者の関与の要素を加えている。
セッションのデザイン(週当たりの分数、セッション数)では、時間と効果の間にほぼ逆のパターンが見られた。最も効果があった6件の研究では、参加者に必要とされた時間は24週間以下であった。より長い時間を必要とする研究では、効果が低かったものもあった。例えば、Graesselら(2011)は最も多くのセッション(288)、Oswaldら(2007)は最も多くの週数(52)、Ibarriaら(2016)は最も多くの総拘束時間(979時間)であった(概算、表3参照)。
クロスオーバー試験の性質上、ウォッシュアウト期間の長さ、Hanら(2017)の介入期間が8週間と比較的短いことから、これらがMultimodal Cognitive Enhancement Therapy(MCET)の効果を制限している可能性があることを認めている。認知症サブグループでは小さな効果量を達成しているので、全体的な効果量は研究期間が邪魔しているだけで、もっと長い研究の方が効果的だったのかもしれない。
環境を分析したところ、最も効果的な研究の上位4つのうち3つは介護施設や長期療養病院で実施されていたのに対し、否定的な効果量を示した研究の83%は、セッションには参加したが自宅で生活している人を対象としたデイケア、デイケア病院、大学施設、研究センターで実施されたものであった。
研究デザインについてもう一つ、Serdà i Ferrerとde Valleの研究(2014)では、高い識字能力を持たない高齢者の参加者には混合法のデザインの方が適している可能性が示唆されている。
(5) アウトカム指標の長所と短所は?
アウトカム指標の選択は研究によって様々であった(表1参照)が、統計的に有意な知見が得られやすくなった可能性がある。また、MMSEのようなスクリーニングテストの中には弱点があるとよく報告されているものもある(Stewart et al 2012年;Verma et al 2015)。
しかし、少なくともいくつかの定量的な分析を容易にするために、よく知られた方法を使用することには価値があった(図2-toto-4)4)。研究は大部分が異質であり、個々の研究に必要な要件は試験された介入によって異なっていた。したがって、異なる尺度の相対的なメリットについての結論は得られず、多因子研究に特化した更なる研究が必要である。
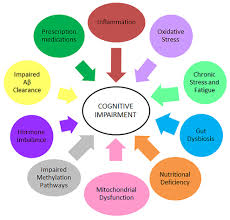
(6) 各介入のモードに対する変化の可能性の高いプロセスに関する理論の証拠は何か?
本研究で用いられた10の介入モードのうち、「はじめに」で紹介したモード(運動、特に高強度運動、認知刺激、栄養)以外は、認知症患者の認知機能の改善とこれらのモードの有効性を相関させた一次研究のエビデンスが不足している。
しかし、アルツハイマー病は複数の病態生理学的因子が関与していることが示されており、身体的、精神的活動や運動は脳血流(CBF)を正常化し、調節し(Aliev et al 2013)、海馬の神経可塑性と相関する脳由来神経栄養因子(BDNF)の産生を促進する(Colcombe et al 2006; Erickson et al 2011)。
特に有酸素運動は、神経新生および血管新生の増加、ならびにBDNFおよび細胞生存、ニューライトの伸長およびシナプス可塑性の促進などの神経保護に関与する他の成長因子の産生と関連している(Cramer et al 2011)、およびデオキシリボ核酸(DNA)を酸化的損傷から保護し、ミトコンドリアを若返らせる(Garatachea et al 2015)。
認知活動は神経細胞の可塑性と認知予備能を高め、不足すると認知症の認知機能の低下を早める(パネライ、2016)。’我々がfMRIで見た変化は、AD脳でもまだ可塑性のリソースを持っていて、ポジティブな環境刺激に反応することができるという考えを支持している’とBaglioら(2015)は述べている。
ストレス解消、瞑想、リラクゼーションはコルチゾールを低下させ、炎症を減少させ、BDNFを増加させた。瞑想の効果はCBFに有意な変化をもたらした(Khalsa、 Amen、 Hanks、 Money、 & Newberg、 2009)。重金属やカビなどの神経毒は認知機能の低下と関連しており、その後、例えばサウナやキレーションによる解毒によって除去されている(Bredesen、 2016; Shoemaker & House、 2006)。
ホルモンバランスは甲状腺機能を最適化し、性ホルモンを調整する。睡眠障害や障害は、神経細胞の経路を乱し、ワーキングメモリを損なう可能性があり、認知障害につながり、認知症の重要な危険因子である(Miller、 2015)。
DNAメチル化、ヒストン修飾、マイクロRNAはADの病態生理に関与する主要なエピジェネティックメカニズムであるため、特に脳の運動やフィジカルトレーニングと組み合わせた場合、栄養が認知症の発症を予防し、認知機能の低下を減衰させることができるという議論もある(Athanasopoulos et al 2016)。
食事因子は、エネルギー代謝とシナプス可塑性の細胞レベルで運動の作用を補完することができる(Gomez-Pinilla、 2011)。上記の介入の変化のプロセスに関するエビデンスベースの高まりを考えると、複数の機能不全を同時にターゲットとし、栄養療法、植物療法、刺激療法を重視したマルチモーダルアプローチが最も有益であるかもしれない(Wollen、 2010)。
(7) MNPIの認知機能改善に対する有効性を評価するために用いられているさまざまな評価ツールの長所と限界は何か。
Kimら(2016)では、中等度・重度のADを有する介護施設の参加者は、KEP+MCP群では、MMSEとCDTでMCP群と比較して、6ヵ月後に有意な改善は見られなかった。しかし、ADAS-Cogスコアは同時点で有意な改善を示しており、これは変化を検出する感度の高さと関連している可能性がある。
MMSEは、この相対的な能力の欠如について広く批判されている。実際、Ibarriaら(2016)はまた、認知はMMSEでは安定しているが、ADAS-Cogではわずかに低下したと報告している。2つの研究ではFAB(可能性のあるスコア18、それ以上のスコアは改善を示す)を使用している。研究間の異質性が非常に多いため、異なるツールの長所と限界は不明である。
(8)認知症と診断された人の認知機能改善のためのMNPIの有効性について、異なる提供方法の有効性はどのようなものであろうか?
異なるモードでは、他のモードよりも効果が現れるまでに時間がかかる場合がある。例えば、Vicente de Sousaら(2017)は、21日間の栄養補給による精神運動リハビリテーションプログラム(NSPRG)を調査した。しかし、このレビューで分析した研究の91%(N = ? )でテストスコアの改善が認められたことからも明らかなように、認知的利益はより長い介入を必要とするかもしれないが、そのすべてが21日を超えていた。最も効果的なグループ研究の中には、介入に個別化された側面が含まれているものもあった。
Christofolettiら(2008)(d = 0.909)は、筋力、バランス、認知を刺激する特定の運動療法を中心とした個別の理学療法セッションを提供した。この研究では、認知機能の低下、特に言語流暢性と実行機能の減衰が観察された。LiとLi(2017)(d = 0.497)は、好きな民謡の歌唱練習など、好きなことや好みに応じて週2回30分の個人セッションを提供した。
Tayら(2016) (d = 0.457)は、個別化された30分間の活動を提供した。さらに個別化されたアプローチは、Raggiら(2007)(d = 0.245)に見られ、専門病院のユニットでの包括的なリハビリテーションプログラムを例示している。この研究は全体で17ヵ月間行われたが、平均在院日数はわずか26日で、神経学的検査や検査室での分析を含む徹底的な調査から始まり、各人の統合的、支持的、個別化された治療が行われた。
要約すると、本レビューでは、主にスペイン、ポルトガル、米国、イタリア、アジアでマルチモーダル介入研究が行われていることがわかった。集団研究は一般的に2-3の方法で行われ、長期療養、デイケア、診療所、病院、大学施設、または地域社会で行われた。
ケーススタディの数は非常に少なく、最大9つのモードを利用したものが見られた。研究期間は3週間から4年間で、セッションは20分から8時間であった。最も効果的な6つの研究では、参加者の所要時間は24週間以内であった。認知症の全段階の人が参加しており、介護者が参加している研究もあった。
考察と意味合い
本レビューの結果は認知症治療に重要な意味を持つものであり、含まれる研究の92%(24/26)が統計的な改善、安定性、低下の減衰を示した。
参加者や患者の個々のニーズを特定し、それに応じて介入を調整することで、マルチモーダルアプローチをパーソナライズした研究では、最大の効果量が得られた。
これらの知見は、脳刺激(Raggi、 Tasca、 & Ferri、 2017)、酸素療法、解毒、ストレス軽減、睡眠衛生、ホルモンの健康、絶食、栄養などの新しい治療法に加えて、認知症に対する認知療法、身体療法、心理療法などの複合的なマルチモーダル介入の広範な研究を奨励すべきである。いくつかの検討事項が浮かび上がってきた。
研究期間の長さ
マルチモーダルまたは「複雑」な介入には、特定の設計指針を必要とする相互作用のある構成要素が含まれる(Craig er al)。 マルチモーダル介入を設計する上で困難なことの一つは、異なる効果が個人に影響を与える様々な期間を考慮に入れることである。最も短い研究(Vicente)では効果量が最も小さく、最も長い研究のうち4つでは認知の維持が認められたため、研究の長さが効果量の指標となるかどうかを検討した。
Raggi、Han、Tay、Li、Li and Kangの結果から明らかなように、介入期間の長さは有効性の指標にはならないことがわかったが、いずれも4ヵ月未満の期間であった。Vicenteは主に栄養学的介入であり、認知への影響も評価していたので、研究期間が短ければ認知的に非生産的であることが証明されたとしても不思議ではない。同様に、Onorら(2007)の場合には、 “認知機能の改善の欠如があった。..おそらくリハビリテーションプログラムの短い期間のために”(p. 268)。
効果の大きさ対利益
認知のような1つのモードだけの測定可能な改善を見てマルチモーダル研究を見直すと、研究の成功や認知症の参加者にとっての介入の利点について誤った仮定をしてしまうことがある。その例としてArkinの研究(2007)があるが、この研究では介入群の中で最も効果量が低かった。にもかかわらず、プログラムの1年目の11人の参加者は、機能の維持、つまりいくつかの談話尺度の改善を達成した。この研究では、3年目から4年目までの年間の低下率をわずか1ポイントに抑えることにも成功しており、これはCERADの比較対照群よりも有意に低かった。したがって、未治療集団の急激な衰退と比較すると、わずかな衰退が恩恵をもたらす可能性がある。
ホリスティックなアプローチ
認知症は多くの危険因子が関与しているという点で多因子性を持っているため、様々な症状に対処するためには、全人的なアプローチで治療を行うことが最善の方法であると考えられる。これは、少なくとも現在設計されているマルチモーダル介入の前提であり、どの要素が認知機能の低下を遅らせたり逆行させたりするのに役立ったのかを解明することはできない。
ポジティブな感情、楽しみ、創造性、信念、スピリチュアリティさえも、例えば運動や食事と同様に認知に寄与しうる。Onorら(2007)は、社会化そのものが改善につながる可能性があり、「個人に対してより総合的なアプローチをとるプログラムは、認知リハビリテーションのみに焦点を当てたプログラムよりも効果的である」と報告している(p. 270)。Maciら(2012)は、認知刺激、身体活動、社会化を統合したアプローチで情動の低下を遅らせ、介護者の負担を軽減することで、これを反響させた。
評価ツール
複数のツールが報告されていることから判断すると、ポジティブな結果が得られることを期待して多くのテストが実施されているという結論に飛びつくかもしれない。しかし、マルチモーダル研究では、多数のテスト、つまり各モードのための完全な組み合わが必要である。これにより、介入が認知の改善に役立っているかもしれないさまざまな方法について、より多くの洞察を得ることができる。しかし、テストは参加者の負担にもなり、脱落を促す可能性もある。このように、マルチモーダル研究においては、さまざまな評価ツールの長所と限界を分析することが急務となっている。
最近、Websterら(2017)は、MMSEのような認知測定は認知症の人やその介護者にとって苦痛であり、以前の能力との関連性を考慮した認知を好む人にとっては落胆させてしまう可能性があることを発見した。
具体的な測定値をより大きなパッケージにすれば、個人の全体像を把握し、より詳細な情報を得ることができる」(p. 13)と考えられ、MMSEやADAS-Cogなどの推奨されている有効な測定値とともに、認知処理速度を推定する時間的な測定値も検討されるべきであると考えられた。
これに沿って、研究では、脳脊髄液バイオマーカー、血液検査、代謝分析、さらに詳細な物語性評価など、さまざまな検査が報告されている。ある論文(Oswald et al 2007)では、別の情報提供者からのデータ、すなわち、入居者の認知能力と機能的能力の変化に関する看護スタッフへの質問票が含まれていた。
今後の研究では、母集団のサンプルに関連した様々な検査を使用することが推奨され、また、標準化された、無料で広く利用可能な、検査前の評価のための手段を使用することが推奨されている。
例えば、CDRグローバルスコアは、今後の研究では、ステージングまたは変化の印象のアウトカム指標として推奨されている(Webster et al 2017)。また、Short Cognitive Test (SKT)は、MMSEよりも「微妙な変化に敏感」であることが知られている(Viola et al 2011)。
研究デザイン ・薬理学と自然主義。このレビューでは、非薬理学的アプローチを探し、選択し、焦点を当てたが、疾患モデルが認知症の可能性の高い経過を予測する能力を向上させているため、前臨床段階および前駆段階では、疾患修飾薬物治療の出現は近い(Ritchie er al)。、 2017)。
本レビューで発見されたように、薬物治療を受けていない認知症の診断を受けた患者は事実上存在しない。したがって、Ibarriaら(2016)に示されているように、薬理学と非薬理学的治療を組み合わせて統合する共同介入の機会が生じる。いわゆる「自然主義的」研究と呼ばれるもので、外来診療所の患者群を何ヶ月もかけて追跡調査することは、臨床の実践に関連性があり、有益である。
Braginら(2012)は、うつ病、認知症、身体障害、内科疾患を持つ患者を対象に、認知機能の低下が60ヶ月間停止したことを示した。患者は、抗うつ薬、コリンエステラーゼ阻害薬、N-メチル-D-アスパラギン酸(NMDA)受容体拮抗薬、ビタミン、サプリメント、身体運動、認知運動を含む、ニーズに応じたマルチモーダル介入で治療された。
この例は、エビデンスベースを強化し、臨床に役立つものであり、(1)日常的に認知症治療薬を処方され、(2)併存疾患を持つことが多い認知症患者に関連するものである。このような患者は、Braginら(2012)が適切に実証しているように、統合的な治療モデルを併用することで利益を得られる可能性がある。
用語。2つ以上のモードを利用するための無数の記述用語が介入文献に浸透していたため、このレビューの付加的な利点は、ここに記載されている類型論を発展させることであった。認知症介入のためのモードと方法の類型(オンライン付録2)は、それらを包括的で論理的な構造に整理している。
このタイポロジーは、研究が既存の文献に関連してどこに位置しているかを体系的に評価することを可能にしている。また、分野によって介入のモードを記述する方法が異なるため、研究の学際的な比較も容易になる。この類型論は、マルチモーダル、マルチコンポーネント、デュアルタスク、統合的、複合的、複合的な介入を含む研究を分類するのに役立つ。
認知症の人を関与させる
研究の設計や実施には、参加者を有意義に参加させる機会がある。おそらく、N-of-1介入がこれほどうまくいった理由の一つは、患者の関与であり、特に治療アプローチの策定を支援し、実践者や研究者と治療アプローチに合意したことである。これは単なる参加の同意や撤回の自由を超えたものである。
これは共同での関与、つまりプロセス全体を通しての共同所有権についてのものである。Tayら(2016)の別の論文では、彼らの目標指向アプローチについてより深く掘り下げている(Chew、 Chong、 Fong、 & Tay、 2015)。認知目標だけでなく、エンゲージメントと社会化を改善する目標、介護者のストレスを軽減する目標、身体機能、行動、気分を改善する目標が設定され、参加者の61.8%がそれを満たしていた
ニーズの多様性 グループは、その中のニーズの多様性によって複雑になっている。Serdà i Ferrerとdel Valle(2014)は、一方では、高齢化、多様な症状、疾患のステージ、グループでの作業の非現実性が、患者の認知状態の有意かつ継続的な低下につながっていることを発見した。一方で、QoLの改善は「決定的で画期的」であったと指摘し、「心理的要因が運動とQoLの関係を媒介している可能性がある」ことを示唆した(p. 197)。
個人に合わせたアプローチ。認知症には病気を改善する治療法は存在しないというのが、一般の人々や主流のメディアでは一般的に信じられていることである(Webster er al)。、 2017)。私たちは現在、最適化されたターゲットを絞った介入が認知機能低下の根本的な原因に対処するのに役立つことを示している。
神経変性疾患における神経毒、栄養欠乏、炎症、腸内マイクロバイオームの役割(Bland、 2016)は、パーソナライズされたケアプランと治療決定の精度向上につながる可能性がある(Galvin、 2017)。さらに、人の認知症には独特の病因があり、個別化された治療法を開発するためには個別に理解する必要がある(Pomorska & Ockene、 2017)。
同様に、研究研究においても、個人を支援するための何らかの要素を加える努力が必要である。個人向けの個別化治療がより広く普及するようになれば、その学習と応用は、研究だけでなく、長期療養の患者や住民にも利益をもたらす可能性がある(Bodai er al)。、 2018)。
限界
マルチモーダル研究では名称の多様性があるため、我々の検索戦略は意図したほど包括的ではないかもしれないし、成功していないかもしれない。詳細に記述されていない介入は、誤った分類につながっている可能性がある。
一貫性を維持するために、また可能な限り多くの研究を含めるために、どの評価方法を含めるかを決定したことで、結論が弱くなった可能性がある。一部の著者からの回答が不足していたため、計算分析からいくつかの研究を省略せざるを得なかった。
結論
全体的には、認知症の一次診断を受けた成人の認知機能を改善するために、現在認知機能の低下に寄与すると理解されている複数の修正可能な危険因子に対処することで、MNPIが有効であることを示すいくつかの証拠がある。認知転帰が改善した症例では、以下の7つの研究要素が存在する傾向があった。
- 少なくとも3つのモードが利用され、そのモードを実施するための方法は複数かつ多様であった。
- 介入の一般的な特徴または焦点は、認知療法、刺激、訓練またはリハビリテーションにあり、身体的、心理社会的、栄養学などの他のモードが追加されていた。
- 各個人に特化した個人的な1対1の対話が含まれており、介入に焦点を当てたり微調整したりするのに役立つ関与、調査、評価が含まれていた。
- 社会的、ロジスティック、または実際的な支援には、介護者や学生、または社会的ネットワークの一般的な広がりが含まれていた。
- 患者の認知障害の程度は介入の障害とはみなされず、むしろ、潜在的な利益を最大化するために中等度から重度の障害を持つ患者に最適化されていた。
- 研究デザインとアウトカム測定法により、測定可能な改善の生成と、結果のタイムリーで有意義なデータ収集が可能となった。
- 介入は、認知症の根本的な原因や、栄養、絶食、酸素療法、ストレス軽減、睡眠衛生などを通じた神経変性メカニズムの破壊方法についての最近の理解の進歩を活用した。
本レビューの目的は、認知症と診断された人の認知機能を改善するためのMNPIの有効性を明らかにすることであった。この分野の研究が進むにつれ、医療従事者は、認知症の根本的な原因に対処することで症状を軽減し、認知機能の低下を遅らせることができるような方法で、認知機能障害のある人々を治療できるようになるだろう。
医療・福祉提供者は、患者やサービス利用者の選択を改善するために、既存の薬物療法の補助としての生活習慣病治療について、よりよく知らされる必要がある。社会的にも経済的にも、新たなエビデンスに遅れを取らないようにすることが急務である。
効果的な治療法に関する現在の関連する知見は、認知症の人やその介護者がセルフケアを通じた個人の健康に向けて力を与え、励ますことができると同時に、臨床的な理解と患者の転帰を継続的に向上させる研究を導き、刺激することができる。