コンテンツ
https://pubmed.ncbi.nlm.nih.gov/30580028/
Addressing concerns over the fate of DNA derived from genetically modified food in the human body: A review
受領日:2018年11月7日
概要
遺伝子組み換え食品・飼料の世界的な商業化により、遺伝子組み換え食品由来のDNAが消費者の体内でどのような運命をたどるのか、健康被害をもたらすのかについて多くの議論がなされている。そこで、遺伝子組み換え食品に由来するDNAの人体への影響について検討した。
機械的・化学的な処理では、DNAの完全性が損なわれる。食品DNAは過酷な加工や消化条件にも耐え、消化管内では数百bpまでの断片が検出されることがある。ヒトや動物の血液や組織に食品(遺伝子組み換え食品も)由来のDNAが存在することを裏付ける有力な証拠がある。
食品由来のDNAが消費者のゲノムに統合され、GM作物DNAが腸内細菌に水平移動するという証拠は限られている。遺伝子組み換え作物由来の食品に含まれる導入遺伝子が、植物性食品の宿主DNAよりも取り込まれ、統合される傾向が強いという証拠は見つからなかった。
植物性食品のDNAが、腸内細菌または体細胞のいずれかに移行した後に機能/発現する証拠は見つからなかった。植物性食品-miRNAは消化を免れ、体内に入り、遺伝子発現パターンに影響を与えることが強く示唆された。
この多角的なレビューによって、遺伝子組み換え食品由来のDNAや遺伝子制御RNAのヒト体内における運命に関する疑問が解決されることを期待している。
キーワード
遺伝子組み換え、遺伝子組み換え食品・飼料、遺伝子組込み、胃腸管、DNAの組込み可能性、DNAの発現可能性
1. はじめに
食用および飼料用の遺伝子組み換え(GM)作物の世界的な栽培面積は2016年に1億8510万ヘクタールに達し、商業的利益の総額は1503億米ドル(1996~2014年の場合)(Brookes and Barfoot, 2016)に達している。GM植物の大部分は、圃場の性能(除草剤耐性、殺虫剤生産)を向上させるために開発されたものである。国やそれぞれの法律にもよるが、GM作物に由来するデンプン、脂肪/油、タンパク質、コーンシロップなどの成分は、現在、人間の食事(乳児用ミルクから焼き菓子まで)だけでなく、家畜の飼料にも含まれている(Tsatsakis et al., 2017a; Tsatsakis et al., 2017b)。
人間や動物は、広範な食品や飼料の供給源から、外来DNA(GMおよび/または非GM)に常にさらされている。数年前までは、摂取されたDNAはヒトや動物の消化管内で完全に分解されると考えられていた(Rizzi et al., 2012)。しかし、遺伝子組み換え食品や飼料の世界的な商業化に伴い、消費者の体内における遺伝子組み換え食品由来の細胞外DNAの運命や影響に改めて関心が集まっている。このため、食品由来の細胞外DNAの分解性、安定性、変異原性、発現性に関わる生物学的プロセスを正確に理解する必要性が生じてきた。
本総説の目的は、外来DNAが消化器官での分解に抵抗して消費者の体内に入る可能性とそのメカニズムを理解するための最近の進展を探ることである。このテーマに関する包括的な総説はすでに出版されているが(Rizzi et al., 2012)、その後多くの論文が出版されており、遺伝子組み換え作物の使用における最近の変化に伴う懸念に対応するために、最新の情報が必要である。特に、植物性食品DNAの腸内細菌への水平的遺伝子移入のホットスポットとして、消化管を評価することに関心があり、潜在的にディスバイオシスや不健康につながる可能性がある。消費者の血液や他の臓器系における食物DNAの存在をめぐる論争について議論する。また、消費者の組織におけるゲノムの統合と外来食物DNAの発現の可能性についても議論する。最後に、植物性食品由来のmiRNAの取り込みの可能性と、動物およびヒトの遺伝子機能への影響の可能性についても簡単に考察する。
2. 食品に含まれるDNAの現状
食品に含まれるDNAの量は、食品源、すなわち動物か植物か、食品の可食部の細胞密度や細胞の種類、加工食品か生食か等によって異なる。動物性食品(10-20 g/kg)のDNA含有量は、植物性食品(0.6-3 g/kg)よりも多い(Herbel and Montag, 1987; Lassek and Montag, 1990)。植物油、デンプン、糖類などの加工食品や高度加工食品のDNA含有量は極めて低く、食品加工時の物理的条件や採用した分析方法によっては検出されないこともある。高温高圧、低pH、化学処理によってDNA分子の変性や断片化が起こり、加工食品中の検出可能なDNAや増幅可能なDNAのサイズが著しく減少することはよく知られている。しかし、物理的な加工条件下でも、植物由来の食品からは最大300 bpの長さのDNA断片が検出された(Bergerová et al., 2011)。さらに、DNAは、加工や保存中に使用される食品添加物や化合物の種類によって相互作用が異なる(Srinivasan et al., 2002)。食品加工のために添加される化合物の性質や、各食品源に存在する酵素の性質やレベルに応じて、DNAの分解の程度は変化する。内因性DNaseの存在、ヌクレアーゼによるDNA分解、高温による加水分解、タンニン酸やアミンの添加、乳酸発酵、刻み、調理、エンドヌクレアーゼの放出、細胞壁の分解などが、最終的に食品や飼料に含まれるDNAの量、サイズ、状態に影響する(Gryson、2010)。
商業的に栽培された遺伝子組み換え植物は、<5つのユニークなタンパク質をコードするトランスジーンを保有することができ、それらは宿主に新しい形質を与えるために同じ植物内で「積み重ねる」ことができる。通常、人間は1日に0.1gから1.0g(100兆個以上の遺伝子)の外来DNAを摂取していると推定されている(Doerfler, 1998; Doerfler et al., 1998)。ヒトが摂取するトランスジェニックは、食品中に存在する他の遺伝子と化学的に同等(構造的に)である。食品加工時に適用される複数の物理化学的条件下で、DNAに対する物理的および化学的(ヒドロキシル化、酸化、脱アミド化)損傷がもたらされる(Kharazmi et al., 2003)。遺伝子組換えトウモロコシのDNAは、pH4.0で65℃、90分間加熱すると断片長が減少するが、957bpの断片は検出可能であった(Bauer et al., 2003)。温度(120℃)、圧力(0.1MPa)、低 pH(2.25)の複合効果により、MON 810 GM トウモロコシから 300 bp 未満のDNA 断片が増幅された(Bergerová et al., 2011)。高分子量のDNA は、挽いた小麦粒(>21 kbp)、ビスケット(100-1500 bp)、ポップコーンや小麦パン(<800 bp)、トマトケチャップやスープ(<400 bp)、発酵サイレージ(<200 bp)といった半加工食品で報告されている(Rizzi 他 2003;Rizzi 他、2012)。ある調査では、トウモロコシやライグラスのサイレージ農場飼料の製造において、DNAが安定したまま無傷であることが判明した。腸内細菌や消費者の動物細胞への水平遺伝子移動が問題となる場合、この飼料は大きなリスクをもたらすと考えられる(Forbes et al., 1998)。95℃で5分以上熱処理した場合のみ、DNAは完全に断片化した(Forbes et al., 1998)。高度に処理された食物DNAの増幅に関する別の研究では、351 bpのアンプリコンでも増幅が観察された(Hird et al., 2006)。
高温でのDNA分解のメカニズムは、脱プリン酸、脱アミノと鎖の切断に基づいている。また、食品加工時の高温では、DNAの二次構造の不可逆的な消失が起こる(Gryson, 2010; Lindahl, 1993)。トウモロコシの穀粒を94℃で5分間加熱した場合(Chiter et al., 2000)や、湿式粉砕したグルテン画分を135℃で2時間乾燥した場合(Gawienowski et al., 1999)に見られたように、高温での乾燥はDNAをより急速に劣化させる。しかし、溶液中のDNAを99oCで7時間加熱しても、最大400bpの平均サイズが観察された。食品加工、調理、機械的処理、酵素分解、放射線照射、超音波処理によるDNAの分解については、別の場所で紹介されているので(Gryson, 2010)、ここでは詳述しないことにする。オートクレーブ、殺菌、ベーキング、ロースト、フライは、DNAの分解性を顕著に高める(Allmann et al.) しかし、これらの加工、加熱、調理処理中のDNAは、依然として検出可能であり、ポリメラーゼ連鎖反応(PCR)で増幅可能な断片長を有することが判明した。このことは、DNA断片が摂取され、ヒトや動物の消化器官に存在する可能性を考慮する上で重要である。
DNAの1日の摂取量は、個人の食事のバリエーションによって大きく異なる。ヒトが摂取する食事性DNAの量は、主に摂取量の違いにより、牛と比較してはるかに少ない。さらに、酪農家では、サイレージやフォレージなど、同じ種類の食物DNAを摂取することが多い。170gのGMダイズ、ジャガイモ、トウモロコシを摂取するヒトは、約70μgのDNAを摂取することになるが、そのうちのごく一部(0.00006%)が挿入されたトランスジーンによるものであるに過ぎない。人間はGM作物由来の加工品を主に摂取しているが、家畜は生や部分的に加工されただけの飼料を含め、はるかに多くの量を摂取している(Van and Young, 2014).例えば、体重600kgのホルスタイン種の乳牛の場合、60%のGMトウモロコシでできた飼料を摂取すると、1日あたり54-57gのトウモロコシDNAを消費することになる(Beever and Phipps, 2001)。これは、消化中にDNAが分解されないと仮定した最大可能曝露状況において、1日あたり54 mgのGM導入遺伝子を消費することになる(図1A)(Jonas et al., 2001;Phipps et al., 2001;Rizzi et al) 消化されると、この食餌性GMおよび/または非GM DNAのサイズは大幅に縮小されるため、水平遺伝子移動に関与しうる無傷の遺伝子断片を含む消化管内の食餌性DNAの最終量は、はるかに少なくなるであろう。
3. 食物DNAの消化管内での動態
胃腸管(GIT)内腔の上皮細胞は、常に外来食物DNAにさらされている。GITの主な機能の1つは栄養素の吸収であるため、これらの細胞は外来DNAが消費者の体内に入る最も可能性の高い侵入経路となる。ヒトの場合、消化管の総粘膜面は平均32 m2(HelanderとFändriks、2014)であり、DNAの平均的な食事摂取量は、通常の食事の一部として1日あたり0.1~1gと推定されている(Doerfler、1998)。
デオキシリボヌクレアーゼI(DNase I)は唾液から検出されるが、DNAの消化は胃で始まると考えられており(Liu et al., 2015)、ペプシン(胃の主要酵素)の作用と環境の酸性度によってヒストンがDNAから分離される。DNAはさらにGITに沿って胃酸とDNAヌクレアーゼによって分解されるため、腸管上皮細胞には小さな断片しか提示されない。しかし、腸管細胞に吸収される可能性のある食物DNAの割合が極めて低いとしても、生物学的影響の可能性を排除することはできない。外来DNAが吸収され、血流に達するかどうかは、Walter Doerfler(ケルン大学)のグループが最初に調査した。一連の実験で、マウスは通常の実験用げっ歯類の飼料に添加した大量のバクテリオファージM13 DNAを摂取した(Schubbert et al., 1994; Schubbert et al., 1997)。この実験では、M13のDNA断片が1692bp(全長7250bpのうち)までなら、胃腸を通過しても生き残ることが初めて示された。しかし、これらの先駆的な研究から20年経った現在でも、DNAの取り込みのメカニズムや結果についてはほとんど知られていない。
腸管上皮はDNA断片の侵入を完全に防ぐバリアーではない。たとえ腸の細胞膜がDNA断片の細胞内への受動的拡散を防いだとしても、腸上皮を介した取り込みは小胞輸送(トランスサイトーシス)を介することが最近になって証明された(図1B(i)(Johannessen et al., n13)。ヒト腸管上皮細胞株 CaCo-2をモデル系として、グリホサート耐性 GM 作物に存在する5-enolpyruvyl-shikimate-3-phosphate synthase (CP4-EPSPS)のCP4 変異遺伝子の断片 (278 および 270 bp)が内在化することが示された。(Sharma et al., 2007)。追跡調査では、633 bpの長さのDNA断片の合計0.06%が、90分以内に極性化したCaCo-2細胞を横切って(先端から基底側方向へ)輸送されることが判明した(Johannessen et al., 2013)。633bpの非分解性DNA断片全体も、基底側コンパートメントで検出された。このことから、著者らは、成人した人間の標準的なDNA摂取量は、1日平均1gのDNA食事摂取を考慮すると、約0.5μg DNA、または1000bpのDNA断片10-10個に相当すると推定した(Johannessen et al., 2013)。遺伝子組み換え作物由来の食品が食事に含まれる場合、1日に吸収される遺伝子断片は数千コピーに過ぎないと考えられる(Jonas et al., 2001)。また、哺乳類細胞によるDNA断片の自然な取り込みは、組織や細胞タイプに特異的なプロセスであり、配列にも依存する(図1B(ii)ことに注意することが重要である(Lehmann and Sczakiel, 2005)。さらに、ヒトの腸管における消化物の通過時間が長いため(実験用げっ歯類と比較して)、腸内微生物および膵臓由来のDNaseによるDNA加水分解がより完全に行われると考えられるため、種間外挿は慎重に行う必要がある。GM 大豆の遺伝子組換え植物 DNAのヒト消化器官内での生存に関する研究では、CP4-EPSPS 導入遺伝子のごく一部(最大 3.7%)だけが胃と上部消化管を通過して生き残り、導入遺伝子は大腸を通過するまでに完全に分解されることが判明した。(Netherwood et al., 2004).
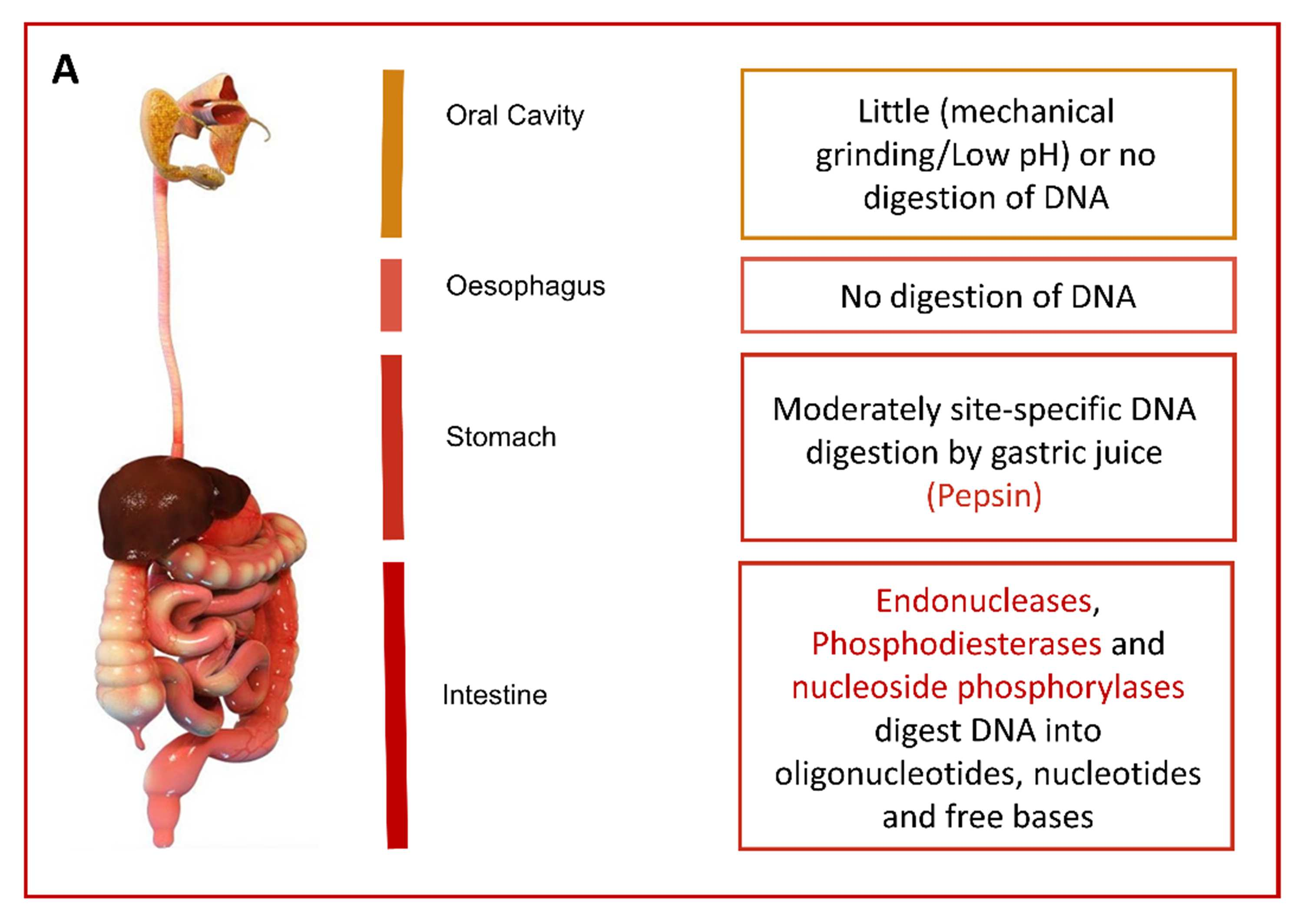
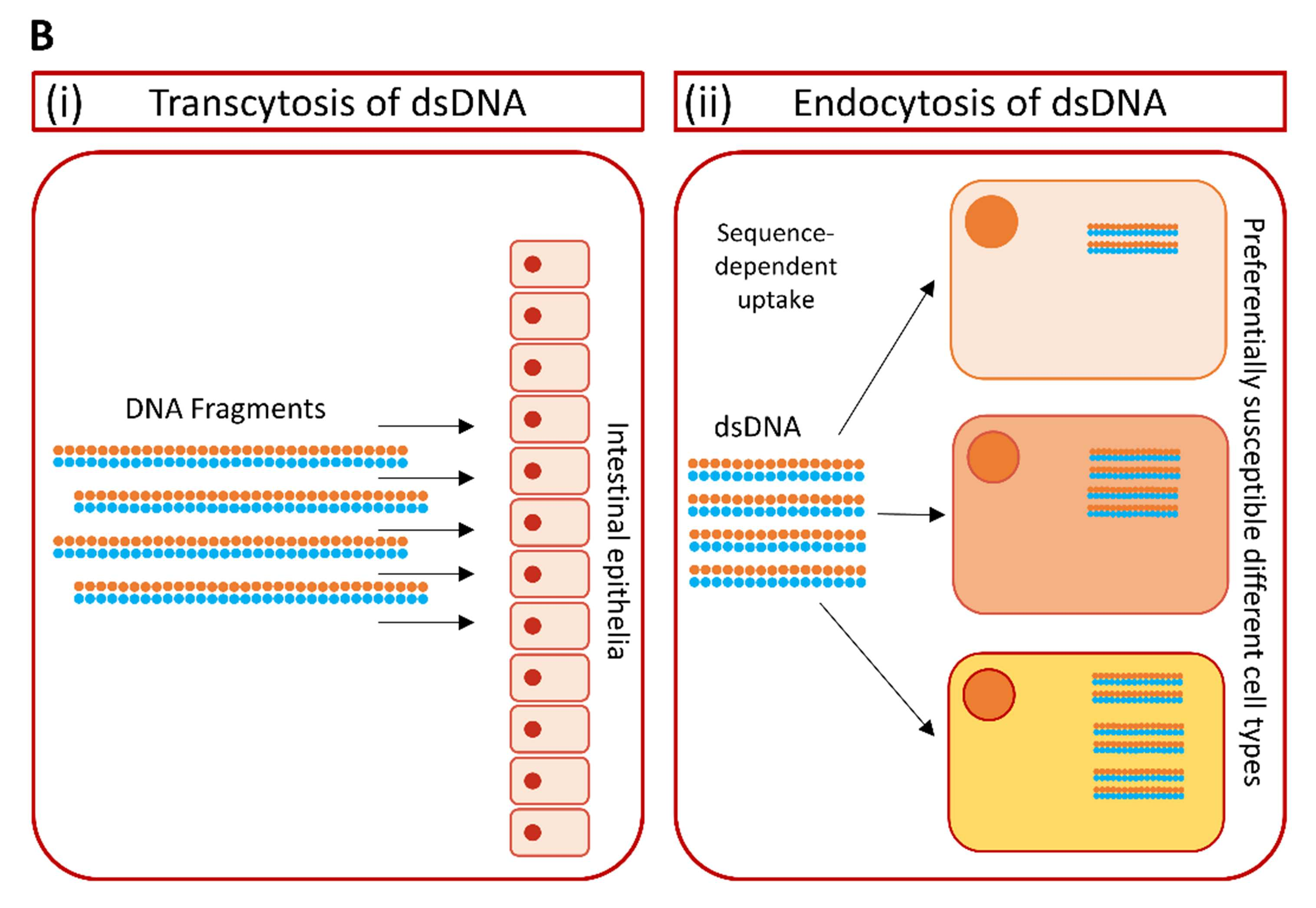
図1 A. ヒト消化器系における細胞外DNAの運命
B. 細胞外DNAの細胞内への取り込みに関与する2つの可能なプロセス。(i) dsDNAのトランスサイトーシス: 小胞輸送によって腸管上皮を通過するDNA断片の取り込み。(ii) dsDNAのエンドサイトーシス: 裸のdsDNAは、配列に依存したメカニズムによって自然に内在化され、遺伝情報が生物活性のある形でかなりの量、生きた細胞に入り込むことができる。このプロセスは、細胞タイプにも依存する。
また、進化の観点からDNA消化の問題を取り上げるのも興味深い。哺乳類は何百万年もの間、食事を通してDNAにさらされてきた。したがって、GITによってDNAがどの程度分解されるかは、進化的に選択された可能性のある特異的な形質であると考えられる。特定のDNA断片の検出は、病原体の存在を検出するセンサーとして機能する可能性がある。実際、外来DNAが腸関門を通過することは、免疫賦活作用としてよく知られている。GITにはいくつかのタイプの免疫感覚細胞が存在し、細菌の非メチル化CpGモチーフを検出することで、防御機構としての自然免疫を引き起こすことができる(Krieg, 2002)。例えば、樹状細胞はToll様受容体TLR9を強く発現しており、Toll/IL-1Rシグナル伝達経路を介して自然免疫細胞を活性化するために、特定の細菌CpGモチーフを認識する(Bauer et al., 2001)。CpGモチーフは通常、哺乳類ではメチル化されているが、細菌ではメチル化されていないため、TLR9は自己と非自己のDNAを識別することができる。TLRが認識する分子パターンには、細菌、ウイルス、寄生虫、真菌に由来するさまざまな種類の脂質、タンパク質、核酸が含まれる(Ohto and Shimizu, 2016)。図2は、食品加工中および消費者の体内におけるDNAの運命をまとめたものである。
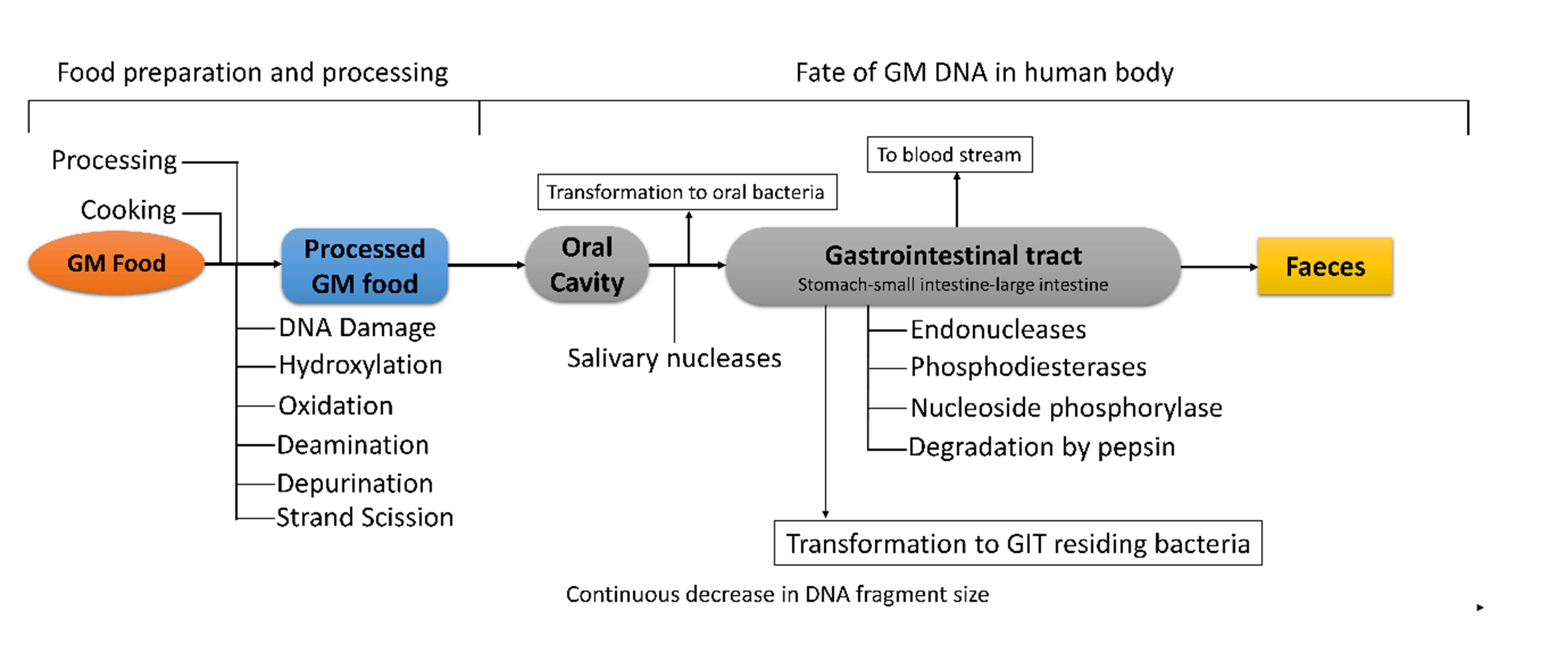
図2 食品の調理・加工がDNAに及ぼす影響と、消費者の体内におけるGM由来の食事由来DNAの運命のまとめ
4. 消化管:遺伝子の水平移動のホットスポット
人体は一般的に単一の生物として研究されているが、異なる体内生息地に数兆個の細菌が生息しているため、より複雑な生態系として機能している。GITだけでも1013 -1014個の細菌が生息している(Sender et al., 2016)。GITに沿って細菌濃度の勾配があり、胃と十二指腸では低濃度(103~104個/g)、回腸では増加(108個/g)、最も高い細菌濃度は大腸と便に見られ、~1011個/gが存在する。腸内細菌叢の異常は、炎症性腸疾患、糖尿病、心血管疾患、あるいは自閉症スペクトラム障害など、さまざまな疾患に関与している(Cho and Blaser, 2012)。これらの細菌群集の動態は複雑であり、ここでは十分に説明することができない。しかし、このレビューに関連するこれらのコミュニティの1つの特徴は、細菌が遺伝物質の移動によって異なる表現形質を共有できることである。この現象は、1928年にFred Griffithによって初めて報告された。病原性細菌株(Streptococcus pneumonia)のDNAを分離し、その細菌の悪性型と混合したのである(Griffith、1928)。強毒菌のDNAも悪性菌のDNAもマウスには効かなかったが、両者を混ぜると慢性感染して敗血症が引き起こされた。その後、この現象は、細菌が抗生物質耐性などの異なる形質を共有する、水平遺伝子移動(HGT)と呼ばれるメカニズムによって引き起こされることが判明した(van Schaik, 2015)。この現象は、細菌集団では非常に一般的であり、これらの生物が環境変化に適応するための戦略を構成している。
遺伝子組み換え作物からの導入遺伝子がGITに生息する細菌に移行する能力について懸念が提起されている(Uzogara, 2000)。特に懸念されるのは、抗生物質耐性をコードする遺伝子が、GM形質導入遺伝子とともに、いくつかのGM作物のゲノムに組み込まれているという事実である。これらの抗生物質耐性遺伝子は、導入されたGMイベントに対して陽性である形質転換植物の選択を容易にするために使用された。
GM植物からのDNA断片は、単一の細菌種によって取り込まれる可能性がある。例えば、GMテンサイ(Gebhard and Smalla, 1998)およびGMジャガイモ(de Vries et al., 2001)からの導入遺伝子DNAは、アシネトバクター属によって容易に同化されることが示されている。しかし、これらの実験は、最適化した実験室条件によって行われ、自然環境では遭遇しないと考えられる。これまでのところ、遺伝子組み換え作物のDNA断片が哺乳類種の腸内細菌叢に組み込まれることを確実に示した生体内試験の研究はない。例えば、アンピシリン耐性をコードするプラスミドDNAの単縁ラットの腸内細菌叢(大腸菌または枯草菌のいずれか)への組み込みを調べたところ、腸から分離したプラスミドが試験管内試験で細菌を形質転換できたとしても、生体内試験では取り込まれなかった(Wilcks et al., 2004). しかし、稀な統合事象の検出を妨げるいくつかの技術的制約があることを念頭に置いておく必要がある。細菌の形質転換体が、現在使用されている分析方法で検出できる数まで増殖するには、何年もかかることがある(Nielsen et al., 2014)。例えば、ペニシリン耐性S. pneumoniaeが米国内の分離株の21.5%になるまでには数十年を要した(Doern et al., 2001).
遺伝子組み換え植物のDNA断片が腸内細菌叢に生息する細菌に取り込まれることはもっともなことだが、ヒトを対象とした研究で、遺伝子組み換え大豆の遺伝子組み換えDNAが被験者の微生物叢に移行したという証拠を得たのはたった1件である(Netherwood et al., 2004)。この研究では、7人のイレオストミストのうち3人が腸内細菌叢にCP4-EPSPSトランスジーンを有しており、遺伝子組み換え大豆の食事摂取後にこの遺伝子は増加しないことが判明した(Netherwood et al., 2004)。一般に、腸内細菌へのHGTは、今日まで完全に証明されていない。まず、消化過程でDNA断片が分解されることを考えると、完全な遺伝子を利用できる可能性は低い。そして、これらの断片は、相同組換えによる統合を促進するために、バクテリアのDNA配列と一致するものが望ましいが、バクテリアによっては、どのようなソースからも等しい効率でDNAを取り込むことができる(de Vries and Wackernagel, 2005)。さらに、もし細菌が遺伝子組み換え作物からDNA断片を取り込んだ場合、無傷または機能的なサブドメインが存在する必要がある。また、微生物のゲノムへの挿入は、その発現を可能にする方法でなければならず、野生型細菌を駆逐するために選択される必要がある。食品から取り込まれたDNA断片の多くは選択的な利点をもたらさないため、形質転換は生理的な代償を強いられることになり、負のフィットネスをもたらす可能性が高い。摂取する抗生物質や除草剤の量が十分であれば、抗生物質の能力を持つグリホサートなどの抗生物質や除草剤に対する耐性を付与する遺伝子のみが選択される可能性がある。また、抗生物質耐性の出現に関する研究の多くは、この問題の原因となりうる線状DNA断片によるランダムな形質転換を考慮していないことも注目される(Gay and Gillespie, 2005)。全体として、HGTによる抗生物質耐性の病原性微生物の発生が、人間や動物の健康に及ぼす影響を考えると、新世代の遺伝子組み換え作物は、抗生物質耐性遺伝子を組み込まずに作られるべきであるというのが道理である。
5. 血流中の食物DNAの存在に関する論争
食餌性DNAの多くは消化の過程で分解されるにもかかわらず、数百ヌクレオチドの断片が血中に到達することがある。Doerflerらがマウスに与えたM13mp18プラスミドの運命を調べる目的で行った実験では、DNA断片が血液中(194-976bp)、末梢血白血球1000個のうちの約1個、および摂食後24時間までの脾臓または肝臓細胞で見つかった(Schubbert et al., 1997).さらに、摂食を延長すると、M13mp18 DNAは脾臓の全DNAからラムダベクターに再クローン化され、これは外来DNAがネズミのDNAに共有結合したことを示す(Schubbert et al., 1997)。その後の研究で、妊娠中にM13を投与すると、胎児や生まれたばかりの動物の細胞からもM13 DNAが検出され、摂取したDNAが胎盤を通過することが示された(Doerfler et al., 1998)。さらに、同じグループによって、大豆の葉を与えたマウスで、より大きな遺伝子であるリブロース-1,5-二リン酸(Rubisco)の運命を調べる実験が行われた(Hohlweg and Doerfler 2001)。Rubisco遺伝子の断片は、摂食後49時間までの腸内、摂食後121時間までの盲腸、さらに肝臓と脾臓で回収された。
宿主由来のDNAが血中に残留することはよく知られているが、食事由来のDNAがヒトの血中にどの程度存在するかは、激しい議論のある分野である。循環する無細胞DNAの存在は、1948年にマンデル(Mandel, 1948)によって初めて報告された。循環しているこれらのDNA断片は、ほとんどが宿主細胞の死(アポトーシス)に由来することがよく知られている。これらの循環DNA断片は、血球表面に吸着した核タンパク質複合体として循環するため、意外にも血清ヌクレアーゼ活性に抵抗する(Thierry et al., 2016)。2013年、4つの独立した研究から得られた1000のヒトサンプルを分析した結果、完全な遺伝子を運ぶのに十分な大きさの食物DNA断片が血流に入ることが報告された(Spisák et al., 2013)。しかし、この結果は、その後の研究において、汚染や感度がデータセットの完全性を損なう可能性を示唆し、より綿密な調査が必要であるとされた(Lusk、2014)。別の調査では、400-600gの調理済みウサギ肉を食べた2人の人間のボランティアの血液中に、ウサギのDNAの存在が評価された(Forsman et al., 2003)。食品中および血液中の高コピー数のウサギのレトロトランスポゾンRERV-Hの存在は、定量PCRによって評価された。この2人のボランティアが摂取したウサギ肉の食事には、合計1014コピーのRERV-HのDNAが含まれていた。この研究では、摂取の1時間後に末梢血1mLあたりトランスポゾンのコピーの最大濃度が検出された。これは、約106個のRERV-H DNAコピーの取り込みに相当する。
全体として、異なる研究によって集められた十分な証拠は、食事に由来する小さなDNA断片が血液中に存在することは、おそらく一般的な現象であることを確認している。遺伝子組み換え作物に由来する食品に関連して、血流中のトランスジェニックDNAの頻度が通常の植物宿主の食事由来DNAよりも高いことを示唆する証拠はない。したがって、遺伝子全体またはその制御エレメントが血液中に存在し、それらが挿入型突然変異を引き起こす可能性は、依然として仮説に過ぎない。
6. 外来性食物RNAの生物学的効果
2012年、Chen-Yu Zhangらが、米から摂取した米miRNAがマウスの遺伝子発現に直接影響を与えることを報告し、食餌性核酸の生物学的効果をめぐる論争がさらに活発化した(Zhang et al.) このことは、植物宿主遺伝子(例えば、褐変抵抗性のArtic ApplesやInnate potato(Food and Drug Administration, 2015)または作物に感染または食害する可能性のあるウイルスや害虫の遺伝子を標的としたRNA干渉(RNAi)経路を介して特定の遺伝子(複数)の発現をノックダウンするために二本鎖(ts)ショートヘアピンRNA(shRNA)分子が発現する作物が承認され始めているGM食品に影響を与える(Chang et al., g17).さらに、shRNAに基づく除草スプレーや殺虫スプレーが、それぞれ雑草や害虫をターゲットに展開されている(Broglie et al., 2017)。このように、比較的新しいタイプのバイオテクノロジーであるこれら2つからの新規shRNA分子は、食品供給に入り始めており、これらの遺伝子制御分子の起こりうるオフターゲット効果から健康上の懸念が生じている(Heinemann et al., n13;Lundgren and Duan、2013;Zhao et al., o17)。
Zhangらによる研究は、激しい議論を引き起こし、現在も続いている。その後、miRagen TherapeuticsとMonsanto社が行った研究では、Zhangらの結果を再現することができなかった(Dickinson et al., 2013)。このため、miRagen社とMonsanto社は、Zhangが得た結果はartefactualまたはspuriousであると主張するようになった。それにもかかわらず、マウスの血漿LDL-コレステロール値の上昇がZhangらによって検出されたが、それはmiRNAの効果ではなく、栄養学的効果によるものであるとされた。これに対し、Zhangたちは、miRagen TherapeuticsとMonsantoが使用したRNA-seq手順に欠陥があり(Chen et al., 2013)、それがマウスの組織で米miRNAを検出できなかった原因である可能性があると指摘した。さらに、Zhangらの結果は、シーケンシング中のクロスコンタミネーションの問題であるとする研究もある(Tosar et al., r14)。
植物由来のmiRNAは2′-O-メチル修飾3’末端を有するため、同等の動物およびヒトの配列と区別することができ、消費者の血液、内臓、母乳において明確に同定されるに至る(Zhao et al. 2018を参照)。ヒト血漿のsmall RNAシーケンスデータセットの最近の分析では、多数の植物性食品miRNA種が存在することが明確に確認されている(Liu et al., 2017)。したがって、クロスキングダム(植物-動物)miRNAコミュニケーションの領域は依然として論争の的となっているが(Witwer and Zhang, 2017)、これらの観察は、植物食品miRNA種が消費者の体内に入り込み、宿主遺伝子機能に潜在的に影響を与えることを確認している(Zhao et al., 2018)。このレビューの文脈では、現在入手可能な証拠から明らかなのは、食品(遺伝子組み換え作物由来かどうか)、または葉面散布のアプリケーションに存在するshRNAは、あらゆる可能性で、動物や人間の消費者の体内に入り込むということである。
これらの摂取されたsiRNA(small interfering RNA)が消費者の遺伝子機能に影響を与え、健康に悪影響を及ぼすかどうかは明らかではない。しかしながら、これらの新しいmiRNA食品暴露源から生じる遺伝子発現の標的外破壊による潜在的な健康リスクは、規制当局がこれらの製品の市場承認申請を検討する際に十分に考慮されるべきである(Heinemann et al., n13)。このリスク評価には、ヒトやその他の重要な生物における標的を特定するためのバイオインフォマティクス解析や、細胞培養における可能な生物活性の評価が含まれる(Heinemann et al., 2013)。
7. 宿主組織における外来DNAの統合性および発現可能性
カリフラワーモザイクウイルス35Sプロモーター(CaMV 35S)は、遺伝子組み換え作物で導入遺伝子を発現させるために最も頻繁に使用される転写制御要素である(Hull et al.) CaMV 35Sプロモーター-エンハンサーフラグメントの導入と統合は、活性化挿入型突然変異誘発をもたらす可能性があることが提案されている。すなわち、CaMV 35Sプロモーターが統合部位周辺の宿主遺伝子機能を活性化する場合である(Ho and Cummins, 2009; Ho et al, 1999; Podevin and Du Jardin, 2012)。CaMV 35Sプロモーターは、実際に動物およびヒトの細胞において試験管内試験で機能することが示されている。これは、Xenopus laevis卵母細胞で最初に示され(Ballas et al., s89)、その後のトランスフェクションレポーター遺伝子アッセイを採用した研究では、CaMV 35Sが動物とヒトの両方の細胞で活性であることが示されている(Kitagima et al., a13;Myhre et al., e06;Tepfer et al., r04;Vlasák et al., k03;Zanta et al., a99)。直近では、CaMV 35Sは、アトランティックサーモンにおけるこの要素を保有するプラスミドの筋肉内注射後に、生体内試験で活性化することも示されている(Seternes et al., 2016)。しかしながら、CaMV 35Sからの発現は、使用される細胞の種に適切な同等のウイルスプロモーター-エンハンサーエレメント(例えば、哺乳類細胞株におけるCMVまたはSV40プロモーター)を用いた対照構築物から観察されるもののせいぜい1%にすぎないことがわかった(Vlasák et al., k03)。これは、CaMV 35Sが、統合されていない、転写的に許容されるエピソームプラスミド分子上に存在する場合でさえ、ヒト細胞環境において非常に弱いエレメントであることを実証している。すべての可能性において、CaMV 35Sは、エピジェネティック(例えば、DNAメチル化)媒介のサイレンシングの影響を受けるであろう宿主細胞ゲノムにランダムに統合されると、さらに機能しなくなる(Rajeev Kumar et al., r15)。
DNA断片が腸関門を通過することは頻繁にあるようだが、腸上皮細胞や他の細胞種のゲノムに統合されることはまれなケースと思われる。万が一、CaMV 35SプロモーターなどのDNA断片が宿主遺伝子や細胞機能を阻害する位置に組み込まれたとしても、腸管上皮細胞のようにターンオーバーが激しい細胞種であれば、その影響はないのかもしれない。腸上皮細胞においてDNA断片の統合後に癌遺伝子が活性化されることが、ターンオーバーを経る前に起こり得るかどうかは明らかではない。
マウスの摂食実験において、食餌性DNAが末梢白血球で頻繁に検出され(Schubbert et al., 1997)、このDNAは投与後24時間以上経過してもほとんど回収できないという事実は、宿主生物から外来DNAを排除することを容易にするいくつかのメカニズムの存在を示唆する。哺乳類細胞ゲノムに組み込まれた外来DNAエレメントの機能を保護するための主要なメカニズムは、メチル化による不活性化からなる。このメカニズムにより、哺乳類細胞は進化の過程でレトロウイルス感染から身を守ることができるようになった。蓄積された内在性レトロウイルスは、ヒトゲノムの8 %を占める(Lander Eric et al., 2001)。動物細胞は、CpGジヌクレオチドのシトシン残基のメチル化によって外来DNA要素を沈黙させることができる、幅広い分子ツールを備えている。トランスジーンの統合を沈黙させることは、遺伝子治療戦略の開発における共通の問題でもあり、臨床試験において少なくとも1つの治療失敗につながった(Neville et al., 2017)。それゆえ、安定した、統合に依存しないトランスジーンの発現部位を付与するための新しいツールを開発する努力がなされている(Neville et al., 2017)。まれにDNA断片の統合が行われる場合、このDNA断片はおそらくメチル化され、したがって転写的に沈黙することになる。CaMV 35Sプロモーターにはクロマチンリモデリング機能がないため、これもDNAメチル化を介したサイレンシングが起こりやすい(Rajeev Kumar et al., 2015)(情報ボックス参照)。さらに、ヒトや動物の細胞にも細胞質DNA感知経路が備わっており、例えばSTING(for stimulator of interferon genes)は、細胞内の外来DNAの存在に応答してIFN生産を促進することが実証されている(Barber、2011)。
遺伝子工学技術を用いた臨床応用や産業応用を促進するために、外来DNAの組み込みのメカニズムを解明するための多くの研究が行われている。先に述べたように、DNAは細胞膜を通過して拡散することはなく、その取り込みは配列と細胞に依存する(Lehmann and Sczakiel, 2005)。核へのアクセスは、有糸分裂のプロフェーズの終わりに核膜が分解するときを除いて、核膜孔複合体を通過することによって制限される。この現象は1980年にCapecchiによって初めて観察され、ヘルペスウイルスのチミジンキナーゼ遺伝子を、この酵素活性を欠くマウス細胞株にマイクロインジェクションすることで証明された(Capecchi、1980)。この酵素をコードするDNAを細胞核に直接投与すると、50-100%の細胞がチミジンキナーゼ活性を発現し、DNAを細胞質に注入するとその遺伝子は発現しないことが判明した(Capecchi, 1980)。しかし、さらなる研究により、プラスミドDNAは核孔を通して非分裂細胞の核内に移行できることが示された(Dowty et al., 1995)。SV40ウイルスゲノムの非分裂細胞の核への侵入能力に関する研究により、DNA核標的配列が発見され、核孔を通して特異的に侵入できるようになった(Dean, 1997)。その後、SV40核局在化シグナルペプチドは、細胞のトランスフェクション効率を高めるために利用された(Brandén et al., 1999)。
外来DNAが核内に侵入した場合、宿主細胞のゲノムに組み込まれることは非常にまれで、分解されるか、希釈されて分裂を繰り返すうちに細胞から失われるのが通常の結果である。しかし、稀に外来DNA断片がゲノムに組み込まれることがあり、その頻度は細胞の種類や配列によって異なる。例えば、線維芽細胞(XP2OS-SV40とHeLa細胞株)の形質転換頻度は0.1%だが、シミアン腎臓細胞株CV-1は6%と高い頻度で安定的に形質転換できる(Gorman et al., 1983)。これらの結果は実験室でのトランスフェクション研究によるものであり、特に生体内の自然な細胞プロセスを正確に反映していない可能性があることに注意すべきである。
DNA断片が染色体に組み込まれるメカニズムには、相同性依存性組換えと不正組換えの2つが考えられる。相同性依存性組換えによる結果はより予測しやすいが、より稀な現象である。大半のケースで起こる非合法な統合は、相同性依存的な統合の4倍から100万倍の頻度で起こると推定されており、この比率は実験条件や使用する細胞種によって異なる(Würtele et al., 2003)。実際、外来DNAがゲノムに統合されるメカニズムについてはまだほとんど分かっておらず、挿入部位は一般にランダムであるため、予測不可能である。さらに、DNA断片は、統合される前に多くの修飾や再配列を受ける可能性がある。外来DNA断片は切断されたり、タンデムリピート(直接または逆方向)に連結されたり、あるいは統合の過程で他のDNAセグメントと間隔をあけたりすることがある。これは、結果として生じる導入遺伝子の発現の安定性に影響を与える(もしあれば)(McBurney et al., 2002)。このようなゲノム修飾は一般に不安定であり、細胞集団はトランスフェクション後の最初の1週間で外来DNA断片のほとんどを失う傾向がある(Würtele et al., 2003)。これらのプロセスは、食物DNA断片を消費者のゲノムDNAに統合するために克服しなければならない大きな障壁を生じさせる。このことは、哺乳類細胞工場を用いたタンパク質バイオ製造または遺伝子治療戦略のいずれかにおいて、導入遺伝子発現のレベルと安定性を高めるための新しい戦略の開発に携わる人々にはよく知られている(Neville et al., 2017)。
このテーマに関する熱心な取り組みにもかかわらず、GM作物からの導入遺伝子が動物またはヒトの消費者のゲノムに組み込まれたことを報告した研究はない。それにもかかわらず、ヒトゲノムが進化のタイムスケールでHGTを通じて複数の種から遺伝子を獲得してきたことは興味深いことである。26の動物種(霊長類10種、ハエ12種、線虫4種)におけるHGTによる新しい遺伝子の獲得を評価した研究では、ヒトゲノムに合計145の「外来」遺伝子があることが判明した(17の既報と128の新報)(Crisp et al., 2015).例えば、ヒトのABO遺伝子群は、脊椎動物と微生物との相互作用を高めるために細菌から獲得されたと考えられている(Brew et al., 2010)。さらに驚くべきことに、ヒトの肥満に関与するFTO遺伝子は、海藻と脊椎動物にしか存在しなかった(Robbens et al., 2008)。また、最近の研究では、栽培サツマイモがアグロバクテリウム属由来の転移DNA(T-DNA)配列をゲノムに組み込んでいることが明らかになった(Kyndt et al., 2015)。この発見は、遺伝子組み換え作物の安全性に関する議論に示唆を与えるかもしれないが、著者らの人工的な遺伝子組み換え作物との比較は、遠回しに言っているように思われる。GM作物の生産方法には、植物組織培養段階の使用(Fonseca et al., 2015)を含め、前述の研究で説明したHGTによる外来遺伝子の自然な取り込みと進化の時間軸を通じた適合性の選択と比較して、確かに多くの相違点がある。
結論
遺伝子組み換え食品および飼料の世界的な商業化は、遺伝子組み換え食品由来のDNA、特に導入遺伝子配列のヒトまたは動物消費者の体内での運命と、それが何らかの健康リスクをもたらすかどうかについての多くの議論を刺激した。このレビューの目的は、食物DNAとRNAの人体における運命に関する懸念に対処することである。
食物DNAは、過酷な加工や消化条件下でも生き残ることができ、数百塩基対までの断片が胃腸管で検出される。また、血液中に食物由来のDNAが存在することを示す有力な証拠も見つかっている。食物DNAの小さな断片が血流に入るという十分な証拠があるが、無傷の遺伝子が存在するかどうかはまだ未解決の問題である。遺伝子組み換え作物由来の食品に含まれる導入遺伝子が、植物性食品の宿主DNAよりも取り込まれ、統合される傾向が強いという証拠は見つからなかった。また、植物性食品のDNAが消費者の腸内細菌または体細胞に移行した後に機能(つまり、遺伝子発現)するという証拠も見つからなかったが、この領域は十分に解明されていないようだ。
植物性食品miRNAについては、これらの分子が消化を免れ、消費者の体内に入る可能性があることを示す証拠を確認した。しかし、摂取されたsiRNA分子が消費者の相同配列を標的とし、遺伝子発現に影響を与えることを示唆する証拠は、現時点でははるかに少ないが、それでも説得力があることがわかった。しかしながら、現在入手可能な証拠に基づいても、遺伝子組み換え作物や葉面殺虫・抗ウイルス剤散布に由来する食品に含まれる新規siRNAの摂取による標的外影響は無視できないため、これらの製品のリスク評価には不可欠な要素である。
遺伝子組み換え食品に由来するDNAの運命に関する研究は数多く行われているが、より詳細で長期的な研究が必要である。全ゲノムや腸内メタゲノム配列のデータセットやRNA配列のデータセットが毎年大量に発表されているので、追加費用をかけずに新しい研究を行うことも可能である。これらのデータから、DNA配列のアライメントアルゴリズムを用いて、稀な統合事象を精査することができる。これにより、ゲノムへの統合や発現を含む、トランスジェニック物質のHGTが行われたかどうかに関して、より明確なデータが得られるはずだ。このように多角的に検討することで、遺伝子組み換え食品由来のDNAや遺伝子制御RNAの人体における運命に関する疑問を解決することができると考えている。
ハイライト
- 消化器官に入る前の機械的・化学的処理により、DNAの完全性が損なわれる
- 数百塩基対までのDNA断片(遺伝子組み換え食品由来のDNAを含む)は、消化管を通過しても生き残り、ヒトや動物消費者の血液や組織に到達する可能性がある
- 食事由来のDNAが体細胞や腸内細菌のゲノムに統合されるという証拠は限られている
- 消費者の体細胞や腸内細菌に組み込まれた食物DNAが、遺伝子発現や機能を持つという証拠はない
- 植物性食品のmiRNAは、消化を免れ、消費者の体内に入り、異なる臓器における遺伝子発現パターンに影響を与えることができる可能性がある。

