Personalizing the Care and Treatment of Alzheimer’s Disease: An Overview
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8169052/
オンライン2021年5月28日公開
概要
アルツハイマー病(AD)は、進行性かつ複雑な多因子性神経変性疾患であり、未だに有効かつ安定した治療法が確立されていない。現在、アルツハイマー病の治療に用いられる薬剤は、アセチルコリンエステラーゼ(AChE)阻害剤やN-メチル-D-アスパラギン酸(NMDA)受容体拮抗剤などの対症療法が中心となっている。また、認知症の行動・心理症状(BPSD)の管理には、抗精神病薬、抗うつ薬、鎮静剤、催眠剤、気分安定薬などの薬剤が用いられる。臨床研究では、ADの特徴的な病理であるアミロイド沈着、タウのリン酸化亢進、神経炎症、血管変化などに焦点を当てた治療法が広く検討されているが、これまでのところ、すべての新規候補薬が有意な臨床効果を示すことはなかった。ADの基礎となる不均一な病因と多様な症状から、各アルツハイマー病患者の複雑な遺伝子、エピジェネティック、環境を考慮した精密医療戦略が必要であると考えられる。この論文では、ADに関する文献を包括的に概観し、認知症状とBPSDの両方に対する現在および将来の治療法を、新たな創薬ターゲットとして腸内細菌叢とエピジェネティックな修飾に特に焦点を当てて紹介している。腸内細菌叢とエピジェネティックな変化は、ADの予防と治療のためのプレシジョン・メディシン戦略を最適化することを目的とした、個別にカスタマイズされた新しいアプローチの基礎となる可能性がある。しかし、ADに精密医療を適用するためには、この多因子性神経変性疾患の臨床的・生物学的な複雑さに加えて、その背景にある病理学的プロセスをさらに広範に研究する必要がある。
キーワード
アルツハイマー病、治療、精密医療、腸内細菌叢、エピジェネティクス
アルツハイマー病
アルツハイマー病(AD)は、ゆっくりと進行する不可逆的な疾患であるが、複雑で多因子性の神経変性疾患であり、認知症の最も一般的な形態であり、認知症全体の60%から80%を占めている1。65歳以前に発症した症例はかなり稀で、AD全体の5%以下を占め、早期発症型AD(EOAD)と呼ばれているが、大半の症例は65歳以降に発症し、後期発症型AD(LOAD)または散発性ADと呼ばれている。ADのうち約1~2%は、発症年齢が非常に早く、進行速度が速く、散発性ADではあまり見られない他の神経症状を伴うこともあり、常染色体優性遺伝すると言われている2。
ADは加齢による疾患ではないが、高齢であることはADの主要なリスク要因となる3。具体的には、ADの発症リスクは65歳以降に有意に増加し、85歳以上では最大31%に達する3,4。加齢依存仮説によれば、認知機能は正常な加齢の間に徐々に低下する。加齢が脳内の炎症プロセスに影響を与え、抗炎症因子と抗炎症因子のバランスが崩れ、慢性的な低レベルの炎症が発生すると考えられている6。
一般的に、女性は加齢に伴う認知機能の低下が緩やかで、言語課題の成績が良く、男性は協調性や視空間課題の成績が良いとされている8。一方、ADの女性は、男性に比べて認知機能の低下が早く、言語課題の成績が低いことが分かっている。また、89歳以上の女性では、男性に比べてADの有病率が高いことが報告されている9。このような違いは、男女で脳の萎縮速度が異なることに起因すると考えられる。このような違いは、脳の萎縮速度が男性と女性で異なることに起因すると考えられている。このような性差は、病気の進行だけでなく、併存疾患にも影響を与えている10。女性のアルツハイマー病患者は、神経解剖学的および認知機能の低下が大きいものの、男性は女性よりも併存疾患の負担が大きいため、男性のアルツハイマー病患者の死亡率が高い理由になっているかもしれない10。具体的には、女性は抑うつ、妄想、マニアックな症状、情緒不安定などの症状を示す傾向があるのに対し、男性は無関心、暴言、不適切な行動などを示すことが多いとされている8。
さらに、ADの変動は、民族性の違いとも関連している。例えば、アフリカ系アメリカ人は、白人に比べてADの有病率が高く、病気の進行も早いという報告がある。一方、Mehta et al 12による研究では、アフリカ系アメリカ人やラテン系住民のアルツハイマー病患者は、白人やアメリカインディアンに比べて生存率が高い可能性があることが示されているが、AD関連の死亡率が最も低かったのはアジア人であった12。
その他のAD発症の危険因子には、遺伝的要因13と後天的要因がある。アミロイド前駆体タンパク質(APP)、プレセニリン1(PSEN1)、プレセニリン2(PSEN2)の遺伝子の変異は、通常、初期のADを引き起こすが、後期のADは主にアポリポタンパク質E遺伝子(APOE)の多型、特にε4対立遺伝子の存在と関連している14。APOE遺伝子は、アストロサイトで産生され、脳内のコレステロールの合成と運搬に重要な役割を果たす脳内脂質輸送タンパク質であるアポEをコードしている。ヒトには3種類のアポEアイソフォーム(アポE2,アポE3,アポE4)が存在し、ε4対立遺伝子の保因者はAD発症のリスクが高く、ε2対立遺伝子の保因者は保護的に働く15。後天的な危険因子としては、最も一般的に報告されている脳血管疾患、2型糖尿病、高血圧、肥満、脂質異常症、配偶者の有無、ストレス、うつ病、不十分な睡眠、喫煙などがある16。AD発症リスクを低下させる保護因子としては、身体活動、地中海食、ビタミンDなどがある17。
ADの発症は、臨床症状が現れる15年前(EOADの場合)から 20~30年前(LOADの場合)に起こる。前臨床ADとも呼ばれるADの静かで無症状の初期段階は、脳脊髄液(脳脊髄液)やアミロイド陽電子放出断層撮影(PET)による脳内の分析が可能な病態生理学的特徴の発現を特徴としている17。
精神状態の検査は、神経疾患や精神疾患の臨床症状を判断する上で重要な役割を果たす20。主観的認知機能低下(SCD)とは、標準化された検査では検出できない、自分で経験した認知機能の低下のことで、前臨床のADの後期によく見られる。SCDは、ADの前臨床症状であり、認知症の最も初期の顕著な症状の一つであると考えられている21,22。ある臨界点で、認知機能低下のレベルを補うことができなくなると、標準化されたテストで明らかになる軽度認知障害(MCI)に移行する23。しかし、SCDを持つ人ではMCIや認知症のリスクが高まるものの、必ずしもADの前駆症状ではなく、SCDを持つ被験者は進行性の認知機能低下を示さない場合もある24。Mini Mental State Examination (MMSE)、Clinical Dementia Rating Scale (CDR)、Global Deterioration Scale (GDS)、Neuropsychiatric Inventory (NPI)、Barthel Index of Activities of Daily Living (ADL)、Seoul Neuropsychological Screening Battery (SNSB)は、これらの認知症状を検査するために用いられる神経心理学的尺度です25。多くの場合、連続的な評価しか行われておらず、長期的な追跡調査では、ADに典型的な進行が見られる。ADが疑われる患者の基本的な評価とAD amnestic presentationの初期の神経心理学的プロファイルに加えて、Addenbrooke´s Cognitive Examination (ACE-III)、Montreal Cognitive Assessment (MoCA)、Neuropsychiatry Unit Cognitive Assessment Tool (NUCOG)、Rowland Universal Dementia Assessment Scale (RUDAS)、および前述のMini Mental State Examinationのような認知症のスクリーニング検査がある26。
ADの発症を説明する仮説には、βアミロイド(Aβ)カスケード仮説やタウ仮説などのタンパク質沈着に基づく仮説、ADの最初の事象としての神経炎症の反応過程に基づく仮説、カルシウム不均衡仮説、血管仮説、酸化ストレス仮説などの機能喪失に基づく仮説のグループがある27。
ADの病態は非常に複雑であり、4つの中核的特徴がある。第一の中核的特徴は、タウタンパク質のリン酸化亢進である。タウは、神経細胞内の微小管に結合するタンパク質で、構造維持や軸索輸送に重要な役割を果たしている。タウタンパク質の過剰リン酸化は、微小管の崩壊や神経原線維変化(NFT)への凝集を引き起こす。さらに、APPがβおよびγセクレターゼ酵素によって切断されると、Aβタンパク質断片が細胞外に蓄積・凝集し、ADの脳内にアミロイド斑として現れる28。
ADの病因として、Aβプラークの蓄積とNFTの形成が1世紀以上前から指摘されてきたが、正確な病態生理学的メカニズムや明確な治療法は今のところ見つかっていない。アミロイドカスケード仮説は、アミロイドβオリゴマー(AβO)仮説として、神経毒性を持つ可溶性のリガンド様AβOによってADが誘発されることが提唱されている29。Aβの他にも、βおよびγセクレターゼによるAPPの切断により、可溶性APPβ、C99,AICDなどが生成される30。さらに、γセクレターゼには90種類以上の基質が知られており、そのすべてがAβの生成を妨げる可能性があることから、散発性ADの場合、APPの代謝とAβの生成は、γセクレターゼ基質間の相互作用や競合に依存しているという考えが非常に有力である31。現在、最も研究されている概念の一つは、ADの発症は、Aβの蓄積ではなく、APPの代謝障害が引き金となり、その後、タウ病理によってさらに進行するというものである29,32。この概念は、88%が65歳以前に認知症を発症するダウン症患者においても、APP遺伝子の余分なコピーが原因でタウ病理が主要な加齢現象であるという事実によって支持されている33,34。したがって、影響を受けやすい微小環境にある選択された投射神経細胞内のタウ病変が、それ自体で散発性ADを引き起こすのではないかという仮説が立てられている35。これは、ADモデル動物として用いられている老化促進非トランスジェニックOXYSラット36における後期アミロイド蓄積の所見や、ADの神経病理が高度に進行している認知的に無傷な人の中枢神経系(CNS)におけるシナプスの機能的完全性は、シナプスのタウオリゴマーの欠如と関連しているという所見と一致している37。そのため、Braak氏のステージ別の測定結果と比較して、接続性に基づいた個別のタウPET測定結果は、患者を中心としたタウ標的の臨床試験介入計画のサンプルサイズを約40%削減した38。
中枢神経系の炎症は、ADの非常に初期の段階で、おそらく臨床症状が現れる数十年前に始まり、炎症プロセスの特徴や強度は、疾患の進行とともに変化する。Cuello博士は、Aβが付着した神経細胞が、炎症の開始因子となり、動員されたミクログリアを介して疾患を悪化させる炎症過程の活性化因子となる可能性を示唆している39。この初期過程は、AD末期の中枢神経系の炎症過程とは異なり、抗炎症剤で管理できる可能性がある。ミクログリアは、中枢神経系の常在マクロファージであり、ADでは活性化され、腫瘍壊死因子(TNF)-α、インターロイキン(IL)-1β、一酸化窒素(NO)などのサイトカインを産生し、神経炎症に影響を与える28。40 ミクログリアは、脳の自然免疫細胞であり、外来の抗原に対して非特異的に作用し、ADの発症に非常に早くから関与していると考えられている。ミクログリアは、環境に応じて、炎症を起こす状態(細胞傷害性、M1)と、炎症を起こさない状態(免疫抑制性、M2)の2つの機能状態を獲得することができる。M1ミクログリアは、IL-1α、TNF-α、補体成分などの炎症性サイトカインを放出し、それに続いて神経毒性を持つA1反応性アストロサイトを誘導する。IL-1α、IL-1β、IL-6,TNF-αなどの炎症性サイトカインは炎症と神経変性を促進し、IL-10などの抗炎症性サイトカインはこれらの作用に対抗する41-43。
しかし、神経変性とミクログリアの関係は、当初考えられていたよりも複雑であることが示唆されている。また、最近、神経変性部位に存在するミクログリアのサブセットとして、Disease-associated Microglia (DAM)が同定された46。このミクログリアのサブセットは、DAMの活性化に必要な受容体であるTREM2(Triggering receptor expressed on myeloid cells 2)をコードする遺伝子の発現を含む、特異的な転写および機能プロファイル47によって特徴づけられる。さらに、TREM2の変異は、以前からADの発症と関連しており49,50,TREM2の欠損は、ADのマウスモデルにおいて、Aβの蓄積と神経細胞の減少を促進することが示されている51,52。さらに、トランスクリプトームプロファイリングにより、APOEとトランスフォーミング成長因子β(TGF-β)がDAMの表現型の重要な制御因子であることが確認された53。Krasemannらは、TREM2-APOE経路が神経変性疾患におけるミクログリアの表現型変化の重要な制御因子であることを明らかにした53。この経路が活性化されると、ミクログリアの表現型が恒常性から神経変性の表現型に切り替わり、ミクログリアが脳の恒常性を維持できなくなる。したがって、ADの発症・進行過程におけるミクログリアのさまざまな役割を理解・認識することは、将来の潜在的な治療戦略やプレシジョン・メディシン・アプローチの適用に非常に重要である。
さらに、血管病変や血液脳関門(BBB)の破綻もADに関連している。AD関連の神経変性で最初に影響を受けるのは内嗅皮質であり、小脳、海馬CA1亜領域、前脳基底部のネットワークに広がっていくと考えられている。疾患が進行すると、神経変性は側頭葉全体に拡大し、大部分の皮質層に影響を及ぼす28。ここでは、神経細胞やシナプスの大量喪失がADの認知機能低下と相関している。
ADの病因および病態生理に関するデータが蓄積されているにもかかわらず、ADは臨床的、病理学的、生物学的に非常に複雑であるため、その分子メカニズムの解明はまだ不完全である。具体的には、アルツハイマー病患者のリスク因子、生体分子プロファイル、および特定の基礎的な病態生理学的プロセスは、高いバリエーションを示している。また、年齢、民族、性別に加えて、ADの基盤となっている広範な遺伝子変異も疾患の不均一性に影響を与えている。これまでのところ、様々な登録遺伝子が同定されており、個々の遺伝子変異が疾患リスクに及ぼす影響は小さいとされている55。しかし、ADの原因となる未知の遺伝的要因はまだ多く、遺伝的リスク変異体を同定し、関与する特定の分子経路を明らかにするためには、さらなるシーケンス研究が必要である。さらに、ADにはかなりの非遺伝的要素があり、脳血管疾患や外傷性脳損傷などのさまざまな環境因子や知的活動などの生活習慣因子がAD発症リスクに影響を与え、個人の遺伝的背景と大きく相互作用している。アルツハイマー病患者に潜在する特定の病態生理プロセスは、脳イメージング技術の応用や、血中および髄液中のバイオマーカーの定量化によって、より身近なものとなっている。したがって、精密医療をADに適用することで、ADの根本的な分子的・臨床的不均一性を明確にし、特定されたリスクと疾患プロセスの分子パターンに合わせた予防・治療介入を行うことが必要である55。
ADの薬理学的治療
ADに対する有効かつ安定した治療法はまだ存在せず、臨床試験の失敗率は他の疾患よりも高い(99.5%)。ADの疾患修飾治療が失敗する理由としては、ADの進行過程の後半での治療開始、不適切な薬剤投与、標的選択の誤り、そして主にADの多様な病態生理に関する知識の不足が挙げられる56。さらに、これまでのほとんどの臨床試験では、ADの臨床的・分子的な不均一性を無視し、ADを均質な疾患とみなしていたことも、ADに有効な治療法を特定できなかった主な理由の一つであると考えられている。
現在、ADの治療は対症療法を中心に行われているが、ADの特徴的な病理をより明確に治療することを目指して臨床研究が展開されており、これらの治療法がADに伴う進行性の衰えを抑制することが期待されている。最後に、精密医療は、現在、ADの臨床試験に取り入れられ始めており、ADの遺伝的リスクがわかっている被験者のサブグループや、特定の生物流体や神経画像のバイオマーカーに焦点を当てている55。
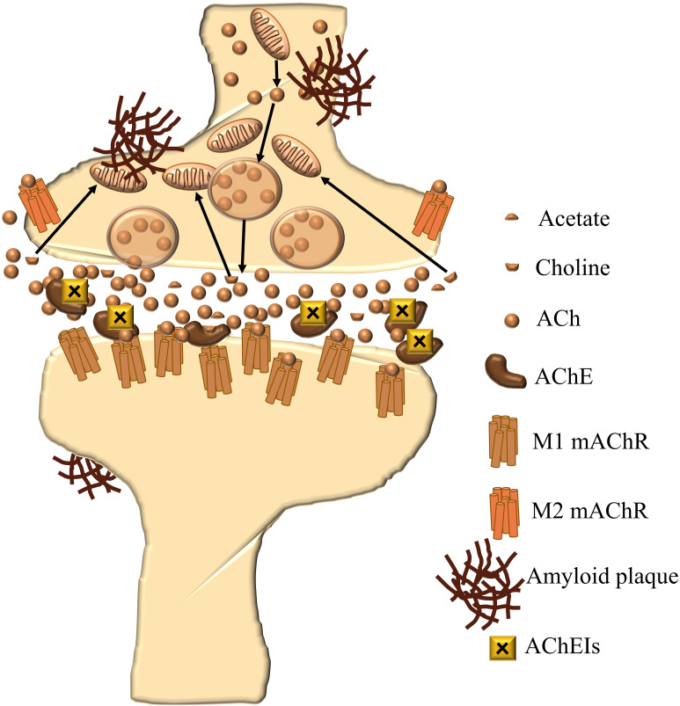
しかし、ADの治療法は、この10年間で大きな変化や改善はない。この治療法には、米国食品医薬品局(FDA)が承認した4つの薬剤:59アセチルコリンエステラーゼ(AChE)阻害剤のドネペジル、ガランタミン、リバスチグミン、およびN-メチル-D-アスパラギン酸(NMDA)受容体拮抗剤のメマンチンが含まれる(図1)。3種類のAChE阻害剤のうち、ガランタミンとドネペジルはAChE阻害剤であり、リバスチグミンはAChEとブチルコリンエステラーゼ(BChE)の両方を阻害する。これらの薬剤は、コリン作動性理論に基づき、コリン作動系が認知過程に重要な役割を果たしていることから、脳内アセチルコリンの消失がAD症状の発症に関与していると考えられている60。したがって、アセチルコリンを分解する酵素であるAChEおよびBChE(図2)を阻害することがAD治療の第一選択となる61。
図1 ADの各段階でFDAが承認している治療法
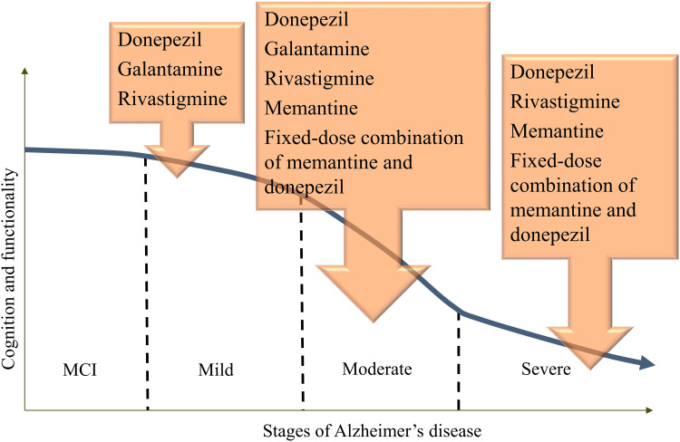
図2 AChE阻害剤による治療中のADのコリン性シナプス
これらの薬剤は、認知機能を改善することが確認されており、一部の薬剤は行動症状にも好影響を及ぼす可能性がある62。しかし、これらの薬剤はいずれも病気の経過や転帰に影響を与えるものではない63。ADの薬物療法は病期によって異なり(図1)軽度から中等度のADにはAChE阻害剤が、中等度から重度のADにはNMDA受容体の拮抗剤であるメマンチンが用いられる64。これらの薬剤は症状を緩和するが、時には副作用を誘発する。これらの薬剤は、症状の緩和をもたらすが、時には副作用を引き起こすこともある。残念ながら、これらの薬剤は疾患修飾性がなく、治療薬ではない65。これらの薬剤は、疾患の進行を遅らせることはできないが、一時的に脳機能を改善し、AChE活性を低下させてアセチルコリン濃度を高くすることで認知機能の低下を遅らせることができる66。他のAChE阻害剤については、フィソスチグミン(下痢、胃痙攣、唾液分泌増加、発汗過多)タクライン(悪心、嘔吐、食欲不振、下痢、不器用、肝障害、半減期が短いため実用的でない投与方法(1日4回))メトリフォネート(長期使用による神経筋、呼吸器系の副作用)などの重大な副作用があり、AD治療薬として承認されなかった61。
軽度、中等度、重度のアルツハイマー病患者8257名を対象としたドネペジルのコクラン・スタディの結果では、認知機能、日常生活動作、臨床医評価によるグローバル変化印象尺度において、統計的に有意な改善が認められたが、行動症状に対しては有意な効果は認められなかった。ドネペジルの用量(5mgおよび10mg)はいずれも有効であったが、副作用(表1)は高用量の方が胃腸障害を中心に多く報告された67。
表1 アセチルコリンエステラーゼ阻害剤の有害反応
| ボディシステム | 効果 | 予防措置 |
|---|---|---|
| 心臓血管系 | ↑洞房結節および房室結節、徐脈、心臓ブロックおよび/または失神エピソードに対する迷走神経の影響 | 徐脈および不整脈を誘発する可能性があるため、β遮断薬、カルシウムチャネル遮断薬、ジゴキシン、ピロカルピン、またはQTc間隔を延長することが知られている薬剤との併用による心臓伝導障害のある患者 |
| 筋肉系 | ↑サクシニルコリン型筋弛緩 | サクシニルコリン型筋弛緩薬による麻酔中 |
| 胃腸系 | ↑胃酸分泌、↑消化性潰瘍を発症するリスク | 潰瘍の病歴のある患者、および非ステロイド性抗炎症薬を服用している患者 |
| 吐き気、嘔吐、下痢、脱水症状の可能性、体重減少 | 栄養不足の患者 | |
| 呼吸器系 | ↑気管支分泌物 | 喘息または閉塞性肺疾患の病歴のある患者 |
| 中枢神経系 | 錐体外路症状の悪化 | パーキンソン病の患者 |
備考 アセチルコリンエステラーゼ阻害剤を使用していない状態と比較して、↑効果が増加している。
もう一つのAChE阻害剤であるリバスチグミン(1.5~6mgを1日2回投与)は、ADの全病期を対象にFDAから承認された。68 リバスチグミンは、高用量(6〜12mg)を投与した場合、軽度から中等度のアルツハイマー病患者において、認知機能の統計的に有意な改善をもたらした。行動症状に対しては有意な効果は認められなかった。副作用(表1)は高用量で非常に多く、ほとんどが消化器症状であったが、頭痛や失神も報告されている。また、rivastigmineの経皮吸収型パッチも試験された。低用量の小型パッチは、大型パッチ(高用量)および同等の1日投与量である口腔周囲用薬と同等の効果を示したが、副作用は少なかった68。
また、ガランタミン(4~12mg、1日2回)の効果をメタアナリシスで解析したところ、軽度から中等度のADにおいて、認知機能が統計的に有意に改善したという結果が得られた。副作用(表1)は、他のAChE阻害剤と同様であった69。このレビューでは、ADのステージ、臨床特性、忍容性に応じて、用量の漸増やAChE阻害剤の切り替えを行うことで、奏効率が向上する可能性が示唆された。また、AChE阻害剤を切り替えることで、アルツハイマー病患者における有効性や安全性・忍容性の欠如に関する問題を防ぐことができるかもしれない69。
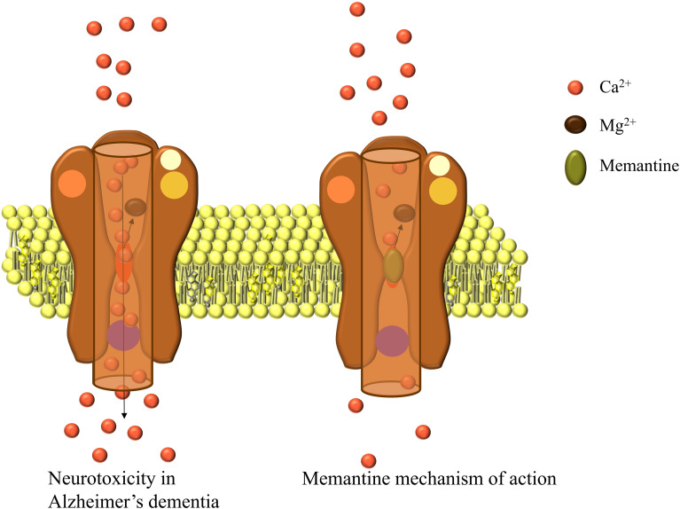
ADでは、アミロイド斑がグルタミン酸系の神経伝達に影響を与え、シナプスおよびシナプス外のグルタミン酸レベルを上昇させ、興奮毒性を誘発する。その結果、神経活動の低下、神経細胞の減少、ADの進行、認知機能の低下などが起こる。シナプスのNMDAグルタミン酸受容体の活性化は、神経細胞の生存に不可欠であるが64,過剰なグルタミン酸刺激は、興奮毒性を引き起こし、シナプス機能の喪失や神経細胞死を引き起こし、これらのプロセスは、ADの神経変性変化につながる病態の一部であると考えられている70。メマンチンは、非競合的なNMDA受容体拮抗薬であり、ADのようにシナプス間隙に高濃度のグルタミン酸が存在する場合(図3)受容体に結合する71。
図3 ADにおけるNMDA受容体の過剰刺激とメマンチンの作用機序
2017年に行われたメタ解析研究では、中等度および重度のアルツハイマー病患者を対象に、ドネペジルの単剤投与とドネペジルとメマンチンの併用療法との間で有効性と安全性を比較した。本試験では、認知機能、行動・心理症状、グローバル機能を分析した。その結果、有意な副作用はなく、すべての領域で併用療法が優れていることが示された72。2018年のメタアナリシスでは、AChEとメマンチンの安全性と有効性が比較されており、この研究によると70,軽度・中等度ADの認知機能を改善するために最も有効なアプローチは、(個別に)ドネペジル10mgとガランタミン24mgまたは32mgを1日1回投与することであった。中等度から重度のADでは、メマンチン20mgとドネペジル10mgの併用療法が最も効果的であった。また、メマンチンの受容性が最も高かった70。行動症状への影響は認められなかった73。
新規の作用機序を持つ多くの新薬が動物モデルで有効であったが、認知機能の低下を改善する効果を示したものはわずかであった。また、現在までに研究された薬剤(ニコチン受容体アゴニスト、グルタミン酸受容体モジュレーター、γセクレターゼ阻害剤、成長因子、スタチン、モノクローナル抗体、タウ阻害剤、セロトニン受容体モジュレーターなど)のほとんどは、臨床試験のフェーズ1~3で開発中または中断されている。その結果、多くの新規候補薬が二重盲検プラセボ対照試験で臨床効果が得られなかったり、重篤な副作用のために中止されたりして、過去10年間に新規のAD治療薬は存在しなかった。
AChEおよびNMDA受容体阻害剤に加えて、前臨床試験および臨床試験では、GABA作動性調節剤、セロトニンおよびアデノシン受容体調節剤、ならびにヒスタミン作動性調節剤など、他の神経伝達物質に基づく治療法も検討されている74,75。
ADの治療戦略として最も広く検討されているのが、Aβカスケードの阻害であり、βセクレターゼ(verubecestat, lanabecestat, elenbecestat, atabecestat, CNP520)やγセクレターゼ(tarenflurbil, semagacestat, avagacestat)を阻害する方法と、最近ではαセクレターゼの活性を高める方法がある76。 -Aβオリゴマーを不安定にしたり、消去する抗Aβ抗体(bapineuzumab, gantenerumab, aducanumab)を用いた受動的免疫療法も、Aβの病態を標的とした発展途上の戦略の一つである。また、Aβのオリゴマー化を防ぐ抗Aβ凝集体として、金属タンパク質を減衰させる化合物(クリオキーノl- PBT1, PBT2)が登場している。76-78 アミロイドカスケード仮説やAβO仮説の限界や不十分さは、Aβの生理的機能を無視していることに起因すると考えられる。第一に、Aβはいわゆる「抗菌ペプチド」と呼ばれる分子群に類似していることが確認されており、その後、Aβが8つのヒト病原体の増殖を抑制することが証明されたことから、Aβが自然免疫系の一部として機能している可能性が示唆されている41。 さらに、Aβは、プロテアーゼ・ネキシン2(PN-2)と呼ばれるクニッツプロテアーゼ阻害ドメインを含むAPPと同様に、トリプシンなどのセリンプロテアーゼや凝固因子を阻害することができ、抗凝固剤として作用する41。Aβは、アポリポタンパク質に類似した機能を持ち、膜貫通タンパク質であるABCA1と相互作用することで、細胞からのコレステロールの排出を促進し、細胞内のコレステロール濃度を低下させることが示されている。また、Aβはピコモル濃度では記憶力を向上させるが、過剰に存在する場合には認知機能を低下させる79。実験的には、Aβは鉄、銅、亜鉛に対する高い結合親和性により、必須微量栄養素の利用を制限することで、新血管形成を遅らせ、さらには腫瘍細胞の増殖を遅らせることで、腫瘍細胞の成長を抑制していると考えられている。このように、Aβの生理的役割は、感染症の予防、脳卒中の予防、脳損傷後の回復促進、コレステロールの輸送、シナプス機能の制御、腫瘍抑制への貢献など、多岐にわたっており、まだ十分に認識されていない。
したがって、Aβの免疫化や、Aβ産生の除去・中和・抑制を目的としたその他の処置は、感染症、脳損傷、2型糖尿病、腫瘍などのAβ産生・沈着の潜在的な活性化因子の評価に先立って行われるべきである。これは、うつ病による仮性認知症やビタミンB12低下症(それぞれ抗うつ薬とビタミンB12で治療)など、可逆的な認知症の原因をチェックする際の、日常的な臨床評価の一部となりうる。その後、認知症が疑われる患者や顕在化した認知症患者の評価に基づき、アミロイド除去のための介入を検討する前に、次のステップとして、
- 1)感染症の可能性、
- 2)アミロイドの生成と沈着を促進する確立されたが治療可能な他の危険因子、特に2型糖尿病、
- 3)ミクログリアの活性化の可能性による差し迫った神経炎症の治療
を目指すべきであると提案する。また、アシクロビルなどの抗ウイルス剤やケトコナゾールなどの抗真菌剤、さらには有益な免疫選択的抗炎症剤などを用いたADの原理実証臨床試験が近い将来必要とされている。
タウ発現阻害剤(アンチセンスオリゴヌクレオチド)ホスファターゼ修飾剤(PPZ、OKA、メマンチン)タウキナーゼ阻害剤(チデグルシブ、リチウム、アミノチアゾール、オキシンドールキナゾリン、サイレネード、R-ロスコビチン……)などを用いて、タウの過リン酸化、凝集、あるいはタウの発現レベルや活性を阻害すること。aloisine)タウアセチル化阻害剤(salsalate)タウ脱グリコシル化阻害剤(phosphodiesterase type 4 inhibitor)タウ凝集阻害剤(methylene blue, LMTX)微小管安定化剤(epothilone D, NAP, TPI 287)なども、ADの進行を防ぐ有効な治療アプローチとなりうる。 76 -78,81
さらに、JAK2/STAT3,NF-κB/NLRP3,p38 MAPK、カルシウム/カルシニューリン/NFAT、TREM2,TLR、またはRAGE/脳脊髄液1R/P2Y1R経路などのカスケードを阻害することによる自然免疫を標的とした炎症反応の抑制(stattic, SB203580, SB202190, SP600125, NJK14047, VIVITペプチド、タクロリムス、抗apoE、抗TREM2,GW2580,MRS2179)や、Aβ特異的Th2リンパ球や抗AβIgGを用いた適応免疫系を標的とした治療法は、神経炎症を伴うADの症状を軽減するための新たな戦略となりうる。現在、アルツハイマー病患者の治療には、アスピリンやイブプロフェンなどの非ステロイド性抗炎症薬が使用されている76-78,81。また、抗酸化物質の神経保護作用は、予防および治療戦略として有望であることから、アルツハイマー病患者にはビタミンE(抗酸化物質)の補給が行われている77。
さらに、ニューロトロフィン(hNGFp、AAV2-NGF、BDNF)を直接投与したり、ニューロトロフィン受容体を標的としたペプチド模倣薬(7,8-DHF、doxygedunin、LM22A-4,bicyclic BDNF loop mimetic)を投与して向神経性効果を高めることで、間接的に神経を再生させることも、ADの治療法として期待されている。ADに対処するもう一つの戦略は、神経再生を促進することである。これは、グリア-ニューロン変換(ニューロジェニン2,Dlx2,さまざまな分子の組み合わせを使用)や、向神経性因子遺伝子をコード化するように遺伝子改変した幹細胞の移植、または向神経性因子や成長因子で前処理した幹細胞の移植によって、機能的な神経細胞を補充することで達成できる可能性がある76-78,81。
例えば、2型糖尿病治療薬であるメトホルミンは、ADにおける抗炎症作用と神経保護作用を有することから、AD治療薬として再利用されている78,82。AD治療薬として再利用できる化合物は、テトラサイクリン系抗生物質、カルシウム拮抗薬、アンジオテンシン受容体拮抗薬(ARB)グルカゴン様ペプチド1(GLP1)類似体、レチノイド治療薬の5つのクラスが提案されている。しかし、最近、ADにおけるリパーパスの最優先候補として選ばれたのは、ROCK2阻害剤のfasudil、新規の抗アポトーシス作用を持つコリンエステラーゼ阻害剤のphenserine、そして抗ウイルス剤のaciclovir、valaciclovir、funciclovirの3つである82。
マルチターゲットディレクテッドリガンド(MTDL)は、複数の分子標的を相乗的に標的とするAD治療戦略の新しいアプローチである。例えば、RPELと名付けられた新しい化合物は、タクラインのファーマコフォアフラグメントを含むピペラジン誘導体である。RPELは、コリンエステラーゼ阻害作用、タウタンパク質のリン酸化抑制作用、Aβペプチドの放出抑制作用を有し、認知機能障害の予防に有効な二重作用を持つ化合物である78,83。
認知症の行動・心理学的症状の治療
アルツハイマー病患者には、記憶障害や学習障害などの認知機能障害84に加えて、認知機能以外の症状(認知症の行動・心理症状(BPSD)と呼ばれる)が見られる。BPSDは、行動、精神症状、気分障害などの異質なグループであり、85 アルツハイマー病患者の約90%に認められる。BPSDには、睡眠障害、不安、攻撃性、抑うつ、徘徊、妄想、幻覚、抑制不能などの症状が含まれ、84-87,1)無気力、2)情動(不安、抑うつ)3)精神病(妄想、幻覚)4)抑制不能(運動過多、衝動性、攻撃性)に分類される84,86。84,86 アルツハイマー病患者の50%以上は、同時に4つ以上の神経精神症状を示しており、このような症状の存在は、認知機能の低下だけでなく、正常な機能にも影響を及ぼし88,アルツハイマー病患者の施設入所の主な理由の一つとなっている。84 BPSDを有するアルツハイマー病患者の男女間には、性差が認められている。同様に、BPSD と診断された EOAD 患者と LOAD 患者の間にも違いが見られた。LOAD 患者は EOAD 患者に比べて BPSD の重症度が高かった89。
AD 患者における BPSD の発症は、海馬、脳幹核、海馬傍回などの様々な脳領域における神経細胞の減少、グルタミン酸の減少、運動過多や攻撃性に関連すると想定される前頭葉や側頭葉におけるコリン作動性およびドーパミン作動性神経伝達の変化、無気力や抑うつの発症につながると考えられる GABA およびセロトニン濃度の変化の結果である90。しかし、BPSDおよびADの複雑な病因により、適切な治療法の選択はしばしば困難である。
BPSD の治療の一部には、疼痛管理や併存する身体疾患の治療が含まれる92。BPSD に対する薬物療法は行われているが、特定の副作用を引き起こす可能性があり、必要な場合にのみ処方されるべきである。90,91 行動的介入、個人的介入、介護者介入、環境的介入92 は、家族やその他の介護者を教育し、支援することを目的としている。これには、様々なトレーニング、コミュニケーションスキルの向上、認知症ケアマップの作成、心理社会的介入、身体活動、感覚刺激、現実志向、認知刺激、検証療法、心理療法的介入、回想療法などが含まれる90,91。
家族を対象とした心理教育トレーニングは、86%以上の研究で効果が認められており、サポートグループは介護者と患者の両方に効果があった。90,91 感覚刺激を伴う療法は、BPSD 患者に有益な効果をもたらす可能性があり、特に焦燥感や行動障害の軽減に有効である。いくつかの研究では、音楽セッションがアルツハイマー病患者の激越、せん妄、過敏性、抑うつ、不安の軽減に役立ち、記憶と方向性を改善することが示されている93,94。 明るい光療法(BLT)は、激越、攻撃性を軽減し、認知能力と運動行動を改善することで、BPSD患者に良い結果をもたらす93。91 心理学的介入は、認知症の後期において、特に介護者と患者の両方が治療に参加する場合に効果的であると言われている。しかし、ADにおけるBPSDの不均一性のため、これらのアプローチでは十分な効果が得られないことがあり、薬物治療を中心とした戦略がとられるようになっている92。
90,91 BPSD に対しては、副作用の少ない抗うつ薬が処方されるのが一般的である。例えば、通常、うつ病患者の治療に用いられるmirtazapineは、アルツハイマー病患者に治療効果を示していない91。抗認知症薬であるAChE阻害剤やメマンチンも、BPSD治療に有用である可能性がある。AChE 阻害剤であるドネペジル、リバスチグミン、ガランタミンは、通常、認知症患者の BPSD 治療に処方される。88 しかし、ドネペジルの投与は、プラセボと比較して、アルツハイマー病患者のBPSD軽減には効果がなかった。
BPSDに対して処方されているもう一つの薬のグループは、抗精神病薬である。95 非定型抗精神病薬はBPSD患者に一定の治療効果を示し、最も効果的なのはリスペリドン、オランザピン、クエチアピン、アリピプラゾールである。しかし、抗精神病薬はしばしばパーキンソン病などの錐体外路性の副作用を引き起こす16。特定のBPSD症状、特に攻撃性に対しては、抗精神病薬は症状の緩和に有用であるかもしれないが、その使用は制限され、コントロールされなければならない90。88 したがって、抗精神病薬による治療は、重度の症状や難治性の症状があり、非薬物療法や他の薬理学的アプローチが有効でない、あるいは不可能な場合にのみ処方されるべきである。96 抗精神病薬の重篤な副作用の一部は男性よりも女性に多く見られるため、女性患者に抗精神病薬を投与する際には特に注意が必要である。
ベンゾジアゼピン系薬剤は、BPSD患者によく使用されるが、その有効性は通常、引き起こされる副作用によってぼやけてしまう。90 BPSD を有する AD 患者の治療には、異なる薬物療法の組み合わせがより有益である可能性がある。例えば、メマンチンとシタロプラムの併用により、アルツハイマー病患者の症状が軽減された。さらに、ドネペジルとメマンチンを併用したアルツハイマー病患者では、ドネペジルのみを投与した患者と比較して、BPSD、全体機能、および認知機能の改善が認められた72。また、ドネペジルとα-コリンを併用した患者(n=57)では、ドネペジルとプラセボを併用した患者(n=58)に比べて、抑うつ、無気力、焦燥、不安などのBPSD症状が有意に改善した。
ADのケアと治療の個別化
ADの治療とケアの個別化は、プレシジョン・メディシン(精密医療)のアプローチを導入することにより、アルツハイマー病患者の現在の治療と社会的ケアを変えることを目的としている。プレシジョン・メディシンとは、生物学、ライフスタイル、環境などの個人差を考慮し、病気の予防や治療の効果を最大限に高めることを目的としたアプローチである。プレシジョン・メディシンは学際的な性格を持ち、ADのような複雑な疾患の調査、予防、治療、治癒のための一連のメカニズムを統合する。このアプローチは、正確な診断を必要とし、副作用を最小限に抑えることを目的としており55,個々の患者の特定の生物学的および遺伝的背景だけでなく、バイオマーカー、表現型および心理社会的特性に関する知識に基づいている。ADに精密医療を適用するためには、ADの疾患特異的、メカニズムベース、または(エピ)ジェネティクス依存性のバイオマーカーを同定・検証することも必要であり、これらのバイオマーカーは、ADの臨床診断および患者の感受性の改善・向上、疾患の進行および治療効果のモニタリング、さらには特定の薬剤の有益性および副作用の分析にも役立つ。
ケアや治療を個人化することで、アルツハイマー病患者の自立、選択、サービスのコントロールを可能にする必要がある。この戦略には、各患者の人口統計学的情報(すなわち、APOE遺伝子型、年齢、性別、教育、環境暴露、ライフスタイル、病歴)を収集し、患者の層別化の基礎とし、身体活動、食事、脳刺激、社会的コミュニケーション、投薬などの精密医療戦略の設計を容易にするための詳細な情報を組み込むことが含まれる100。最近の研究によると、101 系統的、包括的、一時的な評価は、情報収集、関係構築、教育、支援を目的として、人を中心とした情報提供を容易にするためのファイル、文書化、コミュニケーションシステムを活用し、チームの協力的なアプローチで行われるべきである。これらの人を中心とした評価は、可能なケアの選択肢、緩和ケアやホスピスについての知識を深めることを主な目的として、身体的、心理社会的、財政的な福祉を最適化するためのより良い計画につながるはずである。 101 AD の正確な病態生理学的メカニズムも、すべての AD 患者に適した明確な治療法も、これまでのところ見つかっていないため、精密医療のアプローチが必要である。
しかしながら、生命科学の進歩とマルチオミックス研究(ゲノミクス、トランスクリプトミクス、エピゲノミクス、プロテオミクス、メタボロミクス、マイクロバイオミクスなど)の出現により、精密医療に焦点が当てられるようになり、未だ治療不可能な他の疾患と同様に、ADの診断および治療の改善が期待されている41。ADの複雑な遺伝子、エピジェネティック、環境を考慮すると、102 アルツハイマー病患者に最も効果的な精密医療を実施するためには、人口統計学的情報(APOE遺伝子型、年齢、性別、教育、環境暴露、生活習慣、病歴)と詳細な情報(ゲノム変異、脳画像、中枢および末梢のバイオマーカー、患者由来の神経細胞を用いた機能的アッセイ)の両方を包括的に収集して、患者の層別化を確立する必要がある。 100 環境への影響については、2つの人口ベースの成人コホートを対象に、主要道路の近くに住むことと神経疾患の発症率との相関を調べる研究が計画され103,その結果、その結果、主要道路の近くに住むと、認知症の発症率が高くなることがわかった。その原因として、交通関連の大気汚染物質(超微粒子、窒素酸化物など)が神経炎症や酸化ストレスを引き起こす可能性があることや、騒音が睡眠の断片化や認知機能の低下を引き起こす可能性があることが疑われた。
同時に、人工多能性幹細胞(iPSC)のような新しい技術は、ADの遺伝的決定因子や環境調節因子の探索や、アルツハイマー病患者の治療に革命をもたらすことが期待される潜在的な薬剤のスクリーニングにおいて、非常に価値がある104。中等度・重度のADでは、近年、神経の炎症を標的とした薬剤や神経再生治療など、ステージに応じた介入戦略が行われている100。
しかし、次の章では、AD管理の新たなターゲットとして、腸内細菌叢とエピジェネティックな変化に注目する。腸内細菌叢の膨大なバリエーションと特異的なパターンは、ADの予防と治療のための精密医療戦略を最適化することを目的とした、個別にカスタマイズされた新しいアプローチの基礎となる可能性がある。
腸内細菌叢をAD治療のターゲットに
ヒトの腸内には約1000種の生物が生息しており、その細菌密度は1mLあたり約1011個と推定されている。105 腸内細菌叢は個人間で異なっており、これはヒトの生化学的、遺伝的な個性の違いや、病気に対する抵抗力に影響を与える現象である106,107。成人した個体では、腸内細菌叢の組成は、宿主の遺伝、年齢、宿主の免疫系の状態、精神的ストレス、食事、運動など、さまざまな個体要因の影響を受け、その結果、個人間および個人内で腸内細菌叢の組成は非常に大きく変化する109。腸内細菌叢で合成される膨大な数の代謝酵素を考慮すると、腸内細菌叢がヒトの生体における付加的な(代謝)器官とみなされるのも不思議ではない110。
このコミュニケーションは、神経、免疫、内分泌、代謝の各シグナルを介して行われている111。また、腸内細菌叢では、セロトニンやドーパミンをはじめとする様々な神経伝達物質や神経調節物質が直接合成されている113。
したがって、ADを含む神経変性疾患の発症に脳-腸-微生物叢の軸の乱れが寄与していることは十二分に予想され114,それを裏付ける実験的、臨床的データも増えてきている。細菌の細胞は互いに結合するためにアミロイドを産生するため、腸内細菌叢はそれらのタンパク質のかなりの量の供給源となる115。細菌とヒトの中枢神経系アミロイドは、その一次構造が異なるが、三次構造には類似性がある116。115 アミロイド以外にも、腸内細菌はリポポリサッカライドを産生し、これがCD14との相互作用によりtoll-like receptor (TLR) 4を活性化し、炎症反応を促進する116 Aβに対する炎症反応にも同様の経路が存在する117。さらに、腸の炎症マーカーであるカルプロテクチンは、S100A8とA9のヘテロ二量体であり、Aβやα-シヌクレインと同様にアミロイドオリゴマーやフィブリルを形成し、さらにはAβのフィブリル化を誘導するタンパク質である118。アルツハイマー病患者の脳脊髄液や脳内では、カルプロテクチン濃度が有意に高く、アミロイドの凝集やAβとの共凝集を促進する118。さらに、アルツハイマー病患者の糞便でもカルプロテクチン濃度が上昇しており、循環系に入り込んで神経炎症に寄与する可能性が想定される119。
明らかに、加齢に伴う腸由来の炎症反応や高齢者の食生活の乱れは、認知症の発症を促進する可能性がある120。このことは、腸内細菌叢の構成を改善する治療法が、ADの新たな治療法になることを示唆している。一方、プロバイオティクスやプレバイオティクスの使用は、ADのリスクを低減し123,アルツハイマー病患者の認知機能を改善すると考えられている124。例えば、コーヒー豆由来の抗酸化ポリフェノールは、脳損傷による酸化ストレスを軽減し、ADのリスクを低下させる125が、ポリフェノールのバイオアベイラビリティと活性は、健康な腸内細菌叢に強く依存する126。さらに、高脂肪食は、腸内細菌叢の変化を引き起こし、腸管伝染性とリポポリサッカライドの吸収を増加させ、エンドトキシン血症と全身性炎症を引き起こすという証拠がある127。
腸内細菌叢に作用する新たな抗AD治療薬の可能性を扱った臨床研究がいくつかある。例えば、中国で行われた第3相臨床試験では、オリゴマン酸ナトリウムが腸内細菌叢の異常とそれに伴うフェニルアラニン/イソロイシンの蓄積を抑制し、神経炎症を抑制し、認知機能障害を回復させたことが報告されている129。アミロイドと神経原線維のもつれを伴うAD様病態(ADLPAPT)トランスジェニックマウスモデルを用いて行われた最近の研究では、ADLPAPTマウスは野生型(WT)マウスとは腸内細菌叢の構成が異なり、上皮バリアーの完全性が失われ、慢性的な腸炎および全身性炎症が特徴的であることが示された130。この研究では、WTマウスの腸内細菌叢をADLPAPTマウスに頻繁に移植することで、アミロイドβ斑や神経原線維変化の形成が抑制され、グリア反応性や認知機能障害が改善された130。 ADは腸内細菌叢の不均衡と密接に関係している、あるいは腸で始まる可能性があることを示唆する証拠が増えている。130 ADは腸内細菌叢の不均衡と密接に関係しており、腸内で始まる可能性もあることを示唆する証拠が増えてきている。個人間および個人内で腸内細菌叢の組成が大きく異なることを考慮すると、細菌叢を標的とした治療介入は、ADの精密医療アプローチの新たな手段となる可能性が大きい。
ADのエピジェネティック治療の可能性
エピジェネティックなメカニズムの中でも、ヒストンの修飾は、遺伝子発現の制御に関与しており、ADの発症に重要な役割を果たしている。133,134 ヒストンのアセチル化は、最も研究されているヒストンの翻訳後修飾であり、ADの細胞モデルや動物モデルを用いた研究の結果、ヒストンのアセチル化が一貫して減少していることが示されている135,136。そのため、様々なヒストン脱アセチル化酵素阻害剤(HDACi)が、試験管内試験および生体内試験でADの病理学的特徴を回復させる可能性が検証されている133。HDACiは、Aβ蓄積やタウリン酸化などのADの病理学的特徴に影響を与えるだけでなく、シナプス可塑性や学習・記憶を改善することが示されている137,138。クラスI、II、IVのHDACに作用するボリノスタット(SAHA)、トリコスタチンA(TSA)、バルプロ酸(VPA)、酪酸ナトリウム(NaB)、4-フェニル酪酸ナトリウム(4-PBA)、エンチノスタット(MS-275)などのpan-HDACiや、サーチュインクラスIIIのHDACに特異的な阻害剤であるニコチンアミドは、ADの動物実験で低アセチル化を逆転させ、有益な効果を発揮することが示されている137,138。HDAC阻害剤ボリノスタットは、ヒトミクログリアにおける転写因子PU.1の発現を抑制する効果があることが示されている。HDAC阻害剤であるボリノスタットは、ヒトのミクログリアにおける転写因子PU.1の発現を抑制する効果があることが示されており、ADで観察される過剰な炎症のようなミクログリアを介した免疫反応を抑制するのに有用であることが示唆されている139。さらに、半減期が長く、血液脳関門を通過する能力が高いヒドロキサミドベースのクラスIおよびII HDACi(I2)やメルカプトアセトアミドベースのクラスII HDACi(W2)など、最近開発されたHDACiをADマウスに投与すると、学習と記憶が回復した140。これらの化合物は、試験管内試験ではADの病理を、生体内試験では記憶障害を軽減するように見えるため、ADの研究に期待されている141。
VPA、ニコチンアミド、4-PBAなどのHDACiのいくつかは、AD治療のための臨床試験で検討されている132,142。しかし、HDACi、特にpan-HDACiは通常、毒性作用を示すため、その臨床応用は制限されている143。HDACiは通常、非選択的で、ヒストンだけでなく他の細胞質タンパク質にも作用する144。HDAC2およびHDAC3活性の増加は認知機能に悪影響を及ぼし、HDAC1活性の低下は神経毒性を示すことが観察されているため、HDAC1ではなくHDAC2またはHDAC3を阻害するHDACベースの治療法は、ADの潜在的な治療ターゲットとなりうる141。例えば、選択的HDAC3阻害剤であるRGFP-966は、細胞および動物ADモデルにおいて、病的なタウのリン酸化およびAβタンパク質の発現を低下させ、学習および記憶を改善し、多くのAD関連遺伝子を正常化することが示されている145。特異的なHDACiの他の例としては、選択的なHDAC6阻害剤であるtubacinや、選択的なS1RT1およびS1RT2阻害剤であるsuraminが挙げられる137。マウスにHDAC6に基質選択性を有するHDACi M344を投与すると、空間記憶や認知能力の向上、APOEε4,βアミロイド、βセクレターゼ、リン酸化タウの発現低下、BDNF、ADAM10,SIRT1,REST、BIN1,MINT2の上昇が観察された140,146。
HDACiを用いたMTDの例としては、HDACとホスホジエステラーゼ5(PDE5)147,148抗酸化作用149トランスグルタミナーゼ2(TG2)150およびグリコーゲンキナーゼ合成酵素3β(GSK3β)を同時に調節することが挙げられる。 151 ADモデルマウスにおいて、PDE5とHDACの二重阻害剤として作用するCM-414を慢性的に投与すると、海馬スライスにおける長期増強の障害が回復し、脳内のAβおよびタウのリン酸化レベルが低下し、GSK3βの不活性型が増加し、海馬ニューロンの樹状突起密度の減少が元に戻り、認知障害が回復した152。
153 特定のHATを活性化させることで、全般的なアセチル化のバランスが回復し、神経保護に関わる遺伝子発現プログラムが活性化される可能性がある。CBP (cAMP-response element binding protein)、p300,PACAF (p300/CBP-associated factor) などのいくつかのHATは、非選択的なHDACiよりも特異的な性能を示した。しかし、最近の研究では、CBP/p300 HATの低分子活性化剤であるCSP-TTK21が、ADモデルマウスにおいて、エピジェネティック、転写、シナプス可塑性、行動障害を効率的に回復させることが示されている154。また、Aβオリゴマーの形成やタウの凝集を抑制し、抗炎症作用や抗酸化作用を有するクルクミンやその誘導体などの天然物も代替戦略として検討されている155。クルクミンは、p300/CREB結合タンパク質のHAT活性を選択的に阻害すると考えられている156。132,142 レスベラトロールやエピガロカテキンガレート(EGCG)などの植物化学物質も、ヒストンのアセチル化を制御することがわかっている。レスベラトロールは、保存されたHDACクラスIIIファミリーであるサーチュインの活性化因子として同定された。レスベラトロールには、抗酸化作用、抗炎症作用、神経保護作用があり、アルツハイマー病患者の海馬におけるAβペプチドの毒性と凝集を減少させ、神経新生を促進し、海馬の損傷を防ぐことができる157。ADにおけるレスベラトロールの主な神経保護メカニズムは、SIRT1の活性化と関連していると考えられている158。ADの認知障害や脳血管障害の予防におけるレスベラトロールの可能性を評価する臨床試験が行われているが、132,142のエビデンスに基づく臨床試験はまだ不十分である。シチコリン(シチジン-5ʹ-ジフォスフェイト-コリン)は、ヒトの細胞内に存在する天然のコリン化合物で、特に脳組織に多く存在し、神経伝達物質アセチルコリンの前駆体としての役割を果たしている。また、シチコリンは、神経細胞膜に不可欠な成分であるリン脂質の生合成の重要な中間体であり、サーチュイン1(SIRT1)の発現に良い影響を与えることから、神経保護剤としても期待されている162。SIRT1遺伝子の過メチル化とSIRT1の発現低下は、ADに共通する所見であり、APPプロセッシングの異常、神経炎症、神経変性、ミトコンドリア機能障害などの発症メカニズムと関連している163。シチコリンの神経保護作用は、神経細胞死に関与する特定のMAPキナーゼファミリーメンバーの活性と発現を調節する能力とも関連している可能性がある164。
体内の主要なメチル供与体の一つであるS-アデノシルメチオニン(SAM)や、DNAおよびヒストンメチル化活性化剤などのヒストン・メチルトランスフェラーゼ阻害剤も、ADの治療効果が期待できるかもしれない132。しかしながら、ヒストンメチル化酵素の機能が大幅に低下すると、アルツハイマー病患者およびADモデルマウスの両方で学習障害が生じることが知られており、したがって、ヒストンメチル化酵素を部分的に阻害することでしか、バランスのとれた酵素機能を回復させることはできない141。将来的には、得られた薬剤エピジェネティックデータは、ADに対するプレシジョン・メディシン・アプローチの最適化に役立つであろう。
数多くの研究で、ADの病態に関連する特定のmiRNAの制御異常が報告されており、この制御異常のmiRNAパターンを利用することで、ADの診断が改善され、より効果的な新規治療法の基礎となることが示唆されている165-167。Parsi et al 168は、マウスにmiR-16模倣体を脳内投与することで、APP、BACE1,タウを部位依存的に抑制することに成功した。さらに、miR-16の新たな標的として、ニコストリン、γセクレターゼ、αシヌクレイン、トランスフェリン受容体1(TfR1)などが同定された。また、Neuro2a細胞では、miR-132のミミックでもタウタンパク質の発現に同様の効果が認められた。169 miR-132のミミックを投与すると、マウスの記憶機能に有益な効果があり、タウ病理の制御にmiR-132/212が関与していることが裏付けられた。ADの病態におけるmiR-132の重要性とその治療効果は、miR-132ミミックを脳室内に投与することで確認された。その結果、Aβの沈着やタウのリン酸化に関与する酵素であるイノシトール1,4,5-三リン酸3キナーゼB(ITPKB)の発現が増加した170。PC12細胞およびSH-SY5Y細胞にmiR-193a-3pをトランスフェクションしたところ、PTEN遺伝子の発現を標的として、Aβによる神経毒性が減少した171。miR-107は、PC12細胞および6-ヒドロキシドーパミン処理後のマウスにおいて神経保護作用を示したことから、プログラムされた細胞死10(PDCD10)タンパク質の発現を抑制することで、神経毒性に対して重要な役割を果たしていることが示唆された172。
miR-326をADマウスに投与すると、c-Jun N-terminal kinase (JNK)シグナル伝達経路が阻害され、がん原遺伝子VAV1の発現が低下し、タウのリン酸化が抑制され、認知機能が改善された173。miR-34cアンタゴミア(AM34c)を用いると、シナプトタグミン1の発現を負に制御することで、SAMP8マウスの認知機能が改善した174。また、ADの5XFADマウスモデルでは、miR-188-5pオリゴヌクレオチドのトランスフェクションにより同様の効果が得られた175。Zolochevska et al 176は、miR-149,miR-485,miR-4723がAβオリゴマーのシナプスへの結合を阻害することを、生体内試験マウスモデルと脳室内注射を用いて実証した。177 3xTg-ADマウスにmiR-31をコードするレンチウイルス粒子を注入したところ、APPとBACE1のダウンレギュレーションにより認知機能が改善し、不安レベルが低下した178。
最近、miR-592を阻害することでアストロサイトの酸化ストレス傷害を軽減できる可能性が報告され、そのメカニズムとして、dyslexia-associated protein KIAA0319と(Kelch-like ECH-associating protein 1) nuclear factor erythroid 2 related factor 2-antioxidant response element (Keap1/Nrf2/ARE)シグナル経路が関与していることが示唆された179。miR-33のダウンレギュレーションは、炎症、酸化ストレス、細胞のアポトーシスを抑制するとともに、シナプス可塑性を改善した180。miR-33のダウンレギュレーションによる保護効果は、Akt/mammalian target of rapamycin (mTOR)シグナル経路の活性化を抑制することで得られた180。3xTg-ADマウスにmiR-342-3pアンタゴミアを海馬内に注射したところ、miR-342-3pとADの関連性が確認され、miR-342-3pの阻害により認知障害が改善されることが示唆された181。また、miR-342-3pを減少させると、海馬のAβ斑が減少したことから、miR-342-3pがADのAβ代謝経路に重要な影響を与えていることが明らかになり、治療の可能性が示唆された181。また、miR-299-5pをADモデルマウスの脳室に注入すると、オートファジーとアポトーシスが阻害され、その結果、認知機能が改善されたことから、miR-299-5pはADの神経保護因子として期待されている182。
Pereira et al 183は、pre-miR-29bをポリプレックスに封入することに成功し、キトサン/pre-miR-29bおよびポリエチレンイミン/pre-miR-29bシステムがpre-miR-29bを細胞質に効率的に送達し、BACE1の発現とAβ42レベルを低下させることを検証し、miRNAベースの治療薬の実用化に向けて大きな一歩を踏み出した。GabrとBrogi184は、ADのマルチターゲット治療薬を同定するために、ハイスループットスクリーニングを行った。彼らは、AChEとmiR-15bの生合成を阻害するリガンドに着目した。その結果、AChEとmiR-15bの両方を阻害するマルチターゲットリガンド、MG-6267が得られた184。
185 Zhangらは、ベルベリンがcircHDAC9/miR-142-5p軸を制御することにより、Aβ42によって誘発される神経細胞傷害からヒト神経細胞を保護したことから、ベルベリンがADの神経保護作用を有することを示唆している。ベルベリンの投与とlncRNAであるβ-アミロイド切断酵素1アンチセンスRNA(BACE1-AS)の干渉により、Aβ25-35を投与した神経細胞が保護され、生存率が回復した186。ベルベリンは、少なくとも部分的には、BACE1-AS/miR-132-3p軸を通して作用することが示唆されており、AD治療においてベルベリン治療とBACE1-ASの除去を併用する可能性が示唆された186。APP/PS1マウスにおいて、オストホールは学習・記憶能力を向上させ187,ADの細胞モデルでは、細胞の生存率を高め、細胞死を防ぎ、シナプシン-1,シナプトフィジン、シナプス後密度-95(PSD-95)タンパク質のダウンレギュレーションを回復させた188。このオストホールの効果は、miR-9のアップレギュレーションと、それに伴うカルシウム/カルモジュリン依存性プロテインキナーゼキナーゼ2(CAMKK2)およびphospho-AMP-activated kinase α(p-AMPKα)レベルの低下と関連していた。Jiao et al 189は、オストホールの投与がmiR-107の発現に影響を与えることも示した。APP/PS1マウスにオストホールを投与したところ、miR-107の発現が増加し、BACE1が阻害され、海馬および大脳皮質領域のAβが有意に減少し、記憶および学習能力が向上した189 。これらの結果は、オストホールの保護作用およびADの発症を遅らせる可能性を示唆している。
このNMDA受容体拮抗薬は、長鎖非コードRNAであるLINC00094の発現を低下させるとともに、miR-224-4p/miR-497-5pを上昇させ、BBBの伝染性を制御する多機能タンパク質であるエンドフィリン-1の発現を抑制することで、BBBの伝染性を低下させることが明らかになった190。したがって、LINC00094のサイレンシングとメマンチン治療の組み合わせは、AD治療研究における新たなターゲットとなる可能性がある。AD治療に用いられるAChE阻害剤であるドネペジルは、おそらくmiR-206との相互作用によってその効果を部分的に発揮する。APP/PS1マウスの海馬と大脳皮質でmiR-206-3pのアップレギュレーションが検出され、ドネペジル投与後に正常化したことから、miR-206-3pはADの新しい薬理学的標的であり、ドネペジルの抗認知症効果のメディエーターである可能性が示唆された191。
赤ワインに含まれる天然ポリフェノールであるレスベラトロールが、軽度および中等度のアルツハイマー病患者の神経炎症およびAβ沈着を抑制するという研究がある192。興味深いことに、レスベラトロールは、炎症を誘発するmiR-155の発現を低下させ、抗炎症作用のあるmiR-663の発現を増加させるなど、特定のmiRNAの発現を調節することで効果を発揮すると考えられている194。コレステロール値を下げるために使用されるシンバスタチンは、アルツハイマー病患者やADの動物モデルの記憶障害に良い影響を与えることが実証されている196。Huangらの研究では、シンバスタチンが炎症性サイトカインおよびメディエーターの発現を低下させ、アポトーシスを抑制し、神経細胞の生存に貢献したことから、シンバスタチンは抗AD治療薬として使用でき、その効果はmiR-106bの発現を調節することで得られると考えられている196。このように、原因が複数の遺伝子や生物学的プロセスに関連しているADのような複雑な疾患では、miRNAを用いた治療法は大きな可能性を秘めている。今後の研究では、アルツハイマー病患者の治療に抗miRNAまたはmiRNA模倣物を精密医療アプローチとして導入しようとしているが、特定のmiRNAがAD治療に利用できるようになるまでには、まだ長い道のりがあると思われる。とはいえ、エピジェネティクスは、アルツハイマー病患者のエピジェネティック・メカニズムやエピジェネティック・プロファイルに関する知識をADの個別化診断や治療に応用することで、プレシジョン・メディシンのための新たな強力なツールとなる。
結論
現在入手可能なADの治療薬は、対症療法のみに基づいており、AChE阻害剤やNMDA受容体拮抗剤などがある。臨床研究では、ADの特徴的な病態であるアミロイド沈着、タウのリン酸化亢進、神経炎症、血管変化などに着目した治療法が広く検討されているが、これまでのところ、すべての新薬候補が有意な臨床効果を示すことができず、成功には至っていない。ADの病因、認知、行動などの症状、身体的合併症、患者のライフスタイルなどは多岐にわたるため、すべてのアルツハイマー病患者に適した予防法や治療法はない。そのため、臨床の指針となる精密医療戦略が早急に求められている。認知症ステージ、内科的・精神科的併存疾患、主な認知症状やBPSDなどの要因に加えて、エピジェネティックな変化によって調整された遺伝的変動と環境因子の複雑な相互作用を、個々のアルツハイマー病患者に考慮する必要がある。腸内細菌叢とエピジェネティックな変化は、ともに新たな創薬ターゲットであり、その特異的なパターンは、ADの個別化された予防と治療の最適化を目的とした、患者を中心とした新たな集学的アプローチの基礎となる可能性がある。しかし、精密医療をADに適用するためには、この多因子性神経変性疾患の臨床的・生物学的な複雑さだけでなく、その背景にある病理学的プロセスをさらに広範に研究する必要がある。
