コンテンツ
突然変異の意味を理解する。COVID-19のパンデミックにおけるD614Gの意味は不明のままである
https://pubmed.ncbi.nlm.nih.gov/32697970/
https://pubmed.ncbi.nlm.nih.gov/32697968/
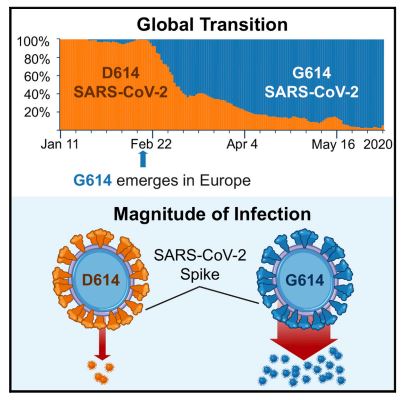
本号のCellでは、Korberらは、スパイク蛋白質D614GのSARS-CoV-2変異体が世界中で急速に優勢になったことを発見した。D614Gがウイルスの表現型を変化させることは臨床データおよび試験管内試験(in vitro)データから示唆されているが、変異が感染、疾患、ワクチンおよび治療法の開発に与える影響については、ほとんど知られていない。
はじめに 2019年後半に中国でSARS-CoV-2が出現し、2020年にCOVID-19パンデミックが急速に拡大した後、ウイルスの進化に関する疑問が転がり込んできた。
SARS-CoV-2は人間により良く適応するように進化したのか?
より感染性が高くなったのか、それとも伝達性が高くなったのか?
より致命的になったのか?
ウイルスの突然変異は、自然淘汰、無作為な遺伝的ドリフト、または最近の疫学の特徴によって頻度が上がることがある。これらの力が連動して働くことがあるため、ウイルスの突然変異が適応によって一般的になったのか、それとも偶然になったのかを区別するのは難しいことが多いである。
単一の突然変異が感染症の結果を変えるのか、パンデミックを起こすのかを判断するのはさらに困難である。このCell誌の本号に掲載されたKorberらの新しい研究(2020)は、この議論の中心に位置している。
彼らは、ウイルスのスパイクタンパク質であるD614Gのアミノ酸の変化がパンデミックの初期に出現し、G614を含むウイルスが現在、世界中の多くの場所で優勢になっているという説得力のあるデータを提示している。
重要な問題は、これが自然淘汰の結果なのかどうか、そしてそれがCOVID-19パンデミックにとって何を意味するのかということである。SARS-CoV-2のようなウイルスにとって、感染は本当にすべてであり、別の宿主に感染しなければ、その系統は終了する。
Korberら(2020)は、G614の急速な普及は、G614がD614よりも感染力が強いためであるという仮説を立てた。
彼らの仮説を支持するために、著者らは、G614感染からの臨床サンプルがより高いレベルのウイルスRNAを有し、試験管内試験(in vitro)実験からより高い力価の偽ウイルスを産生したという証拠を提供したが、この結果は現在、他の人によって裏付けられているようである(例えば、Hu et al 2020; Lorenzo-Redondo et al 2020; Ozono et al 2020; Wagner et al 2020)。
それでも、これらのデータは、G614がD614を含むウイルスよりも感染性または伝達性が高いことを証明するものではない。そしてそのため、D614GがCOVID-19パンデミックに与える潜在的な影響については、もしあるとすれば、多くの疑問が残っている。
D614Gはアウトブレイクの制御を難しくするのか?
この疑問に答えるためには、まず、G614がどのようにして優性遺伝子型になったのか、そしてそれが感染にどのような影響を与えたのかを探らなければならない。上述した仮説に代わるものとして、G614の頻度の増加は偶然とパンデミックの疫学によって説明することができる。
2月にはCOVID-19の症例が最も多かった地域が中国から欧州に移り、3月には米国に移った。これまでの研究が示すように、米国のSARS-CoV-2の系統の大部分はヨーロッパから来たものであり、大陸間の移動量を考えれば当然のことである。
ある地域に系統が定着するかどうかは、伝播だけでなく、導入回数の関数でもある。SARS-CoV-2については、少数の感染が感染の大部分を占めるという良い証拠がある(Endo er al)。したがって、導入されたほとんどのものは絶滅するが、導入されたものは大きくなる(Lloyd-Smith et al 2005)。
G614が世界的に多数を占めるようになった時期には、D614が依然として優勢な中国からの導入数が減少していたのに対し、ヨーロッパからの導入数は増加していた。これだけでも、G614の見かけ上の成功を説明できるかもしれない。
たとえG614を含むウイルスが中国から脱出できたのが「幸運」だったとしても、G614は感染力を高めることができたのである。
Korberら(2020)によって提供された臨床データおよび試験管内試験(in vitro)データは、このシナリオを確かにもっともらしいものにしている。しかし、口腔スワブおよび鼻腔スワブにおけるSARS-CoV-2 RNAの検出率が高いことは、感染の可能性を直接反映していない可能性がある。さらに、感染の多くは症状が出る前の段階で起こる可能性が高く、症状が出る段階でのこれらの違いがどのように比較されるのかはわからない。
この研究で使用されたシュードウイルスアッセイは、培養中の細胞に感染する能力を実証することができ、その結果は重要であるが、新しい宿主に生産的に感染する能力が何を意味するのかは明らかではない。
これらのアッセイは、他のウイルスや宿主タンパク質の影響や、感染や伝達をサポートするために発生しなければならない生化学的な宿主-病原体相互作用のパレードを説明していない。
したがって、2013-2016年のエボラパンデミックの先行経験が示唆するように(Marzi et al 2018)、単一の突然変異だけでは、試験管内試験(in vitro)感染性と適合性のデータに基づいて、大規模で多様なヒト集団に大きな影響を与えると結論づけることは不可能である。
遺伝学的には、ヒトの遺伝子の変異は、その遺伝子の発現に影響を与えることが知られている。G614 が本当に同等に混合した集団でより多くの感染性を持つのであれば、ウイルスの制御は難しくなる。しかし、現時点では、この質問に明確に答えることはできない。
D614Gは感染をより重症化させるのか?
今のところ、G614変異体を含むSARS-CoV-2に感染すると重症化するという証拠はない。イギリスで診断されたCOVID-19症例999例の臨床データを検討することで、Korberら(2020)は、G614を含むウイルスに感染した患者はウイルスRNAのレベルが高いが、入院転帰に差は見られなかったことを明らかにした。
これらの臨床観察は、2つの独立した研究によって支持されている。ワシントン州シアトルのCOVID-19患者175例(Wagner et al 2020)と、米国イリノイ州シカゴのCOVID-19患者88例(Lorenzo-Redondo et al 2020)である。
ウイルス負荷と疾患重症度は常に相関しているわけではなく、特にウイルスRNAがウイルス力価を推定するために使用される場合には、ウイルス力価を推定するためにウイルスRNAが使用される。
現在のエビデンスでは、D614Gは年齢や併存疾患などの他のリスク因子よりもCOVID-19に対する重要性が低いことが示唆されている。
D614Gは治療法やワクチン設計に影響を与えるか?
D614Gの変異は、ヒト免疫系から注目されているウイルスの外部スパイク蛋白質に位置しているため、SARS-CoV-2がワクチン誘発免疫を回避する能力に影響を与える可能性があるが、これらの理由から、その可能性は低いと考えている。
D614Gは、スパイクタンパク質の受容体結合ドメイン(RBD)ではなく、水素結合を介してウイルス表面上でその成熟した三量体形態を安定化する個々のスパイクプロトンの間の界面に存在する。
Korberら(2020)は、この結果、プロトンマー間水素結合の喪失、スパイクプロトンマー間の相互作用の変調、またはグリコシル化パターンの変化が起こり得ることを提案している。これらの変化のいずれかが感染性を変化させる可能性はあるが、抗体の中和に重要であると考えられているRBDエピトープの免疫原性を劇的に変化させる可能性は低い。
さらに、Korberら(Hu et al 2020年;Ozono et al 2020)は、D614またはG614を含むウイルスとの自然感染から生成された抗体が交差中和し得ることを見出しており、この遺伝子座は抗体媒介免疫にとって重要ではないことを示唆している。
したがって、D614G変異が現在開発中のワクチンの有効性に大きな影響を与える可能性は低いと考えられるが、その中にはRBDのみを標的としたものもある。
エントリーおよび融合におけるスパイク機能に対するD614Gの特異的な効果は不明であるため、この変異が治療用エントリー阻害剤に与える影響は不明である。
現在のところ、スパイクとACE2との結合を阻害するように設計されたモノクローナル抗体や、エンドソームの酸性化などの下流過程を調節する薬剤などの治療戦略を阻害するという証拠はない。
しかしながら、SARS-CoV-2の自然感染におけるD614Gの役割がよりよく理解されるまでは、ワクチンや治療法の設計において、この変異を考慮に入れるべきである。
結論
この突然変異がCOVID-19パンデミックにとって何を意味するのかについては、すでに多くの息もつかせぬ解説がなされているが、自然淘汰や偶然によるものかどうかにかかわらず、G614の世界的な拡大は、この突然変異が現在パンデミックになっていることを意味している。結果として、その特性は重要である。
G614が明確な表現型を持っていることは試験管内試験(in vitro)および臨床データから明らかであるが、これがヒトACE2への合法的な適応の結果なのか、透過性を増加させるのか、あるいは顕著な効果があるのかは明らかではない。
Korberら(2020)の研究は、D614Gがパンデミックにどのように影響を与えるかという多くの重要なギャップを埋めるための、より広範な疫学的、生体内試験(in vivo)実験的、多様な臨床研究のための初期の基盤を提供している。
SARS-CoV-2スパイクの変化を追跡する。D614GがCOVID19ウイルスの感染力を増加させることを示す証拠 (抜粋ss
https://pubmed.ncbi.nlm.nih.gov/32697968/
要旨
ハイライト d スパイクG614を持つSARS-CoV-2変異体は、支配的なパンデミック型としてD614に取って代わった d 地域レベルでのG614の一貫した増加は、フィットネスの優位性を示す可能性がある d G614は低いRT PCR Ctsと関連しており、患者のウイルス負荷が高いことを示唆している d G614変異体は疑似型ウイルスとして高い力価に成長する
Korber らは、中国の武漢で最初に確認された D614 型よりも G614 型の Spike タンパク質を持つ SARS-CoV-2 ウイルスが世界的に多く流通しているという証拠を提示している。
フォローアップ研究は、G614に感染した患者が、D614に感染した患者と比較して、より多くのウイルス核酸を流し、G614を有するウイルスは、D614に感染した患者と比較して、試験管内試験(in vitro)で有意に高い感染力価を示すことを示している。
概要
Spike タンパク質のアミノ酸変化 D614G を有する SARS-CoV-2 変異型が、世界的なパンデミックにおいて最もパンデミックしている型となった。
変異型の頻度を動的に追跡した結果、国レベル、地域レベル、および自治体レベルの複数の地理的レベルで G614 の増加パターンが再発していることが明らかになった。
この変化は、G614変異型が導入される前に元のD614型が十分に確立されていた地域の伝染病でも起こった。
このパターンの一貫性は非常に統計的に有意であり、G614変異体はフィットネスの優位性を持っている可能性があることを示唆している。
G614 変異体は疑似型ウイルスとしてより高い力価にまで成長することがわかった。
感染者では、G614はRT-PCRサイクル閾値の低下と関連しており、上気道ウイルス負荷が高いことを示唆しているが、疾患重症度の上昇とは関連していなかった。
これらの知見は、ウイルスのメカニズムを理解する上で重要な変化を明らかにし、免疫学的介入の開発を支援するために Spike 変異のサーベイランスを継続することを支持するものである。
序論
過去20年間で、ベータコロナウイルス属によって引き起こされた3つの主要な病原性人獣共通感染症アウトブレイクが発生した(Cui et al 2019年;de Wit et al 2016年;Liu et al 2020年;Wu et al 2020)。重症急性呼吸器症候群コロナウイルス(SARSCoV)は2002年に出現し、8,000人に10%の死亡率で感染した。
中東呼吸器症候群コロナウイルス(MERSCoV)は2012年に出現し、2,300人に感染し、死亡率は35%であった(Graham and Baric, 2010)。
3つ目のSARS-CoV-2は、重症呼吸器疾患コロナウイルス症2019(COVID19)を引き起こす(Gorbalenya et al 2020)。2019年12月に中国で初めて報告され(Zhou er al)。2020年6月21日の世界保健機関(WHO)の状況報告書には、870万人以上のCOVID-19症例と46万人以上の死亡者が記録されており、その数は日々増加している。
人間はSARS-CoV-2に直接免疫学的な経験がないため、感染や病気に対して脆弱な状態にある。SARS-CoV-2は高い感染力を持っており、基本的な再生産数R0は2.2~3.9と推定されている(Lv et al 2020)。
死亡率の推定値は0.8%から14.5%の間で地域的に異なる(死亡率解析、ジョンズ・ホプキンス医学大学)コロナウイルスは遺伝的なプルーフリーディング機構を有しており(Sevajol et al 2014; Smith et al 2013)、SARS-CoV-2の配列多様性は非常に低い(Fauver et al 2020)。
それでも、自然淘汰は、まれではあるが好ましい突然変異に作用することがある。類推すると、抗原性ドリフトは、インフルエンザシーズン中にインフルエンザウイルスによる変異の漸進的な蓄積をもたらし、免疫学的耐性変異と適合性ランドスケープとの間の複雑な相互作用は、集団間で抗体耐性を発現させることを可能にし(Wu et al 2020)、数シーズンごとに新しいインフルエンザワクチンを開発する必要性を駆り立てる。
インフルエンザのシーズンが長くなることで、選択圧力の機会が増加している(Boni et al 2006)。SARS-CoV-2は、いくつかの季節的な衰退の証拠を示している
パンデミックの持続性は、ワクチンが開発されたとしても、集団における免疫学的に関連する変異の蓄積を可能にする可能性がある。
抗原性ドリフトは、感冒コロナウイルスOC43(Ren et al 2015年;Vijgen et al 2005)および229E(ChiboおよびBirch、2006)、ならびにSARSCoV-1(Guan et al 2003年;Song et al 2005)の間で見られる。
注目すべきは、SARS-CoV-1の受容体結合ドメイン(RBD)における単一のアミノ酸変化であるスパイクD480A/Gが、感染したヒトおよびシベットで発現し、2003/2004年のウイルスの中で支配的な変異体となったことである。
D480A/Gは中和抗体80Rから逃れ、試験管内試験(in vitro)では80Rからの免疫圧がD480変異の出現を再現する可能性がある(Sui er al)。
SARS-CoV-2の抗原性ドリフトの証拠はまだないが、ヒトからヒトへの感染が拡大すれば、SARS-CoV-2もまた、体力的に有利な変異や免疫学的耐性を獲得する可能性がある。
このようなリスクに対処するためには、ウイルスの適合性や抗原性プロファイルに関連する可能性のある進化の変遷を明らかにすることが重要であり、ワクチンや免疫治療の有効性を確保するためには、臨床現場に進出した際の介入が重要である。
SARS-CoV-2に対する有効なワクチンおよび抗体ベースの治療薬を開発する緊急の必要性に対応して、現在、90以上のワクチンおよび50以上の抗体アプローチが探索されている(Cohen, 2020; Yu er al)。
ほとんどの標的は、宿主細胞の結合および侵入を媒介し、中和抗体の主要な標的である三量体スパイクタンパク質である(Chen et al 2020年;Yuan et al 2020)。スパイクモノマーは、受容体結合を媒介するN末端S1サブユニットと、膜融合を媒介する膜近位S2サブユニットからなる(Hoffmann et al 2020a; Walls et al 2020; Wrapp et al 2020)。
SARSCoV-2およびSARS-CoV-1は、79%の配列同一性を共有し(Lu et al 2020)、両方ともアンジオテンシン変換酵素2(ACE2)を細胞受容体として使用する。
SARSCoV-1スパイクに対する抗体応答は複雑である。急速で高い中和抗体応答を有する一部の患者では、これらの応答の早期の低下は、疾患の重症度の増加およびより高い死亡リスクと関連している(Ho et al 2005年;Liu et al 2006年;Temperton et al 2005年;Zhang et al 2006)。
SARSCoV-1スパイクに対するいくつかの抗体は、試験管内試験(in vitro)で感染の抗体依存性増強(ADE)を媒介し、動物モデルで疾患を悪化させる(Jaume et al 2011年;Wan et al 2020年;Wang et al 2014年;Yip et al 2016)。
ほとんどの現在のSARS-CoV-2免疫原および検査試薬は、武漢参照配列のSpikeタンパク質配列に基づいており(Wang et al 2020)、第一世代の抗体治療剤は、初期のパンデミック感染に基づいて発見され、武漢参照配列のタンパク質を用いて評価された。
ウイルスがヒトからヒトへ伝播する際の参照配列の変化は、ウイルスの表現型および/または免疫に基づく介入の有効性を変化させる可能性がある。
そこで、我々は、パンデミック中のSpikeの進化を評価する「早期警戒」戦略を構築するためのバイオインフォマティクスツールを設計し、突然変異の表現型への影響を検査し、ワクチンや抗体ベースの治療薬の進歩に応じて適切な抗体幅評価パネルを作成できるようにした。
SARS-CoV-2のグローバルサンプリングの系統解析は、Global Initiative for Sharing All Influenza Data(GISAID)データベース(https://www.gisaid.org/; Elbe and Buckland-Merrett, 2017; Shu and McCauley, 2017)およびNextstrain(https:// nextstrain.org; Hadfield et al 2018)によって非常に巧みに対処されている。
しかしながら、SARS-CoV-2のような遺伝的多様性が低く、de novo突然変異事象が非常に少ない環境では、ホモプラシーを用いて正の選択を同定する系統樹法(Crispell et al 2019)は、統計的な力に限界がある。
さらに、組換えは系統再構成に交絡因子を加えることができ、組換えは自然コロナウイルスの進化において役割を果たすことが知られており(Graham and Baric, 2010; Lau er al)。組換え配列(潜在的な配列決定アーチファクト)がSARSCoV-2配列の中で発見されている(De Maio er al)。
これらの問題を考慮して、我々は、異なる地理的な場所で再発的に有病率が高くなっている亜種を同定することによって、潜在的な陽性選択の代替指標を開発した。特定のバリアントの相対的な頻度の増加が、異なる地理的地域で繰り返し観察される場合、そのバリアントは選択的優位性を付与するための候補となる。
単一アミノ酸の変化は、表現型に関連する可能性があるため、モニタリングする価値がある。
コロナウイルスの中では、点突然変異は、MERS-CoV(Tang et al 2014)およびSARS-CoV-1(Sui et al 2008;ter Meulen et al 2006)において中和抗体に対する耐性を付与することが実証されている。
HIVエンベロープにおいて、単一アミノ酸の変化は、宿主種の感受性を変化させ(Li et al 2016)、発現レベルを増加させ(Asmal et al 2011)、ウイルス表現型を第2層から第1層に変化させ、中和感受性の全体的な変化を引き起こすことが知られている(Gao et al 2014; LaBranche et al 2006)。
2014; LaBranche et al 2019)、および中和抗体のクラスに対する完全またはほぼ完全な耐性を付与する(Bricault et al 2019; Sadjadpour et al 2013; Zhou et al 2019)。
我々は、GISAIDデータをモニタリングすることにより、多くの地理的地域にわたって頻度が増加しているSpikeアミノ酸バリアントを同定するためのバイオインフォマティクスパイプラインを開発した。
2020年4月上旬までに、Spike D614G変異がこのような挙動を示すことが明らかになり、G614はそれ以来、パンデミックでは支配的な形態となっている。
我々は、G614変異がより大きな感染性と関連しているという実験的証拠と、それがより高いウイルス負荷と関連しているという臨床的証拠を提示している。
私たちは、地域レベルおよび世界レベルでの頻度の変化について、Spike の他の変異の監視を継続しており、一般のウェブサイト(https://cov.lanl.gov/)で定期的に更新情報を提供している。
結果
さらなる解析により、ウイルス負荷は入院に対する潜在的なD614G状態の影響をマスキングしていないことが示された(STAR Methods)。また、一変量解析では、年齢、男性性と入院との間に非常に有意な関連が認められた(STAR法)。
G614はスパイク疑似型ウイルスの高い感染力価と関連している 我々は、D614またはG614 SARS-CoV2スパイク蛋白質を表示する疑似型シングルサイクル小胞性口内炎ウイルス(VSV)とレンチウイルス粒子の感染力価を定量化した。
VSVおよびレンチウイルスの疑似型については、G614を有するウイルスは、D614を有する対応するウイルスよりも有意に高い感染力価(2.6〜9.3倍の増加)を有していた;これは複数の細胞型で確認された(図6A〜6C)。
ピアレビューされていないプレプリントで最近報告された同様の結果はまた、G614がスパイクの安定性および膜の取り込みを増加させることを示唆している(Zhang et al 2020)。
タイプII膜貫通型セリンプロテアーゼであるTMPRSS2は、受容体結合後にウイルスSpikeを切断し、MERSCoV、SARS-CoV、およびSARS-CoV-2の侵入を促進する(Hoffmann et al 2020b; Kleine-Weber et al 2018; Matsuyama et al 2020; MilletおよびWhittaker et al 2014; Park et al 2016; Shulla et al 2011; Zang et al 2020)。
スパイク614は、予想されるTMPRSS2切断部位の近くの融合ペプチドに隣接するポケット内にあり、G614変異体のTMPRSS2に対する傾向および/または要求の違いがあり得ることを示唆している。この仮説を検証するために、TMPRSS2の存在下または非存在下でACE2受容体を安定的に発現する293T細胞を感染させ、感染ウイルスの力価を定量した。
TMPRSS2の発現に関係なく、D614とG614の間で同様の倍数の力価変化が見られた(図6A)。したがって、G614を担持したウイルスの293T-ACE2細胞への侵入は、D614を担持したウイルスと比較して、TMPRSS2によって増強されていない。
G614バリアントが肺細胞において増加した力価を示すかどうかを決定するためには、さらなる研究が必要であり、これはネイティブプロテアーゼ発現レベルをより忠実に再現している可能性があり、このバリアントが本物のSARS-CoV-2の適合性を増加させるかどうかを決定するためには、さらなる研究が必要である。
我々はまた、D614Gの変異がポリクローナル抗体によって同様に中和されるかどうかを試験した。D614とG614が流通していた2020年3月上旬から中旬に感染した可能性が高いサンディエゴ在住者6人の回復期血清は、D614を含む偽ウイルスと比較して、G614を含む偽ウイルスの中和が同等かそれ以上であることを示している(図6Dおよび6E)。
これらの個体のそれぞれがどのウイルスに感染したかは不明であるが、これらの初期データは、細胞培養での適合性が高まっているにもかかわらず、G614ベアリングのウイルスは、回復期の血清による中和に対して本質的により耐性がないことを示唆している。
希少な変異を持つSpike遺伝子に関心のある他の部位 スパイクは全体的には非常に少ない変異を持っている。少数の変異が、世界の集団サンプルの0.3%以上に達しており、これは https://cov.lanl.gov ウェブサイトの自動追跡の閾値となっている(図7Aおよび7B;詳細は表S2に記載)。
アライメントの中で、Spikeの残りの部分と比較してエントロピーが比較的高い領域(すなわち、まれな突然変異の局所的なクラスター)も追跡される(表S2)。関心のある遺伝子変異は、アミノ酸の変化としてSpike構造にマッピングされる(図4)。
シグナルペプチドL5Fの変化をもたらす突然変異は、ツリー内で何度も再発し、グローバルなGISAIDデータの約0.6%で安定的に維持されている。
N末端ドメイン(NTD)およびRBDをコードするSpike遺伝子の領域には、抗体を中和するための潜在的な標的である変異のいくつかのクラスターが存在する(Chen et al 2017; Zhou et al 2019; Sui et al 2008; Tang et al 2014; ter Meulen et al 2006)。
RBDクラスター(陽性475〜483)は、結合したACE2の4A゜内に位置する2つの位置475および476にまたがっている(図4D;Yan et al 2020)。
融合ペプチドは、826〜839の間のアミノ酸変化のクラスターを含む;このクラスターは、変動を追跡するための我々のウェブベースのツール(図7A〜7C)を説明するために、図7で強調されている。
融合前スパイクのヘリックスブレイクの隣にあるHR1(Xia et al 2020)の融合コアもまた、936〜940の間のアミノ酸変化のクラスターを含む(図4E)。
モチーフSXSS(937〜940)は、ヘリックスの結合を強化する可能性がある(Dawson et al 2002; SalamangoおよびJohnson、2015)。Spikeの細胞質尾部はまた、関心のある部位P1263Lを含む。
考察
我々のデータは、1ヶ月の間に、D614G Spike変異を持つ変異体がSARS-CoV-2の世界的な優占型になったことを示している。NextstrainでのSARS-CoV-2変異体の系統追跡から、進化と地理的な関係が複雑に絡み合っていることが明らかになった(https://nextstrain.org; Hadfield et al 2018)。
記事は、異なる場所にG614バリアントを導入し、再導入したであろう。それでも、G614が最初に出現し始めたとき、D614のパンデミックは多くの場所で非常によく確立されていた(例については図S2を参照)。
D614Gのアミノ変化を引き起こす突然変異は、ほぼ常に一緒に追跡する4つの突然変異によって定義される保存されたハプロタイプの一部として伝達される(図S5およびS6)。D614とG614が共存していた多くの異なる集団内でG614の頻度が増加するパターンは非常に有意であり、G614が正の選択下にある可能性があることを示唆している(図1Bおよび3)。
我々はまた、G614がヒト患者の上気道におけるウイルス核酸の高レベルと関連していることを発見した(図5)、これはより高いウイルス負荷を示唆しており、複数の疑似タイピングアッセイにおいてより高い感染性と関連していることを示している(図6)。
ほとんどのG614亜種がGクレード系統に属することを考えると、そのシグナルのために突然変異イベントの再発に依存する系統分類法は、D614Gが陽性選択下にあるかどうかを解決するには不十分な力を持っている。
しかし、GISAIDのデータは、図4. スパイクタンパク質のアミノ酸変化と変異群の構造マッピング (A) スパイク614を含む部位と図7に示した部位が、スパイクタンパク質のS1とS2ユニットにマッピングされている(PDB: 6VSB)。
S1およびS2は、フーリン切断部位に基づいて定義されている(原始体1:S1、濃紺、S2、水色、原始体2:S1、濃緑、S2、薄緑、原始体3:灰色)。
記事は、時間と地理の文脈でSARS-CoV-2バリアント間の関係を調べる機会を提供し、可能性のある陽性選択の初期指標としてG614の頻度の増加を追跡することを可能にした。
このアプローチは、創始者効果とサンプリングバイアスの影響を受ける可能性があるため、我々は一般的に、この戦略を単にアミノ酸の変化の初期の指標として捉え、さらにモニターしてテストする必要があると考えている。
しかし、G614バリアントは、いくつかの理由から、我々の早期検出フレームワークの中で際立ってた。第一に、地理的地域をまたいだ増加の一貫性があり、これは非常に有意に非ランダムであった(図1Bおよび3)。
第二に、もし二つの型が同じように伝播する可能性があるのであれば、G614型が現在進行中の確立されたD614パンデミック病に導入された多くの場所でD614型が持続すると予想される。しかし、そのような場合でも、G614が増加していることがわかった(図1、2、3、S2、S3)。
第三に、G614の頻度の増加は、国家的な留守番命令が発令された後も継続することが多く、旅行者からの連続再送が大幅に減少する可能性があった(図2、S2、S3)。我々の世界的な追跡データによると、SpikeのG614変異型はD614よりも早く広がっていることがわかる。
これは、我々が試験管内試験(in vitro)で観察したG614 Spike疑似型ウイルスで観察されたより高い感染性(図6)と、G614変異体と高い患者Ct値との関連性が一致する仮説であり、生体内でのウイルス負荷が高い可能性があることを示している(図5)。
興味深いことに、我々はG614が疾患の重症度に及ぼす影響を示す証拠を見つけられなかった;すなわち、G614は入院状態と有意に関連していなかった。
しかし、この種の分析は、国によって検査やケアの利用可能性が異なるために複雑になることがあるが、国をまたいだ死亡率の比較において、G614変異体とより高い死亡率との関連が報告されている(Becerra-Flores and Cardozo, 2020)。
G614変異体の感染性の高さが、その急速な広がりと持続性を十分に説明できるかもしれないが、他の要因も考慮する必要がある。これらの要因には疫学的な要因が含まれる。なぜなら、ウイルスの広がりは感染者にも依存するからであり、疫学的な影響はまた、進化的な圧力を模倣するために遺伝子型頻度の変化を引き起こす可能性があるからである。
可能性としては、G614に対する進化的選択と、移動性が高く、つながりのある集団に導入された創始者の影響の組み合わせが、G614の台頭の一因となっている可能性がある。50 UTRまたはRdRPタンパク質のG-クレイド変異も影響を与えているかもしれない。さらに、SpikeのG614変異は免疫学的にも影響を及ぼす可能性がある。
G614変異体は、ポリクローナルな回復血清による中和に敏感である(図5)が、これは免疫介入の観点からは心強いが、SARS-CoV-2のD614型およびG614型が、ワクチン誘発抗体による中和に対して、あるいはいずれかのウイルスの感染に応答して産生された抗体による中和に対して、異なる感受性を有するかどうかを決定することが重要であろう。
また、G614型が実際にD614型よりも感染性が高い場合(図6)、ワクチンまたは抗体治療薬による保護のためには、D614型よりも高い抗体レベルを必要とする可能性がある。
SARS-CoV-1のSpike 614にまたがる免疫優勢な線形エピトープに対する抗体は、ADE活性と関連していた(Wang et al 2016)ので、この変異がADEに影響を与える可能性がある。
Spike遺伝子の変異を追跡することは、現在開発中のワクチンおよび抗体ベースの治療戦略との関連性のため、これまでのところ我々の主要な焦点となっている。このような介入は開発に数ヶ月から数年を要する。効率化のためには、最終的に介入が展開されたときに、循環する変異体に対して効果があることを確実にするために、開発中に最新の変異を考慮に入れる必要がある。
この目的のために、我々は、SARS-CoV-2配列上の潜在的に興味深い変異の探索を可能にするデータ解析パイプラインを構築した。
解析は、GISAIDを通じてデータが入手可能になると毎日更新されるため、実験家はワクチン開発、抗体反応を評価するための試薬、実験計画に利用可能な最新のデータを活用することができる。G614型が世界的に優勢になったスピードは、継続的な警戒の必要性を示唆している。
研究の限界 特定の地理的地域におけるG614型への頻度の変化は、原則として、創始者効果またはサンプリングの偏りに起因している可能性がある。
D614GがCOVID-19ウイルスの感染性を増加させるという証拠、
記事 多くの領域にわたる系統的なバイアスは、我々が観察した有意性のレベルに影響を与える可能性がある。
我々が報告するG614と入院との間の関連性の欠如は、我々が検出できるよりも微妙な疾患重症度への影響を見逃している可能性がある。
D614G突然変異の適合性の増加の実験室での証拠を得るためにここで行われた実験的アプローチは、確立された細胞株への感染の2つの異なるシュードウイルスモデルに基づいている。
このモデルが呼吸器系の自然な標的細胞における野生型ウイルス感染を忠実に再現する程度はまだ決定されておらず、我々の実験室での実験では自然感染の生物学的・機械学的な問題には直接対処していない。
感染性と伝達性は必ずしも同義ではなく、D614G突然変異が実際に感染数の増加につながったのかどうか、また感染時のウイルス負荷の増加だけではないかどうかを判断するためには、より多くの研究が必要である。
我々は、自然感染および多様な標的細胞における野生型ウイルスを用いて(Hou et al 2020)、および関連する動物モデルにおいて、この現象をより詳細に研究することを他の研究者に奨励する。
最後に、実施された中和アッセイは、未知のD614Gステータスを有するSARS-CoV-2感染者からの血清に基づいていた。
したがって、本発明者らは、G614バリアントが中和感受性であることを示しているが、免疫応答を開始したバリアントが試験バリアントと異なる場合、またはモノクローナル抗体が使用される場合に中和の効力が影響を受けるかどうかを解明するためには、より多くの研究が必要である。
改訂版原稿(クリーン版) 東南アジアにおけるSARS-CoV-2の欧米変異体の出現
概要
SARS-CoV-2コロナウイルスは、現在のCOVID-19パンデミックの原因となっており、最初の5ヶ月間で500万人以上の感染者と33万3000人の世界的な死亡者が発生している。このウイルスの系統力学と変異変種への洞察は、異なる気候条件での広がりの性質を理解するために不可欠である。
COVID-19の発生率は、高温多湿の亜熱帯東南アジア諸国で驚くべき速さで増加している。この広がりを理解するために、東南アジア6カ国からGISAIDプラットフォーム上で入手可能なSARS-CoV-2の444のゲノム配列を解析した。多重配列アラインメントと最尤系統解析を行い、この地域に流通する同義でない変異体を解析し、特徴を明らかにした。
全世界的な突然変異分布解析の結果、この地域で見つかった突然変異の大部分はヨーロッパや北米でもパンデミックしており、他の国でもこれらの突然変異が高い頻度で同時に存在していることから、感染経路の可能性があることが示された。
また,ある国の限られた地域では,スパイク蛋白質と非構造蛋白質の特異的な変異が観察された.我々は、循環しているウイルス株を、最も頻度の高い非同義変異(NS)に基づいて、4つの主要なグループと3つのサブグループに分けた。
特にインド国内では、4つの共進化変異を持つ株が高い頻度で流通していることがわかった。また、RdRp(P323L)とスパイク(S)タンパク質(D614G)を変化させる2つの共進化NS変異体を特徴とするグループ2株は、ヨーロッパと北米でよく見られた。
これらのヨーロッパと北米の変異体は東南アジアで急速に優占株として出現し、1月の有病率0%から 2020年5月には81%にまで増加している。
これらの亜種は先祖代々の型よりも進化的に優位性を持っている可能性があり,これからの冬に向けて東南アジアに大きな脅威を与える可能性があると考えられる。
中国が先にパンデミックに遭遇した一方で、北米やヨーロッパ諸国もまた、このパンデミックによって壊滅的な打撃を受けている。さらに、東南アジア、南米、アフリカ諸国内での感染数が増加している。資源に乏しい低所得国での感染数は、検査能力が限られているため、過小評価されている可能性がある。
多くの先行研究では、高温と高湿度がウイルスの拡散を減少させる可能性があることが示されている(Demongeot, Flet-Berliac & Seligmann, 2020; Sajadi et al 2020; Wang, Tang, Feng, & Lv, 2020)。このような気候条件を有するにもかかわらず、比較的高温多湿な亜熱帯東南アジア諸国では、COVID-19の症例が驚くべき速さで増加している。
5月22日現在、東南アジアでは合計182,278人のSARS-CoV-2感染者が確認され、死者数は5,500人を超えている(WHO、コロナウイルス病(COVID-19)状況報告書-124、2020年5月23日発表)。世界中の科学者がゲノムプロファイルを公開し、循環ウイルスの変異変種を特徴づけることで、その進化パターンや原動力についての洞察を得るために、前例のない努力をしている。
Tang, X.L.らは103のゲノム配列を解析し、循環するSARS-CoV-2株は、同義変異(NSP4_S75S)と非同義変異(NS8_L84S)の2つの大きな系統を持っていることを示した(Tang et al 2020)。別の研究では、Forster, Peterらは160の配列を解析して3つの中心的なバリアントを発見し、B型ウイルス(アミノ酸(aa)置換を有する、NS8_L84S)は東アジアに多く、A型(先祖代々の系統)とC型(NS3_G251Vバリアント)はヨーロッパや北米でパンデミックしていると主張した(Forster, Forster, Renfrew, & Forster, 2020)。
Changchuan Yinは558のゲノム配列を解析し、15の高頻度単一SNP遺伝子型を発見した(Yin, 2020)。彼は、単一または共進化変異を有する4つの主要なグループ、すなわち、NSP6_L37Fを有するグループ1、NS3_G251Vを有するグループ2、2部位に共進化変異を有するグループ3(NSP4_S75SおよびNS8_L84S)、および4部位に共進化変異を有するグループ4(241C>Tリーダー配列、NSP3_F105F、NSP12_P323LおよびS_D614G)を示唆した。
さらに、GISAIDは、COVID-19を、それぞれNS8_L84S、NS3_G251VおよびS_D614Gにaa置換を有する非同義変異を有する、北米でパンデミックするクラッドS(Clade S)、アジアおよびヨーロッパでパンデミックするクラッドV(Clade V)、およびヨーロッパでパンデミックするクラッドG(Clade G)の3つの主要なクラッドに分化させた(Fuertes et al 2020)。
その後、彼らはGクラッドをN_203-204を含むGRとGHクラッドに分けた。RG> KRとNS3_Q57Hのaa置換をそれぞれ含むGRとGHに分けた。
最後に、GISAIDから入手可能なゲノムデータに基づき、NextstrainのSARS-CoV-2グローバルゲノム疫学解析では、このウイルスの10の主要なクラッドが示された。
本研究では、東南アジアから入手可能なSARS-CoV-2の444のゲノム配列を調査し、この地域におけるゲノムの発散、系統、および再発変異についての洞察を提供する。
方法と材料
データ収集 東南アジアでは、インド(n=327)、バングラデシュ(n=20)、インドネシア(n=8)、タイ(n=83)、スリランカ(n=4)、ネパール(n=1)、ミャンマー(n=1)の合計444の高カバレッジSARS-CoV-2ゲノムが、2020年5月23日時点でGISAID(www.gisaid.org)に提出されている。
本研究では、hCoV19 / Wuhan / WIV04 / 2019 (Accession: EPI_ISL_402124)を参照ゲノムとして、系統解析および変異解析のために全444個のゲノム配列を解析した。
変異解析 全444個のSARS-CoV-2のゲノム配列をMAFFT(Multiple Alignment using Fast Fourier Transform)アルゴリズム(Katoh, Misawa, Kuma, & Miyata, 2002)を用いてアラインメントし、そのアラインメントをJalView 2.11.0で可視化した。
インド(n=30)、バングラデシュ(n=10)、インドネシア(n=8)、タイ(n=7)、スリランカ(n=4)、ネパール(n=1)から60のゲノム配列のサブセットを選択し、ユニークで共進化的な突然変異とその系統を集中的に解析した。
国別の配列数と比率は、利用可能な配列数と2020年5月23日までのCOVID-19症例の総数をもとに決定した。解析した配列の選択は、ゲノムの質、位置の不一致、ランダムサンプルの収集日を基準にした。
このサブセットのアクセッションID、収集日、場所は補足データ-1に記載した。60ゲノム中の同義でない突然変異とその特異的変異部位は、GISAIDのEpiCoVデータベースの「CoVsurver enabled by GISAID」を用いて決定した。
さらに、東南アジアの全444ゲノムにおける再発同義でない突然変異の頻度は、Anaconda Navigatorの下でSpyder 4.0.1アプリケーションを使用して決定した(Pythonプログラミング言語のフリーでオープンソースの配布物である(Van Rossum & Drake, 2009))。
Spike protein analysis Sタンパク質の配列を参照Sタンパク質と比較し、非同義変異部位を同定した。Sタンパク質の3次元構造をPhyre 2(Kelley, Mezulis, Yates, Wass, & Sternberg, 2015)を用いて構築し、変異部位をPyMOL(TM) 2.4で可視化した。
0ソフトウェア(Schrodinger, 2017)系統樹および進化解析 アラインメントされた配列は、Molecular Evolutionary Genetics Analysis(MEGA X)ソフトウェア(Kumar, Stecher, Li, Knyaz, & Tamura, 2018)の最尤法を用いて系統樹を構築するために使用した。
系統樹の枝やラベル色の調整には、Interactive Tree Of Life (iTOL) v5 (Letunic & Bork, 2019)を用いた。変異クラスター-時間プロット GISAIDで利用可能な444個の配列をすべて解析して、東南アジアの変異クラスター-時間プロットを作成した。
変異に基づくクラスタの割合は、2020年1月1日から5月23日まで毎月プロットされている。さらに、WHOの状況報告書から収集したCOVID-19の感染数と死亡数を同時間プロットに追加した。
感染経路分析 オンラインベースのリアルタイム病原体進化追跡ツール(Hadfield et al 2018)であるNextstrain上の国別フィルターを使用して、東南アジアでの感染パターン(2020年5月23日に実施)を観察した。Nextstrainサーバーは、利用可能な444の配列から329の配列をフィルタリングして、感染マップを作成した。
60ゲノムの詳細解析後に見つかった非同義変異の頻度を、GISAIDベースのSARS CoV-2変異統計サーバーを用いてグローバルに解析した。これらの特定の突然変異の頻度が高い国は、オンラインツールMaptiveを使用して地理的なヒートマップ上にマークされた。
結果
受理された論文 東南アジアのSARS-CoV-2配列444件のうち60件の突然変異を予備的に解析したところ、78件の非同義変異が明らかになった。そのほとんど(n=52)は非構造タンパク質に見られた。アミノ酸(aa)置換を伴う他の変異は、Sタンパク質(n=13)、Nタンパク質(n=9)、Mタンパク質(n=3)およびEタンパク質(n=1)に存在した。
早期に配列決定されたネパールSARS-CoV-2ゲノムは、我々の参照配列と比較して、非同義変異を有していなかった(表-1)。
このデータのサブセットでは、東南アジアのみで観察されたSタンパク質の4aaの変異を含む21のNS変異が同定された(表2)。これらのユニークな突然変異の大部分(n=15)は、これまでに一度しか発生していない。
残りの6つの変異は複数回出現しているが、これらの変異はそれぞれ特定の国や地域で循環していた。さらに、Sタンパク質のaaが置換されている変異が13個見つかった。
また、最も頻度の高い10のaa置換変異(N_R203K、N_G204R、N_P13L、NS3_Q57H、NS3_Q57H、NS8_L84S、NSP12_A97V、NSP12_P323L、NSP3_T1198K、NSP6_L37F、S_D614G)を同定し、それに応じて4つの主要なグループと3つのサブグループに分離した(図1)。
グループ1は、参照配列hCoV19/武漢/WIV04/2019を含む11の配列から構成されている(Accession.EPI_ISL_402124)。) このグループ内のすべての配列は、今年の初め(1月13日〜4月1日)に観察されたものであり、それらの優勢な変異のいずれも保有していない。
グループ2は、共進化変異NSP12_P323LとS_D614Gから構成されている。ほとんどの配列(n=24)がこのグループに属し、その分離日は2020年3月10日から5月4日までの範囲であった。このグループをさらに2つのサブグループに分離した;2aのグループはN_R203K、N_G204R(2881-28883:GGG>AAC)トリヌクレオチドの追加変異を有し、2bのグループはNS3(Q57H)にaa置換を伴う変異を有する。
グループ3は、NSP6_L37Fが特徴で、他の3つの変異(NSP12_A97V、N_P13L、NSP3_T1198K)が12のインド配列でこの変異と共進化し、ユニークなサブグループ3aを形成している。
グループ4は、NS8(L84S)における共通のaa置換を有するバングラデシュ、インド、およびタイからの8つの変異体からなる。
一次解析で見つかった優勢な変異は444のゲノムでも観察され、それらの変異の頻度の割合は図2aに国別に示されている。444個の配列を解析したところ、40個の配列が第1群に属し、203個が第2群に属し、145個が第3群に属し、45個が第4群に属していることがわかった(図2b)。さらに、サブグループ2a、2b、3bにはそれぞれ35、93、109のゲノムが含まれている。
444個の配列をSタンパク質解析したところ、aaa置換部位が49個見つかった(補足データ-2)。aa置換部位のうち、受容体結合ドメインに存在するのは4部位のみであり(R408I、I434K、E471Q、 S494P)、そのうちの2部位は重要な受容体結合モチーフに存在していた。
クラスターベースのタイムプロットでは、2020年1月から5月までの間に444個の利用可能な配列を調査した。クラスターベースのタイムプロットでは、2020年1月から5月までの間に444個の利用可能な配列を調査したが、第2群クラスターは2月までは観測されなかったが(0%、n=0)、3月には36%(n=58)、4月には48%(n=84)、5月には81%(n=61)であった。
第3群クラスターは、これらの月は0%~7%であったが、3月、4月には40%以上と急激に増加した。感染症は1月の17件から 2020年5月には12万8257件まで増加した(図4)。
地理的なヒートマップ(図5)を見ると、60の配列から見つかった78のNS変異の多くは、欧米でも共通していることがわかった(世界的な変異統計データベース、補足データ-3による)。また、感染マップからは、本研究で得られたグループ2の配列(NextstrainのA2clade)が、東南アジアで流通しているウイルスの中で優占的であることが明らかになった(図6)。
このクラッドには、ヨーロッパや北米でもパンデミックしている特徴的なS D614G変異が含まれている(Cao et al 2020; Gonzalez-Richee er al)。
議論
SARS-CoV-2パンデミックは、すでに33万3000人以上の命を犠牲にしており、毎日多くの死者が報告されている。この間、世界的なコミュニティは、その病原性、季節変動、感染特性、免疫をまだ予測していない。
しかし、地域によって致死率が異なり、人によって病原性の程度が異なることは明らかである(Khafaie & Rahim, 2020; Yao er al)。ヨーロッパや北米の一部の地域では、他の地域よりも影響を受けたが、アジア、アフリカ、オーストラリアの大部分では影響が少ないままであった。ssRNAゲノムの解析は、現在、ウイルスの発症と伝播を理解するために極めて重要である。
本研究では、東南アジアに流通しているSARS-CoV-2ウイルスを、共通の非同義変異を調べることにより、4つの主要グループと3つのサブグループに分類した。
第1グループは、再発変異を持たない40株で構成されている。これらの株は、この亜大陸では1月と2月に多く見られる(図2a、2b)。
グループ2は、本研究の変異体の46%(n=203)を含む。このグループに属する株は、特徴的なNS変異、NSP12_P323LおよびS_D614Gと共進化していた。これらの変異体は、当初は欧米でパンデミックしていたが、現在では全世界で68%を占めている。
最近の研究では、95の配列を解析し、NSP12_P323Lのバリアントがより高い頻度で存在することも発見され、このバリアントは、ほとんどが中国の武漢以外の地域でとして発見されたと報告されている(Khailany, Safdar, & Ozaslan, 2020)。
別の研究では、323位(NSP12_P323L)におけるRNA依存性RNAポリメラーゼ(RdRp)aaの置換(NSP12_P323L)がRdRp忠実度を引き起こし、それによりウイルス内の変異の数が増加し、共進化変異を引き起こすことが示唆されている(Pachetti et al 2020)。
NSP12_P323Lは、S_D614Gと共進化した;この特定の非サイレントSタンパク質変異は、S1-S2接合部の近くにエラスターゼ切断部位を追加的に生成し、その結果、融合および細胞侵入を促進する(Koyama, Weeraratne, Snowdon, & Parida, 2020)。
この変異体(S_D614G)は、2020年1月28日に初めて観察され、最初はヨーロッパでパンデミックした。4ヶ月以内に、この変異体は今では世界中で先祖代々のサブタイプを急速に凌駕するようになった(Bhattacharyya et al 2020)。
これらの研究は、東南アジアにおけるグループ2の亜型の頻度と、なぜこれらの亜型が共進化変異を伴う追加のサブグループに細分化したのかを説明している。
我々はグループ2を、N_203-204を含む2つのサブグループ2aおよび2bに分化させた。RG> KRおよびNS3_Q57H aa置換を、NSP12_P323LおよびS_D614Gとともに、それぞれ含む。
いくつかの研究(Ayub, 2020; Lorusso et al 2020; Yin, 2020)は、ヌクレオチド(2881-28883: GGG>AAC)におけるトリヌクレオチドブロック変異について言及しており、この変異は、Nタンパク質のセリンアルギニンリッチモチーフに影響を与える2つのaaの変化(N_203-204: RG>KR)をもたらした。
このトリヌクレオチドブロック変異は、35の配列から発見され、そのうち10はバングラデシュのダッカからのものであった。NS3_Q57H変異変種は、米国(Mercatelli & Giorgi, 2020)およびヨーロッパで一般的に発見されており、欠失性が予測されている(Issa, Merhi, Panossian, Salloum, & Tokajian, 2020)。
サブグループ2a株はバングラデシュ(50%)で優勢であるのに対し、2b株はインド(25%)に多い(図2a)。
グループ3a株は他の株とは異なり、4つの共進化変異を持つユニークな株であった。
これらのうち、NSP6_L37F変異変種は一般的であった(Mercatelli & Giorgi, 2020);この変異変種は、英国、米国、オーストラリア、インドでも頻繁に発見されている。
他の3つの突然変異は比較的一般的ではなく、ほとんどがインドとオーストラリアで発見されている。一方、グループ4は、特徴的なNS8_L84S変異変種からなり、Tang, X.L.らによってS型と宣言された(Tang et al 2020)。この変異は、後に別のグループによってC型として報告され(Forster, Forster, Renfrew, & Forster, 2020)、GISAIDによってSクラスター化された(Fuertes et al 2020)。
グループ4には、主にタイでパンデミックしている45の変異体が含まれていた(43%)。
Sタンパク質を解析した結果、49のaa置換部位が確認され、そのうち4部位は受容体結合ドメインに存在していた。Sタンパク質を解析した結果、49のaa置換部位があり、そのうち4つの部位は受容体結合ドメインに存在していた。
D614G変異の影響は先に述べたとおりであり、他のSタンパク質変異の影響はまだ評価されていない。10,014個の配列を用いて行われた最近の研究では、13個の頻度の高い非同義変異が同定された(Mercatelli & Giorgi, 2020)が、我々はそのうちの7個の変異に加えて、3個の頻度の低い変異がこの領域で高頻度に発見されただけである(図2a)。
この領域で同定されたSタンパク質の変異(補足データ-2)のほとんどは、GISAIDグローバル変異データベースによると、ヨーロッパと北米でも観察された。614 位に aa 置換を持つ S タンパク質の変異は、この領域で調査された株の 46%に見られ、ヨーロッパや北米でも多く見られた。
一方、バングラデシュのある株で見つかったSタンパク質の1109位のaa置換は、スイスの別の株で見つかった。また、インドネシアの株では、S タンパク質の 76 位(S_T76I)に別の aa 置換が見られたが、これはインドの西ベンガルの 2 つの株でも見られた(データは示されていない)。この特異的なaaの置換は、グローバルデータベースによると55回確認された。
そのうち49件はオーストラリアからのものであり、この変異体はオーストラリアから伝わった可能性があることが示唆された。また、グローバルな変異分布統計から、S_A829T変異が31配列で確認され、その全てがタイからのものであった(表2、補足資料-3)。
NSP2_I120F変異はバングラデシュのダッカからの12例中9例に、NSP2_D92G変異はバングラデシュのチッタゴンからの5例中4例に認められた(データは示していない)。
これらの都市は250km離れていることから,新規変異を持つウイルスが地域特異的に流通していることが示唆された.Nextstrainデータベースを用いて行われたNS変異および系統解析は、変異変異のバリエーションとその感染経路の可能性をより詳しく調べる上で特に有用であった。
我々は、共通のN_203-204. バングラデシュのダッカでは、RG>KR aa置換(12株中9株)を発見した。しかし、共通のN_203-204. しかし、チッタゴンでは、共通のN_203-204: RG> KR aa置換ではなく、Nタンパク質の202位(N_S202N)にあまり共通ではないaa置換が最も多い(7株中5株)株で観察された。
変異分布データベースから、Nタンパク質のトリヌクレオチドブロック変異を有する株はヨーロッパでパンデミックしており、最近のサウジアラビアの株ではN_S202N変異が多く見られた。
また、Nextstrainによる系統解析の結果、Chittagong株(Nextstrain B4 cladeに属し、本研究のグループ4)はサウジアラビア株との関係が近いのに対し、Dhaka株(NextstrainのA2 clade、本研究のグループ2)はヨーロッパ株と類似していることが明らかになった。
これらの非同義変異の地理的ヒートマップ(図6)を見ると、これらの変異の多くは英国、米国、オーストラリア、サウジアラビアなどのヨーロッパ諸国でも高頻度に検出されており、東南アジアへの感染経路の可能性が明らかになった。
Nextstrainによる系統解析では、同様の感染経路マップが得られた(図5)。また、今回の研究では、系統解析と突然変異解析により、グループ2の菌株のうち、インドやバングラデシュのヨーロッパや北米の株(Nextstrainによる解析ではA2クラード)との関連性が高いことが確認された。
モルディブ、ブータン、東ティモールの株については、解析時点でウイルスの全ゲノム配列データがないため、解析できないであった。ゲノム配列が確認されている70カ国の中で、SARS-CoV-2の感染数が多いのはインド、バングラデシュ、インドネシアのみであった。
感染頻度は2020年4月中旬から指数関数的に増加している。また、NSP12_P323LとS_D614Gの変異を含むグループ2変種が3月よりも早く発見されていないことが示された。
時間プロットデータ(図4)を見ると、このグループ2クラスターは1月、2月の0%から 2020年5月には81%まで急速に出現しており、この亜大陸では欧米株が最も最近優勢な株であることが示唆されている。
3月初旬に行われた研究では、NSP12_P323L(14408C>T)とS_D614G(23403A>G)の変異がヨーロッパで再発しており、それまでアジアでは検出されていなかったことが報告されており、我々の主張を裏付けている(Pachetti et al 2020)。
他の共進化変異とともに、NSP12_P323LとS_D614Gは、おそらく先祖代々の型よりも進化的に有利な変異体を提供し、この人口密度の高い地域で生き残り、循環することを可能にしているのであろう。
時間プロットを見ると、この地域では第2群の存在が増加していることに伴い、感染例と死亡例が増加していることがわかる。Manuel Becerra-FloresとTimothy Cardozoは最近、米国の様々な州でD614G変異株の有病率と致死率の高さが相関していることを報告した(Becerra-Flores & Cardozo, 2020)。
本研究では、東南アジアのSARS-CoV-2変異体に見られる非同義変異に焦点を当てた。このウイルスの感染および病原性に対するこれらの変異体の生物学的効果を決定するためには、より多くの実験的研究が必要である。
これまでの研究では、高温多湿がSARS-CoV-2の感染を減少させるという仮説が立てられていた。最近の研究では、ゲノムと気候を組み合わせたアプローチを用いて、このウイルスの病原性と伝播に関する重要な情報を提供している(Bajaj & Arya, 2020)。
しかし、SARS-CoV-2の季節性はまだ確立されておらず、比較的高温多湿な気候にもかかわらず、東南アジアではSARS-CoV-2の感染率が増加している。
我々の研究では、Sタンパク質(D614G)とRdrp(P323L)のaa置換を含む欧米の変異体が、最近この地域で支配的な変異体となっていることを示している。
この地域にこの変異体が出現したことにより,感染例や死亡例も増加している。この変異体が急速に出現し、冬が近づいていることを考えると、SARS-CoV-2の次の波は東南アジアで起こる可能性がある。
SARS-CoV-2スパイクの変異がウイルス感染性と抗原性に与える影響
The Impact of Mutations in SARS-CoV-2 Spike on Viral Infectivity and Antigenicity
https://pubmed.ncbi.nlm.nih.gov/32730807/
序論
ハイライト
・100以上の変異を選択し、その感染性と抗原性の解析を行った。
・優性のD614Gそのものと他の変異との組み合わせは感染性が高い
・RBDにおけるN331とN343の両方のグリコシル化をアブレーションすると、感染性が劇的に低下した。
・N234Q、L452R、A475V、V483Aのような10の変異は、いくつかのmAbsに対して顕著な抵抗性を示した。
概要
SARS-CoV-2のスパイク蛋白質は突然変異を受けており、高度に糖鎖化されている。これらの変異の生物学的意義を調べることは極めて重要である。ここでは、80のバリアントと26のグリコシル化部位修飾について、中和抗体と回復期患者からの血清のパネルに対する感染性と反応性を調査した。D614Gは、D614Gと別のアミノ酸変化の両方を含むいくつかのバリアントとともに、有意に感染性が高かった。
受容体結合ドメインでアミノ酸が変化した亜種のほとんどは感染性が低かったが、A475V、L452R、V483A、およびF490Lを含む亜種は、一部の中和抗体に対して耐性となった。さらに、グリコシル化欠失の大部分は感染性が低かったが、N331とN343の両方のグリコシル化欠失は感染性を劇的に低下させ、ウイルスの感染性におけるグリコシル化の重要性を明らかにした。
興味深いことに、N234Qは中和抗体に対して顕著な抵抗性を示したが、N165Qはより感受性が高くなった。これらの知見は、ワクチンや治療用抗体の開発に役立つ可能性がある。
議論
RNA ウイルスである SARS-CoV-2 ウイルスは,ヒトの集団の中で時間の経過とともに進化し続けると予想される.循環するウイルス株の綿密なモニタリングは、ワクチンや治療法の研究開発に情報を提供するために、疑いの余地のない重要性を持っている。
ここでは、GISAIDデータベースに報告されているすべてのスパイク配列(13,000以上)を解析した。その結果、不完全な配列、冗長な配列、曖昧な配列をフィルタリングした結果、80種類のバリアントに絞り込まれた。
さらに、ウイルスタンパク質のグリコシル化はウイルスの複製や免疫応答に影響を与えることがよく知られており、SARS-CoV-2 Sタンパク質は高グリコシル化されていることから、22のグリコシル化部位すべてで26の置換変異を行った。
合計で106個の疑似型ウイルスを作成し、確立された方法(Nie et al 2020;STAR Methodsを参照)を用いてそれらを特徴付けることができた。変異体および調査変異体の特徴を表1にまとめた。
すべてのバリアントのうち、D614Gは特に注目すべきものである。このバリアントは、その出現以来急速に蓄積し、より多くの臨床的提示とリンクしていることが示されている(Korber et al 2020)。
本研究の開始時(2020年5月6日)には、全流通株の62.8%(表S1)を占めていたが、7月3日までには75.7%に達していた。この優性株は、試験した4つの細胞株に効果的に感染することができ、元の武漢-1株に比べて10倍の感染力を持っていた(図3)。
別の重要な知見は、中和mAbsに対する反応性に影響を与える可能性のある天然バリアントは、本研究で使用されたすべての抗体がRBDを標的としていたため、ほぼすべてがRBD領域に位置していたことである(A831Vを除く)(Cao et al 2020年;Ju et al 2020年;Lv et al 2020b;Shi et al 2020)。具体的には、SARS-CoV-2患者の末梢血単核細胞(PBMCs)中のRBD特異的B細胞を単離するために、RBDをベイトとしてP2B-2F6およびP2C-1F11を得た(Ju et al 2020)。
P2C-1F11およびP2B-2F6は、実際には重複するエピトープに結合し、後者の方がより特徴的である。具体的には、P2B-2F6は、RBD上の3つの疎水性相互作用部位(Y449、L452、およびF490)に関与している(図6Aおよび6B)。
実際、L452RおよびF490Lの両方は、P2B-2F6 mAbによる中和に対する感度が低下した自然変異体であった;L452RおよびF490Lの両方がP2C-1F11に対する感度を維持しているため、このmAbはP2B-2F6のための同じクローンに由来するものではないことを示唆している。
さらに、両方の変異体は、参照株と比較して、別の中和性mAb X593に対する感度が10倍減少したことを示した(図4)。
図6mAbエピトープと抗原性関連部位
原文参照
中和 mAbs に対する感度が低下する複数の亜種を同定したが、これらの亜種が現場でどの程度の頻度で存在するかを調べる必要がある。RBDのV483Aは、変異頻度が0.1%を超える2つのバリアントのうちの1つである。それは、2つのmAbs(P2B-2F6およびX593)に対する反応性の低下を示した(図6Aおよび6B; Ju et al 2020)。
別のRBDバリアントA475Vは、RBDの結合エピトープに座る。それは、P2C-1F11、CA1、247、およびCB6を含むいくつかの中和mAbsに対して有意に抵抗性である。
CB6 mAbが受容体結合エピトープを標的とすることは注目に値する(図6Cおよび6D;Shi et al 2020)。具体的には、Y508は、mAb H014によって標的化されたエピトープに埋もれていた(図6Eおよび6F;Lv et al 2020b)。実際、Y508Hは、このmAbに対して抵抗性であることが判明した。
D614G+I472Vが増加した感染性および中和抗体に対するより多くの抵抗性を示したことは言及する価値がある(表1)が、GISAIDでは1つの配列(カナダ由来)のみが報告された。さらに、N439K、L452R、A475V、V483A、F490L、およびY508Hを含むいくつかの亜種は、中和性MAbに対する感受性の低下を有する。
しかし、V483Aのみが研究開始時の頻度が0.1%を超えており、これらはすべて米国で発見され、2020年5月6日時点で28の配列が報告され、2020年7月3日までの36の配列が報告されている。N439Kを含むバリアントは、流通量の大幅な増加、すなわち、2020年5月6日時点で5例(すべて英国)が報告され、2020年7月3日までに47例(英国45例、ルーマニア2例)が報告された。
また、5月6日時点でY508Hを含むフランス由来の配列がGIRSAIDに寄託されたのは1例のみであったのに対し、2020年7月3日時点では4例が報告されており、そのうち2例はオランダ由来、1例はスウェーデン由来、1例はフランス由来であった。
他の亜種については1~2株のみが報告されており、我々がモニタリングしてきた時間枠の間に増加したことは観察されていない。しかしながら,RNAウイルスは常に変異を繰り返しており,ある種の変異はある期間にしか出現しないものもあれば,予測不可能な形で出現するものもあることから,変異の頻度や時間的パターンの観点から,循環している株の解析を継続する必要がある.
本研究で使用した13種類のmAbsは、変異体に対する阻害効果が異なるようであるため、7つのグループに分類できることが示唆された。このように、少なくとも2種類のmAbsで構成される治療レジメンを策定することは興味深いことであろう。
例えば、P2C-1F11 と X593 の組み合わせは、この研究のすべてのバリアントを阻害するのに有効であるはずである。RBDの外のエピトープを標的とした中和抗体をさらに試験することに興味がある。
今回解析したグリコシル化変異体については、N165QはP2b-2F6に対する感度を高めたが、N234QはCA1、CB6、157などの中和性mAに対して抵抗性を示した。どちらも血中には存在しないが、中和性mAbに対するこれら2つの変異体の反応性は注目に値する。
N165およびN234はRBD領域の近くに位置しているので(Watanabe et al 2020)、これらの変異体は、中和性mAbによって標的とされるいくつかのエピトープに影響を与える可能性がある。具体的には、N165のグリコシル化部位は、Sタンパク質のRBD領域へのmAbの結合に関与している(Cao et al 2020)。この糖鎖は、抗体が標的とするエピトープをマスクすることができると考えられる。
このタイプの糖鎖シールドは、HIV-1などの他のウイルスでも観察されている。
具体的には、HIV-1 gp120のN197糖鎖の欠失は、このエピトープを標的とすることによって中和を増強し得る(Li et al 2008; Utachee et al 2010; Wang et al 2013)。
この研究では、同じくRBDに近い他のグリコシル化変異体N234Qは、いくつかのmAbsに対して抵抗性を示した。それにもかかわらず、他のウイルスでの観察と同様に、糖鎖自体が中和性mAbsの標的である可能性を排除することはできない。
具体的には、インフルエンザウイルスH1N1の残基142および144における糖鎖は、中和抗体の誘導に不可欠であり(Huang et al 2020)、一方、HIV-1のgp120、2G12、PGT121およびPG9のエピトープに対する広義の中和抗体は、糖鎖を標的とすることが見出されている(Doores、2015)。
COVID-19ワクチンは、細菌、哺乳類細胞、植物発現系などの異なるプラットフォームで開発されているため、異なる糖鎖プロファイルがワクチンの免疫原性に影響を与え得ることを考慮することが重要である。
中和アッセイに10人の回復期患者からの血清を使用して、よく特徴づけられた中和mAbsで得られた結果を大きく確認した。
療養中の特許から得られたポリクローナル抗体は、完全長Sタンパク質上の複数のエピトープに対して指示されていることを考えると、変化した反応性の大きさはmAbsよりもヒト血清の方がわずかに小さいことが理解されている;その結果、これらのポリクローナル抗体は互いに補完し合うことができる。
しかしながら、ヒト抗体に対する反応性の違いは、ほとんどの場合で数倍の差があり、すべて統計的に有意であると判断された。特筆すべきは、A475VやF490LのようないくつかのRBD変異体は、ヒト血清と複数の中和性mAbsの両方に対する感度を低下させることが確認されている。
A475Vは本研究で使用した13種類のmAbのうち6種類のmAbに対する感度を低下させたのに対し、F490Lは3種類のmAbに対する中和感度を低下させた。
回復期血清中の抗体が、hACE2受容体へのSタンパク質の結合を破壊することが知られているこれらのmAbによって標的化されたこれらの重要なエピトープを中和することができる可能性がある(Ju et al 2020年;Shi et al 2020年;Walls et al 2020年;Wang et al 2020)。A475Vは、水素結合および疎水性相互作用を弱める可能性があり(Shi et al 2020)、一方、F490Lは、分子間の疎水性相互作用を侵食する可能性がある(Ju et al 2020)。
要約すると、100以上の疑似型ウイルスを、感染性およびよく特徴づけられたmAbsまたは回復期患者からのヒト血清による中和に対する感受性の観点から分析した。
アミノ酸の変化がスパイクタンパク質全体にわたって観察された。RBDの外側のアミノ酸変化(D614G)は、より感染性が高いことが判明したが、中和抗体に対する耐性を示す証拠は示されていない。しかし、D614Gの優勢化は特に注目に値する。
ここで研究されたRBDでアミノ酸が変化した株の中には感染力を失ったものもあり、それらが普及しない可能性が高いことを示唆しているが、抗体を媒介とした中和に対する抵抗性が増加したRBD天然亜種は、注意深く観察されるべきである。
さらに、グリコシル化部位のアブレーションは、中和抗体に対する反応性と感染性に影響を与え、グリカンがSARS-CoV-2ウイルスの複製やワクチン誘発免疫応答に大きな影響を与える可能性があることが示唆された。
我々の知見は、感染性の向上と抗原性の変化に関して、循環ウイルスの中で進化しているいくつかの株の意味を明らかにするのに役立つものである。
