ビタミンA
https://www.sciencedirect.com/science/article/pii/S1521661620302254
免疫機能のサポートにおけるビタミンAの役割は確立されているにもかかわらず、健康な人における急性ウイルス性呼吸器感染症の予防のためのサプリメントの有益性を支持する証拠は不十分である。
しかし、ビタミンA欠乏者は、呼吸器同期ウイルス、麻疹ウイルス、インフルエンザウイルスなどのウイルス感染症のリスクが高く、重症度が高く、免疫反応が低下しやすいとされている。
ビタミンAの免疫支持的役割には、ムチンおよびケラチンの促進、リンパ増殖、アポトーシス、サイトカイン発現、抗体産生、好中球、ナチュラルキラー細胞、単球またはマクロファージ、T細胞、およびB細胞の機能強化が含まれる。
Covid-19の治療におけるレチノイドの役割?
https://pubmed.ncbi.nlm.nih.gov/32459003/
2020年の新型コロナウイルス(SARS-CoV-2またはCovid-19)の世界的な大発生は、国際的な健康への深刻な脅威であり、したがって、ウイルスの拡散を遅らせることに大きな影響を与えることができる新規治療法の発見または再利用薬の使用が急務となっている。
1型インターフェロン(IFN-I)は、SARS-CoV-2に対する試験が行われているウイルスに対する初期の自然免疫反応の一族のサイトカインである。しかしながら、SARS-CoV-2に類似したコロナウイルスは、宿主のIFN-I抗ウイルス応答を抑制することができる。
レチノイドは、ビタミンAに関連するファミリー分子であり、IFN-Iの作用を増加させ、増強する能力を含む、強固な免疫調節特性を有する。したがって,レチノイドのようなアジュバントは,IFN-Iを介した抗ウイルス反応を増強させることができるため,SARS-CoV-2の前臨床試験では,IFN-Iと抗ウイルス薬の組み合わせで試験を行うべきことが考えらる。
IFN-I
SARS-CoV-2は、2019年12月に中国で出現した新規の一本鎖RNA(ssRNA)コロナウイルスで、全世界で300万人以上に感染し、2020年5月時点で約25万人の死亡原因となっている。ワクチンや有効な治療法がない中で、1型インターフェロン(IFN-I)(2)を含む多数の新規抗ウイルス薬や再利用療法が検討されている(1、2)。IFN-Iは、強力な抗ウイルス特性を持つサイトカインの一群であり、ウイルス感染に対する初期の自然免疫反応を媒介する(3)。
IFN-Iは、肺上皮細胞、マクロファージ、しかし最も顕著な形質細胞様樹状細胞(pDC)を含む多数の細胞型によって分泌される(3)から構成される(4)。IFN-Iは、膜インターフェロンの活性化を介して細胞の免疫作用を媒介し、ウイルスの複製を阻害し、適応免疫応答を刺激するように作用するIFN刺激遺伝子(ISG)の下流の調節と発現を調節する(4)。
抗ウイルス剤ロピナビル/リトナビル(ChiCTR2000029387)、ファビピラビル(ChiCTR2000029600)、およびSARS-CoV-2の治療のためのロピナビル/リトナビル+グルココルチコイド(ChiCTR2000029386)、ロピナビル/リトナビルおよびリバビリンとの併用(NCT04276688)(5)。
治療法の使用は、中華民国が発表したSARS-CoV-2患者の臨床ケアと治療の基準の最新版の一部である。プロトコルは、500万UのIFN-inとリバビリンの組み合わせを1日2回投与することである(1)。
IFN-Iの抗ウイルス反応によるコロナウイルスの回避 今日まで、IFN-Iが細胞や動物モデルでSARS-CoV-2を阻害できるかどうかを検討した研究はありませんでしたが、IFN-Iが単独または抗ウイルス薬との併用で、密接な関係にある2つのコロナウイルス、SARS-CoVとMERS-CoVをin vitroで阻害するのに有効であるという大規模なデータがある(6)。
しかし、ヒトにおけるSARS-CoVおよびMERS-CoVに対するIFN-Iの臨床的有効性の研究結果は様々であり、IFN-I治療全体としては、一般的にヒトにおけるこれらのコロナウイルス感染を有意に軽減することはできませんだった(6)。既知の抗コロナウイルス薬であるIFN-Iの臨床効果がヒト試験で一貫していないのはなぜかは不明である。
IFN-Iの抗ウイルス特性の証拠は、IFN-I投与のタイミング、およびコロナウイルスに感染した患者における併存疾患の存在と重症度が、IFN-I治療に対する臨床的反応の決定因子の一部であることを示唆している(7, 8)。また、SARS-CoVおよびMERS-CoVは、多くのウイルスと同様に、宿主細胞におけるIFN-Iシグナル伝達を混乱させることができることを示す、説得力のある証拠が多数存在する(9-12)。
例えば、SARS-CoVは、IFN-Iプロモーター活性化に必要な重要な転写因子であるインターフェロン調節因子3(IRF-3)およびレチノイン酸誘導遺伝子I(RIG-I)を阻害することにより、宿主のIFN-I応答を抑制することができる(10、11)。
RIG-IはRNAウイルスの感知に関与するパターン認識受容体であり、IFN-Iおよび初期の自然免疫応答の誘導に重要な役割を果たしている(13)。活性化されたRIG-Iは、IRF-3およびIFN-IおよびIII型インターフェロンを含む多数の抗ウイルス遺伝子のNF-mRNA発現を介してシグナルを送る(13)。
MERS-CoVはまた、RIG-I(13)に拮抗することができ、ORF4bでコードされたアクセサリータンパク質(12)を介してIFN-Iの抗ウイルス応答にも拮抗することができる。したがって、SARS-CoV-2は免疫賦活プログラムの一環として、同様の方法でIFN-Iを介した抗ウイルス反応を阻害するように作用すると予測するのが妥当である。
これらのデータは、抗SARS-CoV-2の薬理学的および治療プロトコルを開発する際に、IFN-Iの抗ウイルス効果を刺激し、増強することが可能なアジュバントが真剣に検討されるべきであることを示唆している。
免疫調節剤としてのレチノイドとSARS-CoV-2のためのIFN-Iプロトコルを持つ潜在的なアジュバント。
レチノイドは、レチニルエステル、全トランスレチノールおよび全トランスレチノイン酸(RA)(14)を含む、全トランスレチノール(ビタミンA)と相対的に定性的な活性を有する分子のファミリーである。RAは生物学的に活性なレチノイド代謝物であり、同族受容体を介して作用することで、適応免疫応答および自然免疫応答の両方を含む多数の生物学的経路に関与する遺伝子の発現を調節する[(15)でレビューされている]。
レチノイドは、NK細胞、抗原提示樹状細胞(DC)、および自然免疫細胞(ILC)を刺激することで、T細胞を介した適応免疫および自然免疫応答のエフェクターとして作用する(15、16)。
レチノイドとIFN-Iの組み合わせを試験する根拠は強く、レチノイドが分泌を刺激し、IFN-Iの効果を増強することを示す多くの前臨床および臨床データに基づいている(17, 18)。
レチノイドは、RIG-Iを含むISG、およびIFN調節因子1(IRF-1)を含むISGのmRNA発現を直接刺激することができる(16、17、19-21)。
レチノイドのIFN-I増強効果は、癌の細胞および動物モデル、ヒト癌臨床試験(17、19)、および多発性硬化症(MS)の治療において文書化されている(22)。
Quらは、多発性硬化症(MS)患者の末梢血単核球をRA処理した場合、IFNが回復したCD8+Tサプレッサー細胞の機能が増加したことを報告している。同様に、MS患者を対象とした第1相臨床試験では、合成レチノイドであるエトレチネートを用いた治療により、IFN–細胞機能とTサプレッサーの機能回復の効果が増強されたことが報告されている(23)。
RIG-I
レチノイドがIFN-Iを増強する重要なメカニズムは、RIG-Iの活性化である。その名が示すように、RIG-IはRAによって刺激され、レチノイドのIFN-I増強および抗ウイルス効果は、RIG-IのmRNAおよび機能の直接的な刺激によって起こることを支持する多くの証拠がある(24-26)。
Soyeら(24)は、U9370およびHuh-7感染細胞における麻疹ウイルス(MeV)の複製をRAが阻害することは、RIG-IのIFN-プロモーターの活性化を介して起こることを実証した。
RIG-I遺伝子およびその下流エフェクター。
同様に、Chenらは、エンテロウイルス71に対するRAの抗ウイルス効果がIFN–Iを介して媒介されたことを報告した(25)。天然および合成レチノイドはまた、B型肝炎ウイルス(HBV)、サイトメガロウイルス、インフルエンザ、MeVおよびノロウイルスを含む多くのウイルスの複製に対して直接的な抑制効果を有する(27-30)。また、レチノイドシグナルの活性化がコロナウイルスを強力に阻害するという証拠もある(31)。
Yuanらは、ライブラリスクリーニングにより、-CoVおよびMERS-CoVウイルスに特異的なアゴニストであるAm580が、SREBPを介したリポトーシス経路を阻害することを明らかにした。
コロナウイルスSARS-CoVおよびMERS-CoVは、IFN-Iを介した抗ウイルス反応を阻害し、おそらく治療を妨げる可能性があることを考えると(9-12)、レチノイドは宿主のIFN-Iシグナルを増強することができることを支持するデータ、および約60年間の臨床使用の後にそれらの十分に文書化された安全性プロファイルは、SARS-CoV-2の細胞および動物モデルにおけるIFN-Iとレチノイドの組み合わせの前臨床試験を保証するものである。
COVID-19の治療におけるビタミンAの標的とメカニズムの解明
https://www.aging-us.com/article/103888/text
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、急速な感染と高い死亡率を特徴とするパンデミック性疾患であるコロナウイルス疾患2019(COVID-19)を引き起こす。COVID-19患者の臨床診断は欧米諸国を中心に急増している。世界的に見ても,COVID-19の有効な治療法はまだ限られている。
ビタミンA(VA)は肺炎の管理において薬理学的活性を示す。このことから、ビタミンAは抗SARS-CoV-2レジメンとして有用である可能性があると考えられる。本研究では,バイオインフォマティクス解析とネットワーク薬理学的手法を用いた計算アッセイを行い,COVID-19の治療におけるVAの治療標的とそのメカニズムを明らかにした。
その結果,SARS-CoV-2に対するVAの候補標的,薬理学的機能,治療経路を同定した。バイオインフォマティクスの知見から,SARS-CoV-2に対するVAの作用機序には,免疫反応の濃縮,炎症反応の抑制,活性酸素に関連する生物学的プロセスが含まれていることが明らかになった。
さらに、COVID-19に対するVAのコアターゲットとして、MAPK1、IL-10、EGFR、ICAM1、MAPK14、CAT、PRKCBを含む7つの標的が同定された。このバイオインフォマティクスに基づいた報告により,VAの抗SARS-CoV-2機能とそのメカニズムを初めて明らかにし,世界的なパンデミック病であるCOVID-19に対する強力な治療オプションとしてVAが作用する可能性を示唆している。
はじめに
新型コロナウイルス重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされる致死性疾患であるコロナウイルス病2019(COVID-19)は、中国で初めて発見され、高い罹患率と死亡率を伴う[1]。このウイルスは世界中に広がり、特に米国では非常に大きな集団に感染している[2]。COVID-19の臨床的特徴には、発熱、無力症、呼吸困難のほか、急性呼吸窮迫症候群、敗血症性ショック、および重症患者の凝固機能障害が含まれることがある[3]。SARS-CoV-2はその致死率の高さから、宿主におけるSARS-CoV感染の病態解明に重要な因子であるアンジオテンシン変換酵素2(ACE2)と強く結合している可能性があると考えられている[4]。
最新の研究成果では、SARS-CoV-2のACE2に対する親和性は、SARS-CoVの10~20倍である可能性が示唆されている[5]。SARS-CoV-2感染者では、65歳以上の死亡率が最も高いことが報告されている[6]。臨床的には、SARS-CoV-2の有効かつ正確な診断が達成されている。しかし、COVID-19に対する内科的薬物療法はまだ不十分である[7]。したがって、COVID-19を治療するための生理活性化合物の探索・開発が必要である。ビタミンは食品として考えられており、免疫系において重要な役割を果たすことが報告されている[8]。
ビタミンA(VA)は、成長および生殖を促進し、骨、上皮組織、視力、および粘膜上皮の正常な分泌を維持するなどの強力な生理機能を有する。VAおよびその誘導体は、前がん病変を予防することができる[9]。VAは免疫機能の維持に必要であり、免疫細胞の分化・増殖に関与しているとの報告が増えている[10]。
VAは、核内受容体を介した標的遺伝子の調節により、免疫細胞の抗体産生能力を向上させたり、Tリンパ球に機能性リンパホカインの放出を誘導したりすることが報告されている[11]。さらに、VAは、循環血液中のナチュラルキラー細胞(抗ウイルス活性を示す)の十分なレベルを維持するために極めて重要である[12]。
VAアジュバント療法は、IgMおよびIgGレベルを上昇させ、Tリンパ球を活性化させることで、体の免疫機能を高める可能性がある[13]。さらに重要なことに、ビタミンAは肺炎に対して重要な役割を果たすことが報告されている。
VA含有量の低さが新生児肺炎と関連していることが証明されている[14]。臨床データは、VAの欠乏が小児における致死的なマイコプラズマ誘発性肺炎に関与していることを示している[15]。さらに、VAの補給は小児の肺炎の臨床合併症の減少と院内時間の短縮に寄与している[16]。
これらのエビデンスはすべて,ビタミンAがCOVID-19の任意の治療法である可能性を示唆しているが,SARS-CoV-2に対するVA,特にその薬理学的機序についてはこれまで検討されていなかった。本報告では,COVID-19に対するVAの治療効果を明らかにするとともに,ネットワーク薬理学的アプローチを用いて,VAの治療的役割の根底にあるメカニズムを明らかにすることを目的とした。
研究成果
SARS-CoV-2およびビタミンA関連遺伝子の同定
SARS-CoV-2関連遺伝子とVA薬理作用遺伝子を決定するために、一連のバイオインフォマティクス解析を行った。GenecardおよびOMIMデータセットから393個のSARS-CoV-2関連遺伝子をアッセイして同定した。さらに、UniProtツールを用いてデータを補正した後、122個のVA-薬理作用遺伝子を同定した(図1)。ターゲット(VA関連遺伝子とSARS-CoV-2関連遺伝子)を比較したところ、SARS-CoV-2に対するVA関連ターゲットが15個同定され、共通の遺伝子をターゲット機能-タンパク質相互作用ネットワーク解析の対象とした(図1)。自由度の中央値を2.923、最大自由度を7、コアターゲットのスクリーニング条件を3~7とした結果、SARS-CoV-2に対するVAのコアターゲットとしてMAPK1、IL-10、EGFR、ICAM1、MAPK14、CAT、PRKCBの7つが同定された(図2)。
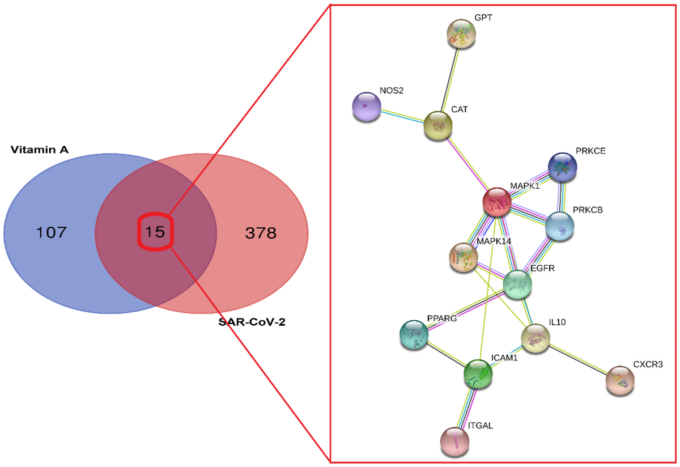
ビタミンAとSARS-CoV-2関連遺伝子の同定。SARS-CoV-2に対するビタミンAの同定されたPPIネットワークとの交差標的を示すベン図。
図2. SARS-CoV-2に対するビタミンAの7つのコアターゲットの遺伝子ネットワーク
SARS-CoV-2に対するビタミンAの生物学的役割
コアターゲットは、VA の生物学的役割と SARS-CoV-2 に対するシグナル伝達経路の可能性を理解するために、遺伝子オントロジー(GO)生物学的プロセスおよび KEGG パスウェイエンリッチメント解析を行った。GOの結果、VAはウイルスに対する細胞応答、免疫、サイトカインの産生と分泌、炎症反応に関連する多くの生物学的プロセスを媒介していることが明らかになった(図3Aおよび補足表1)。免疫応答は、免疫応答活性化細胞表面受容体シグナル伝達経路を介して、好中球およびリンパ球などの異なるクラスの免疫細胞によって媒介される。VA媒介免疫応答はまた、免疫グロブリン産生によっても調節される(図3Aおよび補足表1)。さらに、VAは、SARS-CoV-2に対する急性および慢性炎症応答の両方において役割を果たした(図3Aおよび補足表1)。
図3. SARS-CoV-2に対するビタミンAの7つのコアターゲットの遺伝子オントロジー解析。(A) SARS-CoV-2に対するビタミンAが媒介する生物学的プロセスを示すバブル図。(B) SARS-CoV-2に対するビタミンAのすべてのコアバイオターゲットは、サークロ図の上位10の最も濃縮されたGO用語にリンクされている。
SARS-CoV-2に対するビタミンA媒介シグナル伝達経路とネットワーク
その結果、ビタミン A はヒトサイトメガロウイルス、インフルエンザ A、カポジ肉腫ヘルペスウイルス、ヒト免疫不全ウイルス 1、C 型肝炎、エプスタインバー、ヒト乳頭腫ウイルスなどのウイルス感染症に関連する一連のシグナル伝達経路を制御している可能性があることが明らかになった(図 4、オンラインリソース 2)。さらに、ビタミンAがFoxO、VEGF、TNF、Ras、核内因子κB(NF-κB)、ホスホリパーゼD、mTOR、JAK-STATなどの多くの重要な細胞シグナル伝達経路に関与していることも明らかにした(図4および補足表2)。さらに重要なことは、T細胞受容体シグナル伝達経路、白血球経内皮移動、ナチュラルキラー細胞媒介細胞毒性、FcεRIシグナル伝達経路、B細胞受容体シグナル伝達経路などの免疫応答にビタミンAが関与していることを見出した。Th1・Th2細胞の分化、FcγR介在性貪食、IL-17シグナル伝達経路、Toll様受容体シグナル伝達経路、Th17細胞の分化、ヒトT細胞白血病ウイルス1感染(図4、補足表2)。ビタミンAは、NOD様受容体シグナル伝達経路、ケモカインシグナル伝達経路を介してサイトカイン産生を調節している(図4、補足表2)。これらの知見は、ビタミンAがCOVID-19の潜在的な治療法であり得ることを示唆している。最後に、Cytoscapeソフトウェアを用いて、VA-target-GO-KEGG-SARS-CoV-2の遺伝子ネットワーク図を構築した(図5)。
SARS-CoV-2に対するビタミンAの7つのコアターゲットのKEGG(Kyoto Encyclopedia of Genes and Genomes)パスウェイ解析。A)SARS-CoV-2に対するビタミンA媒介細胞シグナル伝達経路を示すバブル図。B)SARS-CoV-2に対するビタミンAの特定されたコアバイオターゲットは、サークロ図の中で最も濃縮された10のKEGG用語と関連していた。
図4. SARS-CoV-2に対するビタミンAの7つのコアターゲットのKEGG(Kyoto Encyclopedia of Genes and Genomes)パスウェイ解析。A)SARS-CoV-2に対するビタミンA媒介細胞シグナル伝達経路を示すバブル図。B)SARS-CoV-2に対するビタミンAのコアターゲットは、サークロ図の中で最も濃縮された10のKEGG用語と関連している。
SARS-CoV-2に対するVAの標的-KEGG経路の相互作用ネットワーク。中央部は、ビタミンAの抗SARS-CoV-2標的と、濃縮された上位20の生物学的機能とKEGG経路を表した。
図5. SARS-CoV-2に対するVAの標的KEGG経路の相互作用ネットワーク。中段はビタミンAの抗SARS-CoV-2ターゲットと、濃縮された上位20の生体機能とKEGG経路を表している。
議論
近年、2020年にはSARS-CoV-2の有病率と死亡率が世界的に、特に先進国で急増している[17]。しかし、COVID-19に対する既存の薬物治療薬はほとんどなく、臨床で使用されている免疫療法治療薬や抗ウイルス薬の中には、治療効果が限られているものもある[18]。したがって、潜在的な治療薬のさらなる調査と開発が望まれている。今回のバイオインフォマティクス報告では,ネットワーク薬理学の新たなアプローチにより,VA の抗 SARS-CoV-2 標的および分子機構を同定し,明らかにすることを目的とした。
VAは、細胞保護作用、抗ウイルス作用、抗炎症作用、免疫調節作用を介して、COVID-19の治療に強力で有益な薬理学的活性を発揮する可能性がある。ネットワーク薬理学的手法を用いて分子機能を明らかにすることで,VAの抗SARS-CoV-2効果は,MAPK1,IL-10,EGFR,ICAM1,MAPK14,CAT,PRKCBを含むいくつかの鍵となる分子とそれに対応する遺伝子によって調節されていることが示された。
我々は以前の報告で、ビタミンCがSARS-CoV-2に対するコアターゲットのクラスターも調節できることを示した[19]。これらの知見を比較したところ、ビタミンAとビタミンCの両方の効果にMAPK1とEGFRという2つのコアターゲットが見られた。 機能性プロテインキナーゼであるMAPK1は、細胞外刺激から細胞内シグナル伝達への切り替えに重要な役割を果たしている。シグナル伝達経路の変化は、がんを含む複雑な疾患で証明されている[20]。
VAによって発揮される抗肺炎作用は、MAPK1活性を含むMAPKシグナル伝達経路の特異的な抑制に関連していることが報告されている[21]。チロシンキナーゼ受容体であるEGFRは、細胞の増殖、分裂、分化、生存、癌化などの調節に重要な役割を果たしている[22]。EGFR変異患者は院内肺炎を発症する可能性が高いことが報告されている[23]。
重要な抗炎症性サイトカインであるIL-10は、炎症性Th細胞や免疫病理を効果的に制御し、細胞の恒常性を確保することができる[24]。IL-10の不活性化が肺炎発症リスクの増加と関連していることを示す報告もある[25-26]。膜貫通型糖タンパク質受容体であるICAM-1は、炎症性細胞やサイトカインを標的組織にリクルートすることができる[27]。
報告によると、血中のICAM-1含量は、小児肺炎を含む肺炎患者の強力なバイオマーカーとして機能する可能性がある[28] [29]。よく知られた抗酸化酵素であるカタラーゼは、いくつかの生物学的機能のための酸化触媒として作用する[30]。
生物学的には、カタラーゼはインフルエンザ誘発性肺炎に対して潜在的な治療効果があることがわかっている[31]。B細胞の重要な調節因子であるPRKCBは、B細胞の運命を決定する代謝およびミトコンドリアのリプログラミングを調節することができる[32]。
いくつかの証拠は、PRKCB の過剰発現が NF-κB パスウェイの活性化を介して肺炎の発症と関連していることを示している [33]。これらの予測ペプチドは、SARS-CoV-2を検出するための潜在的なマーカーとして使用することができ、SARS-CoVに対する薬理学的なターゲットとして機能する可能性がある。
さらなるバイオインフォマティクスおよび計算アッセイにおいて、COVID-19を管理するためのVAの治療メカニズムは、FoxOシグナル伝達経路、GnRHシグナル伝達経路、PD-L1発現、およびPD-1チェックポイント経路の集団的な調節を介して複合的に実現され得る。
したがって,VAはSARS-CoVに対して,細胞保護作用,抗ウイルス活性,抗炎症作用,免疫調節作用などの薬理学的機序を示している.抗コロナウイルス効果は、推定されるすべてのマルチターゲットおよびマルチパスウェイを相乗的に調節することにより、複雑な疾患を治療するための栄養剤および生理活性化合物の二重の効果である可能性がある。
VAのアジュバント補充は、潜在的に致命的なCOVID-19を治療するために、現在の臨床抗ウイルス剤および免疫療法の治療効果を高める可能性がある。しかし、現在の知見は臨床的にさらに検証されるべきである。
結論として、本研究から得られたバイオインフォマティクスおよび計算科学的知見は、ネットワークファーマコロジー解析によって明らかになった、さまざまな生物学的プロセスおよび細胞シグナル伝達経路を介した抗ウイルス効果、抗炎症効果、および免疫調節効果におけるビタミンAの役割を浮き彫りにした。
さらに重要なことは、同定された生物学的プロセス(薬理学的機能を示す)と治療メカニズムを示唆するシグナル伝達経路から明らかなように、ビタミンAはCOVID-19の治療に臨床的に使用される可能性があるということである(図6)。
図6. 本研究のワークフローをまとめた模式図。

