Contents
- Transmission of SARS-CoV-2 Lineage B.1.1.7 in England: Insights from linking epidemiological and genetic data
Transmission of SARS-CoV-2 Lineage B.1.1.7 in England: Insights from linking epidemiological and genetic data
12月31日
Erik Volz1*+, Swapnil Mishra1*, Meera Chand4*, Jeffrey C. Barrett5*, Robert Johnson1*, Lily Geidelberg1, Wes R Hinsley1, Daniel J Laydon1, Gavin Dabrera4, Áine O’Toole3, Roberto Amato5, Manon Ragonnet-Cronin1, Ian Harrison4, Ben Jackson3, Cristina V. Ariani5, Olivia Boyd1, Nicholas J Loman4,6, John T McCrone3, Sónia Gonçalves5, David Jorgensen1, Richard Myers4, Verity Hill3, David K. Jackson5, Katy Gaythorpe1, Natalie Groves4, John Sillitoe5, Dominic P. Kwiatkowski5, The The CO. Kwiatkowski5, COVID-19 Genomics UK (COG-UK)コンソーシアム7, Seth Flaxman2, Oliver Ratmann2, Samir Bhatt1, Susan Hopkins4, Axel Gandy2*, Andrew Rambaut3*, Neil M Ferguson1*+.
1 MRC Centre for Global Infectious Disease Analysis, Jameel Institute for Disease and Emergency Analytics, Imperial College London, St Mary’s Campus, Norfolk Place, London, W2 1PG, UK
2 インペリアル・カレッジ・ロンドン、サウス・ケンジントン・キャンパス、ロンドンSW7 2AZ、イギリス
3 エディンバラ大学進化生物学研究所(Institute of Evolutionary Biology, University of Edinburgh, Ashworth Laboratories, Charlotte Auerbach Road, Edinburgh, EH9 3FL, UK
4 Public Health England, Wellington House, Waterloo Road, London SE1 8UG
5 ウェルカム・サンガー研究所、ウェルカム・ゲノム・キャンパス、ヒンクストン、ケンブリッジ、CB10 1SA、英国
6 バーミンガム大学微生物・感染症研究所(Institute of Microbiology and Infection, University of Birmingham, Edgbaston, Birmingham, B15 2TT, UK
– www.cogconsortium.uk ※平等に貢献する。
+ 対応。neil.ferguson@imperial.ac.uk
要旨
SARS-CoV-2系統B.1.1.7は、現在Public Health EnglandによってVariant of Concern (懸念の変種)202012/01(VOC)に指定されており 2020年夏の終わりから秋の初めにかけて英国で発生した。我々は、このVOCが伝播に有利であることを示す疫学的証拠をいくつかの観点から検討した。
まず、コミュニティベースの診断検査から収集された全ゲノム配列データから、異なる遺伝子変異の有病率が時間の経過とともに変化していることがわかる。さらに、系統力学的モデリングにより、この系統の遺伝的多様性が指数関数的な成長と一致する形で変化していることが示された。
第二に、遺伝子データから推定されるVOCの頻度の変化は、コミュニティベースの診断用PCR検査におけるS遺伝子ターゲット障害(SGTF)から推定される変化と密接に対応していることを発見した。
第三に、イングランド全土の地域レベルでSGTFと非SGTFの症例数の増加傾向を調べたところ、VOCは、たとえVOCの潜伏期間や発生時期が異なっていたとしても、非VOC系統よりも高い透過性を示している。
入手可能なSGTFのデータでは、報告された症例の年齢構成にシフトが見られ、20歳未満のVOC症例の割合が非VOC症例よりも大きいことが示された。
第四に、VOCの頻度とSARS-CoV-2の全体的な再生産数の独立した推定値との関連を評価する。最後に、局所的なVOCおよび非VOC症例の発生率に直接半機械論的モデルを適用し、それぞれの経時的な再生産数を推定した。
その結果、VOCと非VOCの再生産数の差は0.4~0.7、再生産数の比率は1.4~1.8の範囲であり、懸念の変種(VOC)がかなりの伝達優位性を持っていることがすべての解析で一致した。これらの推定値は、イングランドで社会的距離が高水準にあった時代に適用されたものであり、他の伝播の文脈への外挿には注意が必要であることに注意が必要だ。
序論
当初はバリアントB.1.1.1.7と呼ばれていた新規のSARS-CoV-2系統が、イングランドで急速に地理的範囲と頻度を拡大している。この系統は2020年11月に検出され 2020年9月にイングランドの南東部地域で発生した可能性が高い。2020年12月20日現在、この亜種の確認症例数が最も多いイングランドの地域は、ロンドン、南東部、イングランド東部である。この変異体は免疫学的に重要な同義ではない置換を多数持っている1。スパイク蛋白質のN501Y置換は動物モデルでACE2結合2,3と細胞感染性を増加させることが示されている4,スパイク蛋白質のP618H置換はフーリン切断部位に隣接している5。バリアントはまた、スパイクタンパク質6を標的としたサーモフィッシャーTaqPathプローブの診断テストの失敗に関連付けられているスパイクタンパク質(Δ69-70)の69と70の位置に欠失を持っている。英国では、Δ69-70を持つ他の変異体も流通しているが、そうでなければ陽性のPCR検査でS遺伝子標的が検出されないことは、B.1.1.1.7系統に対する非常に特異的なマーカーであると考えられるようになってきている。全国のコミュニティ検査(「第2の柱」)からのサーベイランスデータは 2020年11月と12月にSARS-CoV-2のPCR検査におけるS遺伝子標的不検出(SGTF)の急増を示し、B.1.1.7系統は現在、Public Health England(PHE)によりVariant of Concern(VOC)202012/01/01に指定されている。
英国のCOVID-19ゲノミクスコンソーシアム(COG-UK)7によって行われた系統分類研究は、VOCには珍しい置換が蓄積されており、他の循環系統と比較して大きな割合で増殖していることを初めて示した。ここでは 2020年10月から 12月5日の間に収集されたVOC全ゲノムを解析し、VOCの頻度の増加率が、英国の他の循環系統に対する伝達優位性と一致していることを発見した。これらの知見を裏付けるために、VOC感染のバイオマーカーとして、~27万5000件の検査結果について、英国全体でSGTFを示すPCR検査の割合の時間的傾向を調査し、局所的なパンデミックの増加とVOCの頻度との関係を検討する。その結果、再生産数(R値)の増加が、VOC感染のバイオマーカーである報告症例のSGTF頻度の増加と関連していることを示し、以下のことを確認した。
この関連性を様々な分析的アプローチを用いて検証した。批判的に言えば、英国での2020年11月のロックダウン期間中、非医薬品介入(NPI)は非VOC系統を再生産数1以下に抑制するのに十分であったが、同時にNPIはVOCを抑制するのに不十分であったという証拠を発見した。
VOCの起源と拡大 202012/01
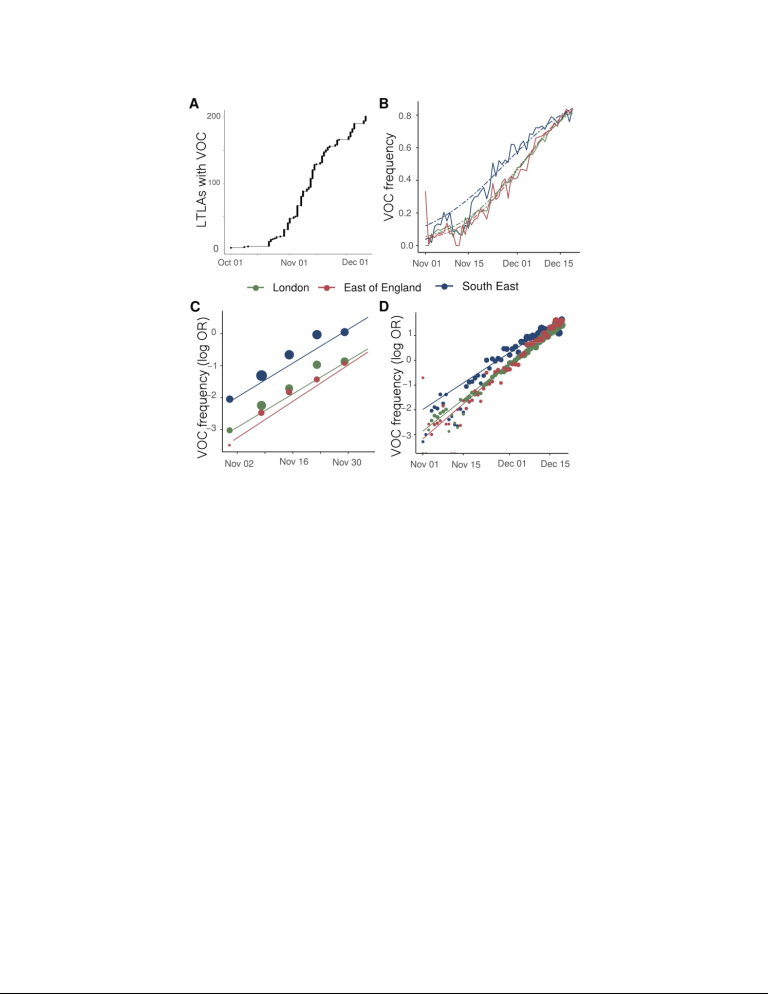
2020年10月から 12月5日の間に収集した1,904本のVOC全ゲノムと、同期間に収集した48,128本のゲノムの遺伝的背景を合わせて、サンプリングの時間と場所を調べた。VOCの配列は、イングランドの199の下層地方自治体(LTLA)に広く分布していたが、南東部(n=875)ロンドン(n=636)イングランド東部(n=293)に高濃度であった。この遺伝的背景と比較すると、VOC系統の増殖は、イングランドで循環しているSARS-CoV-2変異体よりも選択的に有利であることと一致している(図1A)。この変異体の急速な増殖は最初に南東部で観察されたが、その後、ロンドン、イングランド東部、そして現在ではイングランド全域で同様の増殖パターンが観察されている。これらの地域にまたがって、我々は、ロジスティック成長モデルをVOC配列のサンプル頻度に時間をかけてフィットさせ、SARS-CoV-2のおおよその平均発生時間6.5日で調整することによって、VOC系統と非VOC系統の間の同様の成長の差を推定した(支持表S1)1世代あたり49%から53%(支持法を参照)8,9。
VOCのバイオマーカーとしてのSARS-CoV-2検査におけるS遺伝子標的障害
英国では、少数の大規模な検査室を拠点としたコミュニティ症例のハイスループットな全国検査システムがある。そうでなければ陽性の PCR 検査(英国の国家検査システムで実施されている ThermoFisher TaqPath)では、VOC の系統は S 遺伝子ターゲットから検出されないため、我々のゲノム解析を疫学的な症例データにまで拡張することができた。いくつかのSARS-CoV-2変異体がSGTFを引き起こす可能性があるが、11月中旬以降、SGTFを示すピラー2 PCR検査の97%以上がVOC系統によるものである10。2020年11月中旬以前は、PCR陽性者の中のSGTFの頻度は、VOCの頻度のより良いプロキシであった。そこで我々は、ガウスマルコフランダムフィールドモデル(補足情報、図S1参照)を開発し、地域別および週別のVOC系統に起因するSGTF症例の割合(ここでは真陽性率(TPR)と呼ぶ)およびVOCに起因するSGTF症例数を予測した。そして、対応する偽陽性は、S遺伝子陽性症例(S+)のカテゴリーに帰属することになる。
図1 VOC 202012/01lineageの拡大と成長
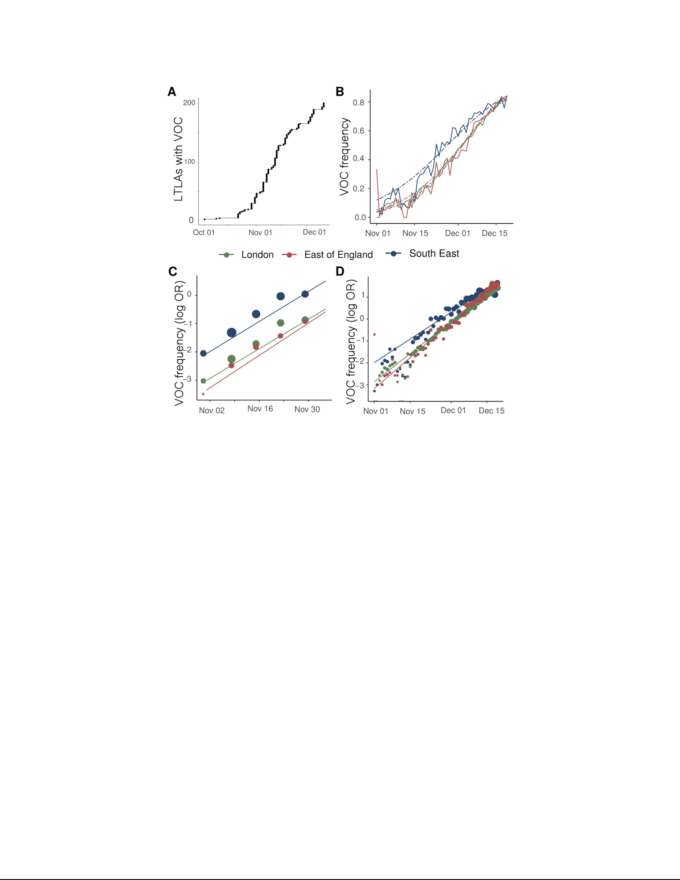
A) 少なくとも1つのサンプリングされたVOCゲノムを報告している英国のLTLAの数。B) イングランドの3つの地域におけるTPR調整済みSGTFの経験的な(実線)と推定される(ダッシュ)頻度。C) ゲノムデータから推定されたVOCの経験的(ポイント)および推定された(線)頻度(対数オッズ)。D)Bと同様のデータから推定したSGTFの経験則(点)と推定(線)頻度(対数オッズ)。
VOCに起因するS遺伝子標的不全を有するSARS-CoV-2症例の傾向
SGTFデータは 2020年11月26日から 12月13日までの間に行われた第2柱の陽性検査結果の35%について利用可能であった。SGTFデータがより豊富であることを考えると、TPR調整後のVOC頻度の経時的な詳細な画像を見分けることができる。全体的に、TPR調整されたSGTF症例の経験的頻度と推定頻度は、時間、地域、成長率の点で、遺伝的データから推定された頻度と同様の拡大パターンを示している(図1D)。12月13日現在、SGTFはイングランドのすべての地域で検出されており(図S2)TPR調整済みSGTFの推定頻度は、ヨークシャーとハンバーの15%から、VOCが最初に検出された南東部の85%までの範囲である。COVID-19感染症の変化は、地域ベースで生(TPR調整なし)のSGTF症例と相関している。図2とS3は、NHS(英国保健医療局) England Sustainability and Transformation Plan(STP)地域(NHS(英国保健医療局)地域の地理的細分化)別のSGTF(S-)症例、S遺伝子陽性症例(S+)総PCR陽性症例の時間推移を示している。視覚的には、ほぼすべてのSTPでロックダウンがS+症例の抑制に成功した一方で、S-症例数はロックダウン中に増加したことがわかる。
図2 NHS(英国保健医療局)のSTP地域の一部における症例の傾向
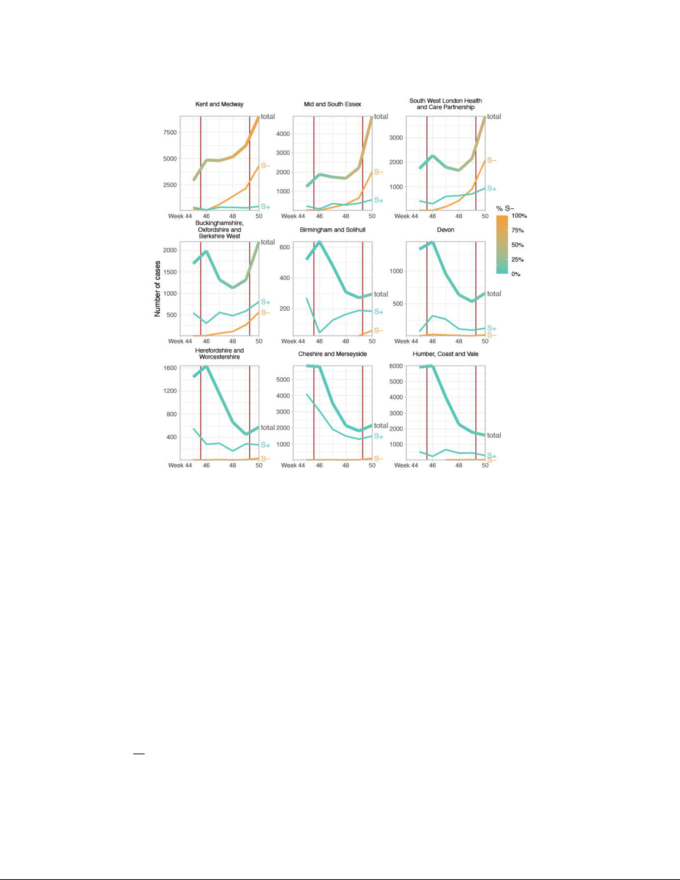
報告された総症例数は太線で示されている。これらのうち、3つの最大の「ライトハウス」検査室で検査された症例のサブセットは、SGTFの検査を受けている。総症例数の線は、検査された症例のうちS-の割合に応じて色分けされている。PHE SGSS システムを介して報告された S+ と S-の数は、細い線で示されている。第2回目のロックダウンの日付は、赤の縦線で示されている。イングランドの全地域からの代表的な NHS(英国保健医療局) STP の 9 つの地域は、データの直近の週の S-の割合が低い順に並べられている。生のSGTFデータがここに示されている(TPRで調整されていない)ため、それ以前の週のS-ケースには、特にイングランドの東および南東部以外の他の非VOC系統が含まれている。すべてのSTPエリアのプロットを図S3に示す。
VOCの透過率の優位性
S-とS+の成長率の違いを調べるために、疫学的な46-50週(11月8日~12月12日)に焦点を当てた。各STPおよび週に報告された総症例数に比例してカウントを上方修正することにより、各STPおよび週におけるS-およびS+の総症例数を推定する。次に、第t+1週目の症例数を第t週目の症例数で割ることで、S-とS+の両方の症例の週ごとの成長率を計算する。SARS-CoV-2の仮定された平均発生時間が6.5日9であることを考えると、これらの週次成長因子を67.5のべき乗に引き上げることで補正し、近似的な再生産数として解釈できることを確認する。各STPおよび週について、S陰性例の経験的再生産数とS陽性例の経験的再生産数の比および差を計算した(図3)。全体として、中央値 乗算的優位性はVOCで1.74,加算的優位性の中央値は0.63であり、両指標ともにVOCの優位性が明確に示されている。
図3 VOCと非VOC系統の週次成長因子
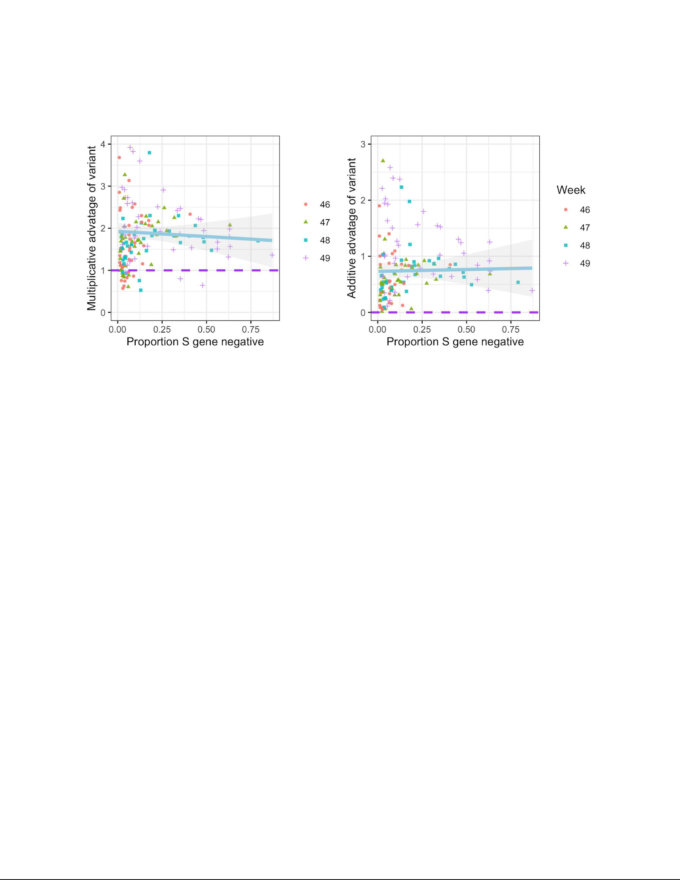
(t+1週目の症例をt週目の症例で割ったもの)の優位性についての経験的データ分析。各ポイントは、図S1に示した生のSGTFデータを用いて、NHS(英国保健医療局)イングランドのSTPエリアと週におけるVOC対非VOCの週次成長因子の比率(左)または差(右)を表している(TPRは補正していない)。色と形は、エピ週を区別している。上のプロットでは 1 以上、下のプロットでは 0 以上の数字は、伝播の優位性を示している。青色の線は、すべてのケースの中の特定の割合のVOCの平均的な優位性を示し、灰色の線は95%の包絡線を示している。低周波での散布は、主にカウント数が少ないことによる統計的なノイズを反映している。
染色体の成長率の傾向をVOCと非VOCの系統の対にしてみると、再生産数が増加していることがわかる。
次に、他の循環系と比較してVOCの増殖率が高いのは、透過性(R)の増加ではなく、生成時間が短い(例えば、培養期間が短い)ことだけが原因ではないかという仮説を検証した。この目的のために、VOCと非VOCの両方の症例が増加または減少したNHS(英国保健医療局) STP地域の数を比較した(表1)。VOCがnon-VOCと同じ再生産数を持ち、発生時間が短い場合、non-VOCが増加した地域ではnon-VOCよりもVOCの方が早く増加することが予想される。しかし、非VOCが減少した地域では、非VOCよりもVOCの方が早く減少することが予想される。また、VOCが増加しても非VOCが減少した地域は、平均的には、その逆の地域と同等のバランスをとることができると考えられる。つまり、VOCの発生間隔だけが短くなった場合、VOCがプラス成長し、非VOCがマイナス成長している地域の割合は、VOCがマイナス成長し、非VOCがプラス成長している地域の割合と高い相関関係があることがわかった。しかし、168 週の STP(42 STP 領域、46~49 週の週次成長因子)のうち、S+で成長が見られ、S+で減少が見られた週は 97 週であったが、逆の週は 1 週のみであり(表1)S+とS-の再生産数が等しくないことを示す強い証拠となった。
(McNemarのカイ二乗検定と連続性補正検定の統計量92.02,p< 1e-15)。S+とS-の成長因子の経験的分布をノンパラメトリックKolmogorov-Smirnov検定で比較すると、2つが同じ確率分布から生じるという帰無仮説を棄却する結果になる(p< 1e-15)。
表1 NHS(英国保健医療局) STP 42地域内の生のSGTFデータから得られたVOCと非VOCの週次成長因子の分割表
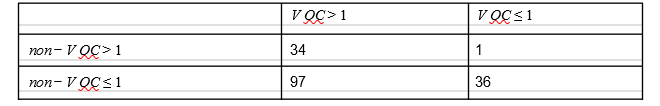
46-49週、発生率の増加(>1)と減少(≤1)で層別化した。対角線外の要素の不均衡は、たとえVOCの発生時間分布が変化していたとしても、透過性が増加していることを示す強い証拠となっている。
VOCと非VOC症例における年齢層の割合
VOC症例と非VOC症例の年齢分布の違いを評価するために、NHS(英国保健医療局) STPの各地域における46~51週目のSおよびS+症例数を検討した。症例数は、各地域の人口年齢構成の違いを考慮して標準化し、各NHS(英国保健医療局) STP地域および各疫学的週のS-症例と、同じSTPおよび週の同数のS+症例(症例対照デザイン)とを比較するように重み付けし、STP週にわたって集計した。二項サンプリング変動、地域別および週別の変動を考慮すると,0~19歳の個人では、VOC症例のバイオマーカーであるS-症例がS+症例と比較して有意に多く、60~79歳の個人ではS-症例が有意に少ないことが観察された(図4)。この傾向は、これまでに最もVOCの影響を受けたイングランドの各地域(イングランド東部、ロンドン、南東部、ミッドランド)で見られ、S+とS-の生の年齢分布(ケースコントロールではなく、加重平均化されておらず、年齢標準化されていない)でも同様の違いが見られる。
図4 SGSSデータセットからのS遺伝子陰性(S-)およびS遺伝子陽性(S+)PCR陽性ピラー2症例の年齢分布(TPRの調整なし)
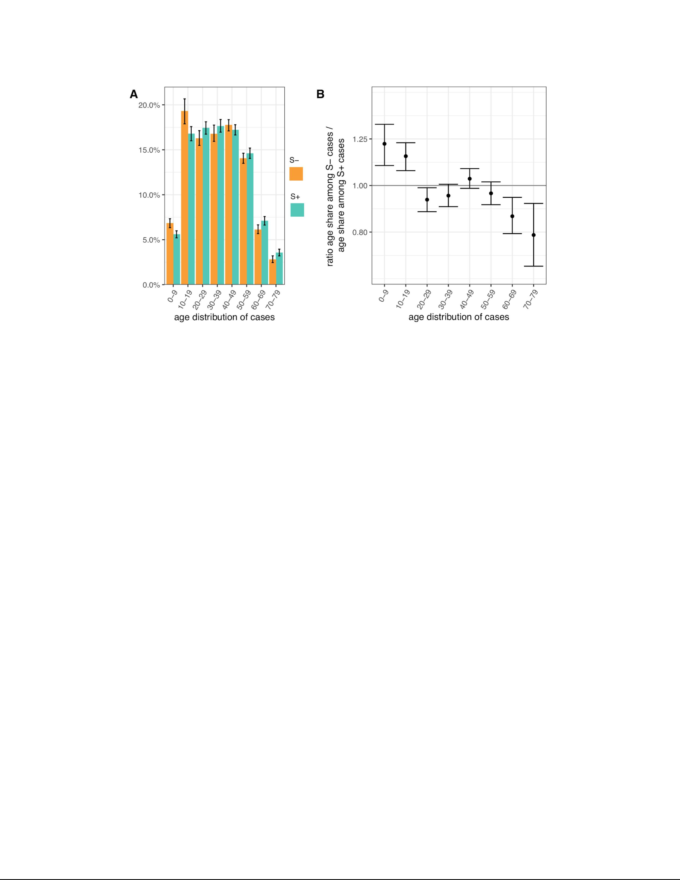
症例数は、各NHS(英国保健医療局) STP地域および疫学的週のS症例を、そのSTPおよび週のS+症例数と同数のS+症例と比較するために重み付けし(症例対照デザイン)各STP地域の年齢構成の違いを考慮して標準化している。(A) S-症例とS+症例の年齢分布。(B) 各10年帯における症例のS-とS+の割合。結果は46-51週目のものである。年齢は80歳を上限とした。95%経験的信頼区間は、STPの地域および週にわたるブートストラップ、およびSTPの地域および週内でのサンプリング変動によって計算された。
VOC透過性の回帰分析
全体的に時間的に変化する再生産数Rに対するVOCの頻度の影響を調べるために、我々はいくつかの回帰分析を行った。分析は、2つの異なる空間スケール、すなわち、下位層の地方自治体(LTLA)とNHS(英国保健医療局) STP地域で行った。それぞれについて、第2柱の検査、死亡、入院に関するデータを用いて、週別、地域別にRtの推定で説明したモデル9,11 を用いている。図5は、ゲノムデータを用いたRaSTPレベルの週次推定値とVOC推定頻度の経験的な関係を示したものである。
図5:全ゲノム間のVOC系統のゲノム頻度の関係を、各週の時間変化する再生産数に対してプロットしたもの
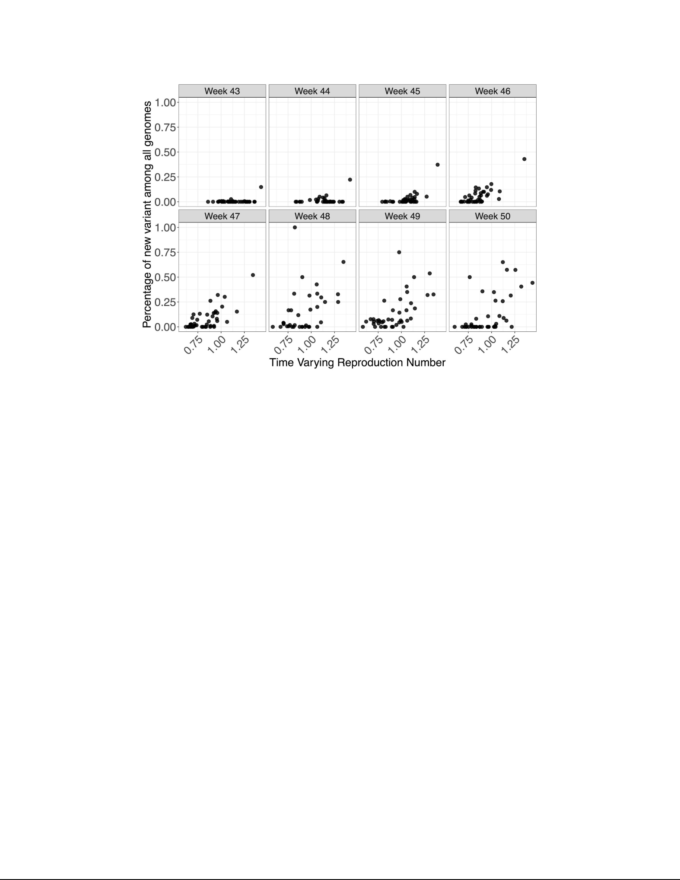
各データポイントはSTP領域
我々は、応答の非正規性を考慮するためにブートストラップ手順を持つ一連のフリークエンシーティストモデルを適用し、また、VOCの頻度を明示的にモデル化するベイズ回帰を適用し、それが同時に頻度の二項分布オブザベーションのためのパラメータとRestimatesを通知するような。Rtwの分散を説明する上での地理の役割は、固定効果とランダム効果の両方を用いて検討された。これらのモデルは、ゲノムベースの頻度推定値と、S遺伝子データが利用可能な第2柱の症例のTPR調整済みSGTF割合の両方に適用された。この定義とSARS-CoV-2の発生時期が約1週間であることを考えると、Rtoは1週間前のVOC頻度とより強い関連があると予想される。そこで、我々のデフォルト分析(ここではtspは44-50週)ではt-1週目のRagainst頻度の回帰を、また、tis週目のRagainst頻度の回帰を提示する。
補足情報で提供されている。
回帰結果を表2に報告する(感度分析は表S2)。我々は、Rに対する相加効果、すなわち、バリアントによるRの増減(線形モデルのRas応答を用いて)を推定した。例えば、相加効果の大きさが 0.4 の場合、VOC が存在しない場合の Rt が 0.8 の領域は、VOC が存在するだけで Rof 1.2 となる。予想通り、週と地域の固定効果を許容するモデルは、ランダム効果モデルよりもVOCの効果サイズが小さくなる。ベイズモデルの結果は、フリークエント主義のランダム効果モデルの結果とよく似ている。
表2の結果は、VOCとRの間に明確な関連性を示している。しかし、この分析では因果関係を証明することはできない。推定された相加効果は、調査した期間中にイギリスで普及していた条件に特有のものである。
表2 異なる回帰モデル、空間分解能、およびVOCの有病率を推定するために使用したデータについて、他のバリアントと比較したVOCの再生産数の推定相加変化
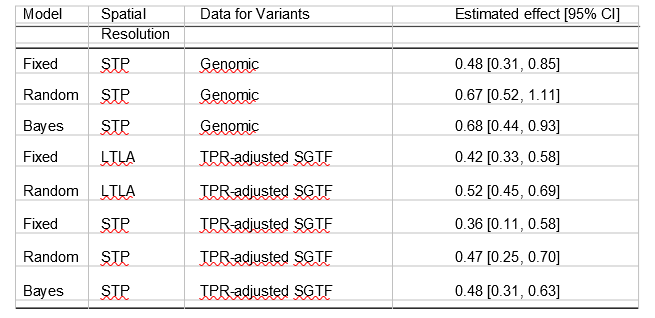
分析は、SARS-CoV-2の発生時間を考慮するために、44~50週目からの再推定値と、1週間前のVOCの割合に関するデータを使用している。
VOCと非VOCの再生産数を独立して推定する。
2020年12月6日までに採取された第2期全国SARS-CoV-2検査の全ゲノム配列の系統力学的解析により、VOCの再生産数を推定した。まず、イギリスから選択した776のゲノムに対して、週ごとに各地域で配列決定された診断症例数に反比例して、ノンパラメトリックskygrowththmodel 12を最尤でフィットさせた(Supporting Methods参照)。このモデルは、VOC 202012/01の有効個体数が、9月20日から 12月6日までの間、1週間あたり58%の比較的安定した成長率で成長し、再生産数1.59に対応したことを示している。成長率の推定値は、分子時計の進化速度の不確実性の影響を受けなかった。第二に、ケント州(n=701)グレーターロンドン(n=606)エセックス(n=131)ノーフォーク(n=81)の50以上の配列を持つ4つの地域のゲノムにモデルを適合させた。この地域分析により、1週間あたりの成長率は58%から92%であり、1.56から 1.95の間の再生産数に対応することが示された(図S6)。最後に、同じ776ゲノムセットを用いて、Skygridモデル13を用いたベイズノンパラメトリック合体解析を行った。この分析では、11月の初めまで成長し、その後、第2回目の英国のロックダウンと重なった11月の間はプラトーを示した(図S7)。このことは、ロックダウンがVOCの成長を抑制したことを示唆しているが、発生率の低下を引き起こすには不十分であった。パラメータ値を推定するために、パラメトリック・ロジスティック成長法を用いてVOC系統の初期成長率を推定した。
縮合モデル14。このモデルでは、1年あたり71.5の成長率を推定し、倍化時間3.7日(95% CrI: 2.4 – 4.9)と再生産数2.27(1.84 – 2.73)に対応している。比較のために、この全期間にわたる単純な指数関数的成長モデルは、9.1日(7.4, 11.2)の倍化時間と1.50(1.40 – 1.60)の再生産数で27.9の成長率が得られた。
並行疫学解析では、PHEの第2柱の症例数全体に適用したTPR補正済みSGTF頻度を用いて、STP地域別にVOCと非VOCの第2柱の症例数を推定した。次に、以前に全体的な(非系統的に層化された)再推定値11を作成するために使用したのと同じモデルを用いて、VOCと非VOCについて別々にRby weekを推定した。まず、非層化モデルを適合させて、感染確認率(陽性例として同定された感染数)と感染播種(各地域における初期感染数)を推定する。播種については、非層化モデルの推定感染数を用いた。42週目と43週目の1日平均感染数は、VOCモデルと非VOCモデルの両方の播種に使用している。SGTF症例の割合は、42週目と43週目のVOCと非VOCの間の播種のための感染を分散させるために使用される。次に、Rtestimatesに影響を与える播種仮定を避けるために、45週目から50週目のRestimatesを計算する。図6Aは、48週目と50週目のVOCと非VOCのRtestimatesの間の事後差の平均値を示し、図6Bは、45週目から50週目のすべてのNHS(英国保健医療局)地域にわたるVOCと非VOCのRtestimatesの中央値をプロットしたものである。VOCの再推定値は、94%のSTP-週のペアで非VOCの再推定値よりも大きかった(図6Bの対角線上の点)。図S4は、全ての週45〜50におけるVOCと非VOCのためのRtestimateとの間の平均事後差を示し、図S5は、Rtestimateの比率を示している。45-50週の平均Rt差は0.51 [95% CrI:-0.09 -1.10]であり、これはVOCとnon-VOCのためのRestimatedの42×6 (STP x week) posteriorsのセットから計算されたものである。すべてのSTPを集計すると、2回目の英語ロックダウン時の平均RdはVOCで1.45 [0.91~1.89]、非VOCで0.92 [0.86~1.06]であった。
図6
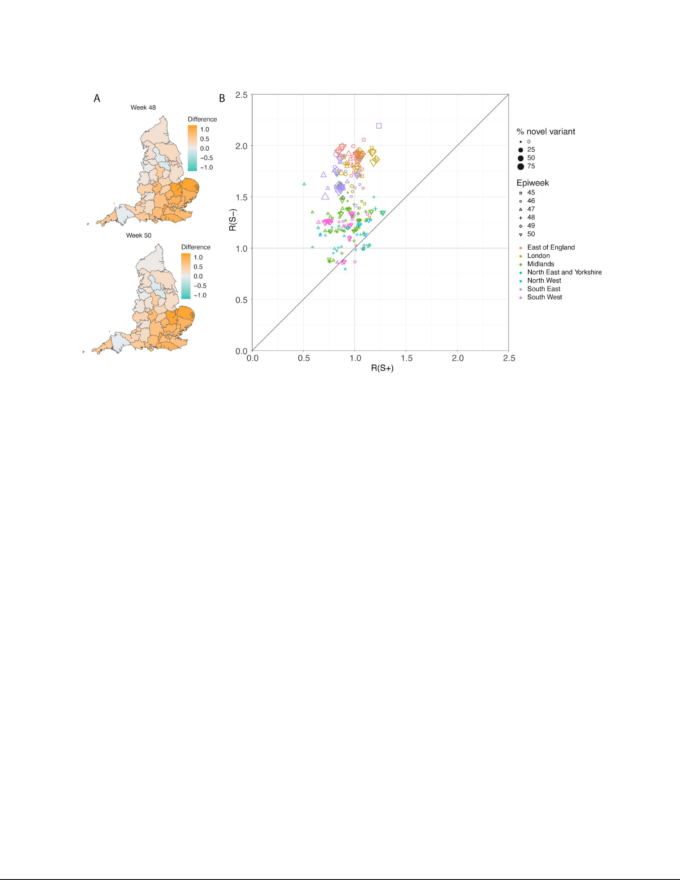
(A)48週目および50週目のすべてのSTPにおけるVOCおよび非VOC亜種のRestimatesの中央値の差のマップ。B)STPおよび週別のVOC(S-)および非VOC(S+)の再生産数の散布図。ポイントサイズはVOCの頻度を示し、形状と色はそれぞれ週とNHS(英国保健医療局)の地域を示している。
考察
B.1.1.1.7系統に関連する置換がウイルス表現型の有意な変化と関連しているという証拠が蓄積されている2-4,15が、これらの変化がヒト間の感染における意味のある違いにつながる程度を評価することは困難であり、実験的に評価することはできない。無作為化実験研究が不可能な場合、複数の場所で複数の時間に一貫したパターンが見られれば、観察研究はより強力な証拠を提供する。ウイルス集団内の新しい系統の頻度が急速に増加することは選択的優位性と一致しているが、特に海外から繰り返し導入される遺伝的変異体については、頻度の増加が創始者効果や遺伝的ドリフトによって引き起こされる可能性もある16,17。しかし、高い有病率を達成した以前の遺伝子変異とは対照的に、英国内からのVOCの拡大が見られ、VOCの拡大に伴ってパンデミックが速くなるパターンが複数の地域で繰り返されている。本論文では、さまざまな統計的手法を用いて時空間的に層化分析を行い、英国のさまざまな地域における2020年11月から 12月の間のSARS-CoV-2感染強度とVOC(B.1.1.1.7)の頻度との関係を評価することに焦点を当てた。
VOC(B.1.1.1.7)の感染特性の評価は、その頻度と、VOC系統に存在するΔ69-70欠失に関連するCOVID-19のコミュニティ症例のルーチンPCR検査におけるS遺伝子標的不全(SGTF)の発生との間に高い相関関係があることによって助けられた(図1およびS1)。2020年11月および12月のPCR陽性コミュニティCOVID-19症例の3分の1以上でS遺伝子陽性の結果が得られたため、SGTF頻度をVOC頻度の代理として使用することができ、その期間における地域別のVOCおよび非VOCの発生傾向を推定することができた。ほぼすべての地域において、SGTF頻度とパンデミックの増加との間に非常に明確な視覚的な関連が見られた(図2およびS3)。これは、VOCおよび非VOCの症例数の週ごとの増加要因を地域ごとに評価した実証的な評価(図3)や、SGTFデータから推定された地域のランドVOC頻度の推定値の間の関連についての正式な回帰分析によって補強されている(表2)。
最後に、SGTFデータを用いて、VOC亜種と非VOC亜種のRby地域と週を独立して推定し(図6およびS4)VOCに関連したRtの増加についても同様の推定値を導き出した。後者の解析は、VOCと非VOC株のRtの関係についてパラメトリックな仮定がなされていないため、おそらく最も強力な解析であると思われる。
フィロダイナミック・モデリングは、SGTFのデータがまばらな時期の10月のVOCの生育に関する追加情報を提供している。すべての解析では明らかではないが、このことは、10月にVOCが急速に拡大したことを示唆しており、11月の国家ロックダウン中には成長が鈍化した(反転しなかった)ことを示唆している(図S6およびS7)。
また、VOCが増加した地域と非VOCが減少した地域との間に大きな統計的に有意なアンバランスが見られたことから、VOCの発生増加率の増加は、再生産数そのものではなく、潜伏期間や発生時間分布の変化のみによるものであるという仮説を除外することができた(表1)。例えば、潜伏期間の変化だけでは、発生数の増加方向は変わらないと考えられる。
我々は、非VOC系統に対するVOCの透過率の優位性を2つの方法で定量化した。この2つのアプローチを適合度で区別することはできなかったが、どちらのアプローチも機械論的にはもっともらしいものである。すべての環境と個人において透過性が増加した場合には、乗算的な透過性の優位性が予想され、一方、相加的な優位性は、特定のサブ集団または文脈における透過性の増加を反映している可能性がある。より一般的には、時間的背景が重要である。これらの伝播の優位性の推定値は、イングランドで社会的距離が高水準にあった時代に適用されたものであり、伝播の要因についての詳細な知識がないまま、他の伝播の状況に外挿することには注意が必要だ。
我々は、週や地域別の変動をコントロールした後でも、20代以下は非VOCバリアントよりもVOCの影響を受けやすいという、小さいながらも統計的に有意なシフトを観察した(図4)。しかし、これまでの結果と同様に、この観察はそのメカニズムを解明するものではない。
これらの違いの根底にあると考えられる要因があるかもしれない。VOCと非VOCのコミュニティ症例の年齢分布の違いは、VOCの全体的な透過性の増加(特に、ロックダウンが行われていたが学校が開校していた時期)20代以下の感受性の増加、またはその年齢層のVOCに対する明白な症状(したがって検査を求める傾向)の増加に起因していると考えられる。
我々の分析にはいくつかの限界がある。分析したゲノムおよび疫学的データは、定期的なサーベイランスの一環として収集されたものであり、英国におけるSARS-CoV-2感染症の完全な代表的なサンプルではないかもしれない。また、我々は、例えば、VOCと非VOCの系統の長期的な感染ダイナミクスをより機械論的にモデル化しようとしたのではなく、比較的単純なモデルを用いた、比較的単純なデータ駆動型の解析に焦点を当てた。また、感染症データに内在する時空間的な相関関係を明示的にモデル化することも試みていない。これは今後の研究の重要な優先課題であるが、人口移動パターンに関するデータを明示的に組み込むことが必要である。
私たちの分析の初期のバージョンは、このVOCに対する英国政府の政策対応や他の国の政策対応に影響を与えた。私たちが推定したVOCの伝播の優位性は、今後数ヶ月の間に英国やその他の地域でCOVID-19を継続的に管理するための大きな課題となっている。社会的な距離を置くための対策は、そうでない場合よりも厳格なものにする必要があるであろう。特に懸念されるのは、2021年1月に学校が再開することを可能にしながら、伝播の制御を維持できるかどうかということである。これらの政策上の疑問は、現在進行中のこの感染症の緊急疫学調査、特に重症度の変化についての証拠の調査、さらには例えば家庭環境での感染性の変化についてのより微妙な理解に基づいた調査から得られることになるであろう。
資金調達
COG-UKは、英国リサーチ&イノベーション(UKRI)国立衛生研究所(NIH(アメリカ国立衛生研究所)R)およびウェル・カム・サンガー研究所として運営されているジェノム・リサーチ・リミテッド(Genome Research Limited)の医療研究評議会(MRC)の一部からの資金援助を受けている。インペリアルカレッジCOVID-19研究基金、UKRI(MR/V038109/1)医学科学アカデミー(SBF004/1080)ビル
– メリンダ・ゲイツ財団(OPP1197730,OPP1175094)欧州委員会(CoroNAb 101003653)NIH(アメリカ国立衛生研究所)R BRC Imperial College NHS(英国保健医療局) Trust Infection and COVID themes(RDA02)Amazon AWS and Microsoft AI for Health、EPSRC、The Medical Research Council(MR/R015600/1)NIH(アメリカ国立衛生研究所)R Health Protection Research Unit for Modelling and Health Economics、NIH(アメリカ国立衛生研究所)R VEEPED project funding(PR-OD-1017-20002)。ウェルカム・サンガー研究所へのウェルカム・コア・ファンディング(206194)。JTM、NL、ARはWellcome Trust(Collaborators Award 206298/Z/17/Z – ARTICネットワーク)の支援を認めている。AR は欧州研究評議会(助成金協定番号 725422 – ReservoirDOCS)の支援を受けている。