Contents
The Circadian Clock and Viral Infections
pubmed.ncbi.nlm.nih.gov/33161818/
要旨
概日時計は哺乳類の生理学のいくつかの側面を制御し、生物学的プロセスと行動の毎日の振動を調整している。私たちの概日リズムは、脳内の内因性の中枢時計によって駆動され、末梢組織の時計と同期し、それによって私たちの免疫系と感染症の重症度を調節している。
これらのリズムは、治療薬やワクチンの薬物動態や有効性に影響を与える。中心となるサーカディアン制御回路と時計制御された宿主経路は、新規の抗ウイルス療法を特定するための肥沃な基盤を提供している。サーカディアンシステムがウイルス感染およびウイルスに対する宿主の反応を調節する上で果たす役割を理解することは、これらの疾患の臨床管理に役立つであろう。
本レビューでは、概日時計とウイルス感染の相互作用に関する実験的・臨床的エビデンスを概観し、ウイルス時計研究の重要性を強調している。
キーワード
概日リズム、ウイルス、COVID-19,ウイルス時計、ウイルス学
はじめに マクロスケールからミクロスケールへのサーカディアンリズム
地球の自転は昼夜のサイクルを導き、細胞レベルでのミクロなプロセスに至るまで、私たちの毎日の概日リズムを動かしている。哺乳類では、主要な外部時間キュー(zeitgeber)は、明暗サイクルであり、網膜視床下部管を介して脳の視床上核(SCN)または「マスタークロック」に信号を伝達する。SCNは、あらゆる組織で概日リズムを調整するために体の他の部分と通信し(Astiz et al 2019)生物が変化する環境を予測して適応することを可能にしている(図1)。
SCNは、脳全体で複数の神経接続を持つ複雑なニューロンネットワークを構成し、自律神経系と内分泌系に信号を伝達する(Astiz et al 2019)。SCNの自律神経系への影響は、ホルモンに対する末梢組織の感受性を変化させる(Buijs et al 2006)。その結果、同じホルモン刺激でも、時間帯に依存して異なる応答を誘発することがある(Becker et al 2019;Garcia-GarciaおよびMendez-Ferrer 2020)。
主ペースメーカーとしてのSCNの重要性は、機能するSCNの移植が、遺伝的に不整脈のあるマウスにおいて概日リズムを再確立することから明らかになる(Ralph et al 1990年;Sujino et al 2003);しかしながら、他の細胞外手がかりは、末梢組織を独立して同期させることができる。
図1. 人体のサーカディアン制御
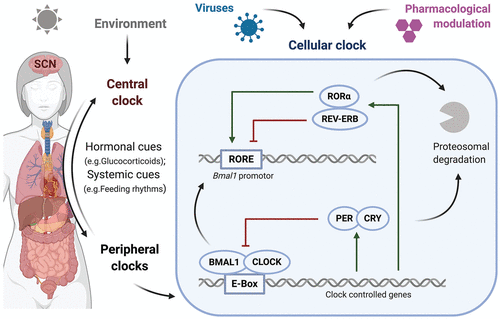
外部からの信号が体内の中心時計である脳のSCNに働きかけ、このSCNが臓器の末梢時計を同期させ、各細胞の時計の分子制御を行っている。転写/翻訳フィードバックループがリズミカルな遺伝子発現を調整し、その構成要素のプロテアソーム分解がシステムを再始動させる。BMAL1:CLOCKはE-Boxに結合し、REV-ERB、RORα、PER:CRYの発現を活性化し、これらはBMAL1:CLOCKを直接阻害するか、Bmal1プロモーター活性に作用する。SCN=視交叉上核、BMAL=脳・筋ARNT様1,CLOCK=概日運動器出力サイクルカプト、ROR=関連オーファン受容体、PER=ピリオド、CRY=クリプトクローム。
個々の細胞内では、概日時計の機械は、活性化因子と抑制因子からなる転写/翻訳フィードバックループ(TTFL)の自律的な産物である(図1)。2つの主要な活性化因子である基本的な螺旋ループ-螺旋転写因子CLOCK(概日運動器出力周期kaput)とBMAL1(脳と筋肉のARNT様1)は、Eボックスと呼ばれるゲノム制御要素と結合するヘテロ二量体を形成し、概日時計遺伝子の発現を調節する。この複合体は、リプレッサーであるPER(ピリオド)とCRY(クリプトクローム)の発現を誘導し、二量体化して負のフィードバックループを形成し、CLOCK:BMAL1が介在する転写を抑制する。第二のインターロックTTFLはBMAL1の発現を制御しており、核内受容体であるREV-ERBαおよびRORαからなり、これらはそれぞれ、Bmal1プロモーター内のレチノイン酸関連オーファン受容体(ROR)応答エレメント(RORE)と結合して、その転写を活性化または阻害する(Guillaumond et al 2005)。REV-ERBαおよびRORαは、それらのプロモーターにEボックスを含み、したがってBMAL1:CLOCKによって制御される。これらの転写因子のユビキチン化依存的な分解は、TTFLをリセットし、これらのコアクロック調節因子のRNAおよびタンパク質産物の24時間振動を確立する(Takahashi, 2017)。
義務寄生虫として、ウイルスは、複製および普及のために宿主に完全に依存している。ウイルスのライフサイクルの最初のステップは、細胞表面で発現する宿主因子または受容体へのウイルスの結合を介した細胞内への侵入である(Helenius, 2018)。ウイルス粒子の侵入およびカプシドの分解の後、RNAまたはDNAゲノムは細胞内に放出され、宿主の転写および翻訳経路を利用して複製を開始する(図2)。簡単に言えば、ウイルス感染は、インフルエンザウイルスに代表されるようなウイルス複製の「ヒットアンドラン」戦略である急性感染から、B型肝炎ウイルス(HBV)のような長期感染を確立する慢性感染まであり、宿主の免疫応答とウイルス回避戦略のバランスを反映している(Virgin er al)。 霊長類における最近の研究では、様々な組織におけるタンパク質をコードする遺伝子の80%以上が毎日リズミカルな発現を示すことが明らかにされ(Mure et al 2018)ウイルス複製の細胞経路への依存性を考えると、宿主時計成分がウイルス複製に直接または間接的に影響を及ぼすことが報告されていることは驚くに値しない。
図2. ウイルスの構造、ライフサイクル、そして病気の結果
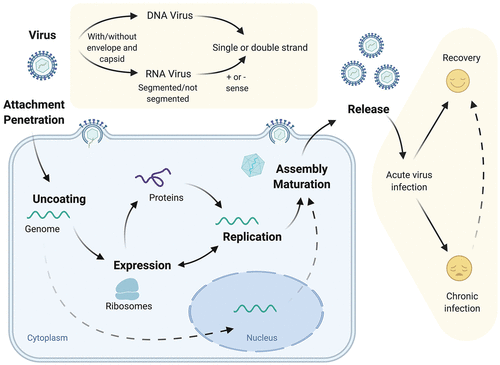
ウイルスは、その遺伝情報をカプセル化されたRNAやDNAとして、脂質のエンベロープに封入されている場合がある。ウイルスが宿主細胞に侵入した後、遺伝情報は放出され、翻訳され、複製される。一部のウイルスでは、その遺伝物質は輸入され、核内で複製される。ウイルスタンパク質の翻訳とゲノムの複製の後、新しいウイルス粒子が組み立てられて放出され、ライフサイクルが完了する。ウイルス感染は宿主の免疫応答によって解消されることもあれば、持続して慢性疾患を引き起こすこともある。
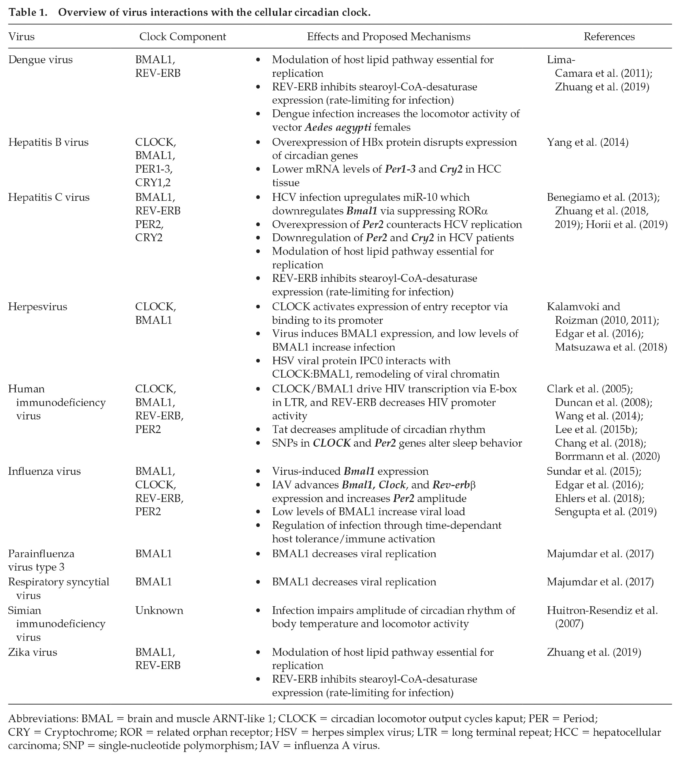
より最近では、乱れた概日時計は、いくつかの病原体関連疾患に対する感受性の増加と関連している(Bellet et al 2013;Kiessling et al 2017;Hopwood et al 2018;T. Li et al 2019;Diallo et al 2020;Kitchen et al 2020)。2019;Diallo et al 2020;Kitchen et al 2020)そして、ウイルス感染と概日時計との間の相互作用は、この分野での研究の拡大に伴い、関心が高まっている(Zhuang et al 2017;Mazzoccoli et al 2020)。本レビューでは、概日時計の観点から見た宿主-ウイルス相互作用の概要、および報告されているウイルスと概日時計の構成要素との相互作用の要約を提供する(表1)。
表1. 細胞性概日時計とのウイルス相互作用の概要
概日的経路がウイルス感染を形作る
ウイルス制御における内分泌系の役割
自律神経系(Becker et al 2019;Garcia-Garcia and Mendez-Ferrer 2020年)体温(Buhr et al 2010年)絶食・摂食サイクル(Wehrens et al 2017;Lewis et al 2020年)サイトカインやホルモン(Astiz et al 2019)など、多くの要因が末梢時計を同期させることができる。自律神経系は概日時計の影響を受けており、一部のウイルスは末梢神経系および中枢神経系に感染する可能性がある(Koyuncu et al 2013)が、現時点では、ウイルス、時計、自律神経系の直接的な相互作用を示す証拠はない。内分泌系は、SCNを末梢時計と同期させるための主要な経路であり、グルココルチコイド発現は、最もよく研究された例の一つである(Oster et al 2006,2017;Pezuk et al 2012)。グルココルチコイド受容体シグナリングは、概日時計との双方向の相互作用を示す(Lamia et al 2011;Caratti et al 2018)。グルココルチコイド(例えば、一般的に処方されるコルチゾール)の治療的投与は、HBVの再活性化の増加(Hatano et al 2019)およびインフルエンザ感染における不良な臨床転帰(Tsai et al 2020)と関連している。グルココルチコイドデキサメタゾンは、最近、コロナウイルス疾患(COVID-19)の重症度を低下させることが示された(Delaney et al 2016;Horby et al 2020)。コルチコステロイドが、ヒト鼻および気管上皮細胞の初代培養物におけるコロナウイルスHCoV-229Eの複製およびサイトカイン産生を抑制するという観察(松山 et al 2020;山谷 et al 2020)は、これらの臨床観察のための潜在的なメカニズムを提供する。松果体から放出されるメラトニンは睡眠行動を調節し、ウイルス誘発性疾患において広範な抗ウイルス活性を有することが報告されている(Anderson and Reiter, 2020でレビュー)。マウスモデル系では、メラトニンは、NLRP3インフラマソームを阻害することができ(Y. Zhang et al 2016; Cao et al 2017; Ma et al 2018)我々および他の人(Shneider et al 2020)をリードして、COVID-19におけるこの炎症性経路の役割を推測している。
宿主免疫のサーカディアン制御。ウイルス感染への影響
環境変化を予測し、感染のリスクを最小化するために、多くの免疫パラメータは一日中振動する(Man et al 2016; Scheiermann et al 2018でレビューされている)。自然免疫系の特定の機能は、細胞時計に依存し、ここで、CLOCK、BMAL1,およびREV-ERBは、ウイルス感染中の核酸感知に関与するパターン認識受容体(PRR)の発現などの必須プロセスを調節する(Silver et al 2012,2018)。潜在性マウスγヘルペスウイルス感染症を有するマウスは、シフトワークを模倣した慢性的な日中の反復的な混乱にさらされている間に、急性炎症性の挑戦を受けた。著者らは、潜伏ウイルスの再活性化、ウイルス負荷の増加および肺のサイトカインおよびケモカイン濃度の変化につながることを指摘した(Trammell and Toth, 2016)。Sengupta et al 2019)は、インフルエンザ感染の時間依存性におけるナチュラルキラーT細胞、ナチュラルキラー細胞、炎症性単球(Ly6chi単球)の重要性を示した。Nguyen et al 2013)は、BMAL1がLy6Chi単球の日周振動を調節していることを示した。他の呼吸器ウイルスは概日依存性である:例えば、Majumdar et al 2017)は、BMAL1欠損が呼吸器同期ウイルス(RSV)およびPIV3(ヒトパラインフルエンザウイルス3型)感染に対する感受性を増加させることを報告した。REV-ERBは、肺炎の文脈で炎症反応およびケモカイン分泌を抑制することができる(Caratti et al 2018)。REV-ERBの遺伝子破壊は、マクロファージにおけるエンドトキシン応答を増加させ、プロ炎症性サイトカインであるインターロイキン6(IL-6)の分泌を増強した(Gibbs et al 2012)。マクロファージの生物学を研究する場合、サイトカイン発現がリズミカルであるのに対し、ファゴサイトーシスは時間帯依存性ではないので、それらの異なる生物学的機能を別々に研究することが関連している(Geiger et al 2019)。このようなパターンは、適応免疫応答、例えば、リンパ球の発生およびトラフィッキングにおいても見られる(Scheiermann et al 2018でレビュー)。リンパ球数は一日の間に振動し、グルココルチコイドはリンパ系器官における日中のT細胞蓄積を誘導する(Shimba er al)。 リンパ球概日時計の損失は、インフルエンザAウイルスとの戦いに重要なリズミカルな適応免疫応答をアブレートする(Druzd et al 2017)。BMAL1は、免疫細胞の表現型および活性に影響を与えるミトコンドリア機能および代謝経路に関連している。免疫代謝のリズム性は、免疫防御および疾患転帰の重要な側面となっている(Early and Curtis, 2016; Carroll et al 2019)。これらの研究は、概日時計がウイルス複製に影響を与える免疫応答をどのように調節しているかを示している。
ウイルス感染に不可欠な宿主経路のサーカディアン制御
肝臓は、トランスクリプトームの20%がリズミカルな発現を示す(R. Zhang et al 2014年)体内で最も概日規制された臓器の1つであり、肝臓に感染するウイルスは時計の影響を受けている可能性が高い。最近の臨床研究では、肝移植後のC型肝炎ウイルス(HCV)再感染のキネティクスは、手術が午前中に行われた場合の方が、午後に行われた場合に比べて、より迅速であることが示された(Zhuang et al 2018)。試験管内試験研究では、概日同期化された肝細胞のHCV感染は、ウイルス受容体のリズミカルな発現と関連していることが示された(Zhuang et al 2019)肝移植後に観察される感染カイネティクスの増加と一致していた。さらに、Bmal1の遺伝子ノックアウト(KO)またはREV-ERBの薬理学的活性化は、HCVおよび関連するフラビウイルスであるデングおよびジカの複製に不可欠な脂質経路を抑制することにより、HCVの複製を阻害した(Zhuuang et al 2019)。
ウイルスタンパク質と関連する宿主因子を同定することは、新たな薬剤標的を明らかにすることができる。SARS-CoV-2タンパク質のインタラクトームの最近のマッピングにより、66個の薬物標的となる宿主因子が同定された(Gordon et al 2020)。これらの宿主遺伝子の30%が概日振動を示すことは注目に値する(RayおよびReddy 2020年)SARS-CoV-2複製の概日制御およびCOVID-19の治療における潜在的な慢性療法のさらなる支持を貸す(Meira et al 2020;RayおよびReddy 2020)。
Chang et al 2018)は、ヒト免疫不全ウイルス1型(HIV-1)感染患者における末梢ウイルスRNAレベルとサンプリング時期との間の関連を報告し、BMAL1発現に関連した未スプライスHIV RNAのレベルの増加を報告した。さらに、CLOCKおよびBMAL1過剰発現は、HIV長末端リピート(LTR)のEボックスモチーフを介してHIV転写を誘導した(Chang et al 2018)。最近の研究では、REV-ERBの薬理学的活性化がBMAL1を減少させ、細胞株および一次CD4 T細胞および誘導多能性幹細胞由来マクロファージにおいてHIV LTR活性およびウイルス複製を阻害することが明らかになった(Borrmann et al 2020)。重要なことに、Eボックス内の変異は、基底LTR活性を減少させ、このモチーフの多機能性を強調し、概日性因子がHIV複製を調節する際に他の宿主転写因子と協力することを示唆している。興味深いことに、HIV-LTRには、ROREやグルココルチコイド応答エレメントなどの保存された他のサーカディアン制御エレメントが発見され、HIVの複製は特定の時間帯に同期しているのではないかという疑問が生じた。
マウスの単純ヘルペスウイルス2(HSV-2)感染は、活動期に比べて安静期に感染した場合に重症化が少なかった(Matsuzawa er al)。 マウスおよびヒトケラチノサイトにおけるHSV-2侵入受容体Nectin1(Pvrl1)はリズミカルな発現を示し、CLOCKによって直接制御されている。CLOCKサイレンシングはPvrl1の発現を減少させ、HSV-2感染の調節におけるCLOCKの役割を示唆した。Bmal1の破壊は、ヌル対立遺伝子Bmal1-/-モデルにおいて、生体内試験および試験管内試験において、ムリドヘルペスウイルス4(MuHV-4)およびHSV-1の複製を増強した(Edgar et al 2016)。MuHV-4のDNAレベルは、活動期の開始時に感染した場合と比較して、休止期の開始時に接種した場合に高かった。生物発光レポーターウイルスを用いた研究は、Bmal1発現が高いときに感染細胞の頻度が増加したことを示した。注目すべきは、MuHV-4 は感染時期に関係なく Bmal1 発現を誘導したことであり、ヘルペスウイルスが細胞のサーカディアンサイクレーションを摂動できることを示唆している。同様の観察が、HSV-1およびインフルエンザA感染において報告された(Edgar et al 2016)。
2つの独立した研究は、インフルエンザウイルス感染のサーカディアン制御を評価した(Ehlers et al 2018;Sengupta et al 2019)。両グループは、Bmal1 KOマウスがより大きな喘息様気道変化を示し、より悪化した急性ウイルス性気管支炎を示し(Ehlers et al 2018)マウスが活動期前に感染した場合、休息期前と比較して生存率が高かったことを報告した(Sengupta et al 2019)。先のEdgar研究とは対照的に、Senguptaらは、異なる時点でマウスを感染させた場合のウイルス負荷の違いを観察しなかった。活動期の開始時の感染は、ウイルス負荷とは無関係に肺の炎症を促進し、インフルエンザ感染のより重篤な転帰は、宿主耐性および免疫活性化経路の時間依存的な調節によって媒介されることを示唆している。これらの研究は、ウイルスのライフサイクルにおけるサーカディアン成分の役割を明らかにするためのモデル系(試験管内試験での分離培養や生体内試験での多細胞相互作用)の重要性を強調している。
ウイルスとサーカディアン・クロックはクロマチンの景観を形作る
エピジェネティックな調節およびクロマチンリモデリングに対する概日時計機械の影響は、CLOCKのヒストン脱アセチラーゼ活性を部分的に反映する(土井 et al 2006;Aguilar-ArnalおよびSassone-Corsi 2015)。サーカディアン転写因子(TF)の時間依存的な結合(Chen et al 2015;Y. Xu et al 2016)は、クロマチン状態およびRNAポリIIリクルートに影響を与える(小池 et al 2012;Le Martelot et al 2012;Pacheco-Bernal et al 2019)。ゲノムワイドなRNAポリメラーゼIIプロファイルは、プロモーターにおけるリズミカルなPol IIリクルートを明らかにし、ヒストンマークのダイナミックな変化は、エピジェネティックなランドスケープの日常的なリモデリングを示唆している(Le Martelot et al 2012)。単一のサーカディアン因子は、対立する転写相を制御して、遺伝子発現の複数の相を有する複雑なサーカディアンリズムを生成することができる(Fang et al 2014)。時計成分は、宿主の転写機械のアクセス性および活性を調節する転写寛容なクロマチンランドスケープを定義し得る(Menet et al 2014;TrottおよびMenet 2018)。DNAゲノムを持つウイルスは、自身の転写および複製を促進するために、この概日性エピジェネティック・マシーンを悪用する可能性がある(図3)。HSVは、周期的な再活性化を伴う潜伏感染を確立し(Nicoll et al 2012)Bmal1発現を誘導し、時計シグナル伝達経路のリプログラミングを導く。KalamvokiおよびRoizmanは、HSVがコードするタンパク質ICP0がCLOCK:BMAL1ヒストンアセチルトランスフェラーゼ複合体と相互作用し、CLOCKの発現をサイレンシングしたsmall interfering RNA(siRNA)を用いて細胞に感染させるか、またはCLOCK変異体を発現するように遺伝子操作した細胞に感染させると、ウイルス複製が有意に減少することを示した(KalamvokiおよびRoizman 2010;KalamvokiおよびRoizman 2011)。これらの知見は、ヘルペスウイルスと概日時計成分との相互作用が、潜伏を調節することができるウイルスクロマチンのリモデリングにつながるモデルを支持する。
図3. 細胞時計はウイルスのライフサイクルに影響を与える
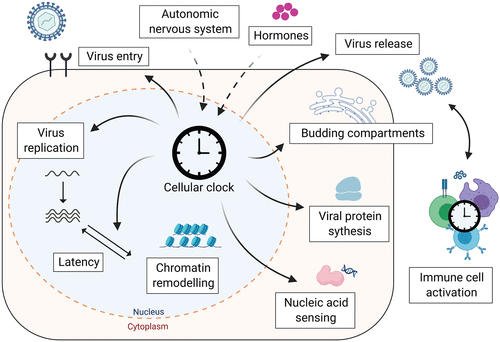
細胞時計は、エントリー受容体の調節から粒子生成のための脂質依存性経路まで、ウイルスのライフサイクルの複数のステップでウイルス感染に影響を与えることができる。さらに、核酸センシングや免疫細胞の活性など、ウイルス感染に対抗する免疫応答は、細胞性概日時計によって制御されている。
ウイルス感染に影響を与える概日リズムと年間リズム
哺乳類の概日リズムは、自然の明暗サイクルの季節変化に適応している;したがって、ウイルス感染症と概日時計との関連は24時間の期間を超えている。季節の違いは、冬の間のウイルス感染症への感受性の増加を説明する可能性がある(Dowell, 2001)。年周期的な発生は、環境因子および外因性因子、ならびに宿主の行動およびフェノロジーによって駆動されるパンデミック性疾患の特徴である(Martinez, 2018)。免疫細胞による遺伝子発現および血液の細胞組成は季節によって異なり、遺伝子発現パターンは北半球と南半球の間で反転している。IL-6受容体やC反応性タンパク質のような疾患リスクバイオマーカーは冬に発現の増加を示し、これはBMAL1発現の低下と一致する(Dopico et al 2015)。同様に、免疫機能は季節変動を示し、好中球活性は低下するが(Klink et al 2012)全血球数は冬季に増加する(Dopico et al 2015)。季節的な生理学的変化の重要な調節因子は、ホルモンレベルの変化であり、ここで、甲状腺ホルモンレベルは視床下部で変化し、グルココルチコイド受容体は冬に最も低い発現を示す(Wood and Loudon, 2014; Dopico et al 2015)。宿主は、非ヒトウイルスのリザーバーやベクターのリズム性と同様に、急性および慢性疾患の転帰に影響を与える。
多くのウイルスは、独自の概日リズムを持ち、一日の異なる時間帯に活動する昆虫ベクターによって感染する(Meireles-Filho and Kyriacou, 2013)。このことは、ウイルスが活動期に宿主に遭遇するか、休息期に遭遇するかに影響を与える。例えば、デングウイルスは、日中および夕暮れ/明け方に活動するイデス・アエジプティ蚊によってヒトに感染し、ウイルス感染は蚊の活動を増強する(Lima-Camara et al 2011)。ジカウイルス(ZIKV)の感染は季節の気候変動に依存すると考えられており、より多くのZIKVの発生データが利用可能になるにつれ、感染の多い季節と少ない季節を定義することが重要になってくる(Petersen et al 2016)。季節的に調整された妊娠計画は、敏感な妊娠期間がZIKVの季節と重ならないようにすることで、垂直伝播を制限する可能性がある(Martinez, 2016)。
人間の農業および技術的介入もまた、ウイルス性疾患の伝播を促進する可能性があり、例えば、夏季の稲の灌漑は、日本脳炎ウイルス感染症の発生率を増加させることが示された(Tian er al)。 冬季に関連した光害は、西ナイルウイルス感染症のリスクの増加と関連している(Kernbach et al 2019)。最後に、気候変動は、年間の環境リズムを変化させ、季節の生物学を混乱させており、生物学的時計を非同期化させ、人間の健康に影響を与える可能性がある(Stevenson et al 2015)。
時を告げるウイルス
宿主の概日リズムがウイルス複製に影響を与えうるのと同様に、ウイルス感染は宿主の概日系を摂動させることができる(図3)。試験管内試験研究では、HBVがコードする調節タンパク質HBxがサーカディアン制御遺伝子転写物を摂動することが示されている(Yang et al 2014)。本研究ではHBx過剰発現系を用いたため、これらの結論は、本物のウイルス複製モデルでの検証が必要であることは注目に値する。マイクロRNA miR-10aのレベルは、慢性HCV患者からの肝生検で上昇した(Horii et al 2019)。試験管内試験解析では、肝細胞でmiR-10aを過剰発現させると、RORαを抑制してBmal1発現が減少することが示された。別の研究では、HCVコアタンパク質を発現する試験管内試験細胞モデルおよびHCV感染患者からの肝生検で、PER2およびCRY2発現の減少が示された(Benegiamo et al 2013)。サーカディアンシグナル伝達経路のウイルス依存性の破壊は、肝臓疾患に寄与する可能性がある(Mukherji et al 2019)。
インフルエンザウイルスは、感染マウスの肺におけるBmal1,Clock、およびRev-erbβのピーク発現のタイミングを変化させ、肺組織の摘出物におけるPer2発現の振幅を減少させた(Sundar et al 2015)。複合的な煙曝露とインフルエンザ感染はマウスの運動量を減少させ、ヒトではより重篤な喘息と関連している(Ehlers et al 2018)。シミアン免疫不全ウイルスは、サルの体温の概日リズムの振幅と平均値を損ない、運動器活動を低下させることが報告されている(Huitron-Resendiz et al 2007)。また、HIVはマウスやヒトでも概日リズムを変化させることが示されている。HIVがコードする転写トランザアクチベーター(Tat)タンパク質は、光同調経路に影響を与えることで、マウスの概日時計をリセットする(Clark et al 2005)。Tatを慢性的に過剰発現させると、マウスでは概日輪走リズムの振幅と運動量が減少した(Duncan et al 2008)。HIV-1感染者において、Tatタンパク質はメラトニン発現を促進することが報告されており、これはHIV感染者によって頻繁に報告される睡眠の質の低下に寄与する可能性がある(Wang et al 2014)。要約すると、ウイルスは、時計転写因子の活性を変化させることにより、またはより一般的にホルモン経路および光同調経路を摂動することにより、概日性遺伝子発現レベルに影響を与え得る。公表された研究では、概日性調節因子と相互作用するウイルスコード化タンパク質の直接的な効果に主に焦点が当てられているが、それ以外の経路も役割を果たしている可能性が高く、調査が必要とされている。例えば、ライフサイクルの一部として宿主のクロマチンに組み込まれるウイルスは、概日制御された遺伝子発現を乱す可能性がある。多くの未解決の問題が残されており、今後の研究ではサーカディアン・レンズを用いて調査することが興味深い。
完全なタイミング 治療へのアプローチ
サーカディアン・モジュレーター
宿主のサーカディアン・マシーンは、抗ウイルス介入のための豊富な治療標的を提供する。REV-ERBの合成アゴニストは、マウスモデルにおいて生体内試験活性を示し(Solt et al 2012)炎症性サイトカインの選択的調節により免疫応答を変化させる(Gibbs et al 2012)。これらのアゴニストは、HCV複製の律速酵素である脂肪酸生合成経路成分ステアロイル-CoA-デサチュラーゼ(SCD)の発現を抑制することを介して、HCVの侵入、RNA複製、および感染性粒子の放出を阻害することが報告された(Zhuang et al 2019)(Lyn et al 2014;Nio et al 2016)。同様の観察が、脂肪酸生合成経路にも依存する関連するフラビウイルス、DENVおよびZIKVで見られた(Paul and Bartenschlager, 2015)。より最近では、REV-ERBアゴニストは、初代細胞におけるHIV転写およびウイルス複製を阻害することが示された(Borrmann et al 2020)。HSVおよびHIVは、潜伏感染を確立し、それによって抗ウイルス薬および宿主免疫応答を回避することができる。時計成分のヒストン脱アセチラーゼ活性は、潜伏ウイルスを活性化するためにサーカディアン修飾薬によって標的化され、HIVを治癒させるための既存の「ショック&キル」根絶アプローチを補完する可能性がある(Deeks, 2012)。
サーカディアンタンパク質活性を調節する追加の薬理学的薬剤が開発されている(Miller and Hirota, 2020)。これらには、BMAL1発現を阻害するCRY安定剤(Hirota et al 2012;J・W・Lie et al 2015a)およびRORモジュレーター(Huhu et al 2011;Solt et al 2011;Chai et al 2020)が含まれる。RORインバースアゴニスト(Kumar et al 2011)は、それらが競合して同じDNA応答エレメントに結合し、同じ遺伝子の多くを調節するので、REV-ERBアゴニストと同様の効果をウイルス複製にもたらし得る(Takeda et al 2012)。これらのリガンドは、炎症性(T. Xu et al 2011)およびウイルス応答を増強または抑制するために、特定の状況下で有益であり得る。
サーカディアン遺伝子多型がウイルス感染に与える影響を検討することは興味深い。K. A. Lee et al 2015b)は、成人HIV感染者におけるサーカディアン遺伝子の遺伝的変動と睡眠パターンとの間の関連を観察した。HIV感染者では、Clock遺伝子およびPer2遺伝子の多型は、睡眠維持不良(睡眠発症後の覚醒)および総睡眠時間の増加と関連していた;しかしながら、基礎となるメカニズムは十分に定義されていない(K. A. Lee et al 2015b)。
時間帯、薬剤投与、およびワクチン接種
投薬のための一日の時間帯を最適化することは、個別化医療の一つの側面であり、抗がん剤治療のサーカディアンタイミングに例示されている(X.M. Li et al 2013)。サーカディアンシステムの改善された理解は、必要とされる抗ウイルス薬の時間と量を変化させる可能性がある。最近の研究では、マウスのHSV-2感染を予防するために必要なアシクロビルの有効量は、活動期には安静時よりも4倍高いことが示されている(Matsuzawa et al 2018)。薬剤の半減期は投与時間に依存しており、半減期が短い(6時間以下)薬剤は投与時間に敏感に反応する可能性がある(Ruben et al 2019)。
CD8 T細胞の概日時計はワクチン接種に対する応答を調節し、オバルブミンペプチドを予め装填した樹状細胞を用いたワクチン接種が夜間に比べて日中に行われた場合、マウスにおいてより高いT細胞活性化につながる(Nobis et al 2019)。
ヒトにおけるインフルエンザワクチン接種は、午前中(午前9~11時)に投与した場合、午後(午後3~5時)に投与した場合と比較して、より効果的であり、複数のインフルエンザ株に対してより高い抗体応答が測定された。
性、ステロイドホルモンまたはサイトカインレベルと抗体応答との間には関連は観察されなかった(Long er al)。 季節に依存する環境を持つ国でのワクチン投与月もまた、抗体応答および様々なウイルスに対する防御に影響を与え得る。B細胞成熟因子(BCMAまたはTNFRSF17)の発現は季節変動を示し(Dopico et al 2015)発現レベルは3価インフルエンザワクチンに対する良好な応答と関連している(Nakaya et al 2011; S. Li et al 2014)。パキスタンでは、ガンビアと比較して、ワクチン接種月と狂犬病ワクチンに対する抗体応答との間に有意な関連が観察された(Moore et al 2006)。
冬の間に増加した発現を示すPRR発現の季節性(Dopico et al 2015)は、ワクチン応答の質を変化させ、黄熱ウイルスに対するより良い保護と相関する(Querec et al 2009)。薬物またはワクチンの投与のタイミングのこれらの単純な手段は、薬物の効率を高め、副作用を減少させることができる(Ruben et al 2019; Zhao et al 2020)。
結論と時間の追跡
この成長分野を再検討した結果、概日リズムとウイルス感染症との関連性を示す明確な証拠が得られた。サーカディアン経路とウイルス複製の間の相互作用を研究することは、多くの機会を提供することができる:
ウイルス感染とそれに関連する免疫応答のより良い理解、新しい抗ウイルスターゲットの同定、現在の治療法の洗練、および慢性感染症の治療。概日時計は、低酸素シグナル伝達(Adamovich et al 2017;Manella et al 2020;Peek 2020)および代謝(Panda 2016;Alexander et al 2020;Cal-Kayitmazbatir et al 2020)を含む他の多くの経路に接続されている。このクロストークは、ウイルス感染に影響を及ぼす可能性が高く、これらの相互作用を理解するには、ウイルス学、サーカディアン生物学、免疫学、および薬理学を含む学際的なアプローチが必要である。
進化とは、外部リズムと内部生物学の融合によって定義される。交代勤務による睡眠障害、社会的時差ぼけ、世界的なウイルス大パンデミックなどの時代に生きる私たちは、ウイルスの薬剤耐性の出現とともに、生物学的リズムを利用することで、ウイルス感染症の治療に新たな治療法や新薬を提供できる可能性がある。プラトンは、「リズムと調和は魂の内なる場所への道を見つける」(プラトン『共和国』紀元前375)と書いているが、リズミカルさと同期性を人間の健康にどのように取り入れることができるかを研究することは、私たちの責任である。
