Contents
pubmed.ncbi.nlm.nih.gov/37626783
受理:2023年6月17日受理:2023年6月17日 /改訂:2023年7月17日 /受理:2023年7月24日 /掲載:2023年8月17日
要旨
COVID-19パンデミックは、多くの病気と多くの死者をもたらし、社会に大きな混乱をもたらした。安全で効果的な」ワクチンの製造は、公衆衛生の重要な目標であった。悲しいことに、前例のない高率の有害事象が、その恩恵に影を落としている。
この2部構成の叙述的レビューでは、新規製品であるCOVID-19 mRNAおよびアデノベクターDNAワクチンの広範な有害性の証拠を提示し、病原性の証拠がある外来抗原を産生するヒト細胞に依存したワクチンの新技術から生じる有害性の徹底的な概観を提供しようとする点で斬新である。
この最初の論文は、これらの新技術に添付された「安全で効果的」な説明に反する査読済みデータを調査したものである。
SARS-CoV-2ウイルス由来であれ、「合成ウイルス」に似たワクチン遺伝子コードによって産生されたものであれ、「スパイク病」と呼ばれるスパイクタンパク質の病原性は、分子生物学と病態生理学の観点からますます理解されるようになっている。
脂質ナノ粒子やウイルスベクター担体によって、注射部位から離れた体組織を通して薬物動態学的にトランスフェクションされることは、「スパイク病」が多くの臓器に影響を及ぼす可能性があることを意味する。
mRNAを運搬するために使用されるナノ粒子の炎症特性、合成mRNAの機能を延長するために採用されるN1-メチルシュードウリジン、mRNAとDNAコードおよび翻訳されたスパイクタンパク質の広範な生体内分布、および外来タンパク質のヒト産生を介した自己免疫が、有害な影響の一因となっている。
本論文では、自己免疫、心臓血管、神経、潜在的な腫瘍学的影響、およびスパイク障害に関する剖検の証拠について概説する。多くの遺伝子ベースの治療技術が計画される中、再評価が必要であり、時宜を得たものである。
キーワード
スパイクタンパク質、病理学、トランスフェクション、生体内分布、脂質ナノ粒子、剖検、炎症、ファーマコビジランス、COVID-19、mRNAワクチン
1. はじめに
この叙述的レビューでは、パンデミックを終わらせるという大きな希望を抱いて “ワープスピード “で開発された新規製品COVID-19ワクチンに付随する「安全で効果的」というメッセージに対抗する確かな証拠を検証する。このような証拠が積み重なり、当初の楽観論に水を差したのである。ワクチンに関連した診断の認識と治療薬の必要性に対する影響は、すべての医療従事者と多くの研究科学者が考慮すべき重要なものである。
主な問題点は、(1)スパイクタンパク質の毒性-ウイルス由来と、新規のCOVID-19 mRNAおよびアデノベクターDNAワクチンの遺伝子コードによって産生された場合の両方-であり、それゆえ「スパイク病」という新しい用語がある[1,2];(3)長時間作用する合成mRNA中のN1-メチルシュードウリジン[4]、(4)脂質ナノ粒子とウイルスベクターキャリアマトリックスを介したmRNA[5]とDNA[6,7]コードの広範な生体内分布、(5)自己免疫を引き起こす可能性のある外来タンパク質をヒト細胞がリボソーム内で産生するという問題[8,9]。
2019年末にSARS-CoV-2が出現し、2020年3月までにWHOによって世界的大流行と宣言されたCOVID-19の関連疾患は、多くの病気を引き起こし、高齢者やリスクのある人々に多くの死亡者を出し、社会を深刻に混乱させた。2019年12月から2021年8月までに発表された論文の包括的な文献レビューでは、COVID-19による最大の死亡リスクは、心血管疾患、脳血管疾患、慢性腎疾患と関連していることが明らかになった[10]。COVID-19の大流行を食い止めるための安全で効果的なワクチンの製造は、最も重要な公衆衛生介入の一つであった。多くのCOVID-19ワクチンが世界中で開発された。非西洋諸国では、ほとんどのワクチンは従来のタンパク質ベースまたは不活化ウイルス技術を使用してきた。mRNAワクチンとアデノベクターDNAワクチンは大手製薬会社によって製造されており、ほとんどの欧米諸国では規制当局に支持されている。これらのワクチンは何百万人もの命を救ってきたと広く主張されてきた。この物語には心からの期待が寄せられている。しかし、この信念の大部分は、初期の感染致死率(IFR)モデリングによる推定値や、ファイザー、モデナ、アストラゼネカ、ヤンセンが主張する有効性に基づくものであり、それらは新たなデータによって損なわれている。
遺伝子ベースのワクチンの使用については論争が巻き起こっているが、本稿ではその理由を探る。「安全で効果的」なワクチンに対する広範な願望に応えるため、遺伝子ベースの技術は迅速な生産が可能である。希望はおそらく、発表された文献の多くやメディアの語り口に影響を及ぼしている。中心的な問題は、SARS-CoV-2スパイクタンパク質の病原性効果を示す証拠が増えてきたことであり、それはウイルスの一部であるにせよ、mRNAやアデノベクターDNAワクチンの遺伝子コードによって産生されるにせよ、である。
この叙述的レビューの目的は、抗原の病原性、抗原をコードする遺伝子の全身への生体内分布、特にmRNAワクチンで修正された長期持続性、そしてこのような生体内分布や外来抗原の細胞産生から予想される有害事象を示す文献やデータについて包括的に説明することである。本総説は、実験的な遺伝子治療技術を大衆のワクチン接種に転用するのが時期尚早であった事例と、次のパンデミックが起こる前に精査と改革が必要な倫理的・規制的問題を提示している。
個人のインフォームド・コンセントの決定と公衆衛生政策の中心は、病気のリスクと介入のリスクと潜在的利益の比較検討である。新規遺伝子ベースのCOVID-19ワクチンのリスクを考えると、SARS-CoV-2感染の深刻さに照らして、その価値はあったのだろうか?まずCOVID-19のリスクについて述べる。
2.COVID-19モデリングと実世界データとの比較
武漢のオリジナル株と2020年のSARS-CoV-2の初期変異株は、それ以降の変異株よりも病原性が高いことは明らかである。これは、感染力は強いが病原性は低いという典型的なウイルスの適応進化と一致しており、人類にとって幸運な自然現象である。COVID-19ワクチンが何百万人もの命を救ったという主張は、VerityらがLancet誌に発表した2020年2月の中国における症例致死率(CFR)に基づくモデル化に基づいている[11]。著者らは、60歳以上ではCFRが6.4%(5.7-7.2)、80歳以上では「最大13.4%(11.2-15.9)…中国全体の感染致死率は0.66%(0.39-1.33)」と推定している(抄録)。幸いなことに、ウイルスは変異し、パンデミックがその後3年間展開する中で、このようなモデル予測は現実のものとならなかった。
COVID-19ワクチンはCOVID-19によって命を救ったが、その数は明らかではない。COVID-19遺伝子ベースのワクチンによって何百万人もの命が救われたという主張は、COVID-19ワクチンが感染と伝播を防いでいるという仮定に一部基づいていた。呼吸器ウイルスに対する全身免疫は、感染からの粘膜免疫ほど有効ではなく、また、ワクチン誘導抗体の適応回避によって、おそらく部分的には継続的に進化する亜種のため、そうではなかった。ファイザー社は、その第3相臨床試験[12]がウイルス感染についてテストしていないことを認めた[13]。
しかし、COVID-19のモデラーたちによって有効性の推定は支持され、保健当局、医学出版物、メディアによって繰り返し強調されてきた。このことは、Watsonら(2022年)が『Lancet Infectious Diseases』誌に発表した「COVID-19ワクチン接種初年度の世界的影響:数理モデリング研究」[14]に示されている。著者らは、感染と伝播に対する防御を含むワクチン接種の利点に関連して、約1440万人の命が救われたと推定しているが、どちらも現在では根拠がないと認識されている。ワトソンらによるこの仮定的推計は、認められた事実として存続しているが、一方、現実の感染致死率(IFR)のデータは、非高齢者におけるワクチン接種の必要性を否定している。
簡単に説明すると、2020年初めにRousselらは、SARS-CoV-2の症例致死率を以前のコロナウイルスやインフルエンザ様疾患と比較した統計的に有意な分析を発表した:OECD諸国では、SARS-CoV-2の死亡率(1.3%)は、フランスのマルセイユの公立病院で確認された一般的なコロナウイルスの死亡率(0.8%、p= 0.11)と有意差はなかった。もし、中国の最初のデータから数ヵ月後にこれらのデータに基づいてモデル化されていたら、ワクチンが利用可能になる前の2020年を含む最終的な死亡統計に沿った、異なる予測がなされていたであろう。
Ioannidisらは2022年に「COVID-19の予測は失敗した」と題する論文で、2020年前半に出現する低IFRを無視したモデルを批判した[16]。Ioannidisらは次のように指摘している:
「疫病予測の失敗は古くからある問題である。実際、伝染病予測が、その疑わしい実績から、意思決定者の間で大きな信頼性を保っていることは驚きである。豚インフルエンザのモデリングでは、英国で3100〜65,000人が死亡すると予測されていた(https://www.theguardian.com/uk/2009/jul/16/swine-flu-cases-rise-britain.(2020年6月2日アクセス)。最終的に457人が死亡した(英国政府、2009年)」。[16] (p. 425)
続いてIoannidisらは、死亡、入院、ICU入室に関する米国の多くのCOVID-19予測モデルを調査し、それらが目標を達成できないマージンが極めて大きいことを強調した。Ioannidisらは続けた:
「このような明らかな失敗にもかかわらず、[COVID-19]の流行予測は繁栄し続けたが、それはおそらく、予測に大きな誤りがあったとしても、深刻な事態には至らなかったからであろう。そうでなければ、ウイルスそのものよりも害を及ぼすことになりかねない」。[16] (p. 428)
社会のナラティブは、一度定着すると転換が難しくなる。
COVID-19遺伝子ベースのワクチンによって救われた命や失われた命の正確な推定には、ワクチン接種者と未接種者を比較した長期的な研究が必要であった。ファイザー社、モデナ社、アストラゼネカ社、ヤンセン社は、最終的にほとんどすべてのプラセボ被験者にワクチンを接種したため、対照群を失った。これは、COVID-19の恐ろしさを考慮した倫理原則に基づくものであったが[17]、短期間のプラセボ対照試験しか行わないことによる科学的完全性の喪失は、WHOの「Covid-19評価のための次のステップ(2020年)に関するアドホック専門家グループ」によって指摘された[18]。
この不足を補うため、英国に拠点を置く1つの民間団体Control Group Cooperative[19]が、COVID-19ワクチン接種展開以降のデータを収集し、唯一の世界的対照群となっている。このワクチン未接種コホートのうち18,497人が、2021年9月から2022年2月にかけてCOVID-19陽性反応と症状の重症度を報告する調査に参加した。4分の1(4636人、25.1%)が症状のあるCOVID-19の病気を経験したと報告した。症状は「軽度」が14.4%、「中等度」が8.7%、「重度」が2%であった。さらに560人が無症状の罹患を報告し、COVID-19を発症した5196人のうち74人(1.4%)だけが通院(入院または外来)を報告し、21人(0.4%)が1週間以上の入院をした。自己報告による調査であるため、報告されなかった死亡例も含まれている。このグループは、71%がビタミンC、D、ケルセチン、亜鉛、適応外のイベルメクチンやヒドロキシクロロキンを組み合わせて摂取しているという点で、おそらく珍しいものであった[20] 。
この文脈で、2022年11月と12月のオーストラリア州政府(NSW)の保健データ[21](図1と図2)は、ワクチン未接種者が入院データにほとんど表れていない一方で、ワクチン接種者が過剰に表れていることを示している。ニューサウスウェールズ州のワクチン未接種者の割合は3.2%と低かったが、2022年後期の重症COVID-19のワクチン未接種者の割合は2.9%とこれより低い。COVID-19ワクチンを高齢者や社会的弱者により多く接種することを考慮しても、少なくともオミクロン株出現後の入院、ICU入室、死亡に対する有意な有効性は示唆されていない。
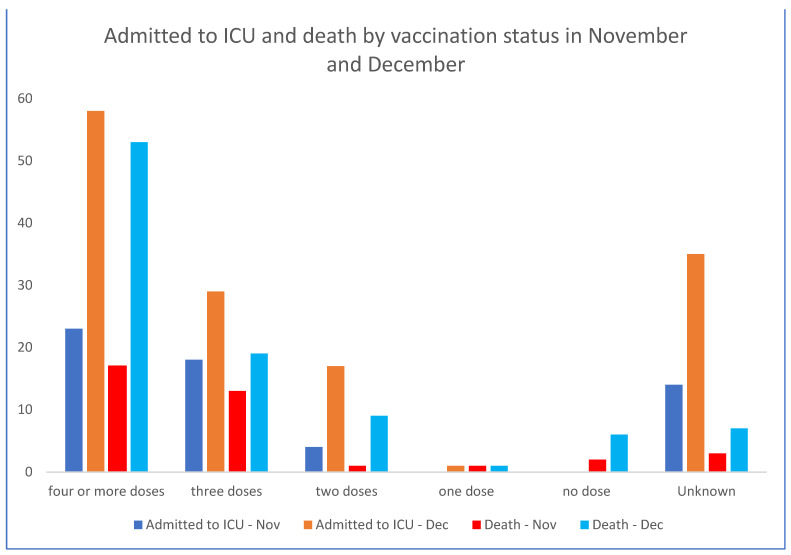
図1.2022年ニューサウスウェールズ州における最近6週間の入院、ICU入室、死亡(ワクチン接種状況別)。
NSW保健省。棒グラフは、図2[21]として掲載した政府公式報告書の抜粋の数字から作成。
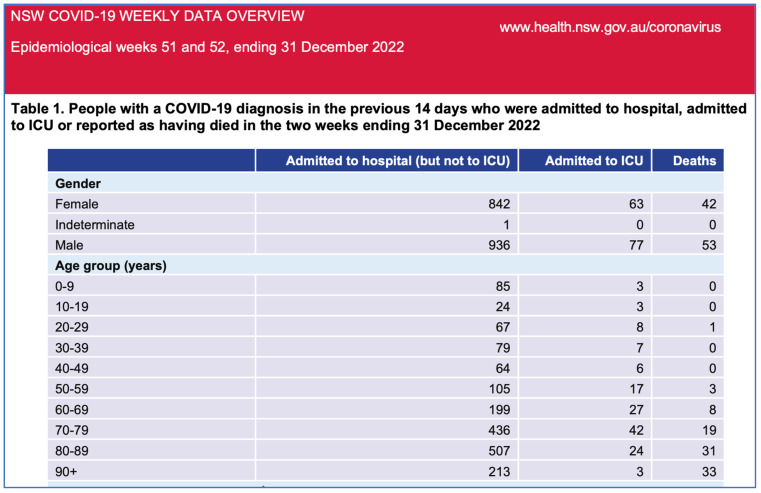
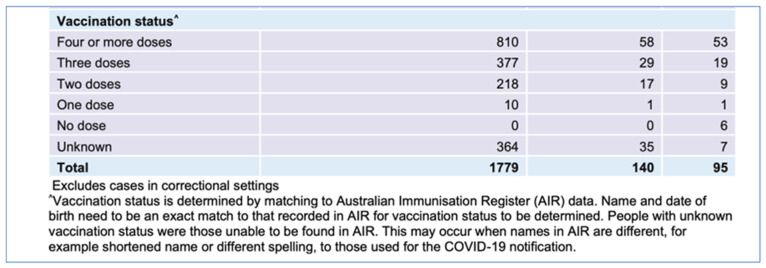
図2オーストラリアNSW州COVID-19による入院、ICU入室、死亡(最近2週間、2022年)。
NSW保健省。ニューサウスウェールズ州COVID週次データ概要過去2週間(2022年)の表1より。なお、同じデータの地域協議会の分析はスペースの関係で削除されている。クリエイティブ・コモンズ 表示 4.0 ライセンスの下で使用。© State of New South Wales.最新情報はwww.nsw.gov.au。[21].
2022年第51週と第52週のニューサウスウェールズ州政府のデータでは、ワクチン未接種者の入院はゼロ、死亡は6人であったが、ワクチン接種が判明している者の入院は1415人、死亡は82人であった。ニューサウスウェールズ州保健局は、ワクチン接種状況を公表していない。これらのデータは、ワクチン接種が「何百万人もの命を救った」という前提を支持するものではなく、接種回数とCOVID-19の重症化との相関関係を示すものであり、調査が必要である。COVID-19遺伝子ベースのワクチン接種開始と同時に全死因死亡率が増加しており、さらなる調査が必要である。
数学モデルは、未来を予測する不確実性の高い数値を生み出す。これらの予測は政治的に利用される可能性がある。予測が政治的な大義名分の付属品にならないようにするためには、モデラー、意思決定者、そして市民が、私たち全員に責任を負わせる現実の事実を確立する必要がある。
もしCOVID-19ワクチンの効能が、当初期待され、その後主張されたものよりも低かった場合、個人のインフォームド・コンセントや公衆衛生政策におけるリスク/ベネフィットの意思決定は変化する。その場合、遺伝子ベースの新規ワクチン技術によって引き起こされる害の程度は、いかなる利益をも上回るかもしれない。
3. TGAとレニック・オーストラリア上院議員との往復書簡
オーストラリアでは、治療用品局(TGA)がファイザー(Comirnaty、BNT162b2)、モデナ(SPIKEVAX、mRNA-1273)、アストラゼネカ(Vaxzevria、ChAdOx1 nCOV-19)、ヤンセン(COVID-19ワクチン、Ad26.COV2.S)を2021年初頭に追加し[22]、2022年1月にはノヴァバックス(Nuvaxovid、NVX-CoV2373)のタンパク質ベースの脂質ナノ粒子埋め込みワクチンを追加した[23]。
2022年12月16日、TGAの助言を受けたオーストラリア保健省は、通知SQ22-000609に関する上院地域問題委員会の質問で、ジェラード・レニック上院議員(自由党、クイーンズランド州)が2022年11月21日に行った質問235に回答した。レニック議員は、議会事務局にオーストラリア人からのCOVID-19ワクチンによる傷害の数多くの報告を受けており、遺伝子ベースのCOVID-19 mRNAワクチンの広範囲に生物学的に分布した高いトランスフェクション率と発現率を示したTGA自身の報告書[5]は、ワクチンがウイルスよりも病原性が高く、ヒト細胞により多くのスパイクタンパク質が負荷されていることを示唆する証拠であるかどうかを質問していた[24]。
TGAはこう答えた:
「ここには生化学と免疫学の混乱がある。翻訳や発現率が高いことは病原性とは関係なく、むしろ抗原(スパイクタンパク質)の発現が良いことを示している。発現されたスパイクタンパク質は病原体ではなく、感染性もない。スパイクタンパク質はコロナウイルスの構成要素の一つに過ぎない。SARS-CoV-2ウイルスに対する体液性および細胞性免疫応答を誘導する抗原として機能する」。[24]
この論文のオーストラリア人著者として、遺伝子ベースのCOVID-19ワクチンが産生するスパイクタンパク質は免疫反応を誘導する抗原として作用し、微生物全体の病原体ではないというTGAの意見に同意する。しかし、TGAの回答は質問のポイントを外している。スパイクタンパク質自体が独立した生物活性と病原性を持つという証拠を要約する。スパイクタンパク質は、COVID-19ウイルス病の根底にある病態生理学と、遺伝子治療メカニズムによってヒト細胞にスパイクタンパク質を大量に産生させるCOVID-19ワクチンによる重篤な有害事象の両方に直接関係している。
実際、2003年に流行したSARSコロナウイルス1(SARS CoV-1)に含まれるスパイクタンパク質は、「重症急性呼吸器症候群」(SARS)という造語が生まれた肺障害の原因として同定された。SARSはアンジオテンシン変換酵素2(ACE-2)レセプターに作用することで発症すると考えられていた。SARS-CoV-1(2003年ウイルス)のスパイク蛋白がACE-2受容体のダウンレギュレーションを引き起こし、マウスの肺水腫と急性肺不全を引き起こしたことが、Nature Medicineに発表された[25]。
4. ナラティブ・レビューの方法論
SARS-CoV-2感染における病原性決定因子としての役割とは別に、スパイクタンパク質の毒性、ひいては病原性を示す証拠となる文献の叙述的レビューをここに紹介する。これは、SARS-CoV-2ウイルス由来か、mRNA(ファイザーとモデナ)あるいはアデノベクターDNA(アストラゼネカとヤンセン)COVID-19ワクチン由来のmRNAによって直接ヒト細胞内で遺伝子コードによって産生されたものかを問わない。
また、mRNAワクチンであるModernaワクチンやファイザーワクチン、タンパク質ワクチンであるNovavax COVID-19ワクチンの脂質-ナノ粒子マトリックスの懸念される毒性や生体内分布プロファイルに関する文献的証拠、mRNAの長期残存やスパイクタンパク質の産生を説明する合成mRNAの改変された性質、有害事象報告における「不良バッチ」のばらつき現象、特に小児や若年成人コホートに対するCOVID-19ワクチン接種に関連する年齢層別のリスク/ベネフィットに関する考察についてもレビューする。
これらの薬物動態学的および薬力学的側面は、遺伝子ベースのCOVID-19ワクチンの病原性に関連する。上記のTGAの回答の文脈では、遺伝子ベースのCOVID-19ワクチンの薬物動態学的生体内分布の側面は、スパイクタンパク質の病原性効果を全身に分布させるため、侵襲性または血液媒介性の段階にある「感染」剤に似ている。
本総説は、TGAをはじめとする規制当局や保健当局が、mRNAやアデノベクターDNAから産生されるスパイクタンパク質の毒性を再評価する際の参考となるよう、学術文献、ファーマコビジランス、ファイザー社の臨床試験文書から、情報公開(FOI)命令を通じて得られた証拠を提示するものである。「スパイク病」とでも呼ぶべき新しい時代の病理学が出現しつつある。また、将来、mRNAやDNAベースの新技術によって引き起こされる、外来抗原産生による新たな自己免疫現象の可能性を評価することも不可欠である。
「スパイク病」による危害のエビデンスは、他の病態生理学的損傷と同様に、臓器系別にレビューされており、ファーマコビジランスデータのレビューは、さらに別の論文の主題となる予定である。
以下の要点は、発表された情報を要約したものである。
キーポイント
- 感染症の流行/パンデミックと闘うためには、安全性が高く効果的なワクチンが中心である。
- SARS-CoV-2のスパイクタンパク質は、ウイルス由来のものであれ、mRNAやアデノベクターDNAワクチンの遺伝子コードから作られたものであれ、病原性を持つ。
- 生体分布げっ歯類の研究データによると、脂質ナノ粒子はmRNAをすべての臓器に運び、血液脳および血液胎盤のバリアを通過する。これらの組織の一部はウイルス感染を受けないと考えられる。したがって、バイオハザードは特にワクチン接種によるものである。
- 脂質ナノ粒子には炎症特性がある。
- 安定性を高めるためにmRNAをN1-methylpseudouridineで修飾すると、スパイクタンパク質が数ヶ月間産生される。mRNAスパイク蛋白がどの臓器からどの程度の細胞数で産生されるかは不明であり、したがってワクチン1バイアルあたりの正確な有効投与量は不明である。
- 細胞内におけるmRNAの長期的な運命は現在のところ不明である。
- mRNAワクチンとアデノベクターDNAワクチンは「合成ウイルス」として機能する。
- 若くて健康な人、さらには脆弱な合併症を持つ多くの高齢者においても、コード化ベースのCOVID-19ワクチンは、ウイルスそのものによる感染よりもはるかに多様な組織にトランスフェクトする可能性が高い。
- その証拠に、mRNAのDNAコピーへの逆転写が可能であることを示唆している。このことはさらに、生殖細胞がDNAコピーを宿主ゲノムに組み込めば、世代間伝播の可能性を示唆している。
- スパイクタンパク質のような外来タンパク質が細胞表面に産生されると、自己免疫反応や組織損傷を引き起こす可能性がある。このことは、将来mRNAをベースとする医薬品やワクチンを開発する場合、極めて否定的な意味を持つ。
- スパイクタンパク質は、炎症、血栓形成、内皮炎に関連した組織損傷やプリオンに関連した調節障害を引き起こすいくつかのメカニズムを介して、病態生理学的作用(「スパイク病」)を発揮する。
- ワクチンコード化されたスパイクタンパク質とACE-2、P53、BRCA1との相互作用は、腫瘍学的可能性を持つ幅広い生物学的干渉の可能性を示唆している。
- 公式ファーマコビジランス・データベースから得られた有害事象データは、FDA-ファイザー社が情報公開によって入手した報告書によれば、高率であり、複数の臓器系(主に神経系、心臓血管系、生殖器系)が影響を受けている。
- ファイザー社とモデナ社のmRNA COVID-19ワクチンの臨床試験データは、独自に解釈され、特に非高齢者において好ましくないリスク/ベネフィットを示すことが査読され、公表されている。小児に対するリスクは明らかにベネフィットを上回っている。
- COVID-19ワクチンのブースター投与を繰り返すと耐性が誘導され、COVID-19感染の再発や「Long-COVID」の一因となる可能性がある。
- SARS-CoV-2の大流行は、公衆衛生および医薬品規制機関の欠陥を明らかにした。
- 憂慮すべき感染症パンデミックへの対応を急いだように見えるが、根本的な原因分析が必要である。
- 多くの臓器系における「スパイク病」関連病態の治療法については、早急な研究が必要であり、長期にわたるCOVID-19ワクチンによる傷害に苦しむ何百万人もの人々に提供する必要がある。
5.SARS-CoV-2スパイクタンパク質の構造
クライオ電子顕微鏡により、パンデミックの初期にスパイクタンパク質の構造が明らかになった[26] 。SARS-CoV-2のスパイクタンパク質は、ウイルスの細胞壁から外側に突出しており、Cuffari[27]の図3の模式図では赤で示されている。
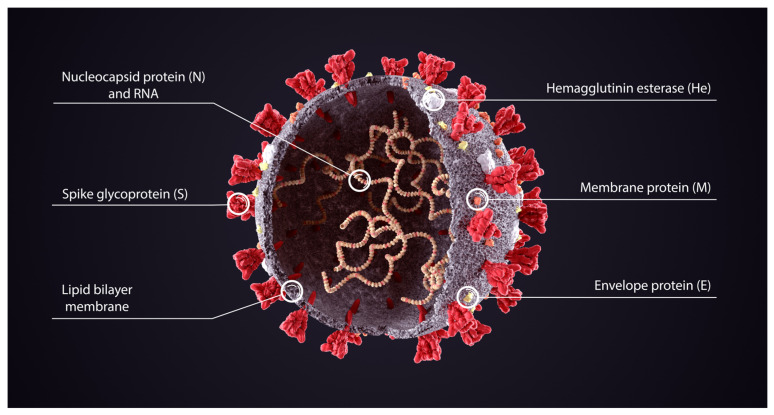
図3 SARS-CoV-2ウイルスの各種タンパク質の図。News-Medical.netより転載(2023年4月26日アクセス) Cuffari (2021):スパイクタンパク質とは何か?(許可を得て、Shuttercockからライセンスを受けている)。[27].
SARS-CoV-2感染の文脈では、スパイクタンパク質は細胞侵入の病原決定因子であり、2つのサブユニットから構成される:S1はN末端ドメイン(NTD)と3つの受容体結合ドメイン(RBD)の3量体から構成されるウイルスから外側に向いたスパイク糖タンパク質の遠位端にあり、S2は主にC末端領域から構成され、スパイクタンパク質の茎を形成し、ウイルスのエンベロープまたは膜に近接して埋め込まれる。
ウイルスはスパイクタンパク質を用いて細胞表面のACE-2レセプターと結合し、細胞内に侵入する。そのために、S1サブユニット上の受容体結合ドメイン(RBD)は、ACE-2受容体と相互作用するために「下」から「上」へとヒンジのように伸長する。
図4はWrappら[26]によるもので、3つの「三量体」RBDのうちの1つが緑色で「上」の位置にある一方、他の2つのRBDは「下」にあり、ACE-2への付着にアクセスできない。左の図はスパイクタンパク質の横顔で、右はS1サブユニットまたは三量体スパイクタンパク質の上部を上から見た図である。
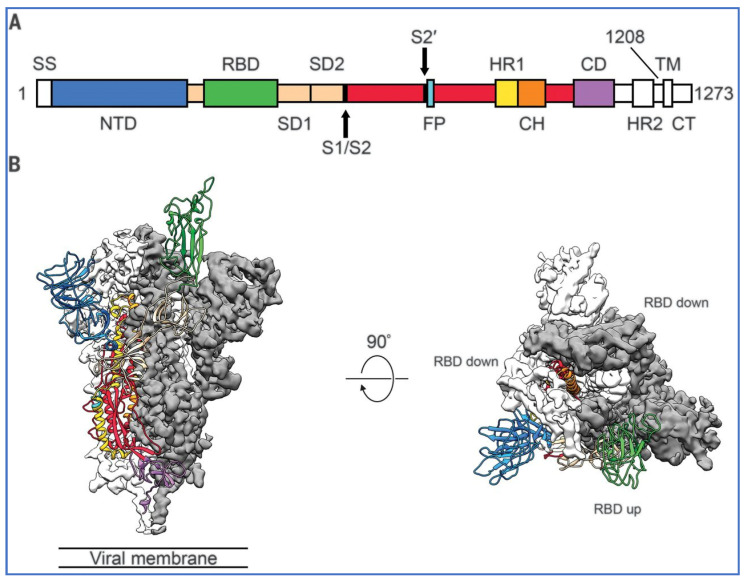
図4プレフュージョンコンフォメーションにおける2019-nCoV Sの構造。
(A)ドメインごとに色分けした2019-nCoV Sの一次構造の模式図。エクトドメイン発現構築物から除外されたドメイン、または最終マップにおいて可視化できなかったドメインは、白色で着色されている。SS、シグナル配列;S2′、S2′プロテアーゼ切断部位;FP、融合ペプチド;HR1、ヘプタッドリピート1;CH、中心ヘリックス;CD、コネクタードメイン;HR2、ヘプタッドリピート2;TM、膜貫通ドメイン;CT、細胞質尾部。矢印はプロテアーゼ切断部位を示す。(B)アップコンフォメーションにある1つのRBDを持つ2019-nCoV Sタンパク質のプレフュージョン構造の側面図と上面図。2つのRBDダウンプロトマーは白またはグレーの低温電子顕微鏡密度として示され、RBDアッププロトマーは(A)の模式図に対応する色のリボンで示されている。26]図1より転載、Copyright (2022)with permission.
5.1. ワクチン産生スパイクタンパク質は保護的閉鎖RBDを持つか?
SARS-CoV-2ビリオンはスパイクタンパク質を三量体の形で、主にプレフュージョンの形で保持している。各ウイルスのプレフュージョンスパイクタンパク質三量体は、3つのRBDがすべてスパイクの頂部に横たわったクローズドな状態か、1つ以上のRBDがスパイクの頂部から突出したオープンな状態か、さまざまなコンフォメーションで見られる。受容体結合部位(RBS)は、RBDが下にあるときはほとんどアクセスできない。スパイクタンパク質にはフリン切断部位があり、そこでS1サブユニットとS2サブユニットに分割され、感染性が促進される。スパイクタンパク質をS1サブユニットとS2サブユニットに分割するにはセリンプロテアーゼが必要であり、これによりACE-2レセプターを介した感染性が大幅に向上する。
受容体との相互作用の後、スパイク・タンパク質はS2サブユニットの露出、融合ペプチドの標的細胞膜への挿入、S2のリフォールディングにつながるコンフォメーション再編成を受ける。このリフォールディングにより、融合ペプチドとスパイクタンパク質の膜貫通ドメインが引き寄せられ、標的細胞膜とウイルス膜が引き寄せられ、融合する。例えるなら、栓抜きが瓶の首からコルクを引き上げるが、コルクは細胞膜とつながっており、一緒に引き上げられるというイメージだ[28]。
オーストラリアで市販されているワクチンは、前融合状態を安定化させ、後融合形態への移行を減少させ、したがって切断を制限するように設計されたスパイクタンパク質の遺伝子組み換え変異に依存している。変異には、2つの残基を二重のプロリンに置換したもの(ファイザー/バイオンテック、モデナ、ノババックス、ヤンセンなど)や、プロテアーゼ耐性のためのフリン切断部位の変異(ヤンセン)などがある。
mRNAやアデノベクターDNAによって作られたスパイクタンパク質が害を及ぼすことを示唆するデータが蓄積されていることを考えると、これらの理論的な安全策は失敗したように見える。
このシステムの失敗にはいくつかの理由が考えられる。全長のスパイク・タンパク質ではなくmRNAだけが脂質ナノ粒子と一緒に注入されるため、mRNA断片は、合成が最適でなかったり、製造後に分解されたりして、全長ではない可能性がある。その場合、スパイクタンパク質は、ペプチド部分と機能的なS1またはS2サブユニットへの切断が可能なコンフォメーションを持つ、切断されたスパイクタンパク質として部分的に発現される可能性がある。
タンパク質コードが完全に発現していても、細胞内で切断が起こることはある。どんな生物学的システムも100%有効ではないし、突然変異はS1とS2への切断を完全に防ぐのではなく、減少させるだけだと思われる。エクソソーム、直接細胞融合、ナノチューブ・トンネルを介したスパイク・タンパク質やサブユニットの他の細胞への輸送はまだ可能である。細胞内での発現エラーにより、スパイクタンパク質が特定の機能を保持する可能性がある。複製可能なプラスミドベクターによる汚染は、複製中の変異やゲノムへの挿入という選択肢を残す。
スパイクタンパク質は、ACE-2受容体との結合による毒性だけでなく、がん抑制遺伝子BRCAやP53との相互作用やミトコンドリア障害による細胞内での細胞毒性、細胞タンパク質との直接接触による凝固障害、プリオンタンパク質の拡散や病的形態への再構成を伴う蓄積による神経毒性を持つ。細胞内のスパイクタンパク質の蓄積は、毒性およびアポトーシス効果を持つ可能性がある。
5.2. RBDの毒素様ドメイン
病原性のもう一つのメカニズムが最近証明された。スパイクタンパク質はS1上のRBDに「毒素様」ドメインも含んでおり、その配列は狂犬病ウイルス(RBG)やHIVの糖タンパク質、神経毒NL-1と相同性を示し、これらは全てコリン作動性系のα7ニコチン酸アセチルコリン受容体(α7 nAChR)に結合する[30]。神経毒NL-1は蛇毒の一種である神経毒で、α7 nAChRの阻害剤として知られるブンガロトキシンの原型に似ており、結合親和性が高い。ヘビ毒3本指神経毒(α-3FNTx)は、神経筋接合部(NMJ)のシナプス後ニコチン性アセチルコリン受容体(nAChR)に作用して骨格筋麻痺を引き起こし、他の部位では特定のnACHRに作用して[31] 、炎症の制御に障害をもたらす[32] 。
このスパイク毒素様結合ドメインは、ACE受容体結合部位に隣接するRBDの一部であり、コンピューターシミュレーション研究[32]と電気生理学的研究の両方で、バンガロトキシンなどの神経毒と同様に、ナノモル用量でα7 nAChRに優先的に結合することが証明されている。活性ペプチドSCoV2Pは、ナノモル濃度において、アセチルコリン(ACh)誘導α7 nAChR応答を、潜在的なアロステリック機構によって増強・阻害し、ニコチンはこれらの作用を増強する。低用量では増強し、高用量ではnAChR機能を阻害する[33] 。
この結合モデルは、COVID-19、ロングCOVID、ワクチン接種傷害の患者における急性炎症性障害やその他の症状について論理的な説明を与える可能性があり、中枢神経系の深刻な調節障害と関連している可能性がある。
6. 懸念の理由薬力学的、薬物動態学的、および病態生理学的
薬物動態学的および薬力学的データは、mRNAおよびアデノベクターDNA COVID-19ワクチンの概念設計に懸念材料を与え、現在広く報告されている病態生理学を理解するための基礎となる。スパイクタンパク質の耐久性と持続的な生物学的利用能と同様に、制御不能な生体内分布が存在する。
6.1. 遺伝子ベースのワクチンは新しい実験技術である
前例のない数の有害事象は、ファイザー、モデナ、アストラゼネカ、ジョンソン・エンド・ジョンソンが採用している遺伝子ベースの技術によって産生されたスパイクタンパク質に関連しているようである。ウイルス-ベクターDNA技術は、ロシアのスプートニクVとエピバックコロナCOVID-19ワクチン、インドのiNCOVACC、中国のConvideciaでも採用されている。しかし、COVID-19ワクチンの大部分は、ほとんどが非西洋諸国で製造されており、従来のタンパク質ベースまたは不活化ウイルス非遺伝子ワクチンである[34,35]。
遺伝子ベースのCOVID-19ワクチンは、FDAによって「遺伝子治療製品」[36]と定義された治療薬の特別なクラスに分類され、レシピエント細胞が膜貫通発現のために抗原を産生する、あるいは免疫応答を二次的に呼び起こすために細胞から離脱するようになっている。従って、設計上、ウイルス様侵入と細胞転写のハイジャックを用いることで、mRNAワクチンとアデノベクターDNA遺伝子ベースのワクチンは、免疫原性の様式において、非免疫細胞を事実上の抗原提示細胞にさせる。したがって、これらの新しいワクチン・プラットフォームは、外来スパイク抗原を発現する細胞に対して引き起こされる細胞病理学的自己免疫反応によって、二次的に組織を損傷する危険性がある。
SARS-CoV-2パンデミック以前は、このような技術の使用は実験的なもので、ほとんどが転移性癌の治療用タンパク質の製造に限定されていた。COVID-19のパンデミック以前には、mRNAワクチンの一般的な使用が認可されたことはなく[37]、ウイルスベクターDNAワクチンは、エボラ出血熱、デング熱、日本脳炎に限定的に使用されたのみであった[38]。
情報公開請求(FOI)により入手した文書により、mRNA COVID-19ワクチンは、米国防総省の支援のもと、トランプ政権の「ワープ・スピード作戦」プログラムによって開発されたことが明らかになった。この遺伝子技術ワクチンは、国家安全保障上の脅威に対する緊急「対策」であり、間違いなくパンデミックは当初、2020年になると思われた。そのため、FDAの通常の、長期にわたる、時間のかかる安全性試験と毒物学プロトコルの多くが、緊急使用認可を急ぐために迂回された[39,40,41]。
6.2. 脂質ナノ粒子の幅広い分布
TurniとLefringhausen[42]は、”COVID-19ワクチン-オーストラリア総説 “の中で、合成mRNAのキャリアである脂質ナノ粒子は、それ自体が炎症を起こす可能性があり、膜を通過し、体内で広く分布することを指摘している。それは血液脳関門と血液胎盤関門の両方を通過する。彼らはModernaワクチンに関するEMAの報告書「mRNAは筋肉内投与後、脳内で血漿中の約2%のレベルで検出された」(491頁)を引用している。彼らはまた、脂質ナノ粒子が血液脳関門を容易に通過する方法と理由について述べた研究[43,44,45]も引用している。
カナダのウイルス学者・ワクチン学者であるバイラム・ブライドル教授(A/Prof Byram Bridle)は、2021年に情報公開請求を通じて、日本の医薬品医療機器総合機構(PMDA)からファイザーのげっ歯類試験の生体内分布データを入手した[46]。米国の独立監視財団であるJudicial Watchは、FDAとCDCが応じることを拒否した後、米国保健福祉省への情報公開訴訟を通じて同じファイザーの研究報告書を入手した[47]。より最近のオーストラリアTGAへの情報公開請求(FOI reply 2389-6)により、TGAの「非臨床評価報告書」の45ページが明らかになった:BNT162b2 COVID-19ワクチン “の45ページで、同じ研究が2021年1月の暫定承認[5]に先立つTGAの評価の一部であったことが判明した(45ページ)。
ファイザー社の生体内分布試験には63匹のウィスター・ハンラットが参加し、うち42匹(オス21匹、メス21匹)にはヒトに相当する1匹あたり50μgのmRNAを注射し、さらに21匹のオスラットにはModerna COVID-19ワクチンに相当する1匹あたり100μgのmRNAを注射した。ルシフェラーゼをコードするmRNAは、放射性同位元素で標識されたコレステロールを含む液体ナノ粒子に封入され、大臀筋に注射され、48時間モニターされた。図5に示されるように、生体分布データは、生体組織や膜を容易に通過するように設計された脂質ナノ粒子がすべての臓器に移動することを示していた。48時間後までには、75%が注射部位から他の場所に移動していた[5,47]。
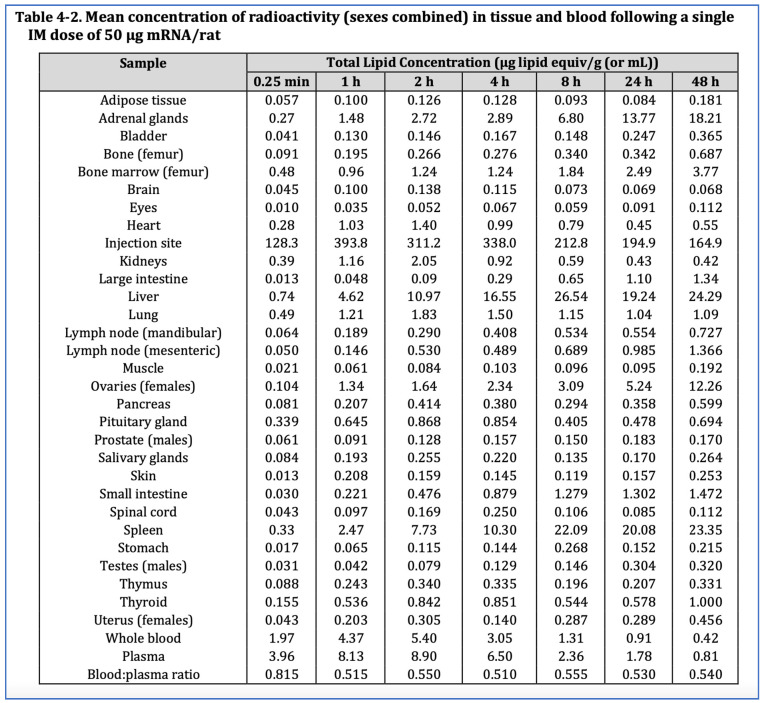
図5.ラットにおける脂質ナノ粒子の生体内分布、ファイザー社による2020年11月の試験。TGA FOI reply 2389-6[5](p.45)より。
細胞のターンオーバーが盛んで、細胞毒性による損傷を適時に修復するのに役立つ脾臓と肝臓が最も高いレベルであったが、脂質ナノ粒子、そしてmRNAは、特に卵巣と副腎だけでなく、脳、目、心臓、精巣、子宮、下垂体、脊髄、胸腺、骨髄など、一見すべての臓器に行き渡った。
ファイザー社のラットの生体内分布研究は裏付けられた。中国の研究者は、ホタルルシフェラーゼ遺伝子をコードする脂質-ナノ粒子-mRNA複合体(mRNA-LNP)をマウスに注射し、注射部位からの生体内分布は「肝臓に多く存在し、急速に全身に分布するようになった」し、「LNPの曝露量とタンパク質の発現量との間の非線形関係は、組織や臓器によって異なる」[48](p.114)。より小さなmRNA-LNP複合体がさらにトランスフェクトされ、肝臓とリンパ節に比較的少量のmRNAが存在すると、注射部位の筋肉よりも高い割合でコード化された生物発光タンパク質が生成された。著者らはこう述べている:
「導入遺伝子の発現期間と動態は、デリバリーシステムの薬物動態と生体内分布に影響される。mRNA-LNPの薬物動態学的-薬力学的関係は非常に複雑であり、組織におけるLNPの曝露量(薬物動態学)に基づいて遺伝子発現と有効性(薬力学)を予測することは不可能である。[46](112-113頁)。
事実上、脂質ナノ粒子とおそらくそのmRNAペイロードは全身に分布し、遺伝子発現は予測不可能に変化する[5,46,48]。
6.3. 長持ちするシュードウリジンmRNA
天然のメッセンジャーRNAは非常に不安定であるため、ModernaとPfizerのCOVID-19ワクチンに含まれるスパイクタンパク質をコードする合成mRNAは、ウリジンをN1-メチルシュードウリジンに置換することで安定化されている[37]。この介入は、合成mRNAを長期間にわたって過剰に安定化させることが現在知られている[49]。Fertigら[50]は、脂質ナノ粒子とその中に含まれるmRNAが、ワクチン接種後15日経っても血漿中を循環していることを発見した。最近の研究では、ワクチン接種後28日目の血漿中にmRNAが認められた[51]。また、Moderna COVID-19 mRNAワクチンを接種した13人の看護師を対象としたブリガム・アンド・ウィメンズ病院の研究では、S1サブユニットがフルスパイクタンパク質とともにピコモル量で約42~72時間まで再循環していることが確認された[52]。
Röltgenら[53]は、三角筋注射部位の同側の腋窩リンパ節の生殖細胞の細胞質と核にmRNAと遊離スパイクタンパク質の両方が60日間持続することを見出した。スパイク蛋白はワクチン接種後2日まで96%のワクチン接種者の血液中に残存し、1回目の接種後1週間後も63%のワクチン接種者に存在した。2回目の接種後、スパイクタンパク質の検出は「妨げられ・・・おそらく・・・抗スパイク抗体によるものであろう」(1037頁)。しかし、先に示したように、修飾RNA分子は極めて安定であり、細胞内に存在し続け、細胞が免疫系に攻撃されて死滅しない限り、細胞内リボソーム・スパイクタンパク質の産生は持続する。ワクチンによって誘導されたスパイクタンパク質の安定性を決定した研究はないが、ワクチン後心筋炎を起こした若年者の血漿中に、ワクチン接種後19日まで遊離したスパイクタンパク質が循環していることが確認されている[54]。
Röltgenら[53]の発見が意味するところについては、Jikomes[55]のブログで、危険性を示すものとして詳しく述べられている。しかしYongは、この持続性は予想外だったと認めている。医療規制当局はCOVID-19ワクチン展開の初期に、mRNAスパイク蛋白産生の持続は短時間で三角筋に限局すると臨床医と一般大衆に保証していた。これは明らかに事実ではなく、複数の組織型におけるスパイクタンパク質の持続的翻訳の生物学的意味については調査が必要である。
これらの研究結果は、日本の厚生省ファイザー社のラット生体内分布研究[46]におけるmRNA-LNPの14日間の半減期と一致しており、表1に要約されている。
表1.ベクターベースのワクチン成分および/または誘導体スパイクタンパク質の持続性を示した研究。
| 著者 | 成分/組織タイプ/アッセイ技術 | 測定期間 |
|---|---|---|
| 動物 | ||
| ファイザー(日本MoH) 2020年[46] | 血漿および組織中の放射性標識LNP | 140時間~14日 |
| 人間 | ||
| 緒方ら(2021)[52]。 | スパイクタンパク質とS1サブユニット(アッセイ) | 3日 |
| Bansalら(2021)[57]。 | スパイク・プロテイン | 4ヶ月 |
| フェルティッヒら(2022)[50]。 | LNPとmRNA | 15日 |
| レルトゲンら(2022)[53]。 | 同側リンパ節のmRNAとスパイク蛋白; 投与2~7日後に血中 |
60日 |
| 山本ら(2022)[58]。 | 皮膚のスパイク・プロテイン | 3ヶ月 |
| ヨンカーら(2023)[54]。 | 血中スパイク蛋白質 | 心筋炎の場合、1~19日 |
| カストルータら(2023)【51 | 血漿中のmRNA | 28日 |
mRNAワクチンからmRNAを取り込んだ細胞は、mRNAの一部をイオン化可能なカチオン性脂質とともに小さな脂質粒子にパッケージングし、エクソソームとして放出する[59]。他の研究では、スパイクタンパク質が、ファイザーCOVID-19ワクチン接種後少なくとも4ヶ月間、循環エクソソーム中に存在することが判明している[57]。このことは、スパイクタンパク質の持続性が、mRNAの持続性と同様に、in vivoで長期間持続することを示している。水痘帯状疱疹ウイルス(VZV)の帯状疱疹としての再活性化は、COVID-19 mRNAワクチン接種後の最も一般的な皮膚有害事象であり、ワクチン接種3ヵ月後の皮膚病変からスパイク蛋白が検出された症例が報告されている[58]。これらの著者らは次のように推測している:
「COVID-19のmRNAワクチン接種は、免疫系を擾乱することによって持続的なVZVの再活性化を誘導する可能性があるが、発現したスパイクタンパク質が病原性の役割を果たすかどうかは不明であった。[58](抄録)
著者らは、COVID-19ワクチンが免疫系を混乱させる可能性として、脂質ナノ粒子、mRNA中のN1-メチルシュードウリジン、スパイクタンパク質(特にS1サブユニット)、抗体依存性の増強、圧倒的な抗原刺激など、いくつかの可能性を仮定している[58]。多くの文献を精査した結果、これらの懸念には根拠があり、スパイクタンパク質には病原性があることが判明した。
6.4. ナノ粒子毒性学
Wangらは2018年、肺や皮膚から取り込まれた少量のナノ粒子でも細胞毒性作用につながることを示した[60]。摂取された場合、ナノ粒子は主に腸間膜リンパ節、肝臓、脾臓を標的とする。一方、薬剤キャリアとして注射された場合、ナノ粒子はあらゆるバリアを通過し、主にマクロファージによる貪食後に脳、卵巣、精巣に移行し、体全体に分布する。生殖毒性は本総説の範囲を超えている。
生殖系に対するナノ粒子毒性に関与する分子メカニズムは完全には解明されていないが、考えられるメカニズムには、酸化ストレス、アポトーシス、炎症、および活性酸素種(ROS)の誘導による遺伝毒性が含まれ、細胞毒性とDNA損傷をもたらす分子レベルおよび遺伝子レベルでの損傷を引き起こす。
mRNA-LNP複合体において特に懸念されるのは、ALC-0315とALC-0159という2つの独自機能性賦形剤で、医薬品に使用されたことはなく、欧州薬局方にも欧州C&L目録にも登録されていない[61]。2021年12月に欧州議会で行われた質問では、「これらのナノ粒子の製造元であるエシュロンは、これらのナノ粒子は『研究用であり、ヒトには使用しない』と明記している」と指摘された。欧州委員会を代表する回答は、「コミルナティの賦形剤は、関連するEMAの科学的ガイドラインと基準に従って、……適切であることが実証されている」というものであった[62]。このような安心感があるにもかかわらず、製剤中に電解質が存在し、接種前に手作業で希釈していることから、得られる懸濁液の安定性と、そこに含まれるナノ材料の多分散性指数について重大な疑問が投げかけられている。
溶液中のナノ粒子はコロイド系を形成し、その安定性は静電反発によって粒子の凝集を防ぐ。コロイドの安定性を計算するために使用されるパラメータはゼータ電位であり、電荷の二重層によって生成される電位を指す。ゼータ電位が低いと、引力は斥力に勝り、より多くの凝集体が形成される。コロイド二相系の安定性は、比率、処理方法、適切な温度、電解質の存在に依存する不安定なバランスである[63]。塩化ナトリウム溶液で希釈した後、Comirnatyの最終的な比率は、電解質2.61mgに対し、ALC-0315 + ALC-0159はわずか0.48mgである。これは、ゼータ電位の劇的な低下をもたらすだけであり、凝集、凝集、そして最終的には凝集が予測される。体中の毛細血管でナノ粒子が凝集することによって引き起こされるダメージを推測することができる。

コロイド懸濁液がリンパ液や血液中に分散するのに十分な安定性を保てば、ナノ粒子とその毒性負荷は体全体に分布し、血液-脳、血液-胎盤、その他の生物学的障壁を越え、どこに蓄積しても細胞死や炎症を引き起こす可能性が高い。さらに、有毒なナノ粒子を体外に排出するのは容易ではない。5.5nm以下の粒子は、腎臓で糸球体濾過された後、尿路を通って排泄される。より大きな粒子は、理論的には肝胆道を通って分解される可能性があるが、クッパー細胞(常在マクロファージ)などによって結合される傾向があり、その処理はかなり遅くなる[64]。mRNA-LNP複合体の大きさは約100nmで、腎臓から排出できる大きさをはるかに超えている。このことが、肝臓への蓄積と観察された肝毒性を説明できるだろう。
6.5. 脂質ナノ粒子は炎症性である
COVID-19ワクチンに使用されている脂質ナノ粒子は、顕著な炎症性サイトカイン分泌と細胞死を伴うマクロファージ炎症性タンパク質を誘導することが判明している[43]。Ndeupenら[43]は、脂質ナノ粒子のこの炎症促進作用が、COVID-19 mRNAワクチンのワクチンアジュバント免疫原性を高め、有害事象を増加させると指摘している。著者らは、脂質ナノ粒子の広範な生体内分布、したがって臓器や全身にわたる広範で重篤なCOVID-19ワクチンの副作用の可能性を考慮していない。
Trougakisら[65]は、COVID-19 mRNAワクチンの有害事象に関する文献をレビューし、「スパイク仮説」と呼ばれるスパイクタンパク主導の病理学的リスクについて言及している。しかしながら、Trougakisたちは、動物モデル研究から得られた脂質ナノ粒子の炎症促進特性の証拠についてもレビューしている。これらには、「Toll様受容体の活性化、好中球の過剰浸潤、多様な炎症経路の活性化、様々な炎症性サイトカインやケモカインの産生」[65] (544頁)が含まれる。
従って、発現する抗原を変えたとしても、有害事象が生じる可能性は高い。Halmaら[66]は、mRNAと脂質ナノ粒子の成分に加えられた変更、特にポリエチレングリコール(PEG)の添加が、分解に対する耐性を高め、脂質ナノ粒子が生体内分布と生物濃縮を助け、免疫系を回避するのに役立ったと指摘している。生物濃縮は細い血管やリンパ管の閉塞につながる。生体内分布とは、COVID-19 mRNAワクチンで見られたように、脳、胎盤、精巣を含むすべての臓器で細胞死と炎症が起こる可能性があることを意味する[5,44,45,46]。
PEGは一部の人にアナフィラキシー反応を引き起こすことが知られており、これはワクチンの患者向け情報リーフレットに既知の有害事象として記載されている。脂質ナノ粒子でカプセル化されたmRNAは炎症性が高いことに加え、スパイク蛋白に対する抗体はスパイク蛋白を産生する細胞や組織に損傷を与える。どの抗原が産生されても、自己免疫反応では細胞へのダメージが生じる[67]。
内因性タンパク質を産生する細胞に対する自己免疫損傷に関与するメカニズムには、内因性タンパク質に対する交差反応性の発現[68]、免疫介在性毒性[69]、IgG4への切り替えによる免疫寛容[70] などがある。IgG4免疫反応への切り替えは、がん感受性[71]、妊娠[72]、慢性炎症性疾患であるIgG4関連疾患[73]に影響を及ぼす。
もう一つのリスクは、ヒトと獣医の両方の分野でコロナウイルスに対する先行ワクチンで問題となった、抗体依存性増強のリスクである[66]。
6.6. ノババックスCOVID-19ワクチンの毒性と新規脂質ナノ粒子技術
脂質ナノ粒子の生体内分布が有害事象に重要な寄与をしていることは、タンパク質ベースのノババックスCOVID-19ワクチンNuvaxovidの有害事象報告からも示唆されている。このワクチンには脂質ナノ粒子マトリックスという新しい技術があり、フリン切断部位と受容体結合ドメイン部位がそのままで、未修飾のスパイクタンパク質の生体内分布を増加させる可能性がある。生物学的分布に関する研究についての問い合わせに対し、ノババックスは2021年半ばに「ノババックスCOVID-19ワクチンについて薬物動態学的/薬力学的研究は実施されていない」と回答した(私信 Novavax-Parry、2021年7月30日)。
ノババックスCOVID-19ワクチンについては、ニュージーランドを含むいくつかの国で心筋炎の有害事象が報告されており、規制当局は心筋炎に関する「アラートコミュニケーション」を発表している[74] 。このことは、ノババックスCOVID-19ワクチン由来の病原性スパイク蛋白が心臓に到達することがあることを示唆している。全体として、ノババックスCOVID-19ワクチンからの有害事象報告は、遺伝子ベースのワクチンよりも少なく、これはスパイクタンパク質の用量反応効果と一致している。しかし、脂質ナノ粒子マトリックスそのものが心筋炎の報告に関与している可能性がある。
6.7. アストラゼネカCOVID-19ワクチンの生体内分布データ
2022年10月、情報公開請求(MHRA IR07151D)により、英国MHRAに提出されたアストラゼネカの文書が入手された。2020年12月21日付のアストラゼネカの「非臨床試験の概要」によると、アストラゼネカのアデノウイルスDNA COVID-19ワクチンの生物学的分布試験を当初実施しなかった根拠は、ウイルスベクターワクチンの先行研究で三角筋や腋窩リンパ節から遠位臓器への広がりが最小であったことであった[75]:
「筋肉内投与によるAZD1222の生物学的分布は、AdCh63と同様で、注射部位と排出リンパ節に限定されると予想される」。
[75] (p. 13)
しかし、後に発表された2021年4月26日付けのアストラゼネカの「非臨床試験の概要」には、同社のCOVID-19ワクチンに関する新たなマウスの生体内分布試験が含まれており、遠位臓器への生体内分布が明らかにされていた[6]:
「AZD1222ベクターDNAの最高レベル(103~107コピー/μg DNA)は、2日目に筋肉内投与部位および坐骨神経(投与部位に近接)で観察された。2日目の骨髄、肝臓、脾臓および肺では、より低レベルのAZD1222ベクターDNA(<LLOQ~104コピー/μg DNA)が観察された。AZD1222のレベルおよびAZD1222ベクターDNAが検出可能なレベルの組織数は、2日目から29日目にかけて減少し、排除されたことが示された」。
[6] (p. 14)
この文書では、ウイルスベクター自体はアデノウイルスとして複製していないことが強調されているが、身体器官における有毒な外来抗原のタンパク質産生という点については的外れである。このことは、ウイルス-ベクターDNA COVID-19ワクチンが、脂質-ナノ粒子に運ばれた修飾mRNA COVID-19ワクチンよりも少量しか広く生物学的に分布していないことを示唆しているが、アデノベクターDNAワクチンがかなりの量のスパイクタンパク質を産生する能力は残っている。アストラゼネカCOVID-19ワクチンに関連した脳血栓症を伴うワクチン誘発性免疫性血栓性血小板減少症(VITT)の3症例の一連の剖検では、血栓症と脳静脈壁にスパイク蛋白が検出された[7]。著者らは抄録でこう述べている:
「SARS-CoV-2スパイク蛋白が血栓内および隣接血管壁に検出された。データは、ワクチンによって引き起こされた抗スパイク免疫に関連する好中球と補体活性化が、おそらく疾患過程に関与していることを示している。」
6.8. 従来のCOVID-19ワクチンでは高い有害事象報告はなかった
伝統的なワクチン技術のCOVID-19ワクチンは、ほとんどが非西洋諸国で入手可能である[35]。これには、インドのBharat Biotech社[76]のCovaxinや中国のSinovac社[77]のCoronaVacなどの不活化ウイルスワクチン技術が含まれる。
オーストラリアとイランを拠点とする企業が共同開発したSpikogenのような、従来の組み換えタンパク質ベースのCOVID-19ワクチンもある[78,79,80]。Spikogenでは、スパイクタンパク質抗原は、細胞接着と侵入を減少させ、潜在的な毒性を減少させるために、フリン切断部位とRBDを除去して改変されている。16,876人が参加したイランでのスピコゲン第3相臨床試験では、SARS-CoV-2のデルタ型がイランで特に流行した際に、主要評価項目である60%以上の感染防御率を達成した[81,82]。スピコゲンはイランで市販されており、ニュージーランドを含むいくつかの国への渡航が認められている。これまでにイランのファーマコビジランスに報告された重篤な全身性有害事象はなく、800万回投与されている。
従来のCOVID-19ワクチンでは、遺伝子ベースのCOVID-19ワクチンの特徴である高率の有害事象報告はなかった。これは、リスクは全身への生物学的分布とスパイクタンパク質の長期産生にあるというさらなる証拠である。これは、スパイクタンパク質の病原性、そして上述の証拠から、脂質-ナノ粒子キャリアマトリックスの病原性を示している。
6.9. 自己細胞から提示される異物抗原の自己免疫リスク
以上のように、スパイクタンパク質には生来毒性があることが証明されている。たとえそれ自体に毒性がなかったとしても、スパイクタンパク質の外来性によって、自己免疫反応を通じて病態生理学的損傷を引き起こす可能性がある。外来タンパク質のわかりやすい結果である。脂質-ナノ粒子マトリックスは、mRNA遺伝子コードをほとんどの、あるいはすべての臓器の細胞に広く生体内分布させることができる。その後、スパイクタンパク質が細胞表面に、また可溶性タンパク質として臓器や血流中に発現すると、T細胞による細胞や組織の破壊、B細胞による抗体が誘導される。後者はまた、免疫複合体の沈着を引き起こし、III型過敏症を経由して組織をさらに損傷する。
したがって、たとえ「無毒」であったとしても、自己免疫反応によってスパイクタンパク質によって組織損傷が引き起こされる可能性がある。これは三角筋のような筋肉では些細なことであるが、脳、卵巣、心臓のような重要な臓器で起こると、深刻で致命的な有害事象を引き起こす。生体膜を通過する脂質ナノ粒子を介した送達方法-mRNA遺伝子治療-が核心的な問題であり、この技術がこれまで商業的に販売されなかった主な理由である。
モデナ社や他の大手製薬会社が、詳細な調査がなされないまま、他の多くの病気に対する大規模なmRNAワクチン製造を計画していることは、非常に問題である。
6.10. ウイルスとワクチン・スパイクタンパク質の病態生理
新型パンデミック/伝染病ウイルスの自然な経過は、時間の経過とともに感染力が増し、病原性が低下することである。SARS-CoV-2では、オリジナルの武漢株とそれに続くアルファ株や他の初期亜種は病原性が非常に高く、デルタ亜種は感染が広がりやすいが病原性はやや低く、様々なオミクロン亜種は感染力は強いが重症度はさらに低くなっている。特に、オミクロン亜型は下気道よりも上気道を標的としているため、ウイルスとスパイクタンパク質の全身への浸透が少ない[83]。
一方、mRNAワクチンやアデノベクターDNAワクチンでは、ヒト細胞はオリジナルの武漢株スパイクタンパク質をわずかに改変したものを製造する。二価」ブースター用量の中には、オミクロンバリアントスパイクタンパク質の遺伝子コードを追加するものもある[84,85]。この遺伝子コードの生体内分布が広範に及ぶと、一般に天然ウイルスで生じるよりも多くのスパイク・タンパク質が全身的に産生される可能性がある。これは、若くて健康な人であれば誰でも起こりうることである。高齢者や合併症のある人は肺の奥深くや全身に深刻なSARS-CoV-2ウイルス感染を起こすリスクが高いが、若くて健康な人は上気道粘膜でウイルスを排除する傾向がある。したがって、若くて健康な人の場合、エンコーディングに基づくCOVID-19ワクチンは、ウイルスそのものによる感染よりもはるかに多様な組織に感染することになる。
多くの研究で、スパイク・タンパク質は毒性があることが証明されている。Understanding the Pharmacology of COVID-19 mRNA Vaccines:スパイクタンパク質の毒性に関する証拠をレビューした。彼らは、COVID-19 mRNAワクチンは辞書の定義を満たすことから、「プロドラッグ」と表現されるべきだと主張した:「体内で(酵素作用によって)薬理学的に活性な薬物に変換される薬理学的に不活性な物質」。これは、スパイクタンパク質の合成を引き起こすリボソームにおけるmRNAの作用によって起こる[86](p.3)。
CosentinoとMarino(2022)は、mRNAの広範な生物学的分布に関する証拠を検討し、「感受性組織におけるSタンパク質の不適切な発現とその後の組織損傷との間の可能な関連を強く支持する証拠がある」と結論づけた[86](p.2)。
彼らは、スパイクタンパク質の身体組織に対する薬理学的および病態生理学的効果に関する文献をレビューした:
- ACE-2受容体への結合は、「血小板凝集、血栓症、炎症、そして高血圧やその他の心血管系疾患の引き金となる可能性がある」としている。
- CD147膜貫通糖タンパク質が破壊されると、心臓のペリサイトや赤血球の機能が阻害され、心筋炎、溶血性貧血、血液の粘性亢進、そしておそらく神経変性過程を引き起こす可能性がある。
- Toll様受容体2および4(TLR2、TLR4)に結合し、(1)TLR2を介した核因子κB(NF-κB経路)の活性化およびマクロファージ免疫機能の欠損、(2)TLR4を介した肺障害、心筋炎および多臓器障害、による炎症性サイトカインカスケードの増加を介した理論的な病原性効果を持つが、世界の研究コミュニティではまだ適切に調査されていなかった。
- 高親和性エストロゲン受容体α(ERα)への結合は、COVID-19ワクチン接種後によく観察される月経不順の原因である可能性があり、乳がんへの関与の可能性が懸念されている。
- スパイクタンパク質S2サブユニットは、タンパク質p53 BP1およびBRCA1と特異的に相互作用する。p53 BP1はよく確立された腫瘍抑制因子であり、BRCA1は乳癌でも前立腺癌でも頻繁に変異している[87]。
CosentinoとMarinoは、これらの “潜在的な毒性学的問題 “が “販売承認に至った研究において考慮されなかった、まさに…これらの製品が従来のワクチンとして扱われたからである “と指摘したが、実際にはプロドラッグとして作用する遺伝子挿入である[86](p.5)。
In vitroの研究では、スパイクタンパク質(S1ユニット)の受容体結合ドメイン(RBD)が、樹状細胞からの炎症反応を引き起こす最も活性の高い物質であることがわかった[88]。
ヒト肺動脈筋および内皮細胞を全長スパイクタンパク質またはRBD単独で処理したin vitroでのさらなる研究では、この場合、RBDは比較的不活性であるが、全長スパイクタンパク質はタンパク質MEK(マイトジェン活性化プロテインキナーゼキナーゼ)のリン酸化を介して肺血管細胞の肥大を誘導することがわかった[89]。このことは、ヒトACE-2を細胞上に持つトランスジェニックマウスにS1ユニット/RBDを気管内投与したところ、スパイクタンパク質S1ユニットを投与されたマウスの気管支洗浄液中の炎症性サイトカインが劇的に増加したのに対し、対照マウス(生理食塩水気管内投与)ではごくわずかであり、全スパイクタンパク質投与マウスでは軽度で遅発性であったことから、S1(RBD)ユニットの切断がACE-2に関連した病理を増加させることが示された[90]。
ヒトに似たACE-2レセプターとスパイク蛋白S1/RBDユニットを持つように育種したマウスを注射すると、COVID-19に似た急性肺病理が誘発されることがわかった。このことは、オーストラリン-イラン製ワクチンSpikogen[78,79]のように改変されていない限り、スパイク蛋白がSARS-CoV-2呼吸器感染症の重症化の主な原因となる細胞毒素であることを示している[86]。このことは、振り返ってみると、SARS-CoV-2がワクチン開発の目的には特に不適当な選択であったことを意味する。
プレプリントの中で、McKernanら[91]は、mRNAワクチンの薬物動態を定量化し、SARS-CoV-2ウイルスよりも多くのスパイクタンパク質を生成し、COVID-19ウイルス感染に罹患していないほとんどの人々において、より全身的に生成するとしている:
「注射の薬物動態は感染症とは異なる。1回30~100μg(ブーストされたものは90~300μg)のスパイクmRNAを注射すると、1回の注射で13兆~40兆個のmRNA分子が数秒で注入されることになる。このボーラス注射の薬物動態は、数日かけて起こるウイルス複製とは異なる。これらのmRNAがそれぞれ10-100個のスパイクタンパク質を産生することができ、30-40兆個の細胞があるとすれば、自然感染よりもワクチン接種によるスパイクタンパク質の曝露の方が、全身的な量も期間もはるかに長くなる可能性がある」。
[91] (p.12)
抗原のヒト組織産生は、投与量が個人によって異なる可能性が高いことを意味する。これは、個人の遺伝学や生理学、コードにさらされる組織、製品のバッチやバイアルのばらつき、輸送、冷蔵、投与の方法などの理由による。毒物学の原則であるdosis sola facit venenum(用量が毒を作る)の観点からは、この点だけで、mRNAワクチンやウイルスベクターDNAワクチンの安全性に疑問を投げかけるものである。
COVID-19ワクチンが一般に発売された頃、ソーク研究所の研究者たちは、SARS-CoV-2ウイルスが細胞侵入するために宿主細胞上のACE-2レセプターに結合するスパイク蛋白に依存していることを発見した[92]。ACE-2は心臓血管系を保護し、SARS-CoV-2スパイクタンパク質はACE-2のレベルを低下させることで肺の傷害を促進する。ソーク研究所のチームは、ACE-2のダウンレギュレーション、内皮一酸化窒素合成酵素(eNOS)の阻害、ミトコンドリア機能の障害、内皮機能の直接的障害によって、スパイクタンパク質単独で血管内皮細胞に損傷を与えることを示した。
6.11. ニコチン性コリン作動性抗炎症経路の破壊
高用量の毒素様スパイクタンパク質結合ドメイン(RBD)は、アセチルコリン(ACh)誘導性のα7 nAChR応答を阻害する。これらのα7 nACHRの阻害は重大な効果をもたらす。ニコチン性コリン作動性システムは、「コリン作動性抗炎症経路」(CAP)と命名されているが、これはこれらの受容体の活性化が炎症を制御し、その阻害が制御不能な炎症を引き起こすためである。CAPは多面的なネットワークを形成しており、神経細胞と非神経細胞に分布し、全身で多様な機能を発揮している。神経系に加えて、α7 nAChRはリンパ球、単球、マクロファージ、樹状細胞、脂肪細胞、ケラチノサイト、内皮細胞、腸や肺の上皮細胞などの非神経細胞にも発現している。このように広範囲に分布していることから、nAChRは、コリン作動性抗炎症経路を介した、あるいは介さないメカニズムで、重症COVID-19の病態生理に関与している可能性がある[32] 。
迷走神経を介したCNSによる炎症・免疫反応の調節は、免疫系と神経系の双方向コミュニケーションに基づいている。迷走神経の求心性神経線維は孤束核に位置し、炎症の状態についてCNSに感覚的入力を与え、その結果、背側運動核から発せられる求心性信号が伝達され、炎症反応が制御される。このような反応は、拡散性の抗炎症ネットワークとは異なり、迅速かつ局所的である。拡散性の抗炎症ネットワークは、遅く、分布し、統合されておらず、濃度勾配に依存している[32] 。
AChの迷走神経放出を介して活性化されたnACHRは、免疫系ではT細胞、B細胞、マクロファージ、単球、好中球、肥満細胞に存在し、IL-4などの抗炎症性サイトカインを促進する一方で、IL-6などの炎症性サイトカインを減少させるなど、炎症を抑えるように作用する[93] 。SARS-CoV-2によるnAChRの調節異常はまた、交感神経系への対抗を抑制し、その結果、中枢性交感神経駆動と交感神経駆動性サイトカインストームの発生を促進する可能性がある[94]。交感神経の嵐は、活性酸素種(ROS)の生成と炎症性サイトカインの放出を増加させることにより、酸化ストレスと炎症亢進を誘発する。
NAChRは気道にも存在する。α3β4nAChRサブタイプは繊毛機能と粘膜繊毛クリアランスをサポートし、α7nAChR刺激は抗炎症性である。したがって、スパイク蛋白ができるように、これら両方の受容体タイプを阻害することは、急性COVID-19と長期COVIDの両方で見られる肺病理に大きく寄与すると考えられる[95]。
SARS-CoV-2感染によるストレスとnAChR阻害によるコリン作動性経路の抑制は、交感神経系(SNS)を活性化し、神経ホルモン刺激と炎症性サイトカインの活性化を引き起こし、交感神経の嵐をさらに進展させる可能性がある。COVID-19における交感神経の過剰活性化は、毛細血管肺漏出の増加、肺胞損傷、急性呼吸窮迫症候群の発症と相関している。さらに、SARS-CoV-2は肺機械受容器と化学受容器を介して、逆行性に髄質呼吸中枢に伝播し、副交感神経髄質中枢におけるnAChR阻害の結果として、突然の呼吸不全を引き起こす可能性がある[96]。
SARS-CoV-2に感染すると、免疫系が動員される。ウイルスが複製されると、細胞やウイルスの残骸やビリオンがnAChRと相互作用し、コリン作動性抗炎症経路をブロックする可能性がある。初期の免疫反応がウイルスの侵入に対抗するのに十分でない場合、ウイルスの複製が広範囲かつ長期化すると、最終的にコリン作動性抗炎症経路が破壊され、免疫反応を制御・調節する能力が著しく損なわれる。炎症性サイトカインの制御不能な作用によりサイトカインストームが発症し、急性肺障害や急性呼吸窮迫症候群(ARDS)、凝固障害、多臓器不全が生じる。この仮説に基づくと、COVID-19は最終的にはニコチン性コリン作動性システムの疾患となるようである[92]。
この同じメカニズムで、長期にわたるCOVIDとCOVID-19ワクチン傷害で経験される症状の幅と重症度の両方を説明することができる。前者ではスパイク蛋白とウイルスの除去に失敗し、制御不能な免疫活性化と後遺症が見られるが[97]、後者のワクチン傷害では、スパイク蛋白がシステムを圧倒し、数ヶ月にわたって産生され、その後の注射ごとに負荷が増加する。これはまた、α7 nAChRアゴニストやポジティブアロステリックモジュレーター(PAMS)による介入の可能性を示すメカニズムでもある。
7. スパイク病の証拠-スパイクタンパク質の病原性
SARS-CoV-2のスパイクタンパク質は病原性であることが判明した。その病理学的作用は結核のように無数に存在し、体内の器官に広く及び、無数の既知の疾患や症候群を誘発するようであるため、「スパイク病」という言葉が作られた[98]。この用語は、インターネット上では “spikeopathy “と綴られており、私たちもその綴りを選択している。
図6は、FDAが遺伝子ベースのCOVID-19ワクチンの公表前にこの可能性を認識していたことを示している。これは、「ワクチンおよび関連生物学的製剤諮問委員会(VRBPAC)2020年10月22日会議」のパワーポイントプレゼンテーションの16枚目のスライドである[99]。目を見張るのは、これらのほとんどが神経系、心臓血管系、自己免疫系の “起こりうる有害事象 “であり、VAERSやその他の世界的なワクチン傷害データベースに報告されたものとの予測精度である。

図6スライド16 FDAのVRBPAC会議(2022年10月)[99]。
ウェブサイトwww.react19.org、2023年6月現在、20以上の臓器系と症候群の見出しの下に、COVID-19ワクチンの害に関する3400以上の発表論文と症例報告がリストアップされている[100]。ここでは、COVID-19 mRNAとアデノベクターDNA産生スパイクタンパク質の病原作用に関連して、いくつかの主要な臓器系について概説する。
7.1. 心血管系の病態
COVID-19ワクチンの心血管系への害に関する文献が蓄積されている。例えば、2023年6月現在、react19.orgの “Cardiac “の見出しには、心筋炎、心筋症、心筋梗塞、高血圧、大動脈解離、姿勢起立性頻脈症候群(POTS)、頻脈、伝導障害に関する432の査読論文と症例報告が掲載されている[100]。
7.1.1. 心筋炎と心膜炎
心筋炎と心膜炎に関する報告は特に多い。Yonkerら[54]は、ワクチン接種後に心筋炎を発症した16人の青年および若年成人の血液中に遊離スパイク蛋白を発見したが、心筋炎を発症していないワクチン接種後の年齢をマッチさせた45人の対照群では発見しなかった。著者らは、COVID-19 mRNAワクチン接種後に心筋炎を発症した若年者の免疫プロファイルと遊離スパイク蛋白血漿中濃度を調べた。心筋炎患者では対照群と比較して、抗体と結合していない全長遊離スパイク蛋白濃度が有意に上昇していた。抗体プロファイルとT細胞応答は、心筋炎患者と慎重に年齢をマッチさせた対照群との間で同様であったが、mRNAワクチン接種の合併症として心筋炎に見られるばらつきの一部は、より大きな転写と血中への分泌を達成するものがあるという事実によって説明できるかもしれない。このことは、このような心筋炎の症例における遊離スパイク蛋白の病原性について重大な懸念を抱かせる。
Avolioら[101] は、ウイルスから分離された遊離のSARS-CoV-2スパイクタンパク質が、CD147レセプター結合を介して炎症性サイトカイン産生に関与する心臓周皮細胞の刺激など、いくつかの機序を介して微小血管障害を引き起こす可能性があることを発見した。スパイクタンパク質の病原性を示すさらなる証拠は、スパイクタンパク質が誘発する心臓の線維化と心筋収縮障害がCOVID-19関連心筋症の根底にある可能性を示すマウス研究によるものである[102]。
天然痘ワクチンなどでみられる過敏性心筋炎とは対照的に、COVID-19ワクチン関連心筋炎が実際には自己免疫性である可能性について、Baumeierら[103] は心筋内生検(EMB)を行った15症例を記載したシリーズで考察している。他の研究や症例報告と同様に、リンパ球浸潤は心内スパイク発現と関連して見られた(ただし、著者らは脂質ナノ粒子の生体内分布特性には特に言及していない)。
Barmadaら[104]は、Yonkerら[54]とBaumeierら[103]の所見を踏まえて、エール大学の最近の研究で、スパイク誘発分子模倣が自己免疫性心筋梗塞の原動力であるかどうかを検討している。彼らは血清研究において、自己抗体の「迅速細胞外抗原プロファイリングスクリーン」であるREAPを用いることにより、この可能性を効果的に除外している。彼らはさらに、サブグループにおける血清サイトカインプロファイルと他の炎症マーカーを参照して、”サイトカイノパシー “を仮定しているが、スパイク蛋白の血中濃度は報告していないし、心筋組織も入手していない。
以上のことから、mRNAワクチン接種後に顕著に見られる心筋の炎症については、まだ多くの実験的研究が必要であるが、スパイクタンパクが一役買っているようである。分子模倣が原因ではないが、心筋に発現あるいは沈着したスパイクタンパク質の存在に対する免疫系の反応に加えて、スパイクタンパク質の直接的な毒性作用が関与している可能性がある。アストラゼネカとジョンソン・エンド・ジョンソンのアデノベクターDNA COVID-19ワクチン、およびノババックスのタンパク質ベースの脂質ナノ粒子埋め込み型ワクチンが原因であると報告されていることから、心筋炎がスパイクパチーによって誘発されることが示唆される[105,106]。
COVID-19ワクチン誘発心筋炎・心膜炎はどの程度一般的か?ベースラインとして、SARS-CoV-2パンデミック前夜の2020年1月7日に発表された研究が報告している:「ウイルス性心筋炎の発症率は10万人あたり10〜22人である[107]。」
地域疫学的発生率に関しては、New England Journal of Medicine誌の総説[108]は、年間発生率は調査のレベルによって異なると指摘している:
「COVID-19のパンデミック以前は、心筋炎の世界的な発生率は年間10万人あたり1〜10例と推定されていた(12)。最もリスクが高かったのは20〜40歳、男性で、男性10万人当たり6.1例、女性10万人当たり4.4例であった。心臓MRIの使用増加により、米国で報告されている心筋炎の発生率は10万人あたり9.5例から14.4例へと徐々に増加している。
[108] (p. 1488)
FDA、TGA、その他の規制当局などの保健当局は、COVID-19ワクチン接種後の心筋炎は非常にまれであると主張している。ファイザー社またはモデナ社のCOVID-19ワクチンを少なくとも1回接種したカリフォルニア州のカイザー・パーマネンテ保険加入成人239万人を対象とした初期の研究では、ワクチン接種後に心筋炎を発症した症例はわずか15例で、すべて男性、平均年齢25歳であった[109] 。しかし、症例はKaiser Permanenteの予防接種委員会への医師の報告、またはワクチン接種後10日以内の入院症例に基づいていた。軽症例は見逃された可能性があり、医師が必ずしも委員会に症例を報告していない可能性もある。
2022年3月16日までの米国VAERS、英国イエローカード、EU EudraVigilanceデータベースへのファーマコビジランス報告のシステマティックレビューでは、18,204件の心筋炎および/または心膜炎の報告事象があり、一部は致死的であった[110]。何億人ものワクチン接種者がいることを考えると、著者らは、これはまれな事象であると指摘している。
FDAは、COVID-19 mRNAワクチンによる心筋炎や心膜炎のリスクは、特に2回目以降の若い男性において、現実に存在することを認めたが、まだまれであると判断し、VAERSに由来する10万人あたり6.5人、思春期の男子では10万人あたり最大20人という数字を引用した[111]。FDAは、自らのFAERS(FDA Adverse Event Report System)やCDCのVAERSのようなファーマコビジランス・データベースには大きな過少報告要因があることを計算していない。
このFDAのファーマコビジランスに由来する推定値や他の推定値に共通する要因は、受動的通知システムにおける過少報告という長年の問題に言及していないことである。ファーマコビジランスのデータベースは、FDAのFAERSやCDCのVAERSのように、大きな過少報告要因があることが認められている。過少報告要因がどの程度大きいかについては議論の余地がある。
心筋炎における過少報告の現象をさらに悪化させているのは、この診断が難しく、しばしば専門ユニット、心臓MRI施設、心筋内生検(EMB)の有無に左右されることである。心筋炎の診断は心筋梗塞に似ることもあり、誤診されることもある。この点に関して、Baumeierらの論文[103](本論文で後述)では、病歴と他の原因因子の除外に基づいてワクチン関連と分類され、組織学的に心筋炎が確認された症例の3分の1は、心臓MRIで心筋炎の証拠がなかったと述べている。さらに、心筋炎の多くの症例は不顕性であり、急性期には見逃される可能性がある。しかし、心筋の軽微な線維化や瘢痕化でさえ不整脈原性病巣を形成する可能性があり、後に重篤で致死的な不整脈を呈するか、さもなければ最終的に心不全(いわゆる炎症性心筋症)に至る可能性があるため、常に良性の経過をたどるとは限らない[112] 。したがって、ワクチン関連心筋炎の正確な発生頻度は不明であると言うのが合理的である:症例は不顕性であったり、見逃されたり、誤分類されたりすることがあり、専門的な画像診断でさえ過小診断することがある。
潜在性心筋炎、あるいは少なくとも心筋病変がどれほど一般的であるかを示す指標として、タイで行われた前向き研究がある。心疾患の既往歴のない青少年(n=301)を対象に、ベースライン時およびファイザーmRNA COVID-19ワクチン2回目接種後3日目、7日目、14日目に、心臓バイオマーカー(トロポニンT、クレアチニンキナーゼバンド(CK-MB))、心電図、心エコー検査、心症状の日記を行った[113]。対照群はなかったが、日記、身体診察、心電図の結果は、「頻脈(7.64%)、息切れ(6.64%)、動悸(4.32%)、高血圧(3.99%)」(p.4)という懸念すべきものであった。54人の青年(18%)に心電図異常がみられた。トロポニンの上昇は5人の青年にみられ、心エコー検査で3人の青年に心嚢液貯留が検出され、1人の青年に心筋炎の徴候がみられたためICUに入室した。2回目のワクチン接種後に心筋炎、潜在性心筋炎、心膜炎を呈した」青少年は合計7人であったが、集中治療室に入院した青少年を除けば、他の6人の症例は潜在性または軽度であり、この厳密な前向き研究がなければ容易に見逃されていた[113] (p.8, Table 3)。
この方法論的に優れたタイの研究は、完全な原稿としては再現されていないようだが、学会抄録では、より単純な方法論で同等の結果が示唆されている[114] 。2021年後半から2022年前半にCOVID-19ブースターワクチン接種を受けたバーゼル大学病院の医療従事者777人のうち、22人(2.8%)に心筋壊死(トロポニン血症)の証拠が検出され、Moderna COVID-19 mRNA-1273ブースター注射以外の原因は認められなかった[114]。2回目のmRNAワクチン接種を受けた別の集団ではありますが、タイの研究では心筋炎または心膜炎の発生率が2.3%であったと報告している。数十億回接種されたことを考えると、これは10万人あたり2300例に相当する。すべての症例が男性であったため、その割合は男性の青年で3.5%であった[113]。
公衆衛生当局の説明では、COVID-19ワクチンによる心筋炎は軽症で自己限定的であるが、症状的にはそうかもしれないが、これらの若い心臓の病理学的変化は持続的であるという証拠がある。イタリアの研究では、mRNAワクチン後に誘発された心筋炎、心筋炎、心膜炎の13症例(年齢中央値15歳)を12週間追跡調査した。1例を除くすべての症例で明らかな症状は消失したが、13例の青年のうち12例では心嚢液貯留がみられ、心臓MRI検査を受けた9例のうち6例では、試験終了時に「心筋傷害が減少したものの持続している」徴候がみられた[115]。
COVID-19ワクチンの登場以来、若者や若年から中年の成人における突然死の流行の説明として、ストレス下で後に不整脈の病巣となる心線維症を誘発する潜在性心筋炎が考えられる[116,117]。この可能性は、ワクチン展開の初期にTGAによって指摘されていた[118]:
「心筋炎の軽症例であっても、不整脈などの長期的な後遺症を引き起こす可能性がある。…現在までに分析されたmRNA COVID-19ワクチン(ファイザーとモデナの両方)接種後の心筋炎および/または心膜炎の症例の大部分は、年長の青年および若年成人(16~30歳)で発生しており、若年男性では投与2日後の数日間に最も高いリスクがありました。」
[118] (p. 8)
7.1.2. スパイクタンパク質の血栓効果
心筋炎の病態とは少し異なるが、COVID-19ワクチンによって誘導されたスパイクタンパク質のACE-2受容体への結合は、血小板凝集、血栓症、炎症を誘発し、血栓を引き起こす可能性がある[119,120]。Angeliら[99]は、これらの病態生理学的効果への生化学的経路を要約している:
ワクチンによって以前に標的とされた破壊された細胞から放出された”遊離浮遊スパイクタンパク質 “は、他の細胞のACE-2と相互作用し、それによってACE-2の内在化と分解を促進するかもしれない(16,79)。このメカニズムは、ACE-2レセプター活性の喪失を通じて、Ang-IIの過剰活性とAng-1-7の欠乏の不均衡を高め、炎症、血栓症、血圧上昇、その他の有害反応(COVID-19ワクチンの「スパイク効果」)の引き金となる可能性がある(80,81)。さらに、他のアンジオテンシナーゼ(POPとPRCP)の欠乏がBP、血栓症、炎症に及ぼす有害な影響は十分に支持されている。
[120] (p. 24)
著者らは、このような血液凝固作用が若い患者でより一般的であるメカニズムについて述べている。アンジオテンシナーゼ・プロリルオリゴペプチダーゼ(POP)とプロリルカルボキシペプチダーゼ(PRCP)は、心血管系疾患を持つ高齢者では欠損しており、逆説的ではあるが、このことはスパイク蛋白が誘発する心血管系の病態に対する感受性を低下させる:
「若く健康な被験者におけるPOPとPRCPの相対的な欠乏は、ACE-2の内在化、ダウンレギュレーション、およびフリーフローティングなスパイクタンパク質相互作用による機能不全を相殺せず、その結果、Ang-IIの蓄積や副作用(COVID-19ワクチンの「スパイク効果」)のリスクが増大する。
[120] (p. 26)
彼らはまた、SARS-CoV-2感染や事前のワクチン接種による既存の免疫が、血小板、内皮血管細胞、筋細胞などの細胞によるタンパク質産生を急増させる免疫反応を誘導し、炎症と血栓形成活性の亢進をもたらすと提唱している。Angeliら[119] は次のように結論している:
第III相臨床試験では一般的に、過去に予防接種を受けたことのある参加者は除外されているが、実生活における膨大な集団へのワクチン接種は、必然的に既存の免疫を持つ個人を含むことになる。そのため、時折、炎症反応や血栓反応が過剰に増強される可能性がある。この分野での更なる研究が早急に必要である。
ライブ電子顕微鏡により、遊離のスパイクタンパク質が、フィロポディア誘導を介して血小板の変形と凝固を引き起こし、スパイクタンパク質が血小板インテグリンと相互作用して凝固障害を引き起こすことが示されている[121] 。パンデミックの初期に、トランスジェニックヒトACE-2受容体血小板を輸血したマウスは、スパイク蛋白が血小板上のACE-2受容体と結合することによって血栓を発症した[1]。著者らはこう述べている:
「SARS-CoV-2とそのスパイクタンパク質は血小板を直接刺激し、凝固因子の放出、炎症因子の分泌、白血球-血小板凝集塊の形成を促進した。」
[1](抄録)
スパイクタンパク質はまた、「アンチトロンビンおよびヘパリン補酵素IIのヘパリン/HSへの結合を競合的に阻害し、トロンビン活性の異常な上昇を引き起こす」ことも発見された[122]。別のマウス研究では、スパイクタンパク質は「血液凝固因子のフィブリノーゲンと結合し、炎症促進活性を高めた構造的に異常な血栓を誘導する」こと、また「スパイクは線溶を遅延させる」ことも発見された[123](前掲書)。
マルセイユにあるMéditerranée感染研究所のフランスの研究者らは、SARS-CoV-2武漢型、アルファ型、デルタ型、オミクロンBA.1型のスパイクタンパク質の赤血球(赤血球)に対する影響をin vitroで調べた。その結果、スパイクタンパク質は赤血球の凝集(凝集塊化)を誘導し、omicron BA.1変異体は0.13ng/μLまでの低濃度で、それ以前の変異体は0.13ng/μLまでの濃度でこれを達成した。作用機序は分子モデリングにより、スパイクタンパク質のプラス電荷が、マイナスに帯電した赤血球の自然な静電反発を減少させるためと推測された。興味深いことに、イベルメクチンをin vitro溶液に添加すると、スパイク・タンパク質と強く結合し、スパイク・タンパク質を添加する前か後に添加するかによって、血球凝集を阻止または逆転させた。著者らは、ワクチン副作用の治療への影響を指摘している[124]。
他の真核細胞の形質膜と内膜は、陰イオンと陽イオンが細胞膜の両側で膜電位を駆動する電流ループとして機能すると考えることができる[125,126]。赤血球のユニークなデザインはトロイダルであり、電流はトーラスの表面にも流れる。赤血球膜表面上のこの静的な流れが、表面膜の負電荷とスターン層との間の分離不足によって妨げられると、ゼータ電位の弱体化によって、形状の歪み、電気誘電率の低下、粘度の上昇、凝集、レオロジー的変化が起こる[127]。この表面電流の流れが静的で、プラスに帯電したスターン層とマイナスの表面膜電荷が効率的に分離されると、ゼータ電位が増強され、赤血球の大きさ、形状、割合、曲率が最適な形状に変化する。赤血球は、酸素(O2)分子を効率的に運搬し、二酸化炭素(CO2)分子を取り込むために、両凹円盤状の形状を維持しなければならない[128]。したがって、プラスに帯電したスパイクタンパク質をマイナスに帯電した赤血球膜に挿入すると、赤血球の形と機能が大きく変化することが予想される。
COVID-19ワクチン接種による血栓性合併症には、内皮細胞障害、免疫反応、レニン-アンジオテンシン-アルドステロン系の調節障害、血栓-炎症など多くの潜在的機序が関与している。さらに、血小板はアセチルコリンを含み、α7nAchRを発現している。アセチルコリンは内因性の血小板凝集抑制因子として働く。造血系α7nAchRの欠損は血小板の活性化を亢進させるが、実験的研究ではα7nAchR刺激は一酸化窒素(NO)レベルの上昇を介して炎症性状態を減少させ、血小板の反応性を調節することができる。したがって、SARS-CoV-2による血小板nAChRの阻害は、COVID-19やワクチン傷害の特徴である血小板の過剰反応性と血栓症を促進する[129] 。
これらのメカニズムは、遺伝子ベースのCOVID-19ワクチンによって産生されたウイルスとスパイクタンパク質の両方に対する凝固を説明するものであろう。また、自然免疫を否定し、COVID-19ワクチン接種とブースター・プログラムを義務付けた公衆衛生政策が、若年層や非高齢層をより大きなリスクにさらしていることも示唆している。このような危害リスクの増加を説明するために、失明症例がファーマコビジランス・データベースに報告されており、2020年1月1日から2022年12月31日までの米国における網膜血管閉塞症診断に関する最近の大規模研究では、Moderna、Pfizer、AstraZenecaのCOVID-19ワクチンを接種したCOVID-19ワクチン接種者は、未接種の米国人と比較してハザード比2.19のリスク増加が認められた[130]。
7.1.3. ワクチン誘発性免疫性血小板減少症(VITT)
上記のような心筋炎や血栓形成におけるスパイクタンパク質の役割とは対照的に、アストラゼネカやジョンソン・エンド・ジョンソンのアデノベクターDNAワクチン、およびアデノベクターDNAロシアSputnik Vワクチン[131]でみられるワクチン誘発性免疫性血小板減少症(VITT)は、抗PF4血小板抗体を介するまれな病態である。これはスパイクタンパク質とは無関係のようで、アデノベクターDNA技術の他のコンポーネントが研究されている[132]。これらのワクチンがほとんど市場から撤退しているのに対し、病態生理学的メカニズムは異なるものの、同様の問題を抱えるmRNA COVID-19ワクチンが撤退していないのは奇妙である。
VITTの病態における抗PF4抗体の存在に加えて、多くの著者が、アデノウイルスベクターワクチンで観察される血栓症の基礎として、スパイク蛋白血症とは無関係に、NETosis(好中球細胞外トラップ)の役割を示す証拠について論じている[133,134]。興味深いことに、TalottaとRobertsonは、NETosisがmRNAワクチンの血栓性結果にも関与している可能性について論じており、例えば、裸のRNAがLNPベクターの枠を抜け出して血流に漏れると、NETosisの引き金として作用する可能性があることを指摘している[135]。
7.2. 自己免疫疾患
ワクチン発売に先立つ2020年、ライオンズ-ワイラー氏は、スパイクタンパク質を含むCOVID-19タンパク質の3分の1以上が、ヒト免疫系の主要タンパク質と問題のある相同性を示すことを示唆した。したがって、これらのタンパク質に対する自己免疫反応の可能性がある。Vojdaniら[9]はLyons-Weilerを引用し、さらにエピトープマッピングを行い、モノクローナル抗SARS-CoV-2スパイクタンパク質抗体と核蛋白質抗体をin vitroで55のヒト組織抗原に適用した。その結果、SARS-CoV-2抗体は28の組織抗原と反応し、「COVID-19の多系統疾患プロセスに関与している」(要旨)可能性が高く、自己免疫疾患を誘発または悪化させる可能性があることがわかった。彼らの論文は2020年10月に提出され、ワクチンが自己免疫関連疾患を引き起こした歴史的前例に言及し、「十分に吟味されていないワクチンは、将来COVID-19からの自由と自己免疫攻撃を引き換えにすることになるかもしれない」(p.2)と懸念を表明した。
Vojdaniたちは、28の抗原が分子模倣性/共通相同性と反応性を持つことを発見した:
「腸とバリアタンパク質、胃腸系細胞、甲状腺、神経系、心臓、関節、皮膚、筋肉、ミトコンドリア、肝臓疾患」。
[9] (p. 5)
Khavinsonらは、「SARS-CoV-2とヒトのタンパク質の相同性」と題する論文の中で、ヒトのタンパク質と相同性のあるヘプタマーやオクタマーが20個以上見つかり、そのうちのいくつかはSARS-CoV-2のスパイクタンパク質の長さ方向に長く融合していることがわかった[136]。彼らは、「構造の類似性から、免疫反応の一部は宿主生物のタンパク質に向けられるだろう」と指摘した(p.1)。
Kelleniは、血小板減少症、心筋炎、免疫誘発性血栓症や血栓塞栓症などの自己免疫疾患を誘発するワクチンの潜在的リスクについて報告している。
最近では、サウジアラビアのグループがCOVID-19ワクチン接種後に自己免疫疾患が明らかに臨床的に出現することを発見した。COVID-19ワクチン接種後に新規に発症した一連の自己免疫疾患のみが報告されている。ワクチン接種から新規発症までの平均期間は7日であった。症例には、血管炎、神経疾患、全身性エリテマトーデス、炎症性関節炎、シェーグレン症候群の症例が含まれた[138] 。Rodríguezらによる系統的レビューでは、COVID-19ワクチン接種後の自己免疫疾患の新規または再発について、発表された464の報告から928例が記録されている[139] 。著者らは次のように指摘している:
「ワクチン接種後の新規発症に関連する最も一般的な疾患は、免疫性血小板減少症、心筋炎、ギラン・バレー症候群であった。対照的に、免疫性血小板減少症、乾癬、IgA腎症、全身性エリテマトーデスは再発エピソードに関連する最も一般的な疾患であった」。
[139](抄録)
Rodríguezらの総説以来、査読を受けた症例報告が続々と登場している。少ないサンプルではあるが、COVID-19ワクチンに起因するとされる自己免疫性皮膚疾患や血管障害があり、その中には「原因と思われる」IgA天疱瘡がアストラゼネカのCOVID-19ワクチンであったものも含まれている[140];mRNAのCOVID-19ワクチン後に表皮基底膜領域に対するIgGおよびIgM自己抗体を伴う自己免疫性水疱症[141]; COVID-19ワクチン後に「四肢痛、発熱、肺塞栓症、多発性皮下結節および血腫」を伴った32歳男性の結節性多発動脈炎[142] 。
自己免疫関連の甲状腺と腎臓の症例報告には、ファイザーCOVID-19ワクチン2回目接種後のバセドウ病[143] とモデナCOVID-19ワクチン3回目接種後の「急速進行性IgA腎症」[144] がある。78歳の女性が2回目のファイザーCOVID-19ワクチン接種後にIgG4関連唾液腺炎と自己免疫性膵炎を発症したことから、著者らは次のように結論づけた:「mRNAワクチンの使用には、ヒトの免疫系への影響に関してより多くの研究が必要である」
23歳の女性が、15日前に3回目のファイザー社製COVID-19ワクチンを接種後、肉芽腫性前部ぶどう膜炎という形で眼自己免疫反応を起こした[146]。著者らは次のようにコメントしている:
「エピトープに対する適応的体液性免疫反応と多特異的細胞性免疫反応の結果としての分子模倣を介したぶどう膜組織における自己免疫反応が、この患者におけるワクチン後ぶどう膜炎の潜在的なメカニズムである可能性がある」。
(p. 1034)
日本の15歳の少女におけるCOVID-19ワクチン接種後の肝炎関連再生不良性貧血(HAAA)の症例報告[147]は、Talotta[148]を引用し、次のように推測した:
「mRNAワクチン接種が自己免疫疾患発症の引き金となる発症機序はまだ不明である。mRNAワクチン接種は、スパイクタンパク質に対する抗体と自己抗原との間の交差反応性を引き起こす可能性があり、また免疫反応を活性化し、インターフェロンIやその他の炎症性サイトカインやケモカインの産生につながる可能性もある」。
[148] (p. 3)
遺伝子ベースのCOVID-19ワクチンによるスパイクタンパク質の長期産生、反復的なブースター投与、SARS-CoV-2感染の再発に見られるような、免疫の反復的抗原刺激により、IgG4レベルが正常レベルの480倍以上に上昇することが確認されている[149,150]。このIgGクラスのシフトは、心臓突然死に関連する重篤な疾患病態と関連する可能性がある[151,152]。
また、全身病変を伴うMikulicz症候群、膵肝胆道疾患、頭頸部疾患、後腹膜線維症/大動脈炎[153,154,155,156] 、リンパ節腫脹、唾液腺炎、涙腺炎とも関連している、自己免疫性膵炎、大動脈周囲炎/後腹膜線維症、前立腺炎、硬化性胆管炎、副鼻腔炎、炎症性偽腫瘍、縦隔線維症、皮膚病変、硬化性甲状腺炎、下垂体炎、睾丸炎、大腸炎[157,158,159,160] などがある。
スパイクタンパク質と潜在的に脂質ナノ粒子のこのような広範な自己免疫作用と炎症促進作用は、「スパイクパチー」が結核に似たもう一つの「偉大な擬態」であることを示しており、根本的な病因の診断を困難にしている[161]。
7.3. 神経疾患
遺伝子ベースのCOVID-19ワクチンから、ファイザー社自身の市販後調査[162,163]を含むファーマコビジランス・データベースに報告された有害事象の中で最も多いグループは、心血管系ではなく神経系である。神経変性疾患の加速を伴う神経症状と認知機能の低下は、急性COVID-19、ワクチン接種による傷害、そしてある程度長期にわたるCOVIDの特徴である[164]。
スパイクタンパク質を作るmRNAの脂質ナノ粒子担体は血液脳関門を通過するため、直接的な神経毒性作用が可能である[43]。COVID-19ワクチン接種後に血液脳関門(BBB)不透過性の喪失が証明されており[165]、スパイクタンパク質S1はBBBを通過して脳実質に移行することができる[166,167]。脳内皮細胞(BBBの構成要素)のin vitro細胞培養実験では、S1サブユニット(RBD)が内皮細胞のACE-2に結合してBBBを通過することが示された。S1サブユニットはミトコンドリア障害と相関し、細胞核にも侵入した。著者らは、S1サブユニットが遺伝子発現を阻害する可能性があると推測した。
7.3.1. 神経血管学的および神経免疫学的側面
この病態生理学は、中枢神経系と末梢神経系における血管病態と自己免疫病態を介したものである可能性が高い。スパイクタンパク質は、in vitroのヒト細胞培養で、ACE-2の発現を増加させることによって脳血管周皮細胞の制御を異常にし、これらの細胞が脳血管系を裏打ちし、低酸素によって悪化する「強力な炎症反応」と同様に、「収縮性および筋線維形成性の表現型」を採用することが発見されている[169]。
さらにマウスの実験では、スパイクタンパク質を脳に注入することで、TLR4が介在する神経炎症と海馬のミクログリオーシスを引き起こし、関連する記憶機能障害を引き起こした。ヒトでは、COVID-19後の認知機能障害は、特定のTLR4遺伝子型により起こりやすいことが指摘された[170]。これは、マウスの海馬にS1サブユニット(RBD)を注入すると、細胞死とグリア活性化が引き起こされ、マウスは認知障害と不安様行動を示すという同様のマウス実験結果を再現したものである[171]。
Tillmanら(2023)[172]は、SARS-CoV-2スパイクタンパク質のS1サブユニットとS2サブユニットを、スパイクネックにあるらせんモチーフを介して共発現させると、機能的α7 nAChRの大幅なダウンレギュレーションが起こり、「精神神経疾患に関与し、コリン作動性抗炎症経路を破壊する」(p.689)と述べている。ドイツの研究者たち[173](preprint)は、スパイクタンパク質のS1ユニットを静脈注射したマウスを解剖し、ヒトの剖検頭骨を調べた。その結果、卵巣や精巣を含むほとんどの臓器の細胞にS1ユニットが結合していることがわかった。脳では、対照群と比較して、頭蓋骨の骨髄、髄膜、脳実質において、ACE-2レセプターの発現が知られているように、S1の存在がタンパク質の発現の差に関連していることがわかった。S1は、マウスとヒトの両方で、頭蓋骨髄と髄膜をつなぐチャネル(SMC)を含む脳の様々な領域に見られた。このことから、S1タンパク質は、貪食細胞や血管からの直接の浸潤による分布に加えて、頭蓋骨を通る経路としてこれらのチャネルを利用している可能性が示唆される。S1タンパク質は脊髄だけでなく、脛骨や大腿骨の骨髄にも蓄積していた。
ヒトのプロテオミクスデータを用いて、著者らは、注射後の既知の凝固障害と一致する補体および凝固カスケードの調節異常を発見した。好中球に関連する経路は調節異常であり、いくつかのタンパク質は発現を増加させ、他のタンパク質は発現を減少させた。発現が増加したものの中には、インターフェロン-γ(IFN-γ)やIFN-γがC-X-Cモチーフ・ケモカイン・リガンド10(CXCL10)というタンパク質を誘導するような炎症に関連したタンパク質があった。その他のタンパク質の変化は、好中球細胞外トラップ(NETosis)形成、好中球脱顆粒、ホスファチジルイノシトール3-キナーゼ/プロテインキナーゼB(PI3K-AKT)経路に関与していた。髄膜では、上昇したタンパク質は血小板の活性化、シグナル伝達、凝集にも関連していた。脳の大脳皮質では、リボソームタンパク質のレベルが変化し、神経変性経路の調節異常がみられた。血漿中サイトカインレベルと血漿中IL-6はスパイクS1注射3日後に上昇した。
S1ユニットのスパイクタンパク質をマウスに実験的に注射したほか、COVID-19以外の病気で死亡した患者34人を剖検し、そのうちの10人の頭蓋骨にスパイクタンパク質が残存していることを発見し、これらが髄膜を介して脳実質に広がり、長いCOVID症状に関与している可能性を指摘した。要約すると、スパイクタンパク質は脳の様々な部位に蓄積し、死後もそこに存在し、ミクログリアの活性化、α7nAChRの遮断、凝固・好中球関連経路の調節異常、炎症性蛋白質のアップレギュレーションを引き起こし、これらすべてが記憶喪失、脳の炎症、細胞死に関係している[173]。
注目すべきは、SARS-CoV-2ウイルス感染、特に初期の変異型は嗅覚障害を引き起こす可能性があり、嗅神経に対する神経毒性を示すことである。ウイルスと遺伝子ベースのCOVID-19ワクチンの神経毒性作用のメカニズムは現在も研究中である。
Olajideら[174]は、SARS-CoV-2スパイク糖タンパク質がミクログリアへの影響を介して神経炎症を誘導することを提唱した:
「ミクログリアにおけるこのタンパク質による神経炎症の誘導は、NF-κBとp38 MAPKの活性化を介しており、おそらくTLR4の活性化の結果であろう。」
[174] (要旨、445ページ)
「S1によるBV-2ミクログリアの活性化は、神経炎症の特徴であるTNF-α、IL-6、IL-1βの放出の増加をもたらした。スパイクS1タンパク質による神経炎症プロセスの活性化は、ミクログリアにおける同タンパク質によるiNOSを介したNO産生の増加を示す結果によってさらに確認された。iNOS/NOの上昇は、アルツハイマー病、パーキンソン病、多発性硬化症、てんかん、片頭痛など、さまざまな中枢神経系疾患に関連している」。
[174] (p. 452-453)
細胞培養のin vitro実験において、スパイクタンパク質はα-シヌクレイン(α-Syn)の発現を増加させることが示唆されている。α-Synは凝集しやすいタンパク質であり、パーキンソン病やレビー小体型認知症、その他の神経変性疾患患者の脳に見られる特徴的な病変であるレビー小体の発症にさらに関与している[175]。
Winklerら[176]は、ヒトACE-2を気管と肺に発現させたマウスモデルで、SARS-CoV-2を経鼻曝露することにより、軽度の呼吸器COVID-19を引き起こした。彼らは脳にSARSCoV-2を検出しなかったが、脳脊髄液と血清中のケモカインレベルの上昇と同様に神経炎症の徴候を発見した。これらの変化により、皮質下および海馬の白質領域でミクログリアが活性化した。ミクログリアは一般に中枢神経系のマクロファージと呼ばれ、神経細胞の発生過程で樹状突起の棘やシナプスを除去することで神経細胞ネットワークを維持している。しかし、マウスモデルで活性化されると、神経毒性状態に移行し、皮質下白質ではオリゴデンドロサイト前駆細胞と成熟オリゴデンドロサイトの両方が失われた。
さらに、ミエリンと有髄軸索は感染後少なくとも7週間は減少し、神経細胞ネットワークの構造と機能に影響を与えた。脱髄疾患は、mRNA注射による既知の副作用の一部である。海馬では、ミクログリアの活性化は神経新生の阻害と関連しており、このことは患者の記憶形成障害を説明することができる。ミクログリアの活性化は、C-Cモチーフ・ケモカイン11(CCL11)と呼ばれる分子の持続的なレベル上昇によって媒介されるようであった。CCL11は、老化や神経新生の阻害[177,178] 、アレルギーや好酸球の動員[179] と関連している。
Fernández-Castañedaら[180]は、マウスモデルで軽度の呼吸器SARS-CoV-2感染の影響を調査した。彼らは、感染開始後7週間にわたり、脳脊髄液と血清中のCCL11タンパク質を含む神経炎症性サイトカインとケモカインの変化を検出した。また、皮質下白質の脳領域に特異的な変化も観察され、ミクログリアの活性化、それに伴うオリゴデンドロサイト、オリゴデンドロサイト前駆細胞、ミエリンの消失が見られた。
他の著者は、CCL11タンパク質が、STAT5シグナル伝達経路を介して、非腫瘍関連CD4+T細胞におけるCD4+CD25+Foxp3+Treg細胞の割合、CCR3とFoxp3の発現、IL2とTGFβ1の放出を増加させることを見出している[60]。制御性T細胞は免疫抑制的であり、免疫反応を免疫寛容の方向にシフトさせる。これは、mRNA-LNP複合体によるワクチン接種が、炎症性IgG1およびIgG3からIgG4への抗体の全般的なシフトを引き起こし、Treg細胞と免疫寛容に関連し、2回目のワクチン接種後に起こることを示したドイツのグループ[149] と一致している。スパイク特異的IgG抗体のうちIgG4の割合は、2回目の接種直後の0.04%から3回目の接種後期には19.27%に上昇した。寛容効果の実証として、クリーブランド・クリニックの大規模なスタッフ研究では、その後のブースター接種によってIgG4が増加することは、SARS-CoV-2感染に対する感受性の増加と相関することが判明している[181]。
eotaxin CCL11(eotaxin-1)のようなケモカインは、上皮細胞、間葉系細胞、および内皮細胞から局所的に産生され、好酸球が気道に到達すると、好酸球の遊走とプライミング、またはメディエーターの分泌を指示するのに重要である[182,183] 。好酸球は、主要塩基性タンパク質、好酸球カチオン性タンパク質、好酸球由来神経毒、好酸球ペルオキシダーゼを含む様々な炎症性顆粒塩基性タンパク質を分泌する[184] 。
別の研究では、S1上のRBGの毒素様ドメインに注目し、α7 nAChRに結合し、脳内のIL-1bとTNFαのレベルを増加させ、マウスのエピソード記憶を障害した[178]。上述したように、この受容体は炎症性サイトカインの産生を制御しているため、スパイクタンパク質を用いてこの受容体を遮断すると、非常に高いレベルの炎症が引き起こされる可能性がある。
nAChRは海馬、大脳皮質、大脳辺縁系に高発現しており、認知、感覚情報処理、注意、ワーキングメモリー、報酬経路などに関与している。アルツハイマー病患者では、脳、特に海馬におけるα7の減少が報告されている。α7nACHRは神経毒に類似した方法で結合することに加え、スパイクタンパク質はアミロイド形成性を持つことが証明されている[185] 。アルツハイマー病のアミロイドβ(Aβ)ペプチドはピコモル親和性でnAChRに結合し、ヘビα神経毒はこれを競合的に阻害することが知られている[186]。アミロイドはスパイクタンパク質と同様にnAChR受容体に結合することが長い間知られてきた。コンピューターによるアミロイドへの結合メカニズムのin silicoモデリングは、ヘビ毒との類似性を示しており、そのため、AChRとの相互作用によってアミロイドのコンフォメーション変化が起こり、チャネル開口部がブロックされ、ヘビ毒と同様に、低濃度では最初は活性化されるが、その後AChRチャネル機能が鈍化しブロックされると提唱されている。健常人の脳内では、低濃度(ピコモル)の可溶性Aβペプチドが生理的役割を果たしているが、アルツハイマー病では濃度がナノモル領域まで上昇し、アルツハイマー病の神経病理学的特徴である不溶性プラークの形成を引き起こす[187] 。
7.3.2. プリオン形成と神経変性作用
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患はすべて、プラークやレビー小体に蓄積するミスフォールドタンパク質と関連している。これらのタンパク質はアミロイド原性と呼ばれ、「プリオン様」とも呼ばれている。TDP-43のプリオン様C末端ドメインとα-シヌクレインは相乗的に相互作用し、神経毒性のあるハイブリッド線維を生成する[188] 。このように、α7 nAChRを介したスパイク蛋白が神経変性障害に寄与するメカニズムには、直接阻害と二次的なアミロイド生成阻害という少なくとも2つのメカニズムが存在する。
SARS-CoV-2のスパイクタンパク質のレセプター結合ドメインはプリオン様特性を持ち、このような特性を持つ唯一のコロナウイルスであり、ACE-2レセプターに対するビリオンの結合親和性を高め、ヒトへの感染性と伝播性を高めている[189]。無傷の受容体結合ドメイン(RBD)S1サブユニットを持つ完全なスパイクタンパク質は、BBBを通過する場合、プリオン様特性を持つため、病原性の可能性についてさらなる研究が必要である。
さらに、mRNAやアデノベクターDNAワクチンには、TDP-43やFUS(RNA/DNA結合やRNA制御に関与するタンパク質)をプリオン型に凝集させるタンパク質配列が含まれている。これは、アルツハイマー病などの神経変性疾患を引き起こす可能性がある[190,191]。神経変性疾患との関連は、ヘパリン結合性アミロイド形成タンパク質と相互作用するスパイクタンパク質の能力である[192]。推測の域を出ないが、これらの考察はワクチン接種によるプリオン病の症例報告によって裏付けられている[193]。In vitroの実験では、スパイクタンパク質は好中球エラスターゼによってより小さなセグメントにタンパク質分解され、その一部はアミロイド形成特性を示した[185] 。
脳の神経細胞に存在するシアロ糖タンパク質中の特定の一次配列によって、これらのタンパク質は、同じタンパク質の鋳型となるコピーを介して、コンフォメーションの自己複製が可能な様々な代替構造をとることができる。プリオンと呼ばれるものへの変換は、一般的にタンパク質の機能を根本的に変化させ、しばしば伝達可能なものとなる[194]。このようにプリオンは、プリオンタンパク質のミスフォールドしたアミロイド形成アイソフォームから構成されている。
クロイツフェルト・ヤコブ病(CJD)などのプリオン病は、急速な神経変性とアストロサイトおよびミクログリアの活性化を伴う空胞化と海綿状の神経病理学的変化の結果として引き起こされる致死的な神経変性疾患である[195] 。神経細胞におけるミスフォールディングタンパク質の蓄積は、アルツハイマー病やパーキンソン病などの他の神経変性疾患の病因に関与している[196,197] 。感染性プリオン病もまた、非特異的な神経認知作用を引き起こす可能性がある[198] 。
COVID-19ワクチン接種後のCJD症例も記録されており、早ければワクチン接種後5日目の症例[199]と6ヵ月目に死亡した症例[200]がある。オーストラリアでは、2022年1月~2月の認知症死亡数が、同じ月の2017年~2021年の基準値(COVID-19の第1波を含む)を27.2%上回り、その後も認知症死亡率の増加が続いている[201,202]。
神経症状はCOVID-19後、「長いコビド」、mRNAワクチン接種後によく見られ、プリオンの関与の可能性が指摘されている。
COVID-19 mRNAワクチン接種がプリオンを産生し、神経変性過程を引き起こす可能性のあるメカニズムには以下のようなものがある:TAR DNA結合タンパク質(TDP-43)やFused in Sarcoma(FUS)のようなRNA結合タンパク質は、活性化されて病気の原因となるプリオンを形成する可能性がある。TDP-43の二量体は、UGリッチRNAやTGリッチDNAに結合し、分解に対して抵抗性があり[203] 、タンパク質が細胞質内にあるときにこれらのRNA配列に結合すると、プリオン形成につながるミスフォールディングを引き起こす可能性がある[204] 。従って、ファイザー社のワクチンがユニークなRNAヌクレオシド1-メチル-3′-シュードウリディリル(Ψ)を使用していること、そしてワクチンmRNAに複数のウラシル・モチーフが見つかっていることが気になるところである[191]。
タンパク質と結合し、ミスフォールディングを沈殿させる可能性のあるmRNA中のウラシル配列に加えて、スパイクタンパク質のS1サブユニットのRBD中のプリオン様ドメインがインシリコで同定されている。SARS-CoV-2はこのようなドメインを持つ唯一のコロナウイルスであり、プリオンの可能性に加えて、SARS-CoV-1と比べてACE-2レセプターに対する親和性が10倍から20倍高い[189]。
さらに、スパイクタンパク質RBDは、ヘパリンやヘパリン結合アミロイド形成タンパク質と相互作用できるいくつかのヘパリン結合部位を持っており、このペプチドが機能的アミロイドとして作用しやすく、有毒な凝集体を形成しやすいことを示唆している[205] 。S1タンパク質は、凝集しやすいタンパク質であるAβ、α-シヌクレイン、タウ、プリオン、TDP-43と安定に結合することが証明されており、したがってこれらのタンパク質の凝集とそれに続く神経変性を引き起こす可能性がある[192]。
研究チームはまた、S1サブユニット内の「グリシンジッパー」モチーフが、ミスフォールディングのしやすさ、ひいてはプリオンの形成に関係していることも突き止めた。GxxxGモチーフは膜貫通タンパク質に共通する特徴であり、グリシンはタンパク質のα-ヘリックスを架橋するのに重要な役割を果たす[206]。プリオンタンパク質は、α-ヘリックスがβ-シートとしてミスフォールドすると毒性を示すようになり、タンパク質は膜に入る能力を失う[207]。アミロイドβ前駆体タンパク質(APP)には4つのGxxxGモチーフがあり、グリシンはアルツハイマー病に関連するアミロイドβのミスフォールディングにおいて中心的な役割を果たしている[208]。SARS-CoV-2スパイクタンパク質は膜貫通タンパク質であり、その配列中に5つのGxxxGモチーフを持ち(uniprot.org/uniprot/P0DTC2参照)、そのうちの1つはRBD内にある。
もうひとつ提案されているメカニズムは、活性酸素(ROS)の影響によるプリオンやプリオン様タンパク質の自然誘導である。過剰な活性酸素の形成と認知機能障害を伴うと推定されるミトコンドリア機能の低下は、急性重症COVID-19、長期COVID[198] およびスパイク病の両方の特徴である。ストレスがかかると、TDP-43、FUS、その他のRNA結合タンパク質が核から細胞質に移動し、ストレス顆粒と会合する[210,211] 。ストレスが消滅すると、ストレス顆粒は分解し、RNA結合タンパク質は核に戻る。過剰な活性酸素を伴う環境ストレス(例えば、毒素への暴露、外傷性傷害、ウイルス感染など)が強まると、プロテオソームの正常な機能が失われ、正常なコンフォメーションが回復するため、RNA結合タンパク質が不適切に凝集する可能性が高まる可能性がある[212,213]。
神経炎症、特にアストロサイトの活性化の影響も同様である。動物実験では、プリオン病の前臨床段階から臨床段階への移行が、神経炎症、炎症性サイトカインの上昇、A1反応性アストロサイトの活性化の亢進を伴う共同感染環境において加速されることが示されている[214] 。活性化したミクログリアからのTNFとC1qは、さらにA1アストロサイトを活性化し[215] 、神経細胞損傷を媒介し、プリオン伝播の病巣となることで神経毒性を示すと考えられている[216] 。マウスにおけるスパイク蛋白ペプチドに対するワクチン接種後の非中和抗体もまた、グリア細胞とアストロサイトを活性化することが証明されており[217]、活性化されたアストロサイト、プリオン形成、認知機能障害というこの提案されているメカニズムと一致している。
Seneffたちは、神経変性疾患におけるスパイクタンパク質の潜在的な病態生理学的メカニズムに関する広範な叙述的レビューの中で、「スパイクタンパク質は、そのプリオン様特性を介して、神経炎症と神経変性疾患、血管系における凝固障害に寄与する;広く蔓延しているインスリン抵抗性の状況下でプリオンタンパク質の制御が抑制されることによるさらなる疾患リスク」、そして「なぜこれらのプリオン様特性が、SARS-CoV-2による自然感染よりも、ワクチンに関連したmRNA誘導スパイクタンパク質に関連するのかを説明する」[29](抄録p.1).彼らが検討した主な結果は以下の通りである:
- スパイク誘発性内皮炎は血液脳関門を乱し、スパイクタンパク質とアミロイドβや高リン酸化タウとの相互作用を介してアルツハイマー病を悪化させる[164]。
- 球状C末端ドメインの自己抗体が、プリオンタンパク質の小胞体への輸送を阻害することによって、侵攻型のクロイツフェルト・ヤコブ病(CJD)を引き起こすことが、研究によって示されている[218] 。
- スパイクタンパク質自体もRNA結合タンパク質であり、LINE-1を介してスパイクタンパク質mRNAのDNAへの逆転写を促進するのかもしれない。神経変性疾患と関連して、神経細胞はLINE-1を活発に発現している[219,220]。
- mRNAワクチンに含まれる脂質ナノ粒子からmRNAを取り込んだ細胞は、mRNAの一部をイオン化可能なカチオン性脂質とともに、エクソソームとして放出される小さな脂質粒子にパッケージングし、体中に運搬することができる[59,221]。例えば、脾臓の免疫細胞がスパイクタンパク質の無傷のmRNAコードを迷走神経に沿って脳に送り、そこでニューロンやミクログリア細胞がスパイクタンパク質の合成を開始する可能性がある。
- miR-146aは免疫細胞から放出されるエクソソームに含まれており、COVID-19と関連して発現レベルが変化するmiRNAのリストに含まれている[222]。脳幹に到達したエクソソームは、スパイクタンパク質だけでなく、無傷のmRNAやmiRNA分子も運搬する可能性があり、その中には脳のウイルス感染とプリオン病の両方に関連しているmiR-146aも含まれている[223,224]。
- スパイクタンパク質自体が急激なTNF-αの上昇を誘導し、認知障害を引き起こすが、これは脳内のプリオンタンパク質(PrP)の発現を上昇させることを示している可能性がある。プリオン糖タンパク質(PrPC)数の増加は、プリオンのコンフォメーションミスフォールディングを引き起こし、プリオンとプリオン関連疾患を発生させる可能性がある[225,226]。
- スパイクタンパク質は、トランスフェクトされた細胞において老化を誘導することが示されている[227]。さらに、mRNA COVID-19ワクチンは、主にその脂質含量(イオン化可能脂質、コレステロール、リン脂質1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC))により、曝露された免疫細胞において合胞体形成を介して早期老化を誘導することが提案されている。[228].In vitroの分子生物学的研究は、高分子の混雑がネイティブPrPの神経毒性を持つ可溶性βオリゴマー構造への変換を促進することを示している[229]。
7.3.3. 自律神経失調症
COVID-19感染またはワクチン接種のもう一つの重要な特徴は、自律神経系(ANS)機能の神経学的障害である自律神経失調症(DSN)であり、心臓、膀胱、汗腺、瞳孔、腸、その他の自律神経系に広範な影響を及ぼす。交感神経系(SNS)と副交感神経系(PSNS)の両方が影響を受け、交感神経の嵐や、過剰発汗、運動不耐性、不眠、安静時頻脈、姿勢低血圧、疲労、排尿・排便機能障害などの異常な自律神経反応が起こる可能性がある。SARS-CoV-2の神経侵襲性は、DSN[96] のような神経学的合併症を引き起こし、α7 nAChR阻害で起こるような直接的な自律神経細胞傷害または間接的な免疫介在性機序のいずれかを示唆している。SARS-CoV-2によるnAChRの阻害は、PSNSの阻害とその後のサイトカインストームの進行に伴うSNSの誇張を引き起こす可能性がある[94]。
COVID-19に関連するもう一つの神経機能障害は無嗅覚症で、COVID-19の一般的な症状であり、パーキンソン病の前駆症状でもある。嗅球には豊富なnAChRのネットワークがあり、α7 nAChRは嗅覚軸索末端にも発現している可能性がある。このことは、嗅覚神経に沿った前向輸送によってCNS感染を促進する可能性がある。したがって、無嗅覚症はCOVID-19におけるニコチン性コリン作動性システムの機能不全のもう一つの徴候を表しているのかもしれない[32]。
mRNAワクチンの実験的性質、SARS-CoV-2スパイクタンパク質の病原性、BBBを通過する脂質ナノ粒子キャリアマトリックスの能力を考えると、これらの神経病理学的影響の可能性は重大な懸念である。
7.4. 発がん効果
現在までのところ、mRNA注射と癌を結びつける決定的な証拠はない。世界中の新聞や医師から、何年も寛解していた癌が再発したという逸話的証拠が報告されている。これらはいわゆる “ターボ・ガン “と呼ばれ、急速に進行してステージが進んだり、死亡したりする。ワクチンの抗がん作用を研究している著名な腫瘍学者アンガス・ダルグリーシュ教授[230] は、COVID-19ワクチン接種後にこのような現象が起こると主張し、厳しい批判を浴びている。ダルグリーシュはBMJ誌の編集長に手紙を書き、公開書簡とした[231]。
確定的な評価を下すには時期尚早である。しかし、スパイクタンパク質と、それが癌を引き起こす可能性、あるいは癌と効果的に戦えないほど免疫系を障害する可能性については見ることができる。ダルグリッシュの書簡では、COVID-19ワクチン接種後に報告された癌の大部分は「メラノーマまたはB細胞ベースの癌であり、これらは免疫制御に非常に影響を受けやすい」と指摘している。
免疫反応には、活性化経路と抑制経路の非常に複雑なネットワークの活性化が関与している。免疫防御は自己寛容の維持と共存しており、これらのプロセスのバランスは極めて重要である。免疫チェックポイントはネットワーク制御において重要な役割を果たしている。重要な抑制性チェックポイント受容体のひとつは、プログラム細胞死タンパク質1(PD-1、CD279)であり、通常T細胞、成熟B細胞、その他の免疫細胞に存在する[232]。PD-1のリガンドであるプログラム死リガンド1(PD-L1)とPD-L2は、樹状細胞やマクロファージなどの抗原提示細胞上に恒常的に発現している;PD-L1のアップレギュレーションは、単球や顆粒球の活性化後に観察される[233,234]。
Loackerら[235]は、ワクチン接種を受けた人の末梢顆粒球と単球のPD-L1発現が、ワクチン接種を受けていない人の発現よりも有意に高いことを示している。Diskinら[236]は、癌におけるPD-L1のT細胞発現は、腫瘍抗原と無菌炎症性の合図によって制御されることを発見した。PD-L1+ T細胞は、(1) CD4+T細胞において、PD-L1の結合がSTAT3(シグナルトランスデューサーおよび転写活性化因子タンパク質3)に依存した「バックシグナル」を誘導し、活性化を阻止する[233] ことにより、腫瘍促進寛容[232] を発揮した;(2)PD-L1+T細胞は、内因性PD-L1がない場合でも、エフェクターT細胞を抑制し、腫瘍形成を促進する。(3)PD-L1+T細胞は、PD-1+マクロファージに関与し[234]、代替的M2様プログラムを誘導し、適応的抗腫瘍免疫に障害を与える。これらの結果を総合すると、PD-L1+ T細胞が腫瘍免疫における寛容を促進することがわかる。
さらに、SinghとSingh[87]は、スパイクタンパク質のS2サブユニットと腫瘍抑制タンパク質P53、BRCA1およびBRCA2とのin vitroでの相互作用を証明した。直接的な相互作用とは別に、スパイクタンパク質のmRNAコードで細胞をトランスフェクションすると、インターフェロン調節因子9(IRF9)の産生を抑制し、炎症性遺伝子転写物を活性化するmiRNA(miR-148とmiR-590)を含むエクソソームが生成される[237]。
Covid19のワクチン接種は、健康な免疫系に不可欠なI型インターフェロンのシグナル伝達を障害するという証拠がある[238]。インターフェロンは、腫瘍細胞の抑制や免疫細胞におけるタンパク質合成の制御に関与しており、その障害は癌やウイルス性疾患に関連している。IRF9の継続的な阻害は、TNF関連アポトーシス誘導リガンド(TRAIL)とそのすべての制御作用およびアポトーシス作用を抑制する。IRF9の抑制はまた、BRCA2のがん保護作用を損なうと予想され、致死的神経疾患に関連する強力な免疫炎症反応を促進することが判明している[239] 。IRF9が欠損すると、重篤なCOVID-19疾患のリスクが有意に高くなり[240]、BRCA2遺伝子活性のがん保護作用が損なわれる。
関連するがんには、女性では乳がん、卵管がん、卵巣がん、男性では前立腺がん、乳がん、小児では急性骨髄性白血病がある。Liuら[241]は、mRNA注射がIRF7とSTAT2(シグナル伝達物質および転写活性化因子タンパク質2)も抑制することを示し、これは乳房感受性遺伝子1(BRCA1)の抗腫瘍効果を妨害することが予想される。BRCA1に関連するがんは、女性では乳がん、子宮がん、卵巣がん、男性では前立腺がん、乳がん、両者では膵臓がんのリスクが中程度に上昇し、小児では急性骨髄性白血病である[242] 。BRCA1の発現低下は、癌と神経変性の両方に関連している。
7.5. スパイク病の生検と剖検による証拠
COVID-19ワクチン接種後の心筋炎が疑われた15症例(ファイザー8例、アストラゼネカ2例、ジョンソン・エンド・ジョンソン2例)を対象としたドイツの多施設共同症例シリーズで、心筋内生検(EMB)の包括的な免疫組織病理学的検査が行われた。以前のSARS-CoV-2や心筋炎症に関連する他のウイルスに対する免疫学的検査は陰性であった。1人を除くすべての患者が炎症性バイオマーカーを示し、炎症性心筋症、活動性心筋炎、重症巨細胞性心筋炎と診断された。14例中9例が心筋内スパイク蛋白陽性であった。リンパ球浸潤を調べたところ、CD4+とCD8+のT細胞が優勢であったことから、著者らは自己免疫反応が病理の基盤であると結論した[103] 。同様に、HLA-D4活性化リンパ球とMAC-1+マクロファージの相対的頻度も、この結論を支持するものであった。図7はスパイク蛋白の組織染色の一部を示したものである[103]。
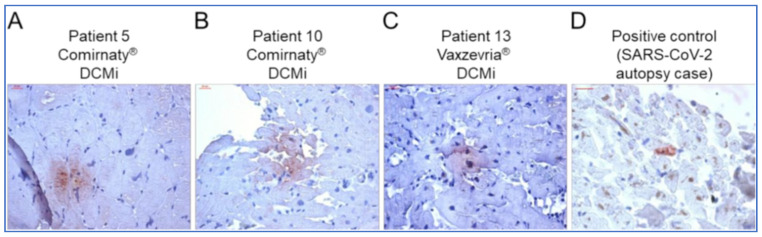
図7.COVID-19ワクチン接種後の心臓組織におけるSARS-CoV-2スパイクタンパク質の証拠
(A-C)コミルナティ®(パネル(A,B)、患者5および10)またはバクスゼブリア®(パネル(C)、患者13)接種後にDCMiと診断された患者のEMBにおけるSARS-CoV-2スパイクタンパク質の代表的な免疫組織化学染色。(D)SARS-CoV-2陽性の心臓組織を陽性対照とした。倍率400倍。スケールバー20μm。文献[103]より許可を得て転載。[103].Copyright 2022 MDPI.
76歳男性の剖検例では、COVID-19ワクチンのスパイク蛋白が死因であることが明らかになった[167]。臨床的には、この被験者は2021年5月の1回目のワクチン接種(アストラゼネカ社)当日から心血管系の副作用がみられ、2021年7月の2回目のワクチン接種(ファイザー社)後には神経学的および精神医学的変化がみられ、2021年12月のブースター接種(ファイザー社)の3週間後に倒れて死亡した。急性および慢性の炎症性および細胞変性変化が脳と心臓に影響を及ぼした。免疫組織化学的染色では、血管壁、脳のグリア細胞、および「リンパ球性心筋炎を示した心臓内皮細胞」にスパイク蛋白が認められた[167] (p. 8)。さらに、「免疫組織化学的染色ではSARS-CoV-2のヌクレオカプシド蛋白は検出されなかった」と著者は結論している:「スパイク蛋白の存在は、ウイルス感染というよりもむしろワクチン接種によるものである」[167] (抄録)と結論した。
米国で行われた13例の脳剖検では、スパイクタンパク質のS1サブユニット(受容体結合ドメインRBDを含む)が、内皮炎、サイトカイン放出、神経毛細血管損傷を伴う神経血管内皮細胞の変性を引き起こした。内皮細胞はスパイク糖タンパク質を含んでいたが、ウイルスRNAを含んでいなかったことから、図8に示すように、遊離スパイクタンパク質のS1サブユニット/RBDがCOVID-19病のこれらの症例における主な病原体であることが確認された[243]。
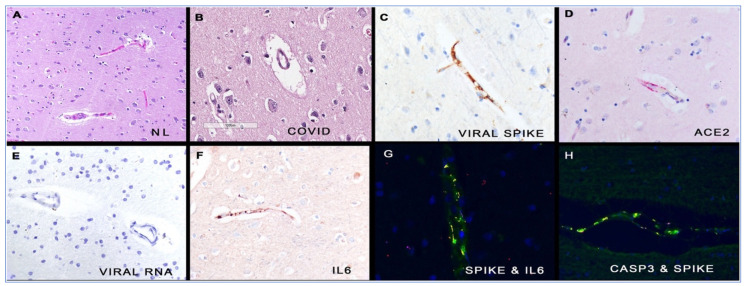
図8ヒト脳におけるCOVID-19の組織学的および分子学的相関
パネル(A)は正常脳の微小血管を示す。対照的に、COVID-19脳組織の毛細血管の多くは血管周囲の浮腫が顕著である(パネル(B))。COVID-19脳の連続切片分析から、微小血管の内皮細胞はスパイク糖タンパク質(パネル(C))、ACE2レセプター(パネル(D))およびIL 6(パネル(F))を含んでいたが、ウイルスRNA(パネル(E))は含んでいなかった。蛍光イエローシグナルは、これらの内皮細胞におけるスパイクタンパク質とIL6(パネル(G))およびカスパーゼ3(パネル(H))との共局在をそれぞれ示す。各倍率は800倍で、DAB(茶)シグナル(パネル(C-F))またはFast Red(赤)(パネルD)。(この図の凡例中の色に関する言及の解釈については、読者はこの論文のウェブ版を参照されたい)。Annals of Diagnostic Pathology, Vol.51, Nuovo GJ, Magro C, Shaffer T. et al., Endothelial cell damage is the central part of COVID-19 and a mouse model induced by injection of the S1 subunit of the spike protein.図1、151682、文献から許可を得て転載。[243].Copyright (2020) Elsevier.
同じ研究グループは、COVID-19で死亡した患者の心臓を11例剖検したケースシリーズでも同様の所見を得た[244]。彼らは、外来スパイク抗原の発現が病理学的に重要であることを強く示唆する、以下の詳細を記している:
「致死性COVID-19の心疾患は、感染性ウイルスではなく、ウイルスのスパイクタンパク質と関連している。ウイルスのスパイク蛋白は間質マクロファージでエンドサイトーシスされ、心筋炎を誘発する。組織学的所見では、血管周囲の水腫、内皮細胞の損傷、微小血栓が認められる」。
[244] (ハイライト、p.1)
この米国の研究グループの知見により、COVID-19の神経血管および心臓病理の発症メカニズムとしてスパイクパフォマシーが確認された。従って、COVID-19ワクチンを介して脳や心臓でスパイクタンパク質の産生を延長する遺伝子をコードする遺伝子が広く生物学的に分布することも、同じ作用機序に従う可能性が高い。
韓国で、それまで健康であった22歳の男性軍新兵の剖検で、ファイザーmRNA COVID-19ワクチン接種5日後に広範な心筋炎が認められた症例報告。著者らは、剖検時の病理組織学的調査の重要性を強調した。彼らは、COVID-19パンデミックの間、学術文献にそのような調査が著しく欠けていたことを指摘した[245]。
ドイツの病理学者が、ワクチン接種直後に死亡し、それまでCOVID-19に罹患していなかった人々の遺体の剖検を行った。ハイデルベルクの主任病理学者シルマッハー博士らは、COVID-19 mRNAワクチン接種後2週間以内に自宅で死亡した35人を解剖した。そのうち10人は既往症による死亡であった。残りの25人の予期せぬ死亡のうち、5人は心筋炎で死亡したことが判明した。心筋にリンパ球性の炎症性浸潤がみられ、他に重大な心血管系の病態がないにもかかわらず、不整脈を伴っていたと推定された。5例とも1週間以内に死亡し、1例はワクチン接種後12時間以内に死亡した。1例は三角筋の注射部位に同様の炎症性浸潤を認めた[246]。
アルネ・ブルクハルト教授と同僚のウォルター・ラング教授が率いるドイツの病理学者の別のグループは、ファイザー社のCOVID-19 mRNAワクチン接種後の25例の剖検例における病理組織学的所見を発表した。これらの所見には、心筋炎の炎症性浸潤だけでなく、血管の病変にもワクチン産生スパイク蛋白が含まれていた。図9は、免疫組織病理学的に染色されたmRNA産生スパイク蛋白について説明したドイツ語のPowerPointプレゼンテーションからのものであり[247]、血管壁の内皮細胞に浸潤した染色された(茶色の)スパイク蛋白を示している:
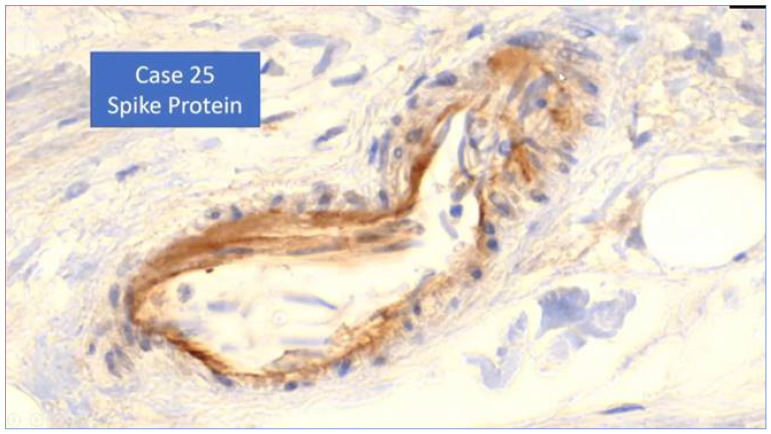
図9.Burkhardt(2022a)[247]による血管壁のスパイクタンパク質。
アルネ・ブルクハルト教授の言葉を借りれば、このスライドに添えられたドイツ語からの訳はこうである:
「そう、これは特別な方法で得られた知見である。つまり、このケースでは、ワクチン接種から122日後も血管壁からこの毒素が検出されることが確実なのである。これがこの損傷の原因であることも明らかである」。
今のところはっきりしないのは、それがただそこに沈着しているだけなのか、それともこれらの細胞が、いわばmRNAの指示通りにスパイクタンパク質を実際に産生するのか、ということだ」。
図10は、Burkhardtらによる同じ剖検症例シリーズからのもので、スパイクタンパク質が血液脳関門を通過したか、脂質-ナノ粒子-mRNA複合体が通過し、脳組織でスパイクタンパク質の転写を引き起こしたことを示している[248]。
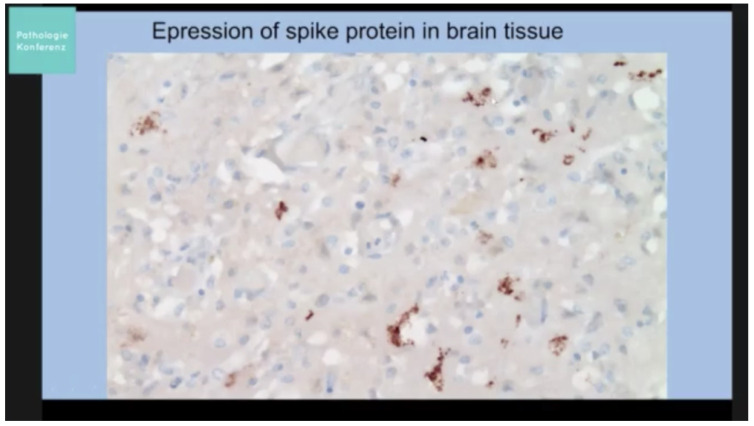
図10.ブルクハルト(2022b)の脳組織中のスパイクタンパク質[248]。
患者の死因となった病理組織におけるスパイクタンパク質の存在は、犯罪現場で 「決定的な銃」を発見するのに似ている。このような染色法を用いたより多くの剖検と関連した研究が必要であることは明らかである。
アストラゼネカ社またはヤンセン/ジョンソン・エンド・ジョンソン社のアデノベクターDNAワクチンによるVITTで死亡した患者3人の剖検例を対象とした最近のケースシリーズでは、脳静脈洞血栓の組織染色が用いられている[7] 。著者らが報告している:
「血栓に隣接する内皮細胞はほとんど破壊されていた。好中球細胞外トラップと補体活性化のマーカーが脳静脈血栓の境界と内部に存在した。SARS-CoV-2スパイク蛋白が血栓内および隣接血管壁に検出された。
[7](抄録)
ウイルス-ベクターDNA COVID-19ワクチンによる脳静脈血栓部位でのスパイクタンパク質の発見と、上記のようなNETosisの存在は、遺伝子ベースのワクチンによるスパイク症のさらなる証拠となる。
8. ディスカッション
本稿の冒頭で、SARS-CoV-2のスパイクタンパク質を製造するようにヒト細胞を誘導する遺伝子ベースのワクチンのリスクに関するオーストラリアの上院議員の質問に対する、オーストラリアの保健規制当局であるTGAの回答を引用した。その回答は、スパイクタンパク質は病原体ではないというものだった。我々はスパイクタンパク質が病原体であるという重要な証拠を提示した。これはウイルスの一部である場合、遊離しているがウイルス由来の場合、そしてmRNAやアデノベクターDNA COVID-19ワクチンのmRNAによってリボソームで産生される場合に当てはまる。スパイクタンパク質の病態生理学的作用機序は解明され続けている。
我々は、スパイクタンパク質がACE-2受容体に結合することによって障害を引き起こし、それによって受容体をダウンレギュレートし、血管内皮細胞にダメージを与えることを立証した。スパイクタンパク質は毒素様結合ドメインを持っており、中枢神経系や免疫系にあるα7 nAChRに結合し、それによって、炎症やIL-6などの炎症性サイトカインを減少させる機能など、nAChRの機能を阻害する。神経変性疾患との関連は、ヘパリン結合性アミロイド形成タンパク質と相互作用し、脳タンパク質の凝集を開始するスパイクタンパク質の能力にもよる。
スパイクタンパク質の持続は、持続的な炎症(慢性炎症)を引き起こし、最終的には免疫系を免疫寛容(IgG4)に移行させる可能性がある。女性や妊娠中の女性にとって特に影響があるのは、スパイクタンパク質がエストロゲン受容体αに結合することで、エストロゲンのメッセージ伝達を阻害することである。
スパイクタンパク質は、がん抑制遺伝子と相互作用し、ミトコンドリア障害を引き起こすことにより、細胞内で細胞毒性を発揮する。細胞表面に発現したスパイクタンパク質は、細胞毒性自己免疫反応を引き起こす。
遊離したスパイクタンパク質は、臓器や血液中の他の細胞上のACE-2に結合する。血液中でスパイク蛋白は血小板に影響を与え、凝固因子を放出し、炎症因子を分泌し、白血球-血小板凝集塊を形成する。スパイク蛋白はフィブリノゲンと結合し、血栓を誘発する。
また、スパイクタンパク質を産生するmRNAをワクチン接種した場合、自己免疫につながる適応免疫系の主要タンパク質とスパイクタンパク質の相同性が問題となる。
薬物動態学的要因が病態生理学に寄与している。前述のように、日本のPMDAに関するファイザーの生体内分布研究(脂質ナノ粒子キャリア分子の75%が48時間以内に三角筋からすべての臓器に移行した)は、オーストラリア人に対するmRNA COVID-19ワクチンの仮承認の前に、オーストラリアTGAに知られていた[5]。多くの臓器でスパイクタンパク質の複製を引き起こすため、遺伝子ベースのワクチンは合成ウイルスとして機能する。
mRNAの担体である脂質ナノ粒子と、mRNA-LNP複合体をより安定で分解されにくいものにするPEGは、それぞれ毒性を持つ。脂質ナノ粒子は主に炎症促進作用によって、PEGは感受性の高い人にアナフィラキシーを引き起こす。
Röltgenら[53]は、COVID-19ワクチンに含まれるN1-メチルシュードウリジン安定化mRNAが、少なくとも60日間スパイクタンパク質を産生することを発見した。遺伝暗号のレトロポジションに関する他の研究[249]も引用されており、このような外来病原性タンパク質の産生が、生涯にわたって、あるいは世代を超えて行われる可能性を示唆している。
スパイクタンパク質そのもの、特にS1サブユニットが病原性であり、重症の急性COVID-19、おそらく長期のCOVID、およびmRNAとアデノベクターDNAのCOVID-19ワクチン傷害で見られる炎症とその他の病理を引き起こすことが、多くの新しい研究によって示されている。「スパイク病」という言葉は、フランスの研究者Henrion-Caude[98]が学会で作った造語であり、SARS-CoV-2スパイクタンパク質の多様で実質的な病理学的効果を考えると、この用語の使用は発見的価値があると思われる。
スパイク病は、CosentinoとMarino[86]によって要約されているように、ACE-2結合に関連する血小板凝集、血栓症および炎症、心臓のペリサイトおよび赤血球の機能を阻害するCD147膜貫通糖タンパク質の破壊、炎症カスケードを点火するTLR2およびTLR4への結合、月経不順の原因となる可能性のあるERαへの結合、p53BP1およびBRCA1との相互作用を介したがんリスクの増加を通じて、その効果を発揮する。他の研究では、ACE-2による炎症性サイトカインの産生、MEKのリン酸化、eNOSのダウンレギュレーション、内皮細胞の機能低下を通じて、さらなるスパイク病理学的作用が示されている。
スパイクタンパク質の特に新しい作用は、α7 nAChRの阻害を介したニコチン性コリン作動性システムの異常で、多くの細胞や臓器系における抗炎症生化学的経路の障害や、副交感神経迷走神経緊張の障害につながる。
COVID-19 mRNAおよびアデノベクターDNAワクチンの傷害は、重篤な急性COVID-19症や長期COVIDと重複するが、より広い生体内分布とスパイクタンパク質の長期産生を考えると、より多様である。心筋炎は認識されているが、しばしば軽度でまれなものとして軽視されてきたが、COVID-19ワクチンに関連した比較的よくみられる不顕性心筋炎の証拠[113,115]や剖検の証拠[246,247,248]は、比較的若く健康な人の突然死における役割を示唆している[116,117]。スパイクタンパク質はまた、ACE-2に関連した炎症、アンジオテンシン系の障害[119]、血小板上のACE-2受容体との直接結合[1]、アンチトロンビンの障害[122]、線溶の遅延[123](前刷り)、赤血球の静電反発の減少による赤血球凝集[124]を介して血栓症を増加させるメカニズムを持っている。
COVID-19ワクチン接種後に新たに発症した自己免疫疾患は、スパイクタンパク質、そして他のSARS-CoV-2蛋白質を含むウイルス性疾患におけるヒト蛋白質との相同性に関係しているかもしれない[5,138]。
mRNA-LNP複合体はBBBを通過し、COVID-19ワクチン後に神経障害がファーマコビジランスデータベースに多く報告されている。スパイク病の根底にある障害として、多くのメカニズムが解明されつつある:BBB透過性[128];ミトコンドリア障害[168];脳血管周皮細胞の調節障害[169];TLR4を介した神経炎症[170];海馬細胞死[171];補体および凝固カスケードおよび好中球の調節異常による凝固障害[173](前刷);ミクログリアの調節異常を介した神経炎症および脱髄[174,177,180];神経変性疾患に関与するα-Synの発現増加[175];加齢とそれに伴う神経細胞やミエリンの喪失に関連するC-Cモチーフケモカイン11のレベル上昇;α7ニコチン性アセチルコリン受容体(nAChR)に結合し、脳内のIL-1bとTNFαのレベルを上昇させ、高レベルの炎症を引き起こす[172,177];S1サブユニットはアミロイド形成性[185];直接的な神経細胞傷害または間接的な免疫介在性メカニズムのいずれかによる自律神経失調症[96]。g.,α7 nAChRの阻害;ワクチンと疾患の両方によって引き起こされる無嗅覚[44] 、パーキンソン病の前駆症状でもある。
さらに、球状C末端ドメインの自己抗体はクロイツフェルト・ヤコブ病(CJD)を引き起こす可能性があり[218]、miR-146aはCOVID-19[222]と関連して変化し、脳のウイルス感染とプリオン病の両方に関連している。
スパイクを介した脳へのダメージのメカニズムについては、神経学的および神経変性的な悪影響の有病率に匹敵するほど多くの可能性があり、早急にさらなる研究が必要である。
がんは、ワクチンが原因であることが確実に証明されているわけではないが、ワクチン接種に密接に関連しているようであり、転写因子やがん抑制遺伝子とのスパイクタンパク質の相互作用という形で、考えられる原因を検討した。
このワクチンは、COVID-19による死亡リスクが最も高い60歳以上を守るためのものであった[10]が、Dopp and Seneff (2022)[250]によるリスク分析によると、注射によって死亡する可能性は、80歳以上の感染によって死亡するリスクよりも0.13%低いだけであった。
さらに、自然老化は免疫系の変化を伴い、新しい抗原に効果的に反応する能力を低下させる。ウイルスに対する年齢層別応答と同様に、このことは、高齢者ではワクチンの免疫誘導効果が低下し、新規感染と闘う能力が低下することを意味する[251]。2回投与のCOVID-19 mRNAワクチン接種により、高齢マウスでは適応免疫応答が制限され、SARS-CoV-2感染に罹患しやすくなった[252]。米国の退役軍人のワクチン接種後の重症化リスクは、Voら(2022年)の研究によると、依然として年齢と関連していた[253]。このようなブレークスルー感染のリスクは、免疫不全状態が存在する場合にも高かった。
最後に、スパイクオパチーと多臓器不全、神経障害、死亡との関連を証明する、ドイツで行われた現在入手可能な最良の剖検症例シリーズをレビューした。
9. 結論
この総説では、SARS-CoV-2のスパイクタンパク質、特にS1サブユニットの病原性としての役割を明らかにした。また、現在では、mRNAやアデノベクターDNA遺伝子コードによって産生される、広く生物学的に分布するスパイク・タンパク質が、さまざまな疾患を誘発することが明らかになっている。根底にある病態生理学的、生化学的メカニズムは解明されつつある。mRNAワクチンやノババックスワクチンの脂質ナノ粒子キャリアは、病的な炎症促進特性をも有している。ヒト組織内に外来抗原を産生する遺伝子ベースのワクチンという前提は、特にその分布が高度に局在化されていない場合、自己免疫疾患や炎症性疾患のリスクをはらんでいる。
COVID-19ワクチンに関連した疾患は、急性、慢性を問わず様々な症状を呈する可能性があり、既往症の悪化も懸念される。私たちはまた、遺伝子ベースのCOVID-19ワクチンと脂質ナノ粒子キャリアマトリックス、およびmRNAまたはウイルス-ベクターDNA技術に基づく他のワクチンの中止を提唱する。より安全な方法は、SARS-CoV-2に対するワクチンとして現在数多くある、十分に試験された組換えタンパク質、弱毒化または不活化ウイルス技術を用いたワクチンを使用することである。
著者の貢献
構想、P.I.P.、A.L.、C.T.、J.G.;執筆-原案作成、P.I.P.、A.L.、C.T.、C.J.N.、R.C.、J.G.;執筆-校閲・編集、P.I.P.、C.J.N.、A.L.、C.T.、N.J.H.、J.G.、R.C..
資金調達
この研究は外部資金援助を受けていない。
データの利用可能性に関する声明
図1で使用したデータは、図2に示したNSW Healthの報告書の表にあるNSW Healthの公式データから得たものである。
利益相反
著者らは利益相反がないことを表明している。
