Contents
Sigma-1 Receptor Activation Induces Autophagy and Increases Proteostasis Caacity In Vitro and In Vivo
オンラインで公開2019年3月2日
要旨
ヒトの神経変性疾患の発症には、オートファジーの機能障害やタンパク質の恒常性の乱れが関与しており、タンパク質クリアランスの過程であるオートファジーの調節は、薬理学的に重要なターゲットの一つとなっている。
シグマ-1受容体(Sig-1R)は学習や記憶に関与しており、様々な実験で多動的な神経保護効果が報告されていることから、Sig-1Rの活性化は神経変性疾患の予防や治療の一つの可能性として認識されており、興味深いことに、Sig-1Rの変異を伴う筋萎縮性側索硬化症ではオートファジーが障害されている。
ここでは、ムスカリン受容体リガンドでありSig-1Rアゴニストであるテトラヒドロ-N,N,N-ジメチル-2,2-ジフェニル-3-フランメタナミン塩酸塩(ANAVEX2-73)のオートファジーおよびプロテオスタシスへの影響を解析した。本研究では、Sig-1Rを薬理学的に活性化することにより、ヒト細胞および線虫においてオートファジーの活性化が促進され、線虫においてはプロテオスタシスの活性化が促進され、最終的にはタンパク質の凝集による麻痺が改善されることを初めて分子レベルで明らかにした。
ANAVEX2-73は既にアルツハイマー病の治療薬として臨床試験が行われているが、今回の化合物のオートファジーおよびプロテオスタシスに対する新規な活性は、将来的にSig-1Rの創薬標的としての使用や開発に影響を与える可能性がある。
また、本研究により、シグマ-1Rはオートファジーの上流側に位置していることが明らかになり、神経変性疾患以外にも、オートファジー機能障害を伴う様々な疾患への応用が期待される。
キーワード
シグマ-1受容体、オートファジー、プロテオスタシス、神経変性、線虫
1. はじめに
アルツハイマー病やパーキンソン病(AD、PD)筋萎縮性側索硬化症(ALS)などの神経変性疾患の病態は、タンパク質のホメオスタシスの乱れと関連している[1,2,3]。したがって、プロテオームの完全性とプロテオスタシスの制御と維持が最も重要である。細胞のプロテオスタシスは、タンパク質の折りたたみ、タンパク質の組み立て、損傷を受けたタンパク質のリフォールディング、およびタンパク質の分解を含み、ヒートショックプロテイン70(HSP70)などのシャペロンや異なるコ・シャペロンを含む、きめ細かに調整された因子のネットワークの制御下にある[4]。細胞の無傷の機能と長期的な生存のためには、特殊なプロセスを介して誤って折り畳まれたタンパク質を除去することが重要だ。UPSは生理的なタンパク質のターンオーバーには特に重要であるが、分解基質は限られており、オートファジー-リソソーム経路は、特に病原性や加齢条件下で、凝集したタンパク質や疾患関連タンパク質のクリアランスに関与している。
オートファジーは、オートファゴソームと呼ばれる二重膜小胞が関与する高度に動的な小胞媒介の細胞分解経路であり、大きなタンパク質複合体(タンパク質の集合体)さらには小器官全体を隔離し、それらを分解のためにリソソソームに送達する [8]。低栄養・低エネルギー環境下では、オートファジーはリサイクルを介してアミノ酸の構成要素を生成し、エネルギー供給を保証している。また、オートファジーは、細胞の生存と機能を維持するためのストレスや適応応答、レスキューメカニズムとして重要な役割を果たしている[8]。正準オートファジーは、もともと酵母で同定されたオートファジー関連(ATG)遺伝子のホモログに主に属する様々な因子を介して環境の合図に応答する[9]。哺乳類のラパマイシンmTOR複合体1(mTORC1)は、ULK1のリン酸化を阻害することでオートファジー活性をネガティブに制御しており、カノニカルオートファジーの重要な初期制御因子である。より下流の膜拡張は、最近秀逸にレビューされたように、2つのユビキチン様共役系(ATG12-ATG5およびATG8/LC3)およびWDリピートドメインホスホイノシチド相互作用1-4(WIPI1-4)のATG18タンパク質ファミリーのメンバーによって調節されている[10]。
オートファジーの機能不全および機能不全を神経変性疾患と結びつけ、また、プロテオスタシスにおけるオートファジーの役割と一致して、タンパク質凝集体の蓄積と結びつけている多くのデータがある。したがって、オートファジーの調節は、神経変性における重要な薬理学的ターゲットの一つとなっている[11,12,13]。実際、AD、PD、ALSでは、オートファジーと発症経路が重複していることが知られている[12]。最近では、ADの予防と治療に向けた異なる代替見解と新しい薬理学的ターゲットが進化しており、オートファジープロセスへの強い焦点を含んでいる。
シグマ受容体には、中枢神経系で高発現しているシグマ受容体-1 とシグマ受容体-2 の 2 つのサブタイプがある;シグマ受容体-1 は、本研究で使用した HEK293 細胞や HeLa 細胞を含む様々な腫瘍細胞株にも存在している [14,15,16]。シグマ-1受容体(Sig-1R)は1996年にクローニングされ[17,18]、小胞体(ER)(およびER-ミトコンドリア界面)に局在する223アミノ酸の膜タンパク質であり、ERシャペロンとしての役割を示唆している。Sig-1Rは、(1)小胞体からミトコンドリアへのCa2+シグナル伝達の確保、(2)小胞体から核へのシグナル伝達の促進、(3)レドックス応答性転写因子であるNrf2の活性調節によるフリーラジカル損傷の抑制[19,20]により、細胞の生存を促進することが示された。構造的には、Sig-1Rのリガンド結合が特徴的であり[21]、ヒト受容体の結晶構造が解かれている[22]。
一般に、Sig-1Rの発現または活性の欠損は神経変性と関連しており、Sig-1Rの活性化は、異なる薬理学的プロファイルを有する異なるタイプのSig-1R活性化剤を採用した、異なる試験管内試験および生体内試験モデルにおいて神経保護と関連している[15,23]。Sig-1Rの薬理学的活性化は多能性調節下流効果をもたらし、Sig-1Rの誤った機能は神経変性の病因にも関与していることが強く示唆されている[24]。このことは、ADを含む神経変性疾患の治療のために、新規かつ特異性の高い薬理学的Sig-1R活性化剤を設計する努力の基礎となっている[25]。
このような背景から、新規のSig-1Rアゴニストであるテトラヒドロ-N,N,N-ジメチル-2,2-ジフェニル-3-フランメタナミン塩酸塩(ANAVEX2-73)が開発された。薬理学的には、ANAVEX2-73はSig-1とムスカリン受容体の両方に作用し、低マイクロモル領域での親和性を示する[26,27]。これまでに、動物モデルを用いた前臨床試験では、ANAVEX2-73の頑健な疾患修飾作用が示されている。ADに関しては、ANAVEX2-73は第2a相臨床試験を実施しており、良好な安全性プロファイルと探索的エンドポイントに対する濃度依存性の改善が示されている[28,29,30]。ANAVEX2-73は、ADのマウスモデルにおけるミトコンドリア保護、ERK活性化の調節およびアストロサイトの生存促進、酸化ストレスからの保護など、様々な神経調節作用および神経保護作用もすでに知られている[31,32,33]。
Sig-1R、オートファジー、神経変性との関連性の可能性を示す最初の証拠は、最近ALSの文脈で示された。ALSに関連した変異体Sig-1-Rはオートファジー物質の蓄積を引き起こし、実際にオートファジーを減少させることが明らかにされた[34]。さらに、アストロサイトにおけるコカインを介したオートファジーにはSig-1Rが関与していることが実証された[36]。さらに、低分子のSig-1Rモジュレーターが癌細胞においてプログラムされた死のリガンド1(PD-L1)のオートファジー分解を誘導することを明らかにした[37]。これらの知見から、オートファジー活性を解析するための標準的な測定法を用いて、ヒトHeLa細胞、HEK293細胞(試験管内試験)および線虫C. elegans細胞(生体内試験)のオートファジーに対するANAVEX2-73の効果の可能性を検討した [38,39,40,41]。さらに、ANAVEX2-73がタンパク質凝集体に及ぼす影響と、その後、線虫の運動行動に及ぼすタンパク質凝集体の影響を調べた。興味深いことに、ANAVEX2-73は試験管内試験および生体内試験でのオートファジー活性の強力な誘導因子であり、線虫のタンパク質凝集体形成と麻痺を改善することが明らかになった。
2. 材料と方法
2.1. 細胞培養と顕微鏡
HeLaおよびHEK293A細胞を、活性FBS(Life Technologies GmbH, Carlsbad, CA, USA, 10270106)、1×ABAM(Invitrogen, 15240-062)および1mMピルビン酸ナトリウム(Invitrogen, 1136-088)を補充したDMEM(Invitrogen, Carlsbad, CA, USA, 41965062)中で培養した。培地交換後、それぞれ10,1,および0.1μMのANAVEX2-73およびPRE-084(Tocris、Bristol、UK,0589)で2時間処理した;ANAVEX2-73はANAVEX Life Sciences Corp、New York、NY、USAから提供された。その後、Bafilomycin A1 (BafiA1) (Toronto Research Chemicals, North York, ON, Canada, B110000)をさらに2時間添加し、最終的に細胞を回収した。ウェスタンブロット分析は、以前に記載されたように実施した[40,41]。簡潔に言うと、細胞は、プレキャストNuPAGE 4%-12% Bis-Trisゲル(Invitrogen、NPO322)を使用してSDS-PAGEにさらされた。タンパク質は、Amersham Imager 600(GE)を使用して化学発光によって検出された。
GFP-LC3B を安定的に発現させた HEK293A 細胞の共焦点蛍光顕微鏡分析は、レーザー走査型顕微鏡 LSM 710 (Zeiss, Oberkochen, Germany) を用いて行った。
2.2. C. elegans 系統、維持管理、および方法
線虫は、HB101大腸菌を播種した線虫増殖培地(NGM)プレート上で標準的な手順に従って維持した。本研究では、以下の菌株を用いた。GFP-LGG-1(ex[Plgg1-lgg1-GFP]/pRF4;Beth Levineの親切な贈り物)20℃で維持した;および株CL2006(dvIs2 [pCL12(unc-54/ヒトAβペプチド1-42)+pRF4])以前に記載されているように、15℃で維持した[40,42]。後者の株は、Caenorhabditis Genetic Center(米国)から入手した。
麻痺率の分析のために、同期性CL2006線虫を、HB101大腸菌を播種したプレート上で15℃で培養し、M9緩衝液(コントロール)または100μMまたは50μM ANAVEX2-73にそれぞれ再懸濁した。成虫になった最初の日から、ワームを毎日新鮮なプレートに移し、プラチナワイヤーで鼻を叩いて麻痺の有無を調べた。鼻を動かしても体が動かないミミズは麻痺していると判定された。死んだミミズや他の表現型を示すミミズは統計に含めなかった。チオフラビンS(Sigma T1892)を用いたアミロイドβ42凝集体の染色は、以前に記載されているように行った[40]。ワームをガラススライド上の2%寒天パッド上にマウントし、レーザー走査型顕微鏡LSM710(Zeiss,Oberkochen)を用いて共焦点蛍光顕微鏡分析を行った。
オートファジー活性の分析のために、GFP-LGG-1を発現する同期線虫を20℃で培養した。成虫初日に、ワームを80μM ANAVEX2-73またはコントロールM9液体培地に2時間移し、その後、BafiA1またはジメチルスルホキシド(DMSO)(コントロール)で2時間処理した。その後、ワームをウェスタンブロットのために溶解し、または共焦点蛍光顕微鏡で分析した。
ウェスタンブロット分析は、前記[40]に記載されているように行った。一般に、12匹のワームをプレキャストNuPAGE 4%-12% Bis-Trisゲル(Invitrogen、NPO322)を用いてSDS-PAGEに供した。タンパク質は、Amersham Imager 600 (GE)を用いた化学発光により検出した。
2.3. 定量的リアルタイムPCR
RNA 抽出、逆転写、リアルタイム PCR は前記 [40] に記載されているように行った。
2.4. 統計的方法
統計的有意性は、SIGMA STAT (SPSS Science)を用いたStudent t-検定およびSPSS Statistics (IBM)を用いたlog-rank検定によって決定された。統計的有意性は、p ≤ 0.05のレベルで認められた。結果は平均値±標準偏差(SD)で表される。
3. 結果と考察
3.1. Sig1-RアゴニストANAVEX2-73がオートファジー活性を高める
オートファジーに対するANAVEX2-73の効果を調べるために、ヒトHeLa細胞をANAVEX2-73で処理し、LC3-IIのフラックスを調べてオートファジー活性を解析した。LC3-II は LC3 の脂質化した形態であり、オートファゴソームに(部分的に)付着したままで、リソソソームで分解される。したがって、リソソソーム分解を阻害するためのBafiA1を用いたLC3-IIフラックスの定量化は、適切なガイドライン[38]に従った細胞のオートファジー活性に直接対応している。図1に表示されているように、ANAVEX2-73は、コントロール条件と比較して有意にオートファジーフラックスを誘導する。ANAVEX2-73を適用した後のオートファジー活性のフラックスには濃度依存的で有意な増加がある。10μMで2倍以上、1μMのANAVEX2-73で1.5倍以上の増加(図1A)。オートファジーの誘導を誘発するための標準的なポジティブコントロールとして、HeLa細胞を、オートファジー刺激としての栄養欠乏に似たEBSS培地でインキュベートした。
図1 Sig-1Rの活性化はオートファジー活性を高める
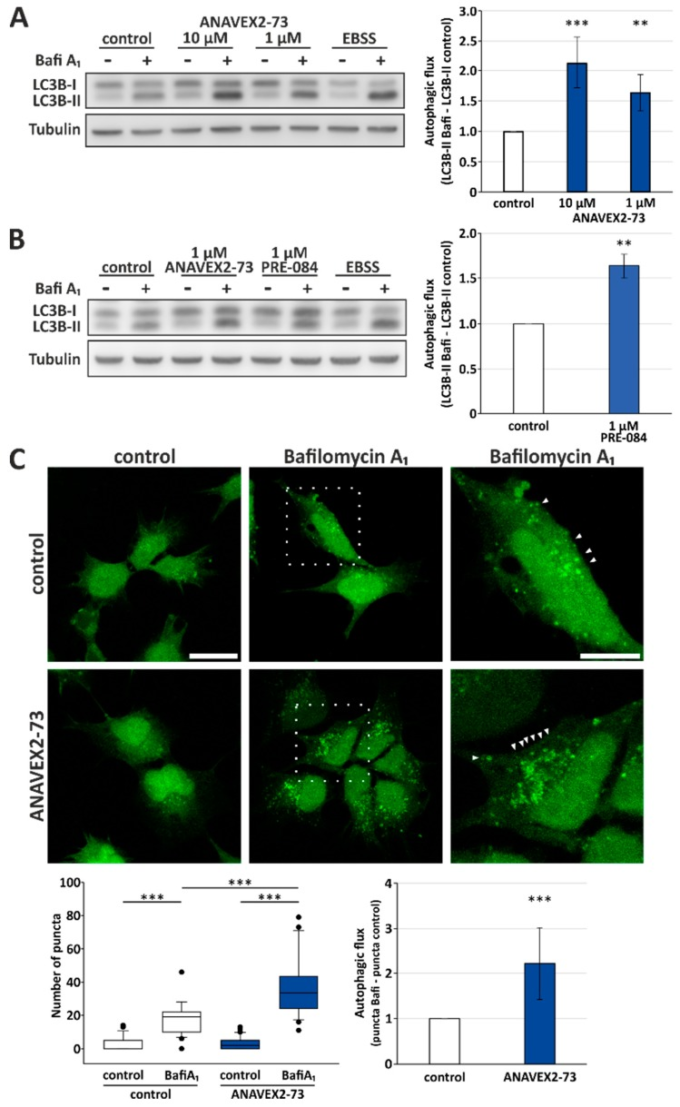
ANAVEX2-73(A)またはPRE-084(B)を添加した場合のオートファジーのフラックスのウェスタンブロット分析。HeLa細胞をANAVEX2-73,PRE-084,およびBafiA1(2μM)またはDMSOの指示された濃度で処理した。統計は、平均±SDとして描かれている。*** p ≤ 0.001,** p ≤ 0.01,t検定、n = 4。C)GFP-LC3Bレポーター構築物で安定的にトランスフェクションHEK293細胞の代表的な共焦点蛍光顕微鏡写真。細胞は、1μMのANAVEX2-73,BafiA1,および/またはDMSOで処理した。スケールバー=20μmまたは10μm、それぞれ。GFP陽性オートファゴソーム構造(矢印で示した)は、3つの独立した実験において、各処理ごとに約30個の細胞でカウントされた。*** p ≤ 0.001,t検定。
ここでは、Sig-1RアゴニストとしてANAVEX2-73に焦点を当てたが、もちろん、他の一般的で高選択性のSig-1Rアゴニストも入手可能であり、様々な細胞モデルや動物モデルで既に研究されている。そのような化合物としては、(+)-ペンタゾシン、(+)-SKF10,047,SA4503(1-[2-(3,4-ジメトキシフェニル)エチル]-4-(3-フェニルプロピル)ピペラジン)およびPRE-084(2-モルホリン-4-イルチル)-1-フェニルシクロヘキサン-1-カルボキシレート)が挙げられる[14]。Sig-1RリガンドであるPRE-084は、動物モデルでは中枢神経系で様々な活性を示しており、その中には強心作用や抗うつ作用などがあることがわかった[43]ので、この化合物をコントロールとしてフラックスアッセイの一部に含めた。興味深いことに、PRE-084はHeLa細胞においてもオートファジー活性を促進することがわかった。PRE-084はANAVEX2-73と同等のオートファジー活性を誘導する:1μMで1.5倍以上のオートファジー活性の誘導が観察された(図1B)。しかし、ANAVEX2-73とは対照的に、PRE-084をはじめとする実験化合物は臨床試験には適用できない。
次に、ウエスタンブロット実験を、HEK293細胞におけるオートファゴソーム出現の程度を直接可視化することによって補完した。そのために、我々は、GFP-LC3Bレポーター構築物を安定的に発現するHEK293細胞にANAVEX2-73を適用した。この細胞モデルでは、共焦点蛍光顕微鏡を用いて、BafiA1を補充した際のLC3-II陽性オートファゴソーム構造の蓄積を直接モニタリングすることができる[44]。実際、ANAVEX2-73処理は、全体的にLC3-II陽性パンク タの数を増加させ、その結果、オートファジーのフラックスを増加させた(図1C)。
まとめると、独立した細胞アッセイと2つの異なるヒト細胞株において、Sig-1R活性化は有意に増加したオートファジーフラックスを誘導した。もちろん、Sig-1RリガンドとしてのANAVEX2-73の効果の一部は、潜在的にムスカリン性ACh受容体での効果に起因する可能性があることを考慮する必要がある。しかし、オートファジーに対するmACh受容体の影響についてはあまり知られていない。実際、これまでのところ、ACh誘発オートファジーがムスカリン性ACh受容体活性化-AMPK-mTOR経路を介して細胞保護効果を有することを示す報告は文献の中で1件のみである[45]。一方、PRE-084も排他的選択的Sig-1Rアゴニストとしてオートファジーのフラックスを誘導していたことは、ANAVEX2-73のオートファジーに対する効果がSig-1R活性化を介していることを強く支持するものである。また、ムスカリン性ACh受容体の活性化がタンパク質の凝集やプロテオスタシスに有益な効果を示すという実験データは存在しなかった。
3.2. Sig-1R の活性化は ULK1 のリン酸化を誘導し、オートファジーネットワーク因子の発現レベルに影響を与える。
セリン 555 でのリン酸化を介したセリン/スレオニンプロテインキナーゼ ULK1 (unc-51-like kinase 1) の活性化は、正規のオートファジー経路の刺激を示している。ANAVEX2-73は、ULK1セリン555リン酸化を有意に誘導した(1 µMで最大2倍;図2A)。また、PRE-084をSig-1Rアゴニストとして解析したところ、PRE-084も同様にULK1のセリン555リン酸化を促進することがわかった(1 µMで最大1.5倍; 図2B)。この活性化されたULK1リン酸化は、AMPKキナーゼ[46]を介して刺激されるだけでなく、mTORによっても阻害され得ることに言及しなければならないが、これらは両方とも栄養状態の基礎生理学的センサーであり、定型的なオートファジー刺激の主要なシグナル伝達物質である。ULK1は実際には、オートファジープロセス中のファゴフォア形成の誘導を媒介するシグナルであり、したがって、オートファジーの中心的なプロモーターである。ULK1自体は、少なくとも3つのタンパク質パートナーとの複合体で機能する。FIP200(200kDaの焦点接着キナーゼファミリー相互作用タンパク質)ATG13,およびATG101である。上流経路(mTORとAMPKを含む)の複雑なパターンがULK1に収束していることから、この複合体は複数のシグナルをオートファゴソーム形成に変換するノードとして機能していることが示唆されている[47]。
図2 Sig-1Rの活性化はULK1の活性化を刺激し、異なるオートファジーネットワーク因子の発現レベルに影響を与える

A)HeLa細胞を1μMのANAVEX2-73で処理した際のセリン555(pS555)でのULK1リン酸化のウェスタンブロット分析。統計は平均値±SDで示されている。** p ≤ 0.01,t検定、n = 4。B)HeLa細胞を1μM PRE-084で処理した際のセリン555(pS555)でのULK1リン酸化のウェスタンブロット分析。統計は平均値±SDで示されている。* p ≤ 0.05,t検定、n = 4。C)オートファジーネットワーク因子の相対的な発現レベルをオートファジーqPCRアレイを用いて解析した。各遺伝子の発現量を対照細胞(1とした)との関係で示し、アップレギュレーションのしきい値を1.5,ダウンレギュレーションのしきい値を0.67とした。
我々は、Sig-1Rの活性化がULK1のリン酸化およびオートファジーフラックスを有意に誘導することを発見したので、次に、我々は、qPCRオートファジーアレイを使用して、HeLa細胞をANAVEX2-73で処理した後、オートファジープロセスの異なるセットポイントを表す主要なオートファジーネットワーク因子の相対的な発現レベルを調査した(図2C)。最も顕著なのは、GABA Type A Receptor Associated Protein Like 1(GABARAPL1;約2.7倍の発現増加;発現レベル1.5で誘導のカットオフを設定)のmRNA発現のANAVEX2-73介在による誘導を発見したことである。
GABARAPL1は、オートファジーにおいて部分的に冗長な役割を持つ6つのATG8オルソログ、MAP1LC3A、MAP1LC3B、MAP1LC3C、および3つのMAP1LC3パラログ、GABA受容体関連タンパク質GABARAP1,GABARAPL1,およびGABARAPL2からなるヒトMAP1LC3ファミリーに属している[38]。また、選択的マクロオートファジー経路に関与するユビキチン・オートファジー受容体SQSTM1/p62の発現は、ANAVEX2-73によって増強された(発現レベルは約1.9)。さらに、ATG5と共役してオートファゴソームタンパク質複合体を構築し、最終的にオートファゴソームバイオジェネシスにおいてATG16L1と一緒に作用するATG12の誘導の傾向も明らかであった[49];一貫して、ATG16L1の発現もANAVEX2-73で処理するとわずかに増強されるようであった(図2C)。さらに、このqPCRアレイに含まれるオートファジーネットワーク因子のいずれも、ANAVEX2-73で処理した際に発現がダウンレギュレートされなかったことは明らかであり、Sig-1Rの活性化がオートファジーに対して正の調節効果を持つという重要な知見を支持するものである。
3.3. ANAVEX2-72 はオートファジーを積極的に制御し、プロテオスタシス能を増加させ、C. elegans のタンパク質凝集介在性麻痺を改善する。
そこで、線虫を用いて、ANAVEX2-73によるSig-1Rの活性化がオートファジーおよびプロテオスタシスに与える影響を解析した。線虫では、ヒトの Sig-1R の線虫オルソログは W08F4.3 であり、筋肉系を含むいくつかの組織に発現している。また、生体内でのオートファージックフラックスをモニターするために、GFP-LGG-1レポーターワーム株を使用した。LGG-1 は哺乳類 GABARAP の線虫オルソログであり、GFP タグ付きタンパク質はウェスタンブロッティングや共焦点蛍光顕微鏡によるオートファジー活性の評価に使用することができる。ウェスタンブロッティングを用いて、図1に示すように、HeLa細胞におけるフラックス測定と同様に、GFP-LGG-1-IIとBafiA1を併用した場合と併用しない場合のレベルを分析した。実際、ANAVEX2-73はC.elegansのオートファージックフラックスをほぼ2倍に増加させた(図3A)。この知見をさらに実証するために、我々は共焦点蛍光顕微鏡を使用して、GFP-LGG-1陽性パンク タ[40]によって示されるように、オートファゴソーム構造を直接可視化した。ANAVEX2-73の補充(プラス/マイナスBafiA1)は、有意にオートファジー活性の増加を示しているGFP-LGG1パンククタの数を増加させた。実際、我々は有意な増加を発見した。生体内で観察されるオートファジー活性のフラックスは、ANAVEX2-73によって約2.5倍に誘導される(図3B)これはウエスタンブロット分析(図3A)と一致している。
図3 ANAVEX2-73 による Sig-1R の活性化により、線虫のオートファジーが促進された
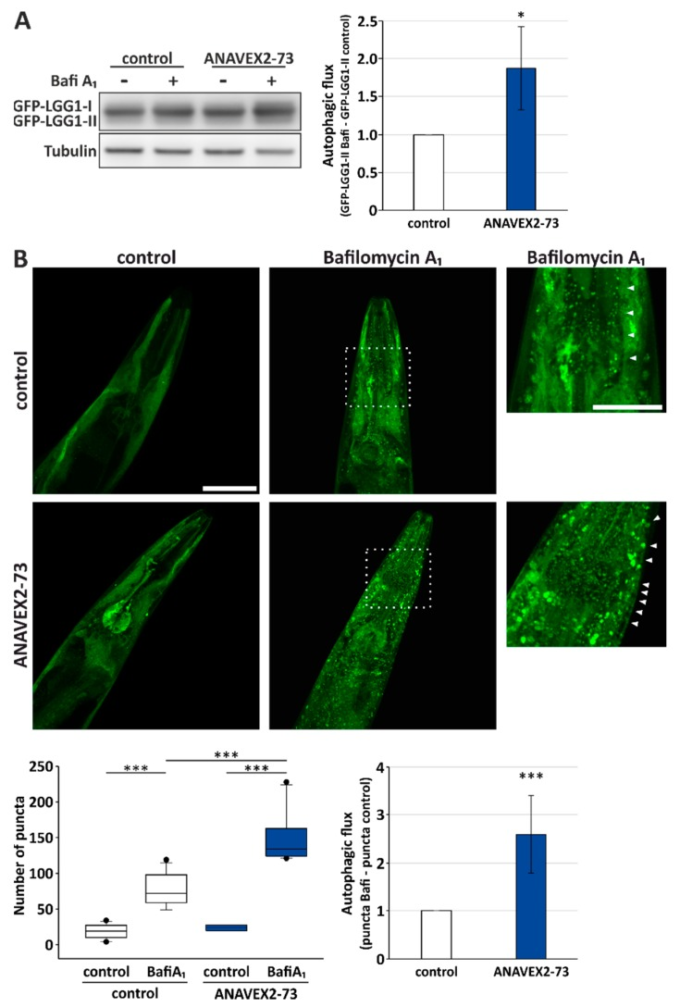
(A) 線虫を80μMのANAVEX2-73で処理した後のGFP-LGG1のウエスタンブロット解析。統計量は平均値±SDで示されている。* p ≤ 0.05,t検定、n = 3。B)80μMのANAVEX2-73とBafiA1またはDMSOで処理したC.elegansの代表的な共焦点蛍光顕微鏡像(合計2時間)。スケールバー=50および25μm。GFP陽性オートファゴソーム構造(矢印で示す)の数を、3つの独立した実験で、各実験で、ワームの少なくとも8〜11個のそれぞれの頭部領域でカウントした。オートファジーフラックスは、GFP陽性パンククタとBafiA1を加えたパンククタを対照のパンククタと比較して、示されたように計算された*** p ≤ 0.001,t検定。
以上のことから、これまでの試験管内試験および生体内試験のデータは、オートファジーフラックスの測定によって示されるように、Sig-1RアゴニストANAVEX2-73がオートファジーを誘導することを明確に示している。このことから、我々は、オートファジー誘導の機能的帰結を、生体内でのプロテオスタシスに対する分解経路の影響に焦点を当てて、さらに調べることを勧められた。したがって、我々は、体壁筋細胞内のAβ42オリゴマーと高分子量の凝集体の蓄積に起因する時間依存性の麻痺を特徴とするヒトAβ42発現ワームを採用した[50,51];それは、Aβ42発現ワームは、ADのモデルとしてではなく、むしろ筋細胞内のタンパク質凝集が明確な表現型(ここでは麻痺)を行うことにつながる一般的なプロテオスタシスストレスとプロテオ毒性の実験モデルとして考えられていることをここで強調している[40]。Aβ42タンパク質凝集体をチオフラビンでin situ染色した。コントロールワームと比較して、Aβ42ワームをANAVEX2-73で処理すると、チオフラビン陽性のAβ42凝集体の数が減少した(図4A)オートファジーの誘導は、おそらくAβ42凝集体のクリアランスが強化されることによって、プロテオスタシスに影響を与え、その結果、凝集体の減少した組織沈着をもたらすことを示唆している。筋細胞におけるAβ42凝集体の蓄積は、時間の経過とともにミミズの麻痺を促進することが知られている[40,50]。ANAVEX2-73誘導オートファジーの時間依存性運動行動への影響を解析するために、この麻痺の程度を調べた。C. elegansを本化合物(または対照としてM9緩衝液)で12日間まで処理し、麻痺の程度を毎日定量した。2つの濃度のANAVEX2-73(50と100μM)を用いて、2つのANAVEX2-73処理群で麻痺が明らかに減少していることを発見した;これらの群は麻痺の程度に関してコントロールから明らかに分離している(図4B)。ANAVEX2-73は明らかに麻痺速度を減速させ、Aβ42を発現するワームの時間依存性の運動障害を打ち消する。
図4 ANAVEX2-73によるSig-1Rの活性化は線虫のプロテオスタシス能力を向上させ、Aβ42による麻痺を改善する

A)80μMのANAVEX2-73またはM9培地(コントロール)で処理した線虫の頭部領域におけるチオフラビンS陽性Aβ42凝集体の代表的な共焦点蛍光顕微鏡写真、9日間連続。スケールバー=50μm。B)Aβ42誘導性麻痺の分析。ワームをANAVEX2-73またはM9緩衝液の存在下で維持し、麻痺表現型を毎日調べた。統計は対数順位検定を用いて行った。麻痺画分は、ANAVEX2-73処理したワームとコントロールワームを比較して有意に異なっている。処理あたり約70匹のワームの合計で3つの独立した実験。黒=コントロール、ライトグレー= 50μMのANAVEX2-73,ダークグレー= 100μMのANAVEX2-73。
Sig-1R アゴニストを介したオートファジー誘導が、ワームのタンパク質凝集やプロテオトキシン誘発性運動障害を減少させることで、プロテオスタシスに直接影響を与えるという我々の知見は、タンパク質のホメオスタシスの不均衡に関連する神経変性の予防(および治療)において、Sig-1R 活性化が果たす役割の可能性を示唆している。今回観察されたANAVEX2-73によるプロテオスタシス能の亢進と同様に、タンパク質のホメオスタシスが高度に障害され、細胞内タンパク質の凝集が特徴的なALSにおいても、Sig-1Rの欠乏や機能障害が関与していることが報告されている。例えば、(1)Sig-1Rのミスセンス変異がALSの原因となることが示されている[24]、(2)Sig-1Rのノックアウトがスーパーオキシドジスムターゼ1 SOD1変異マウスの疾患を加速させることが示されている[52]、(3)ALSに関連した変異体Sig-1Rはオートファジー物質の蓄積とオートファジーの低下を引き起こすことが示されている[34]。さらに、Sig-1R活性の保護的役割の裏付けとして、(1)実験薬PRE-084を投与するとSOD1マウスの病態が改善されること[53]、(2)変異Sig-1Rの発現は細胞内のALSリンクTDP43とFUSの蓄積を誘導すること[34]、(3)PRE-084はALSマウスの運動機能と運動ニューロンの生存を改善することが以前に報告されている[53]。最近では、Sig-1R受容体の過剰発現により、SQSTM1/p62とLC3Bパンククタの数が増加し、ヒトの疾患組織におけるオートファジー活性化を示唆することが示された[54]。
オートファジー過程のいくつかのステップは治療的な調節が可能であり、様々なオートファジー活性化化合物は、すでに様々な実験レベル(試験管内試験および生体内試験)や、癌や神経変性を含むヒト疾患モデルで研究されている[55]。もちろん、神経変性疾患への効果的な介入については、中枢神経系を対象としたヒトでの研究が予定されている化合物については、毒性や安全性の問題に加えて、血液脳関門の伝染性も確保しなければならない。オートファジーを標的とした化合物の一例として、双極性障害の治療に使用されているリチウムがあるが、これもオートファジー誘導の上流工程を阻害することでオートファジーを活性化する。メトホルミンとシンバスタチンもまた、AMPKの活性化を介してオートファジーを促進することが実験的に示されており、それぞれ糖尿病と肥満の治療に用いられている[55]。Sig-1Rアゴニストは、ADやALSを含む様々な神経変性疾患の治療のために精力的に研究されている[15,56,57]。実際、この化合物は神経発達疾患(レット症候群)だけでなく、神経変性疾患(AD、PD)の両方で臨床試験が行われている。今回発表されたデータに基づき、オートファジーを促進することでタンパク質の恒常性を安定化させるSig-1Rアゴニストを使用することは、このような治療アプローチに付加価値をもたらす可能性があり、神経変性疾患の予防および治療のための更なる臨床研究を強く支持するものであると考えられる。
以上の結果から、Sig-1Rの活性化がヒト細胞および線虫においてオートファジーの活性化を促進し、プロテオスタシスにも効果があることが初めて明らかになった。我々は、Sig-1R/ムスカリンの二重選択的活性を有する化合物ANAVEX2-73の神経細胞での新規活性を報告した。この化合物の新規活性は、試験管内試験および生体内試験でオートファジーを強力に誘導し、プロテオスタシス能力を高め、Aβ42を発現する線虫の時間依存性麻痺表現型にも有益な効果をもたらした。このように、オートファジープロセスを特異的に誘導し、神経細胞のプロテオスタシスを安定化させることは、神経細胞の生存と機能を安定化させるための重要な概念の一つであり、加齢に伴う神経変性の予防に役立つ可能性があると考えられる。最後に、Sig-1Rが新規なオートファジー調節因子であるという新たな発見は、Sig-1Rの謎を解く天然リガンドの探索を含め、今後のSig-1Rの研究を後押しするものとなるかもしれない。
