Contents
Repurposing of CNS drugs to treat COVID-19 infection: targeting the sigma-1 receptor
2021年1月5日
要旨
新型新型コロナウイルス感染症(COVID-19)は、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)によって引き起こされる。SARS-CoV-2の感染者数がエスカレートしていることから、世界的なパンデミックのステータスを持つウイルスの広がりが認められている。しかし、いくつかの薬剤が承認されているものの、COVID-19を治療するための予防薬や治療薬は市販されていない。
最近、比較ウイルス-ヒトタンパク質-タンパク質相互作用マップを用いた2つの論文により、小胞体中のシグマ-1受容体が細胞内でのSARS-CoV-2複製において重要な役割を果たしていることが明らかになった。SIGMAR1(SIGMAR1によってコードされるシグマ-1受容体)のノックアウトおよびノックダウンは、SARS-CoV-2複製のロバストな減少をもたらし、このことは、シグマ-1受容体がSARS-CoV-2複製の重要な治療標的であることを示している。
興味深いことに,最近の臨床試験では,シグマ-1受容体に高い親和性を有する抗うつ薬フルボキサミンを投与することで,SARS-CoV-2に感染した成人外来患者の臨床症状の悪化を予防できることが示された。
このレビューでは、シグマ-1受容体の簡単な歴史と、SARS-CoV-2の細胞内での複製における役割について述べている。
ここでは、シグマ-1受容体に高い親和性を持つ従来の中枢神経系(CNS)薬(フルボキサミン、ドネペジル、イフェンプロジルなど)をSARS-CoV-2感染者の治療に再利用することを提案している。最後に,CUTAMESINEやARKETAMINEなど他の中枢神経系の候補薬の可能性について考察した。
キーワード 小胞体、複製、シグマ-1受容体
序論
新型コロナウイルス感染症(COVID-19)は、新規RNAウイルスSARS-CoV-2によって引き起こされる急性呼吸器疾患である。2019年12月に中国・武漢でSARS-CoV-2が検出されて以降、世界的にSARS-CoV-2の感染者数が著しく増加している。2020年12月16日、ジョンズ・ホプキンス大学コロナウイルスリソースセンターの報告書によると、世界の感染者数は73,992,814人、世界の死亡者数は1,645,136人となっている。2021年に近づくにつれ、様々な地域でCOVID-19感染の第2波、第3波が発生している。そのため、COVID-19感染者に対する予防薬や治療薬の早期開発が求められている。COVID-19を治療するための多くの候補薬の臨床試験が現在進行中である[1-3]。
医薬品の再利用は、開発と承認に必要なスピードと低コストのため、COVID-19パンデミックに対する有望なアプローチである[4-8]。蓄積された証拠は、SARS-CoV-2感染が中枢神経系(CNS)に劇症的な影響を及ぼし、感染者の精神医学的および神経学的症状を引き起こす可能性があることを示唆している[9-13]。また、COVID19感染妊婦の子孫における自閉症スペクトラム障害などの神経発達障害のリスクが議論されている[14,15]。
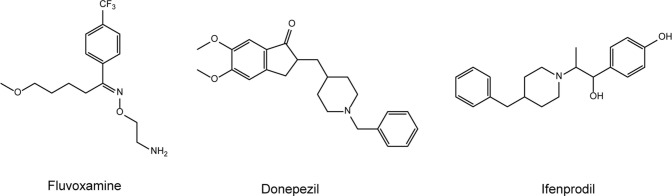
2020年11月12日、Lenzeら[16]は、シグマ-1受容体に高い親和性を持つ中枢神経系薬剤である抗うつ薬フルボキサミン(図1)が、SARS-CoV-2に感染した成人外来患者の臨床症状の悪化を予防できることを実証した。パイロットデータは、SARS-CoV-2感染者の重症化を防ぐことが重要であることを示している[17]が、より大きなサンプルサイズを用いた更なる試験が必要である。
図1 フルボキサミン、ドネペジル、イフェンプロジルの化学構造

このレビューでは、著者は小胞体(ER)タンパク質シグマ-1受容体の簡単な歴史と、SARS-CoV-2の細胞内複製におけるシグマ-1受容体の役割を評価している。最後に、シグマ-1受容体アゴニズムを有する従来の中枢神経系薬剤が、SARS-CoV-2感染者の治療のための予防薬になる可能性があることを提案する。
SARS-CoV-2複製による小胞体ストレス
SARS-CoV-2はエンドサイトーシスと呼ばれる過程を経てスパイク糖タンパク質を介して細胞内に入る。その後、SARS-CoV-2の複製は、小胞体(ER)由来の中間コンパートメントであるER-ゴルジ(ER-Golgi)で行われる(図2)[1, 18]。SARS-CoV-2の複製によるERストレスが炎症イベント(サイトカインストーム)に寄与し、高死亡率を伴う急性呼吸窮迫症候群の重篤な症状を引き起こす可能性が示唆されている(図2)[1, 18-21]。ある症例対照研究では、SARS-CoV-2陽性者でERストレスマーカー[すなわち、グルコース調節タンパク質78(GRP78)C/EBP相同タンパク質(CHOP)phospho-extracellular signal regulated kinase(PERK)]のレベルが高いことが示されている[22]。これらをまとめると、ERはSARS-CoV-2感染症の管理のための潜在的な治療標的となりうる可能性がある[20, 23]。
図2 SARS-CoV-2の複製サイクルにおけるシグマ-1受容体の役割
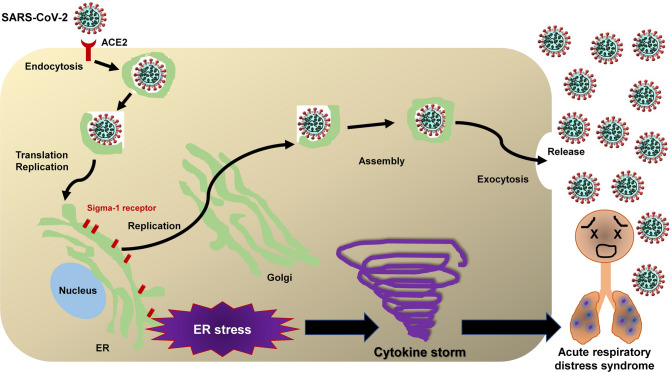
SARS-CoV-2の細胞内複製サイクルにおけるERおよびERストレスにおけるシグマ-1受容体の役割。SARS-CoV-2はスパイク蛋白質を介して細胞表面のACE2(アンジオテンシン変換酵素2)受容体に結合し、エンドサイトーシスを誘発する。SARS-CoV-2の複製は、その後、ER-ゴルジのER由来の中間コンパートメントで行われる。SARS-CoV-2の複製によるERストレスが炎症イベント(サイトカインストーム)を引き起こし、急性呼吸窮迫症候群の重篤な症状を引き起こし、高い死亡率を伴うことが示唆されている。ER内のシグマ-1受容体は、細胞内でのSARS-CoV-2の複製に重要な役割を果たしている[41,42]。この図は、Zhangら[1]から少し改変したものである。
シグマ-1受容体の簡単な歴史
1976年、Martin博士らは、シグマ受容体が、原薬SKF-10,047(N-アリルノルメタゾシン)の特異的な精神催眠作用を媒介するサブタイプのオピオイド受容体であることを最初に提案した[24]。その後、1982年にSu博士[25]が[3H](+)SKF-10,047の特異的な結合部位を報告し、オピオイド受容体拮抗薬(すなわち、ナロキソンおよびナルトレキソン)に対して耐性があることが証明された。代表的な抗精神病薬ハロペリドールは、シグマ受容体に結合する[3H]SKF-10,047で非常に高い親和性(IC50 = 7.0 nM)を有していた[25]。Su博士によって報告された結合部位は、後に古典的なオピエート受容体と区別するために「シグマ受容体」と呼ばれるようになった。受容体の結合研究では、シグマ-1受容体とシグマ-2受容体という少なくとも2つのサブタイプが存在することが示されている。
1997年に、223アミノ酸からなる単一のポリペプチドであるシグマ-1受容体がクローニングされた。この受容体には、ERリテンションシグナルが含まれている[26]。2007,Hayashi and Su [27]は、シグマ-1受容体が、様々な細胞機能を制御する新規なER分子シャペロンとして機能しうることを報告した。このアッセイでは、シグマ-1受容体アゴニスト(すなわち、フルボキサミン、フルオキセチン)は、シグマ-1受容体の別のERシャペロンであるBiP/GRP78からの解離を促進し、細胞内でシグマ-1受容体シャペロン活性をもたらす。対照的に、シグマ-1受容体アンタゴニスト(すなわち、ハロペリドール、NE-100)は、この結合を強化し、それによってシグマ-1受容体アゴニストの作用を遮断する[27,28]。2017年には、シグマ-2受容体がTMEM97(膜貫通タンパク質97またはMAC30)として同定され、これはER常駐型の膜貫通タンパク質である[29]。
実質的な証拠は、シグマ-1受容体が多くの精神疾患および神経変性疾患の病態生理に役割を果たしていること、およびシグマ-1受容体アゴニストが多くの中枢神経系障害において有益な効果を有することを示唆している[30-40]。
SARS-CoV-2複製におけるシグマ-1受容体の役割
2020年4月30日、SARS-CoV-2-ヒトタンパク質-タンパク質相互作用マップを用いた研究により、SARS-CoV-2とヒトタンパク質との間に332の高信頼性タンパク質-タンパク質相互作用が同定された[41]。興味深いことに、シグマ-1およびシグマ-2受容体に対する複数の化合物が、SARS-CoV-2複製の有望な阻害剤として同定された[41]。シグマ-1受容体リガンドとしては、クロロキン、クレマスチン、デキストロメトルファン、ハロペリドール、E-52862,PB28,PD-144418,およびRS-PPCCが挙げられる。シグマ-2受容体リガンドとしては、クレマスチン、クロロキン、ハロペリドール、PB28,PD-144418,およびRS-PPCCが挙げられる。このアッセイでは、PB28はヒドロキシクロロキンの約20倍の効力を有していた。
2020年10月15日、同じグループ[42]は、SARS-CoV-2の機能的宿主依存性因子としてシグマ-1受容体(SIGMAR1によってコードされる)を同定した。彼らは、SIGMAR1のノックアウトまたはノックダウンが、SIGMAR2(TMEM97としても知られている)ではなくSIGMAR1のノックアウトまたはノックダウンが、SARS-CoV-2複製のロバストな減少をもたらしたことを実証し、これはシグマ-1受容体がSARS-CoV-2複製の鍵となる標的であることを示している。本研究では、3種類の代表的な抗精神病薬(ハロペリドール、フルフェナジン、クロルプロマジン)をSARS-CoV-2阻害アッセイで比較した。SARS-CoV-2に対する阻害作用の順序は、クロルプロマジン(pIC50=6.050)>フルフェナジン(pIC50=6.460)>ハロペリドール(pIC50=5.684)である[42]。しかし、これらの化合物のシグマ-1受容体での結合親和性は、ハロペリドール(Ki = 4 nM)>フルフェナジン(Ki = 17 nM)>クロルプロマジン(Ki = 180 nM)の順であった[43]。このように、これらの化合物のSARS-CoV-2複製阻害活性は、シグマ-1受容体に対する活性とは関連していなかった。ハロペリドールは強力なシグマ-1受容体拮抗薬であるため[27, 28]、シグマ-1受容体の遮断がSRAS-CoV-2の抗ウイルス活性に寄与するかどうかは不明である。
予備解析では、シグマ-1受容体に高または中等度の親和性を有する典型的な抗精神病薬(ハロペリドール、クロルプロマジン、フルフェナジンなど)を投与された患者の転帰は、シグマ-1受容体に親和性のない非典型的な抗精神病薬(アリピプラゾール、オランザピン、クエチアピン、リスペリドン、brexpiprazole、パリペリドンなど)を投与された患者の転帰よりも良好であった[42]。これらのデータから、SARS-CoV-2感染者の臨床症状の悪化を予防するために、典型的な抗精神病薬が有益な効果を有すると結論づけることはできないが、データは支持を集めている。典型的な抗精神病薬ハロペリドール(強力なシグマ-1受容体拮抗薬)とシグマ-1受容体親和性のない非定型抗精神病薬を用いた、さらなる無作為化対照試験が必要である。
それにもかかわらず、Nature誌とScience誌に掲載された2つの論文は、多くの中枢神経系薬剤がシグマ-1受容体に高~中等度の親和性で結合することが報告されているため、COVID-19感染症患者に対するシグマ-1受容体化合物の使用を強く推奨している[41, 42, 44]。しかしながら、シグマ-1受容体リガンドのどの薬理学的活性(すなわち、アゴニストまたはアンタゴニスト)がSARS-CoV-2複製の活性に関与しているのかは不明のままである。
ハロペリドールとその他の抗精神病薬
ハロペリドール(Ki = 4 nM)ペルフェナジン(Ki = 12 nM)フルフェナジン(Ki = 17 nM)トリフルペラジン(Ki = 67 nM)ピモジド(Ki = 144 nM)クロルプロマジン(Ki = 180 nM)およびトリフルプロマジン(Ki = 214 nM)などの代表的な抗精神病薬は、シグマ-1受容体に高~中等度の親和性を有する[43]。ハロペリドールは強力なシグマ-1受容体アンタゴニストであるが、他の抗精神病薬(すなわちクロルプロマジン)の薬理活性(アンタゴニストまたはアゴニスト)は不明である。対照的に、クロザピンやオランザピンなどの非定型抗精神病薬はシグマ-1受容体に結合しない[43]。オランザピン、アリピプラゾール、パリペリドン、リスペリドン、クエチアピンなどの非定型抗精神病薬は抗ウイルス活性を示さなかった[41,42]。
中等度型COVID-19(WHO-OSCI 3-5)の成人被験者(n = 40)を対象とした標準治療プロトコルに従ったクロルプロマジンのランダム化臨床試験(ClinicalTrials.gov Identifier: NCT04366739)がフランスのパリで進行中である。さらに、エジプトのカイロでは、COVID-19を有する成人(n=100)を対象とした標準治療プロトコルに従ったクロルプロマジンの単盲検無作為化臨床試験(ClinicalTrials.gov Identifier: NCT04354805)が進行中である。近い将来に結果が出ることが期待されている。
ハロペリドールなどの代表的な抗精神病薬は、強力なドーパミン-D2受容体拮抗作用により錐体外路性副作用を生じることが知られている。さらに、ハロペリドールの反復使用は、脳内のドパミン-D2受容体のアップレギュレーションを引き起こし、結果としてドパミン過敏症を引き起こす可能性がある[45]。以上のことから、ハロペリドールは強力なシグマ-1受容体拮抗作用を有するにもかかわらず、SARS-CoV-2患者には適した薬剤ではないと考えられる。シグマ-1受容体拮抗薬の方がSARS-CoV-2の複製を阻害するにはシグマ-1受容体拮抗薬の方が優れている場合、大正製薬株式会社(日本、東京)による第I/II相試験で示されたように、ドーパミン-D2受容体拮抗薬を使用しない選択的シグマ-1受容体拮抗薬NE-100が適しているかもしれない[46]。大正製薬株式会社(日本、東京)による第I/II相試験で示されたように[46]。
フルボキサミンとその他の抗うつ薬
選択的セロトニン再取り込み阻害薬(SSRI)やセロトニンおよびノルエピネフーリン再取り込み阻害薬(SNRI)などの抗うつ薬は、うつ病や不安症など多くの精神疾患の治療に使用されてきた。1996年に我々は、フルボキサミン、セルトラリン、フルオキセチン、シタロプラムなどのいくつかのSSRIが、ラット脳内のシグマ-1受容体に高~中等度の親和性を有することを実証した(表(表1)1)[47]。2014年には、SNRI(デュロキセチン、ベンラファキシン、ミルナシプラン)ミルタザピン(ノルアドレナリン・特異的セロトニン系抗うつ薬)を含む新規抗うつ薬のシグマ-1受容体での結合親和性を報告した[48]。シグマ-1受容体におけるSSRIの力価は、フルボキサミン>セルトラリン>フルオキセチン>エスシタロプラム>シタロプラム>パロキセチンの順であった(表(表1).1)。また、SNRIとミルタザピンは、シグマ-1受容体で非常に弱い親和性を示した(表11)。さらに、フルボキサミン、フルオキセチンおよびエスシタロプラムは、PC12細胞における神経成長因子(NGF)誘発性神経突起の伸長を有意に増強し、これらのSSRIの効果はNE-100によって拮抗された[48, 49]。さらに、フルボキサミンとフルオキセチンのNGF誘発性神経突起の増殖に対する効果は、セルトラリンによって拮抗されており、これはセルトラリンがシグマ-1受容体拮抗薬である可能性を示唆している[48]。
表1 ラット脳におけるシグマ-1受容体に対する抗うつ薬の親和性
| 抗うつ薬 | Ki(nM) | アクション |
|---|---|---|
| フルボキサミン(SSRI) | 36 A又は17.0 B | アゴニスト |
| セルトラリン(SSRI) | 57 A又は31.6 B | 拮抗薬 |
| フルオキセチン(SSRI) | 240 A又は191.2 B | アゴニスト |
| エスシタロプラム(SSRI) | 288.3 b | アゴニスト |
| シタロプラム(SSRI) | 292 Aまたは403.8 B | nd |
| イミプラミン(TCA) | 343 a | アゴニスト |
| デシプラミン(TCA) | 1987 a | |
| パロキセチン(SSRI) | 1893 Aまたは2041 B | |
| デュロキセチン(SNRI) | 3533 b | |
| ベンラファキシン(SNRI) | > 10,000 b | |
| ミルナシプラン(SNRI) | > 10,000 b | |
| ミルタザピン(NaSSA) | > 10,000 b |
SSRI選択的セロトニン再取り込み阻害剤、SNRIセロトニン・ノルアドレナリン再取り込み阻害剤、TCA三環系抗うつ剤、NaSSAノルアドレナリン・特異的セロトニン作動性抗うつ剤、n.d.未定
aNaritaら[47]
bIshima er al
生体内試験マウスモデルを用いて、フルボキサミンがシグマ-1受容体の活性化を介してフェンシクリジン(PCP)治療後のマウスの認知障害を改善したのに対し、セルトラリンとパロキセチンはPCP治療後の認知障害を改善しなかったことを明らかにした[50, 51]。これらの知見は、フルボキサミンとセルトラリンがそれぞれシグマ-1受容体でアゴニストとして、またアンタゴニストとして機能している可能性を示唆している。いくつかの臨床研究では、統合失調症患者の認知障害に対するフルボキサミンの有益な効果が実証されている[52-55]。フルボキサミンは、現在入手可能な抗うつ薬の中で最も強力なシグマ-1受容体アゴニストである。
11C]SA4503を用いた陽電子放出断層撮影(PET)試験では、フルボキサミン(50-200mg)を経口投与すると、ヒトの脳内でシグマ-1受容体に結合することが明らかになり、治療用用量のフルボキサミンがシグマ-1受容体に結合することが示唆された[56]。これらの知見は、シグマ-1受容体での活性化がヒトにおけるフルボキサミンの薬理作用に関与していることを示している[32-35, 57]。
ICU患者または敗血症に対するフルボキサミン
せん妄は、集中治療室(ICU)に入院している高齢患者の間で非常に多くみられる疾患である。古瀬・橋本ら[58]は、ICU患者のせん妄に対するフルボキサミンの有益な効果を明らかにした5例を報告しており、急性大動脈解離、外傷性くも膜下出血、脳挫傷、腎盂腎炎による敗血症、脳梗塞、肺気腫、重症肺炎などである。フルボキサミンはICU患者において有益な効果を示したが、これらの症例からその作用機序を決定することはできない。
2019,Rosenら[59]は、敗血症性ショックのマウスモデルにおいて、ERのシグマ1受容体がサイトカインの産生に必須であり、フルボキサミンが炎症反応や致死的敗血症性ショックから保護しうることを報告した。シグマ1ノックアウト(KO)マウスは、亜致死量(5mg/kg)のリポ多糖(LPS)を投与した後、野生型マウスと比較して死亡率が増加したことから、シグマ1受容体が全身の炎症を抑制することが示唆されている[59]。さらに、フルボキサミンは敗血症モデルの臨床スコアを有意に改善し、LPS投与マウスの生存率を向上させた[59]。以上のことから、強力なシグマ-1受容体アゴニストであるフルボキサミンが、SARS-CoV-2の複製に伴う小胞体ストレスに関連した炎症イベント(サイトカインストーム)を改善できることが強く示唆された(図2,33)。
図3 SARS-CoV-2感染者の治療におけるシグマ-1受容体アゴニストの予防効果の提案スキーム
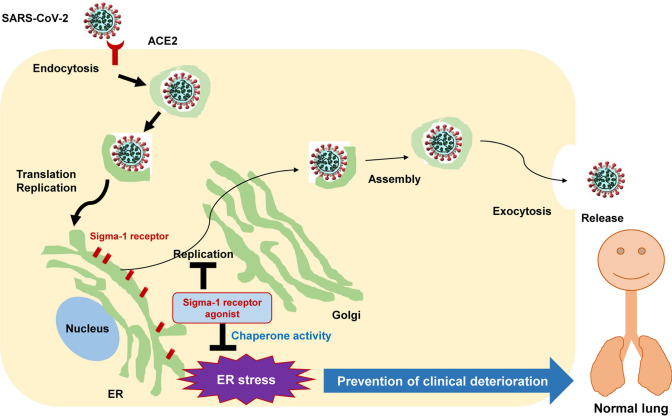
最近の研究では、シグマ-1受容体リガンドがSARS-CoV-2の複製を減衰させることが示されている[41, 42]。シグマ-1受容体シャペロン活性を介して、強力なシグマ-1受容体アゴニズムを有する従来の中枢神経系化合物(フルボキサミン、ドネペジル、イフェンプロジル)は、SARS-CoV-2の複製に起因する細胞内の小胞体ストレスを減衰させ、その結果、炎症性イベント(すなわち、サイトカインストーム)に対する遮断をもたらす可能性がある。したがって、シグマ-1受容体アゴニストを用いた早期治療は、SARS-CoV-2感染個体における臨床的悪化をブロックするか、または遅らせることができる。少し変更したものを図2に示すが、Zhangら[1]からの引用である。
SARS-CoV-2感染症外来でのフルボキサミンの使用について
2020年11月12日、Lenzeら[16]は、SARS-CoV-2に感染した成人外来患者を対象に、フルボキサミンを用いた臨床増悪の予防に関する論文を発表した。この試験では、フルボキサミン群(n = 80)の患者6人(n = 72)とプラセボ群(n = 72)の患者6人と比較して、フルボキサミン群(n = 80)のいずれも呼吸器悪化の基準を満たしていなかった。本試験はサンプルサイズが小さいため、大規模なサンプルサイズを用いたさらなる試験が強く望まれる。COVID-19(ClinicalTrials.gov Identifier: NCT04668950)を用いた成人被験者(n = 880)を対象としたフルボキサミンの完全遠隔無作為化プラセボ対照臨床試験が同じグループによって進行中である。
この試験では、フルボキサミンは強力なシグマ-1受容体アゴニズムを有することから選択された[16]。ERシグマ-1受容体アゴニストのシャペロン活性の役割を考えると、フルボキサミンの強力なシグマ-1受容体活性がこれらの患者における有益な作用に寄与する可能性がある。しかし、今回の試験では、SARS-CoV-2感染者におけるフルボキサミンのシグマ-1受容体アゴニズムの有益な作用への寄与を証明することはできなかった。したがって,シグマ-1受容体アゴニズムの役割を確認するためには,SARS-CoV-2感染者を対象としたフルボキサミン対セルトラリン(またはパロキセチン)の臨床試験が必要である。重要なことは、フルボキサミンの利点は、安全性、低コスト、経口投与であることである。
ドネペジル
強力なアセチルコリンエステラーゼ(AChE)阻害剤であるドネペジル(図1)は、アルツハイマー病(AD)の治療に広く用いられてきた。ドネペジルは、AChE阻害作用に加え、シグマ-1受容体やシグマ-2受容体などのシグマ受容体に結合することが知られている[60]。我々は、ドネペジルが PC12 細胞における NGF 誘導性神経突起の増殖を増強し、NE-100 がドネペジルによる NGF 誘導性神経突起の増殖を有意に阻害したことを報告している[61]。さらに、ドネペジルはシグマ-1受容体の活性化を介してマウスのPCP誘発性認知障害を改善した[62]。さらに、[11C]SA4503を用いたPET試験では、ドネペジル(5mgおよび10mg)の経口投与により、ヒトの脳内でシグマ-1受容体にそれぞれ約60%および約75%の占有率で結合することが示された[63]。これらの結果から、ドネペジルのヒトにおける薬理作用にはシグマ-1受容体の活性化が関与していることが示唆される。したがって、SARS-CoV-2感染が確認されたアルツハイマー病患者を対象に、ドネペジルを投与した場合と投与しなかった場合の追跡調査を行うことは興味深いことである。
イフェンプロジル
イフェンプロディルは、日本やフランスを含む限られた国で脳血管拡張薬として使用されている。イフェンプロディルは、N-メチル-d-アスパラギン酸受容体(NMDAR)のGluN2Bサブユニットのプロトタイプアンタゴニストであることが知られている(図1)。α1アドレナリン受容体とNMDARでの拮抗作用に加え、イフェンプロジルはシグマ-1受容体とシグマ-2受容体に高い親和性で結合する[64-66]。さらに、イフェンプロディルはPC12細胞におけるNGF誘導性神経突起の伸長を有意に増強した[67]。一方、α1 アドレナリン受容体アンタゴニストであるプラゾシンや NMDAR GluN2B アンタゴニストである Ro 25-6981 は、NGF 誘導性神経突起の伸長を変化させなかった。さらに、NE-100はシグマ-2受容体アンタゴニストSM-21ではなく、イフェンプロディルのNGF誘発性神経突起の伸長に対する増強作用を有意に阻害した[67]。これらの知見は、シグマ-1受容体の活性化がイフェンプロジルの薬理作用に一役買っていることを示唆している。
我々は、小児期に虐待歴のある心的外傷後ストレス障害(PTSD)患者においてイフェンプロディルの有益な効果を示した症例をいくつか報告している[68, 69]。このように、イフェンプロジルはシグマ-1受容体の活性化を介してPTSD患者に有益な効果をもたらす可能性があると考えられる[70]が、大規模なサンプルサイズを用いたさらなる研究が必要である。
以上のことから、シグマ-1受容体アゴニストであるイフェンプロディルは、SARS-CoV-2感染が確認された患者の治療薬になる可能性があることが示唆された。現在、Algernon Pharmaceutical社(カナダ、BC州バンクーバー)によるCOVID-19疾患が確認された入院患者を対象としたイフェンプロディル(20mgおよび40mg)の無作為化オープンラベル試験(ClinicalTrials.gov Identifier: NCT04382924)が進行中である。
その他の候補となるカクタメシン、アルケタミン
1996年、松野ら[71]は新規かつ選択的なシグマ-1受容体アゴニストSA4503(cutamesine)を開発した(シグマ-1受容体ではIC50 = 17.4 nM、シグマ-2受容体ではIC50 = 1,784 nM)。SA4503はPC12細胞におけるNGF誘導性神経突起の伸長を有意に増強し、その効果はNE-100によって拮抗された[49]。また、SA4503がシグマ-1受容体の活性化を介してマウスのPCP誘発性認知障害を改善したことも報告している[50]。脳卒中モデルでは、SA4503が脳卒中後の回復を促進したことから、SA4503は脳卒中患者の治療薬として適している可能性が示唆されている[72]。しかし、虚血性脳卒中患者を対象としたSA4503の第II相試験では、機能的エンドポイントに有意な効果は認められなかった[73]。重要なことは、SA4503(1mg/日および3mg/日を28日間投与)はヒトにおいて安全で忍容性が良好であったことである[73]。したがって、SARS-CoV-2感染者を対象としたSA4503の臨床試験を実施することは興味深いことであろう。さらに、COVID-19に対するシグマ-1受容体アゴニストがいくつか追加されている[74]。
NMDARアンタゴニストである(R,S)-ケタミンは、麻酔薬として世界的に広く使用されている[75]。現在、(R,S)-ケタミンは、重度のうつ病患者に対して急速な発症と持続的な抗うつ作用を示したことから、重度のうつ病に対して最も魅力的な抗うつ薬であると考えられている[76-78]。(R,S)-ケタミンは、シグマ-1受容体(Ki = 139.6 μM)およびシグマ-2受容体(Ki = 26.3 μM)を含むシグマ受容体と相互作用することが知られている[79]が、シグマ-1受容体に対する親和性は前述の候補物質(フルボキサミン、ドネペジル、イフェンプロジル、カッタメシン)に比べて低いことが知られている。さらに、(R,S)-ケタミンは、シグマ-1受容体の活性化を介して、PC12細胞におけるNGF誘導性神経突起の伸長を刺激した[79]。我々は以前に、(R,S)-ケタミンが治療抵抗性のうつ病患者において強力な抗炎症作用を示すことを報告している[80]。以上のことから、(R,S)-ケタミンはSARS-CoV-2に感染した患者に有益な効果をもたらす可能性が示唆されている[81, 82]。現在、ウィリアムズ・ボーモント病院(米国ミシガン州)で、SARS-CoV-2に感染した患者を対象とした(R,S)-ケタミンのオープンラベル試験(ClinicalTrials.gov Identifier: NCT04365985)が進行中である。
(R)-ケタミン(アルケタミン)は、シグマ-1受容体において(S)-ケタミン(エスケタミン)よりも強力である[83,84]。PET研究では、(R,S)-ケタミンが非ヒト霊長類の脳でシグマ-1受容体と相互作用することが示された[85]。これらのデータは、親和性が低いにもかかわらず、ヒトの脳内シグマ-1受容体を刺激する可能性を示唆している。重要なことは、ヒトにおける(R,S)-ケタミンの副作用はエスケタミンと関連しているため、(R,S)-ケタミンの副作用(精神病や解離)は(R,S)-ケタミンやエスケタミンよりも低いということである[86]。まとめると、COVID-19患者における(R,S)-ケタミンのデータが陽性であれば、SARS-CoV-2に感染した個体においても、アーケタミンが抗炎症作用を発揮する可能性があると考えられる。
結論と今後の方向性
Nature誌およびScience誌に掲載された2つの論文は、ERシャペロンタンパク質シグマ-1受容体がSARS-CoV-2の細胞内での複製において重要な役割を果たしており、シグマ-1受容体がCOVID-19感染症の有望な治療標的であることを強く示唆している[41, 42, 44, 74, 88]。しかしながら、シグマ-1受容体リガンドのどの薬理学的活性(すなわち、アゴニストまたはアンタゴニスト)がSARS-CoV-2複製の遮断に関与しているのかは不明のままである。
現在、逆転写ポリメラーゼ連鎖反応(RT-PCR)試験を用いてSARS-CoV-2感染を検出することは容易である。上述したように,フルボキサミン,ドネペジル,イフェンプロジルなどの従来の中枢神経系薬剤は,シグマ-1受容体に強力なアゴニスティック活性を示す。これらの薬剤を用いてSARS-CoV-2感染が確認されたCOVID-19感染者をできるだけ早く治療すれば,臨床症状の悪化を阻止したり,遅らせたりすることができるかもしれない。SARS-CoV-2感染者を対象としたシグマ-1受容体作動薬は世界中で使用されており、今こそ臨床試験を開始すべき時期である。これらの候補の中で、フルボキサミンは、小児から高齢者まで使用できるため、COVID-19パンデミックに最も魅力的な薬剤である。
さらに、COVID-19パンデミックは、多くの人にとってストレスとなる可能性がある。SARS-CoV-2に感染した個人は、恐怖、不安、抑うつ、自殺念慮などの精神症状を呈する可能性がある。最近の研究では、COVID-19の生存者は、不安障害、不眠症、認知症などの精神疾患のリスクが高いようであることが示された[89]。これらの因子を考慮すると、フルボキサミンは不安障害およびうつ病に対して有益な作用を有するため、COVID-19治療のための最も魅力的な候補薬である可能性がある。最後に、COVID-19のパンデミックが早く治まることを願う。