Contents
Progress in Understanding the Molecular Mechanisms Underlying the Antitumour Effects of Ivermectin
オンラインで公開2020年1月21日
www.ncbi.nlm.nih.gov/pmc/articles/PMC6982461/
Jian Liu,1 Kun Zhang,1 Lin Cheng,1 He Zhu,1 and Tianmin Xu1
要旨
イベルメクチンはアベルメクチン(AVM)のジヒドロ誘導体で、1981年に動物用医薬品として獣医、農業、養殖市場に導入された。イベルメクチンは、元々は寄生虫感染症であるオンコセルカ症の治療薬として使用されていたが、1987年にヒト用医薬品として採用された。それ以来、イベルメクチンは他のヒトの病気の防除にも使用され、ヒトの健康と福祉に大きな効果を発揮していた。
過去10年間、多くの発表された研究では、がんにおけるイベルメクチンの役割を明らかにしようとしてきた。本レビューでは、イベルメクチンの特性評価における現在の進歩を定義するために、発表された研究を要約する。イベルメクチンは、WNT-T 細胞因子(TCF)Hippo、Akt/mTOR 経路を含むいくつかの経路の調節を介して、PAK1 媒介のサイトスタティックオートファジー、カスパーゼ依存性アポトーシス、免疫原性細胞死(ICD)を誘導することにより、癌細胞株の細胞死を引き起こす。
イベルメクチンは、がん細胞の増殖および増殖に影響を与え、RNAヘリカーゼとしての機能、表面誘導解離(SID)ペプチドの低分子模倣薬としての機能、塩化物チャネル受容体の活性化薬としての機能、ミトコンドリア機能障害および酸化ストレスの誘導薬としての機能など、いくつかの異なる役割を果たしている。
さらに、イベルメクチンは多剤耐性タンパク質(MDR)を誘導し、強力な抗ミトチン活性を有し、血管新生を標的とし、がん幹細胞(CSC)を阻害する。イベルメクチンが抗腫瘍効果を発揮することは多くの研究で証明されており、十分な臨床試験を経て、がん患者に有用である可能性がある。
キーワード
イベルメクチン、がん、分子機構、抗腫瘍効果、薬物療法
序論
北里研究所の大村聡氏は1979年にイベルメクチンを発見し 2015年にはこの発見によりノーベル生理学・医学賞を受賞している。イベルメクチンは、最初は動物用医薬品として導入された。1980年代になると、イベルメクチンは他のアベルメクチン(AVM)よりも安全で効果が高いことから、この化合物が抗寄生虫薬としてヒトに投与できることを科学者たちが発見した。イベルメクチンは、オンコセルカ症(河川失明症)の原因となる寄生虫、Enterobius vermicularis、リンパ系フィラリア症(象皮症)の原因となる寄生虫 Ascaris lumbricoides、Strongyloides stercoralis、Ancylostoma duodenale、Trichuris trichiura など、家畜に寄生するさまざまな種類の寄生虫を死滅させることで、人や家畜を寄生虫感染から守る効果がある1。 -3
イベルメクチンの分子メカニズムの解明を目的とした初期の研究により、イベルメクチンは、寄生虫の神経細胞の信号や筋細胞を遮断する Cys-loop 受容体ファミリーの一つであるグルタミン酸チャネル(GluCl)の活性を高め、寄生虫を死滅させることが明らかになり、哺乳類のγ-アミノ酪酸(GABA)受容体を標的とした薬剤の感受性の科学的根拠となることが明らかになった4。
イベルメクチンの分子メカニズムの理解が進んだことにより、イベルメクチンは、1) 35型ヒドロキシトリプタミン受容体(5-HT3R)2) Ach誘導電流を増強する興奮性陽イオン透過性受容体(nAChR)など、いくつかのリガンドゲートイオンチャネルや受容体にも影響を与えることが明らかになった5。 5 3) P2X4受容体、その上部膜貫通ドメイン(TM)領域は細胞質の細胞外表面近くにあり、TM1およびTM2に位置するすべてのアミノ酸のAlaまたはTrpへの変異を誘導する;および4) ファルネソイドX受容体(FXR)、細胞質の核内ホルモン受容体スーパファミリーのメンバーである。 6
最近では、イベルメクチンがGβγに依存しない方法でリン酸化ホスファチジルイノシトール-4,5-二リン酸(PIP2)をリン酸化することでK+チャネル(GIRK)を内向きに整流するG蛋白質ゲートの一種であるGIRK2を直接活性化することも実証されている6,7。
興味深いことに、その幅広い効果により、様々な医療分野での生体内試験および試験管内試験研究の結果、寄生虫によるものだけでなく、多くの疾患の治療薬としてイベルメクチンが開発されていた。例えば、イベルメクチンは、糖尿病マウスの血清コレステロール値とグルコース値を低下させ、インスリン感受性を改善すること、フラビウイルスのウイルス複製を減少させること、トリパノソーマ症やマラリアの主要な昆虫媒介者の生存率を低下させること、T細胞誘発性皮膚疾患に対して抗炎症作用を示すことが示されている8。
イベルメクチンは古くから抗寄生虫薬として知られている。イベルメクチンは古くから抗寄生虫薬として知られており、過去数年の間に、イベルメクチンが膠芽腫、乳がん、9 卵巣がん、10 白血病11,神経線維腫症2型(NF2)腫瘍などの様々な種類のがんの治療に抗がん剤として広く使用される可能性があることを示す研究が増えてきており、その結果、抗がん剤としての強い可能性があることが示されている。しかし、イベルメクチンの分子レベルでの抗がん作用はまだ明らかにされていない(図1)。
今回のレビューでは、イベルメクチンが広範囲のがんに対して抗腫瘍効果を発揮することを示す大量のデータが収集された。イベルメクチンはすでにFDA(米国連邦医薬品局)にヒト用として登録されているため、抗がん剤として採用される日もそう遠くないであろう2。
図1 イベルメクチンの抗腫瘍効果の分子機構を解明
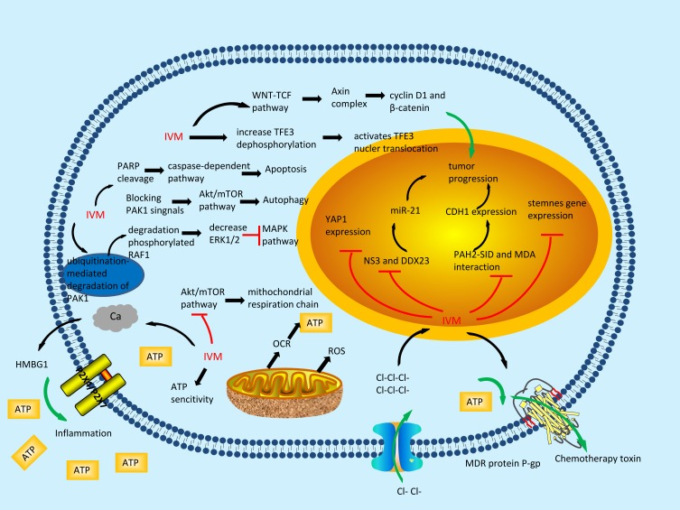
イベルメクチンはがん細胞の細胞死を誘導する
イベルメクチンはPAK1を介したサイトスタティックオートファジーを誘導する
オートファジーは細胞内の自己分解プロセスであり、細胞の成長と代謝の調節に重要な役割を果たしている13 。PAK タンパク質は核内シグナル伝達や細胞骨格再編成の重要なモジュレーターであり、PAK タンパク質の中でも p21 (RAC1) -activated kinase 1 (PAK1) は多くの生物学的活動に関わる幅広いシグナルをモジュレーションしている。PAK1シグナルの遮断は腫瘍細胞の死に寄与する。15 Akt/mTORシグナル伝達経路は、オートファジーにおいて重要な抑制的役割を果たすことが以前に示されている16 。
いくつかの研究では、PAK1阻害剤であるイベルメクチンが、試験管内試験と生体内試験の両方でサイトスタティックなオートファジーを誘導することにより、乳がん、卵巣がん、膠芽腫、NF2腫瘍の増殖を抑制することが示されている2,12,15,17。イベルメクチンは、PAK1 のユビキチン化を介した分解を増加させることで Akt/mTOR シグナル伝達経路を阻害し、その結果、オートファジーのフラックスが増加する18 。
また、イベルメクチンを介した PAK1 の不活性化は、リン酸化された RAF1,細胞外シグナル制御キナーゼ½(ERK1/2)および MAPK/ERK(MEK)のレベルを低下させることを強く示唆する結果もあった。これらの因子はすべて、MAPK経路の活性化と腫瘍増殖に寄与し、上咽頭癌(NPC)やメラノーマの細胞死に関与している19,20 。さらに、Qianhui Douは、イベルメクチンがベクリン1(オートファジー関連タンパク質)とAtg14LまたはVps34(陽性調節因子)との相互作用を増強し、ベクリン1とBcl-2(陰性調節因子)の共沈を減少させることで、オートファゴソームの形成を媒介することを発見した17。
イベルメクチンはカスパーゼ依存性アポトーシスを誘導する
アポトーシスは、多細胞生物の内部環境の安定性を維持するために遺伝子によって制御される細胞のプログラムされた自律的な死であるが、一般的に多くの種類の癌では制御されていない21。アポトーシスは主に、ミトコンドリア膜電位の崩壊(ΔΨm)とチトクロム c の放出を主な特徴とする細胞内経路(ミトコンドリア媒介)と細胞外経路(死の受容体媒介)の 2 つの経路を介して発生する22 。さらに、エフェクターであるカスパーゼ3と開始剤であるカスパーゼ9が活性化され、カスパーゼ3の基質であり、アポトーシスの基本的な構成要素であるポリADPリボースポリメラーゼ(PARP)の切断が誘導される。22
同様に、乳がん細胞をイベルメクチンで処理すると、PARP の切断、細胞死の特徴であるカスパーゼ-1 の活性化、古典的なアポトーシスで典型的に起こるカスパーゼ-3 の活性化が誘導される23。これは、イベルメクチンがカスパーゼ依存性経路を介して膠芽腫や慢性骨髄性白血病細胞のアポトーシスを誘導することを示唆している。11
核輸送因子をコードする KPNB1 は新たな治療標的遺伝子である。児玉正樹は最近、イベルメクチンが卵巣上皮癌(EOC)細胞において多期細胞周期停止とアポトーシスを開始することを報告しており、これは KPNB1 抑制後に観察された変化と一致している10。さらに別の研究では、イベルメクチンはチトクローム c の放出を促進し、Bax と p53 の発現を上昇させ、Bcl-2 の発現を低下させ、サイクリン E、サイクリン D1,CDK2,CDK6,CDK4 のレベルを低下させることで、グリオブラストーマと HeLa 細胞のアポトーシスを誘導することが示されている26,27。
イベルメクチンは免疫原性細胞死(ICD)を誘導する
ICDは近年出現した新しい概念である。ダメージ関連分子パターン(DAMP)は、高移動度群蛋白質B1(HMGB1)表面露出カルレチキュリン(CRT)分泌ATPの放出を含むICDの主要な免疫原性の特徴を誘導する28,29。30 腫瘍微小環境内のがん細胞からの細胞外ATPの放出は厳密に制御され、制御されており、ATPはCD73やCD39などの腫瘍関連細胞外ATPアーゼによって分解される。PSB 069 による細胞外 ATP 酵素(CD39 および CD73)の阻害により、イベルメクチンによる細胞毒性は、多くのタイプの癌細胞株で抑制することができる。
最近のデータでは、イベルメクチンがマウスやヒトのトリプルネガティブ乳がん(TNBC)細胞を炎症性および免疫原性のメカニズムで殺傷する能力を支持しており、腫瘍細胞がATPを放出し、P2X4/P2X7-gated pannexin-1チャネルの開通が増加することによってICDを引き起こし、細胞死を引き起こすことを実証している。23
イベルメクチンによる細胞死は、まず、シュラミン(P2受容体の非選択的阻害剤)を用いてプリンリン作動性シグナル伝達を遮断し、ATPアーゼを用いて細胞外ATPレベルを低下させることによって増強される。さらに、P2X7-KOマウスとWTマウスでは、イベルメクチンとATPを併用することで、P2X1とP2X4受容体、またはP2X4サブユニットのホモ三量体からなる仮説的なヘテロ三量体が形成された後の[Ca2+]の最大増加が増強された32。イベルメクチンは、生きたマウス乳がん細胞(4T1.2, CT26)および MD アンダーソン転移性乳がん細胞(MDA-MB231)の表面で CRT をアップレギュレートすることができ、これらの効果はアポトーシスを促進し、炎症の重要なメディエーターである HMGB1 の放出につながる23 。さらに、カスパーゼ-1活性後のIL-1βの放出を誘導するためにK+のレベルを十分に低いレベルまで低下させることができる細孔形成も誘発された。
イベルメクチンはいくつかの経路を修飾する
イベルメクチンはYAP1(Yea-Associated Protein 1)を阻害して増殖を抑制する
LATS1/2は、ヒッポ経路の最も重要なハブであるMOB1の存在下でYAP1/TAZを潜在的にリン酸化し、14-3-3タンパク質と細胞質に結合し、したがって、TEAドメインファミリーメンバー(TEAD)が介在する転写の活性化、およびE3ユビキチンリガーゼSCFβTRCPが分解される前にYAP1を保護する33。YAP1は、成長期に臓器サイズを調節するヒッポ経路の下流標的であり、異なる転写因子と相互作用して遺伝子発現を活性化することができる多機能タンパク質である34,35。
さらに、多くの研究で、肝内胆管細胞癌(ICC)肝細胞癌と胆管癌の複合癌(cHC-CC)33,大腸癌(CRC)36,卵巣癌35,37,38,胃癌(GC)の患者において、YAP1の核内蓄積の増加が予後不良と関連していることが報告されている34。 イベルメクチンは核内の YAP1 タンパク質の発現を低下させることで抗腫瘍効果を発揮し、GC の増殖を抑制することを発見し、YAP1 の核内発現は YAP1 の mRNA レベルとわずかに関連していることを示唆している39。
イベルメクチンは WNT-T 細胞因子(TCF)経路応答ブロッカーとして機能する
WNT とその下流のエフェクターは、分化、転移、細胞老化、細胞死、腫瘍開始、腫瘍成長など、癌の進行に重要な役割を果たす幅広いプロセスでつながっている40 。このβ-カテニンの継続的な消去により、β-カテニンが核に到達するのを防ぎ、それによって WNT の標的遺伝子は、DNA 結合型 TCF/リンポイドエンハンサー因子(LEF)ファミリーのタンパク質によって抑制される41 。この効果は、TCF の転写活性の継続的かつ直接的な活性化によって救済され、C 末端リン酸化β-カテニンリン酸化ホスホフォームとサイクリン D1 のレベルの抑制と関連している。
また、イベルメクチンは生体内で肺がんの発生を抑制することから、腸がん、乳がん、皮膚がん、肺がんなどの WNT-TCF 依存性疾患を WNT-TCF 経路応答のブロッカーで治療する可能性があることが示唆された42。さらに、スフェロイド形成の解析を通じてイベルメクチンの抗クローン形成効果を観察したところ、イベルメクチンを用いた前処理により、試験した細胞株では、浮遊スフェロイドが最大 73%除去され、この効果はサイクリン D1 の抑制を伴っており、イベルメクチンが癌幹細胞の形成を制限することを実証している42。
イベルメクチンは TFE3 活性を増加させる
MiT/TFE ファミリーの一員である TFE3 は、mTOR 誘導性リン酸化により制御される bHLH-ロイシンジッパー転写因子であり、リソソソーム遺伝子だけでなく、酸化ストレス応答や酸化代謝を含む新たに特徴づけられた標的にも寄与している44 。イベルメクチン投与により TFE3(Ser321)の脱リン酸化が増加し、TFE3 の核内転座が活性化され、ヒトメラノーマ細胞における TFE3 レポーターの活性化が促進される。45 mTORC1 の不活性化は TFE3 の細胞内局在を制御し、その結果、Ser321 の脱リン酸化が制御され、それによって TFE3 の 14-3-3 への結合を阻害し、核内での最大 TFE3 の蓄積をもたらす。
イベルメクチンはRNAヘリカーゼ阻害剤としての役割を果たす
マイクロRNA(miRNA)は、内因性の20~24ヌクレオチド長の小分子RNAの一種である。タンパク質をコードする遺伝子の特定の mRNA 分子を切断したり、その翻訳を阻害したりすることでタンパク質の発現を制御することで、miRNA は、初期発生、細胞増殖、アポトーシス、細胞死、脂肪代謝、細胞分化などの一連の基本的なプロセスに関与している46 。
microRNA-21(miR-21)のアップレギュレーションは、グリオーマ悪性腫瘍の発生と強く関連している。また、Yinらは、DDX23(DEAD-box RNAヘリカーゼ)がグリオーマ細胞の転写後レベルでmiR-21産生を促進することも実証している47。さらに、RNA ヘリカーゼ阻害剤であるイベルメクチンは、細胞の浸潤と増殖を阻害する可能性があり、それにより、DDX23 の発現に影響を与えることなく、U87MG グリオーマ細胞における前駆体および成熟 miR-21 のレベルを低下させることが報告されている47。 47 さらに、イベルメクチンは、患者由来の2つのグリオーマ幹細胞株であるX01細胞とCSC2細胞、がん由来の4つの細胞株であるA549細胞、DU145細胞、HeLa細胞、PANC-1細胞の細胞増殖を有意に抑制する。
イベルメクチンは、SIDペプチドの低分子模倣薬として機能する。
DNA修復およびDNA複製エピジェネティック制御に関連するタンパク質の変異は、暴走エピジェネティック制御が癌の発生および進行において重要な役割を果たすことを示唆している。規制緩和されたエピジェネティクスに関して、上皮間葉転換(EMT)は、上皮細胞由来の悪性腫瘍細胞の移動および浸潤のための重要な生物学的プロセスである。EMT はまた、血管新生、腫瘍成長、癌幹細胞(CSC)の生成にも関与しており、腫瘍の再発や従来の治療に対する抵抗性に影響を及ぼす可能性がある48,49。
クロマチン調節因子SIN3AのPAH2ドメインとSIN3相互作用ドメイン(SID)含有タンパク質との相互作用をSIDペプチドで遮断すると、EMTが逆転し、細胞間接合を維持するRARβ、ERα、E-カドヘリンなどの細胞分化・増殖に関与するタンパク質をコードするサイレンシング遺伝子の発現が抑制されることが報告されている51。また、治療に関連するSIDペプチドの新しい組み合わせは、AM580(RARα特異的アゴニスト)との組み合わせで増強されたRARα/β経路を活性化し、形態形成を誘導し、腫瘍球形成を抑制することも発見されている51。
イベルメクチンは SID ペプチドの低分子模倣薬として、SIN3-PAH2 と MAD の相互作用を阻害し、E-カドヘリンをコードする CDH1 の発現を誘導することから、 EMT 介在性癌の進行に重要な役割を果たしている。また、イベルメクチンは、ヒト MDA-MB-231 細胞やマウス MMTV-Myc 細胞の 試験管内試験 および TNBC 細胞のタモキシフェン感受性を回復させる9 。さらに、MDA-MB-231 細胞や D3H2LN 細胞では、17β-オエストラジオール(E2)による増殖促進や ERαアンタゴニストであるタモキシフェン(Tam)による増殖抑制が、イベルメクチン治療に応答して ERαの再発現を介して反映されている9。
イベルメクチンはミトコンドリア呼吸を阻害する
ミトコンドリア機能不全は活性酸素種(ROS)の主な影響であり、他の多くの形態の活性酸素の前駆体であるスーパーオキサイドは、主にミトコンドリア機能不全によって引き起こされるミトコンドリア電子漏洩によって形成される25。
Liu Yingyingらは、U87,T98G、ヒト微小血管内皮細胞(HBMEC)の基底酸素消費率(OCR)と最大OCRに対するイベルメクチンの用量依存的な抑制効果を実証しており、これはイベルメクチンが呼吸複合体I酵素の活性を低下させることでミトコンドリア呼吸を抑制することを示している24。 これらの研究者らはまた、これらの細胞をイベルメクチンに曝露すると、ミトコンドリアの呼吸鎖によって生成される電気化学的プロトン勾配であるミトコンドリア膜電位が低下することも発見している。
イベルメクチンの抗増殖作用およびアポトーシス作用は、抗酸化物質α-トコフェロールまたはマンニトールとの相互作用により、リン酸化されたAkt、mTORおよびmTORの下流にあるリボソームS6タンパク質(rS6)のレベルが低下した。これは、酸化ストレスにつながる Akt/mTOR パスウェイの抑制を通じたミトコンドリア機能に対するイベルメクチンの負の効果を反映している。 24,25
同様に、アセチル-l-カルニチン(ALCAR:ミトコンドリアの燃料)とN-アセチル-l-システイン(NAC:抗酸化物質)は、腎細胞癌(RCC)細胞においてイベルメクチンの阻害効果を逆転させた。さらに、イベルメクチンは、活性酸素の誘導と一致して、活性酸素産生の増加と関連している STAT1,および STAT1 の下流標的である IFIT3,OAS1,および TRIM22 を含む遺伝子の調節障害を起こすようである。白血病、乳がん、リンパ腫を含むいくつかのがんは、正常細胞よりも代謝が活発でミトコンドリアに依存しているため、正常細胞よりもイベルメクチンに反応しやすいことが研究で明らかになっている52。
イベルメクチンは哺乳類の塩化物イオンチャネルを活性化する
イベルメクチンは寄生虫や蠕虫などの無脊椎動物において GluCl を活性化し、この活性化が GABA 受容体と Glu-Cl の開通を刺激する。しかし、ミトコンドリア膜電位は用量依存的に変化せず、塩化物流束の変化はフローサイトメトリーで測定された細胞サイズの増加と一致した11。イベルメクチンは細胞内カルシウムを増加させたが、BAPTA-AMやEDTAで細胞外カルシウムをキレート化してもイベルメクチン誘発細胞死を阻害しなかったため、イベルメクチンの細胞毒性はこの増加とは無関係であった11。
イベルメクチンの他の新規分子機構
イベルメクチンは血管新生阻害剤である
血管新生(微小血管形成)は、腫瘍微小環境から老廃物や沈殿物を除去しながら、腫瘍の成長に必要な物質を提供するがんメーカーである。53 以前の研究では、HBMECを用いた試験管内試験での毛細血管ネットワーク形成実験で、10μMのイベルメクチンがHBMECの管状構造を形成する能力を完全に排除したことが明らかになり、血管新生に対するイベルメクチンの効果が確認されている。24 結論として、これらの知見は、イベルメクチンが強力な血管新生阻害剤であり、HBMECの増殖を阻害し、アポトーシスを誘導することを示している。
イベルメクチンは抗ミトチン活性を発揮する
微小管は、真核生物の細胞に広く存在する極性細胞骨格の一種で、主にチューブリンから構成されており、有糸分裂に重要な役割を果たしている。有糸分裂の際には、細胞が2つの娘細胞に分裂する前に、1つの細胞の重複した染色体が2つの同一のグループに分割される。
イベルメクチンと線虫のチューブリンとの相互作用を発見したShoaib Ashrafによるチューブリン重合実験では、イベルメクチンが哺乳類のチューブリン重合度を向上させることが明らかになった55。さらに、HeLa細胞を低マイクロモル濃度でイベルメクチンで試験管内試験処理した場合、複製を防止し、哺乳類のチューブリンを安定化させ、低温脱重合に対する抵抗性を助けたが、イベルメクチンを除去すると細胞分裂の阻害が緩和され、タキソールの効果と同様の効果が得られた55。
イベルメクチンはP-Glycoprotein(P-Gp)阻害剤である
多剤耐性(MDR)という現象に基づき、がん細胞は、化学療法剤に曝露した後、その機能や構造に関係のない様々な化学療法剤に対する耐性や交差耐性を発現する可能性がある57 。癌細胞におけるMDR表現型の発現は、多くの場合、ABCB1(多重薬剤耐性1,MDR1としても知られている)遺伝子によってコードされる膜貫通タンパク質、特にP-gp58の高発現に起因する。
P-gpはATP結合カセット(ABC)トランスポーターファミリーの最も重要なメンバーであり、ヒトの血液脳関門の一部であり、脳内への薬物摂取を制限している59 。しかしながら、P-gpの遺伝子多型、またはイベルメクチンとこの流出輸送タンパク質を阻害する薬剤との共処理は、P-gpの機能または発現を変化させ、予想通り、脳内のイベルメクチン濃度を上昇させ、深刻な神経毒性を誘発する可能性がある60 。Didier と Loor は、2 種類の P-gp プローブを親 MDR 細胞に保持し、その回復を測定した短期アッセイで、イベルメクチンが P-gp の阻害剤であるだけでなく基質でもあることを証明している61 。
イベルメクチンはCSCの阻害剤である
胚性幹(ES)細胞は、初期胚または原始生殖腺から分離された細胞の一種であり、試験管内試験では無制限の増殖、自己再生、多分化活性などのユニークな特徴を持っている。ES細胞は、試験管内試験および生体内試験の両方で、ほぼすべての種類の体細胞に分化するように誘導することができる。いくつかの重要なES細胞特異的転写因子、すなわち八量体結合タンパク質4(Oct-4)ホメオボックスタンパク質Nanog、SRY-box 2(Sox-2)は、NuRD、Sin3A、Pml複合体などの複数の阻害性複合体のタンパク質と相互作用し、相互に連結しており、ES細胞の自己複製と多分化を制御する重要な転写因子である62。63 さらに,0.5μMのイベルメクチンは、D3H2LN細胞におけるNanog、Oct4およびSox2遺伝子の発現を50~80%減少させ、一方で、クローン原性、自己再生依存性の腫瘍球増殖を90~100%減少させた。
この抗寄生虫剤の開発の一環として、イベルメクチンのヒトおよび動物に対する薬理学、安全性および毒性が広く評価されてきた。例えば、マウス、ラット、ウサギの経口投与におけるイベルメクチンの LD50 は 10~50 mg/kg である。ヒトでは、イベルメクチンの毒性は非常に低く、120 mg(~2 mg/kg)に増量しても、健康なボランティアでは重篤な副作用は認められていない。イベルメクチンは低マイクロモル濃度でAML患者に細胞毒性を示すことがわかった。対照的に、20μmまでの濃度では、イベルメクチンは正常末梢血幹細胞(PBSC)において細胞死を誘導しない。しかし、PBSCサンプルのCD34+細胞をゲートした場合、イベルメクチン誘導細胞死のIC50は10.5±0.6μmであったのに対し、イベルメクチン誘導細胞死のIC50は約5μmであった。また、イベルメクチンの一次正常造血およびAML細胞クローン形成解析への影響も評価した。イベルメクチン(6μm)は、正常造血細胞のクローン形成能を15%低下させた。対照的に、イベルメクチンは 6 つの AML 原発サンプルのうち 3 つのクローン形成能を 40%以上減少させた11 。重要なことに、2 つの研究では、イベルメクチンは癌細胞に対して優先的な抑制効果を示すが、正常細胞ではその役割が有意に減少したり、効果がないことが明らかになった。研究者らは、5,10μMおよび15μMのイベルメクチンが、すべてのRCC細胞株の増殖を有意に抑制し、用量依存的にアポトーシスを誘導することを発見した。IC50値の範囲は3~10μMであった。一方、15μM のイベルメクチンは、HRPT(ヒト近位尿細管)HRE(ヒト腎上皮)HRCE(ヒト腎皮質上皮)細胞の増殖を抑制し、アポトーシスを誘導することができ、IC50 値は 15μM よりも高かった52。同様に、別の研究では、正常骨髄(NBM)CD34細胞では、CML CD34細胞と比較して、同じ濃度のイベルメクチンがアポトーシスを誘導したり、アポトーシスを増加させたりしなかったことが判明しており、正常CD34細胞はCML CD34細胞ほどイベルメクチンに敏感ではないことを示している25。多くの癌は、正常細胞よりも高い代謝活性とミトコンドリア機能への依存性を示す。そのため、がん細胞は正常細胞よりもミトコンドリアを標的とした薬剤に対して感受性が高く、これらの薬剤が抗がん剤治療の副作用を減少させる可能性がある。
多くの試験管内試験および生体内試験の前臨床研究により、イベルメクチンが様々な悪性疾患の治療に有効であることが示されている。試験管内試験でのイベルメクチンの濃度中央値は、表1に記載されている全ての研究において、5μM(0.01-100μM)であることが判明している。ヒト薬物動態学的データによると、この濃度は臨床的に達成される可能性がある64 。免疫不全マウスで様々な腫瘍細胞株を使用して(表2)イベルメクチンの生体内試験での有効性を評価した。イベルメクチンの経口及び腹腔内投与に使用された投与量の中央値は、5mg/kg(2.4~40mg/kg)であり、これはヒトにおける0.40mg/kgの投与量に相当し65,現在ヒト対象での使用が安全であると考えられている最高投与量(2mg/kg)よりも低い64 。
表1 イベルメクチンを用いた試験管内試験での腫瘍研究のまとめ
| がんの種類 | 細胞株 | [µM] | IC50µM | 分子メカニズム | 参照 |
|---|---|---|---|---|---|
| トリプルネガティブ乳がん | 4T1 MMTV-Myc |
0.01 0.1 |
SIN3コリプレッサーの選択的阻害とタモキシフェン感受性の回復。 | 9 | |
| マウスとヒトのトリプルネガティブ 乳がん |
4T1.2 DDHer2 |
1 4 8 |
2 | アポトーシスと壊死の混合メカニズム | 23 |
| ヒト白血病 | OCI-AML2 HL60 U937 K61a TEX |
5 10 15 20 |
4.54 4.64 6.54 5.68 5.41 |
塩化物依存性の膜過分極を誘発する | 11 |
| 卵巣がん | TYK-nu KOC7C SKOV3 RMUG-S HEI-193 |
0.1 1 10 100 |
5〜20 10〜20 10〜20 5〜20 5 |
キナーゼPAK1を不活性化し、PAK1依存性増殖をブロックします | 12 |
| 乳癌 | MDAB-435 MDA-MB-231 MDA-MB-468 MDA-MB-361 MCF-7 HS578T |
5 10 15 20 |
20〜40 10〜20 |
PAK1 / Akt軸をブロックすることにより、細胞増殖抑制性オートファジーを誘導します | 17 |
| ヒト神経膠芽腫 | U87 T98G |
1 5 10 |
〜5 〜5 |
ミトコンドリア機能障害と酸化ストレスの誘発 | 24 |
| 子宮頸癌 | ヘラ | 2.5 5 10 15 20 |
7.87 5.78 |
DNA断片化とクロマチン凝縮の誘導 | 27 |
| ヒト胃がん | MKN1 MKN7 MKN28 SH10TC |
2.5 5 10 |
10.2 31.9 25.4 21.2 |
はい関連タンパク質1発現の阻害 | 39 |
| ヒト黒色腫 | SKMe28 | 2.5 5 10 |
2.5 | ROS-TFE3依存のオートファジーの抑制 | 45 |
| 人間の結腸癌 | CC14 CC36 LS174T DLD1 |
0.1 1 5 5 |
2.3 1.7 1 0.8 |
WNT-TCF経路を阻害する | 42 |
| ヒト乳がん | MDA-MB-231 | 0.2 0.4 0.8 1 5 8 |
幹細胞集団の細胞生存率とクローン原性を優先的に阻害します | 63 |
表2 イベルメクチンを用いた腫瘍の生体内試験試験のまとめ
| がんの種類 | 細胞株 | 用量mg / kg | 結果 | 参照 |
|---|---|---|---|---|
| マウス白血病 ヒト白血病 |
MDAY-D2 OCI-AML2 K562 |
3 5 6。 |
3つのモデルすべてで腫瘍の質量と体積が最大70%減少しました | 11 |
| 乳癌 | MDA-MB-231-GFP | 2.4 | 腫瘍の重量とサイズが減少しました。 | 17 |
| ヒト神経膠芽腫 | U87 T98G |
40 | マウスの体重の減少は観察されなかったが、腫瘍の成長を有意に阻害した。 | 24 |
| ヒト胃がん | MKN1 | ip | 腫瘍重量が減少した。 | 39 |
| ヒト肺がん | H358 | ip | 成長の約50%の抑制を示す | 42 |
| 人間の結腸癌 | DLD1 CC14 HT29 |
10 | DLD1腫瘍の成長を阻害しました。抑制されたHT29腫瘍の成長。CC14腫瘍の成長には影響しません。 | 42 |
| ヒト神経膠腫 | U87MG | 3 10 |
3mg / kgで腫瘍サイズを最大50%縮小します。 | 47 |
薬物リポジショニングは、効果的で安全な新しい抗がん剤を見つけるという経済的コストおよび効率性のニーズを満たすための別の戦略を提供することができる。腫瘍学における薬剤リポジショニングの最終的な目標は、革新的な治療法への患者アクセスを促進することである。ここに挙げたハードルに対処するためには、革新的な金融/規制上の解決策が必要であることは明らかである。現在、個々の薬剤の再利用の有効性を実証するための科学的・臨床的作業が進行中であるが、薬剤の承認と使用を管理するための社会的・政治的枠組みを議論する必要があり、現在の規制の枠組みの調整などの持続可能な解決策を模索すべきである66。
おわりに
癌におけるイベルメクチンの役割はまだ発見されていない。多くの標的は同じ経路を共有している。例えば、Akt/mTOR経路は、ミトコンドリア機能不全、酸化ストレス、オートファジーと関連している。塩素依存性膜の過分極化は、細胞死の進行における抗ミトコンドリア作用と関連している。ICDやmTORC1経路は活性酸素と結合しているが、これらの関連性は明らかにされていない。
がん患者さんをより効果的に管理するためには、イベルメクチンを他の薬剤と併用することが有効である。イベルメクチンと現在使用されている薬剤との併用は、特定のタイプの癌患者にとってより好ましい予後をもたらす可能性がある。例えば、ダヌルビシン/シタラビン、タモキシフェン、パクリタキセルおよび抗BRAF V600阻害剤と組み合わせた場合、イベルメクチンは、それぞれ白血病、TNBC、EOCおよびメラノーマに対して、より強力な抗がん作用を示す。経口イベルメクチンは、ヒト寄生虫感染症の治療に臨床用量で広く使用されているが、明確な副作用は見られない。
しかし、この多機能薬の詳細な作用機序はまだ解明されていない。しかし、提案されている抗がん剤のスキームと新薬の応用は、私たちの健康に一歩近づけるものであり、これは私たちが追求し続けるべき目標である。
